Патент на изобретение №2358969
|
||||||||||||||||||||||||||
(54) КОНДЕНСИРОВАННОЕ 4-ОКСОПИРИМИДИНОВОЕ ПРОИЗВОДНОЕ
(57) Реферат:
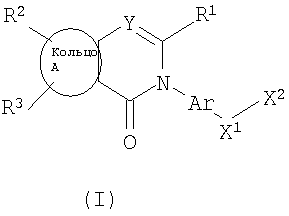
Изобретение относится к новым соединение формулы I
где Ar представляет собой бивалентную группу, образованную удалением двух атомов водорода из бензола, пиримидина или пиридина (эта бивалентная группа может быть дополнительно замещена атомом галогена, низшим алкокси (эта низшая алкоксигруппа может быть дополнительно замещена галогеном), гидрокси или низшим алкилом); X1 представляет собой атом кислорода; R1 представляет собой линейный или разветвленный низший алкил (эта низшая алкильная группа может быть дополнительно замещена гидрокси, галогеном, алкокси, аллилокси или аралкилокси), фенил, аралкил или алкокси; кольцо А представляет собой 5- или 6-членное гетероарильное кольцо, содержащее 1 или 2 атома азота или атома серы в кольце, или бензольное кольцо; R2 и R3 могут быть одинаковыми или отличными друг от друга, и каждый представляет собой водород, амино, алкиламино, гидрокси, низший алкилсульфонил, галоген, низший алкил (эта низшая алкильная группа может быть дополнительно замещена галогеном), низший циклоалкил (эта низшая циклоалкильная группа может быть дополнительно замещена галогеном), низший алкокси (эта низшая алкоксигруппа может быть дополнительно замещена галогеном), арил, гетероарил, моно-низший алкилкарбамоил, низший алкилкарбоксамид, арилкарбоксамид, низший алкилсульфониламино, алкиламиносульфонил, аралкил или алканоилалкиламино; Y представляет собой СН или атом азота; -X2 представляет собой группу, представленную формулой (II)
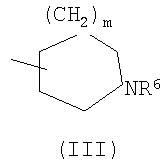
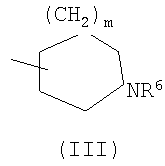
(где R4 и R5 и атом азота, взятые вместе, могут образовывать 5-8-членное моноциклическое кольцо (это моноциклическое кольцо может быть замещено атомом галогена, оксогруппой или низшей алкильной группой, которая сама может быть замещена галогеном), или 6-10-членное бициклокольцо, n представляет собой целое число, имеющее значение 3 или 4, и (СН2)n может быть замещен низшей алкильной группой, содержащей 1-3 атома углерода), формулой (III)
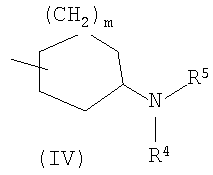
(где m представляет собой целое число, имеющее значение от 0 до 4, и R6 представляет собой низшую алкильную или циклоалкильную группу), или формулой (IV)
где символы имеют значение, определенное выше, а также к средству для профилактики или лечения заболевания обмена веществ, заболевания системы кровообращения или заболевания нервной системы, содержащему соединения формулы I. Технический результат: получены и описаны новые соединения, которые могут найти применение в области медицины. 2 н. и 16 з.п. ф-лы.
Область изобретения Настоящее изобретение относится к конденсированным 4-оксопиримидиновым производным. Предпосылки изобретения У живых существ, включая млекопитающих, гистамин, эндогенный фактор с физиологической активностью, действует как нейротрансмиттер и обладает далеко проникающим фармакологическим действием (см., например, Life science, Vol.17, p.503 (1975)). Иммуногистохимические исследования ясно показали, что гистаминергическая (продукция) сома присутствует в сосцевидных отростках ядер в области сзади гипоталамуса, гистаминергические нервные волокна распространены на очень большом участке в мозге, что говорит о том, что гистамин обладает множеством различных фармакологических действий (см., например, Journal of Comprehensive Neurology, Vol.273, p.283). Присутствие гистаминергического нерва в сосцевидных отростках ядер в области сзади гипоталамуса дает основание предположить, что гистамин играет особо важную роль в церебральной функции контроля физиологии гипоталамуса, т.е. в ритмах бодрствования, внутренней секреции, потреблении пищи/воды и сексуальном поведении (см., например, Progress in Neurobiology, Vol.63, p.637 (2001)). Тот факт, что существуют прорастания гистаминергических нервных волокон в те области мозга, которые связаны с сохранением состояния бодрствования (например, кора головного мозга), дает основание предположить, что гистамин играет определенную роль в поддержании состояния бодрствования или в цикле бодрствование – сон. Также тот факт, что существуют прорастания гистаминергических нервных волокон во многие периферические структуры, такие как гиппокамп или миндалевидный комплекс, дает основание предположить, что он играет определенную роль в регуляции автономной нервной системы и эмоций, контроле мотивации, познавательной функции и памяти. После того как гистамин высвобождается из клеток, продуцирующих гистамин, он взаимодействует со специфическими полимерами, называемыми рецепторами, на поверхности клеточной оболочки или в мишеневых клетках, что и обеспечивает его фармакологический эффект и регуляцию функций организма. К настоящему времени известны четыре типа гистаминовых рецепторов. В результате различных фармакологических и физиологических исследований было обнаружено, что гистаминовые H3 рецепторы участвуют в функции центральных и периферических нервов (см., например, Trends in Pharmacological Science, Vol.8, p.24 (1986)), в течение последних нескольких лет были идентифицированы гены гистаминовых H3 рецепторов человека и грызунов (см., например, Molecular Pharmacology, Vol.55, p.1101 (1999)). Было показано, что гистаминовые Н3 рецепторы присутствуют в центре пресинаптической мембраны периферических нервных клеток, функционируя как ауторецепторы, контролируя высвобождение гистамина, а также контролируя высвобождение других нейротрансмиттеров. В частности, было сообщение, что агонисты, антагонисты или обратные агонисты гистаминовых H3 рецепторов регулируют высвобождение гистамина, норадреналина, серотонина, ацетилхолина или допамина из синаптических окончаний. Например, высвобождение нейротрансмиттеров, таких как (R)-( Раскрытие изобретения Поэтому целью настоящего изобретения является обеспечение новых веществ, обладающих антагонизмом (действие по ингибированию связывания гистамина с гистаминовыми H3 рецепторами) или обратным агонизмом (действие по подавлению постоянной активности гистаминовых H3 рецепторов) гистаминовых H3 рецепторов, т.е. новых веществ, которые действуют как антагонисты или обратные агонисты гистаминовых H3 рецепторов в живом организме. Авторы настоящего изобретения обнаружили, что конденсированные 4-оксопиримидиновые производные действуют как антагонисты или обратные агонисты гистаминовых H3 рецепторов, и на основании таких открытий они вышли на настоящее изобретение. Для достижения указанной выше цели настоящим изобретением обеспечиваются соединения, описанные в пп.(1)-(45), или их соли: (1) Соединение, представленное формулой (I): где Ar представляет собой бивалентную группу, образованную удалением двух атомов водорода из бензола, пиримидина, пиридина, тиазола, оксазола, пиразола, тиадиазола или тиофена (эта бивалентная группа может быть дополнительно замещена атомом галогена, низшим алкокси (эта низшая алкоксигруппа может быть дополнительно замещена галогеном), гидрокси или низшим алкилом); X1 представляет собой атом азота, атом серы или атом кислорода; R1 представляет собой 5- или 6-членную гетероарильную группу, содержащую 1-4 гетероатома, выбранных из азота, серы и кислорода, гетероарилалкильную группу (гетероарил в этой группе имеет значение, определенное выше), линейный или разветвленный низший алкил (эта низшая алкильная группа может быть дополнительно замещена гидрокси, галогеном, алкокси, аллилокси или аралкилокси), фенил, аралкил, алкокси, алкилтио или низший алкиламино; кольцо A представляет собой 5- или 6-членное гетероарильное кольцо, содержащее 1 или 2 атома азота или атома серы в кольце, или бензольное кольцо; R2 и R3 могут быть одинаковыми или отличными друг от друга, и каждый представляет собой водород, амино, алкиламино, диалкиламино, нитро, циано, гидрокси, низший алкилсульфонил, галоген, низший алкил (эта низшая алкильная группа может быть дополнительно замещена галогеном), низший циклоалкил (эта низшая циклоалкильная группа может быть дополнительно замещена галогеном), низший алкокси (эта низшая алкоксигруппа может быть дополнительно замещена галогеном или гидрокси), низший циклоалкокси (эта низшая циклоалкоксигруппа может быть дополнительно замещена галогеном), арилокси, аралкилокси, гетероарилокси, гетероарилалкилокси, арил, гетероарил, арилкарбамоил, гетероарилкарбамоил, арилалкилкарбамоил, гетероарилалкилкарбамоил, моно-низший алкилкарбамоил, ди-низший алкилкарбамоил, низший алкилкарбоксамид, арилкарбоксамид, гетероарилкарбоксамид, арилалкилкарбоксамид, гетероарилалкилкарбоксамид, алканоил, арилкарбонил, арилалкилкарбонил, формил, гидрокси, алкилтио, алкоксикарбониламино, низший алкилсульфониламино, арилсульфониламино, алкиламиносульфонил, ариламиносульфонил, аралкил, алканоиламино или алканоилалкиламино; Y представляет собой CH или атом азота; -X2 представляет собой группу, представленную формулой (II): (где R4 и R5 могут быть одинаковыми или отличными друг от друга, и каждый представляет собой низшую алкильную группу (эта низшая алкильная группа может быть дополнительно замещена галогеном) или циклоалкильную группу, или R4, R5 и атом азота, взятые вместе, могут образовывать 5-8-членное моноциклическое кольцо (это моноциклическое кольцо может быть замещено атомом галогена, оксогруппой или низшей алкильной группой, которая сама может быть замещена галогеном), или 6-10-членное бициклокольцо, n представляет собой целое число, имеющее значение от 2 до 4, и (CH2)n может быть замещен низшей алкильной группой, содержащей 1-3 атома углерода), формулой (III):
(где m представляет собой целое число, имеющее значение от 0 до 4, и R6 представляет собой низшую алкильную или циклоалкильную группу), или формулой (IV): (где символы имеют значение, определенное выше), при условии что формула (I) исключает 3-[4-(2-диэтиламиноэтокси)фенил]-2-метил-3H-хиназолин-4-он, 3-[4-(2-диметиламиноэтокси)фенил]-2-метил-3H-хиназолин-4-он, 2-метил-3-[4-(2-пиперидин-1-ил-этокси)фенил]-3H-хиназолин-4-он, 3-[4-(3-диметиламинопропокси)фенил]-2-метил-3H-хиназолин-4-он, 3-[4-(3-диэтиламинопропокси)фенил]-2-метил-3H-хиназолин-4-он и 3-[2-(2-диэтиламиноэтокси)фенил]-2-метил-3H-хиназолин-4-он], или его фармацевтически приемлемая соль; (2) Соединение по п.(1), где кольцо A представляет собой бензольное кольцо, пиридиновое кольцо или пиримидиновое кольцо, или его фармацевтически приемлемая соль; (3) Соединение по п.(1), где кольцо A представляет собой бензольное кольцо или пиридиновое кольцо, или его фармацевтически приемлемая соль; (4) Соединение по пп.(1), (2) или (3), где по меньшей мере один из R2 и R3 представляет собой атом водорода, или его фармацевтически приемлемая соль; (5) Соединение по пп.(1), (2) или (3), где один из R2 и R3 представляет собой атом водорода, а другой представляет собой атом водорода, атом галогена, низший алкил (эта низшая алкильная группа может быть дополнительно замещена галогеном), низший алкокси (эта низшая алкоксигруппа может быть дополнительно замещена галогеном или гидрокси), гидрокси, арил (эта арильная группа может быть дополнительно замещена низшим алкилом), гетероарил, низший алкилкарбоксамид, арилкарбоксамид, арилалкилкарбоксамид или низший алкилсульфониламино, или его фармацевтически приемлемая соль; (6) Соединение по пп.(1), (2) или (3), где один из R2 и R3 представляет собой атом водорода, а другой представляет собой атом водорода, атом галогена, низший алкил (эта низшая алкильная группа может быть дополнительно замещена галогеном) или низший алкокси (эта низшая алкоксигруппа может быть дополнительно замещена галогеном), или его фармацевтически приемлемая соль; (7) Соединение по любому из пп.(1)-(6), где Ar представляет собой фенил или пиримидинил, т.е. бивалентную группу, образованную удалением двух атомов водорода из бензола или пиримидина (эта бивалентная группа может быть дополнительно замещена атомом галогена, низшим алкокси (эта низшая алкоксигруппа может быть дополнительно замещена галогеном), гидрокси или низшим алкилом), и n имеет значение 3 или 4, или его фармацевтически приемлемая соль; (8) Соединение по любому из пп.(1)-(7), где -X2 представлен формулой (II): [где символы имеют значение, определенное выше], или его фармацевтически приемлемая соль; (9) Соединение по п.(8), где n имеет значение 3 или 4, и R4, R5 и атом азота, взятые вместе, образуют 5-8-членное моноциклическое кольцо (это моноциклическое кольцо может иметь в качестве группы заместителя атом галогена или низшую алкильную группу, которая может быть замещена галогеном), или его фармацевтически приемлемая соль; (10) Соединение по п.(8), где n имеет значение 3 или 4, и R4, R5 и атом азота, взятые вместе, образуют 6-10-членное бициклокольцо, или его фармацевтически приемлемая соль; (11) Соединение по п.(8), где n имеет значение 3, и R4, R5 и атом азота, взятые вместе, образуют 5-8-членное моноциклическое кольцо (это моноциклическое кольцо может иметь в качестве группы заместителя атом галогена или низшую алкильную группу, которая может быть замещена галогеном), или его фармацевтически приемлемая соль; (12) Соединение по п.(8), где n имеет значение 3 и R4, R5 и атом азота, взятые вместе, образуют 6-10-членное бициклокольцо, или его фармацевтически приемлемая соль; (13) Соединение по любому из пп.(1)-(7), где -X2 представлен формулой (III):
[где символы имеют значение, определенное выше], или его фармацевтически приемлемая соль; (14) Соединение по любому из пп.(1)-(7), где -X2 представлен формулой (IV): [где символы имеют значение, определенное выше], или его фармацевтически приемлемая соль; (15) Соединение по любому из пп.(1)-(14), где R1 представляет собой низшую алкильную группу, содержащую 1-3 атома углерода (эта низшая алкильная группа может быть дополнительно замещена галогеном), или фенильную группу, или его фармацевтически приемлемая соль; (16) Соединение по любому из пп.(1)-(14), где R1 представляет собой метил, этил, н-пропил, изопропил или трифторметил, или его фармацевтически приемлемая соль; (17) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой: 2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 3-{4-[3-(диэтиламино)пропокси]фенил}-2-метил-4-(3H)-хиназолинон, 2-метил-3-{4-[3-(2-метил-1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 3-{4-[3-(2,5-диметил-1-пирролидинил)пропокси]фенил}-2-метил-4(3H)-хиназолинон, 2-метил-3-{4-[4-(1-пиперидинил)бутокси]фенил}-4(3H)-хиназолинон, 3-{4-[3-(1-азепанил)пропокси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[3-(1-азоканил)пропокси]фенил}-2-метил-4(3H)-хиназолинон, 2-метил-3-{4-[3-(2-метил-1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(4-метил-1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 3-(4-{3-[(2R,6S)-2,6-диметил-1-пиперидинил]пропокси}фенил)-2-метил-4(3H)-хиназолинон, 2-метил-3-{4-[3-(3-метил-1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 3-{4-[3-(3,5-диметил-1-пиперидинил)пропокси]фенил}-2-метил-4(3H)-хиназолинон, 2-метил-3-{3-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 3-{3-бром-4-[3-(1-пиперидинил)пропокси]фенил}-2-этил-4(3H)-хиназолинон, 2-метил-3-{4-[2-(1-пиперидинил)этокси]фенил}-4(3H)-хиназолинон, 2,5-диметил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 3-{4-[3-(1-пиперидинил)пропокси]фенил}-2-пропил-4(3H)-хиназолинон, 3-{4-[3-(1-пиперидинил)пропокси]фенил}-2-трифторметил-4(3H)-хиназолинон, 2-изопропил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2,6-диметил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2,8-диметил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-этил-5-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 5-фтор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 5-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 5-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 5-гидрокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон трифторацетат, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-5-трифторметил-4(3H)-хиназолинон, 7-фтор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил)-4(3H)-хиназолинон, 6-фтор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6,7-дифтор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-бром-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6,7-диметокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 8-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 8-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2,6-диметил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-этил-5-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 5-фтор-2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-5-трифторметил-4(3H)-хиназолинон, 5-хлор-2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 2,5-диметил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[2,3-d]пиримидин-4(3H)-он, 2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[2,3-d]пиримидин-4(3H)-он, 6-хлор-2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3Н)-он, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он, 2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[4,3-d]пиримидин-4(3H)-он, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[4,3-d]пиримидин-4(3H)-он, 2-метил-3-{2-[3-(1-пиперидинил)пропокси]-5-пиримидинил}-4(3H)-хиназолинон, 2,5-диметил-3-{2-[3-(1-пиперидинил)пропокси]-5-пиримидинил}-4(3H)-хиназолинон, 2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[2,3-d]пиримидин-4(3H)-он, 6-хлор-2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он, 6-хлор-2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3Н)-он, 2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он, 2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он, 2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[4,3-d]пиримидин-4(3H)-он, 2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[4,3-d]пиримидин-4(3H)-он, 6-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо-[3,4-d]пиримидин-4(3Н)-он, 3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-(ацетиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-(бутириламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-(гексаноиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-(бензоиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-[(2-фенилацетил)амино]-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-(2-нафтоиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-6-[(метилсульфонил)амино]-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-6-[(метилсульфонил)амино]-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-(ацетиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-(бутириламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-(гексаноиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-(бензоиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-[(2-фенилацетил)амино]-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-(2-нафтоиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон 6-[ацетил(метил)амино]-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-6-фенил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-6-(4-метилфенил)-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-6-(3-метилфенил)-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-6-(2-метилфенил)-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-6-(3-пиридил)-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-6-(4-пиридил)-4(3H)-хиназолинон, 2-метил-5-фенил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-6-(2-пиридил)-4(3H)-хиназолинон, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-(1-циклогексил-4-пиперидинилокси)фенил}-2-метил-4(3H)-хиназолинон, 3-{4-(1-изопропил-4-пиперидинилокси)фенил}-2-метил-4(3H)-хиназолинон, 3-{4-(1-этил-4-пиперидинилокси)фенил}-2-метил-4(3H)-хиназолинон, 3-{4-(1-бутил-4-пиперидинилокси)фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метил-5-трифторметил-4(3H)-хиназолинон, 3-{4-(1-циклопентил-4-пиперидинилокси)фенил}-2,5-диметил-4(3H)-хиназолинон, 7-хлор-3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2,6-диметил-4(3H)-хиназолинон, 6-хлор-3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-6-метокси-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[2,3-d]пиримидин-4(3H)-он, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[4,3-d]пиримидин-4(3H)-он, 6-хлор-3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2,5-диметил-4(3H)-хиназолинон, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-5-метокси-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метил-5-трифторметил-4(3H)-хиназолинон, 5-хлор-3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолин, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[4,3-d]пиримидин-4(3Н)-он, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[4,3-d]пиримидин-4(3H)-он, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[2,3-d]пиримидин-4(3H)-он, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[2,3-d]пиримидин-4(3H)-он, 6-хлор-3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, 6-хлор-3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[3,4-d]пиримидин-(3H)-он, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, 2-фенил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, цис-2-метил-3-(4-{[4-(1-пирролидинил)циклогексил]окси}фенил)-4(3H)-хиназолинон, транс-2-метил-3-(4-{[4-(1-пирролидинил)циклогексил]окси}фенил)-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-3-пирролидинил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутил-3-пирролидинил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-4-азепанил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутил-4-азепанил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-метил-2-{4-[3-(1-пиперидинил)пропокси]фенил}-1(2H)-изохинолинон, 2-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-3-метил-1(2H)-изохинолинон, 2-метил-3-[4-{[3-(1-пирролидинил)циклопентил]окси}фенил]-4(3H)-хиназолинон, 2-этил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[2,3-d]пиримидин-4(3H)-он, 2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[4,3-1]пиримидин-4(3H)-он, 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-5-фтор-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-7-фтор-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-метокси-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-фтор-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-8-фтор-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-фтор-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, 6-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он, 6-метокси-2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он, 5-метокси-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон, 7-метокси-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон, 2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[2,3-d]пиримидин-4(3H)-он, 5-фтор-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон, 2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)пиридо[4,3-d]пиримидин-4(3H)-он, 6-метокси-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон или 6-метокси-2-метил-3-(4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон, или его фармацевтически приемлемую соль; (18) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[2,3-d]пиримидин-4(3H)-он или его фармацевтически приемлемую соль; (19) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[4,3-d]пиримидин-4(3H)-он или его фармацевтически приемлемую соль; (20) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 2-этил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[2,3-d]пиримидин-4(3H)-он или его фармацевтически приемлемую соль; (21) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[4,3-d]пиримидин-4(3H)-он или его фармацевтически приемлемую соль; (22) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2,5-диметил-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (23) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метил-5-трифторметил-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (24) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-5-метокси-2-метил-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (25) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-5-фтор-2-метил-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (26) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-7-фтор-2-метил-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (27) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-метокси-2-метил-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (28) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-фтор-2-метил-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (29) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-8-фтор-2-метил-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (30) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[4,3-d]пиримидин-4(3H)-он или его фармацевтически приемлемую соль; (31) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-фтор-2-метилпиридо[3,4-d]пиримидин-4(3H)-он или его фармацевтически приемлемую соль; (32) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[4,3-d]пиримидин-4(3H)-он или его фармацевтически приемлемую соль; (33) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 6-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он или его фармацевтически приемлемую соль; (34) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 6-метокси-2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он или его фармацевтически приемлемую соль; (35) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 2,5-диметил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (36) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-5-трифторметил-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (37) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 5-фтор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (38) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 6-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (39) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 5-метокси-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (40) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 7-метокси-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (41) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[2,3-d]пиримидин-4(3H)-он или его фармацевтически приемлемую соль; (42) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 5-фтор-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (43) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)пиридо[4,3-d]пиримидин-4(3H)-он или его фармацевтически приемлемую соль; (44) Соединение по п.(1), где соединение, представленное формулой (I), представляет собой 6-метокси-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон или его фармацевтически приемлемую соль; (45) Соединение по п.1, где соединение, представленное формулой (I), представляет собой 6-метокси-2-метил-3-(4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон или его фармацевтически приемлемую соль. Соединение или соль по любому из пп.(1)-(45) действует как антагонист или обратный агонист гистаминового H3 рецептора. Иными словами, настоящее изобретение также обеспечивает антагонист или обратный агонист гистаминового H3 рецептора, состоящий из соединения по любому из пп.(1)-(45) или его фармацевтически приемлемой соли. Согласно данным самых последних исследований гистаминовые H3 рецепторы очень активны в рецепторных клетках и тканях или в мембранных фракциях, выделенных из рецепторных клеток и тканей, и они постоянно активны в живом организме (эндогенные факторы, например активность, наблюдаемая в отсутствие гистамина) (см., например, Nature, Vol.408, p.860). Сообщалось, что такая постоянная активность подавляется обратными агонистами. Например, постоянная активность ауторецептора подавляется тиоперамидом или ципроксифаном, и в результате активируется высвобождение нейротрансмиттеров из синаптических окончаний, т.е. высвобождение и отделение гистамина. На крысах на основании того факта, что высокоселективный ингибитор фермента синтеза гистамина (гистидиндекарбоксилазы) негативно влияет на процесс бодрствования, было показано, что действие гистамина направлено на регулирование мотивированного бодрствования. У кошек введение (R)-( С другой стороны, тиоперамид, который является антагонистом или обратным агонистом гистаминового H3 рецептора, усиливает бодрствование дозозависимым образом. Также тиоперамид уменьшает медленную волну REM-сна (см., например, Life Science, Vol.48, p.2397 (1991)). Кроме того, тиоперамид или GT-2331, который является антагонистом или обратным агонистом гистамина H3, уменьшает эмотивную каталепсию и сон у страдающих нарколепсией собак (см., например, Brain Research, Vol.793, p.279 (1998)). Такие открытия говорят о том, что H3 рецепторы участвуют в регуляции бодрствование – сон и расстройствах сна, что дает основание предположить, что селективные агонисты, антагонисты или обратные агонисты H3 могут быть полезными для профилактики и лечения расстройств сна и состояний, сопровождающихся расстройством сна (например, идиопатическая гиперсомния, повторяющаяся время от времени гиперсомния, врожденная гиперсомния, нарколепсия, нарушения, связанные с периодическим движением конечностей во сне, синдром апное во сне, нарушение циркадного ритма, синдром хронической усталости, нарушение быстрого сна (REM-сна), старческая бессонница, отсутствие сна у работающих в ночную смену, идиопатическая бессонница, повторяющаяся время от времени бессонница, врожденная бессонница, депрессия и синдром интеграции дисфункций). Поэтому соединение или соль по любому из пп.(1)-(45), которое действует как антагонист или обратный агонист H3 рецептора, как предполагают, является полезным для профилактики и лечения расстройств сна и состояний, сопровождающихся расстройством сна. У крыс введение тиоперамида или GT-2331, который является антагонистом или обратным агонистом гистамина H3, лечит нарушения, связанные с неспособностью к обучению (LD), гиперкинезией и дефицитом внимания (ADHD) (см., например, Life Science, Vol.69, p.469 (2001)). У крыс введение (R)-( С другой стороны, тиоперамид, который является антагонистом или обратным агонистом гистамина H3, восстанавливает ухудшение памяти, вызванное лекарственным средством скополамином в испытании индукции амнезии, дозозависимым образом (см., например, Pharmacology, Biochemistry and Behavior, Vol.68, p.735 (2001)). Такие открытия дают основания предположить, что антагонисты или обратные агонисты гистаминового H3 рецептора могут быть полезны для профилактики и лечения неспособности к запоминанию/обучению и заболеваний, сопровождающихся неспособностью к запоминанию/обучению, таких как болезнь Альцгеймера, болезнь Паркинсона или расстройство дефицита внимания/гиперкинезии. Поэтому соединение или соль по любому из пп.(1)-(45), как предполагают, является полезным для профилактики и лечения неспособности к запоминанию/обучению и заболеваний, сопровождающихся неспособностью к запоминанию/обучению. У крыс интравентрикулярное введение гистамина подавляет пищевое поведение, что дает основания предположить, что гистамин принимает участие в регуляции пищевого поведения (см., например, Journal of Physiology и Pharmacology Vol.49, p.191 (1998)). Действительно, тиоперамид, который является антагонистом или обратным агонистом гистамина H3, подавляет пищевое поведение дозозависимым образом, а также способствует высвобождению интрацеребрального гистамина (см., например, Behavioral Brain Research, Vol.104, p.147 (1999)). Такие открытия дают основания предположить, что гистаминовые H3 рецепторы принимают участие в регуляции пищевого поведения и что антагонисты или обратные агонисты гистамина H3 могут быть полезными для профилактики и лечения заболеваний обмена веществ, таких как нарушение пищевого поведения, ожирение, сахарный диабет, кахексия и гиперлипидемия. Поэтому соединение или соль по любому из пп.(1)-(45), как предполагают, является полезным для профилактики и лечения таких заболеваний обмена веществ. У крыс введение (R)-( Такие открытия дают основания предположить, что гистаминовые H3 рецепторы принимают участие в регуляции давления крови, сердечных сокращений и минутного сердечно-сосудистого выброса и что агонисты, антагонисты или обратные агонисты гистаминового H3 рецептора могут быть полезными для профилактики и лечения заболеваний системы кровообращения, таких как гипертензия и различные проблемы сердца. Поэтому соединение или соль по любому из пп.(1)-(45), как предполагают, является полезным для профилактики и лечения таких заболеваний системы кровообращения. У мышей тиоперамид, который является антагонистом или обратным агонистом гистамина H3, подавляет судороги, вызванные стимуляцией электрошоком, или эпилептические удары, вызванные пентилентетразолом (PTZ), дозозависимым образом, (см., например, European Journal of Pharmacology, V p.129 (1993), и Pharmacology, Biochemistry and Behavior, Vol.68, p.735 (2001)). Такие открытия дают основания предположить, что антагонисты или обратные агонисты гистамина H3 могут быть полезными для профилактики и лечения эпилепсии или центральных судорог. Поэтому соединение или соль по любому из пп.(1)-(45), как предполагают, является полезным для профилактики и лечения такой эпилепсии или центральных судорог. Иными словами, настоящее изобретение, кроме того, обеспечивает средство для профилактики или лечения заболевания обмена веществ, заболевания системы кровообращения или заболевания нервной системы, содержащее в качестве активного ингредиента соединение по любому из пп.(1)-(45) или его фармацевтически приемлемую соль. В качестве заболевания обмена веществ можно указать, по меньшей мере, одно заболевание, выбранное из группы, включающей ожирение, сахарный диабет, нарушения гормональной секреции, гиперлипидемию, подагру и ожирение печени. В качестве заболевания системы кровообращения можно указать, по меньшей мере, одно заболевание, выбранное из группы, включающей стенокардию, острую и застойную сердечную недостаточность, инфаркт миокарда, кольцевидный артериосклероз, гипертензию, заболевание почек и нарушение электролитного баланса. В качестве заболевания нервной системы можно указать, по меньшей мере, одно заболевание, выбранное из группы, включающей расстройство сна, заболевание, сопровождающееся расстройством сна, булимию, аффективное расстройство, эпилепсию, делириозный синдром, деменцию, расстройство дефицита внимания/гиперактивности, ухудшение памяти, болезнь Альцгеймера, болезнь Паркинсона, когнитивное расстройство, двигательное расстройство, дизестезию, дизосмию, резистентность к морфину, наркозависимость, алькогольную зависимость и тремор. В качестве заболевания нервной системы можно также указать, по меньшей мере, одно заболевание, выбранное из группы, включающей идиопатическую гиперсомнию, повторяющуюся время от времени гиперсомнию, врожденную гиперсомнию, нарколепсию, периодическое движение конечностей во сне, синдром апное во сне, нарушение циркадного ритма, синдром хронической усталости, нарушение быстрого сна (REM-сна), старческую бессонницу, нарушение санитарных норм сна у работающих в ночную смену, идиопатическую бессонницу, повторяющуюся время от времени бессонницу, врожденную бессонницу, депрессию, ощущение тревоги и шизофрению. Соединение или соль по любому из пп.(1)-(45) можно использовать в сочетании с сопутствующим лекарственным средством. Иными словами, настоящее изобретение, кроме того, обеспечивает средство для профилактики или лечения заболевания обмена веществ, заболевания системы кровообращения или заболевания нервной системы, содержащее в качестве активных ингредиентов соединение по любому из пп.(1)-(45) или его фармацевтически приемлемую соль и сопутствующее лекарственное средство. В этом случае примеры сопутствующего лекарственного средства включают антидиабетические средства, средства, снижающие уровень липидов, антигипертензивные средства и средства против ожирения. Можно сочетать два или более таких сопутствующих лекарственных средств. В качества такого средства для профилактики или лечения обеспечивается также средство для профилактики или лечения заболевания обмена веществ, заболевания системы кровообращения или заболевания нервной системы, включающее (i)-(iii): (i) соединение по любому из пп.(1)-(45) или его фармацевтически приемлемую соль; (ii) одно или несколько соединений, выбранных из группы, включающей (a)-(g): (a) антагонист или обратный агонист гистамина H3, отличный от (i), (b) бигуанид, (c) агонист PPAR, (d) инсулин, (e) соматостатин, (f) ингибитор (g) средства, усиливающие секрецию инсулина; и (iii) фармацевтически приемлемый носитель. Далее объясняется терминология, используемая в настоящем описании, а затем более подробно описывается соединение, относящееся к настоящему изобретению. “Арильная группа” означает углеводородную кольцевую арильную группу, содержащую 6-14 атомов углерода, такую как фенил, нафтил, бифенил или антрил. “Низшая алкильная группа” означает линейную или разветвленную алкильную группу, содержащую 1-6 атомов углерода, например метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, неопентил, изопентил, 1,1-диметилпропил, 1-метилбутил, 2-метилбутил, 1,2-диметилпропил, гексил, изогексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2 диметилбутил, 1,3-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,2,2-триметилпропил или 1-этил-2-метилпропил. “Циклоалкильная группа, содержащая 3-9 атомов углерода” означает, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил или циклононил. “Алкоксигруппа” означает группу, где атом водорода гидроксигруппы замещен указанной выше низшей алкильной группой, например метокси, этокси, пропокси, изопропокси, бутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, гексилокси или изогексилокси. “Алкилсульфонильная группа” означает группу, где указанная выше алкильная группа объединена с сульфонилом, например метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил или бутилсульфонил. “Алкилсульфониламиногруппа” означает группу, где один из атомов водорода аминогруппы замещен указанной выше алкилсульфонильной группой, например метилсульфониламино, этилсульфониламино, пропилсульфониламино, изопропилсульфониламино, бутилсульфониламино, втор-бутилсульфониламино, трет-бутилсульфониламино, N-метилметилсульфониламино, N-метилэтилсульфониламино, N-метилпропилсульфониламино, N-метилизопропилсульфониламино, N-метилбутилсульфониламино, N-метил-втор-бутилсульфониламино, N-метил-трет-бутилсульфониламино, N-этилметилсульфониламино, N-этил-этилсульфониламино, N-этилпропилсульфониламино, N-этилизопропилсульфониламино, N-этилбутилсульфониламино, N-этил-втор-бутилсульфониламино или N-этил-трет-бутилсульфониламино. “Цикло(низший алкил)сульфонильная группа” означает группу, где указанная выше “циклоалкильная группа, содержащая 3-9 атомов углерода” объединена с сульфонилом, например циклопропилсульфонил, циклобутилсульфонил, циклопентилсульфонил, циклогексилсульфонил, циклогептилсульфонил, циклооктилсульфонил или циклононилсульфонил. “Аралкильная группа” означает группу, где указанная выше низшая алкильная группа содержит одну из указанных выше арильных групп, т.е. бензил, 1-фенилэтил, 2-фенилэтил, 1-нафтилметил или 2-нафтилметил. “Гетероарильная группа” означает 5-7-членное моноциклическое кольцо, содержащее 1-3 гетероатома, выбранных из группы, состоящей из кислорода, серы и азота, или бициклическое кольцо, где моноциклическое кольцо конденсировано с бензольным кольцом или пиридиновым кольцом, например фурил, тиенил, пирролил, имидазолил, триазолил, тиазолил, тиадиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиримидинил, пиридазинил, пиразолил, пирадинил, хинолил, изохинолил, хиназолинил, хинолидинил, хиноксанил, циннолинил, бензоимидазолил, имидазопиридил, бензофуранил, нафтилиденил, 1,2-бензоизоксазолил, бензоксазолил, бензотиазолил, оксазолопиридил, пиридотиазолил, изотиазолопиридил или бензотиенил. “Атом галогена” означает фтор, хлор, бром или иод. “Алкоксикарбониламиногруппа” означает группу, где один из атомов водорода в аминогруппе замещен указанной выше алкоксикарбонильной группой, например метоксикарбониламино, этоксикарбониламино, пропоксикарбониламино, изопропоксикарбониламино, бутоксикарбониламино, втор-бутоксикарбониламино, трет-бутоксикарбониламино, пентилоксикарбониламино, N-метилметоксикарбониламино, N-метилэтоксикарбониламино, N-метилпропоксикарбониламино, N-метилизопропоксикарбониламино, N-метилбутоксикарбониламино, N-метил-втор-бутоксикарбониламино, N-метил-трет-бутоксикарбониламино, N-этилметоксикарбониламино, N-этилэтоксикарбониламино, N-этилпропоксикарбониламино, N-этилизопропоксикарбониламино, N-этилбутоксикарбониламино, N-этил-втор-бутоксикарбонил амино или N-этил-трет-бутоксикарбониламино. “Гидроксиалкильная группа” означает группу, где один из атомов водорода в указанной выше низшей алкильной группе замещен гидроксигруппой, например гидроксиметил, гидроксиэтил, 1-гидроксипропил, 1-гидроксиэтил, 2-гидроксипропил или 2-гидрокси-1-метилэтил. “Группа моно-низший алкилкарбамоил” означает группу, где карбамоильная группа является монозамещенной указанной выше низшей алкильной группой, например метилкарбамоил, этилкарбамоил, пропилкарбамоил, изопропилкарбамоил, бутилкарбамоил, втор-бутилкарбамоил или трет-бутилкарбамоил. “Группа ди-низший алкилкарбамоил” означает карбамоил, который является дизамещенным одинаковыми или отличными друг от друга низшими алкильными группами. Примерами “групп ди-низший алкилкарбамоил” являются диметилкарбамоил, диэтилкарбамоил, этилметилкарбамоил, дипропилкарбамоил, метилпропилкарбамоил и диизопропилкарбамоил. “Группа ди-низший алкилкарбамоил” также включает 5-8-членное моноциклическое кольцо, образованное атомом азота, образующим карбамоильную группу, объединенным с одинаковыми или отличными друг от друга низшими алкильными группами, или бициклическое кольцо, с которым конденсировано моноциклическое кольцо с образованием бензольного кольца или пиридинового кольца. Конкретными примерами являются группы, представленные следующими формулами. “Алкиламиногруппа” означает группу, где аминогруппа является монозамещенной указанной выше низшей алкильной группой, например метиламино, этиламино, пропиламино, изопропиламино, бутиламино, втор-бутиламино или трет-бутиламино. “Диалкиламиногруппа” означает группу, где аминогруппа является дизамещенной одинаковыми или отличными друг от друга низшими алкильными группами, например диметиламино, диэтиламино, дипропиламино, метилпропиламино или диизопропиламино. “Аминоалкильная группа” означает группу, где один из атомов водорода, образующих указанную выше алкильную группу, является замещенным аминогруппой, например аминометил, аминоэтил или аминопропил. “Алканоильная группа” означает группу, где указанная выше алкильная группа объединена с карбонильной группой, например метилкарбонил, этилкарбонил, пропилкарбонил или изопропилкарбонил. “Алканоиламиногруппа” означает группу, где указанная выше алканоильная группа объединена с аминогруппой, например ацетиламино, пропаноиламино, бутаноиламино, пентаноиламино, метилацетиламино, N-метилпропаноиламино, N-метилбутаноиламино, N-метилпентаноиламино, N-этилацетиламино, N-этилпропаноиламино, N-этилбутаноиламино или N-этилпентаноиламино. “Моно(низший алкил)аминокарбонилоксигруппа” означает карбонилоксигруппу, монозамещенную указанной выше низшей алкильной группой, например метиламинокарбонилокси, этиламинокарбонилокси, пропиламинокарбонилокси или изопропиламинокарбонилокси. “Ди(низший алкил)аминокарбонилоксигруппа” означает карбонилоксигруппу, дизамещенную указанными выше низшими алкильными группами, например диметиламинокарбонилокси, диэтиламинокарбонилокси, диизопропиламинокарбонилокси или этилметиламинокарбонилокси. “Алкилтиогруппа” означает группу, где указанная выше алкильная группа объединена с атомом серы, например метилтио, этилтио, пропилтио или изопропилтио. “Циклоалкоксигруппа” означает группу, где атом водорода гидроксигруппы замещен циклоалкильной группой, содержащей 3-9 атомов углерода, например циклопропокси, циклобутокси, циклопентилокси, циклогексилокси или циклогептилокси. “Арилоксигруппа” означает группу, где атом кислорода объединен с указанной выше арильной группой, например фенокси, нафталин-1-илокси или нафталин-2-илокси. “Гетероарилоксигруппа” означает группу, где указанная выше гетероарильная группа объединена с оксигруппой, например группа фуран-2-илокси, фуран-3-илокси, тиофен-2-илокси, тиофен-3-илокси, 1Н-пиррол-2-илокси, 1Н-пиррол-3-илокси, 1Н-имидазол-2-илокси, 1Н-имидазол-4-илокси, 3H-имидазол-4-илокси, 4H-[1,3,4]триазол-3-илокси, 2H-[1,2,4]триазол-3-илокси, 1Н-[1,2,4]триазол-3-илокси, тиазол-2-илокси, тиазол-4-илокси, тиазол-5-илокси, пиридин-2-илокси, пиридин-3-илокси, пиридин-4-илокси, пиримидин-2-илокси, пиримидин-4-илокси, пиримидин-5-илокси, пиридазин-3-илокси, пиридазин-4-илокси, 2H-пиразол-3-илокси, 1H-пиразол-4-илокси, 1Н-пиразолил-3-окси, пиразин-3-илокси, пиразин-4-илокси, хинолин-2-илокси, хинолин-3-илокси, хинолин-4-илокси, изохинолин-1-илокси, изохинолин-3-илокси, изохинолин-4-илокси, хиназолин-2-илокси, хиназолинил-3-илокси, хиноксалин-2-илокси, хиноксалин-3-илокси, циннолин-3-илокси, циннолин-4-илокси, 1Н-бензимидазол-2-илокси, 1Н-имидазо[4,5-b]пиридин-5-илокси, 1H-имидазо[4,5-b]пиридин-6-илокси, 1Н-имидазо[4,5-b]пиридин-7-илокси, бензо[d]изоксазол-4-илокси, бензо[d]изоксазол-5-илокси, бензо[d]изоксазол-6-илокси, бензоксазол-4-илокси, бензоксазол-5-илокси или бензоксазол-6-илокси. “Гетероарилалкильная группа” означает группу, где указанная выше гетероарильная группа объединена с указанной выше алкильной группой, например фуран-3-илметил, фуран-2-илметил, фуран-3-илэтил, фуран-2-илэтил, фуран-3-илпропил, фуран-2-илпропил, тиофен-3-илметил, тиофен-2-илметил, тиофен-3-илэтил, тиофен-2-илэтил, тиофен-3-илпропил, тиофен-2-илпропил, 1H-пиррол-3-илметил, 1H-пиррол-2-илметил, 1Н-пиррол-3-илэтил, 1Н-пиррол-2-илэтил, 1Н-пиррол-3-илпропил, 1H-пиррол-2-илпропил, 1H-имидазол-4-илметил, 1Н-имидазол-2-илметил, 1Н-имидазол-5-илметил, 1Н-имидазол-4-илэтил, 1H-имидазол-2-илэтил, 1Н-имидазол-5-илэтил, 1Н-имидазол-4-илпропил, 1H-имидазол-2-илпропил, 1Н-имидазол-5-илпропил, 1Н-[1,2,3]триазол-4-илметил, 1Н-[1,2,3]триазол-5-илметил, 1Н-[1,2,3]триазол-4-илэтил, 1Н-[1,2,3]триазол-5-илэтил, 1Н-[1,2,3]триазол-4-илпропил, 1Н-[1,2,3]триазол-5-илпропил, 1H-[1,2,4]триазол-3-илметил, 1Н-[1,2,4]триазол-5-илметил, 1Н-[1,2,4]триазол-3-илэтил, 1Н-[1,2,4]триазол-5-илэтил, 1Н-[1,2,4]триазол-3-илпропил, 1Н-[1,2,4]триазол-5-илпропил, тиазол-4-илметил, тиазол-3-илметил, тиазол-2-илметил, тиазол-4-илэтил, тиазол-3-илэтил, тиазол-2-илэтил, тиазол-4-илпропил, тиазол-3-илпропил, тиазол-2-илпропил, [1,2,4]тиадиазол-3-илметил, [1,2,4]тиадиазол-3-илэтил, [1,2,4]тиадиазол-3-илпропил, [1,2,4]тиадиазол-5-илметил, [1,2,4]тиадиазол-5-илэтил, [1,2,4]тиадиазол-5-илпропил, [1,3,4]тиадиазол-2-илметил, [1,3,4]тиадиазол-2-илэтил или [1,3,4]тиадиазол-2-илпропил. “Моноарилкарбамоильная группа” означает карбамоильную группу, монозамещенную указанной выше арильной группой, например фенилкарбамоил. Далее более подробно описывается соединение, представленное указанной выше формулой (I), относящееся к настоящему изобретению. Сначала раскрываются символы, используемые в формуле (I). [где символы имеют указанное выше значение]. Ar представляет собой фенил, пиримидинил, пиридил, тиазолил, оксазолил, пиразолил, тиадиазолил или тиенил, т.е. бивалентную группу, образованную удалением двух атомов водорода из бензола, пиримидина, пиридина, тиазола, оксазола, пиразола, тиадиазола или тиофена, но из этих групп предпочтительными являются фенил или пиримидинил, т.е. группа, образованная удалением двух атомов водорода из бензола или пиримидина. Ar может быть замещен галогеном, низшим алкокси, гидрокси и низшим алкилом. Примерами такого галогена являются фтор, бром и хлор. В качестве низшего алкокси можно указать метокси и этокси. Такая низшая алкоксигруппа может быть дополнительно замещена галогеном. В качестве низшего алкила можно указать метил и этил. X1 представляет собой атом азота, атом серы или атом кислорода, но из них предпочтительным является кислород. X2 представлен формулой (II): [где символы имеют указанное выше значение], формулой (III):
[где символы имеют указанное выше значение] или формулой (IV): [где символы имеют указанное выше значение]. Сначала будет описан случай, где -X2 представлен формулой (II). [где символы имеют указанное выше значение]. n означает целое число, имеющее значение от 2 до 4, предпочтительно 3 или 4, но более предпочтительно 3. “Низшие алкильные группы”, представленные R4 и R5, идентичны указанным выше. Более конкретно, такая низшая алкильная группа может, например, представлять собой метил, этил, пропил или изопропил. “Низшие алкильные группы”, представленные R4 и R5, могут быть одинаковыми или отличными друг от друга. “Циклоалкильные группы”, представленные R4 и R5, идентичны указанным выше. Такая циклоалкильная группа может, например, представлять собой циклопропил, циклобутил или т.п. R4, R5 и атом азота в указанной выше формуле (II) могут образовывать 5-8-членное моноциклическое кольцо (помимо атома азота, смежного с R4 и R5, такое кольцо может, кроме того, содержать гетероатом, выбранный из атома азота, атома серы и атома кислорода). Примерами моноциклического кольца являются пирролидиновое кольцо, пиперидиновое кольцо, гомопиперидиновое кольцо, гептаметилениминовое кольцо, пиперазиновое кольцо, морфолиновое кольцо и гомоморфолиновое кольцо. R4, R5 и атом азота в указанной выше формуле (II) могут также образовывать бициклокольцо. Такое бициклокольцо представляет собой азабициклическое кольцо и является неароматическим кольцом, содержащим в качестве единственного гетероатома, образующего это кольцо атом азота, связанный с R4 и R5 в указанной выше формуле (II). Такое кольцо предпочтительно содержит от 6 до 10 образующих кольцо атомов, но более предпочтительно 7-9 образующих кольцо атомов. Примерами такого бициклокольца являются группы, представленные формулами (V). (CH2)n в указанной выше формуле (II) может быть замещен низшей алкильной группой, содержащей от 1 до 3 атомов углерода. Примерами такой низшей алкильной группы являются метил, этил, н-пропил и изопропил. Когда X2 представляет собой группу, представленную указанной выше формулой (II), предпочтительно, чтобы n имел значение 3 или 4, и R4, R5 и атом азота, взятые вместе, образовывали 5-8-членное моноциклическое кольцо (такое моноциклическое кольцо может содержать в качестве группы заместителя атом галогена или низшую алкильную группу, которая может быть замещена галогеном), или образовывали 6-10-членное бициклокольцо, и более предпочтительно, чтобы n имел значение 3 и R4, R5 и атом азота, взятые вместе, образовывали 5-8-членное моноциклическое кольцо (такое моноциклическое кольцо может содержать в качестве группы заместителя атом галогена или низшую алкильную группу, которая может быть замещена галогеном), или образовывали 6-10-членное бициклокольцо. Далее будет описан случай, где -X2 представлен формулой (III).
[где символы имеют указанное выше значение]. m означает целое число, имеющее значение от 0 до 4, из которых предпочтительным значением является 2 или 3. R6 представляет собой низшую алкильную группу или циклоалкильную группу. “Низшая алкильная группа”, представленная R6, идентична указанным выше. Более конкретно, такая низшая алкильная группа может, например, представлять собой метил, этил, пропил, бутил или пентил. “Циклоалкильная группа”, представленная R6, идентична указанной выше низшей алкильной группе, например метилу, этилу, пропилу, бутилу, изопропилу, изобутилу, трет-бутилу, пентилу, изоамилу, неопентилу, 1,1-диметилпропилу, 1-метилбутилу, 2-метилбутилу, гексилу, изогексилу, 1-метилпентилу или 1,1-диметилбутилу. Когда -X2 представлен формулой (III), два отличных друг от друга атома углерода из атомов углерода, образующих X2, могут быть объединены вместе через -(CH2)m11- (m11 означает целое число, имеющее значение от 1 до 3) с образованием бициклокольца. Примерами такого бициклокольца являются группы, представленные формулами (III-2). (III-2) [где символы имеют указанное выше значение]. Далее описывается случай, когда -X2 представлен формулой (IV). [где символы имеют указанное выше значение]. m означает целое число, имеющее значение от 0 до 4, из которых предпочтительным значением является 2 или 3. R4 и R5 имеют указанные выше значения, и предпочтительные и более предпочтительные аспекты идентичны указанным выше аспектам R4 и R5. Когда -X2 представлен формулой (IV), два отличных друг от друга атома углерода из атомов углерода, образующих X2 (за исключением атомов углерода в R4 и R5), могут быть объединены вместе через простую связь или -(CH2)m11- (m11 означает целое число, имеющее значение от 1 до 3) с образованием бициклокольца. Примерами такого бициклокольца являются группы, представленные формулами (IV-2). [где символы имеют указанное выше значение]. Когда -X2 представляет собой одно из бициклоколец, представленных формулами(IV-2), предпочтительные аспекты R4 и R5 идентичны указанным выше. Из указанных выше определений X2 более конкретно можно указать, например, 2-диметиламиноэтил, 2-диэтиламиноэтил, 2-ди-н-пропиламиноэтил, 2-диизопропиламиноэтил, 3-диметиламинопропил, 3-диэтиламинопропил, 3-ди-н-пропиламинопропил, 3-диизопропиламинопропил, 4-диметиламинобутил, 4-диэтиламинобутил, 4-ди-н-пропиламинобутил, 4-диизопропиламинобутил, 2-(этилметиламино)этил, 2-(этилпропиламино)этил, 2-(этилизопропиламино)этил, 2-(метилизопропиламино)этил, 2-(этил-н-пропиламино)этил, 3-(этилметиламино)пропил, 3-(этилпропиламино)пропил, 3-(этилизопропиламино)пропил, 3-(метилизопропиламино)пропил} 2-(этил-н-пропиламино)пропил, 4-(этилметиламино)бутил, 4-(этилпропиламино)бутил, 4-(этилизопропиламино)бутил, 2-(этил-н-пропиламино)бутил, 2-дициклопропиламиноэтил, 2-дициклобутиламиноэтил, 2-дициклопентиламиноэтил 2-дициклогексиламиноэтил, 3-дициклопропиламинопропил, 3-дициклобутиламинопропил, 3-дициклопентиламинопропил, 3-дициклогексиламинопропил, 4-дициклопропиламинобутил, 4-дициклобутиламинобутил, 4-дициклопентиламинобутил, 4-дициклогексиламинобутил, 2-(циклобутил-циклопропиламино)этил, 2-(циклобутил-циклопентиламино)этил, 2-(циклогексил-циклопентил)этил, 3-(циклобутил-циклопропиламино)пропил, 3-(циклобутил-циклопентиламино)пропил, 3-(циклогексилциклопентиламино)пропил, 4-(циклобутил)циклопропиламинобутил, 4-(циклобутил-циклопентиламино)бутил, 4-(циклогексил-циклопентиламино)бутил, 2-(циклопропилметиламино)этил, 2-(циклопропилэтиламино)этил, 2-(циклопропил-н-пропиламино)этил, 2-(циклопропилизопропиламино)этил, 2-(циклобутилметиламино)этил, 2-(циклобутилэтиламино)этил, 2-(циклобутил-н-пропиламино)этил, 2-(циклобутилизопропиламино)этил, 2-(циклопентилметиламино)этил, 2-(циклопентилэтиламино)этил, 2-(циклопентил-н-пропиламино)этил, 2-(циклопентилизопропиламино)этил, 2-(циклогексилметиламино)этил, 2-(циклогексилэтиламино)этил, 2-(циклогексил-н-пропиламино)этил, 2-(циклогексилизопропиламино)этил, 3-(циклопропилметиламино)пропил, 3-(циклопропилэтиламино)пропил, 3-(циклопропил-н-пропиламино)пропил, 3-(циклопропилизопропиламино)пропил, 3-(циклобутилметиламино)пропил, 3-(циклобутилэтиламино)пропил, 3-(циклобутил-н-пропиламино)пропил, 3-(циклобутилизопропиламино)пропил, 3-(циклопентилметиламино)пропил, 3-(циклопентилэтиламино)пропил, 3-(циклопентил-н-пропиламино)пропил, 3-(циклопентилизопропиламино)пропил, 3-(циклогексилметиламино)пропил, 3-(циклогексилэтиламино)пропил, 3-(циклогексил-н-пропиламино)пропил, 3-(циклогексилизопропиламино)пропил, 4-(циклопропилметиламино)бутил, 4-(циклопропилэтиламино)бутил, 4-(циклопропил-н-пропиламино)бутил, 4-(циклопропилизопропиламино)бутил, 4-(циклобутилметиламино)бутил, 4-(циклобутилэтиламино)бутил, 4-(циклобутил-н-пропиламино)бутил, 4-(циклобутилизопропиламино)бутил, 4-(циклопентилметиламино)бутил, 4-(циклопентилэтиламино)бутил, 4-(циклопентил-н-пропиламино)бутил, 4-{циклопентилизопропиламино)бутил, 4-(циклогексилметиламино)бутил, 4-(циклогексилэтиламино)бутил, 4-(циклогексил-н-пропиламино)бутил, 4-(циклогексилизопропиламино)бутил, 2-пирролидин-1-ил-этил, 2-пиперидин-1-илэтил, 2-гомопиперидин-1-илэтил, 2-гептаметиленимин-1-илэтил, 2-морфолин-4-илэтил, 2-гомоморфолин-4-илэтил, 3-пирролидин-1-илпропил, 3-пиперидин-1-илпропил, 3-гомопиперидин-1-илпропил, 3-гептаметиленимин-1-илпропил, 3-морфолин-4-илпропил, 3-гомоморфолин-4-илпропил, 4-пирролидин-1-илбутил, 4-пиперидин-1-илбутил, 4-гомопиперидин-1-илбутил, 4-гептаметиленимин-1-илбутил, 4-морфолин-4-илбутил, 4-гомоморфолин-4-илбутил, 2-(5-азабицикло[2.1.1]гексан-5-илэтил, 2-(6-аза)бицикло[3.1.1]гептан-6-илэтил, 2-(7-азабицикло[2.1.1]гептан-7-илэтил), 2-(8-азабицикло[3.2.1]октан-8-ил-этил), 2-(9-азабицикло[3.3.1]нонан-9-илэтил), 3-(5-азабицикло[2.1.1]гексан-5-илпропил), 3-(6-азабицикло[3.1.1]гептан-6-илпропил), 3-(7-азабицикло[2.1.1]гептан-7-илпропил), 3-(8-азабицикло[3.2.1]октан-8-илпропил), 3-(9-азабицикло[3.3.1]нонан-9-илпропил), 4-(5-азабицикло[2.1.1]гексан-5-илбутил), 4-(6-азабицикло[3.1.l]гептан-6-илбутил), 4-(7-азабицикло[2.1.1]гептан-7-илбутил), 4-(8-азабицикло[3.2.1]октан-8-илбутил, 4-(9-азабицикло[3.3.1]нонан-9-илбутил, 1-метилазетидин-3-ил, 1-метилазетидин-2-ил, 1-этилазетидин-3-ил, 1-этилазетидин-2-ил, 1-изопропилазетидин-3-ил, 1-изопропилазетидин-2-ил, 1-циклопропилазетидин-3-ил, 1-циклобутилазетидин-2-ил, 1-циклобутилазетидин-3-ил, 1-циклобутилазетидин-2-ил, 1-циклопентилазетидин-3-ил, 1-циклопентилазетидин-2-ил, 1-циклогексилазетидин-3-ил, 1-циклогексилазетидин-2-ил, 1-метилпирролидин-3-ил, 1-метилпирролидин-2-ил, 1-этилпирролидин-3-ил, 1-этилпирролидин-3-ил, 1-изопропилпирролидин-3-ил, 1-изопропилпирролидин-2-ил, 1-циклопропилпирролидин-3-ил, 1-циклопропилпирролидин-2-ил, 1-циклобутилпирролидин-3-ил, 1-циклобутилпирролидин-2-ил, 1-циклопентилпирролидин-3-ил, 1-циклопентилпирролидин-2-ил, 1-циклогексилпирролидин-3-ил, 1-циклогексилпирролидин-2-ил, 1-метилпиперидин-4-ил, 1-метилпиперидин-3-ил, 1-метилпиперидин-2-ил, 1-этилпиперидин-4-ил, 1-этилпиперидин-3-ил, 1-этилпиперидин-2-ил, 1-изопропилпиперидин-4-ил, 1-изопропилпиперидин-3-ил, 1-изопропилпиперидин-2-ил, 1-циклопропилпиперидин-4-ил, 1-циклопропилпиперидин-3-ил, 1-циклопропилпиперидин-2-ил, 1-циклобутилпиперидин-4-ил, 1-циклобутилпиперидил-3-ил, 1-циклобутилпиперидин-2-ил, 1-циклопентилпиперидин-4-ил, 1-циклопентилпиперидин-3-ил, 1-циклопентилпиперидин-2-ил, 1-циклогексилпиперидин-4-ил, 1-циклогексилпиперидин-3-ил, 1-циклогексилпиперидин-2-ил, 3-диметиламиноциклобутил, 3-диэтиламиноциклобутил, 3-диизопропиламиноциклобутил, 3-дициклопропиламинобутил, 3-дициклобутиламинобутил, 3-дициклопентиламинобутил, 3-дициклогексиламинобутил, 2-диметиламиноциклобутил, 2-диэтиламиноциклобутил, 2-диизопропиламиноциклобутил, 2-дициклопропиламинобутил, 2-дициклобутиламинобутил, 2-дициклопентиламинобутил, 2-дициклогексиламинобутил, 3-(циклопропилметиламино)циклобутил, 3-(циклопропилэтиламино)циклобутил, 3-(циклобутилметиламино)циклобутил, 3-(циклобутилэтиламино)циклобутил, 3-(циклопентилметиламино)циклобутил, 3-(циклопентилэтиламино)циклобутил, 3-(циклогексилметиламино)циклобутил, 2-(циклопропилметиламино)циклобутил, 2-(циклопропилэтиламино)циклобутил, 2-(циклобутилметиламино)циклобутил, 2-(циклобутилэтиламино)циклобутил, 2-(циклопентилметиламино)циклобутил, 2-(циклопентилэтиламино)циклобутил, 2-(циклогексилметиламино)циклобутил, 3-пирролидин-1-илциклобутил, 2-пирролидин-1-илциклобутил, 3-пирролидин-1-илциклопентил, 2-пирролидин-1-илциклопентил, 4-пирролидин-1-илциклогексил, 3-пирролидин-1-илциклогексил, 2-пирролидин-1-илциклогексил, 3-пиперидин-1-илциклобутил, 2-пиперидин-1-илциклобутил, 3-пиперидин-1-илциклопентил, 2-пиперидин-1-илциклопентил, 4-пиперидин-1-илциклогексил, 3-пиперидин-1-илциклогексил, 2-пиперидин-1-илциклогексил, 3-гомопиперидин-1-илциклобутил, 2-гомопиперидин-1-илциклобутил, 3-гомопиперидин-1-илциклопентил, 2-гомопиперидин-1-илциклопентил, 4-гомопиперидин-1-илциклогексил, 3-гомопиперидин-1-илциклогексил, 2-гомопиперидин-1-илциклогексил, 3-гептаметиленимин-1-илциклобутил, 2-гептаметиленимин-1-илциклобутил, 3-гептаметиленимин-1-илциклопентил, 2-гептаметиленимин-1-илциклопентил, 4-гептаметиленимин-1-илциклогексил, 3-гептаметиленимин-1-илциклогексил, 2-гептаметиленимин-1-илциклогексил, 2-морфолин-4-илциклобутил, 3-морфолин-4-илциклобутил, 2-морфолин-4-илциклопентил, 3-морфолин-4-илциклопентил, 2-морфолин-4-илциклогексил, 3-морфолин-4-илциклогексил, 4-морфолин-4-илциклогексил, 2-гомоморфолин-4-илциклобутил, 3-гомоморфолин-4-илциклобутил, 4-гомоморфолин-4-илциклобутил, 2-гомоморфолин-4-илциклопентил, 3-гомоморфолин-4-илциклопентил, 4-гомоморфолин-4-илциклопентил, 2-гомоморфолин-4-илциклогексил, 3-гомоморфолин-4-илциклогексил, 4-гомоморфолин-4-илциклогексил, 2-(5-азабицикло[2.1.1]гексан-5-ил)циклобутил, 2-(6-азабицикло[3.1.l]гептан-6-ил)циклобутил, 2-(7-азабицикло[2.1.1]гептан-7-ил)циклобутил, 2-(8-азабицикло[3.2.1]октан-8-ил)циклобутил, 2-(9-азабицикло[3.3.1]нонан-9-ил)циклобутил, 3-(5-азабицикло[2.1.1]гексан-5-ил)циклобутил, 3-(6-азабицикло-[3.1.1]гептан-6-ил)циклобутил, 3-(7-азабицикло[2.1.1]гептан)-7-илциклобутил, 3-(8-азабицикло[3.2.1]октан-8-ил)циклобутил, 3-(9-аза-бицикло[3.3.1]нонан-9-ил)циклобутил, 2-(5-азабицикло[2.1.1]гексан-5-ил)циклопентил, 2-(6-азабицикло[3.1.1]-гептан-6-ил)циклопентил, 2-(7-азабицикло[2.1.1]гептан-7-ил)циклопентил, 2-(8-азабицикло[3.2.1]октан-8-ил)циклопентил, 2-(9-азабицикло[3.3.1]нонан-9-ил)циклопентил, 3-(5-азабицикло[2.1.1]гексан-5-ил)циклопентил, 3-(6-аза)бицикло-[3.3.1]гептан-6-илциклопентил, 3-(7-азабицикло[2.1.1]гептан-7-ил)циклопентил, 3-(8-азабицикло[3.2.1]октан-8-ил)циклопентил, 3-(9-азабицикло[3.3.1]нонан-9-ил)циклопентил, 2-(5-азабицикло[2.1.1]гексан-5-ил)циклогексил, 2-(6-азабицикло[3.1.1]гептан-6-ил)циклогексил, 2-(7-азабицикло[2.1.1]гептан-7-ил)циклогексил, 2-(8-азабицикло[3.2.1]октан-8-ил)циклогексил, 2-(9-азабицикло[3.3.1]нонан-9-ил)циклогексил, 3-(5-азабицикло[2.1.1]гексан-5-ил)циклогексил, 3-(6-азабицикло[3.1.1]гептан-6-ил)циклогексил, 3-(7-азабицикло[2.1.1]гептан-7-ил)циклогексил, 3-(8-азабицикло[3.2.1]октан-8-ил)циклогексил, 3-(9-азабицикло[3.3.1]нонан-9-ил)циклогексил, 3-(7-азабицикло[2.2.1]гепт-7-ил)пропил, 3-(8-азабицикло[3.2.1]окт-8-ил)пропил, 3-(3,3-дифтопирролидин-1-ил)пропил, 3-(3-фторпиперидин-1-ил)пропил, 3-[(3R)-3-фторпирролидин-1-ил]пропил, 3-(4,4-дифторпиперидин-1-ил)пропил, 3-(4-фторпиперидин-1-ил)пропил, 3-(3,3-дифторпиперидин-1-ил)пропил, 3-[(3R)-3-метилпиперидин-1-ил]пропил, 3-[(2R,5R)-2,5-диметилпирролидин-1-ил]пропил, 3-[3-метилпирролидин-1-ил]пропил, 3-[(2S)-2-метилпирролидин-1-ил]пропил, 3-[(2R)-2-метилпирролидин-1-ил]пропил, 3-[(3S)-3-метилпиперидин-1-ил]пропил, 3-(азепан-1-ил)пропил, 3-[(2-оксопирролидин-1-ил)]пропил. Из них предпочтительными являются 3-пиперидин-1-илпропил, 1-циклобутилпиперидин-4-ил, 1-циклопентилпиперидин-4-ил, 3-[(3S)-3-метилпиперидин-1-ил]пропил, 3-[(2R)-2-метилпирролидин-1-ил]пропил, 3-[(2S)-2-метилпирролидин-1-ил]пропил, 1-циклопентилпиперидин-4-ил, 3-(пирролидин-1-ил)пропил, 3-(пиперидин-1-ил)пропил. R1 представляет собой 5-6-членную гетероарильную группу, содержащую в кольце от 1 до 4 гетероатомов, выбранных из азота, серы и кислорода, гетероарилалкильную группу (где гетероарил в гетероарилалкиле имеет значение, определенное выше), линейную или разветвленную низшую алкильную группу (эта низшая алкильная группа может быть дополнительно замещена гидрокси, галогеном, алкокси, аллилокси или аралкилокси), фенильную группу, аралкильную группу, алкоксигруппу, алкилтиогруппу или низшую алкиламиногруппу. В “5-6-членной гетероарильной группе, содержащей в кольце от 1 до 4 гетероатомов, выбранных из азота, серы и кислорода”, представленной R1, когда кольцо содержит от 2 до 4 гетероатомов, эти гетероатомы могут быть одинаковыми или отличными друг от друга. Примерами 5-6-членных гетероарильных групп являются фурил, тиенил, пирролил, имидазолил, триазолил, тиазолил, тиадиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиримидинил, пиридазинил, пиразолил и пирадинил. “Гетероарилалкильная группа”, представленная R1, имеет значение, определенное выше. R1 предпочтительно представляет собой низшую алкильную группу, содержащую от 1 до 3 атомов углерода (эта низшая алкильная группа может быть дополнительно замещена галогеном), или фенил, но более предпочтительно метил, этил, н-пропил, изопропил или трифторметил. R2 и R3 могут быть одинаковыми или отличными друг от друга, и каждый представляет собой атом водорода, амино, нитро, циано, гидрокси, низший алкилсульфонил, атом галогена, низший алкил (эта низшая алкильная группа может быть дополнительно замещена гидрокси или атомом галогена), низший циклоалкил (эта низшая циклоалкильная группа может быть дополнительно замещена атомом галогена), низший алкокси (эта низшая алкоксигруппа может быть дополнительно замещена атомом галогена), низший циклоалкокси (эта низшая циклоалкоксигруппа может быть дополнительно замещена атомом галогена), арилокси, аралкилокси, арил, гетероарил, моно-низший алкилкарбамоил, ди-низший алкилкарбамоил, низший алкилкарбоксамид, арилкарбоксамид, гетероарилкарбоксамид, алканоил, алкилтио, алкоксикарбониламино, алкил, арилсульфониламино, алкиламиносульфонил, ариламиносульфонил, аралкил, алканоиламино или алканоилалкиламино. “Низшая алкилсульфонильная группа”, представленная R2 или R3, имеет значение, определенное выше; “Низшая алкильная группа”, представленная R2 или R3, имеет значение, определенное выше. Такая низшая алкильная группа может быть дополнительно замещена гидроксигруппой или атомом галогена, таким как хлор или фтор. “Низшая алкоксигрупп”, представленная R2 или R3, имеет значение, определенное выше. “Группа цикло-низший алкокси”, представленная R2 или R3, означает группу, где указанная выше группа цикло-низший алкил объединена с атомом кислорода. Такая группа цикло-низший алкокси может быть дополнительно замещена атомом галогена, таким как хлор или фтор. “Арилоксигруппа”, представленная R2 или R3, имеет значение, определенное выше. “Аралкилоксигруппа”, представленная R2 или R3, означает группу, где указанная выше аралкильная группа объединена с атомом кислорода. “Арильная группа”, представленная R2 или R3, имеет значение, определенное выше. “Гетероарильная группа”, представленная R2 или R3, имеет значение, определенное выше. “Группа моно-низший алкилкарбамоил”, представленная R2 или R3, имеет значение, определенное выше. “Группа ди-низший алкилкарбамоил”, представленная R2 или R3, имеет значение, определенное выше. “Группа низший алкилкарбоксамид”, представленная R2 или R3, означает группу, где указанная выше разветвленная или линейная алкильная группа, содержащая от 1 до 6 атомов углерода, объединена с карбоксамидом, например метилкарбоксамид, этилкарбоксамид или изопропилкарбоксамид. “Алканоильная группа”, представленная R2 или R3, означает группу, где указанная выше алкильная группа объединена с карбонилом, например метилкарбонил, этилкарбонил, пропилкарбонил или изопропилкарбонил. “Алкилтиогруппа”, представленная R2 или R3, означает группу, где указанная выше алкильная группа объединена с серой, например метилтио, этилтио, пропилтио или изопропилтио. “Алкоксикарбоксамидная группа”, представленная R2 или R3, означает группу, где указанная выше алкоксигруппа объединена с карбоксамидом, например метоксикарбоксамид, этоксикарбоксамид или изопропоксикарбоксамид. “Арилкарбоксамидная группа”, представленная R2 или R3, означает группу, где указанная выше арильная группа объединена с карбоксамидом, например фенилкарбоксамид или нафтилкарбоксамид. “Гетероарилкарбоксамидная группа”, представленная R2 или R3, означает группу, где указанная выше гетероарильная группа объединена с карбоксамидом, например фурилкарбоксамид, тиенилкарбоксамид или пирролилкарбоксамид. “Арилсульфониламиногруппа”, представленная R2 или R3, означает группу, где указанная выше арильная группа объединена с сульфониламино, например фенилсульфониламино или нафтилсульфониламино. “Алкиламиносульфонильная группа”, представленная R2 или R3, означает группу, где указанная выше алкильная группа объединена с аминосульфонилом, например метиламиносульфонил, этиламиносульфонил или изопропиламиносульфонил. “Ариламиносульфонильная группа”, представленная R2 или R3, означает группу, где указанная выше арильная группа объединена с аминосульфонилом, например фениламиносульфониламино или нафтиламиносульфониламино. “Аралкильная группа”, представленная R2 или R3, имеет значение, определенное выше. “Алканоилалкиламиногруппа”, представленная R2 или R3, означает группу, где указанная выше алканоильная группа объединена с указанным выше алкиламино, например ацетилметиламино или ацетилэтиламино. Кольцо A представляет собой 5-6-членное гетероарильное кольцо, содержащее в кольце 1 или 2 гетероатома, выбранных из азота или серы, или бензольное кольцо. Такое кольцо A может, например, представлять собой бензольное кольцо, пиридиновое кольцо, пиримидиновое кольцо, тиофеновое кольцо или пиразиновое кольцо, из которых предпочтительными являются бензольное кольцо, пиридиновое кольцо и пиримидиновое кольцо, и более предпочтительными являются бензольное кольцо и пиридиновое кольцо. Когда такое 5-6-членное гетероарильное кольцо, представленное кольцом A, содержит два гетероатома, эти гетероатомы могут быть одинаковыми или отличными друг от друга. Кольцо A может иметь заместитель R2 или R3. Указанные выше группы заместителей R2 или R3 в этом кольце A могут быть одинаковыми или отличными друг от друга. Из групп, указанных выше, группы, представленные формулой (VI): [где символы имеют указанное выше значение, и формула (VI-0):
показывает место связывания] могут, например, представлять собой группы, представленные формулами (VI-1): [где символы имеют указанное выше значение], из которых предпочтительными являются группы, представленные формулами (VI-2): [где символы имеют указанное выше значение], и из этих групп более предпочтительными являются группы, представленные формулами (VI-3): [где символы имеют указанное выше значение]. Любые из предпочтительных аспектов групп Ar, X1, X2, Y, R1, R2, R3, R4, R5, R6, n, m и кольца A, описанных выше, могут быть объединены. Более конкретно, соединение, представленное формулой (I): [где символы имеют указанное выше значение], предпочтительно представляет собой 2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 3-{4-[3-(диэтиламино)пропокси]фенил}-2-метил-4-(3H)-хиназолинон, 2-метил-3-{4-[3-(2-метил-1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 3-{4-[3-(2,5-диметил-1-пирролидинил)пропокси]фенил}-2-метил-4(3H)-хиназолинон, 2-метил-3-{4-[4-(1-пиперидинил)бутокси]фенил}-4(3H)-хиназолинон, 3-{4-[3-(1-азепанил)пропокси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[3-(1-азоканил)пропокси]фенил}-2-метил-4(3H)-хиназолинон, 2-метил-3-{4-[3-(2-метил-1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(4-метил-1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 3-(4-{3-[(2R,6S)-2,6-диметил-1-пиперидинил]пропокси}фенил)-2-метил-4(3H)-хиназолинон, 2-метил-3-{4-[3-(3-метил-1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 3-{4-[3-(3,5-диметил-1-пиперидинил)пропокси]фенил}-2-метил-4(3H)-хиназолинон, 2-метил-3-{3-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 3-{3-бром-4-[3-(1-пиперидинил)пропокси]фенил}-2-этил-4(3H)-хиназолинон, 2-метил-3-{4-[2-(1-пиперидинил)этокси]фенил}-4(3H)-хиназолинон, 2,5-диметил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 3-{4-[3-(1-пиперидинил)пропокси]фенил}-2-пропил-4(3H)-хиназолинон, 3-{4-[3-(1-пиперидинил)пропокси]фенил}-2-трифторметил-4(3H)-хиназолинон, 2-изопропил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2,6-диметил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2,8-диметил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-этил-5-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 5-фтор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 5-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4{3H)-хиназолинон, 5-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 5-гидрокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон трифторацетат, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-5-трифторметил-4(3H)-хиназолинон, 7-фтор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-фтор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6,7-дифтор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-бром-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6,7-диметокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 8-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 8-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}бензо[g]-хиназолин-4(3H)-он, 2,6-диметил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-этил-5-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 5-фтор-2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-5-трифторметил-4(3H)-хиназолинон, 5-хлор-2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 2,5-диметил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[2,3-d]пиримидин-4(3H)-он, 2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[2,3-d]пиримидин-4(3H)-он, 6-хлор-2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо-[3,4-d]пиримидин-4(3H)-он, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он, 2-метил-3-{3-[3-(1-пирролидинил)пропокси]фенил}пиридо[4,3-d]пиримидин-4(3H)-он, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[4,3-d]пиримидин-4(3H)-он, 2-метил-3-{2-[3-(1-пиперидинил)пропокси]-5-пиримидинил}-4(3H)-хиназолинон, 2,5-диметил-3-{2-[3-(1-пиперидинил)пропокси]-5-пиримидинил}-4{3H)-хиназолинон, 2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[2,3-d]пиримидин-4(3H)-он, 6-хлор-2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он, 6-хлор-2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он, 2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3Н)-он, 2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он, 2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[4,3-d]пиримидин-4(3H)-он, 2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[4,3-d]пиримидин-4(3H)-он, 6-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он, 3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-(ацетиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-(бутириламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-(гексаноиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-(бензоиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-[(2-фенилацетил)амино]-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-(2-нафтоиламино)-2-метил-3-{4-[3-(1-илперридинил)пропокси]фенил}-4-(3Н)-хиназолинон, 2-метил-6-[(метилсульфонил)амино]-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-6-[(метилсульфонил)амино]-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-(ацетиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-(бутириламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-(гексаноиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-(бензоиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-[(2-фенилацетил)амино]-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 7-(2-нафтоиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 6-[ацетил-(метил)амино]-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-6-фенил-3-(4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-6-(4-метилфенил)-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-6-(3-метилфенил)-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-6-(2-метилфенил)-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-6-(3-пиридил)-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-6-(4-пиридил)-4(3H)-хиназолинон, 2-метил-5-фенил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-6-(2-пиридил)-4(3H)-хиназолинон, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-{1-циклогексил-4-пиперидинилокси)фенил}-2-метил-4(3H)-хиназолинон, 3-{4-(1-изопропил-4-пиперидинилокси)фенил}-2-метил-4(3H)-хиназолинон, 3-{4-(1-этил-4-пиперидинилокси)фенил}-2-метил-4(3H)-хиназолинон, 3-{4-(1-бутил-4-пиперидинилокси)фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метил-5-трифторметил-4(3H)-хиназолинон, 3-{4-(1-циклопентил-4-пиперидинилокси)фенил}-2,5-диметил-4(3H)-хиназолинон, 7-хлор-3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2,6-диметил-4(3H)-хиназолинон, 6-хлор-3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-6-метокси-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[2,3-d]пиримидин-4(3H)-он, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[4,5-d]пиримидин-4(3H)-он, 6-хлор-3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2,5-диметил-4(3H)-хиназолинон, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-5-метокси-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метил-5-трифторметил-4(3H)-хиназолинон, 5-хлор-3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[4,3-d]пиримидин-4(3H)-он, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[4,3-d]пиримидин-4(3H)-он, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[2,3-d]пиримидин-4(3H)-он, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[2,3-d]пиримидин-4(3H)-он, 6-хлор-3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, 6-хлор-3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[3,4-d]пиримидин-4(3H)-он, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[4,5-d]пиримидин-4(3H)-он, 2-фенил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, цис-2-метил-3-(4-{[4-(1-пирролидинил)циклогексил]окси}фенил)-4(3H)-хиназолинон и транс-2-метил-3-(4-{[4-(1-пирролидинил)циклогексил]окси}фенил)-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-3-пирролидинил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутил-3-пирролидинил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклопентил-4-азепанил)окси]фенил}-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутил-4-азепанил)окси]фенил}-2-метил-4(3Н)-хиназолинон, 3-метил-2-{4-[3-(1-пиперидинил)пропокси]фенил}-1(2H)-изохинолин, 2-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-3-метил-1(2H)-изохинолин, 2-метил-3-[4-{[3-(1-пирролидинил)циклопентил]окси}фенил]-4(3H)-хиназолинон, 2-этил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[2,3-d]пиримидин-4(3Н)-он, 2-метил-4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[4,3-d]пиримидин-4(3Н)-он, 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-5-фтор-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-7-фтор-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-метокси-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-фтор-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-8-фтор-2-метил-4(3H)-хиназолинон, 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-фтор-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, 6-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо-[3,4-d]пиримидин-4(3H)-он, 6-метокси-2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он, 5-метокси-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон, 7-метокси-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон, 2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[2,3-d]пиримидин-4(3H)-он, 5-фтор-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон, 2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)пиридо[4,3-d]пиримидин-4(3H)-он, 6-метокси-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон или 6-метокси-2-метил-3-(4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон. Из соединений формулы (I), относящихся к настоящему изобретению, соединение, представленное формулой (I-1): [где символы имеют указанное выше значение] можно, например, получить следующим способом. [где символы имеют указанное выше значение]. (Стадия 1) Эта стадия представляет собой способ получения соединения (3) взаимодействием производного аминокарбоновой кислоты (1) с ангидридом кислоты (2). Количество используемого ангидрида кислоты (2) обычно составляет от 1 до 10 экв., но предпочтительно от 2 до 5 экв. в расчете на 1 экв. соединения (1). Температура реакции представляет собой температуру от комнатной до 150°C, но предпочтительно от 100 до 130°C. Время реакции обычно составляет от 1 до 24 часов, но предпочтительно от 1 до 6 часов. Используемый в реакции растворитель конкретно не ограничен, при условии что он не влияет на проведение реакции, например он представляет собой диметилформамид, диметилсульфоксид, 1,4-диоксан или толуол, но из них предпочтительными являются диметилформамид и 1,4-диоксан. Альтернативно, на этой стадии соединение (3) можно получить взаимодействием производного аминокарбоновой кислоты (1) и ангидрида кислоты (2) в указанных выше реакционных условиях, без использования реакционного растворителя. Соединение (3), полученное таким образом, затем может быть использовано на следующей стадии после его выделения/очистки с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, кристаллизация, эстракция растворителем, обратное осаждение или хроматография, или без выделения и очистки. Соединение (3), полученное на этой стадии, можно получить также следующим способом. [где символы имеют указанное выше значение]. Стадия 1) представляет собой способ получения амидосоединения, представленного формулой (1-2), взаимодействием соединения (1) и хлорангидрида кислоты (2-1) в присутствии основания. [где символы имеют указанное выше значение]. Хлорангидрид кислоты (1-2), используемый на этой стадии, может, например, представлять собой фенилацетилхлорид, 1-нафтоилхлорид, 2-нафтоилхлорид, циклопропанкарбонилхлорид, циклобутанкарбонилхлорид, циклопентанкарбонилхлорид или циклогексанкарбонилхлорид. Используемое количество соединения (2-1) обычно составляет от 1 до 10 экв., но предпочтительно от 1 до 1,5 экв. в расчете на 1 экв. соединения (1). Используемое основание может, например, представлять собой триэтиламин, диизопропиламин, пиридин или т.п., но предпочтительно диизопропиламин, этиламин или пиридин. Температура реакции обычно составляет от 0 до 100°C, но предпочтительно от 0 до 80°C. Время реакции обычно составляет от 1 до 48 часов, но предпочтительно от 3 до 12 часов. Используемый в реакции растворитель конкретно не ограничен, при условии что он не препятствует осуществлению реакции, но предпочтительным является инертный растворитель. Примерами такого инертного растворителя являются пиридин, метиленхлорид, хлороформ, тетрагидрофуран, 1,4-диоксан, диэтиловый эфир и толуол, но из них предпочтительным является тетрагидрофуран или пиридин. Амидное соединение (1-2), полученное в результате реакции, используют для реакции на стадии 2) без выделения/очистки после отгонки используемого в реакции растворителя с получением остатка. Стадия 2) представляет собой способ получения соединения (3) взаимодействием остатка, содержащего амидное соединение (1-2), полученное на описанной выше стадии 1), с оксалилхлоридом. Используемое количество оксалилхлорида обычно составляет от 1 до 10 экв., но предпочтительно от 1 до 3 экв. в расчете на 1 экв. соединения (1). Время реакции обычно составляет от 1 до 48 часов, но предпочтительно от 1 до 12 часов. Температура реакции обычно составляет от 0 до 100°C, но предпочтительно от 0 до 50°C. Используемый в реакции растворитель конкретно не ограничен, при условии что он не препятствует осуществлению реакции, но предпочтительным является инертный растворитель. Примерами такого инертного растворителя являются метиленхлорид, хлороформ, тетрагидрофуран, 1,4-диоксан, диметилформамид, диметилсульфоксид и толуол, но из них предпочтительными являются метиленхлорид, хлороформ, тетрагидрофуран и толуол. На этой стадии реакцию можно осуществить добавлением каталитического количества диметилформамида к реакционной смеси. Каталитическое количество диметилформамида обычно составляет от 0,01 до 0,5 экв., но предпочтительно от 0,01 до 0,2 экв. в расчете на 1 экв. соединения (1). Соединение (3), полученное таким образом, затем может быть использовано на следующей стадии после его выделения/очистки с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, эстракция растворителем, обратное осаждение, кристаллизация или хроматография, или без выделения/очистки. (Стадия 2) Эта стадия представляет собой способ получения соединения (5) взаимодействием соединения (3) и соединения (4), которые были получены на описанной выше стадии 1. Используемое количество соединения (4) обычно составляет от 0,5 до 10 экв., но предпочтительно от 1 до 3 экв. в расчете на 1 экв. соединения (3). Температура реакции обычно составляет от 60°C до 160°C, но предпочтительно от 80°C до 130°C. Время реакции обычно составляет 2-48 часов, но предпочтительно от 5 до 10 часов. Используемый в реакции растворитель конкретно не ограничен, при условии что он не препятствует осуществлению реакции, но инертный растворитель, такой как толуол, 1,4-диоксан, диметилформамид и диметилсульфоксид, является предпочтительным. Конкретными примерами соединения (4), используемого на этой стадии, являются 4-аминофенол, 5-амино-2-нафтол, 6-амино-2-нафтол, 2-амино-5-гидроксипиримидин, 2-амино-5-гидроксипиридин, 3-амино-6-гидроксипиридин, 5-амино-3-гидрокси-1Н-1,2,4-триазол, 2-амино-4-гидрокситиазол, 3-амино-6-гидроксипиридазин, 2-амино-4-гидроксиоксазол, 2-амино-5-гидроксипиразин, 5-амино-3-гидроксиизотиазол, 2-амино-5-гидрокси-1,3,4-тиадиазол, 3-амино-5-гидрокси-1,2,4-тиадиазол, 5-амино-3-гидрокси-1,3,4-тиадиазол, 5-амино-3-гидроксиизоксазол, 2-амино-6-гидроксихинолин, 2-амино-5-гидрокси-1Н-бензимидазол, 5-амино-2-гидрокси-1Н-бензимидазол, 2-амино-5-гидрокситиазол[5,4-b]пиридин, 2-амино-5-гидроксибензотиазол, 2-амино-5-гидроксибензоксазол, 3-амино-6-гидроксибензоксазол. Соединение (5), полученное таким образом, затем может быть использовано на следующей стадии после его выделения/очистки с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, эстракция растворителем, кристаллизация, обратное осаждение или хроматография, или без выделения/очистки. (Стадия 3) Эта стадия представляет собой способ получения соединения (7) взаимодействием соединения (5), полученного на указанной выше стадии 2, с галогенированным соединением (6). Используемое основание может, например, представлять собой гидрокарбонат натрия, карбонат калия или гидрид натрия, но предпочтительно карбонат калия и карбонат натрия. Используемое количество основания обычно составляет от 1 до 10 экв., но предпочтительно от 1,5 до 5 экв. в расчете на 1 экв. соединения (5). Время реакции обычно составляет от 1 до 48 часов, но предпочтительно от 5 до 12 часов. Температура реакции обычно составляет от 0 до 150°C, но предпочтительно от 50°C до 100°C. Галогенированное соединение может, например, представлять собой 1,3-бромхлорпропан или 1,4-бромхлорбутан. Соединение (7), полученное таким образом, затем может быть использовано на следующей стадии после его выделения/очистки с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, эстракция растворителем, кристаллизация, обратное осаждение или хроматография, или без выделения/очистки. (Стадия 4) Эта стадия представляет собой способ получения соединения (I-1) по настоящему изобретению взаимодействием соединения (7), полученного на указанной выше стадии 3, с аминосоединением (8) в присутствии основания. Используемое на этой стадии основание может, например, представлять собой гидрокарбонат натрия, карбонат натрия, карбонат калия или гидрид натрия, но из них предпочтительными являются карбонат натрия и карбонат калия. Используемое количество основания обычно составляет от 1 до 10 экв., но предпочтительно от 1 до 5 экв. Используемое количество аминосоединения (8) обычно составляет от 1 до 10 экв., но предпочтительно от 2 до 5 экв. в расчете на 1 экв. соединения (7). На этой стадии для повышения реакционноспособности соединения (7) предпочтительно, чтобы в реакционной системе также одновременно присутствовал иодид калия, иодид тетра-н-бутиламмония и т.п. Используемое количество иодида калия обычно составляет от 0,1 до 10 экв., но предпочтительно от 0,1 до 3 экв. Температура реакции обычно составляет от 0 до 150°C, но предпочтительно от 50°C до 100°C. Время реакции обычно составляет от 1 до 48 часов, но предпочтительно от 1 до 12 часов. Используемый в реакции растворитель конкретно не ограничен, при условии что он не влияет на проведение реакции, но инертный растворитель, такой как диметилформамид, тетрагидрофуран, 1,4-диоксан, ацетон или метилэтилкетон, является предпочтительным. Соединение (I-1) по настоящему изобретению, полученное таким образом, может затем может быть выделено/очищено с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, эстракция растворителем, кристаллизация, обратное осаждение или хроматография. Соединение (I-1), относящееся к настоящему изобретению, можно получить также следующим способом: [где L1 представляет собой удаляемую группу, а остальные символы имеют указанное выше значение]. (Стадия 5) Эта стадия представляет собой способ получения соединения (I-1) взаимодействием соединения (5), полученного на указанной выше стадии 2, с аминосоединением (9). Используемое аминосоединение (9) содержит в молекуле удаляемую группу. Эта удаляемая группа конкретно не ограничена, при условии что она отщепляется с образованием соединения (I-1) в реакции с соединением (5). Примерами являются атомы галогенов, таких как хлор и бром, тозил и мезил, но из них предпочтительными являются бром и тозил. Используемое количество аминосоединения (9) обычно составляет от 1 до 10 экв., но предпочтительно 3 экв. в расчете на 1 экв. соединения (5). Основание, используемое на этой стадии, может, например, представлять собой гидрокарбонат натрия, карбонат натрия, карбонат калия или гидрид натрия, но из них предпочтительными являются карбонат калия и карбонат натрия. Температура реакции обычно составляет от 0 до 150°C, но предпочтительно от 25°C до 100°C. Время реакции обычно составляет от 1 до 72 часов, но предпочтительно от 3 до 12 часов. Используемый в реакции растворитель конкретно не ограничен, при условии что он не препятствует осуществлению реакции, но предпочтительным является инертный растворитель, такой как диметилформамид, тетрагидрофуран, 1,4-диоксан, ацетон или метилэтилкетон. Соединение (I-1) по настоящему изобретению, полученное таким образом, затем может быть выделено/очищено с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, эстракция растворителем, кристаллизация, обратное осаждение или хроматография. Соединение, относящееся к настоящему изобретению, можно получить также следующим способом, используя соединение (3), полученное на стадии 1. [где символы имеют указанное выше значение]. (Стадия 6) Эта стадия представляет собой способ получения соединения (I-1), относящегося к настоящему изобретению, взаимодействием соединения (3), полученного указанной выше стадии 1, с аминосоединением (10). На этой стадии используемое количество соединения (10) составляет от 1 до 10 экв., но предпочтительно от 1 до 5 экв. в расчете на 1 экв. соединения (3). Температура реакции обычно составляет от -20°C до 180°C, но предпочтительно от 0°C до 130°C. Время реакции обычно составляет от 1 до 72 часов, но предпочтительно от 3 до 12 часов. Используемый в реакции растворитель конкретно не ограничен, при условии что он не влияет на проведение реакции, например инертный растворитель, такой как диметилформамид, диметилсульфоксид, уксусная кислота, 1,4-диоксан или толуол, но из них предпочтительным является диметилформамид или уксусная кислота. Соединение (1-1) по настоящему изобретению, полученное таким образом, затем может быть использовано на следующей стадии после его выделения/очистки с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, эстракция растворителем, кристаллизация, обратное осаждение или хроматография. Соединение (10) не ограничено свободным амином, и можно также использовать кислотно-аддитивную соль. Такая кислотно-аддитивная соль может, например, представлять собой гидрохлорид, тозилат или трифторацетат. Из соединений (10) соединение, представленное формулой (10-1): [где символы имеют указанное выше значение] можно получить следующим способом. [где T представляет собой гидроксигруппу или атом фтора, а другие символы имеют указанное выше значение]. (Стадия 6-1) Эта стадия представляет собой способ взаимодействия соединения (10A) с соединением (10B) с получением соединения (10C). В формуле (10A), когда T представляет собой гидроксигруппу (это соединение будет указано как (10A-1)), соединение (10C) можно получить, используя соединение (10A-1) и соединение (10B) в реакции Мицунобу (Mitsunobu). Реакцию Мицунобу можно осуществить способом, описанным в литературе (см., например, “The Use of Diethylazodicarboxilate and Triphenylphosphine in Synthesis and Transformation of Natural Products”, Synthesis, Vol.1, 1981, pp.1-28, by O.Mitsunobu et al.), в присутствии фосфина и азосоединения, способом на основе этой методики или сочетанием таких способов с традиционно используемыми способами. Используемое количество соединения (10B) обычно составляет от 0,5 до 10 экв., но предпочтительно от 1 до 3 экв. в расчете на 1 экв. соединения (10A-1). Фосфиновое соединение, используемое на этой стадии, обычно представляет собой, например, трифенилфосфин, триэтилфосфин или т.п. Используемое количество фосфинового соединения обычно составляет от 0,5 до 10 экв., но предпочтительно от 1 до 3 экв. в расчете на 1 экв. соединения (10B). Используемое азосоединение может, например, представлять собой диэтилазодикарбоксилат или диизопропилазодикарбоксилат. Используемое количество азосоединения обычно составляет от 0-5 до 10 экв., но предпочтительно от 1 до 3 экв. в расчете на 1 экв. соединения (10B). Время реакции на этой стадии обычно составляет от 1 до 48 часов, но предпочтительно от 4 до 12 часов. Температура реакции на этой стадии обычно от комнатной температуры до температуры кипения используемого в реакции растворителя, но предпочтительно от 15°C до 30°C. Используемый на этой стадии реакции растворитель конкретно не ограничен, при условии что он не влияет на проведение реакции, но конкретными примерами являются тетрагидрофуран и толуол. В формуле (10A), когда T представляет собой атом фтора (это соединение будет указано как (10A-2)), соединение (10C) можно получить взаимодействием соединения (10A-2) с соединением (10B) в присутствии основания. Основание, используемое на этой стадии, может, например, представлять собой гидроксид натрия. Используемое количество основания обычно составляет от 1 до 10 экв., но предпочтительно от 1 до 5 экв. в расчете на 1 экв. соединения (10B). Используемое количество соединения (10B) обычно составляет от 1 до 10 экв., но предпочтительно от 2 до 5 экв. в расчете на 1 экв. соединения (10A-2). На этой стадии для повышения реакционноспособности соединения (10A-2) предпочтительно, чтобы в реакционной системе одновременно присутствовал иодид калия и иодид тетра-н-бутиламмония. Используемое количество иодида калия обычно составляет от 0,1-10 экв., но предпочтительно от 0,1 до 3 экв. Температура реакции обычно составляет от 0°C до 150°C, но предпочтительно от 50°C до 100°C. Время реакции обычно составляет от 1 до 48 часов, но предпочтительно от 1 до 12 часов. Используемый на этой стадии реакции растворитель конкретно не ограничен, при условии что он не влияет на проведение реакции, но конкретными примерами являются инертные растворители, такие как диметилформамид, тетрагидрофуран, 1,4-диоксан, ацетон и метилэтилкетон. Полученное на этой стадии соединение (10C) затем может быть выделено/очищено с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, экстракция растворителем, кристаллизация, обратное осаждение или хроматография. Соединение (10B), используемое на этой стадии, может, например, иметь формулу, представленную ниже. (Стадия 6-2) Эта стадия представляет собой способ получения соединения (10-1) каталитическим восстановлением соединения (10C), полученного на описанной выше стадии 6-1, с использованием в качестве катализатора палладия на активированном угле. Используемое количество палладия на активированном угле обычно составляет от 0,01 до 1 экв., но предпочтительно от 0,05 до 0,5 экв. в расчете на 1 экв. соединения (10C). Температура реакции обычно составляет от 0°C до 80°C. Время реакции обычно составляет от 1 до 48 часов, но предпочтительно от 1 до 12 часов. Полученное таким образом на этой стадии соединение (10-1) затем может быть выделено/очищено с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, экстракция растворителем, кристаллизация, обратное осаждение или хроматография, или его можно использовать на следующей стадии без выделения/очистки. Из соединений (10) соединение, представленное формулой (10-2): [где символы имеют указанное выше значение], можно получить следующим способом. (Стадия 6-3) На этой стадии соединение (10F) можно получить взаимодействием 4-аминофенола (10D) с соединением (10E). Реакция, которую используют на этой стадии, представляет собой указанную выше реакцию Мицунобу. Используемое количество спиртового соединения (10E) обычно составляет от 0,5 до 10 экв., но предпочтительно от 1 до 3 экв. в расчете на 1 экв. соединения (10D). Защитная группа для аминогруппы в соединении (10E) не ограничена группой Boc и может представляет собой любую защитную группу для аминогрупп, описанную в указанной выше ссылке “Protective Groups in Organic Synthesis”, by T.W.Green, Vol.2, John Wiley & Sons, 1991, которая действует как защитная группа для аминогрупп на стадии 6-3 и может быть удалена на стадии 6-4. Фосфиновое соединение, используемое на этой стадии, обычно представляет собой, например, трифенилфосфин или триэтилфосфин. Используемое количество фосфинового соединения обычно составляет от 0,5 до 10 экв., но предпочтительно от 1 до 3 экв. в расчете на 1 экв. соединения (10E). Используемое азосоединение, может, например, представлять собой диэтилазодикарбоксилат или диизопропилазодикарбоксилат. Используемое количество азосоединения обычно составляет от 0,5 до 10 экв, но предпочтительно от 1 до 3 экв. в расчете на 1 экв. соединения (10E). Соединение (10E), используемое на этой стадии может, например, представлять собой 1-Boc-4-пиперидинол. Время реакции обычно составляет от 1 до 48 часов, но предпочтительно от 4 до 24 часов. Температура реакции на этой стадии обычно от комнатной температуры до температуры кипения используемого в реакции растворителя, но предпочтительно от 15°C до 30°C. Используемый на этой стадии реакции растворитель конкретно не ограничен, при условии что он не влияет на проведение реакции, но конкретными примерами являются тетрагидрофуран и толуол. Соединение (10F), полученное таким образом, затем может быть выделено/очищено с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, эстракция растворителем, кристаллизация, обратное осаждение или хроматография, или его можно использовать на следующей стадии без выделения/очистки. (стадия 6-4) Эта стадия представляет собой способ получения соединения (10G) удалением защитной группы у аминогруппы в соединении (10F), полученном на указанной выше стадии 6-3. Защитная группа может быть удалена способом, описанным в литературе (см., например, “Protective Groups in Organic Synthesis”, by T.W.Green, Vol.2, John Wiley & Sons, 1991), способом на основе этой методики или сочетанием таких способов с традиционно используемыми. Когда защитная группа для аминогруппы представляет собой Boc-группу, она может быть удалена, например, при помощи ТФУК. Соединение (10G), полученное таким образом, затем может быть выделено/очищено с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, эстракция растворителем, кристаллизация, обратное осаждение или хроматография, или его можно использовать на следующей стадии без выделения/очистки. (стадия 6-5). Эта стадия представляет собой способ получения соединения (10I) взаимодействием соединения (10G), полученного на стадии 6-4, с соединением (10H). Реакция, используемая на этой стадии, представляет собой так называемую реакцию восстановительного аминирования. Количество соединения (10H), используемое на этой стадии, обычно составляет от 1 до 10 моль, но предпочтительно от 2 до 4 моль в расчете на 1 моль соединения (10G). Соединение (10Н), используемое на этой стадии, может, например, представлять собой циклобутанон или циклопентанон. Используемый восстановитель может представлять собой металлоорганический реагент, такой как боргидрид натрия, цианоборогидрид натрия или триацетоксиборгидрид натрия. Количество восстановителя обычно составляет от 1 моль до 5 моль, предпочтительно от 1 моль до 3 моль в расчете на соединение (10G). В реакционную систему также может быть включено каталитическое количество ZnCl2. Реакцию обычно осуществляют в инертном растворителе, таком как, например, метанол, этанол, бензол, толуол, ксилол, метиленхлорид, хлороформ, диметоксиэтан, тетрагидрофуран, диоксан, диметилформамид, или в смеси таких растворителей. Температура реакции обычно от комнатной температуры до температуры кипения используемого в реакции растворителя, но предпочтительно от 20°C до 100°C. Время реакции обычно составляет 30 минут до 7 дней, но предпочтительно от 3 часов до 2 дней. Полученное таким образом на этой стадии соединение (10I) затем может быть выделено/очищено с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, эстракция растворителем, кристаллизация, обратное осаждение или хроматография, или его можно использовать на следующей стадии без выделения/очистки. В реакции на этой стадии, когда R6 представляет собой циклопропильную группу, соединение (10I) можно получить, используя (1-метоксициклопропокси)триметилсилан вместо соединения (10H). (Стадия 6-6) Эта стадия представляет собой способ получения соединения (10-2) каталитическим восстановлением соединения (10I), используя в качестве катализатора палладий на активированном угле. Используемое количество палладия на активированном угле обычно составляет от 0,01 до 1 экв., но предпочтительно от 0,05 до 0,5 экв. в расчете на 1 экв. соединения (10I). Температура реакции обычно составляет от 0 до 80°C. Время реакции обычно составляет от 1 до 48 часов, но предпочтительно от 1 до 12 часов. Соединение (10-2), полученное таким образом, затем может быть выделено/очищено с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, эстракция растворителем, кристаллизация, обратное осаждение или хроматография, или его можно использовать на следующей стадии без выделения/очистки. Другие примеры соединения (10) представляют собой соединения или их кислотно-аддитивные соли, представленные следующими формулами. Когда соединение, относящееся к настоящему изобретению, охватываемое формулой (I), содержит группу заместителя в кольце A, такое соединение можно получить, используя исходное вещество, которое уже содержит соответствующий заместитель. Когда необходимо введение защитных групп в группу заместителя или удаление защиты, можно использовать способ, описанный в литературе, например, “Protective Groups in Organic Synthesis”, T.W. Green, 2nd Edition, John Wiley & Sons, Ltd., 1991, способ на основе этой методики или сочетанием таких способов с традиционно используемым способом. Соединение, относящееся к настоящему изобретению, можно получить также заменой функциональной группы в кольце A и введением/удалением защитной группы, если это необходимо. Защитная группа в группе заместителя может быть введена или удалена способом, описанным в “Protective Groups in Organic Synthesis”, T.W. Green, 2nd Edition, John Wiley & Sons, Ltd., 1991, способом на основе этой методики или сочетанием таких способов с традиционно используемым способом. Функциональная группа может быть заменена способом, описанным в литературе, например, “Comprehensive Organic Synthesis”, Vol.6, Pergamon Press, 1991, или “Comprehensive Organic Transformations”, Richard L et al, VCH Publishers, 1988, способом на основе этой методики или сочетанием таких способов с традиционно используемым. Когда кольцо A представляет собой бензольное кольцо, Ar представляет собой фенил, т.е. бивалентную группу, образованную удалением двух атомов водорода из бензола, и кольцо A содержит нитрогруппу, заместитель в кольце A может быть дополнительно модифицирован при помощи, например, следующих способов. [где R7 имеет такое же значение, как у R1, а другие символы имеют указанное выше значение]. (Стадия 7) На этой стадии соединение (1-4), относящееся к настоящему изобретению, которое содержит в качестве заместителя нитрогруппу, подвергают каталитическому восстановлению с использованием в качестве катализатора палладия на активированном угле, с преобразованием, таким образом, нитрогруппы в амино. Используемое на этой стадии количество палладия на активированном угле обычно составляет от 0,01 до 1 экв., но предпочтительно от 0,05 до 0,5 экв. в расчете на 1 экв. соединения (1-4). Температура реакции обычно составляет от 0 до 80°C. Время реакции обычно составляет 1 часа до 48 часов, или предпочтительно от 1 до 12 часов. Соединение (1-5), полученное таким образом, затем может быть использовано на следующей стадии после его выделения/очистки при помощи средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, эстракция растворителем, кристаллизация, обратное осаждение или хроматография, или без выделения/очистки. (Стадия 8) Эта стадия представляет собой способ получения соединения (1-6) взаимодействием соединения (1-5), полученного на стадии 7, с карбоновокислотным соединением (11). Эта реакция представляет собой реакцию амидного связывания, и это может представлять собой обычную реакцию образования амида, описанную в литературе, например “Theory and Experiment in Peptide Synthesis”, Nobuo Izumiya, Maruzen, 1983, или “Comprehensive Organic Synthesis”, Vol.6, Pergamon Press, 1991, способ на основе этой методики или сочетание таких способов с традиционно используемым. Конкретно, это может осуществить специалист в данной области, используя известный агент конденсации, или, альтернативно, это достигается активацией с использованием сложного эфира, способом с использованием смешанного ангидрида кислоты, способом с использованием хлорангидрида кислоты или способом с использованием карбодиимида, которые известны специалистам в данной области. Примерами такого амид-образующего агента являются тионилхлорид, оксазалилхлорид, N,N-дициклогексилкарбодиимид, иодид 1-метил 2-бромпиридиния, N,N’-карбонилдиимидазол, дифенилфосфорилхлорид, дифенилфосфорилазид, N,N’-дисукцинимидилкарбонат, N,N’-дисукцинимидилоксалат, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, этилхлороформиат, изобутилхлорформиат и гексафторфосфат бензотриазо-1-илокси-трис(диметиламино)фосфония, но из них предпочтительными являются тионилхлорид, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, N,N-дициклогексилкарбодиимид и гексафторфосфат бензотриазо-1-илокси-трис(диметиламино)фосфония. В реакции образования амида основание и агент конденсации можно использовать вместе с указанным выше амид-образующим агентом. Используемое основание может представлять собой третичный алифатический амин, такой как триметиламин, триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин, N-метилпирролидин, N-метилпиперидин, N,N-диметиланилин, 1,8-диазабицикло[5.4.0]ундека-7-ен (DBU) и 1,5-азабицикло[4.3.0]нона-5-ен (DBN), или ароматический амин, например пиридин, 4-диметиламинопиридин, пиколин, лутидин, хинолин или изохинолин, но из них предпочтительными являются третичные алифатические амины, и особенно предпочтительным является триэтиламин или N,N-диизопропилэтиламин. Агент конденсации, который используют, может, например, представлять собой гидрат N-гидроксибензотриазола, N-гидроксисукцинимид, N-гидрокси-5-норборнен-2,3-дикарбоксиимид или 3-гидрокси-3,4-дигидро-4-оксо-1,2,3-бензотриазол, но из них особенно предпочтительным является N-гидроксибензотриазол. Используемое количество соединения (1-5) варьируют в зависимости от типа используемого соединения и растворителя и других реакционных условий, но обычно оно составляет от 0,1 до 10 экв. и предпочтительно от 0,5 до 3 экв. в расчете на 1 экв. карбоновокислотного производного (11) или его реакционноспособного производного. Используемое количество амид-образующего агента варьируют в зависимости от типа используемого соединения и растворителя и других реакционных условий, но обычно оно составляет от 1 до 10 экв. и предпочтительно от 1 до 3 экв. в расчете на 1 экв. карбоновокислотного производного (11) или его реакционноспособного производного. Используемое количество агента конденсации варьируют в зависимости от типа используемого соединения и растворителя и других реакционных условий, но обычно оно составляет от 1 до 10 экв. и предпочтительно от 1 до 3 экв. в расчете на 1 экв. карбоновокислотного производного (11) или его реакционноспособного производного. Используемое количество основания варьируют в зависимости от типа используемого соединения и растворителя и других реакционных условий, но обычно оно составляет от 1 до 10 экв. и предпочтительно от 1 до 5 экв. Используемый на этой стадии реакции растворитель может, например, представлять собой инертный растворитель, и он конкретно не ограничен, при условии что такой растворитель не влияет на проведение реакции, при этом конкретными примерами являются метиленхлорид, хлороформ, 1,2-дихлорэтан, N,N-диметилформамид, эфир этилуксусной кислоты, метиловый эфир уксусной кислоты, ацетонитрил, бензол, ксилол, толуол, 1,4-диоксан, тетрагидрофуран, диметоксиэтан или смеси таких растворителей, но с точки зрения поддержания подходящей температуры реакции предпочтительными являются, например, метиленхлорид, хлороформ, 1,2-дихлорэтан, ацетонитрил или N,N-диметилформамид. Температура реакции на этой стадии обычно от -78°C до температуры кипения растворителя, но предпочтительно от 0 до 30°C. Время реакции на этой стадии обычно составляет от 0,5 до 96 часов, но предпочтительно от 3 до 24 часов. Основание, амид-образующий агент и агент конденсации, используемые на этой стадии, можно использовать в сочетании. Соединение (1-6) по настоящему изобретению, полученное таким образом, затем может быть выделено/очищено с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, эстракция растворителем, обратное осаждение, кристаллизация или хроматография. Когда группа заместителя в кольце A представляет собой арильную группу или гетероарильную группу, соединение (1-8) можно получить следующим способом, используя соединение (1-7) по настоящему изобретению, содержащее атом галогена в кольце A. [где X представляет собой атом галогена, X4 представляет собой арильную или гетероарильную группу, а другие символы имеют указанное выше значение]. (Стадия 9) Эта стадия представляет собой способ получения соединения (1-8) по настоящему изобретению, содержащего в качестве заместителя в кольце A арильную или гетероарильную группу, получением другого производного соединения (1-7), которое содержит в кольце A атом галогена, такого как хлор, бром или иод. Для преобразования соединения (1-7) в соединение (1-8) осуществляли реакцию сочетания Сузуки (Suzuki). Более конкретно, соединение (1-8) по настоящему изобретению, содержащее в качестве заместителя в кольце A арильную или гетероарильную группу, можно получить взаимодействием соединения (1-7), содержащего атом галогена в кольце A, с X4-B(OH)2 в присутствии основания, палладиевого катализатора и, если это необходимо, фосфинового лиганда. Эта стадия может быть осуществлена способом, описанным в “Angew. Chem., Int. Ed. Eng.”, 1999, 38(16), pp.2413-2416, by J.P.Wolfe, S.L.Buchwald et al., способом на основе этой методики или сочетанием таких способов с традиционно используемым способом. Используемое основание может, например, представлять собой карбонат натрия, карбонат калия, карбонат цезия, фторид цезия, фторид калия или фторид натрия. Используемое количество основания обычно составляет от 1 до 10 экв., но предпочтительно от 1 до 3 экв. в расчете на 1 экв. соединения (1-7). Используемый палладиевый катализатор может, например, представлять собой Pd(PPh3)4, Pd(OAc)3, Pd3(dba)3 или PdCl3(PPh3)3. Используемое количество палладиевого катализатора обычно составляет от 0,01 до 0,5 экв., но предпочтительно от 0,05 до 0,2 экв. в расчете на 1 экв. соединения (1-7). Используемый фосфиновый лиганд может, например, представлять собой PPh3, P(o-tol)3, P(tBu)3, 2-[ди(трет-бутил)фосфино]-1,1′-бифенил, 2-[ди(трет-бутил)фосфино]-2′-диметиламино-1,1′-бифенил, 2-[дициклогексилфосфино]-1,1′-бифенил или 2-[дициклогексилфосфино]-2′-диметиламино-1,1′-бифенил. Используемое борановое соединение может представлять собой коммерческое производное арилбора или производное гетероарилбора, такое как фенилборная кислота, эфир фенилборной кислоты или диалкилфенилборан, или необходимое для этого производное бора может быть получено известным способом, способом на основе такой методики или сочетанием таких способов с традиционно используемым способом. Используемое количество соединения бора обычно составляет от 1 до 10 экв., но предпочтительно от 2 до 5 экв. Количество борной кислоты X4-B(OH)2 (X имеет определенное выше значение) обычно составляет от 1 до 10 экв., но предпочтительно от 2 до 5 экв. Соединение (1-9), относящееся к настоящему изобретению, можно получить следующим способом. [где символы имеют указанное выше значение]. Реакция этой стадии известна как реакция Мицунобу и представляет собой способ, описанный в литературе, например Mitsunobu. O, “The Use of Diethylazodicarboxilate and Triphenylphosphine in synthesis and Transformation of Natural Products”, Synthesis, Vol.1, 1981, pp.1-28, способ на основе этой методики или сочетание таких способов с традиционно используемым способом, в присутствии фосфинового соединения и азосоединения. Используемое на этой стадии количество спиртового соединения (12) обычно составляет от 0,5 до 10 экв., но предпочтительно от 1 до 3 экв. в расчете на 1 экв. соединения (5). Фосфиновое соединение, используемое на этой стадии, обычно представляет собой, например, трифенилфосфин или триэтилфосфин. Используемое количество фосфинового соединения обычно составляет от 0,5 до 10 экв., но предпочтительно от 1 до 3 экв. в расчете на 1 экв. соединения (5). Используемое азосоединение, может, например, представлять собой диэтилазодикарбоксилат или диизопропилазодикарбоксилат. Используемое количество азосоединения обычно составляет от 0,5 до 10 экв., но предпочтительно от 1 до 3 экв. в расчете на 1 экв. соединения (5). Время реакции на этой стадии обычно составляет от 1 до 48 часов, но предпочтительно от 4 до 12 часов. Температура реакции на этой стадии обычно в пределах комнатной температуры до температуры кипения используемого в реакции растворителя, но предпочтительно от 15°C до 30°C. Используемый на этой стадии реакции растворитель конкретно не ограничен, при условии что он не влияет на проведение реакции, но конкретными примерами являются тетрагидрофуран или толуол. Соединение (1-9), полученное таким образом, затем может быть выделено/очищено с использованием средств, известных из уровня техники, например, таких как концентрирование, концентрование при пониженном давлении, эстракция растворителем, кристаллизация, обратное осаждение или хроматография. Соединение, относящееся к настоящему изобретению, представленное формулой (I), может быть легко выделено/очищено обычными средствами выделения/очистки. Такие средства могут, например, включать экстракцию растворителем, перекристаллизацию, обратное осаждение, колоночную хроматографию или фракционную тонкослойную хроматографию. Эти соединения могут быть преобразованы в соли или сложные эфиры, которые являются фармацевтически приемлемыми, традиционными способами, или наоборот, свободные соединения могут быть получены из солей или сложных эфиров традиционными способами. Конденсированное 4-оксопиримидиновое производное по настоящему изобретению может существовать в виде фармацевтически приемлемой соли, и такую соль можно получить в соответствии с традиционными способами, используя соединение, представленное указанной выше формулой (I). Примерами такой кислотно-аддитивной соли являются соли галогеновых кислот, такие как гидрохлорид, гидрофторид, гидробромид и гидроиодид; соли неорганических кислот, такие как нитрат, перхлорат, сульфат, фосфат и карбонат; соли низших алкилсульфоновых кислот, такие как соль метансульфоновой кислоты, соль трифторметансульфоновой кислоты и соль этансульфоновой кислоты; арилсульфонаты, такие как соль бензолсульфоновой кислоты и соль п-толуолсульфоновой кислоты; соли органических кислот, такие как фумарат, сукцинат, цитрат, тартрат, оксалат и малеат; и соли аминокислот, такие как глутамат и аспартат. Примеры основно-аддитивной соли представляют собой соли щелочных металлов, такие как соли натрия и калия, соли щелочноземельных металлов, такие как соли кальция и магния, соли аммония и соли органических оснований, такие как гуанидин, триэтиламин и дициклогексиламин. Соединение по настоящему изобретению может, кроме того, существовать в виде свободного соединения, в форме гидрата соли или сольвата. Соединение, представленное формулой (I), можно вводить перорально или можно использовать непероральный путь введения. При клиническом использовании соединения по настоящему изобретению его можно также объединять с другими фармацевтически приемлемыми добавками в различных фармацевтических препаратах в зависимости от способа введения. Такие добавки могут представлять собой добавки, обычно используемые в фармацевтических препаратах, такие как желатин, лактоза, белый мягкий сахар, оксид титана, крахмал, кристаллическая целлюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, кукурузный крахмал, микрокристаллический воск, белый вазелин, алюмометасиликат магния, безводный фосфат кальция, лимонная кислота, трицитрат натрия, гидроксипропилцеллюлоза, сорбит, сложные эфиры жирных кислот сорбитана, полисорбат, сложные эфиры жирных кислот сахарозы, полиоксиэтилен, гидрированное касторовое масло, поливинилпирролидон, стеарат магния, светлая безводная кремневая кислота, тальк, растительное масло, бензиловый спирт, аравийская камедь, пропиленгликоль, полиалкиленгликоль, циклодекстрин или гидроксипропилциклодекстрин. Форма для введения такого фармацевтического препарата в виде смеси с вышеуказанными добавками может представлять собой твердый препарат, такой как таблетки, капсулы, гранулы, порошки или суппозитории, или жидкий препарат, такой как сиропы, эликсиры или инъекции, и их можно получить в соответствии со способами, обычно используемыми для получения фармацевтических композиций. В случае жидкого препарата его можно растворять или суспендировать в воде или другой подходящей среде. В частности, в случае инъекции композицию можно растворить или суспендировать в физиологическом солевом растворе или виноградном сахаре и, если это необходимо, можно добавить буферы и консерванты. Такие фармацевтические препараты могут содержать соединение по настоящему изобретению в количестве от 1,0 до 100 мас.%, но предпочтительно от 1,0 до 60 мас.% в расчете на общее количество препарата. Фармацевтические препараты, содержащие соединение по настоящему изобретению, можно получить, например, в соответствии со следующими фармацевтическими примерами. (Фармацевтический пример 1) 10 частей соединения примера 1, 15 частей тяжелого оксида магния и 75 частей лактозы однородно смешивали с получением порошка или композиции в виде мелких частиц с размером 350 мкм или меньше. Этот порошок вводили в контейнер в виде капсулы с получением капсулы. (Фармацевтический пример 2) 45 частей соединения примера 1, 15 частей крахмала, 16 частей лактозы, 21 часть кристаллической целлюлозы, 3 части поливинилового спирта и 30 частей дистиллированной воды однородно смешивали, измельчали, сушили и сортировали с получением гранул, имеющих диаметр от 1410 до 177 мкм. (Фармацевтический пример 3) После получения гранул таким же способом, как описано в фармацевтическом примере 2, 3 части стеарата кальция добавляли к 96 частям этих гранул и прессовали в таблетки, имеющие диаметр 10 мм. (Фармацевтический пример 4) 10 частей кристаллической целлюлозы и 3 части стеарата кальция добавляли к 90 частям гранул, полученных в фармацевтическом примере 2, прессовали в таблетки, имеющие диаметр 8 мм, и добавляли смешанную суспензию, включающую замоченный желатин/осажденный карбонат кальция, с получением таблеток, имеющих сахарное покрытие. Такие фармацевтические препараты могут также содержать другие терапевтически полезные соединения. Соединение по настоящему изобретению можно использовать в сочетании с другими средствами, полезными для лечения нарушений обмена веществ и/или нарушений питания. Такие ингредиенты в таких сочетаниях можно вводить в разное время или одновременно в процессе лечения или можно вводить в виде разных лекарственных препаратов или в виде одного фармацевтического препарата. Поэтому должно быть понятно, что настоящее изобретение включает одновременное введение или введение в разное время, и термин “введение” в контексте настоящего изобретения следует понимать именно таким образом. Диапазон комбинаций соединения по настоящему изобретению с другими средствами, полезными при нарушениях обмена веществ и/или нарушениях питания, в принципе, охватывает комбинации со всеми фармацевтическими препаратами, полезными для лечения нарушений обмена веществ и/или нарушений питания. Соединение по настоящему изобретению можно использовать в сочетании с другими лекарственными средствами, эффективными для лечения, профилактики или контроля таких расстройств, как гипертензия, гипертензия, связанная с ожирением, расстройства, связанные с гипертензией, гипертрофия сердца, гипертрофия левого желудочка и метаболический синдром, ожирение и связанные с ожирением расстройства. Для профилактики или лечения этих расстройств другие лекарственные средства (сопутствующие лекарственные средства) можно вводить одновременно, отдельно или последовательно. При одновременном использовании с одним, двумя или более другими лекарственными средствами введение можно осуществлять в виде одной дозы. Однако в комбинационной терапии композицию, содержащую соединение по настоящему изобретению и сопутствующие лекарственные средства, можно вводить одновременно, отдельно или последовательно в виде разных упаковок. Также можно осуществлять введение с интервалами во времени. Размер дозы сопутствующих лекарственных средств может быть определен на основании дозы, используемой в клинической практике, и его можно подходящим образом выбрать в зависимости от конкретного пациента, пути введения заболевания или используемой комбинации. Способ введения сопутствующего лекарственного средства конкретно не ограничен, и достаточно объединить каким-либо образом соединение по настоящему изобретению и сопутствующее лекарственное средство. Примеры способа введения включают: 1) введение единого фармацевтического препарата, полученного одновременным смешиванием соединения по настоящему изобретению с другим лекарственным средством; 2) одновременное введение двух типов фармацевтических препаратов, изготовленных отдельным получением соединения по настоящему изобретению и другого лекарственного средства, тем же введением; 3) введение двух типов фармацевтических препаратов, изготовленных отдельным получением соединения по настоящему изобретению и другого лекарственного средства, тем же введением с интервалом во времени; 4) одновременное введение двух типов фармацевтических препаратов, изготовленных отдельным получением соединения по настоящему изобретению и другого лекарственного средства, разными путями введения, и 5) введение двух типов фармацевтических препаратов, изготовленных отдельным получением соединения по настоящему изобретению и другого лекарственного средства, разными путями введения с интервалом во времени (например, введение соединения по настоящему изобретению с последующим введением другого лекарственного средства или в обратном порядке). Соотношение для смешивания соединения по настоящему изобретению и другого лекарственного средства можно подходящим образом выбрать в зависимости от вводимых лекарственных средств, пути ведения и заболевания. Примеры сопутствующих лекарственных средств, используемых в настоящем изобретении, включают антидиабетические средства, средства, снижающие уровень липидов, антигипертензивные средства и средства против ожирения. Два или более из этих сопутствующих лекарственных средств можно сочетать в подходящей пропорции. Примеры антидиабетических средств включают: 1) агонисты PPARг, такие как глитазоны (например, циглитазон; дарглитазон; энглитазон; изаглитазон (MCC-555); пиоглитазон; розиглитазон; троглитазон; BRL49653; CLX-0921; 5-BTZD и т.п.) и G1 0207, LG-100641, LY-300512 и т.п.; 2) бигуаниды, такие как буформин; метформин; и фенформин и т.п.; 3) ингибиторы протеинтирозинфосфатазы-1В; 4) соединения сульфонилмочевины, такие как ацетогексамид; хлорпропамид; диабинез; глибенкламид; глипизид; глибурид; глимепирид; гликлазид; глипентид; гликвидон; глисоламид; толазамид; и толбутамид и т.п.; 5) меглитиниды, такие как репаглинид и натеглинид и т.п.; 6) ингибиторы альфа-глюкозидгидролазы, такие как акарбоза; адипозин; камиглибоза; эмиглитат; миглитол; воглибоза; прадимицин-Q; салбостатин; CKD-711; MDL-25,637; MDL-73,945; и MOR 14 и т.п.; 7) ингибиторы альфа-амилазы, такие как тендамистат, трестатин и Al-3688 и т.п.; 8) средства, усиливающие секрецию инсулина, такие как линоглирид; и A-4166 и т.п.; 9) ингибиторы жирно-кислотного окисления, такие как кломоксир и этомоксир и т.п.; 10) антагонисты A2, такие как мидаглизон; изаглидол; дериглидол; идазоксан; эароксан и флупароксан и т.п.; 11) инсулин или инсулиномиметики, такие как биота, LP-100, новарапид, инсулин детемир, инсулин лизпро, инсулин гларгин, инсулин-цинковая суспензия; Lys-Pro инсулин, GLP-1 (73-7) и GLP-1 (7-36)-NH2) и т.п.; 12) нетиазолидиндионовые средства, такие как JT-501 и фарглитазар и т.п.; 13) двойные агонисты PPAR 14) другие лекарственные средства – сенсибилизаторы инсулина; и 15) агонисты VPAC2 рецептора. Примеры средств, снижающих уровень липидов, включают: 1) средства, усиливающие экскрецию желчных кислот, такие как холестирамин, колечевелем, колестипол, диалкиламиноалкилпроизводные поперечно-сшитого декстрана; Colestid®; LoCholest®; и Questran® и т.п.; 2) ингибиторы HMG-CoA редуктазы, такие как аторвастатин, итавастатин, флувастатин, ловастатин, правастатин, ривастатин, розувастатин, симвастатин и ZD-4522 и т.п.; 3) ингибиторы HMG-CoA синтазы; 4) ингибиторы абсорбции холестерина, такие как сложные эфиры станола, бета-ситостерин, стерингликозиды, эзетимид и т.п.; 5) ингибиторы кислого кофермента A – холестеринацилтрансферазы (ACAT), такие как авасимид, эфлуцимиб, KY505, SMP 709 и т.п.; 6) ингибиторы CETP, такие как JTT 705, торсетрапиб, CP 532,632, BAY63-2149, SC 591, SC 795 и т.п.; 7) ингибиторы скваленсинтетазы; 8) антиоксиданты, такие как пробукол и т.п.; 9) агонисты PPAR 10) модуляторы FXR рецептора, такие как GW 4064, SR 103912 и т.п.; 11) LXR рецептор, такие как GW 3965, T9013137 и XTCO179628 и т.п.; 12) ингибиторы синтеза липопротеинов, такие как ниацин; 13) ингибиторы системы ренин-ангиотензин; 14) частичные агонисты PPARд; 15) ингибиторы обратного поглощения желчных кислот, такие как BARI 1453, SC435, PHA384640, S-435, AZD7706 и т.п.; 16) агонисты PPARд, такие как GW 501516, GW 590735 и т.п.; 17) ингибиторы синтеза триглицеридов; 18) ингибиторы транспорта триглицеридов в микросомах, такие как инплитапид, LAB687, CP346086 и т.п.; 19) модуляторы транскрипции; 20) ингибиторы скваленэпоксидазы; 21) активаторы рецепторов липопротеина низкой плотности (LDL); 22) ингибиторы агрегации тромбоцитов; 23) ингибиторы 5-LO или FLAP; и 24) агонисты рецепторов ниацина. Примеры антигипертензивных средств включают: 1) диуретики, такие как тиазиды, включая хлорталидон, хлортиазид, дихлорфенамид, гидрофлуметиазид, индапамид и гидрохлортиазид; петлевые диуретики, такие как буметанид, этакриновая кислота, фуросемид и торсемид; натрий-сберегающие средства, такие как амилорид и триамтерен; и антагонисты альдостерона, такие как спиронолактон, эпиренон и т.п.; 2) бета-адренергические блокаторы, такие как ацебутолол, атенолол, бетаксолол, бевантолол, бисопролол, бопиндолол, картеолол, карведилол, целипролол, эсмолол, инденолол, метапролол, надолол, небиволол, пенбутолол, пиндолол, пропанолол, соталол, тертатолол, тилизолол, тимолол и т.п.; 3) блокаторы кальциевых каналов, такие как амлодипин, аранидипин, азелнидипин, барнидипин, бенидипин, бепридил, циналдипин, клевидипин, дилтиазем, эфонидипин, фелодипин, галлопамил, израдипин, лацидипин, лемилдипин, лерканидипин, никардипин, нифдипин, нилвадипин, нимодепин, нисолдипин, нитрендипин, манидипин, пранидипин, верапамил и т.п.; 4) ингибиторы ангиотензин-превращающего фермента (ACE), такие как беназеприл; каптоприл; цилазаприл; делаприл; эналаприл; фосиноприл; имидаприл; лосиноприл; моэксиприл; хинаприл; хинаприлат; рамиприл; периндоприл; периндроприл; кваниприл; спираприл; тенокаприл; трандолаприл, зофеноприл и т.п.; 5) ингибиторы нейтральной эндопептидазы, такие как омапатрилат, кадоксатрил и экадотрил, фосидотрил, сампатрилат, AVE7688, ER4030 и т.п.; 6) антагонисты эндотелина, такие как тезосентан, A308165, YM62899 и т.п.; 7) вазодилататоры, такие как гидралазин, клонидин, миноксидил, никотиниловый спирт и т.п.; 8) антагонисты рецептора ангтиотензина II, такие как кандесартан, эпросартан, ирбесартан, лосартан, пратосартан, тасосартан, телмисартан, валсартан, и EXP-3137, FI6828K, RNH6270 и т.п.; 9) 10) блокаторы альфа 1, такие как теразосин, урапидил, празосин, буназосин, тримазосин, доксазосин, нафтопидил, индорамин, WHIP 164, XEN010 и т.п.; 11) агонисты альфа 2, такие как лофексидин, тиаменидин, моксонидин, рилменидин, гуанобенз и т.п.; и 12) ингибиторы альдостерона и т.п. Примеры средств против ожирения включают: 1) ингибиторы транспортера 5НТ (серотонина), такие как пароксетин, флуоксетин, фенфлурамин, флувоксамин, сертралин и имипрамин; 2) ингибиторы транспортера NE (норэпинефрина), такие как GW 320659, деспирамин, талсупрам и номифензин; 3) антагонисты/обратные агонисты CB-1 (каннабиноидного-1 рецептора), такие как римонабант (Sanofi Synthelabo), SR-147778 (Sanofi Synthelabo), BAY 65-2520 (Bayer) и SLV 319 (Solvay), и средства, раскрытые в патенте США 4) антагонисты грелина, такие как раскрытые в WO 01/87335, и WO 02/08250; 5) антагонисты/обратные агонисты H3 (гистамина H3), такие как тиоперамид, 3-(1Н-имидазол-4-ил)пропил N-(4-пентенил)карбамат, клобенпропит, иодофенпропит, имопроксифан, GT2395 и A331440, и средства, раскрытые в WO 02/15905; и O-[3-(1Н-имидазол-4-ил)пропано)]карбаматы, пиперидин-содержащие антагонисты гистаминового H3-рецептора (Lazewska, D. et al., Pharmazie, 56:927-32 (2001), производные бензофенона (Sasse, A. et al., Arch. Pharm. (Weinheim) 334:45-52 (2001)), замещенные N-фенилкарбаматы (Reidemeister, S. et al., Pharmazie, 55:83-6 (2000)), и производные проксифана (Sasse, A. et al., J. Med. Chem., 43:3335-43 (2000)); 6) антагонисты рецептора меланин-концентрирующего гормона 1 (MCH1R), такие как Т-226296 (Takeda), SNP-7941 (Synaptic) и средства, раскрытые в WO 01/82925, WO 01/87834, WO 02/051809, WO 02/06245, WO 02/076929, WO 02/076947, WO 02/04433, WO 02/51809, WO 02/083134, WO 02/094799 и WO 03/004027 и Японской Патентной Заявке 7) агонисты/антагонисты MCH2R (меланин-концентрирующего гормона 2R); 8) антагонисты NPY1 (нейропептида Y Yl), такие как BIBP3226, J-115814, BIBO 3304, LY-357897, CP-671906 и GI-264879; и средства, раскрытые в патенте США 9) антагонисты NPY5 (нейропептида YY5), такие как 152,804, GW-569180A, GW-594884A, GW-587081X, GW-548118X; FR235,208; FR226928, FR240662, FR252384; 1229U91, GI-264879A, CGP71683A, LY-377897, LY-366377, PD-160170, SR-120562A, SR-120819A, JCF-104 и H409/2 и средства, раскрытые в патенте США 10) лептин, такой как рекомбинантный лептин человека (PEG-OB, Hoffman La Roche) и рекомбинантный метионил-лептин человека (Amgen); 11) производные лептина, такие как описанные в патенте США 12) антагонисты опиоидов, такие как налмефен (Revex ®), 3-метоксиналтрексон, налоксон и налтрексон; и средства, раскрытые в WO 00/21509; 13) антагонисты орексина, такие как SB-334867-A; и средства, раскрытые в WO 01/96302, WO 01/68609, WO 02/51232, WO 02/51838 и WO 03/023561; 14) агонисты BRS3 (рецептора бомбезина подтипа 3); 15) агонисты CCK-A (холецистокинина-A), такие как AR-R 15849, GI 181771, JMV-180, A-71378, A-71623 и SR146131, и средства, раскрытые в патенте США 16) CNTF (цилиарные нейротрофические факторы), такие как GI-181771 (Glaxo-SmithKline); SR146131 (Sanofi Synthelabo); бутабиндид; и PD170,292, PD149164 (Pfizer); 17) производные CNTF, такие как аксокин (Regeneron); и средства, раскрытые в WO 94/09134, WO 98/22128 и WO 99/43813; 18) агонисты GHS (рецептора стимулятора секреции гормона роста), такие как NN703, гексарелин, MK-0677, SM-130686, CP-424,391, 1-692,429 и 1-163,255, и средства, раскрытые в патенте США 19) агонисты 5HT2c (серотонинового рецептора 2c), такие как BVT933, DPCA37215, IK264; PNU22394; WAY161503, R-1065 и YM348; и средства, раскрытые в патенте США 20) агонисты Mc3r (рецептора меланокортина 3); 21) агонисты Mc4r (рецептора меланокортина 4), такие как CHIR86036 (Chiron); ME-10142 и ME-10145 (Melacure), и средства, раскрытые в WO 99/64002, WO 00/74679, WO 01/991752, WO 01/74844, WO 01/70708, WO 01/70337, WO 01/91752, WO 02/059095, WO 02/059107, WO 02/059108, WO 02/059117, WO 02/12166, WO 02/11715, WO 02/12178, WO 02/15909, WO 02/068387, WO 02/068388, WO 02/067869, WO 03/007949 и WO 03/009847; 22) ингибиторы повторного поглощения моноамина, такие как сибутратмин (Mendia®/Reductil®) и его соль, и средства, раскрытые в патенте США 23) ингибиторы повторного поглощения серотонина, такие как дексфенфлурамин, флуоксетин и средства, раскрытые в патенте США 24) агонисты GLP-1 (глюкагон-подобного пептида 1) ; 25) Топирамат (Topimax®); 26) фитофармсоединение 57 (CP 644,673); 27) ингибиторы ACC2 (ацетил-CoA карбоксилазы-2); 28) агонисты 29) ингибиторы DGAT1 (диацилглицеринацилтрансферазы 1); 30) ингибиторы DGAT2 (диацилглицеринацилтрансферазы 2); 31) ингибиторы FAS (синтазы жирных кислот), такие как Cerulenin и C75; 32) ингибиторы PDE (фосфодиэстеразы), такие как теофиллин, пентоксифиллин, запринаст, силденафил, амринон, милринон, циклостамид, ролипрам и циломиласт; 33) агонисты тиреоидного гормона 34) активаторы UCP-1 (несвязывающегося белка 1), 2 или 3, такие как фитановая кислота, 4-[(E)-2-(5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-нафталинил)-1-пропенил]бензойная кислота (TTNPB) и ретиноевая кислота; и средства, раскрытые в WO 99/00123; 35) ацил-эстрогены, такие как олеоил-эстрон, раскрытые в Mar-Grasa, M. et al., Obesity Research, 9:202-9(2001); 36) антагонисты глюклокортикоидов; 37) ингибиторы 11 38) ингибиторы SCD-1 (стеароил-CoA десатуразы-1); 39) ингибиторы дипептидилпептидазы IV (DP-IV), такие как изолейцинтиазолидид, валинпирролидид, NVP-25 DPP728, AF237, P93/01, TSL 225, TMC-2A/2B/2C, FE 999011, P9310/K364, VIP 0177, SDZ 274-444; и соединения, раскрытые в WO 03/004498, WO 03/004496, EP 1258476, WO 02/083128, WO 02/062764, WO 03/000250, WO 03/002530, WO 03/002531, WO 03/002553, WO 03/002593, WO 03/000180 и WO 03/000181; 40) ингибиторы липазы, такие как тетрагидролипстатин (орлистат/Xenical®), Triton WR1339, RHC80267, липстатин, теасапонин и диэтилумбеллиферил фосфат, FL-386, WAY-121898, Bay-н-3176, валилактон, эстерацин, эбелактон A, эбелактон B, RHC 80267 и средства, раскрытые в WO 01/77094 и в патенте США 41) ингибиторы транспортера жирных кислот; 42) ингибиторы транспортера дикарбоксилата; 43) ингибиторы транспортера глюкозы; 44) ингибиторы транспортера фосфата; 45) агонисты меланокортина, такие как Melanotan II или средства, раскрытые в WO 99/64002 и WO 00/746799; 46) антагонисты меланин-концентририрующего гормона; 47) антагонисты галанина; 48) агонисты CCK; 49) кортикотропин-высвобождающий гормон; и 50) агонисты фосфодиэстеразы-3B (PDE3B); и т.п. Указанные выше комбинации включают комбинации композиции по настоящему изобретению не только с одним из других активных соединений, но также с двумя или более другими активными соединениями. Неограничивающие примеры включают комбинации композиций по настоящему изобретению с одним, двумя или более активными соединениями (сопутствующими лекарственными средствами), выбранными из средств, снижающих уровень липидов, и антигипертензивных средств. Комбинации композиций по настоящему изобретению с одним, двумя или более активными соединениями (сопутствующими лекарственными средствами), выбранными из средств, снижающих уровень липидов, и антидиабетических средств, полезны для лечения, контроля или профилактики метаболического синдрома. В частности, композиции, включающие средство против ожирения, антигипертензивное средство, в дополнение к антидиабетическому средству и/или средству, снижающему уровень липидов, полезны для синергического лечения, контроля или профилактики метаболического синдрома. При клиническом применении соединений по настоящему изобретению доза и частота введения зависят от пола, возраста, веса и состояния пациента и от типа и продолжительности эффекта, который желательно получить. Однако при пероральном введении взрослому пациенту доза составляет 0,01-100 мг/кг, но предпочтительно 0,3-1 мг/кг в день для введения в виде одной или нескольких доз, и при непероральном введении взрослому пациенту доза составляет 0,001-10 мг/кг, но предпочтительно 0,001-0,1 мг/кг в день для введения в виде одной или нескольких доз. Лечащий врач, ветеринар или клиницист сможет легко определить эффективное фармакологическое количество лекарственного средства для профилактики, подавления или остановки процесса заболевания. ПРИМЕРЫ Настоящее изобретение далее будет описано при помощи примеров, но должно быть понятно, что настоящее изобретение не ограничивается каким-либо образом приведенными ниже примерами. Для тонкослойной хроматографии, которую используют в примерах, для пластин использовали силикагель 60F245 (Merck), а в качестве средства детекции использовали УФ-детектор. Wakogel При анализе ЯМР-спектра в растворе тяжелого диметилсульфоксида измерения осуществляли с использованием спектрометра Gemini-200 (200 МГц, Varian), Gemini-300 (300 МГц, Varian), Mercury 400 (400 МГц, Varian) или Inova 400 (400 МГц, Varian), используя диметилсульфоксид в качестве внутреннего стандарта, и все значения выражали в виде миллионных долей (м.д.). В представленных ниже примерах аббревиатуры имеют следующие значения: i-Bu: изобутильная группа n-Bu: н-бутил t-Bu: трет-бутил Me: метильная группа Et: этильная группа Ph: фенильная группа i-Pr: изопропильная группа n-Pr: n-пропильная группа CDCl3: тяжелый хлороформ CD3OD: тяжелый метанол DMSO-d6: тяжелый диметилсульфоксид. Аббревиатуры, используемые для обозначения спектров ядерного магнитного резонанса, имеют следующие значения: s: синглет d: дублет dd: двойной дублет t: триплет m: мультиплет br: уширенный q: квартет J: константа взаимодействия Hz: герц Пример 1 2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон (1) Получение 2-этил-4H-3,1-бензоксазин-4-она Антраниловую кислоту (10 г, 72,9 ммоль) и пропионовый ангидрид (20,9 г, 160 ммоль) смешивали и перемешивали при 130°C в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении, остаток растворяли в метиленхлориде, органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия, а затем дистиллированной водой и сушили безводным сульфатом натрия. Целевое соединение (12,5 г, 98%) получали в виде бесцветного твердого вещества, после того как сульфат натрия отфильтровывали и продукт концентрировали досуха. (2) Получение 2-этил-3-(4-гидроксифенил)-4-(3H)-хиназолинона 2-этил-4H-3,1-бензоксазин-4-он (6,5 г, 37,1 ммоль) и 4-аминофенол (4,05 г, 37,1 ммоль) растворяли в диметилформамиде (18 мл) и перемешивали при 140°C в течение 10 часов. Смесь охлаждали до комнатной температуры, добавляли дистиллированную воду (94 мл) и твердый осадок отфильтровывали. Продукт перекристаллизовывали (этанол) и целевое соединение (6,52 г, 66%) получали в виде кристаллов светло-коричневого цвета. (3) Получение 2-этил-3-[4-(3-хлорпропокси)фенил]-4(3H)-хиназолинона 2-этил-3-(4-гидроксифенил)-4(3H)-хиназолинон (17,9 г, 67,5 ммоль), 1,3-бромхлорпропан (12,1 г, 70,3 ммоль) и карбонат калия (19,7 г, 143 ммоль) смешивали в диметилформамиде (180 мл) и перемешивали при 80°C в течение 2 часов. После выпаривания растворителя при пониженном давлении добавляли этилацетат и дистиллированную воду. После экстрагирования этилацетатом органическую фазу промывали дистиллированной водой и сушили безводным сульфатом натрия. Сульфат натрия отфильтровывали, фильтрат упаривали при пониженном давлении и полученное твердое вещество промывали этанолом с получением целевого соединения (19,1 г, 82%) в виде твердого вещества светло-коричневого цвета. (4) Получение 2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона 2-этил-3-[4-(3-хлорпропокси)фенил]-4(3H)-хиназолинон (19 г, 55,6 ммоль), пиперидин (23,7 г, 278 ммоль), карбонат калия (11,5 г, 83,4 ммоль) и иодид калия (13,8 г, 83,4 ммоль) смешивали в диметилформамиде (400 мл) и перемешивали при 80°C в течение 24 часов. Растворитель выпаривали при пониженном давлении, остаток растворяли в этилацетате и органическую фазу промывали дистиллированной водой и сушили безводным сульфатом натрия. После очистки колоночной хроматографией на силикагеле (хлороформ/метанол=30/1) указанное в заголовке соединение (10,1 г, 47%) получали в виде бесцветных кристаллов перекристаллизацией из диэтилового эфира/гептана. 1H ЯМР (400 МГц, CDCl3, Соединения примеров 2-16 можно получить таким же способом, как указано в примере 1, способом на основе этой методики или их сочетанием с традиционным способом, используя соответствующую антраниловую кислоту, ангидрид кислоты, аминофенол, 1,3-бромхлоралкан и амин в качестве исходных веществ. Пример 2 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и пиперидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 3 2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и пирролидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 4 3-{4-[3-(диэтиламино)пропокси]фенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и диэтиламин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 5 2-метил-3-{4-[3-(2-метил-1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон (рацемическая смесь) Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и 2-метилпирролидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 6 3-{4-[3-(2,5-диметил-1-пирролидинил)пропокси]фенил}-2-метил-4(3H)-хиназолинон (смесь цис- и транс-изомеров) Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и 2,5-диметилпирролидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 7 2-метил-3-{4-[4-(1-пиперидинил)бутокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 1,4-бромхлорбутан и пиперидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 8 3-{4-[3-(1-азепанил)пропокси]фенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и азепан в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 9 3-{4-[3-(1-азоканил)пропокси]фенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и азокан в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 10 2-метил-3-{4-[3-(2-метил-1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон (рацемическая смесь) Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и 2-метилпиперидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 11 2-метил-3-{4-[3-(4-метил-1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и 4-метилпиперидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 12 3-(4-{3-[([2R,6S)-2,6-диметил-1-пиперидинил]пропокси}фенил)-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и (2R,6S)-2,6-диметилпиперидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 13 2-метил-3-{4-[3-(3-метил-1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон (рацемическая смесь) Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и 3-метилпиперидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 14 3-{4-[3-(3,5-диметил-1-пиперидинил)пропокси]фенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и 3,5-диметилпиперидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 15 2-метил-3-{3-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 3-аминофенол, 1,3-бромхлорпропан и пиперидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 16 3-{3-бром-4-[3-(1-пиперидинил)пропокси]фенил}-2-этил-4(3H)-хиназолинон (1) Получение 2-бром-1-(3-хлорпропокси)-4-нитробензола 4-амино-2-бромфенол (2,0 г, 9,17 ммоль), 1,3-бромхлорпропан (907 мкл, 9,17 ммоль) и карбонат калия (1,90 г, 13,8 ммоль) смешивали в диметилформамиде (8 мл) и перемешивали при 80°C в течение 17 часов. Добавляли этилацетат, смесь промывали 1н. водным раствором гидроксида натрия и дистиллированной водой в указанном порядке и органическую фазу сушили безводным сульфатом натрия. Продукт очищали колоночной хроматографией на силикагеле (гексан/этилацетат=9/l-7/3) и получали, таким образом, целевое вещество (1,3 г, 48%). 4-амино-2-бромфенол получали способом, описанным в литературе (J. Org. Chem., Vol.62, 1997, p.4504). (2) Получение 3-бром-4-(3-хлорпропокси)анилина 2-бром-1-(3-хлорпропокси)-4-нитробензол (1,3 г), хлорид аммония (1,3 г) и железо (1,3 г) добавляли к смеси растворителей метанола (8 мл) и дистиллированной воды (4 мл) и смесь кипятили с обратным холодильником в течение 2 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали. Остаток растворяли в этилацетате, промывали дистиллированной водой и насыщенным солевым раствором. Органическую фазу сушили безводным сульфатом натрия, концентрировали и сушили с получением целевого вещества (0,92 г). (3) Получение 3-[3-бром-4-(3-хлорпропокси)фенил]-2-этил-4(3H)-хиназолинона 3-бром-4-(3-хлорпропокси)анилин (0,2 г, 4,92 ммоль) и 2-этил-4H-3,1-бензоксадин-4-он (0,87 г, 4,92 ммоль) растворяли в диметилформамиде (3 мл) и перемешивали при 140°C в течение 5 часов. Добавляли этилацетат и дистиллированную воду, смесь экстрагировали этилацетатом и сушили безводным сульфатом натрия. К остатку добавляли метанол и нерастворимые вещества отфильтровывали. Фильтрат концентрировали, продукт очищали колоночной хроматографией на силикагеле (гексан/этилацетат=80/20-75/25) и получали, таким образом, целевое вещество (4l6 мг, 20%). (4) Получение 3-{3-бром-4-[3-(1-пиперидинил)пропокси]фенил}-2-этил-4(3H)-хиназолинона 3-[3-бром-4-(3-хлорпропокси)фенил]-2-этил-4(3H)-хиназолинон (70 мг) растворяли в пиперидине (1 мл) и перемешивали при 80°C в течение 5 часов. Реакционный раствор разбавляли диэтиловым эфиром и нерастворимые вещества отфильтровывали. Фильтрат концентрировали, сушили в вакууме и получали, таким образом, указанное в заголовке соединение (80 мг, 99%) в виде твердого вещества светло-желтого цвета. 1H ЯМР (400 МГц, CDCl3, Пример 17 2-метил-3-{4-[2-(1-пиперидинил)этокси]фенил}-4(3H)-хиназолинон 2-метил-3-(4-гидроксифенил)-4-(3H)хиназолинон (100 мг, 0,40 ммоль), 2-(1-пиперидинил)этанол (89 мг, 0,50 ммоль) и трифенилфосфин (125 мг, 0,50 ммоль) растворяли в безводном тетрагидрофуране (2 мл) и охлаждали на ледяной бане. Диэтилазодикарбоксилат (75 мкл, 0,50 ммоль) добавляли по каплям при 0°C и перемешивали при комнатной температуре в течение 48 часов. Растворитель отгоняли при пониженном давлении, добавляли простой эфир, твердый осадок отфильтровывали и фильтрат концентрировали. Остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол=30/1) и указанное в заголовке соединение (124 мг, 86%) получали в виде маслянистого вещества светло-коричневого цвета. 2-метил-3-(4-гидроксифенил)-4-(3H)хиназолинон синтезировали по способу примера 1-(1) и-(2). 1H ЯМР (400 МГц, CDCl3, Пример 18 2,5-диметил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон (1) Получение 1-[3-(4-нитрофенокси)пропил]пиперидина 3-пиперидин-1-ил-пропан-1-ол (3,66 г, 25,6 ммоль), 4-нитрофенол (2,96 г, 21,3 ммоль) и трифенилфосфин (6,71 г, 25,6 ммоль) растворяли в безводном тетрагидрофуране в потоке азота и охлаждали на ледяной бане. Добавляли по каплям диизопропилазодикарбоксилат (5,0 мл, 25,6 ммоль) и перемешивали при комнатной температуре в течение 40 часов. Реакционную жидкость концентрировали, добавляли диэтиловый эфир и твердый осадок отфильтровывали. Фильтрат концентрировали, продукт очищали колоночной хроматографией на силикагеле (хлороформ/метанол=100/0-95/5) и получали, таким образом, целевое вещество (3,49 г, 62%) в виде маслянистого остатка светло-желтого цвета. 1-[3-(4-нитрофенокси)пропил]пиперидин также получали следующим способом. Гидрид натрия (2,8 г) осаждали в диметилформамиде (20 мл) в потоке азота и медленно добавляли 3-пиперидин-1-ил-пропан-1-ол (5,0 г, 34,9 ммоль) на ледяной бане. После 1 часа перемешивания при комнатной температуре добавляли 1-фтор-4-нитробензол (4,92 г, 34,9 ммоль) и смесь перемешивали при комнатной температуре в течение 15 часов. Добавляли дистиллированную воду и этилацетат, смесь экстрагировали этилацетатом и сушили безводным сульфатом натрия. После концентрирования остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол= 10/0-9/1) и получали, таким образом, целевое вещество (7,56 г, 82%) в виде маслянистого остатка светло-желтого цвета. (2) Получение 4-[3-(1-пиперидинил)пропокси]анилина 1-[3-(4-Нитрофенокси)пропил]пиперидин растворяли в метаноле и целевое соединение получали каталитическим восстановлением с использованием в качестве катализатора палладия на активированном угле в потоке водорода. (3) Получение 2,5-диметил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона 2,5-Диметил-4H-3,1-бензоксадин-4-он (100 мг, 0,57 ммоль) и 4-[3-(1-пиперидинил)пропокси]анилин (134 мг, 0,57 ммоль) растворяли в уксусной кислоте (3 мл) и перемешивали при 130°C в течение 10 часов. Растворитель отгоняли при пониженном давлении и добавляли этилацетат и 1н. водный раствор гидроксида натрия. Смесь экстрагировали этилацетатом и органическую фазу сушили безводным сульфатом натрия. После очистки колоночной хроматографией на силикагеле (хлороформ/метанол=20/1), указанное в заголовке соединение (76 мг, 34%) получали в виде бесцветных кристаллов перекристаллизацией (эфир/гептан). 2,5-диметил-4H-3,1-бензоксадин-4-он получали по способу примера 1-(1), используя 2-амино-6-метилбензойную кислоту и уксусный ангидрид в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Данные ЯМР для гидрохлорида 4-[3-(1-пиперидинил)пропокси]анилина, используемого для получения соединения данного примера, представлены ниже. 1H ЯМР (400 МГц, CDCl3/CD3OD=5/1, Соединения примеров 19-62 можно получить таким же способом, как указано в примере 18, способом на основе этой методики или их сочетанием с традиционным способом, используя соответствующую антраниловую кислоту, ангидрид кислоты и 4-[3-(1-пиперидинил)пропокси]анилин, 4-[3-(1-пирролидинил)пропокси]анилин или 5-амино-2-[3-(1-пиперидинил)пропокси]пиримидин в качестве исходных веществ. Пример 19 3-{4-[3-(1-пиперидинил)пропокси]фенил}-2-пропил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя антраниловую кислоту, масляный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 20 3-{4-[3-(1-пиперидинил)пропокси]фенил}-2-трифторметил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя антраниловую кислоту, безводную трифторуксусную кислоту и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 21 2-изопропил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя антраниловую кислоту, безводную изобутиловую кислоту и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 22 2,6-диметил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-5-метилбензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 23 7-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-4-хлорбензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 24 2,8-диметил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-3-метилбензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 25 2-этил-5-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-метилбензойную кислоту, пропионовый ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 26 5-фтор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 141-145°C) по способу примера 18, используя 2-амино-6-фторбензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/н-пентан). 1H ЯМР (400 МГц, CDCl3, Пример 27 5-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-хлорбензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 28 5-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 3, используя 2-амино-6-метоксибензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 29 Трифторацетат 5-гидрокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона Указанное в заголовке соединение получали деметилированием 5-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона, синтезированного в примере 28, используя трибромид бора. 1H ЯМР (400 МГц, CDCl3, Пример 30 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-5-трифторметил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-трифторметилбензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 31 7-фтор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-4-фторбензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 32 6-фтор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-5-фторбензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 33 6,7-дифтор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-4,5-дифторбензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 34 6-бром-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-5-бромбензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 35 6-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-5-хлорбензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 36 6-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 136-138°C) по способу примера 18, используя 2-амино-5-метоксибензойную кислоту, уксусный ангидрид и 4-(3-пиперидинил)пропоксианилин в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир/н-пентан). 1H ЯМР (400 МГц, CDCl3, Пример 37 6,7-диметокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-4,5-диметоксибензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 38 8-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-3-хлорбензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 39 8-метокси-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-3-метоксибензойную кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 40 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}бензо[g]-хиназолин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 3-амино-2-нафтойную кислоту, уксусный ангидрид и 4-[3-(1-пирролидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 41 2,6-диметил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон (1) Получение 4-[3-(1-пирролидинил)пропокси]анилина Целевое соединение получали по способу примера 18, используя 3-пирролидин-1-ил-пропан-1-ол и 4-нитрофенол или 1-фтор-4-нитробензол в качестве исходных веществ. (2) Получение 2,6-диметил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-5-метилбензойную кислоту, уксусный ангидрид и 4-[3-(1-пирролидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Данные ЯМР для 4-[3-(1-пирролидинил)пропокси]анилина, используемого для получения соединения данного примера представлены ниже. 1H ЯМР (400 МГц, CDCl3, 4-[3-(1-пирролидинил)пропокси]анилин также можно получить в виде 4-[3-(1-пирролидинил)пропокси]анилиндитозилата обработкой 2 экв. п-толуолсульфоновой кислотой. Данные ЯМР для этой соли тозила представлены ниже. 1H ЯМР (400 МГц, ДМСО-d6) Пример 42 2-этил-5-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-метилбензойную кислоту, пропионовый ангидрид и 4-[3-(1-пирролидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 43 5-Фтор-2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-фторбензойную кислоту, уксусный ангидрид и 4-[3-(1-пирролидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 44 2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-5-трифторметил-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 137-140°C) по способу примера 18, используя 2-амино-6-трифторметилбензойную кислоту, уксусный ангидрид и 4-[(3-(1-пирролидинил)пропокси]анилин в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/н-пентан). 1H ЯМР (400 МГц, CDCl3, Пример 45 5-хлор-2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-хлорбензойную кислоту, уксусный ангидрид и 4-[3-(1-пирролидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 46 2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя антраниловую кислоту, пропионовый ангидрид и 4-[3-(1-пирролидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 47 2,5-диметил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 112-113°C) по способу примера 18, используя 2-амино-6-метилбензойную кислоту, уксусный ангидрид и 4-[(3-{1-пирролидинил)пропокси]анилин в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 48 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[2,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 2-аминоникотиновую кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3:CD3OD=6:1, Пример 49 2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[2,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 2-аминоникотиновую кислоту, уксусный ангидрид и 4-[3-(1-пирролидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 50 6-хлор-2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 5-амино-2-хлоризоникотиновую кислоту, уксусный ангидрид и 4-[3-(1-пирролидинил)пропокси]анилин в качестве исходных веществ. 5-амино-2-хлоризоникотиновую кислоту получали по способу, описанному в литературе (J. Chem. Soc. Perkin Trans. 1, 1996, p.2221). 1H ЯМР (400 МГц, CD3OD, Пример 51 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали каталитическим восстановлением 6-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-она, синтезированного в примере 63, в этилацетате с использованием в качестве катализатора палладия на активированном угле, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 52 2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[4,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 4-аминоникотиновую кислоту, уксусный ангидрид и 4-[3-(1-пирролидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CD3OD, Пример 53 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[4,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 4-аминоникотиновую кислоту, уксусный ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 54 2-метил-3-{2-[3-(1-пиперидинил)пропокси]-5-пиримидинил}-4(3H)-хиназолинон (1) Получение 5-нитро-2-(3-пиперидин-1-илпропокси)-пиримидина 2-Хлор-5-нитропиримидин (300 мг, 1,88 ммоль), 3-пиперидин-1-ил-пропан-1-ол (323 мг, 2,26 ммоль) и карбонат цезия (725 мг, 3,76 ммоль) смешивали в безводном диметилформамиде (5 мл) и перемешивали в течение 2 дней при комнатной температуре. Растворитель отгоняли при пониженном давлении, добавляли этилацетат и 1н. водный раствор гидроксида натрия и смесь экстрагировали этилацетатом. После сушки безводным сульфатом натрия продукт очищали колоночной хроматографией на силикагеле (хлороформ/метанол=30/1) и целевое соединение (110 мг, 22%) получали в виде твердого вещества светло-коричневого цвета. 2-хлор-5-нитропиримидин получали способом, описанным в литературе (Heterocycles, 1984, Vol.22, p.79). (2) Получение 5-амино-2-(3-пиперидин-1-ил-пропокси)пиримидина 5-Нитро-2-(3-пиперидин-1-илпропокси)пиримидин (100 мг, 0,38 ммоль) растворяли в смеси растворителей метанола (2 мл) и дистиллированной воды (2 мл), добавляли дитионит натрия (Na2S2O4) (655 мг) и смесь перемешивали в течение 30 минут при комнатной температуре. Растворитель отгоняли при пониженном давлении, к остатку добавляли метанол и осадок отфильтровывали. Фильтрат концентрировали и целевое соединение (60 мг, 68%) получали в виде маслянистого остатка желтого цвета. (3) Получение 2-метил-3-{2-[3-(1-пиперидинил)пропокси]-5-пиримидинил}-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 18, используя антраниловую кислоту, уксусный ангидрид и 5-амино-2-[3-(1-пиперидинил)пропокси]пиримидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 55 2,5-диметил-3-{2-[3-(1-пиперидинил)пропокси]-5-пиримидинил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-метилбензойную кислоту, уксусный ангидрид и 5-амино-2-[3-(1-пиперидинил)пропокси]пиримидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 56 2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[2,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 2-аминоникотиновую кислоту, пропионовый ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, CD3OD, Пример 57 6-хлор-2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 5-амино-2-хлоризоникотиновую кислоту, пропионовый ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 58 6-хлор-2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 5-амино-2-хлоризоникотиновую кислоту, пропионовый ангидрид и 4-[3-(1-пирролидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 59 2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали каталитическим восстановлением 6-хлор-2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-она, синтезированного в примере 57, используя палладий на активированном угле в качестве катализатора, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 60 2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали каталитическим восстановлением 6-хлор-2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-она, синтезированного в примере 58, используя палладий на активированном угле в качестве катализатора, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 61 2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[4,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 4-аминоникотиновую кислоту, пропионовый ангидрид и 4-[3-(1-пиперидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 62 2-этил-3-{4-[3-(1-пирролидинил)пропокси]фенил}пиридо[4,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 4-аминоникотиновую кислоту, пропионовый ангидрид и 4-[3-(1-пирролидинил)пропокси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 63 6-Хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он 6-Хлор-2-метил-3-(4-гидроксифенил)пиридо[3,4-d]пиримидин-4(3H)-он (52 мг, 0,18 ммоль), гидробромид 1-(3-бромпропил)пиперидина (78 мг, 0,27 ммоль) и карбонат калия (100 мг, 0,72 ммоль) смешивали в диметилформамиде (1 мл) и перемешивали при 80°C в течение 1 часа. Растворитель отгоняли при пониженном давлении, добавляли дистиллированную воду и смесь экстрагировали этилацетатом. Органическую фазу промывали дистиллированной водой и сушили безводным сульфатом натрия. Указанное в заголовке соединение (45 мг, 60%) получали в виде бесцветных кристаллов очисткой колоночной хроматографией на силикагеле (хлороформ/метанол=30/1) и перекристаллизации (этанол). 6-Хлор-2-метил-3-(4-гидроксифенил)пиридо[3,4-d]пиримидин-4(3H)-он синтезировали по способу примера 1-(1) и -(2), используя 5-амино-4-карбокси-2-хлорпиридин и уксусный ангидрид в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 64 3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали алкилированием 3-(4-гидроксифенил)-4(3H)хиназолинона и гидробромида 1-(3-бромпропил)пиперидина по способу примера 63. 3-(4-гидроксифенил)-4(3H)хиназолинон получали способом, описанным в литературе (Heterocycles, 1993, Vol.35, p.775). 1H ЯМР (400 МГц, CDCl3, Пример 65 6-(ацетиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон (1) Получение 6-амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона 2-Метил-6-нитро-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон (110 мг, 0,26 ммоль), синтезированный по способу примера 1, растворяли в метаноле (3 мл) и атмосферу в системе заполняли азотом. После добавления 10% палладия на активированном угле (100 мг) атмосферу заменяли водородом и смесь перемешивали при комнатной температуре в течение 1 часа. Катализатор отфильтровывали и фильтрат концентрировали досуха с получением целевого соединения (91 мг, 89%) в виде твердого вещества светло-желтого цвета. (2) Получение 6-(ацетиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона 6-Амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон (228 мг, 0,58 ммоль) растворяли в смеси растворителей безводного тетрагидрофурана (5 мл) и безводного пиридина (1 мл) и охлаждали на ледяной бане. Добавляли по каплям ацетилхлорид (68 мг, 0,87 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли этилацетат и 1н. водный раствор гидроксида натрия, смесь экстрагировали этилацетатом и органическую фазу сушили безводным сульфатом натрия. Продукт очищали колоночной хроматографией на силикагеле(хлороформ/метанол=20/1) и указанное в заголовке соединение (156 мг, 62%) получали в виде бесцветных кристаллов перекристаллизацией из диэтилового эфира/гептана. 1H ЯМР (400 МГц, CDCl3, Соединения примеров 66-79 получали конденсацией амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона с соответствующим хлорангидридом кислоты или карбоновой кислотой по способу примера 65. Пример 66 6-(бутириламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали конденсацией 6-амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона с бутаноилхлоридом по способу примера 65. 1H ЯМР (400 МГц, CDCl3, Пример 67 6-(гексаноиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали конденсацией 6-амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона с гексаноилхлоридом по способу примера 65. 1H ЯМР (400 МГц, CDCl3, Пример 68 6-(бензоиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали конденсацией 6-амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона с бензоилхлоридом по способу примера 65. 1H ЯМР (400 МГц, CDCl3, Пример 69 6-[(2-фенилацетил)амино]-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали конденсацией 6-амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона с бензилоилхлоридом по способу примера 65. 1H ЯМР (400 МГц, CDCl3, Пример 70 6-(2-нафтоиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали конденсацией 6-амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона с 2-нафтоилхлоридом по способу примера 65. 1H ЯМР (400 МГц, CDCl3, Пример 71 2-метил-6-[(метилсульфонил)амино]-3-{3-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали конденсацией 6-амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона с мезилхлоридом по способу примера 65. 1H ЯМР (400 МГц, CDCl3, Пример 72 2-метил-6-[(метилсульфонил)амино]-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали конденсацией 6-амино-2-метил-3-{4-[3-(1-пирролидинил)пропокси]фенил}-4(3H)-хиназолинона с мезилхлоридом по способу примера 65. 1H ЯМР (400 МГц, CDCl3, Пример 73 7-(ацетиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали конденсацией 7-амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона с ацетилхлоридом по способу примера 65. 1H ЯМР (400 МГц, CDCl3, Пример 74 7-(бутириламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали конденсацией 7-амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона с бутаноилхлоридом по способу примера 65. 1H ЯМР (400 МГц, CDCl3, Пример 75 7-(гексаноиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали конденсацией 7-амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона гексаноилхлоридом по способу примера 65. 1H ЯМР (400 МГц, CDCl3, Пример 76 7-(бензоиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали конденсацией 7-амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона с бензоилхлоридом по способу примера 65. 1H ЯМР (400 МГц, CD3OD, Пример 77 7-[(2-фенилацетил)амино]-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали конденсацией 7-амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона с бензилоилхлоридом по способу примера 65. 1H ЯМР (400 МГц, CD3OD, Пример 78 7-(2-нафтоиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали конденсацией 7-амино-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона с 2-нафтоилхлоридом по способу примера 65. 1H ЯМР (400 МГц, CD3OD, Пример 79 6-[ацетил(метил)амино]-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали обработкой 6-(ацетиламино)-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона, синтезированного в примере 65, гидридом натрия в диметилформамиде и метилирования метилиодидом. 1H ЯМР (400 МГц, CDCl3, Пример 80 2-метил-6-фенил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон 2-Метил-6-бром-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон (100 мг, 0,25 ммоль) и фенилбороновую кислоту (40 мг, 0,32 ммоль) растворяли в диметоксиэтане (1 мл) и атмосферу в системе заполняли азотом. Добавляли 2M водный раствор карбоната натрия (0,3 мл) и комплекс тетракис(трифенилфосфин) палладия (10 мг, 0,012 ммоль) и перемешивали при 80°C в течение 3 часов. К реакционной смеси добавляли этилацетат и дистиллированную воду для осуществления экстракции этилацетатом. Органическую фазу промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Продукт очищали колоночной хроматографией на силикагеле (хлороформ/метанол=20/1) и целевое соединение (61 мг, 61%) получали в виде бесцветного твердого вещества. Использовали 2-метил-6-бром-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, который синтезировали в примере 34. 1H ЯМР (400 МГц, CDCl3, Пример 81 2-метил-6-(4-метилфенил)-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали реакцией сочетания Сузуки 2-метил-6-бром-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона и 4-метилфенилбороновой кислоты, по способу примера 80. 1H ЯМР (400 МГц, CDCl3, Пример 82 2-метил-6-(3-метилфенил)-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали реакцией сочетания Сузуки 2-метил-6-бром-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона и 3-метилфенилбороновой кислоты, по способу примера 80. 1H ЯМР (400 МГц, CDCl3, Пример 83 2-метил-6-(2-метилфенил)-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали реакцией сочетания Сузуки 2-метил-6-бром-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона и 2-метилфенилбороновой кислоты, по способу примера 80. 1H ЯМР (400 МГц, CDCl3, Пример 84 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-6-(3-пиридил)-4(3H)-хиназолинон Указанное в заголовке соединение получали реакцией сочетания Сузуки 2-метил-6-бром-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинона и 3-пиридилбороновой кислоты, по способу примера 80. 1H ЯМР (400 МГц, CD3OD, Пример 85 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-6-(4-пиридил)-4(3H)-хиназолинон Указанное в заголовке соединение получали реакцией сочетания Сузуки 2-метил-6-бром-3-{4-[3-(1- пиперидинил)пропокси]фенил}-4(3H)-хиназолинона и 4-пиридилбороновой кислоты, по способу примера 80. 1H ЯМР (400 МГц, CD3OD, Пример 86 2-метил-5-фенил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон 5-Хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон (100 мг, 0,24 ммоль), фенилборную кислоту (90 мг, 0,73 ммоль) и карбонат цезия (480 мг, 1,45 ммоль) смешивали в 1,4-диоксане (1 мл) и атмосферу в системе заполняли азотом. Добавляли Pd2(dba)3 (15 мг, 0,012 ммоль) и три-трет-бутилфосфин (10 мг, 0,036 ммоль) и перемешивали при 100°C в течение 12 часов. К реакционной смеси добавляли хлороформ и дистиллированную воду и смесь экстрагировали хлороформом. Органическую фазу промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Продукт очищали тонкослойной хроматографией на силикагеле и указанное в заголовке соединение (20 мг, 18%) получали в виде бесцветного твердого вещества. Использовали 5-хлор-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, который синтезировали в примере 27. 1H ЯМР (400 МГц, CDCl3, Пример 87 2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-6-(2-пиридил)-4(3H)-хиназолинон 6-Бром-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон (100 мг, 0,25 ммоль) и 2-(трибутилстаннил)пиридин (90 мг, 0,25 ммоль) растворяли в толуоле (1 мл) и атмосферу в системе заполняли азотом. Добавляли комплекс палладий тетракис(трифенилфосфин) (30 мг, 0,025 ммоль) и перемешивали при 120°C в течение 12 часов. Нерастворимые вещества отфильтровывали через целит, к фильтрату добавляли хлороформ, органическую фазу промывали дистиллированной водой и сушили безводным сульфатом натрия. Продукт очищали колоночной хроматографией на силикагеле (хлороформ/метанол=9/1) и целевое соединение (20 мг, 20%) получали в виде бесцветного твердого вещества. Использовали 6-бром-2-метил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон, который синтезировали в примере 34. 1H ЯМР (400 МГц, CD3OD, Пример 88 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон (1) Получение 3-{4-[(1-трет-бутоксикарбонил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинона 2-Метил-3-(4-гидроксифенил)-4(3H)хиназолинон, синтезированный по способу примера 1-(1) и -(2) (1,0 г, 3,96 ммоль), N-(трет-бутоксикарбонил)-4-пиперидинол (956 мг, 4,75 ммоль) и трифенилфосфин (1,56 г, 5,94 ммоль) растворяли в безводном тетрагидрофуране (2 мл) в потоке азота и охлаждали на ледяной бане. Добавляли по каплям при 0°C диэтилазодикарбоксилат (1,17 мл, 5,94 ммоль) и перемешивали при комнатной температуре в течение 48 часов. Растворитель отгоняли при пониженном давлении, добавляли простой эфир, твердый осадок отфильтровывали и фильтрат концентрировали. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат=7/3) и целевое соединение (1,1 г, 64%) получали в виде твердого вещества светло-коричневого цвета. 2-Метил-3-(4-гидроксифенил)-4 (3H)хиназолинон синтезировали по способу примера 1-(1) и -(2). (2) Получение 2-метил-3-[4-(4-пиперидинилокси)фенил]-4(3H)-хиназолинона 3-{4-[(1-трет-Бутоксикарбонил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон (1,1 г, 2,53 ммоль) растворяли в хлороформе (10 мл), добавляли трифторуксусную кислоту (10 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Растворитель отгоняли при пониженном давлении, добавляли этилацетат и 2н. водный раствор гидроксида натрия, смесь экстрагировали этилацетатом и органическую фазу сушили безводным сульфатом натрия. Сульфат натрия отфильтровывали и фильтрат концентрировали и сушили с получением целевого соединения (0,83 г, 98%) в виде твердого вещества цвета лаванды. 1H ЯМР (400 МГц, CDCl3, (3) Получение 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинона 2-метил-3-[4-(4-пиперидинилокси)фенил}-4(3H)-хиназолинон (370 мг, 1,10 ммоль) и циклобутанон (155 мг, 2,20 ммоль) растворяли в растворе 0,5M хлорида цинка(II) и цианоборгидрида натрия в метаноле (6 мл) и перемешивали при комнатной температуре в течение 1 часа. Растворитель отгоняли при пониженном давлении, добавляли этилацетат и дистиллированную воду, смесь экстрагировали этилацетатом и органическую фазу промывали дистиллированной водой. После сушки безводным сульфатом натрия продукт очищали колоночной хроматографией на силикагеле (хлороформ/метанол=30/1) и указанное в заголовке соединение (165 мг, 39%) получали в виде бесцветного твердого вещества. 1H ЯМР (400 МГц, CDCl3, Пример 89 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали осуществлением восстановительного аминирования по способу примера 88-(3), используя 2-метил-3-[4-(4-пиперидинилокси)фенил}-4(3H)-хиназолинон, N-Boc-4-пиперидинол и циклопентанон в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 90 3-{4-(1-циклогексил-4-пиперидинилокси)фенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали осуществлением восстановительного аминирования по способу примера 88-(3), используя 2-метил-3-[4-(4-пиперидинилокси)фенил}-4(3H)-хиназолинон, N-Boc-4-пиперидинол и циклогексанон в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 91 3-{4-(1-изопропил-4-пиперидинилокси)фенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали осуществлением восстановительного аминирования по способу примера 88-(3), используя 2-метил-3-[4-(4-пиперидинилокси)фенил}-4(3H)-хиназолинон, N-Boc-4-пиперидинол и ацетон в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 92 3-{4-(1-этил-4-пиперидинилокси)фенил}-2-метил-4(3H)-хиназолинон 2-Метил-3-[4-(4-пиперидинилокси)фенил}-4(3H)-хиназолинон (50 мг, 0,15 ммоль), этилиодид (23 мг, 0,15 ммоль) и карбонат калия (0,30 ммоль) смешивали в диметилформамиде (1 мл) и перемешивали при комнатной температуре в течение 1 часа. Растворитель отгоняли при пониженном давлении, добавляли этилацетат и 1н. водный раствор гидроксида натрия и смесь экстрагировали этилацетатом. Органическую фазу промывали дистиллированной водой, сушили безводным сульфатом натрия и продукт очищали колоночной хроматографией на силикагеле (хлороформ/метанол=30/1) с получением указанного в заголовке соединения (25 мг, 46%) в виде бесцветного твердого вещества. 1H ЯМР (400 МГц, CDCl3, Пример 93 3-{4-(1-бутил-4-пиперидинилокси)фенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали N-алкилированием, используя 2-метил-3-[4-(4-пиперидинилокси)фенил}-4(3H)-хиназолинон и бутилиодид, по способу примера 92. 1H ЯМР (400 МГц, CDCl3, Пример 94 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метил-5-трифторметил-4(3H)-хиназолинон (1) Получение 4-(4-нитрофенокси)пиперидина N-Boc-4-пиперидинол (10 г, 50 ммоль), 4-нитрофенол (7,0 г, 50 ммоль) и трифенилфосфин (15,7 г, 60 ммоль) растворяли в безводном тетрагидрофуране (150 мл) и охлаждали на ледяной бане. Медленно добавляли диизопропилазодикарбоксилат (11,8 мл, 60 ммоль) и перемешивали в течение 2 дней при комнатной температуре. Растворитель отгоняли при пониженном давлении, добавляли диэтиловый эфир и твердый осадок отфильтровывали. Фильтрат концентрировали и продукт очищали колоночной хроматографией на силикагеле (гексан/этилацетат=6/1). К полученному остатку добавляли трифторуксусную кислоту и перемешивали при комнатной температуре в течение 1 часа. После дистилляции при пониженном давлении добавляли 1н. водный раствор гидроксида натрия и смесь экстрагировали этилацетатом. После сушки безводным сульфатом натрия продукт концентрировали и сушили с получением целевого соединения (6,75 г, 61%). (2) Получение 1-циклопентил-4-(4-нитрофенокси)пиперидина 4-(4-Нитрофенокси)пиперидин (1,03 г, 4,65 ммоль) и циклопентанон (783 мг, 9,31 ммоль) растворяли в растворе 0,5M хлорида цинка(II) и цианоборгидрида натрия в метаноле (20 мл) и перемешивали при комнатной температуре в течение 10 часов. Растворитель отгоняли при пониженном давлении, добавляли этилацетат и 1н. водный раствор гидроксида натрия, смесь экстрагировали этилацетатом и органическую фазу промывали дистиллированной водой. После сушки безводным сульфатом натрия продукт концентрировали и получали, таким образом, целевое соединение (1,31 г, 96%) в виде твердого вещества светло-коричневого цвета. (3) Получение 4-[(1-циклопентилпиперидин-4-ил)окси]анилина 1-Циклопентил-4-(4-нитрофенокси)пиперидин (1,30 г) растворяли в метаноле и целевое соединение (1,0 г, 86%) получали в виде твердого вещества светло-коричневого цвета каталитическим восстановлением, используя катализатор палладий на активированном угле. (4) Получение 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метил-5-трифторметил-4(3H)-хиназолинона 2-Метил-5-трифторметил-4H-3,1-бензоксадин-4-он (71 мг, 0,31 ммоль) и 4-[(1-циклопентил-4-пиперидинил)окси]анилин (80 мг, 0,31 ммоль) растворяли в уксусной кислоте (0,5 мл) и перемешивали при 130°C в течение 6 часов. Растворитель отгоняли при пониженном давлении и добавляли этилацетат и 1н. водный раствор гидроксида натрия. Смесь экстрагировали этилацетатом и органическую фазу сушили безводным сульфатом натрия. Продукт очищали колоночной хроматографией на силикагеле (хлороформ/метанол=20/1) и получали, таким образом, указанное в заголовке соединение (88 мг, 61%) в виде твердого вещества светло-коричневого цвета. 2-Метил-5-трифторметил-4H-3,1-бензоксадин-4-он получали по способу примера 1-(1), используя 2-амино-6-трифторметилбензойную кислоту и уксусный ангидрид в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Данные ЯМР для 4-[(1-циклопентилпиперидин-4-ил)окси]анилина, используемого для получения соединения данного примера, представлены ниже. 1H ЯМР (400 МГц, CDCl3, Продукты примеров 95-115 можно получить таким же способом, как указано в примере 94, способом на основе этой методики или их сочетанием с традиционным способом, используя соответствующую антраниловую кислоту, ангидрид кислоты и 4-[(1-циклопентил-4-пиперидинил)окси]анилин или 4-[(1-циклобутил-4-пиперидинил)окси]анилин в качестве исходных веществ. Пример 95 3-{4-(1-циклопентил-4-пиперидинилокси)фенил}-2,5-диметил-4(3H)-хиназолинон Указанное в заголовке соединение получали циклизацией, используя 2,5-диметил-4H-3,1-бензоксазин-4-он и 4-[(1-циклопентил-4-пиперидинил)окси]анилин, по способу примера 94. 1H ЯМР (400 МГц, CDCl3, Пример 96 7-хлор-3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали циклизацией, используя 7-хлор-2-метил-4H-3,1-бензоксазин-4-он и 4-[(1-циклопентил-4-пиперидинил)окси]анилин, по способу примера 94. 1H ЯМР (400 МГц, CDCl3, Пример 97 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2,6-диметил-4(3H)-хиназолинон Указанное в заголовке соединение получали циклизацией, используя 2,6-диметил-4H-3,1-бензоксазин-4-он и 4-[(1-циклопентил-4-пиперидинил)окси]анилин, по способу примера 94. 1H ЯМР (400 МГц, CDCl3, Пример 98 6-хлор-3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали циклизацией, используя 6-хлор-2-метил-4H-3,1-бензоксазин-4-он и 4-[(1-циклопентил-4-пиперидинил)окси]анилин, по способу примера 94. 1H ЯМР (400 МГц, CDCl3, Пример 99 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-6-метокси-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали циклизацией, используя 6-метокси-2-метил-4H-3,1-бензоксазин-4-он и 4-[(1-циклопентил-4-пиперидинил)окси]анилин, по способу примера 94. 1H ЯМР (400 МГц, CDCl3, Пример 100 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[2,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали циклизацией, используя 2-метил-4H-пиридо[2,3-1][1,3]оксадин-4-он и 4-[(1-циклопентил-4-пиперидинил)окси]анилин, по способу примера 94. 1H ЯМР (400 МГц, CDCl3, Пример 101 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[4,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали в виде твердого вещества белого цвета (т.пл.: 140-143°C) циклизацией, используя 2-метил-4H-пиридо[4,3-d][1,3]оксазин-4-он и 4-[(1-циклопентил-4-пиперидинил)окси]анилин, по способу примера 94, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 102 6-хлор-3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали циклизацией, используя 6-хлор-2-метил-4H-пиридо[3,4-d][1,3]оксадин-4-он и 4-[(1-циклопентил-4-пиперидинил)окси]анилин, по способу примера 94. 1H ЯМР (400 МГц, CDCl3, Пример 103 3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали каталитическим восстановлением 6-хлор-3-{4-[(1-циклопентил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-она, синтезированного в примере 102, используя палладий на активированном угле в качестве катализатора, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 104 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2,5-диметил-4(3H)-хиназолинон (1) Получение 4-[(1-циклобутил-4-пиперидинил)окси]анилина Целевое соединение получали в виде твердого вещества светло-коричневого цвета по способу примера 94, используя 4-(4-нитрофенокси)пиперидин и циклобутанон в качестве исходных веществ. 4-[(1-циклобутил-4-пиперидинил)окси]анилин монотозилат также можно получить обработкой полученного 4-[(1-циклобутил-4-пиперидинил)окси]анилина одним эквивалентом п-толуолсульфоновой кислоты. Использовали 4-(4-нитрофенокси)пиперидин, который синтезировали в примере 94. (2) Получение 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2,5-диметил-4(3H)-хиназолинона Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 142-143°C) по способу примера 94, используя 2-амино-6-метилбензойную кислоту, уксусный ангидрид и 4-[(1-циклобутил-4-пиридинил)окси]анилин в качестве исходных веществ, с последующей перекристаллизацией (этилацетат). 1H ЯМР (400 МГц, CDCl3, Данные ЯМР для 4-[(1-циклобутил-4-пиперидинил)окси]анилина, используемого для получения соединения данного примера, представлены ниже. 1H ЯМР (400 МГц, CDCl3, Данные ЯМР для 4-[(1-циклобутил-4-пиперидинил)окси]анилина монотозилата представлены ниже. 1H ЯМР (400 МГц, CDCl3/CD3OD=4/1, Пример 105 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-5-метокси-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества светло-желтого цвета (т.пл.: 153-156°C) по способу примера 94, используя 2-амино-6-метоксибензойную кислоту, уксусный ангидрид и 4-(1-циклобутил-4-пиперидинил)оксианилин в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир/н-гептан). 1H ЯМР (400 МГц, CDCl3, Пример 106 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метил-5-трифторметил-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 132-134°C) по способу примера 94, используя 2-амино-6-трифторметилбензойную кислоту, уксусный ангидрид и 4-[(1-циклобутил-4-пиперидинил)окси]анилин в качестве исходных веществ, с последующей перекристаллизацией (этилацетат). 1H ЯМР (400 МГц, CDCl3, Пример 107 5-хлор-3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 94, используя 2-амино-6-хлорбензойную кислоту, уксусный ангидрид и 4-[(1-циклобутил-4-пиперидинил)окси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 108 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[4,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 94, используя 4-аминоникотиновую кислоту, уксусный ангидрид и 4-[(1-циклобутил-4-пиперидинил)окси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 109 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[4,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 186-189°C) по способу примера 94, используя 4-аминоникотиновую кислоту, пропионовый ангидрид и 4-[(1-циклобутил-4-пиперидинил)окси]анилин в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 110 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[2,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 94, используя 2-аминоникотиновую кислоту, уксусный ангидрид и 4-[(1-циклобутил-4-пиперидинил)окси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 111 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[2,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 146-148°C) по способу примера 94, используя 2-аминоникотиновую кислоту, пропионовый ангидрид и 4-[(1-циклобутил-4-пиперидинил)окси]анилин, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 112 6-хлор-3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 94, используя 5-амино-2-хлоризоникотиновую кислоту, уксусный ангидрид и 4-[(1-циклобутил-4-пиперидинил)окси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 113 6-хлор-3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 94, используя 5-амино-2-хлоризоникотиновую кислоту, пропионовый ангидрид и 4-[(1-циклобутил-4-пиперидинил)окси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 114 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали в виде твердого вещества светло-желтого цвета (т.пл.: 169-171°C) каталитическим восстановлением 6-хлор-3-{4-[(циклобутил-4-пиперидинил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-она, синтезированного в примере 112, в этилацетате, используя палладий на активированном угле в качестве катализатора, в присутствии триэтиламина, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 115 3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали каталитическим восстановлением 6-хлор-3-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-2-этилпиридо[3,4-d]пиримидин-4(3H)-она, синтезированного в примере 113, используя палладий на активированном угле в качестве катализатора, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 116 2-фенил-3-[4-(3-пиперидин-1-илпропокси)фенил]-4(3H)-хиназолинон (1) Получение 2-фенил-4H-3,1-бензоксазин-4-она Антраниловую кислоту (1,0 г, 7,29 ммоль) растворяли в пиридине (10 мл), медленно добавляли на ледяной бане бензоилхлорид (1,13 г, 8,02 ммоль) и перемешивали при 50°C в течение ночи. Растворитель отгоняли при пониженном давлении, остаток растворяли в безводном метиленхлориде (20 мл), добавляли на ледяной бане оксалилхлорид (925 мг, 7,29 ммоль) и каталитическое количество диметилформамида и перемешивали при комнатной температуре в течение 4 часов. Добавляли насыщенный водный раствор гидрокарбоната натрия, смесь экстрагировали метиленхлоридом и органическую фазу сушили безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, остаток промывали диэтиловым эфиром/гептаном и целевое соединение (3,13 г, 69%) получали в виде твердого вещества светло-желтого цвета. (2) Получение 2-фенил-3-[4-(3-пиперидин-1-илпропокси)фенил]-4(3H)-хиназолинона Указанное в заголовке соединение получали циклизацией 2-фенил-4H-3,1-бензоксазин-4-она и 4-(3-пиперидин-1-илпропокси)анилина по способу примера 18-(2). 1H ЯМР (400 МГц, CDCl3, Пример 117 цис-2-метил-3-(4-{[4-(1-пирролидинил)циклогексил]окси}фенил)-4(3H)-хиназолинон и транс-2-метил-3-(4-{[4-(1-пирролидинил)циклогексил]окси}фенил)-4(3H)-хиназолинон (1) Получение 1,4-диоксаспиро[4.5]декан-8-ола 1,4-Диоксаспиро[4,5]декан-8-он (1,0 г, 6,40 ммоль) растворяли в метаноле (10 мл), медленно добавляли боргидрид натрия (242 мг, 6,40 ммоль) и перемешивали при комнатной температуре в течение 5 минут. Смесь охлаждали на ледяной бане, добавляли 10% водный раствор хлористоводородной кислоты и хлорид натрия и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Сульфат натрия отфильтровывали и продукт концентрировали при пониженном давлении с получением целевого соединения (614 мг, 61%) в виде маслянистого вещества светло-желтого цвета. (2) Получение 2-метил-3-{4-[(4-оксоциклогексил)окси]фенил}-4(3H)-хиназолинона 2-Метил-3-(4-гидроксифенил)-4-(3H)хиназолинон (665 мг, 2,63 ммоль), 1,4-диоксаспиро[4,5]декан-8-ол (500 мг, 3,16 ммоль) и трифенилфосфин (1,03 г, 3,96 ммоль) растворяли в безводном тетрагидрофуране (5 мл) и охлаждали на ледяной бане. Добавляли по каплям при 0°C диизопропилазодикарбоксилат (777 мкл, 3,96 ммоль) и перемешивали при комнатной температуре в течение 48 часов. Добавляли дистиллированную воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором, остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат=2/8-0/10), получали защищенное соединение кеталя и затем осуществляли удаление защиты. К остатку добавляли 10% водный раствор хлористоводородной кислоты и перемешивали при комнатной температуре в течение 3 часов. Добавляли 2н. водный раствор гидроксида натрия и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Продукт очищали колоночной хроматографией на силикагеле (хлороформ/метанол=20/1) с получением целевого соединения (511 мг, 49%) в виде твердого вещества светло-оранжевого цвета. 2-Метил-3-(4-гидроксифенил)-4-(3H)хиназолинон синтезировали по способу примера 1-(1) и -(2). (3) Получение цис-2-метил-3-(4-{[4-(1-пирролидинил)циклогексил]окси}фенил)-4(3H)-хиназолинона и транс-2-метил-3-(4-{[4-(1-пирролидинил)циклогексил]окси}фенил)-4(3H)-хиназолинона 2-Метил-3-{4-[(4-оксоциклогексил)окси]фенил}-4(3H)-хиназолинон (484 мг, 1,39 ммоль) и пирролидин (99 мг, 1,39 ммоль) растворяли в водно-метанольном растворе (1,7 мл) 0,5M хлорида цинка(II)/цианоборгидрида натрия и перемешивали при комнатной температуре в течение 3 часов. Добавляли 2н. водный раствор гидроксида натрия и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором и сушили безводным сульфатом натрия. Продукт очищали колоночной хроматографией на силикагеле (гексан/этилацетат=8/2-5/5) и соответственно получали цис-изомер (260 мг) и транс-изомер (180 мг) указанного в заголовке соединения в виде бесцветного твердого вещества. цис-2-метил-3-(4-{[4-(1-пирролидинил)циклогексил]окси}фенил)-4(3H)-хиназолинон 1H ЯМР (400 МГц, CDCl3, транс-2-метил-3-(4-{[4-(1-пирролидинил)циклогексил]окси}фенил)-4(3H)-хиназолинон 1H ЯМР (400 МГц, CDCl3, Пример 118 3-{4-[(1-циклопентил-3-пирролидинил)окси]фенил}-2-метил-4(3H)-хиназолинон (рацемическая смесь) 1-Бензил-3-пирролидинон восстанавливали боргидридом натрия по способу примера 117-(1) и получали целевое соединение. (2) Получение 3-{4-[(1-бензил-3-пирролидинил)окси]фенил}-2-метил-4(3H)-хиназолинона 1-Бензил-3-пирролидинол и 2-метил-3-(4-гидроксифенил)-4-(3H) хиназолинон подвергали реакции этерификации Мицунобу и получали, таким образом, целевое соединение. 2-Метил-3-(4-гидроксифенил)-4-(3H)хиназолинон синтезировали по способу примера 1-(1) и -(2). 3) Получение 3-{4-[(3-пирролидинил)окси]фенил}-2-метил-4(3H)-хиназолинона Целевое соединение получали каталитическим восстановлением 3-{4-[(1-бензил-3-пирролидинил)окси]фенил}-2-метил-4(3H)-хиназолинона, используя гидроксид палладия в качестве катализатора в метаноле. (4) Получение 3-{4-[(1-циклопентил-3-пирролидинил)окси]фенил}-2-метил-4(3H)-хиназолинона (рацемическая смесь) Указанное в заголовке соединение получали восстановительным аминированием по способу примера 88-(3), используя 3-{4-[(3-пирролидинил)окси]фенил}-2-метил-4(3H)-хиназолинон и циклопентанон. 1H ЯМР (400 МГц, CDCl3, Пример 119 3-{4-[(1-циклобутил-3-пирролидинил)окси]фенил}-2-метил-4(3H)-хиназолинон (рацемическая смесь) Указанное в заголовке соединение получали восстановительным аминированием по способу примера 118, используя 3-{4-[(3-пирролидинил)окси]фенил}-2-метил-4(3H)-хиназолинон и циклобутанон. 1H ЯМР (400 МГц, CDCl3, Пример 120 3-{4-[(1-циклопентил-4-азепанил)окси]фенил}-2-метил-4(3H)-хиназолинон (рацемическая смесь) (1) Получение 3-{4-[(4-азепанил)окси]фенил}-2-метил-4(3H)-хиназолинона 2-Метил-3-(4-гидроксифенил)-4(3H)хиназолинон и 1-(трет-бутоксикарбонил)-4-гидроксиазепан подвергали реакции этерификации Мицунобу по способу примера 117-(2) и целевое соединение получали удалением защиты с использованием трифторуксусной кислоты. 2-Метил-3-(4-гидроксифенил)-4(3H)хиназолинон синтезировали, как указано в примере 1-(2). (2) Получение 3-{4-[(1-циклопентил-4-азепанил)окси]фенил}-2-метил-4(3H)-хиназолинона (рацемическая смесь) Указанное в заголовке соединение получали восстановительным аминированием по способу примера 117-(3), используя 3-{4-[(4-азепанил)окси]фенил}-2-метил-4(3H)-хиназолинон и циклопентанон. 1H ЯМР (400 МГц, CDCl3, Пример 121 3-{4-[(1-циклобутил-4-азепанил)окси]фенил}-2-метил-4(3H)-хиназолинон (рацемическая смесь) Указанное в заголовке соединение получали восстановительным аминированием по способу примера 120, используя 3-{4-[(4-азепанил)окси]фенил}-2-метил-4(3H)-хиназолинон и циклобутанон. 1H ЯМР (400 МГц, CDCl3, Пример 122 3-метил-2-{4-[3-пиперидин-1-илпропокси]фенил}-1(2H)-изохинолинон (1) Получение 3-(1-гидроксиэтил)-2-бензофуран-l(3H)-она Раствор диизопропиламида лития (26,9 ммоль) в безводном тетрагидрофуране (100 мл) охлаждали до -78°C в потоке азота и добавляли по каплям раствор фталида (3,0 г, 22,4 ммоль) в тетрагидрофуране (100 мл). После перемешивания при -78°C в течение 30 минут медленно добавляли ацетальдегид (1,19 г, 26,9 ммоль) и перемешивали при -50°C в течение 4 часов. После повышения температуры до комнатной температуры добавляли дистиллированную воду и смесь экстрагировали этилацетатом. Органическую фазу промывали дистиллированной водой и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат=4/6) и целевое соединение (1,96 г, 49%) получали в виде маслянистого остатка желтого цвета. (2) Получение 3-метил-1H-изохроман-1-она 3-(1-Гидроксиэтил)-2-бензофуран-1(3H)-он (1,3 г, 7,30 ммоль) и моногидрат п-толуолсульфоновой кислоты (3,46 г, 18,2 ммоль) растворяли в толуоле (50 мл) и кипятили с обратным холодильником в течение 4 часов. Добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушили безводным сульфатом натрия. Остаток очищали колоночной хроматографией на силикагеле (гексан/этилацетат= 10/0-5/5) и целевое соединение (0,64 г, 55%) получали в виде твердого вещества оранжевого цвета. (3) Получение 2-(2-оксопропил)бензойной кислоты 3-Метил-1Н-изохроман-1-он (320 мг, 2,0 ммоль) растворяли в этаноле (5 мл), добавляли 2н. водный раствор гидроксида натрия (3 мл) и перемешивали при 80°C в течение 5 часов. Этанол отгоняли при пониженном давлении, добавляли 8н. водный раствор хлористоводородной кислоты и смесь экстрагировали этилацетатом. Органическую фазу сушили безводным сульфатом натрия, концентрировали и сушили с получением целевого соединения (280 мг, 79%) в виде твердого вещества желтого цвета. (4) Получение 2-(4-метоксифенил)-3-метил-1(2H)-изохинолинона 2-(2-Оксопропил)бензойную кислоту (100 мг, 0,56 ммоль), 4-метоксианилин (76 мг, 0,56 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,84 ммоль) и пиридин (0,5 мл) растворяли в хлороформе (5 мл) и перемешивали при комнатной температуре в течение ночи. Добавляли хлороформ, органическую фазу промывали водным раствором лимонной кислоты, водным раствором гидрокарбоната натрия и насыщенным солевым раствором в указанном порядке и сушили безводным сульфатом натрия. Продукт очищали колоночной хроматографией на силикагеле (гексан/этилацетат=10/0-3/7) с получением целевого соединения (66 мг, 44%) в виде твердого вещества светло-коричневого цвета. (5) Получение 2-(4-гидроксифенил)-3-метил-1(2H)-изохинолинона 2-(4-Метоксифенил)-3-метил-1(2H)-изохинолинон (56 мг, 0,21 ммоль) растворяли в безводном метиленхлориде, медленно добавляли при -10°C раствор 1M трибромида бора в метиленхлориде (0,63 мл) и перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и метиленхлорид отгоняли при пониженном давлении. Добавляли 8н. водный раствор соляной кислоты и твердый осадок отфильтровывали и сушили с получением целевого соединения (48 мг, 91%) в виде бесцветного твердого вещества. (6) Получение 3-метил-2-{4-[3-пиперидин-1-илпропокси]фенил}-1(2H)-изохинолинона 2-(4-Гидроксифенил)-3-метил-1(2H)-изохинолинон (30 мг, 0,12 ммоль), гидробромид 1-(3-бромпропил)пиперидина (51 мг, 0,18 ммоль) и карбонат калия (49 мг, 0,36 ммоль) смешивали в диметилформамиде (3 мл) и перемешивали при 80°C в течение 3 часов. Растворитель отгоняли при пониженном давлении, добавляли дистиллированную воду и смесь экстрагировали этилацетатом. Органическую фазу сушили безводным сульфатом натрия и продукт очищали колоночной хроматографией на силикагеле (хлороформ/метанол=20/1) с получением указанного в заголовке соединения (18 мг, 40%) в виде бесцветного твердого вещества. 1H ЯМР (400 МГц, CDCl3, Пример 123 2-{4-[(1-циклобутил-4-пиперидинил)окси]фенил}-3-метил-1(2H)-изохинолинон Реакцию Мицунобу и реакцию восстановительного аминирования осуществляли в указанном порядке по способу примера 88, используя 2-(4-гидроксифенил)-3-метил-1(2H)-изохинолинон, N-(трет-бутоксикарбонил)-4-пиперидинол и циклобутанон в качестве исходных веществ, и получали, таким образом, указанное в заголовке соединение в виде бесцветного твердого вещества. Использовали 2-(4-гидроксифенил)-3-метил-1(2H)-изохинолинон, который синтезировали в примере 122-(5). 1H ЯМР (400 МГц, CDCl3, Пример 124 2-метил-3-[4-{[3-(1-пирролидинил)циклопентил]окси}фенил]-4(3H)-хиназолинон (транс изомер) (1) Получение 3-{4-[(3-гидроксициклопентил)окси]фенил}-2-метил-4(3H)-хиназолинона 3-(4-Гидроксифенил)-2-метил-4(3H)-хиназолинон (300 мг, 1,19 ммоль), 1,3-циклопентандиол (242 мг, 2,37 ммоль) и трифенилфосфин (468 мг, 1,78 ммоль) растворяли в тетрагидрофуране (3 мл), добавляли по каплям при 0°C диизопропилазодикарбоксилат (0,35 мл, 1,78 ммоль) и перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли дистиллированную воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным солевым раствором и сушили безводным сульфатом магния. Продукт очищали колоночной хроматографией на силикагеле (гексан/этилацетат=40/60-0/100) и целевое соединение (520 мг) получали в виде маслянистого остатка светло-коричневого цвета. (2) Получение 3-[4-({3-[(метилсульфонил)окси]циклопентил}окси)фенил]-2-метил-4(3H)-хиназолинона 3-{4-[(3-Гидроксициклопентил)окси]фенил}-2-метил-4(3H)-хиназолинон (520 мг, 1,19 ммоль) и триэтиламин (0,33 мл, 2,32 ммоль) смешивали в метиленхлориде и охлаждали на ледяной бане. Добавляли по каплям мезилхлорид (0,12 мл, 1,55 ммоль) и перемешивали в течение 10 минут при комнатной температуре. К реакционной смеси добавляли дистиллированную воду и смесь экстрагировали этилацетатом. Органическую фазу промывали дистиллированной водой и сушили безводным сульфатом магния. Остаток концентрировали досуха и получали, таким образом, целевое соединение (553 мг). (3) Получение 2-метил-3-[4-{[3-(1-пирролидинил)циклопентил]окси}фенил]-4(3H)-хиназолинона (транс изомер). 3-[4-({3-[(Метилсульфонил)окси]циклопентил}окси)фенил]-2-метил-4(3H)-хиназолинон (550 мг, 1,33 ммоль), пирролидин (474 мг, 6,7 ммоль) и карбонат калия (277 мг, 2,0 ммоль) смешивали в диметилформамиде (10 мл) и перемешивали при 80°C в течение ночи. Добавляли дистиллированную воду и смесь экстрагировали этилацетатом. Органическую фазу сушили безводным сульфатом магния и полученный остаток очищали колоночной хроматографией на силикагеле (хлороформ/метанол=20/1) с получением указанного в заголовке соединения (143 мг) в виде бесцветного твердого вещества. 2-метил-3-[4-{[3-(1-пирролидинил)циклопентил]окси}фенил]-4(3H)-хиназолинон (транс изомер) 1H ЯМР (400 МГц, CDCl3, Пример 125 3-{4-[3-(7-азабицикло[2.2.1]гепт-7-ил)пропокси]фенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и гидрохлорид 7-азабицикло[2.2.1]гептана в качестве исходных веществ. Гидрохлорид 7-азабицикло[2.2.1]гептана получали способом, описанным в литературе (J. Am. Chem. Soc, 2003, Vol.125, p.15191). 1H ЯМР (400 МГц, CDCl3, Пример 126 3-{4-[3-(8-азабицикло[3.2.1]окт-8-ил)пропокси]фенил}-2-метил-4(3H)-хиназолинон (1) Получение гидрохлорида 8-азабицикло[3.2.1]октана Тропан (1,0 мл, 7,44 ммоль) растворяли в толуоле (10 мл), медленно добавляли хлорэтилкарбонат (2,2 мл, 23 ммоль) и смесь перемешивали при 80°C в течение 24 часов. К реакционной смеси добавляли дистиллированную воду и смесь экстрагировали этилацетатом. Органическую фазу сушили и концентрировали безводным сульфатом магния. Полученный маслянистый остаток растворяли в концентрированной соляной кислоте (10 мл) и нагревали при перемешивании при 100°C в течение 2 часов. Растворитель отгоняли при пониженном давлении, к остатку добавляли толуол и смесь подвергали дистилляции при пониженном давлении с получением целевого соединения (820 мг, 72%) в виде бесцветного твердого вещества. (2) Получение 3-{4-[3-(8-азабицикло[3.2.1]окт-8-ил)пропокси]фенил}-2-метил-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и гидрохлорид 8-азабицикло[3.2.1]октана в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 127 3-{4-[3-(3,3-дифторпирролидин-1-ил)пропокси]фенил}-2-метил-5-(трифторметил)-4(3H)-хиназолинон трифторацетат Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и гидрохлорид 3,3-дифторпирроллидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 128 3-(4-{3-[(3R)-3-фторпирролидин-1-ил]пропокси}фенил)-2-метил-5-(трифторметил)-4(3H)-хиназолинон трифторацетат Указанное в заголовке соединение получали по способу примера 1, используя 2-амино-6-(трифторметил)бензойную кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и гидрохлорид (3R)-3-фторпирролидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 129 3-{4-[3-(4,4-дифторпиперидин-1-ил)пропокси]фенил}-2-метил-5-(трифторметил)-4(3H)-хиназолинон трифторацетат Указанное в заголовке соединение получали по способу примера 1, используя 2-амино-6-(трифторметил)бензойную кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и гидрохлорид 4,4-дифторпиперидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 130 3-{4-[3-(4-фторпиперидин-1-ил)пропокси]фенил}-2-метил-5-(трифторметил)-4-(3H)-хиназолинон трифторацетат Указанное в заголовке соединение получали по способу примера 1, используя 2-амино-6-(трифторметил)бензойную кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и гидрохлорид 4-фторпиперидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 131 3-{4-[3-(3,3-дифторпиперидин-1-ил)пропокси]фенил}-2-метил-5-(трифторметил)-4(3H)-хиназолинон трифторацетат Указанное в заголовке соединение получали по способу примера 1, используя 2-амино-6-(трифторметил)бензойную кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и гидрохлорид 3,3-дифторпиперидина в качестве исходных веществ. 1H ЯМР (400 МГц, ДМСО-d6, Пример 132 3-{4-[3-(3-фторпиперидин-1-ил)пропокси]фенил}-2-метил-5-(трифторметил)-4(3H)-хиназолинон трифторацетат (рацемическая смесь) Указанное в заголовке соединение получали по способу примера 1, используя 2-амино-5-(трифторметил)бензойную кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и гидрохлорид 3-фторпиперидина в качестве исходных веществ. 1H ЯМР (400 МГц, ДМСО-d6, Пример 133 2-метил-3-(4-{3-[(3R)-3-метилпиперидин-1-ил]пропокси)фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и (3R)-3-метилпиперидин (R)-(-)-манделат в качестве исходных веществ. (3R)-3-Метилпиперидин (R)-(-)-манделат получали способом, описанным в литературе (J. Org. Chem. 1987, Vol.52, p.5466). 1H ЯМР (400 МГц, CDCl3, Пример 134 3-(4-{3-[(2R,5R)-2,5-диметилпирролидин-1-ил]пропокси}фенил)-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и (2R,5R)-2,5-диметилпирролидин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 135 2-метил-3-(4-{3-[3-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон (рацемическая смесь) Указанное в заголовке соединение получали по способу примера 1, используя антраниловую кислоту, уксусный ангидрид, 4-аминофенол, 1,3-бромхлорпропан и 3-метилпирролидин в качестве исходных веществ. 3-метилпирролидин получали способом, описанным в литературе (J. Med. Chem., 2000, Vol.43, p.4388). 1H ЯМР (400 МГц, CDCl3, Пример 136 5-метокси-3-[4-(3-пиперидин-1-илпропокси)фенил]-2-пропил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-метоксибензойную кислоту, масляный ангидрид и 4-(3-пиперидин-1-илпропокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 137 5-метокси-2-пропил-3-[4-(3-пирролидин-1-илпропокси)фенил]-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-метоксибензойную кислоту, масляный ангидрид и 4-(3-пирролидин-1-илпропокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 138 2-метил-3-(4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон (1) Получение 3-[(2S)-2-метилпирролидин-1-ил]пропан-1-ола Гидробромид (2S)-2-метилпирролидина (2,70 г, 16,3 ммоль), 3-бромпропанол (2,49 г, 17,9 ммоль) и карбонат калия (6,75 г, 48,9 ммоль) смешивали в тетрагидрофуране (20 мл) и перемешивали при 60°C в течение 18 часов. Осадок отфильтровывали и фильтрат концентрировали. Остаток дистиллировали при пониженном давлении и получали, таким образом, целевое соединение (1,88 г, 80%) в виде бесцветного маслянистого вещества. Гидробромид (2S)-2-метилпирролидина получали способом, описанным в литературе (J. Org. Chem., 1989, Vol.54, p.209), используя D-пролинол в качестве исходного вещества. (2) Получение (2S)-2-метил-1-[3-(4-нитрофенокси)пропил]пирролидина Целевое соединение получали по способу примера 18, используя 3-[(2S)-2-метилпирролидин-1-ил]пропанол и 4-нитрофенол в качестве исходных веществ. (3) Получение 4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}анилина Целевое соединение получали каталитическим восстановлением (2S)-2-метил-1-[3-(4-нитрофенокси)пропил]пирролидина в метаноле с использованием катализатора палладия на активированном угле. (4) Получение 2-метил-3-(4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 18, используя антраниловую кислоту, уксусный ангидрид и 4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Данные ЯМР для 4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}анилина, используемого для получения соединения данного примера, представлены ниже. 1H ЯМР (400 МГц, CDCl3, Пример 139 2,5-диметил-3-(4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-метилбензойную кислоту, уксусный ангидрид и 4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 140 2,6-диметил-3-(4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-5-метилбензойную кислоту, уксусный ангидрид и 4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 141 2-этил-3-(4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя антраниловую кислоту, пропионовый ангидрид и 4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 142 6-хлор-2-этил-3-(4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 5-амино-2-хлоризоникотиновую кислоту, пропионовый ангидрид и 4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 143 6-метокси-2-метил-3-[4-(3-пирролидин-1-илпропокси)фенил]-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-5-метоксибензойную кислоту, уксусный ангидрид и 4-(3-пирролидин-1-илпропокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 144 6-метокси-2-метил-3-(4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 102-106°C) по способу примера 18, используя 2-амино-5-метоксибензойную кислоту, уксусный ангидрид и 4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}анилин в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 145 2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон (1) Получение 3-[(3S)-3-метилпиперидин-1-ил]пропан-1-ола (3S)-3-Метилпиперидин/(S)-(+)-манделат (19,9 г, 79,1 ммоль), 3-бром-1-пропанол (10 г, 71,9 ммоль) и карбонат калия (14,9 г, 108 ммоль) смешивали в тетрагидрофуране (200 мл) и кипятили с обратным холодильником в течение 30 часов. Нерастворимые вещества отфильтровывали, фильтрат концентрировали и к остатку добавляли этилацетат и гексан. Образовавшиеся нерастворимые вещества отфильтровывали, фильтрат концентрировали и целевое соединение (9,6 г, 85%) получали в виде бесцветного маслянистого вещества дистилляцией при пониженном давлении. (3S)-3-Метилпиперидин (S)-(+)-манделат получали способом, описанным в литературе (J. Org. Chem., 1987, Vol.52, p.5466). (2) Получение 4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}анилинмонотозилата 4-{3-[(3S)-3-Метилпиперидин-1-ил]пропокси}анилин получали в виде маслянистого вещества светло-коричневого цвета по способу примера 18, используя 4-нитрофенол и 3-[(3S)-3-метилпиперидин-1-ил]пропан-1-ол в качестве исходных веществ. Полученное маслянистое вещество растворяли в этилацетате, добавляли 1 экв. раствора моногидрата п-толуолсульфоновой кислоты в метаноле и целевое соединение получали в виде твердого вещества светло-персикового цвета отфильтровыванием образованного твердого вещества. (3) Получение 2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 18, используя антраниловую кислоту, уксусный ангидрид и 4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Данные ЯМР для 4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}анилинмонотозилата, используемого для получения соединения данного примера, представлены ниже. 1H ЯМР (400 МГц, CDCl3/CD3OD=10/1, Пример 146 5-бром-2-метил-3-[4-(3-пирролидин-1-илпропокси)фенил]-4(3H)-хиназолинон (1) Получение 2-амино-6-бромбензойной кислоты Целевое соединение получали восстановлением 2-бром-6-нитробензойной кислоты железом в смеси растворителей метанола и водного раствора хлорида аммония. 2-Бром-6-нитробензойную кислоту получали способом, описанным в литературе (J. Chem. Soc. Perkin Trans. 1, 1991, p.1565), используя 2-бром-6-нитротолуол в качестве исходного вещества. (2) Получение 5-бром-2-метил-3-[4-(3-пирролидин-1-илпропокси)фенил]-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-бромбензойную кислоту, уксусный ангидрид и 4-(3-пирролидин-1-илпропокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 147 5-фтор-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-фторбензойную кислоту, уксусный ангидрид и 4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 148 2-этил-5-фтор-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-фторбензойную кислоту, пропионовый ангидрид и 4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 149 6-фтор-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 5-амино-2-фторизоникотиновую кислоту, уксусный ангидрид и 4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 5-Амино-2-фторизоникотиновую кислоту получали способом, описанным в литературе (J. Chem. Soc. Perkin Trans. 1, 1996, p.2221). 1H ЯМР (400 МГц, CDCl3, Пример 150 2-этил-6-фтор-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 5-амино-2-фторизоникотиновую кислоту, пропионовый ангидрид и 4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 151 6-хлор-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 5-амино-2-хлоризоникотиновую кислоту, уксусный ангидрид и 4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 152 6-хлор-2-этил-3-(4-{3-[(3S)-3-метил-пиперидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 18, используя 5-амино-2-хлоризоникотиновую кислоту, пропионовый ангидрид и 4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 153 Моногидрохлорид 2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[2,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 255-262°C) по способу примера 18, используя 2-аминоникотиновую кислоту, уксусный ангидрид и 4-{3-[(3S)-3-метилпиридин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ, и обработкой 1 экв. основания (4н. этилацетатный раствор), с последующей перекристаллизацией (этанол/этилацетат). 1H ЯМР (400 МГц, CDCl3/CD3OD=10/1, Пример 154 Моногидрохлорид 2-этил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[2,3-d]пиримидин-4(3H)-она Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 245-252°C) по способу примера 18, используя 2-аминоникотиновую кислоту, пропионовый ангидрид и 4-{3-[(3S)-3-метилпиридин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ, и обработкой 1 экв. основания (4н. этилацетатный раствор), с последующей перекристаллизацией (этанол/этилацетат). 1H ЯМР (400 МГц, CDCl3/CD3OD=10/1, Пример 155 2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[4,3-d]пиримидин-4(3H)-он монотозилат Указанное в заголовке соединение синтезировали в виде твердого вещества светло-желтого цвета (т.пл.: 185-188°C) по способу примера 18, используя 4-аминоникотиновую кислоту, уксусный ангидрид и 4-{3-[(3S)-3- метилпиридин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ, и обработкой 1 экв. п-толуолсульфоновой кислоты с последующей перекристаллизацией (этанол/этилацетат). 1H ЯМР (400 МГц, CDCl3/CD3OD=10/1, Пример 156 Гидрохлорид 2-этил-5-метокси-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-метоксибензойную кислоту, пропионовый ангидрид и 4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 157 2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали каталитическим восстановлением 6-хлор-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-она, синтезированого в примере 151, используя катализатор палладий на активированном угле, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 158 2-этил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали каталитическим восстановлением 6-хлор-2-этил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[3)4-d]пиримидин-4(3H)-она, синтезированного в примере 152, используя катализатор палладий на активированном угле, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 159 Гидрохлорид 8-фтор-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-3-фторбензойную кислоту, уксусный ангидрид и 4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3/CD3OD=10/1, Пример 160 Гидрохлорид 8-фтор-2-метил-3-{4-[3-пирролидин-1-илпропокси]фенил}-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-3-фторбензойную кислоту, уксусный ангидрид и 4-(3-пирролидин-1-илпропокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3/CD3OD=10/1, Пример 161 6-(2-фторэтокси)-2-метил-3-[4-(3-пиперидин-1-илпропокси)фенил]-4(3H)-хиназолинон Указанное в заголовке соединение получали деметилированием и алкилированием 6-метокси-2-метил-3-[4-(3-пиперидин-1-илпропокси)фенил]-4(3H)-хиназолинона и 2-фторэтилтозилата в качестве исходных веществ, по способу примера 192. Использовали 6-метокси-2-метил-3-[4-(3-пиперидин-1-илпропокси)фенил]-4(3H)-хиназолинон, который синтезировали в примере 36. 1H ЯМР (400 МГц, CDCl3, Пример 162 6-(2-фторэтокси)-2-метил-3-[4-(3-пирролидин-1-илпропокси)фенил]-4(3H)-хиназолинон Указанное в заголовке соединение получали деметилированием и алкилированием 6-метокси-2-метил-3-[4-(3-пирролидин-1-илпропокси)фенил]-4(3H)-хиназолинона, синтезированного в примере 143, по способу примера 192. 1H ЯМР (400 МГц, CDCl3, Пример 163 5-метокси-2-метил-3-[4-(3-пирролидин-1-илпропокси)фенил]-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-метоксибензойную кислоту, уксусный ангидрид и 4-(3-пирролидин-1-илпропокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 164 5-метокси-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси)фенил)-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 144-146°C) по способу примера 18, используя 2-амино-6-метоксибензойную кислоту, уксусный ангидрид и 4-{3-[(3S)-3-метилпиридин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир/н-гептан). 1H ЯМР (400 МГц, CDCl3, Пример 165 6-метокси-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси)фенил)-4(3H)-хиназолинон (1) Получение 6-метокси-2-метил-4H-3,1-бензоксазин-4-она Целевое соединение получали по способу примера 1-(l), используя 2-амино-5-метоксибензойную кислоту и уксусный ангидрид в качестве исходных веществ. (2) Получение 6-метокси-2-метил-3-[4-(3-пирролидин-1-ил пропокси)фенил]-4(3H)-хиназолинона 6-Метокси-2-метил-4H-3,1-бензоксазон-4-он (80 мг, 0,42 ммоль) и 4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}анилинмонотозилат (176 мг, 0,42 ммоль) растворяли в уксусной кислоте (2 мл) и перемешивали при комнатной температуре в течение 20 часов. Уксусную кислоту отгоняли при пониженном давлении, добавляли этилацетат и 1н. водный раствор гидроксида натрия, смесь экстрагировали этилацетатом и сушили безводным сульфатом натрия. После очистки колоночной хроматографией на силикагеле (хлороформ/метанол=20/1) в результате перекристаллизации получали указанное в заголовке соединение (110 мг, 62%) в виде бесцветных кристаллов (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 166 6-(дифторметокси)-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 253, используя 3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси)фенил)-4(3H)-хиназолинон, синтезированный в примере 165, и хлордифторацетат натрия в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 167 5-(дифторметокси)-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 253, используя 5-метокси-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон и хлордифторацетат натрия в качестве исходных веществ. Использовали 5-метокси-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси)фенил)-4(3H)-хиназолинон, который синтезировали в примере 164. 1H ЯМР (400 МГц, CDCl3, Пример 168 7-метокси-2-метил-3-[4-(3-пирролидин-1-илпропокси)фенил]-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-4-метоксибензойную кислоту, уксусный ангидрид и 4-(3-пирролидин-1-илпропокси)анилин в качестве исходных веществ. 2-Амино-4-метоксибензойную кислоту получали способом, описанным в литературе (J. Chem. Soc. Perkin Trans. 1, 1997, p.3261). 1H ЯМР (400 МГц, CDCl3, Пример 169 7-метокси-2-метил-3-[4-(3-пиперидин-1-илпропокси)фенил]-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-4-метоксибензойную кислоту, уксусный ангидрид и моногидрохлорид 4-(3-пиперидин-1-илпропокси)анилина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 170 7-метокси-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества светло-желтого цвета (т.пл.: 94-96°C) по способу примера 165, используя 2-амино-4-метоксибензойную кислоту, уксусный ангидрид и 4-{3-[(3S)-3-метилпиридин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 171 5-метокси-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон (1) Получение 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилата 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилин получали в виде маслянистого вещества светло-коричневого цвета по способу примера 138, используя гидробромид (2R)-2-метилпирролидина, 3-бромпропанол и 4-нитрофенол в качестве исходных веществ. Полученное маслянистое вещество растворяли в этилацетате, добавляли 1 экв. раствора моногидрата п-толуолсульфоновой кислоты в метаноле и целевое соединение получали в виде бесцветного твердого вещества отфильтровыванием образованного твердого вещества. Гидробромид (2R)-2-метилпирролидина получали способом, описанным в литературе (J. Org. Chem., 1989, Vol.54, p.209), используя L-пролинол в качестве исходного вещества. (2) Получение 5-метокси-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-6-метоксибензойную кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Данные ЯМР для 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилата, используемого для получения соединения данного примера, представлены ниже. 1H ЯМР (400 МГц, CDCl3/CD3OD=5/1, Пример 172 6-метокси-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 106-108°C) по способу примера 165, используя 2-амино-5-метоксибензойную кислоту, уксусный ангидрид и 4-{3-[(2R)-3-метилпиридин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 173 7-метокси-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-4-метоксибензойную кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 174 3-[4-(3-азепан-1-илпропокси)фенил]-2,6-диметил-4(3H)-хиназолинон (1) Получение 4-(3-азепан-1-илпропокси)анилина Целевое соединение получали по способу примера 138, используя азепан, 3-бромпропанол и 4-нитрофенол в качестве исходных веществ. (2) Получение 3-[4-(3-азепан-1-илпропокси)фенил]-2,6-диметил-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-5-метилбензойную кислоту, уксусный ангидрид и 4-(3-азепан-1-илпропокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 175 3-[4-(3-азепан-1-илпропокси)фенил]-5-фтор-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-6-фторбензойную кислоту, уксусный ангидрид и 4-(3-азепан-1-илпропокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 176 3-[4-(3-азепан-1-илпропокси)фенил]-7-фтор-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-4-фторбензойную кислоту, уксусный ангидрид и 4-(3-азепан-1-илпропокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 177 3-[4-(3-азепан-1-илпропокси)фенил]-5-метокси-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-6-метоксибензойную кислоту, уксусный ангидрид и 4-(3-азепан-1-илпропокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 178 3-[4-(3-азепан-1-илпропокси)фенил]-6-метокси-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-5-метоксибензойную кислоту, уксусный ангидрид и 4-(3-азепан-1-илпропокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 179 2,7-диметил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропоксифенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали в виде белых кристаллов по способу примера 165, используя 2-амино-6-метоксибензойную кислоту, уксусный ангидрид и 4-{3-[(3S)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ, и обработкой с использованием 1 экв. раствора 4н. хлористоводородной кислоты в этилацетате с последующей перекристаллизацией (из этанола/этилацетата). 1H ЯМР (400 МГц, CDCl3/CD3OD=10/1, Пример 180 3-[4-(3-азепан-1-илпропокси)фенил]-2-метилпиридо[4,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 165, используя 4-аминоникотиновую кислоту, уксусный ангидрид и 4-(3-азепан-1-илпропокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 181 2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя антраниловую кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 182 2,5-диметил-3-[2-метокси-4-[3-(1-пиперидинил)пропокси]фенил]-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 63, используя 2-амино-6-метилбензойную кислоту, уксусный ангидрид, 4-амино-3-метоксифенол и гидробромид 1-(3-бромпропил)пиперидина в качестве исходных веществ. 4-Амино-3-метоксифенол получали способом, описанным в литературе (J. Med. Chem., 1995, Vol.38, p.2748). 1H ЯМР (400 МГц, CDCl3, Пример 183 2,5-диметил-3-{2-метокси-4-[3-пирролидин-1-илпропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 63, используя 2-амино-6-метилбензойную кислоту, уксусный ангидрид, 4-амино-3-метоксифенол и гидробромид 1-(3-бромфенил)пирролидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 184 6-хлор-3-[2-метокси-4-(3-пиперидин-1-илпропокси)фенил]-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 63, используя 5-амино-2-хлоризоникотиновую кислоту, уксусный ангидрид, 4-амино-3-метоксифенол и гидробромид 1-(3-бромпропил)пиперидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 185 6-хлор-3-{2-метокси-4-[3-пирролидин-1-илпропокси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 63, используя 5-амино-2-хлоризоникотиновую кислоту, уксусный ангидрид, 4-амино-3-метоксифенол и гидробромид 1-(3-бромпропил)пирролидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 186 6-фтор-3-[2-метокси-4-(3-пиперидин-1-илпропокси)фенил]-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 63, используя 5-амино-2-фторизоникотиновую кислоту, уксусный ангидрид, 4-амино-3-метоксифенол и гидробромид 1-(3-бромпропил)пиперидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 187 6-фтор-3-{2-метокси-4-[3-пирролидин-1-илпропокси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 63, используя 5-амино-2-фторизоникотиновую кислоту, уксусный ангидрид, 4-амино-3-метоксифенол и гидробромид 1-(3-бромпропил)пирролидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 188 3-[2-метокси-4-(3-пиперидин-1-илпропокси)фенил]-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали каталитическим восстановлением 6-хлор-3-[2-метокси-4-(3-пиперидин-1-илпропокси)фенил]-2-метилпиридо[3,4-d]пиримидин-4(3H)-она, синтезированного в примере 184, используя катализатор палладий на активированном угле, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 189 3-{2-метокси-4-[3-пирролидин-1-илпропокси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали каталитическим восстановлением 6-хлор-3-{2-метокси-4-[3-пирролидин-1-илпропокси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-она, синтезированного в примере 185, используя катализатор палладий на активированном угле, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 190 3-[2-метокси-4-(3-пиперидин-1-илпропокси)фенил]-2-метилпиридо[4,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 63, используя 4-аминоникотиновую кислоту, уксусный ангидрид, 4-амино-3-метоксифенол и гидробромид 1-(3-бромпропил)пиперидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 191 3-{3-бром-4-[3-пирролидин-1-илпропокси]фенил}-2-метил-5-(трифторметил)-4(3H)-хиназолинон (1) Получение 4-амино-2-бромфенола Целевое соединение получали восстановлением 2-бром-4-нитрофенола железом в смешанном растворе метанола и водного раствора хлорида аммония. 2-Бром-4-нитрофенол получали способом, описанным в литературе (J. Org. Chem., Vol.62, 1997, p.4504). (2) Получение 3-{3-бром-4-[3-пирролидин-1-илпропокси]фенил}-2-метил-5-(трифторметил)-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 63, используя 2-амино-6-(трифторметил)бензойную кислоту, уксусный ангидрид, 4-амино-2-бромфенол и гидробромид 1-(3-бромпропил)пирролидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 192 6-хлор-3-[2-фторэтокси-4-(3-пиперидин-1-илпропокси)фенил]-2-метилпиридо[3,4-d]пиримидин-4(3H)-он (1) Получение 6-хлор-3-[2-гидрокси-4-(3-пиперидин-1-илпропокси)фенил]-2-метилпиридо[3,4-d]пиримидин-4(3H)-она 6-Хлор-3-[2-метокси-4-(3-пиперидин-1-илпропокси)фенил]-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, синтезированный в примере 3-3 (143 мг, 0,32 ммоль), растворяли в метиленхлориде (3 мл), добавляли трибромид бора (1M раствор в метиленхлориде, 3,2 ммоль) на ледяной бане, перемешивали при комнатной температуре в течение 15 часов и при 40°C в течение 3 часов. Для остановки реакции добавляли насыщенную углекислотой воду, смесь экстрагировали этилацетатом и сушили безводным сульфатом натрия. Продукт очищали колоночной хроматографией на силикагеле (хлороформ/метанол=20/1) и целевое соединение (49 мг, 35%) получали в виде твердого вещества светло-желтого цвета. 1H ЯМР (400 МГц, CDCl3, (2) Получение 6-хлор-3-[2-фторэтокси-4-(3-пиперидин-1-илпропокси)фенил]-2-метилпиридо[3,4-d]пиримидин-4(3H)-она 6-Хлор-3-[2-гидрокси-4-(3-пиперидин-1-илпропокси)фенил]-2-метилпиридо[3,4-d]-пиримидин-4(3H)-он (10 мг), 2-фторэтилтозилат (7,6 мг) и карбонат калия (16 мг) смешивали в диметилформамиде (2 мл) и перемешивали при 80°C в течение 10 часов. Добавляли дистиллированную воду, смесь экстрагировали этилацетатом и сушили безводным сульфатом натрия. Продукт очищали тонкослойной хроматографией на силикагеле (хлороформ/метанол=10/1) и указанное в заголовке соединение (8,5 мг, 77%) получали в виде бесцветного твердого вещества. 1H ЯМР (400 МГц, CDCl3, Пример 193 2,5-диметил-3-[2-гидрокси-4-(3-пиперидин-1-илпропокси)фенил]-4(3H)-хиназолинон 2,5-Диметил-3-{2-метокси-4-[3-пирролидин-1-илпропокси]фенил}-4(3H)-хиназолинон, синтезированный в примере 182, деметилировали, используя способ примера 192-(1), и получали, таким образом, указанное в заголовке соединение. 1H ЯМР (400 МГц, CDCl3, Пример 194 2,5-диметил-3-{2-фторэтокси-4-[3-пиперидин-1-илпропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 192-(2) используя 2,5-диметил-3-{2-гидрокси-4-[3-пирролидин-1-илпропокси]фенил}-4(3H)-хиназолинон и 2-фторэтил тозилат в качестве исходных веществ. Использовали 2,5-диметил-3-{2-гидрокси-4-[3-пирролидин-1-илпропокси]фенил}-4(3H) хиназолинон, который синтезировали в примере 193. 1H ЯМР (400 МГц, CDCl3, Пример 195 3-{2-фторэтокси-4-[3-пиперидин-1-илпропокси]фенил}-2-метилпиридо[3,4-d]-пиримидин-4(3H)-он Указанное в заголовке соединение получали каталитическим восстановлением 6-хлор-3-{2-фторэтокси-[3-пиперидин-1-илпропокси]фенил}-2-метилпиридо[3,4-d]пиримидин-(3H)-она, синтезированного в примере 192, используя катализатор палладий на активированном угле, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 196 3-{2-фторэтокси-4-[3-пиперидин-1-илпропокси]фенил}-2-метилпиридо[4,3-d]пиримидин-(3H)-он Указанное в заголовке соединение получали по способу примера 192, используя 3-{2-метокси-4-[3-пиперидин-1-илпропокси]фенил}-2-метилпиридо[4,3-d]пиримидин-4(3H)-он и 2-фторэтилтозилат в качестве исходных веществ. Использовали 3-{2-метокси-4-[3-пиперидин-1-илпропокси]фенил}-2-метилпиридо[4,3-d]пиримидин-4(3H)-он, который синтезировали в примере 190. 1H ЯМР (400 МГц, CDCl3, Пример 197 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он (1) Получение 6-хлор-3-(4-гидроксифенил)-2-метилпиридо[3,4-d]пиримидин-4(3H)-она Целевое соединение получали по способу примера 1-(1) и -(2), используя 5-амино-2-хлоризоникотиновую кислоту, уксусный ангидрид и 4-аминофенол в качестве исходных веществ. (2) Получение 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-она 6-Хлор-3-(4-гидроксифенил)-2-метилпиридо[3,4-d]пиримидин-4(3H)-он (300 мг, 1,04 ммоль) растворяли в безводном метаноле (15 мл) в потоке азота, добавляли метоксид натрия (7 ммоль) и смесь кипятили с обратным холодильником в течение 20 часов. Смесь оставляли для охлаждения, затем добавляли уксусную кислоту и растворитель отгоняли при пониженном давлении. К остатку добавляли дистиллированную воду, твердый осадок отфильтровывали и получали, таким образом, указанное в заголовке соединение (259 мг, 88%) в виде твердого вещества цвета лаванды. 1H ЯМР (400 МГц, CDCl3/CD3OD=5/1, Пример 198 2-этил-3-(4-гидроксифенил)-6-метоксипиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 197, используя 5-амино-2-хлоризоникотиновую кислоту, пропионовый ангидрид, 4-аминофенол и метоксид натрия в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3/CD3OD=5/1, Пример 199 6-метокси-2-метил-3-[4-(3-пиперидин-1-илпропокси)фенил]пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 145-147°C) по способу примера 63, используя 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он и гидробромид 1-(3-бромпропил)пиридина в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). Использовали 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, который синтезировали в примере 197. 1H ЯМР (400 МГц, CDCl3, Пример 200 6-метокси-2-метил-3-[4-(3-пирролидин-1-илпропокси)фенил]пиридо[3,4-d]-пиримидин-4(3H)-он Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 123-126°C) по способу примера 63, используя 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он и гидробромид 1-(3-бромпропил)пирролидина в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). Использовали 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, который синтезировали в примере 197. 1H ЯМР (400 МГц, CDCl3, Пример 201 2-этил-6-метокси-3-{4-[3-пиперидин-1-илпропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 63, используя 2-этил-3-(4-гидроксифенил)-6-метоксипиридо[3,4-d]пиримидин-4(3H)-он и гидробромид 1-(3-бромпропил)пиперидина в качестве исходных веществ. Использовали 2-этил-3-(4-гидроксифенил)-6-метоксипиридо[3,4-d]пиримидин-4(3Н)-он, который синтезировали в примере 198. 1H ЯМР (400 МГц, CDCl3, Пример 202 2-этил-6-метокси-3-{4-[3-пирролидин-1-илпропокси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 63, используя 2-этил 3-(4-гидроксифенил)-6-метоксипиридо[3,4-d]пиримидин-4(3H)-он и гидробромид 1-(3-бромпропил)пирролидина в качестве исходных веществ. Использовали 2-этил 3-(4-гидроксифенил)-6-метоксипиридо[3,4-d]пиримидин-4(3H)-он, который синтезировали в примере 198. 1H ЯМР (400 МГц, CDCl3, Пример 203 6-метокси-3-{2-метокси-4-[3-пирролидин-1-илпропокси]фенил|-2-метилпиридо[3,4-d]пиримидин-4(3H)-он (1) Получение 3-(4-гидрокси-2-метоксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-она Целевое соединение получали по способу примера 197, используя 5-амино-2-хлоризоникотиновую кислоту, уксусный ангидрид, 4-амино-3-метоксифенол и метоксид натрия в качестве исходных веществ. (2) Получение 6-метокси-3-{2-метокси-4-[3-пирролидин-1-илпропокси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-она Указанное в заголовке соединение получали по способу примера 63, используя 3-(4-гидрокси-2-метоксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он и гидробромид 1-(3-бромпропил)пирролидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 204 6-бром-3-{2-фторэтокси-4-[3-пирролидин-1-илпропокси]фенил}-2-метил-4(3H)-хиназолинон (1) Получение 6-бром-3-{2-метокси-4-[3-пирролидин-1-илпропокси]фенил}-2-метил-4(3H)-хиназолинона Целевое соединение получали по способу примера 63, используя 2-амино-5-бромбензойную кислоту, уксусный ангидрид, 4-амино-3-метоксифенол и гидробромид 1-(3-бромпропил)пирролидина в качестве исходных веществ. (2) Получение 6-бром-3-{2-фторэтокси-4-[3-пирролидин-1-илпропокси]фенил}-2-метил-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 192, используя 6-бром-3-{2-метокси-4-[3-пирролидин-1-илпропокси]фенил}-2-метил-4(3H)-хиназолинон и 2-фторэтилтозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 205 6-этоксикарбонил-3-{2-фторэтокси-4-[3-пирролидин-1-илпропокси]фенил}-2-метил-4(3H)-хиназолинон 6-Бром-3-{2-фторэтокси-4-[3-пирролидин-1-илпропокси]фенил}-2-метил-4(3H)-хиназолинон (37 мг), ацетат палладия(II) (2 мг), dppf(1,1′-бис(дифенилфосфино)ферроцен) (8,2 мг) и триэтиламин (22 мг) смешивали в этаноле (5 мл) и атмосферу в системе заменяли на оксид углерода. Смесь затем кипятили с обратным холодильником в атмосфере оксида углерода в течение 2 дней. К жидкой реакционной смеси добавляли этилацетат и твердый осадок отфильтровывали. Фильтрат концентрировали, очищали тонкослойной хроматографией на силикагеле (хлороформ/метанол=10/1) и получали, таким образом, указанное в заголовке соединение (23 мг, 63%) в виде твердого вещества светло-серого цвета. Использовали 6-бром-3-{2-фторэтокси-4-[3-пирролидин-1-илпропокси]фенил}-2-метил-4(3H)-хиназолинон, который синтезировали в примере 204. 1H ЯМР (400 МГц, CDCl3, Пример 206 3-{2-фторэтокси-4-[3-пирролидин-1-илпропокси]фенил}-6-метоксикарбонил-2-метил 4(3H)-хиназолинон 6-Этоксикарбонил-3-{2-фторэтокси-4-[3-пирролидин-1-илпропокси]фенил}-2-метил-4(3H)-хиназолинон, синтезированный в примере 205, обрабатывали метоксидом натрия в безводном метаноле и получали, таким образом, указанное в заголовке соединение. 1H ЯМР (400 МГц, CDCl3, Пример 207 3-{3-фтор-4-[3-пиперидин-1-илпропокси]фенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 63, используя антраниловую кислоту, уксусный ангидрид, 4-амино-2-фторфенол и гидробромид 1-(3-бромпропил)пиперидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 208 3-{2-фтор-4-[3-пиперидин-1-илпропокси]фенил}-2-метил 4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 63, используя антраниловую кислоту, уксусный ангидрид, 4-амино-3-фторфенол и гидробромид 1-(3-бромпропил)пиперидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 209 2-метил-3-{3-метил-4-[3-пиперидин-1-илпропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 63, используя антраниловую кислоту, уксусный ангидрид, 4-амино-2-метилфенол и гидробромид 1-(3-бромпропил)пиперидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 210 2-метил-3-{2-метил-4-[3-пиперидин-1-илпропокси]фенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 63, используя антраниловую кислоту, уксусный ангидрид, 4-амино-3-метилфенол и гидробромид 1-(3-бромпропил)пиперидина в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 211 3-{4-[(1-циклобутилпиперидин-4-ил)окси]-2-метоксифенил}-2,5-диметил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 88, используя 2-амино-6-метилбензойную кислоту, уксусный ангидрид, 4-амино-3-метоксифенол, трет-бутил-4-гидроксипиперидин 1-карбоксилат и циклобутанон в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 212 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-метокси-2-метилпиридо[3,4-d]-пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 88, используя 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, трет-бутил-4-гидрокси пиперидин-1-карбоксилат и циклобутанон в качестве исходных веществ. Использовали 6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, который синтезировали в примере 197. 1H ЯМР (400 МГц, CDCl3, Пример 213 3-{4-[(1-циклопентилпиперидин-4-ил)окси]фенил}-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 88, используя 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, трет-бутил-4-гидрокси пиперидин-1-карбоксилат и циклопентанон в качестве исходных веществ. Использовали 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, который синтезировали в примере 197. 1H ЯМР (400 МГц, CDCl3, Пример 214 6-хлор-3-{4-[(1-циклобутилпиперидин-4-ил)окси]-2-метоксифенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 88, используя 5-амино-2-хлоризоникотиновую кислоту, уксусный ангидрид, 4-амино-3-метоксифенол и трет-бутил-4-гидроксипиперидин-1-карбоксилат и циклобутанон в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 215 3-{4-[(1-циклобутилпиперидин-4-ил)окси]-2-метоксифенил}-2-метилпиридо[4,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 88, используя 4-аминоникотиновую кислоту, уксусный ангидрид, 4-амино-3-метоксифенол, трет-бутил-4-гидроксипиперидин-1-карбоксилат и циклобутанон в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 216 3-{4-[(1-циклобутилпиперидин-4-ил)окси]-3-фторфенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 88, используя антраниловую кислоту, уксусный ангидрид, 4-амино-2-фторфенол, трет-бутил-4-гидроксипиперидин-1-карбоксилат и циклобутанон в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 217 3-{4-[(1-циклопентилпиперидин-4-ил)окси]-3-фторфенил}-2-метил 4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 88, используя антраниловую кислоту, уксусный ангидрид, 4-амино-2-фторфенол, трет-бутил-4-гидроксипиперидин-1-карбоксилат и циклопентанон в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 218 3-{4-[(1-циклобутилпиперидин-4-ил)окси]-2-фторфенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 88, используя антраниловую кислоту, уксусный ангидрид, 4-амино-3-фторфенол, трет-бутил-4-гидроксипиперидин-1-карбоксилат и циклобутанон в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 219 3-{4-[(1-циклопентилпиперидин-4-ил)окси]-2-фторфенил}-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 88, используя антраниловую кислоту, уксусный ангидрид, 4-амино-3-фторфенол, трет-бутил-4-гидроксипиперидин-1-карбоксилат и циклопентанон в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 220 Гидрохлорид 2-метил-3-{4-[(1-циклобутилпиперидин-4-ил)окси]-2-метилфенил}-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 88, используя антраниловую кислоту, уксусный ангидрид, 4-амино-3-метилфенол, трет-бутил-4-гидроксипиперидин-1-карбоксилат и циклобутанон в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 221 2-метил-3-{4-[(1-циклопентилпиперидин-4-ил)окси]-2-метилфенил}-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 88, используя антраниловую кислоту, уксусный ангидрид, 4-амино-3-метилфенол, трет-бутил-4-гидроксипиперидин-1-карбоксилат и циклопентанон в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 222 3-{4-[(1-циклопентилпиперидин-4-ил)окси]-2-(2-фторэтокси)фенил}-2-метилпиридо[4,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 192, используя 3-{4-[(1-циклобутилпиперидин-4-ил)окси]-2-метоксифенил}-2-метилпиридо[4,3-d]пиримидин-4(3H)-он и 2-фторэтилтозилат в качестве исходных веществ. Использовали 3-{4-[(1-циклобутилпиперидин-4-ил)окси]-2-метоксифенил}-2-метилпиридо[4,3-d]пиримидин-4(3H)-он, который синтезировали в примере 221. 1H ЯМР (400 МГц, CDCl3, Пример 223 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-5-фторэтокси-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 192, используя 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-5-метокси-2-метил-4(3H)-хиназолинон и 2-фторэтилтозилат в качестве исходных веществ. Использовали 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-5-метокси-2-метил-4(3H)-хиназолинон, который синтезировали в примере 105. 1H ЯМР (400 МГц, CDCl3, Пример 224 6-хлор-3-{4-[(1-циклобутилпиперидин-4-ил)окси]-2-(2-фторэтокси)фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 192, используя 6-хлор-3-{4-[(1-циклобутилпиперидин-4-ил)окси]-2-метоксифенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он и 2-фторэтилтозилат в качестве исходных веществ. Использовали 6-хлор-3-{4-[(1-циклобутилпиперидин-4-ил)окси]-2-метоксифенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, который синтезировали в примере 220. 1H ЯМР (400 МГц, CDCl3, Пример 225 3-{4-[(1-циклобутилпиперидин-4-ил)окси]-2-(2-фторэтоксифенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали каталитическим восстановлением 6-хлор-3-{4-[(1-циклобутилпиперидин-4-ил)окси]-2-(2-фторэтокси)фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-она, синтезированного в примере 230, используя палладий на активированном угле в качестве катализатора, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 226 3-{2-[(1-циклобутилпиперидин-4-ил)окси]пиримидин-5-ил}-2-метил-5-(трифторметил)-4(3H)-хиназолинон (1) Получение трет-бутил-4-[(5-нитропиримидин-2-ил)окси]пиперидин-1-карбоксилата 2-Хлор-5-нитропиримидин (80 мг, 0,5 ммоль), трет-бутил-4-гидроксипиперидин-1-карбоксилат (100 мг, 0,5 ммоль) и фторид цезия (114 мг, 0,75 ммоль) смешивали в диметилформамиде и перемешивали при комнатной температуре в течение 12 часов. Растворитель отгоняли при пониженном давлении, продукт очищали колоночной хроматографией на силикагеле (гексан/этилацетат =10/0-3/7) и получали, таким образом, целевое соединение (61 мг, 38%) в виде твердого вещества светло-желтого цвета. (2) Получение трет-бутил-4-[(5-аминопиримидин-2-ил)окси]пиперидин-1-карбоксилата трет-Бутил-4-[(5-нитропиримидин-2-ил)окси]пиперидин-1-карбоксилат (500 мг, 1,54 ммоль) растворяли в смеси растворителей метанола (10 мл) и тетрагидрофурана (10 мл) и добавляли в потоке азота палладий на активированном угле (10%, 200 мг). Атмосферу в системе заменяли водородом и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную жидкость фильтровали через целит, фильтрат концентрировали, сушили и получали, таким образом, целевое соединение (439 мг, 97%). (3) 2-метил-3-[2-(пиперидин-4-илокси)пиримидин-5-ил]-5-(трифторметил)-4(3H)-хиназолинон 2-Метил-5-(трифторметил)-4H-3,1-бензоксадин-4-он (78 мг, 0,34 ммоль) и трет-бутил-4-[(5-аминопиримидин-2-ил)окси]пиперидин-1-карбоксилат (100 мг, 0,34 ммоль) растворяли в уксусной кислоте (2 мл) и перемешивали при 130°C в течение 6 часов. Уксусную кислоту отгоняли при пониженном давлении, добавляли 1н. водный раствор гидроксида натрия и смесь экстрагировали этилацетатом. Продукт сушили безводным сульфатом натрия и концентрировали с получением целевого соединения (112 мг, 81%) в виде аморфного твердого вещества коричневого цвета. (4) Получение 3-{2-[(1-циклобутилпиперидин-4-ил)окси]пиримидин-5-ил}-2-метил-5-трифторметил-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 88-(3), используя 2-метил-3-[2-(пиперидин-4-ил-окси)пиримидин-5-ил]-5-(трифторметил)-4(3H)-хиназолинон и циклобутанон в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 227 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-5-метокси-2-пропил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 94, используя 2-амино-6-метоксибензойную кислоту, масляный ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 228 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-метокси-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 171-173°C) по способу примера 94, используя 2-амино-5-метоксибензойную кислоту, уксусный ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилинмонотозилат в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 229 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-2-этил-6-фторпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 94, используя 5-амино-2-фторизоникотиновую кислоту, пропионовый ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 230 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-фтор-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 161-163°C) по способу примера 94, используя 5-амино-2-фторизоникотиновую кислоту, уксусный ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилин в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир/н-гептан). 1H ЯМР (400 МГц, CDCl3, Пример 231 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-5-фтор-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 190-192°C) по способу примера 94, используя 2-амино-6-фторбензойную кислоту, уксусный ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилинмонотозилат в качестве исходных веществ, с последующей перекристаллизацией (этилацетат). 1H ЯМР (400 МГц, CDCl3, Пример 232 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-фтор-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества светло-желтого цвета (т.пл.: 122-125°C) по способу примера 94, используя 2-амино-5-фторбензойную кислоту, уксусный ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилинмонотозилат в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 233 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-7-фтор-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 163-166°C) по способу примера 94, используя 2-амино-4-фторбензойную кислоту, уксусный ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилинмонотозилат в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 234 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6,7-дифтор-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 94, используя 2-амино-4,5-дифторбензойную кислоту, уксусный ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилин и монотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 235 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-2-этил-5-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 94, используя 2-амино-6-метилбензойную кислоту, пропионовый ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 236 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-2-этил-5-фтор-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 94, используя 2-амино-6-фторбензойную кислоту, пропионовый ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 237 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-2-этил-5-метокси-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 94, используя 2-амино-6-метоксибензойную кислоту, пропионовый ангидрид и 4-[(1-циклобутилпиперидин 4-ил)окси]анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 238 5-хлор-3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-2-этил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 94, используя 2-амино-6-хлорбензойную кислоту, пропионовый ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 239 3-{3-бром-4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-5-фтор-2-метил-4(3H)-хиназолинон (1) Получение 3-бром-4-[(1-циклобутилпиперидин-4-ил)окси]анилинмонотозилата 3-Бром-4-[(1-циклобутилпиперидин-4-ил)окси]анилин получали по способу примера 94, используя 2-бром-4-нитрофенол, N-Boc-4-пиперидинол и циклобутанон в качестве исходных веществ. Обработкой смеси 1 экв. моногидрата п-толуолсульфоновой кислоты получали целевое соединение в виде бесцветного твердого вещества. 2-Бром-4-нитрофенол получали способом, описанным в литературе (J. Org. Chem., Vol.62, 1997, p.4504). (2) Получение 3-{3-бром-4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-5-фтор-2-метил-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 94, используя 2-амино-6-фторбензойную кислоту, уксусный ангидрид и 3-бром-4-[(1-циклобутилпиперидин-4-ил)окси]анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 240 3-{3-бром-4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-2,5-диметил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 94, используя 2-амино-6-метилбензойную кислоту, уксусный ангидрид и 3-бром-4-[(1-циклобутилпиперидин-4-ил)окси]анилин монотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 241 Гидрохлорид 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-2-этил-5-(трифторметил)-4(3H)-хиназолинона Указанное в заголовке соединение получали по способу примера 94, используя 2-амино-6-(трифторметил)бензойную кислоту, пропионовый ангидрид, 4-[(1-циклобутилпиперидин-4-ил)окси]анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 242 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-8-фтор-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества светло-коричневого цвета (т.пл.: 177-179°C) по способу примера 94, используя 2-амино-3-фторбензойную кислоту, уксусный ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилинмонотозилат в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 243 2-[3-(бензилокси)пропил]-3-{4-[(1-циклопентилпиперидин-4-ил)окси]фенил}пиридо[2,3-d]пиримидин-4(3H)-он (1) Получение 2-{[4-(бензилокси)бутаноил]амино}никотиновой кислоты 4-(Бензилокси)масляную кислоту (154 мг, 0,79 ммоль) растворяли в хлороформе, добавляли тионилхлорид (158 мг) и смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель и избыток тионилхлорида отгоняли при пониженном давлении, остаток растворяли в хлороформе, добавляли триэтиламин (0,46 мл) и этиловый эфир 2-аминоникотиновой кислоты (110 мг, 0,66 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной жидкости добавляли насыщенный водный раствор гидрокарбоната натрия, смесь экстрагировали хлороформом и сушили безводным сульфатом натрия. Полученный остаток растворяли в метаноле, добавляли 2н. водный раствор гидроксида натрия (0,66 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. После добавления к реакционной жидкости водного раствора хлористоводородной кислоты, чтобы сделать смесь слабокислотной, растворитель отгоняли при пониженном давлении. К остатку добавляли этилацетат и небольшое количество этанола, твердый осадок отфильтровывали и получали, таким образом, целевое соединение (166 мг, 80%) в виде бесцветного твердого вещества. (2) Получение 2-[3-(бензилокси)пропил]-4H-пиридо[2,3-d][1,3]оксадин-4-она 2-{[4-(Бензилокси)бутаноил]амино}никотиновую кислоту (100 мг, 0,32 ммоль) растворяли в хлороформе (4 мл) в потоке азота, добавляли оксалилхлорид (50 мкл) и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной жидкости добавляли триэтиламин (0,2 мл) и перемешивали в течение 1 часа. Добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Экстракт сушили безводным сульфатом натрия, концентрировали и получали, таким образом, целевое соединение (42 мг, 45%) в виде маслянистого остатка коричневого цвета. (3) Получение 2-[3-(бензилокси)пропил]-3-{4-[(1-циклопентилпиперидин-4-ил)окси]фенил}пиридо[2,3-d]пиримидин-4(3H)-она Указанное в заголовке соединение получали по способу примера 94, используя 2-[3-(бензилокси)пропил]-4H-пиридо[2,3-d][1,3]оксазин-4-он и 4-[(1-циклопентилпиперидин-4-ил)окси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 244 2-[2-(аллилокси)этил]-6-хлор-3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}пиридо[3,4-d]пиримидин-4(3H)-он (1) Получение 2-[2-(аллилокси)этил]-6-хлор-4H-пиридо[3,4-d][1,3]оксадин-4-она Целевое соединение получали по способу примера 243, используя этиловый эфир 5-амино-2-хлоризоникотиновой кислоты и 3-(аллилокси)пропионовую кислоту в качестве исходных веществ. (2) Получение 2-[2-(аллилокси)этил]-6-хлор-3-{4-[(1-циклобутилпиперидин-ил)окси]фенил}пиридо[3,4-d]пиримидин-4(3H)-она Указанное в заголовке соединение получали по способу примера 94, используя 2-[2-(аллилокси)этил]-6-хлор-4H-пиридо[3,4-d][1,3]оксадин-4-он и 4-[(1-циклобутилпиперидин-4-ил)окси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 245 6-хлор-3-{4-[(1-циклопропилпиперидин-4-ил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он (1) Получение 1-циклопропил-4-(4-нитрофенокси)пиперидина 4-(4-Нитрофенокси)пиперидин (1,92 г, 8,63 ммоль) и [(1-этоксициклопропил)окси](триметил)силан (2,27 г, 12,9 ммоль) растворяли в смеси растворителей уксусной кислоты (20 мл) и метанола (20 мл), добавляли цианоборгидрид натрия (1,08 г, 17,3 ммоль) и смесь перемешивали при 65°C в течение 18 часов. Растворитель отгоняли при пониженном давлении, добавляли этилацетат и 1н. водный раствор гидроксида натрия, смесь экстрагировали этилацетатом и органическую фазу промывали дистиллированной водой. После сушки безводным сульфатом натрия продукт концентрировали и получали, таким образом, целевое соединение (1,94 г, 86%) в виде маслянистого вещества светло-коричневого цвета. Использовали 4-(4-нитрофенокси)пиперидин, полученный в примере 94. (2) Получение 4-[(1-циклопропилпиперидин-4-ил)окси]анилина Целевое соединение получали каталитическим восстановлением 1-циклопропил-4-(4-нитрофенокси)пиперидина в смеси растворителей метанола и этилацетата, используя катализатор палладий на активированном угле. (3) Получение 6-хлор-3-{4-[(1-циклопропилпиперидин-4-ил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-она Указанное в заголовке соединение получали по способу примера 94, используя 5-амино-2-хлоризоникотиновую кислоту, уксусный ангидрид и 4-[(1-циклопропилпиперидин-4-ил)окси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 246 3-{4-[(1-циклопропилпиперидин-4-ил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали каталитическим восстановлением 6-хлор-3-{4-[(1-циклопропилпиперидин-4-ил)окси]фенил}-2-метилпиридо[3,4-d]пиримидин-4(3H)-она, синтезированного в примере 251, используя катализатор палладий на активированном угле, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 247 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-(дифторметокси)-2-метил-(3H)-хиназолинон (1) Получение 3-{4-[(1-циклобутилпиперидин-ил)окси]фенил}-6-гидрокси-2-метил-(3H)-хиназолинона Целевое соединение получали деметилированием 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-6-метокси-2-метил-4(3H)-хиназолинона, синтезированного в примере 234, по способу примера 192(1). (2) Получение 3-{4-[1-циклобутилпиперидин-4-ил)окси]фенил}-6-(дифторметокси)-2-метил-4(3)-хиназолинона 3-{4-[(1-Циклобутилпиперидин-4-ил)окси]фенил}-6-гидрокси-2-метил-4(3H)-хиназолинон (37 мг), хлордифторацетат натрия (17 мг) и карбонат калия (25 мг) смешивали в диметилформамиде и перемешивали при 120°C в течение 2 часов. К реакционной смеси добавляли дистиллированную воду, смесь экстрагировали хлороформом и сушили безводным сульфатом натрия. Продукт очищали колоночной хроматографией на силикагеле (хлороформ/метанол=15/1) и получали, таким образом, указанное в заголовке соединение (19 мг, 46%) в виде маслянистого остатка светло-желтого цвета. 1H ЯМР (400 МГц, CDCl3, Пример 248 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-7-метокси-2-метил-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 94, используя 2-амино-4-метоксибензойную кислоту, уксусный ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 249 6-хлор-3-(2-метокси)-4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-2-метилпиридо[3,4-d]пиримидин-4(3H)-он (1) Получение 6-хлор-3-(4-гидрокси-2-метоксифенил)-2-метилпиридо[3,4-d]пиримидин-4(3H)-она Указанное в заголовке соединение получали по способу примера 1-(1) и -(2), используя 5-амино-2-хлоризоникотиновую кислоту, уксусный ангидрид и 4-амино-3-метоксифенол в качестве исходных веществ. (2) Получение 6-хлор-3-(2-метокси-4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-2-метилпиридо[3,4-d]пиримидин-4(3H)-она 6-Хлор-3-(4-гидрокси-2-метоксифенил)-2-метилпиридо[3,4-d]пиримидин-4(3H)-он (250 мг, 0,79 ммоль), 3-[(3S)-3-метилпиперидин-1-ил]пропан-1-ол (186 мг, 1,2 ммоль) и трифенилфосфин (310 мг, 1,2 ммоль) растворяли в безводном тетрагидрофуране (6 мл) в потоке азота и охлаждали на ледяной бане. Добавляли по каплям диизопропилазодикарбоксилат (0,23 мл, 1,2 ммоль) и перемешивали в течение 2 дней при комнатной температуре. Смесь концентрировали при пониженном давлении, добавляли диэтиловый эфир и твердый осадок отфильтровывали. Фильтрат концентрировали, продукт очищали колоночной хроматографией на силикагеле (хлороформ/метанол=100/0-95/5) и получали таким образом указанное в заголовке соединение (200 мг, 56%) в виде бесцветных кристаллов. 1H ЯМР (400 МГц, CDCl3, Пример 250 6-хлор-3-(2-гидрокси-4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-2-метилпиридо[3,4-d]пиримидин-4(3H)-он 6-Хлор-3-(2-метокси-4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, синтезированный в примере 249, подвергали деметоксилированию по способу примера 192(1) и получали, таким образом, указанное в заголовке соединение. 1H ЯМР (400 МГц, CDCl3, Пример 251 6-хлор-3-(2-(2-фторэтокси)-4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 192(1), используя 6-хлор-3-(2-гидрокси-4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-2-метилпиридо[3,4-d]пиримидин-4(3H)-он и 2-фторэтилтозилат в качестве исходных веществ. Использовали 6-хлор-3-(2-гидрокси-4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, который синтезировали в примере 250. 1H ЯМР (400 МГц, CDCl3, Пример 252 2-этил-6-метокси-3-(4-{3-[(2S)-2-метилпирролидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 249, используя 2-этил-6-метокси-3-(4-гидроксифенил)пиридо[3,4-d]пиримидин-4(3H)-он и 3-[(2S)-2-метилпирролидин-1-ил]пропан-1-ол в качестве исходных веществ. Использовали 2-этил-6-метокси-3-(4-гидроксифенил)пиридо[3,4-d]пиримидин-4(3H)-он, который синтезировали в примере 198. 1H ЯМР (400 МГц, CDCl3, Пример 253 Гидрохлорид 2-этил-6-метокси-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-(3H)-она Указанное в заголовке соединение получали по способу примера 249, используя 2-этил-6-метокси-3-(4-гидроксифенил)пиридо[3,4-d]пиримидин-4(3H)-он и 3-[(3S)-3-метилпиперидин-1-ил]пропан-1-ол в качестве исходных веществ. Использовали 2-этил-6-метокси-3-(4-гидроксифенил)пиридо[3,4-d]пиримидин-4(3H)-он, который синтезировали в примере 198. 1H ЯМР (400 МГц, CDCl3, Пример 254 6-метокси-3-(2-метокси-4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)-2-метилпиридо[3,4-d]пиримидин-(3H)-он Указанное в заголовке соединение получали по способу примера 249, используя 6-метокси-3-(4-гидрокси-2-метоксифенил)-2-метилпиридо[3,4-d]пиримидин-4(3H)-он и 3-[(3S)-3-метилпиперидин-1-ил]пропан-1-ол в качестве исходных веществ. Использовали 6-метокси-3-(4-гидрокси-2-метоксифенил)-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, который синтезировали в примере 203 (1). 1H ЯМР (400 МГц, CDCl3, Пример 255 6-метокси-2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 249, используя 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он и 3-[(3S)-3-метилпиперидин-1-ил]пропан-1-ол в качестве исходных веществ. Использовали 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин 4(3H)-он, который синтезировали в примере 197. 1H ЯМР (400 МГц, CDCl3, Пример 256 6-метокси-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 249, используя 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он и 3-[(2R)-2-метилпирролидин-1-ил]пропан-1-ол в качестве исходных веществ. Использовали 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, который синтезировали в примере 197. 1H ЯМР (400 МГц, CDCl3, Пример 257 2,5-диметил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-6-метилбензойную кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 258 2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-5-(трифторметил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-6-(трифторметил)бензойную кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 259 5-хлор-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-6-хлорбензойную кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 260 5-фтор-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение синтезировали в виде твердого вещества белого цвета (т.пл.: 125-127°C) по способу примера 165, используя 2-амино-6-фторбензойную кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил)пропокси]анилинмонотозилат в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир). 1H ЯМР (400 МГц, CDCl3, Пример 261 6-фтор-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-5-фторбензойную кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 262 7-фтор-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-4-фторбензойную кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 263 8-фтор-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-3-фторбензойную кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 264 2,6-диметил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)-4(3H)-хиназолинон Указанное в заголовке соединение получали по способу примера 165, используя 2-амино-5-метилбензойную кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 265 2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)пиридо[2,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 165, используя 2-аминоникотиновую кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 266 2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)пиридо[4,3-d]пиримидин-4(3H)-он Указанное в заголовке соединение синтезировали в виде твердого вещества светло-желтого цвета (т.пл.: 238-250°C) по способу примера 165, используя 4-аминоникотиновую кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси]анилинмонотозилат в качестве исходных веществ, с последующей перекристаллизацией (этилацетат/диэтиловый эфир/н-гептан). 1H ЯМР (400 МГц, CDCl3, Пример 267 2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-он (1) Получение 6-хлор-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-она Целевое соединение получали по способу примера 165, используя 5-амино-2-хлоризоникотиновую кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. (2) Получение 2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4(3H)-она Указанное в заголовке соединение получали растворением 6-хлор-2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)пиридо[3,4-d]пиримидин-4{3H)-она в этилацетате, и осуществляя каталитическое восстановление с использованием в качестве катализатора палладия на активированном угле, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 268 2-метил-3-[4-(3-пиперидин-1-илпропокси)фенил]пиридо[3,2-d]пиримидин-4(3H)-он (1) Получение 3-нитропиридин-2-карбоновой кислоты Указанное соединение получали способом, описанным в литературе (Tetrahedron, 1998, Vol.54, p.6311; и J. Am. Chem. Soc, 1954, Vol.76, p.3167), используя 2-хлор-3-нитропиридин в качестве исходного вещества. (2) Получение 3-аминопиридин-2-карбоновой кислоты 3-Нитропиридин-2-карбоновую кислоту (2,72 г, 16,2 ммоль) и гидрокарбонат натрия (1,34 г, 16,2 ммоль) растворяли в дистиллированной воде (20 мл) и атмосферу в системе заполняли азотом. После добавления 10% палладия на активированном угле (1,72 г) атмосферу в системе заменяли водородом и смесь перемешивали при комнатной температуре в течение 50 часов. Добавляли 1н. водный раствор соляной кислоты и pH реакционного раствора доводили до слабокислотного значения. Растворитель отгоняли при пониженном давлении, к остатку добавляли небольшое количество этанола и этилацетата и образовавшийся осадок отфильтровывали. Фильтрат концентрировали и получали, таким образом, целевое вещество (1,50 г, 67%) в виде твердого вещества светло-желтого цвета. (3) Получение 2-метил-3-[4-(3-пиперидин-1-ил-пропокси)фенил]пиридо[3,2-d] пиримидин-4(3H)-она Указанное в заголовке соединение получали по способу примера 165, используя 3-аминопиридин-2-карбоновую кислоту, уксусный ангидрид и 4-(3-пиперидин-1-ил-пропокси)анилинмонотозилат в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 269 2-метил-3-(4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}фенил)пиридо[3,2-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 165, используя 3-аминопиридин-2-карбоновую кислоту, уксусный ангидрид и 4-{3-[(2R)-2-метилпирролидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. Использовали 3-аминопиридин-2-карбоновую кислоту, которую синтезировали в примере 268. 1H ЯМР (400 МГц, CDCl3, Пример 270 2-метил-3-[4-(3-пирролидин-1-илпропокси)фенил]пиридо[3,2-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 165, используя 3-аминопиридин-2-карбоновую кислоту, уксусный ангидрид и 4-(3-пирролидин-1-илпропокси)анилин в качестве исходных веществ. Использовали 3-аминопиридин-2-карбоновую кислоту, которую синтезировали в примере 268. 1H ЯМР (400 МГц, CDCl3, Пример 271 2-метил-3-(4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}фенил)пиридо[3,2-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 165, используя 3-аминопиридин-2-карбоновую кислоту, уксусный ангидрид и 4-{3-[(3S)-3-метилпиперидин-1-ил]пропокси}анилинмонотозилат в качестве исходных веществ. Использовали 3-аминопиридин-2-карбоновую кислоту, которую синтезировали в примере 268. 1H ЯМР (400 МГц, CDCl3, Пример 272 3-{4-[(1-циклобутилпиперидин-4-ил)окси]фенил}-2-метилпиридо[3,2-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 165, используя 3-аминопиридин-2-карбоновую кислоту, уксусный ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилинмонотозилат в качестве исходных веществ. Использовали 3-аминопиридин-2-карбоновую кислоту, которую синтезировали в примере 268. 1H ЯМР (400 МГц, CDCl3, Пример 273 3-{4-[(1-циклобутил-пиперидин-4-ил)окси]фенил}-2-этилпиридо[3,2-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 165, используя 3-аминопиридин-2-карбоновую кислоту, пропионовый ангидрид и 4-[(1-циклобутилпиперидин-4-ил)окси]анилинмонотозилат в качестве исходных веществ. Использовали 3-аминопиридин-2-карбоновую кислоту, которую синтезировали в примере 268. 1H ЯМР (400 МГц, CDCl3, Пример 274 3-[4-(3-азепан-1-илпропокси)фенил]-2-метилпиридо[3,4-d]пиримидин-4(3H)-он (1) Получение 3-[4-(3-азепан-1-илпропокси)фенил]-6-хлор-2-метилпиридо[3,4-d]пиримидин-4(3H)-она Целевое соединение получали по способу примера 165, используя 5-амино-2-хлоризоникотиновую кислоту, уксусный ангидрид и 4-(3-азепан-1-илпропокси)анилин в качестве исходных веществ. (2) Получение 3-[4-(3-азепан-1-илпропокси)фенил]-6-хлор-2-метилпиридо[3,4-d]пиримидин-4(3H)-она Указанное в заголовке соединение получали каталитическим восстановлением 3-[4-(3-азепан-1-илпропокси)фенил]-6-хлор-2-метилпиридо[3,4-d]пиримидин-4(3H)-она в этилацетате, используя в качестве катализатора палладий на активированном угле, в присутствии триэтиламина. 1H ЯМР (400 МГц, CDCl3, Пример 275 3-[4-(3-азепан-1-илпропокси)фенил]-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Указанное в заголовке соединение получали по способу примера 249, используя 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он и 3-(азепан-1-ил)пропан-1-ол в качестве исходных веществ. Использовали 3-(4-гидроксифенил)-6-метокси-2-метилпиридо[3,4-d]пиримидин-4(3H)-он, который синтезировали в примере 268. 1H ЯМР (400 МГц, CDCl3, Пример 276 3-[4-(3-азепан-1-илпропокси)фенил]-2-метилпиридо[3,4-d]пиримидин-4(3H)-он Целевое соединение получали по способу примера 165, используя 2-аминоникотиновую кислоту, уксусный ангидрид и 4-(3-азепан-1-илпропокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 277 5-фтор-2-метил-3-[4-(3-пирролидин-1-илбутокси)фенил]-4(3H)-хиназолинон (рацемическая смесь) (1) Получение 4-(3-пирролидин-1-илбутокси)анилина (рацемическая смесь) Целевое соединение получали по способу примера 18, используя 3-пирролидин-1-илбутан-1-ол (рацемическая смесь) и 4-нитрофторбензол в качестве исходных веществ. 3-Пирролидин-1-илбутан-1-ол (рацемическая смесь) получали способом, описанным в литературе (J. Org. Chem., 1949, Vol.14, p.862). 1H ЯМР (400 МГц, CDCl3, (2) Получение 5-фтор-2-метил-3-[4-(3-пирролидин-1-илбутокси)фенил]-4(3H)-хиназолинона (рацемическая смесь) Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-фторбензойную кислоту, уксусный ангидрид и 4-(3-пирролидин-1-илбутокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 278 2-метил-3-[4-(3-пирролидин-1-илбутокси)фенил]-5-(трифторметил)-4(3H)-хиназолинон (рацемическая смесь) Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-(трифторметил)бензойную кислоту, уксусный ангидрид и 4-(3-пирролидин-1-илбутокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Пример 279 2,5-диметил-3-[4-(3-пирролидин-1-илбутокси)фенил]-4(3H)-хиназолинон (рацемическая смесь) Указанное в заголовке соединение получали по способу примера 18, используя 2-амино-6-метилбензойную кислоту, уксусный ангидрид и 4-(3-пирролидин-1-илбутокси)анилин в качестве исходных веществ. 1H ЯМР (400 МГц, CDCl3, Примеры фармакологических испытаний, в которых в качестве испытываемого соединения использовали 2-этил-3-{4-[3-(1-пиперидинил)пропокси]фенил}-4(3H)-хиназолинон (соединение примера 1), представлены ниже. (Пример фармакологического испытания 1: испытание ингибирования связывания аналога гистамина) Последовательность кДНК [Международная Патентная Публикация WO00/39164, описание], которая кодирует гистаминовый H3 рецептор человека, клонировали, используя векторы экспрессии pCR2.1, pEFlx (продукт от Invitrogen) и pCI-neo (продукт от Promega Inc.). Полученные векторы экспрессии трансфицировали в клетки хозяина, HEK293 и CHO-K1 (American type culture collection), используя катионный липидный метод [Proceedings of the National Academy of Sciences of the United States of America, Vol.84, p.7413 (1987), и получали, таким образом, клетки, экспрессирующие гистаминовый рецептор H3. Препарат мембран, полученный из клеток, которые представляли гистаминовый рецептор H3, испытываемое соединение (соединение примера 1) и 20000 имп./мин [3H]N- Как указано выше, соединение примера 1 сильно препятствовало связыванию N- (Пример фармакологического испытания 2: Испытание антагонизма, индуцированного R- Под анестезией кетамином/ксилазином (74 мг/кг и одноразовое внутрибрюшинное введение 11 мг/кг) постоянную направляющую канюлю (размер 26, длина 11 мм) вставляли в ventriculus tertius самцов крыс SD (возраста 7-10 недель, 200-300 г), используя устройство для стереотаксического исследования мозга, и фиксировали при помощи зубопротезной пластмассы. Положение кончика направляющей канюли было в 2,2 мм сзади от брегмы и на глубине 8 мм от поверхности черепа, посередине. По прошествии 1 недели периода выздоровления в ventriculus tertius вводили R- (Пример фармакологического испытания 3: кинетическое испытание in vivo) Испытываемое соединение (соединение примера 1) вводили перорально или внутривенно самцам крыс SD (возраста 7-10 недель, 200-400 г), которым не давали пищу в течение ночи, и из хвостовой вены брали примерно 100 мкл крови, используя гепаринизированную капиллярную трубку, в заданное время. Кровь центрифугировали (4°C, 6000 об/мин, 10 минут) и получали плазму. К плазме добавляли трехкратное количество этанола (содержащего внутренний стандарт), перемешивали, оставляли на 20 минут при -20°C и центрифугировали (4°C, 10000 об/мин, 10 минут). Надосадочную жидкость анализировали методом ЖХ/МС/МС и концентрацию в плазме измеряли методом с использованием относительной калибровочной кривой. В результате было обнаружено, что испытываемое соединение имело биодоступность 60% и период полусуществования в крови 6,3 часа. (Пример фармакологического испытания 4: испытание активность в мозге/цереброспинальной жидкости) Испытываемое соединение (соединение примера 1) вводили перорально или внутривенно самцам крыс SD (возраста 7-10 недель, 200-400 г) и выпускали кровь из брюшной аорты под анестезией эфиром, используя шприц с гепариновой обработкой, в заданное вермя. Кожу в затылочной части головы разрезали, прокалывали стоматологической иглой размера 30 G между шейными позвонками и вставляли в субарахноидальное пространство. 50-100 мкл цереброспинальной жидкости извлекали при помощи 1-мл шприца через трубку, соединенную с 30 G иглой, и извлекали мозг. Образец крови центрифугировали (4°C, 6000 об/мин, 10 минут) и к плазме добавляли трехкратное количество этанола (содержащего внутренний стандарт) и перемешивали. К образцу мозга добавляли 2 мл воды, гомогенизировали, часть удаляли и добавляли трехкратное количество этанола (содержащего внутренний стандарт) и перемешивали. Брали цереброспинальную жидкость, добавляли трехкратное количество этанола (содержащего внутренний стандарт) и перемешивали. Указанный выше образец оставляли при -20°C в течение 20 минут, центрифугировали (4°C, 12000 об/мин, 10 минут), надосадочную жидкость анализировали методом ЖХ/МС/МС и концентрацию в плазме, головном мозге и цереброспинальной жидкости измеряли методом с использованием относительной калибровочной кривой. В результате было обнаружено, что испытываемое соединение имело интрацеребральную концентрацию 3,16 нмоль/г, концентрацию в цереброспинальной жидкости 0,142 мкМ и концентрацию в плазме 2,32 мкМ на время 2 часа после перорального введения (10 мг/кг). Промышленная применимость Новое конденсированное 4-оксопиримидиновое производное, представленное формулой (I), или его фармацевтически приемлемая соль обладают сильным антагонистическим действием в отношении гистамина или активностью обратного агониста и поэтому являются полезными для профилактики или лечения болезней обмена веществ, таких как ожирение, сахарный диабет, нарушения гормональной секреции, гиперлипидемия, подагра и ожирение печени; заболеваний системы кровообращения, таких как стенокардия, острая и застойная сердечная недостаточность, инфаркт миокарда, кольцевидный артериосклероз, гипертензия, заболевание почек и нарушение электролитного баланса; или заболеваний центральной или периферической нервной системы, таких как расстройства сна или заболевания, сопровождающиеся расстройством сна (например, идиопатическая гиперсомния, повторяющаяся время от времени гиперсомния, врожденная гиперсомния, нарколепсия, периодическое движение конечностей во сне, синдром апное во сне, нарушение циркадного ритма, синдром хронической усталости, нарушение быстрого сна (REM-сна), старческая бессонница, нарушение санитарных норм сна у работающих в ночную смену, идиопатическая бессонница, повторяющаяся время от времени бессонница, врожденная бессонница, депрессия, ощущение тревоги и шизофрения), булимия, аффективные расстройства, эпилепсия, делириозный синдром, деменция, расстройство дефицита внимания/гиперактивности, ухудшение памяти, болезнь Альцгеймера, болезнь Паркинсона, когнитивное расстройство, двигательное расстройство, дизестезия, дизосмия, резистентность к морфину, наркозависимость, алькогольная зависимость и тремор.
Формула изобретения
1. Соединение, представленное формулой (I) 2. Соединение по п.1, где кольцо А представляет собой бензольное кольцо, пиридиновое кольцо или пиримидиновое кольцо, или его фармацевтически приемлемая соль. 3. Соединение по п.1, где кольцо А представляет собой бензольное кольцо или пиридиновое кольцо, или его фармацевтически приемлемая соль. 4. Соединение по пп.1-3, где по меньшей мере один из R2 и R3 представляет собой атом водорода, или его фармацевтически приемлемая соль. 5. Соединение по пп.1-3, где один из R2 и R3 представляет собой атом водорода, тогда как другой представляет собой атом водорода, атом галогена, низший алкил (эта низшая алкильная группа может быть дополнительно замещена галогеном), низший алкокси (эта низшая алкоксигруппа может быть дополнительно замещена галогеном), гидрокси, арил, гетероарил, низший алкилкарбоксамид, арилкарбоксамид, арилалкилкарбоксамид или низший алкилсульфониламино, или его фармацевтически приемлемая соль. 6. Соединение по пп.1-3, где один из R2 и R3 представляет собой атом водорода, тогда как другой представляет собой атом водорода, атом галогена, низший алкил (эта низшая алкильная группа может быть дополнительно замещена галогеном) или низший алкокси (эта низшая алкоксигруппа может быть дополнительно замещена галогеном), или его фармацевтически приемлемая соль. 7. Соединение по п.1, где Ar представляет собой бивалентную группу, образованную удалением двух атомов водорода из бензола или пиримидина (эта бивалентная группа может быть дополнительно замещена атомом галогена, низшим алкокси (эта низшая алкоксигруппа может быть дополнительно замещена галогеном), гидрокси или низшим алкилом), или его фармацевтически приемлемая соль. 8. Соединение по любому одному из пп.1-3 или 7, где X2 представлен формулой (II) 9. Соединение по п.8, где R4, R5 и атом азота, взятые вместе, образуют 5-8-членное моноциклическое кольцо (это моноциклическое кольцо может иметь в качестве группы заместителя атом галогена или низшую алкильную группу, которая может быть замещена галогеном), или его фармацевтически приемлемая соль. 10. Соединение по п.8, где R4, R5 и атом азота, взятые вместе, образуют 6-10-членное бициклокольцо, или его фармацевтически приемлемая соль. 11. Соединение по п.8, где n имеет значение 3, и R4, R5 и атом азота, взятые вместе, образуют 5-8-членное моноциклическое кольцо (это моноциклическое кольцо может иметь в качестве группы заместителя атом галогена или низшую алкильную группу, которая может быть замещена галогеном), или его фармацевтически приемлемая соль. 12. Соединение по п.8, где n имеет значение 3, и R4, R5 и атом азота, взятые вместе, образуют 6-10-членное бициклокольцо, или его фармацевтически приемлемая соль. 13. Соединение по любому одному из пп.1-3 или 7, где X2 представлен формулой (III) 14. Соединение по любому одному из пп.1-3 или 7, где X2 представлен формулой (IV) 15. Соединение по любому одному из пп.1-3, 7, 9, 10, 11 или 12, где R1 представляет собой низшую алкильную группу, содержащую 1 -3 атома углерода (эта низшая алкильная группа может быть дополнительно замещена галогеном), или фенильную группу, или его фармацевтически приемлемая соль. 16. Соединение по любому одному из пп.1-3, 7, 9, 10, 11 или 12, где R1 представляет собой метил, этил, н-пропил, изопропил или трифторметил, или его фармацевтически приемлемая соль. 17. Соединение по п.1, где соединение, представленное формулой (I), представляет собой: 18. Средство для профилактики или лечения заболевания обмена веществ, заболевания системы кровообращения или заболевания нервной системы, содержащее в качестве активного ингредиента соединение по пп.1-17 или его фармацевтически приемлемую соль.
|
||||||||||||||||||||||||||

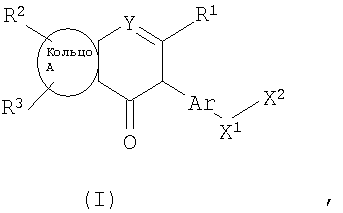
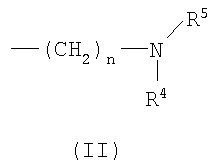
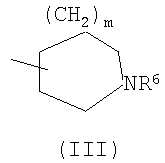
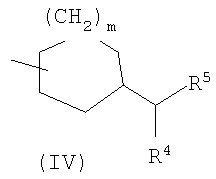
 )-метилгистамин, подавляется агонистами и активируется антагонистами или обратными агонистами, например, такими как тиоперамид (см., например, Trends in Pharmacological Science, Vol.19, p.177(1998)).
)-метилгистамин, подавляется агонистами и активируется антагонистами или обратными агонистами, например, такими как тиоперамид (см., например, Trends in Pharmacological Science, Vol.19, p.177(1998)).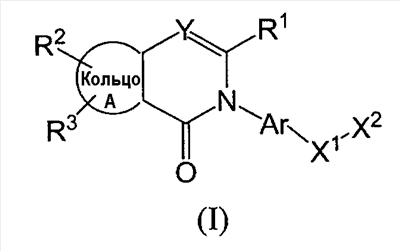
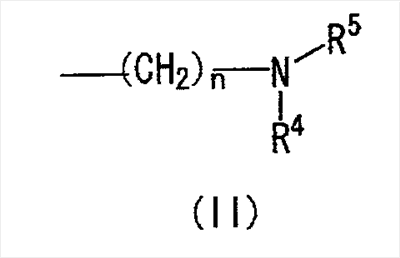
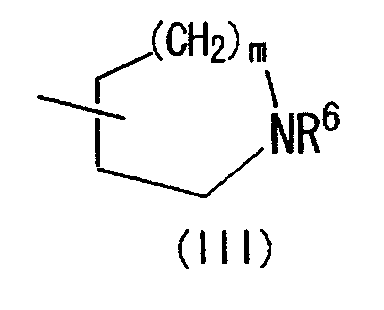
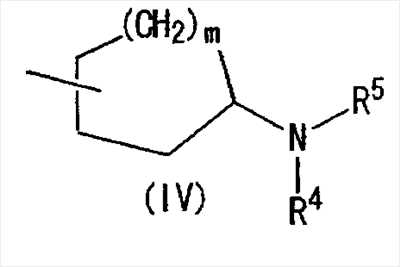
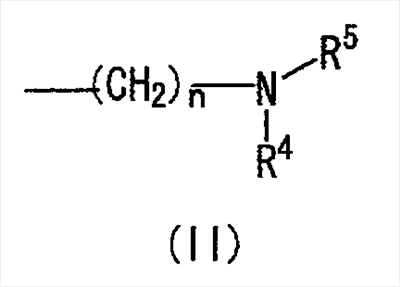
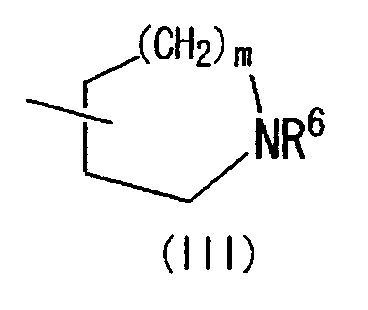
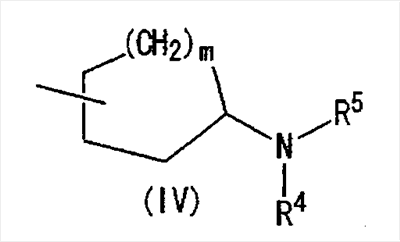
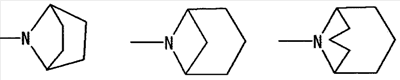
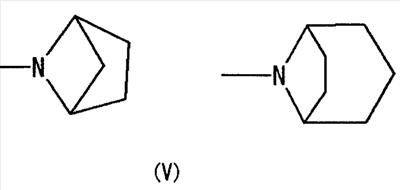
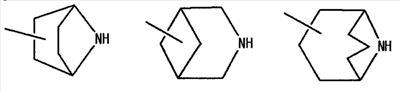
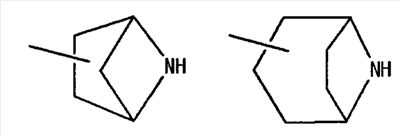
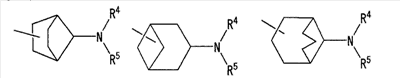
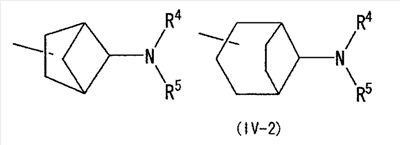
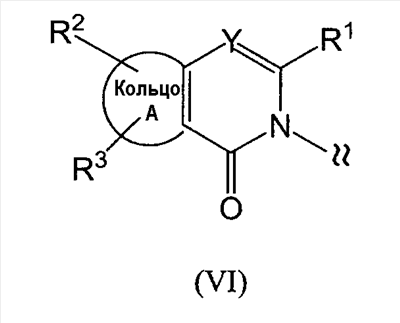
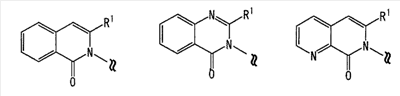
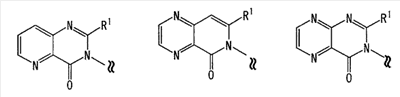
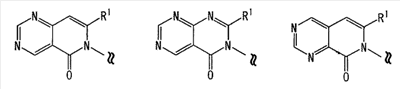
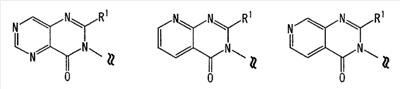
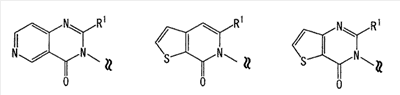
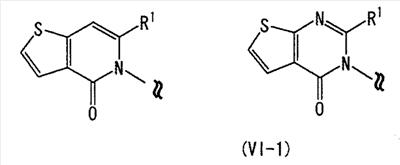
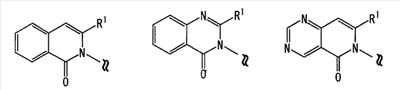
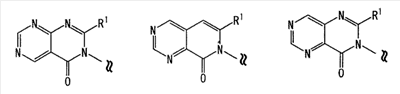
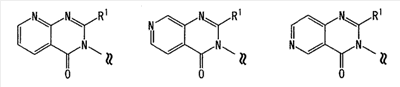
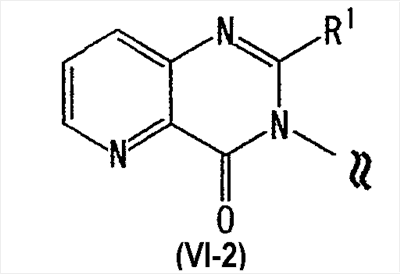
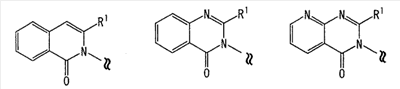
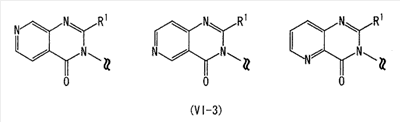
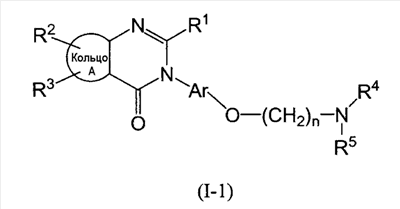
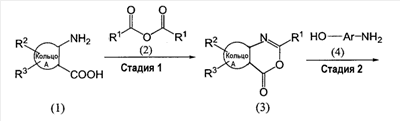
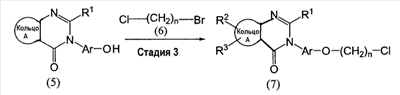
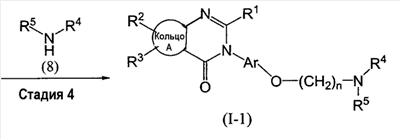
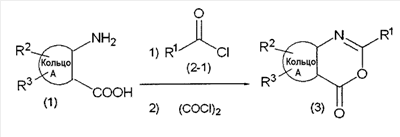
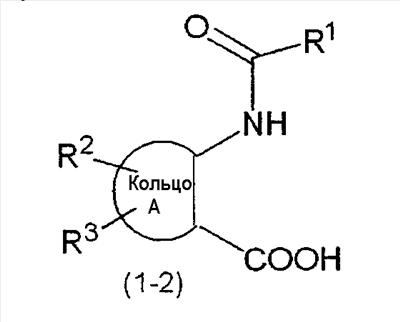
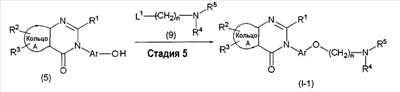
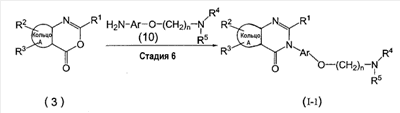
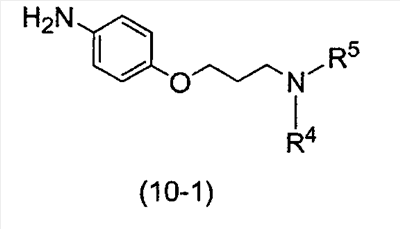
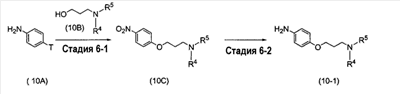
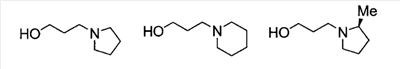
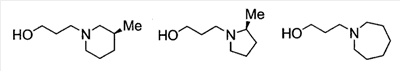
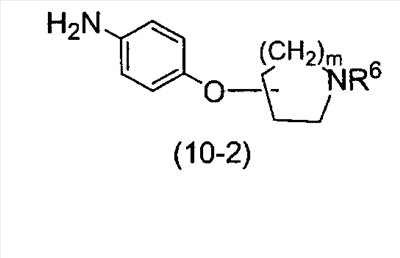
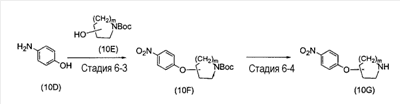
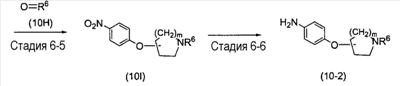
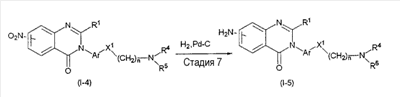
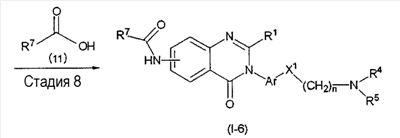
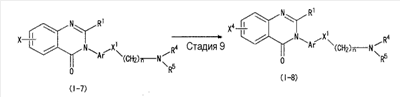
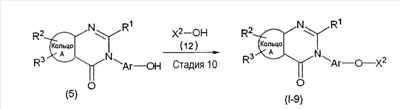
 , такие как CLX-0940, GW-1536, GW1929, GW-2433, KRP-297, 1-796449, LR-90 и SB 219994 и т.п.;
, такие как CLX-0940, GW-1536, GW1929, GW-2433, KRP-297, 1-796449, LR-90 и SB 219994 и т.п.; адренергические блокаторы, такие как нипрадилол, аротинолол, амосулалол и т.п.;
адренергические блокаторы, такие как нипрадилол, аротинолол, амосулалол и т.п.; 5532237, патенте США
5532237, патенте США  C-300 (Wako Pure Chem.) использовали в качестве силикагеля для колонок и LC-SORBTM SP-B-ODS (Chemco) или YMC-GEL
C-300 (Wako Pure Chem.) использовали в качестве силикагеля для колонок и LC-SORBTM SP-B-ODS (Chemco) или YMC-GEL м.д.): 1,22 (3H, т, J=7,2 Гц), 1,41-1,47 (2H, м), 1,57-1,64 (4H, м), 1,97-2,05 (2H, м), 2,36-2,58 (8H, м), 4,06 (2H, т, J=6,4 Гц), 7,02 (2H, д, J=8,4 Гц), 7,12 (2H, д, J=8,4 Гц), 7,43 (1Н, т, J=7,6 Гц), 7,67-7,78 (2H, м), 8,25 (1Н, д, J=8,4 Гц).
м.д.): 1,22 (3H, т, J=7,2 Гц), 1,41-1,47 (2H, м), 1,57-1,64 (4H, м), 1,97-2,05 (2H, м), 2,36-2,58 (8H, м), 4,06 (2H, т, J=6,4 Гц), 7,02 (2H, д, J=8,4 Гц), 7,12 (2H, д, J=8,4 Гц), 7,43 (1Н, т, J=7,6 Гц), 7,67-7,78 (2H, м), 8,25 (1Н, д, J=8,4 Гц).