|
|
(21), (22) Заявка: 2005141200/15, 29.12.2005
(24) Дата начала отсчета срока действия патента:
29.12.2005
(43) Дата публикации заявки: 10.07.2007
(46) Опубликовано: 20.06.2009
(56) Список документов, цитированных в отчете о
поиске:
ANDROSOVA О.A. et al. Synthesis of highly water-soluble piperazine derivatives of [60] fullerene, Fullerenes and Atomic Clusters, 7th Biennial International Workshop, St.Petersburg, Russia, June 30 – July 4, 2003, p.118. RU 2119449, 27.09.1998. RU 2133727 C1, 27.07.1999. RU 2254329 C1, 20.06.2005. US 5177248 A, 05.01.1993. ANDROSOVA O.A.et al. Synthesis of water-soluble fullerene derivatives from chlorofullerene C60C16, Fullerenes and Atomic Clusters, 7th Biennial International Workshop, St.Petersburg, Russia, June 30 – July 4, 2003, p.116. ANDROSOVA O.A. et al. Reactions of higher fullerene halides C60C124, C60C128, C60C130 and C60F36 with amines: a promising synthetic route to water-soluble fullerene derivatives, Fullerenes and Atomic Clusters, 7th Biennial International Workshop, St.Petersburg, Russia, June 30 – July 4, 2003, p.117.
Адрес для переписки:
142432, Московская обл., г. Черноголовка, пр-кт Акад. Семенова, 1, ИПХФ РАН, директору академику С.М. Алдошину
|
(72) Автор(ы):
Любовская Римма Николаевна (RU),
Трошин Павел Анатольевич (RU),
Трошина Олеся Анатольевна (RU)
(73) Патентообладатель(и):
Институт проблем химической физики Российской академии наук (ИПХФ РАН) (RU)
|
(54) ВОДОРАСТВОРИМЫЕ АМИНОФУЛЛЕРЕНЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ
(57) Реферат:
Изобретение может быть использовано для создания медицинских препаратов на основе фуллеренов. Водорастворимые аминофуллерены – пиперазинсодержащие производные фуллерена С60 общей формулы
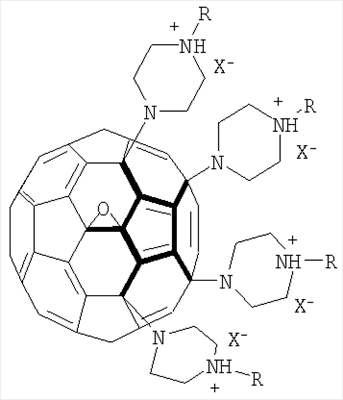
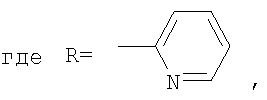   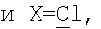 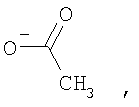 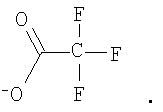
Изобретение позволяет синтезировать в макроколичествах аминофуллерены с более высокой растворимостью в воде. 4 н.п. ф-лы, 8 ил.
Изобретение относится к химии фуллеренов, в частности к способам синтеза водорастворимых производных [60]фуллерена. Изобретение может найти применение в научно-исследовательской работе (в частности, при изучении биологической активности заявляемых соединений) и является перспективным для создания медицинских препаратов на основе фуллеренов.
Исследования биологической активности известных водорастворимых производных [60]фуллерена показали, что эти соединения могут быть использованы для создания ряда уникальных медицинских препаратов.
Из литературных источников было показано, что ряд производных фуллеренов являются потенциальными средствами для борьбы со СПИДом. Они являются аллостерическими ингибиторами ВИЧ-1 протеазы, поскольку размер фуллеренового каркаса совпадает с размером активного центра фермента [1 – Т.Mashino, К.Shimotohno, N.Ikegami, D.Nishikawa, К.Okuda, К.Takahashi, S.Nakamura, M.Mochizuki, Bioorg. Med. Chem. Lett., 2005, 15, 1107; 2 – S.Bosi, T.Da Ros, G.Spalluto, J.Balzarini, M.Prato, Bioorg. Med. Chem. Lett., 2003, 13, 4437; 3 – S.H.Friedman, P.S.Ganapathi, Y.Rubin, G.L.Kenyon, J.Med. Chem., 1998, 41, 2424].
Кроме того, известно, что как сам фуллерен C60, так и ряд его производных являются эффективными фотосенсибилизаторами и превращают обычный кислород (триплетный) в высокоактивный синглетный с квантовыми выходами, близкими к 100%. Это свойство позволяет использовать производные фуллеренов для фотодинамической терапии рака. Сообщается также о непосредственном действии производных фуллерена на раковые клетки (химиотерапия) [4 – N.Nakajima, С.Nishi, F.-M.Li, Y.Ikada, Fuller. Sci. Technol, 1996, 4, 1; 5 – T.Mashino, D.Nishikawa, K.Takanashi, N.Usui, T.Yamory, M.Seki, T.Endo, M.Mochizuki, Bioorg. Med. Chem. Lett., 2003, 13, 4395; 6 – Y.Tabata, T.Ishii, T.Aoyama, R.Oki, Y.Hirano, O.Ogawa, Y.Ikada in “Perspectives of Fullerene Nanotechnology”, E.Osawa Ed., Kluver Academ. PubX., Dordrecht-Boston-London, 2001].
Отмечено, что весьма важной является способность производных фуллерена улавливать свободные радикалы. Благодаря этому они могут оказаться эффективными средствами для лечения таких нейродегенеративных заболеваний, как болезнь Альцгеймера, Паркинсона и амиотрофический латеральный склероз [7 – L.Dugan, D.M.Turelsky, С.Du, D.Lobner, M.Wheeler, R.Almli, С.К.F. Shen, T.Y.Luh, D.Choi, T.S.Lin, Proc. Natl. Acad. Sci. USA, 1997, 94, 9434].
Столь многообещающие результаты биологических исследований указывают на перспективность дальнейшего изучения водорастворимых производных фуллеренов.
К настоящему моменту описано большое число производных фуллерена С60, называемых водорастворимыми. Большая часть их растворяется только в смеси вода – ДМСО 1:9, причем максимальная концентрация достигает лишь 10-4-10-5 моль/л [8 – Т.Da Ros, M.Prato, Chem. Comm., 1999, 663]. Столь низкая растворимость этих производных фуллеренов затрудняет их биологическое исследование и делает их неперспективными в качестве медицинских препаратов.
Получено также несколько соединений С60, в которых 5-6 объемных аддендов равномерно распределены на поверхности фуллеренового каркаса [9 – L.L.Dugan, D.М.Turelsky, С.Du, D.Lobner, M.Wheeler, R.Almli, С.К.F. Shen, T.Y.Luh, D.Choi, T.S.Lin, Proc. Natl. Acad. Set USA, 1997, 94, 9434; 10 – M.Smith, J.March, “March s Advanced Organic Chemistry”, Willey Interscience, New York-Chichester-Weinheim-Brisbane-Singapore-Toronto, 2001, p.795; 11 – С P.Butts, M.Jazdzyk, Chem. Commun., 2003, 1530]. Такие производные фуллерена хорошо растворяются в воде, однако они теряют способность ингибировать ВИЧ-1 протеазу, а также эффективно генерировать синглетный кислород и улавливать свободные радикалы, что не позволяет их использовать в медицине [12 – D.М.Guldi, K.-D.Asmus, Radiation Physics and Chemistry, 1999, 56, 449]. s Advanced Organic Chemistry”, Willey Interscience, New York-Chichester-Weinheim-Brisbane-Singapore-Toronto, 2001, p.795; 11 – С P.Butts, M.Jazdzyk, Chem. Commun., 2003, 1530]. Такие производные фуллерена хорошо растворяются в воде, однако они теряют способность ингибировать ВИЧ-1 протеазу, а также эффективно генерировать синглетный кислород и улавливать свободные радикалы, что не позволяет их использовать в медицине [12 – D.М.Guldi, K.-D.Asmus, Radiation Physics and Chemistry, 1999, 56, 449].
Таким образом, к настоящему времени было получено лишь несколько (в пределах 10) водорастворимых производных фуллеренов, которые могут найти применение в медицине. Наиболее важными среди них являются 3 синтезированных соединения с дендримерными аддендами, присоединенными к фуллереновому каркасу [13 – М.Brettreich, A.Hirsch, Tetrahedron Lett., 1998, 39, 2731; 14 – Н.Isobe, H.Mashima, E.Nakamura, Org. Lett., 2003, 5, 4461]. Растворимость их в воде составляет 15-35 мг/мл, что оказалось приемлемым для разработки на их основе ингибиторов ВИЧ-1 протеазы. Одно из дендримерных производных С60 [13] в настоящее время проходит заключительную стадию клинических испытаний в качестве препарата для борьбы со СПИДом. Серьезным фактором, ограничивающим массовое использование этого соединения, является сложность его синтеза.
Известны также несколько растворимых в воде конъюгатов с пептидами, углеводами и олигонуклеотидами [15 – F.Pellarini, D.Pantarotto, Т.Da Ros, A.Giangaspero, A.Tossi, M.Prato, Org. Lett., 2001, 3, 1845], которые, однако, не нашли практического применения. По-видимому, это также связано со сложностью и многостадийностью синтезов этих соединений.
Задачей заявляемого изобретения являются новые водорастворимые соединения формул 1 и 2 и способы их получения, а именно:
водорастворимые аминофуллерены – пиперазинсодержащие производные фуллерена C60 общей формулой
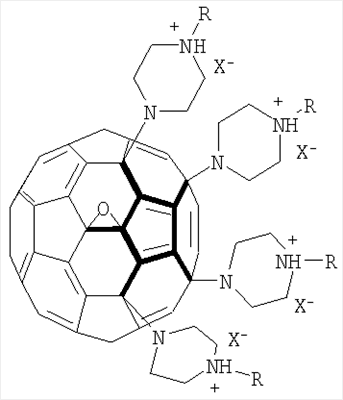
где 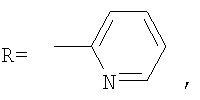 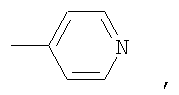 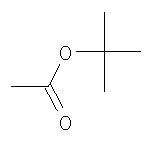 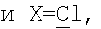 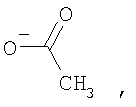 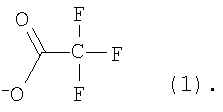
А также водорастворимые аминофуллерены – пиперазинсодержащие производные фуллерена С60 общей формулой
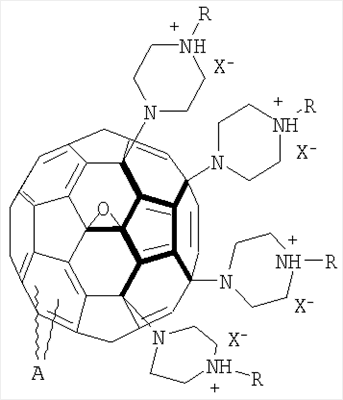
где А – циклопропановый адденд: 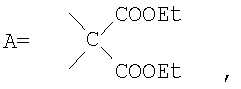 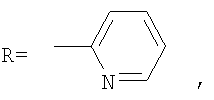 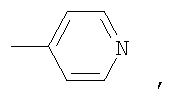  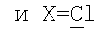 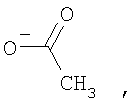 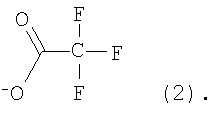
Способ получения водорастворимых аминофуллеренов по п.1 включает фотохимическое взаимодействие фуллерена С60 с амином в течение определенного времени, где в качестве исходного реагента берут соответствующий N-замещенный пиперазин, содержащий электронакцепторную группу на азоте, с последующим выделением целевого продукта методом колоночной хроматографии и дальнейшим превращением полученного продукта в соль.
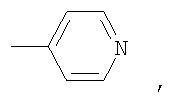
В способе получения водорастворимых аминофуллеренов по п.2 путем фотохимического присоединения амина в качестве исходных реагентов берут производное фуллерена А-С60 (А – циклопропановый адденд) и N-замещенный пиперазин: ((2-пиридил)пиперазин, (4-пиридил)пиперазин или трет-бутоксикарбонилпиперазин, с последующим выделением целевого продукта методом колоночной хроматографии и дальнейшим превращением полученного продукта в соль.
Сущность заявляемого изобретения состоит в следующем.
Заявляемые способы включают реакцию фотохимического радикального присоединения N-замещенных пиперазинов к [60] фуллерену с последующим превращением полученных соединений в водорастворимые соли. Присоединение некоторых N-замещенных пиперазинов было описано ранее [16 – Н.Isobe, N.Tomita, E.Nakamura, Org. Lett., 2000, 2, 3663], однако эта реакция никогда не была использована для получения водорастворимых производных. Более того, авторы [16] утверждали, что циклические амины (в том числе N-метилпиперазин и морфолин) в реакции с фуллереном дают индивидуальное соединение состава С60[амин]4O. Мы детально изучили реакции фуллерена с метилпиперазином и морфолином и показали, что независимо от условий реакции образуется сложная смесь продуктов, среди которых основными являются С60[амин]4O (M1, Фиг.1; описанный ранее [17 – G.Schik, K.-D.Kampe, A.Hirsch, J.Chem. Soc, Chem. Commun., 1995, 2023]) и неизвестные ранее С60[амин]3ОН (М2, Фиг.1) и С60[амин]5OH (М3, Фиг.1). Этот результат был подтвержден данными 1Н и 13С ЯМР-спектроскопии (Фиг.2), а также электроспрей-масс-спектрометрии (Фиг.1).
Впервые нами была показана возможность превращения смеси соединений С60[амин]4O, С60[амин]3ОН и С60[амин]5ОН (амин – N-метилпиперазин) в соответствующие соли, заявляемые в предложенном техническом решении и не описанные ранее в научно-технической литературе. Была измерена растворимость этих солей в воде и показано, что она превышает 300 мг/мл, и таким образом превышает растворимость всех известных соединений.
К сожалению, колоночная хроматография на силикагеле не позволила разделить смесь продуктов реакции фуллерена с N-метилпиперазином. Из-за своей высокой основности эти соединения легко подвергаются гидролизу на силикагеле с образованием смеси продуктов С60[N-метилпиперазин]x(ОН)y.
Впервые было предложено использовать в качестве реагентов N-замещенные пиперазины, содержащие электронакцепторную группу на азоте для подавления склонности к гидролизу аминофуллеренов.
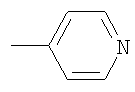
В качестве примеров были выбраны 1-(2-пиридил)пиперазин, 1-(4-пиридил)пиперазин, 1-(третбутоксикарбонил)пиперазин и 2-(1-пиперазинил)пиримидин. Было показано, что основными продуктами реакций этих пиперазинов с фуллереном являются соединения С60[амин]4O и С60[амин]2 (Фиг.3), которые легко разделяются методом колоночной хроматографии на силикагеле.
Состав и строение всех полученных соединений (4 продукта состава С60[амин]4O и 4 С60[амин]2 с разными пиперазинами) было доказано методами 1Н и 13С ЯМР-спектроскопии и масс-спектрометрии. Выходы основного продукта С60[амин]4O в реакциях превышают 60%, что позволяет получать эти соединения в макроколичествах.
Впервые было осуществлено превращение тетраминопроизводных фуллерена С60
(С60[амин]4O) в соли (ацетаты, трифторацетаты, гидрохлориды и др.), растворимость которых в воде превышает 150 мг/мл (Фиг.4).
Важным моментом является проведение реакции при комнатной температуре. Упаривание кислых растворов солей аминопроизводных фуллерена в вакууме при температуре выше 50°С осложняется процессами гидролиза и Гофмановского расщепления.
Предложенные нами способы позволяют также получать другие водорастворимые производные фуллерена С60. Производное состава А-С60 (где А – циклопропановый адденд: 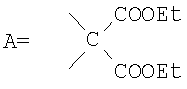 ) было использовано в качестве исходного реагента в реакции радикального присоединения с указанными N-замещенными пиперазинами. Методом колоночной хроматографии нами были выделены продукты состава А-С60[амин]4O. Таким образом, к каркасу производного фуллерена А-С60 присоединяются 4 пиперазиновых остатка и атом кислорода; этот процесс протекает не региоселективно, и в результате образуются смеси изомеров А-С60[амин]4O с разным положением адденда А по отношению к присоединенным пиперазиновым остаткам. Соединения А-С60[амин]4O также легко превращаются в соли, обладающие высокой растворимостью в воде (Фиг.5). ) было использовано в качестве исходного реагента в реакции радикального присоединения с указанными N-замещенными пиперазинами. Методом колоночной хроматографии нами были выделены продукты состава А-С60[амин]4O. Таким образом, к каркасу производного фуллерена А-С60 присоединяются 4 пиперазиновых остатка и атом кислорода; этот процесс протекает не региоселективно, и в результате образуются смеси изомеров А-С60[амин]4O с разным положением адденда А по отношению к присоединенным пиперазиновым остаткам. Соединения А-С60[амин]4O также легко превращаются в соли, обладающие высокой растворимостью в воде (Фиг.5).
Заявляемые нами способы позволяют синтезировать в макроколичествах аминофуллерены, растворимость которых в воде составляет более 150 мг/мл, что почти на порядок превышает растворимость всех других полученных к настоящему моменту производных фуллерена. В заявляемых нами соединениях все адденды расположены вблизи друг от друга, оставляя большую часть фуллеренового каркаса свободной. Такое строение обуславливает сохранение уникальных биологических свойств фуллерена (способность ингибировать ВИЧ-1 протеазу, генерировать синглетный кислород и улавливать свободные радикалы) и указывает на перспективы их медицинского использования.
Заявляемые способы получения водорастворимых производных фуллерена представляются очень важными и для создания водорастворимых производных фуллерена, в структуру которых входят органические лиганды, ответственные за специфические взаимодействия с клеточной мембраной или внутриклеточными структурами и ферментами. Заявляемое техническое решение включает в себя:
1) использование реакции радикального присоединения аминов к [60]фуллерену для получения водорастворимых аминофуллеренов;
2) использование N-замещенных пиперазинов, содержащих электронакцепторную группу на азоте, а именно 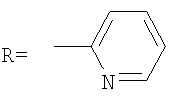 , , 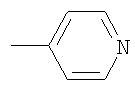 , ,  , для селективного синтеза тетраминопроизводных С60[амин]4O, стабильных по отношению к гидролизу в условиях колоночной хроматографии на силикагеле; , для селективного синтеза тетраминопроизводных С60[амин]4O, стабильных по отношению к гидролизу в условиях колоночной хроматографии на силикагеле;
3) универсальный метод превращения производных фуллерена А-С60 в тетрааминопроизводные А-С60[амин]4O (где  ); );
4) метод превращения аминопроизводных фуллерена С60[амин]4O и АС60[амин]4O в водорастворимые соли (гидрохлориды, ацетаты или трифторацетаты).
Изобретение иллюстрируется следующими примерами.
Пример 1: 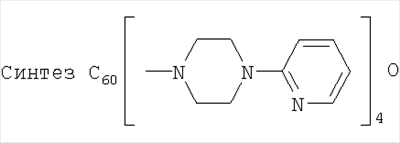 (Фиг.6) (Фиг.6)
Фуллерен (0,5 г; 0,694 ммоль) растворили в 40 мл о-дихлорбензола и к раствору прибавили 2,26 г (13,87 ммоль) 1-(2-пиридил)пиперазина. Смесь мешали на открытом воздухе 24 часа при облучении 60-W лампой при комнатной температуре. Контроль степени образования продукта вели с использованием тонкослойной хроматографии на силуфоле. По окончании реакции раствор разбавили семикратным количеством толуола и прибавили гексан до помутнения. Полученный раствор отфильтровали и нанесли на колонку, заполненную силикагелем (30-75 µ, 90 Å). Продукт состава С60[амин]2О элюировали смесью толуола с гексаном 3:2-4:1. Продукт состава С60[амин]4О начинал элюироваться смесью толуола с гексаном 9:1 и полностью вымывался смесью толуола с метанолом 99.5:0.5. Выделенные фракции упарили под вакуумом, а сухой остаток промыли несколько раз гексаном. Масса продукта С60[амин]4O составила 0,763 г (79%). Полученное соединение С60[амин]4O было охарактеризовано методами 1Н и 13С ЯМР (Фиг.7) и электроспрей-масс-спектрометрией (Фиг.8).
Пример 2: 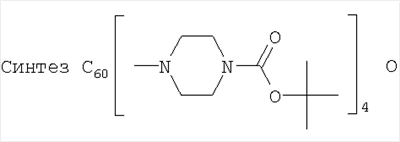
Фуллерен (100 мг; 0,139 ммоль) растворили в 10 мл о-дихлорбензола. К раствору прибавили 600 мг (3,226 ммоль) 1-(третбутоксикарбонил)пиперазина, растворенного в 20 мл о-дихлорбензола. Смесь мешали на открытом воздухе 48 часов при облучении 60-W лампой при комнатной температуре. Контроль степени образования продукта вели с использованием тонкослойной хроматографии на силуфоле. По окончании реакции к раствору добавили 270 мл толуола и прибавляли гексан до появления осадка. Раствор отфильтровали и нанесли на колонку, заполненную силикагелем (30-75 µ, 90 Å). Продукт состава С60[амин]2O элюировали смесью толуола с гексаном 7:3. Продукт состава С60[амин]4O начинал элюироваться толуолом, но полностью вымывался смесью толуола с метанолом 99,5:0,5. Выделенные фракции упарили под вакуумом, а сухой остаток промыли несколько раз гексаном. Масса продукта С60[амин]4O составила 140 мг (68%). Полученное соединение С60[амин]4O было охарактеризовано методами 1Н и 13С ЯМР.
Пример 3: 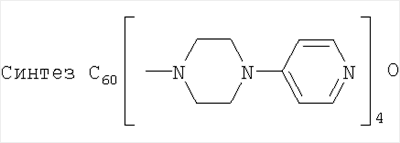
106 мг (0,147 ммоль) фуллерена растворили в 15 мл о-дихлорбензола, предварительного перегнанного над пентаоксидом фосфора в атмосфере аргона. К раствору прибавили 478,5 мг (2,94 ммоль) 1-(4-пиридил)пиперазина. Смесь мешали в среде аргона 15 мин. Затем отвакуумировали колбу с раствором и запустили сухой воздух. Смесь мешали 24 часа при облучении 60-W лампой при комнатной температуре. Выпал осадок. Осадок отцентрифугировали, промыли на центрифуге толуолом и несколько раз метанолом и затем высушили на воздухе. Масса продукта составила 196 мг (96%). Продукт не растворим в толуоле, метаноле, ацетоне, диоксане, слабо растворим в пиридине, ДМСО, ДМФА, очень хорошо растворим в кислотах. Полученное соединение также охарактеризовано методоми ЯМР.
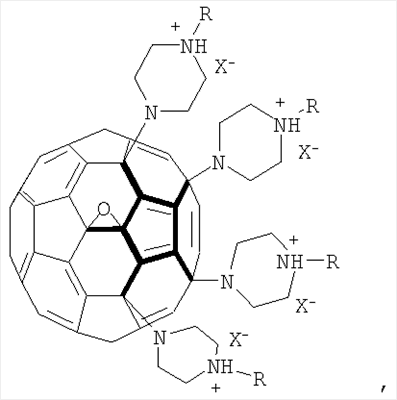
Пример 4: Получение солей пиперазинсодержащих производных фуллерена
500 мг соединения С60[амин4]O растворили при перемешивании в 20 мл концентрированной соляной кислоты (или в таком же объеме уксусной или трифторуксусной кислоты). Полученный раствор отфильтровали в вакууме водоструйного насоса и высушили на воздухе при комнатной температуре (в течение 7-10 дней). Масса полученной соли составила 540 мг (97%) для гидрохлорида, 600 мг (95%) для ацетата и 770 мг (97%) для трифторацетата. Данные химического анализа для гидрохлорида показало присутствие 7.78 и 7.10 формульных единиц HCl на один фуллереновый каркас соответственно. Это соответствует 0.65 и 0,59 HCl на один атом азота, что свидетельствует о том, что менее основный атом азота, присоединенный к фуллерену, не подвергается протонированию в значительной степени. Аналогичная ситуация наблюдается и в случае остальных солей.
Пример 5: Получение смеси соединений 2 из соединения 1 в реакции радикального присоединения.
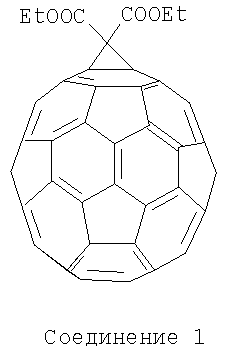
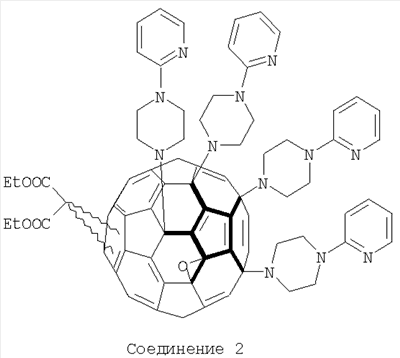
110 мг (0,125 ммоль) соединения 1 растворили в 10 мл о-дихлорбензола и к раствору прибавили 535 мг (3,28 ммоль) 1-(2-пиридил)пиперазина. Смесь мешали на открытом воздухе 48 часов при облучении 60-W лампой при комнатной температуре. Контроль образования продукта вели с использованием тонкослойной хроматографии на силуфоле. По окончании реакции раствор разбавили толуолом до объема 200 мл, добавили 150 гексана, отфильтровали и нанесли на колонку, заполненную силикагелем. Продукт 2 начинает элюироваться смесью толуола с гексаном 4:1 и полностью вымывается смесью толуола с метанолом 98,7:1,3. Полученный раствор 2 упарили под вакуумом, растворили в минимуме толуола и высадили гексаном. Осадок отцентрифугировали, промыли несколько раз гексаном и высушили на воздухе. Масса получившегося продукта составила 144 мг (75%). Соединение было охарактеризовано методами ЯМР и электроспрей-масс-спектрометрии.
Пример 6: Трансформация смеси соединений 2 в водорастворимые соли.
100 мг продукта 2 растворили в 10 мл концентрированной соляной кислоты, отфильтровали под вакуумом и высушили на воздухе. Масса продукта после высушивания составила 100 мг (91%). Аналогично получают водорастворимые соли с уксусной или трифторуксусной кислотой.
Формула изобретения
1. Водорастворимые аминофуллерены – пиперазинсодержащие производные фуллерена С60 общей формулы
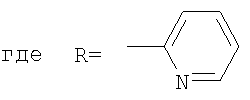 , ,  , ,  и и 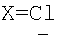 , , 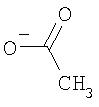 , , 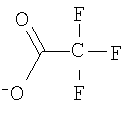 . .
2. Водорастворимые аминофуллерены – пиперазинсодержащие производные фуллерена С60 общей формулы
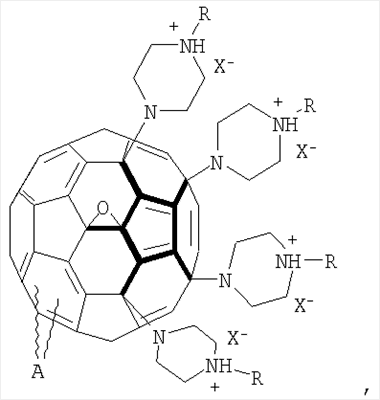
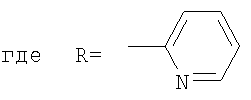 , ,  , ,  , А – циклопропановый адденд: , А – циклопропановый адденд: 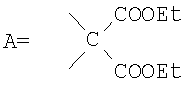 и и 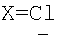 , ,  , ,  . .
3. Способ получения водорастворимых аминофуллеренов, включающий фотохимическое взаимодействие фуллерена С60 с амином, отличающийся тем, что в качестве исходного реагента берут N-замещенный пиперазин, содержащий электронакцепторную группу на азоте, а именно 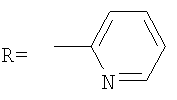 , ,  , ,  , с последующим выделением целевого продукта методом колоночной хроматографии и дальнейшим превращением полученного продукта в соль. , с последующим выделением целевого продукта методом колоночной хроматографии и дальнейшим превращением полученного продукта в соль.
4. Способ получения аминофуллеренов путем фотохимического присоединения амина, отличающийся тем, что в качестве исходных реагентов берут производное фуллерена А-С60, где А – циклопропановый адденд  и N-замещенный пиперазин, содержащий электронакцепторную группу на азоте, а именно и N-замещенный пиперазин, содержащий электронакцепторную группу на азоте, а именно  , ,  , ,  , с последующим выделением целевого продукта методом колоночной хроматографии и дальнейшим превращением полученного продукта в соль (гидрохлорид, ацетат или трифторацетат). , с последующим выделением целевого продукта методом колоночной хроматографии и дальнейшим превращением полученного продукта в соль (гидрохлорид, ацетат или трифторацетат).
РИСУНКИ
|
|