|
|
(21), (22) Заявка: 2006117769/04, 08.10.2004
(24) Дата начала отсчета срока действия патента:
08.10.2004
(30) Конвенционный приоритет:
24.10.2003 DE 10349669.6
(43) Дата публикации заявки: 27.11.2007
(46) Опубликовано: 10.06.2009
(56) Список документов, цитированных в отчете о
поиске:
WO 01/85697 А, 15.11.2001. SU 1598876 A3, 07.10.1990.
(85) Дата перевода заявки PCT на национальную фазу:
24.05.2006
(86) Заявка PCT:
EP 2004/011244 20041008
(87) Публикация PCT:
WO 2005/044803 20050519
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
ХОФФМАНН Хольгер (DE),
ХААГ-РИХТЕР Забине (DE),
КУРЦ Михель (DE),
ТИТГЕН Хайко (DE)
(73) Патентообладатель(и):
САНОФИ-АВЕНТИС ДОЙЧЛАНД ГМБХ (DE)
|
(54) ПРОИЗВОДНЫЕ БЕНГАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ
(57) Реферат:
Настоящее изобретение относится к производным бенгамида, которые продуцируются микроорганизмом Myxococcus virescens ST200611 (DSM 15898) во время ферментации, их применению для лечения и/или профилактики раковых заболеваний, содержащим производные бенгамида лекарственным средствам, способу получения бенгамида формулы (V). Также изобретение относится к соединению формулы (I). Технический результат: получены новые производные бенгамида, обладающие полезными биологическими свойствами. 7 н. и 8 з.п. ф-лы, 7 табл.
Рак является заболеванием человека и животного, протекающим чаще всего с летальным исходом и возникающим за счет неконтролируемого роста гомологичных клеток. Раком называют образование злокачественных опухолей (малигномы), новообразования (опухоли, соответственно карциномы) или злокачественное перерождение (малигнизация), а также нарушение созревания лейкоцитов (лейкемия, рак крови). Раковые или опухолевые клетки возникают за счет превращения гомологичных клеток. Злокачественность раковой клетки выражается в автономии роста, то есть в ее способности инфильтрующе расти беспрепятственно и беспорядочно в плане строения органов и при разрушении ткани. Достоверным признаком злокачественности является образование дальнейших опухолевых метастазирований (метастазы) за счет гематогенного или лимфогенного распространения опухолевых клеток. Рак относится к самым частым причинам смертности человека, и поэтому существует большая потребность в способах и средствах для излечения или терапии злокачественных перерождений.
Возможность терапии злокачественных опухолей включает, наряду с операционным удалением опухоли, если возможно радикальное удаление, лучевую терапию с помощью рентгеновских лучей,  -, -,  -, -,  -лучей, иммунотерапию и химиотерапию. Иммунотерапия в настоящее время применима только в ограниченной мере. Под химиотерапией опухолей понимают введение цитотоксинов (цитостатиков) для лечения опухолей и оставшихся опухолевых клеток чаще всего после локальной хирургической терапии или облучения. Эти вещества специфически опосредуют определенные процессы цитокинеза, так что чувствительнее реагируют ткани с высокой долей делящихся клеток, как, например, быстро растущая опухолевая ткань. Используют алкилирующие соединения, как, например, циклофосфамид, антиметаболиты, как метотрексат, алкалоиды, как винкристин, и антибиотики, как дауномицин или адриамицин. Все эти агенты, однако, из-за значительных побочных действий обладают большими недостатками, так что только отдаляется, но не предотвращается летальный исход. К тому же в случае дегенерированных (раковых) клеток возникают резистентности по отношению к родственным средствам, тогда современные лекарственные средства не действуют более цитостатически, а действуют, вероятно, токсически вследствие побочных действий. -лучей, иммунотерапию и химиотерапию. Иммунотерапия в настоящее время применима только в ограниченной мере. Под химиотерапией опухолей понимают введение цитотоксинов (цитостатиков) для лечения опухолей и оставшихся опухолевых клеток чаще всего после локальной хирургической терапии или облучения. Эти вещества специфически опосредуют определенные процессы цитокинеза, так что чувствительнее реагируют ткани с высокой долей делящихся клеток, как, например, быстро растущая опухолевая ткань. Используют алкилирующие соединения, как, например, циклофосфамид, антиметаболиты, как метотрексат, алкалоиды, как винкристин, и антибиотики, как дауномицин или адриамицин. Все эти агенты, однако, из-за значительных побочных действий обладают большими недостатками, так что только отдаляется, но не предотвращается летальный исход. К тому же в случае дегенерированных (раковых) клеток возникают резистентности по отношению к родственным средствам, тогда современные лекарственные средства не действуют более цитостатически, а действуют, вероятно, токсически вследствие побочных действий.
К тому же обнаружено, что комбинированное или последовательное применение цитостатиков превосходит эффективность отдельного цитостатика (монотерапия), и благодаря этому возможно, что существенные побочные эффекты при полихимиотерапии не суммируются. По всем этим причинам настоятельно необходимы и поэтому во всем мире изыскиваются новые химиотерапевтические средства.
В качестве первых примеров бенгамидов из морской губки Jaspis cf. Coriacea (семейство Coppatiidae, отряд Choristidia B Astrophorida) выделены додеканоилзамещенные в капролактамном цикле бенгамиды А и В (Adamczewski и др., J. Org. Chem., 51, 4497-4498 (1986)) и описаны как биотоксичные по отношению к эукариотическим клеткам, нематодам и бактериям.
Примерами производных бенгамида, в случае которых обнаружена противоопухолевая активность, являются бенгамид Е
и его N-метилированное производное – бенгамид F. Бенгамид Е ингибирует клеточную пролиферацию благодаря тому, что останавливается цитокинез в сайте рестрикции G1/S и в фазе G2/M клеточного цикла. Производные бенгамида В ингибируют клеточную пролиферацию рака молочной железы MDA-MB-435 (Kinder и др., J. Med. Chem., 44, 3692-3699 (2001)).
Общим для известных производных бенгамида является то, что они выделены из морских губок рода Jaspis sp. или Pachastrissa sp (Thale и др., J. Org. Chem., 66, 1733-1741 (2001)).
В настоящее время обнаружено, что штамм микроорганизма Myxococcus virescens ST200611 (Немецкая коллекция микроорганизмов (DSM) 15898) может продуцировать нового рода производные бенгамида, которые в незначительных концентрациях ингибируют клеточную пролиферацию и вследствие этого пригодны для лечения и/или профилактики раковых заболеваний.
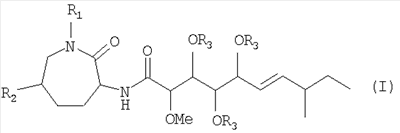
Настоящее изобретение относится к соединению формулы (I):
причем
R1 означает Н или (С1-С6)-алкил;
R2 означает Н или ОН и
R3 означает Н или -С(=О)-(С1-С6)-алкил;
или физиологически приемлемой соли соединения формулы (I).
Независимо друг от друга, R1 означает предпочтительно Н или метил, а R3 означает предпочтительно Н.
Изобретение предпочтительно относится к соединению формулы (I), где
R1 означает Н или метил;
R2 означает Н или ОН и
R3 означает Н;
(С1-С6)-алкил означает линейную или разветвленную алкильную группу с 6 атомами углерода, как, например, метил (Ме), этил, н-пропил, изопропил, трет-бутил или н-гексил, предпочтительно метил.
Далее, изобретение относится к соединению формулы (I), отличающемуся тем, что оно представляет собой соединение формулы (II):
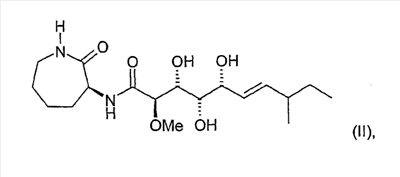
соединение формулы (III):
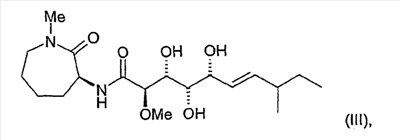
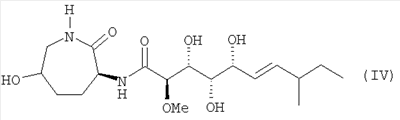
и соединение формулы (IV):
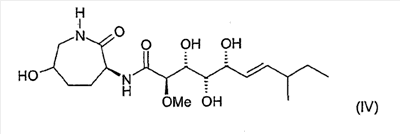
Настоящее изобретение относится далее ко всем очевидным химическим эквивалентам предлагаемых согласно изобретению соединений формулы (I). Такими эквивалентами являются соединения, которые обладают незначительным химическим различием и оказывают такое же фармакологическое действие или в мягких условиях превращаются в предлагаемые согласно изобретению соединения. К указанным эквивалентам относятся, например, также соли, продукты восстановления, продукты окисления, сложные эфиры, простые эфиры, ацетали или амиды соединений формулы (I), а также эквиваленты, которые специалист может получать стандартными способами, сверх того, все оптические антиподы, диастереомеры и все стереоизомерные формы.
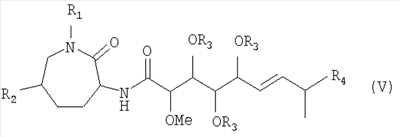
Изобретение относится, далее, к способу получения соединения формулы (V):
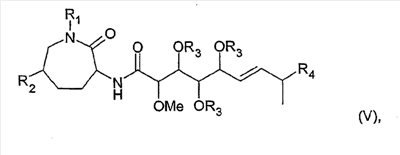
причем
R1 означает Н или (С1-С6)-алкил;
R2 означает Н или ОН;
R3 означает Н или -С(=О)-(С1-С6)-алкил; и
R4 означает метил или этил;
или физиологически приемлемой соли соединения формулы (V),
отличающемуся тем, что
1) штамм Myxococcus virescens ST200611 (DCM 15898) или один из его вариантов и/или мутантов в пригодных условиях ферментируют в культуральной среде вплоть до накопления одного или нескольких из соединений формулы (V) в культуральной среде;
2) соединение формулы (V) выделяют из культуральной среды;
3) соединение формулы (V), в случае необходимости, дериватизируют и/или, в случае необходимости, превращают в физиологически приемлемую соль.
Предпочтительно изобретение относится к способу получения соединения формулы (V), причем R4 означает этил. Продукт такого способа соответствует соединению формулы (I), как описано выше.
Особенно предпочтительно изобретение относится к получению соединения формулы (V), причем, независимо друг от друга, R1 означает Н или метил, R3 означает Н и R4 означает этил.
Далее, изобретение относится к способу получения соединения формулы (II), соединения формулы (III), соединения формулы (IV), а также производных бенгамида Е и F.
Центры хиральности в соединениях формул (I) и (V), если не указано ничего другого, могут находиться в R- или в S-конфигурации. Изобретение относится как к оптически чистым соединениям, так и также к смесям стереоизомеров, как смеси энантиомеров и смеси диастереомеров.
Под физиологически приемлемыми солями соединений формул (I) и (V) понимают как их органические, так и также неорганические соли, которые описываются в Remington’s Pharmaceutical Sciences (17-е издание, с. 1418 (1985)). На основании физической и химической стабильности и растворимости для кислотных групп, среди прочих, предпочтительны соли натрия, калия, кальция и аммония; для основных групп, среди прочих, предпочтительны соли соляной кислоты, серной кислоты, фосфорной кислоты или карбоновых кислот или сульфокислот, как, например, уксусная кислота, лимонная кислота, бензойная кислота, малеиновая кислота, фумаровая кислота, винная кислота и п-толуолсульфокислота.
Культуральной средой является питательный раствор или твердая среда по меньшей мере с одним обычным источником углерода и азота, а также обычными неорганическими солями. Если к культуральной среде добавляют гидроксилизин, то штамм Myxococcus virescens ST200611 (DCM 15898) за счет рестрикции гидроксилизином продуцирует соединение формулы (V), где R2 означает ОН.
Объектом настоящего изобретения также является способ получения соединения формулы (V), как описано выше, причем R2 означает ОН, и причем культуральная среда на стадии 1 содержит гидроксилизин.
Предлагаемый согласно изобретению способ можно использовать для ферментации в лабораторном масштабе (в масштабе от миллилитра до литра) и в промышленном масштабе (в масштабе кубического метра).
В качестве источников углерода для ферментации пригодны ассимилируемые углеводы и редуцированные сахара, как глюкоза, лактоза, сахароза или D-маннит, а также содержащие углеводы природные продукты, как, например, солодовый экстракт или дрожжевой экстракт.
Азотсодержащими питательными веществами являются, например, аминокислоты; пептиды и белки, а также продукты их деструкции, как, например, казеин, пептон или триптон; мясные экстракты; дрожжевые экстракты; глютен; размолотые семена, например, кукурузы, пшеницы, бобов, сои или хлопчатника; остатки после дистилляции при получении спирта; мясная кормовая мука; аммониевые соли; нитраты.
Предпочтительно источником азота является один или несколько синтетически или биосинтетически получаемых пептидов. Неорганические соли включают, например, хлориды, карбонаты, сульфаты или фосфаты щелочных или щелочноземельных металлов, железа, цинка, кобальта и марганца. Микроэлементами являются, например, кобальт и марганец.
Пригодными условиями для образования предлагаемых согласно изобретению бенгамидов являются следующие: образование предлагаемых согласно изобретению бенгамидов предпочтительно происходит в культуральной среде, которая содержит 0,05-5%, предпочтительно 0,1-2,5% дрожжевого экстракта; 0,2-5,0%, предпочтительно 0,1-2% казитона; 0,02-1,0%, предпочтительно 0,05-0,5% CaCl2 x 2 H2O; 0,02-1,5%, предпочтительно 0,05-0,7% MgSO4 x 7H2O, а также от 0,00001% до 0,001% цианокобаламина. Данные в процентах соответственно относятся к массе всего питательного раствора.
Культивирование микроорганизма осуществляют аэробно, например, в виде погруженных культур при встряхивании или при перемешивании во встряхиваемых колбах или ферментерах или на твердой среде, в случае необходимости, при введении воздуха или кислорода. Культивирование можно осуществлять в диапазоне температур от примерно 18°С до 35°С, предпочтительно при от примерно 20°С до 32°С, в особенности, при 27-30°С. Область значений рН должна составлять от 4 до 10, предпочтительно от 6,5 до 7,5. Микроорганизм в этих условиях культивируют, в общем, в течение периода времени от 2 суток до 10 суток, предпочтительно от 72 часов до 168 часов. Предпочтительно культивируют на нескольких стадиях, то есть сначала на водной питательной среде получают одну или несколько предкультур, которые затем пересевают на непосредственно продуцирующую среду, основная культура, например, в объемном соотношении от 1:10 до 1:100. Предкультуру получают, например, тем, что штамм в форме вегетативных клеток или плодовых тел пересевают на питательный раствор и оставляют расти в течение примерно 20-120 часов, предпочтительно 48-96 часов. Вегетативные клетки и/или плодовые тела можно получать, например, тем, что штамм в течение примерно 1-15 суток, предпочтительно 4-10 суток, оставляют расти на твердой или жидкой питательной среде, например дрожжевом агаре.
Выделение, соответственно очистку производного бенгамида формулы (V) из культуральной среды осуществляют известными способами при учете химических, физических и биологических свойств природных веществ. Для определения концентрации соответствующих производных бенгамида в культуральной среде или на отдельных стадиях выделения используют высокоэффективную жидкостную хроматографию (ВЭЖХ), причем количество образовавшегося вещества целесообразно сравнивают с эталонным раствором.
Для выделения культуральный бульон или культуру вместе с твердой средой лиофилизируют, затем производное бенгамида экстрагируют из лиофилизата с помощью органического растворителя, как, например, метанол или 2-пропанол. Органическая фаза растворителя содержит предлагаемые согласно изобретению природные вещества, ее, в случае необходимости, концентрируют в вакууме и очищают далее.
Дальнейшую очистку одного или нескольких соединений согласно изобретению осуществляют хроматографией на пригодных материалах, предпочтительно, например, при использовании молекулярных сит, силикагеля, оксида алюминия, ионообменников или адсорбирующих смол, соответственно обращенных фаз (RP). С помощью этой хроматографии разделяют производные бенгамида. Хроматографию производных бенгамида осуществляют с помощью забуференных водных растворов или смесей водных и органических растворов.
Под смесями водных или органических растворов понимают все смешивающиеся с водой органические растворители, предпочтительно метанол, 2-пропанол и ацетонитрил, при концентрации от 5% до 95% растворителя, предпочтительно от 5% до 40% растворителя, или также все забуференные водные растворы, которые смешиваются с органическими растворителями. Используемыми буферами являются такие, как указанные выше.
Разделение производных бенгамида на основании их различной полярности осуществляют путем хроматографии с обращенной фазой (RP), например, на MCI® (адсорбирующая смола, фирма Mitsubishi, Япония) или Amberlite XAD® (TOSOHAAS), или на других гидрофобных материалах, как, например, на RP-8- или RP-18-фазах. Кроме того, разделение можно осуществлять с помощью хроматографии на нормальных фазах, например, на силикагеле, оксиде алюминия и подобных.
Хроматографию производных бенгамида осуществляют с помощью забуференных, щелочных или подкисленных водных растворов или смесей водных растворов со спиртами или другими, смешивающимися с водой органическими растворителями. В качестве органического растворителя предпочтительно используют ацетонитрил и метанол.
Под забуференными, щелочными или подкисленными водными растворами понимают, например, воду, фосфатный буфер, ацетат аммония, цитратный буфер, в концентрации вплоть до 0,5 М, а также муравьиную кислоту, уксусную кислоту, трифторуксусную кислоту, аммиак, триэтиламин или все обычные, известные специалисту кислоты и основания предпочтительно в концентрации вплоть до 1%. В случае забуференных водных растворов особенно предпочтительным является 0,1%-ный раствор ацетата аммония.
Хроматографируют с помощью градиента, который начинается со 100% воды и заканчивается 100% растворителя, предпочтительно используют линейный градиент 5-95% ацетонитрила.
Альтернативно, также осуществляют гель-хроматографию или хроматографию на гидрофобных фазах. Гель-хроматографию осуществляют на полиакриламидных или сополимерных гелях, как, например, Biogel-P 2® (Biorad) или Fractogel TSK HW 40® (Merck, Германия). Последовательность вышеуказанный хроматографий является обратимой.
Если бенгамиды находятся в виде диастереомеров, то их можно разделять известными методами, например путем разделения на колонке с хиральной фазой.
Дериватизацию ОН-групп в боковой цепи соединений формул (I) или (V) (R3 соответственно означает Н) до ацильной группы (R4 соответственно означает -С(=О)-(С1-С6)-алкил) осуществляют само по себе известными способами (J. March, Advanced Organic Chemistry, John Wiley and Sons, 4-е издание, 1992), например, путем введения во взаимодействие с ангидридом кислоты. Взаимодействие с ацетангидридом с получением соединения формулы (I) или (V), где R3 означает -С(=О)=СН3, описывается, например, Adamczeski и др., J. Am. Chem. Soc., 111, 647-654 (1989).
Алкилирование NH-группы в капролактамном цикле соединения формулы (I) или (V) (R1 соответственно означает Н) осуществляют также само по себе известными способами (J. March, Advanced Organic Chemistry, John Wiley and Sons, 4-е издание, 1992), например, путем реакции с Ме2СО3 или Ме2SO4 для получения соответствующих N-метилированных производных или путем реакции с (С1-С6)-алкилбромидом в присутствии основания.
Изолят штамма микроорганизма Myxococcus virescens ST200611 депонирован в Немецкой коллекции микроорганизмов и клеточных культур ГмбХ (DSMZ), Mascheroder Weg 1B, 38124 Брауншвейг, Германия, согласно положениям Будапештского соглашения от 11.09.2003 под следующим номером: DSM 15898.
Вегетативные клетки штамма DSM 15898 имеют характерную для Myxococcus virescens палочковидную форму. На твердых питательных средах Myxococcus virescens ST200611 (DSM 15898) образует оранжево-желтые плодовые тела, которые содержат круглые миксо-споры.
Вместо штамма Myxococcus virescens ST200611 (DSM 15898) можно также использовать его мутанты и/или варианты, которые синтезируют одно или несколько из предлагаемых согласно изобретению соединений.
Мутантом является микроорганизм, в котором модифицированы один или несколько генов генома, причем функционально или наследуемо сохраняются ген или гены, которые ответственны за способность организма продуцировать предлагаемое согласно изобретению соединение.
Такие мутанты можно получать само по себе известным образом за счет физических средств, например облучения, как облучение с помощью ультрафиолетовых или рентгеновских лучей, или химических мутагенов, как, например, этилметансульфонат (EMS); 2-гидрокси-4-метоксибензофенон (МОВ) или N-метил-N’-нитро-N-нитрозогуанидин (MNNG), или как описывается Brock и др. в книге  Biology of Microorganism Biology of Microorganism , Prentice Hall, c. 238-247 (1984). , Prentice Hall, c. 238-247 (1984).
Вариантом является фенотип микроорганизма. Микроорганизмы обладают способностью адаптироваться к окружающей их среде и поэтому проявляют характерную физиологическую гибкость. В случае фенотипической адаптации в процесс вовлекаются все клетки микроорганизма, причем род изменения обусловлен не генетически и обратим в измененных условиях (H. Stolp, Microbial ecology: organismus, habitats, activities. Cambridge University Press, Кембридж, Великобритания, с. 180 (1988)).
Скрининг мутантов и/или вариантов, которые синтезируют одно или несколько предлагаемых согласно изобретению соединений, осуществляют по следующей схеме:
– лиофилизация ферментационной среды;
– экстракция лиофилизата с помощью органического растворителя;
– экстракция соединения из культурального фильтрата с помощью твердых фаз;
– анализ путем ВЭЖХ, тонкослойной хроматографии или путем тестирований биологической эффективности.
Описанные условия ферментации имеют значение для Myxococcus virescens ST200611 (DSM 15898), а также для его мутантов и/или вариантов.
Объектом настоящего изобретения, далее, является применение микроорганизма Myxococcus virescens ST200611 (DSM 15898) или мутанта и/или варианта для получения соединения формулы (V), в особенности соединения формулы (IV), или его физиологически приемлемой соли, как описано выше.
Для обнаружения ингибирования клеточной пролиферации используют тест, основанный на определении внутриклеточной концентрации АТФ. Можно использовать известные линии опухолевых клеток, как, например, Нер-G2 и Colo205. В этом тесте содержание АТФ метаболически активных клеток при этом по реакции с люциферазой служит в качестве меры числа живых клеток.
Соединения формул (II)-(IV) в тесте использовали в разовой дозе 0,3-40 мкМ, и зависимость от дозы указана в виде значения ТС50, причем (IIA) и (IIB) соответственно означают диастереомер соединения формулы (II):
Таблица 1
Эффективность бенгамида в тесте на клеточную пролиферацию в виде значения ТС50 в мкМ |
| Соединение |
Hep-G2 |
Colo 205 |
| (II) |
16 |
27 |
| (IIA) |
17 |
33 |
| (IIB) |
6 |
10 |
| (III) |
9 |
15 |
| (IV) |
>40 |
42 |
| Бенгамид Е |
36 |
46 |
| Бенгамид F |
27 |
33 |
Объектом изобретения, далее, является применение соединения формулы (I) или его физиологически приемлемой соли в качестве лекарственного средства в медицине человека или животного, в особенности для лечения и/или профилактики раковых заболеваний. Предпочтительно изобретение относится к применению соединения формулы (I) или физиологически приемлемой соли для лечения рака молочной железы, рака кишки, рака желудка, рака печени, опухолей головного мозга, опухолей яичника, рака пищевода, рака почки, мышечной карциномы, в особенности карциномы мышщ головы и затылка.
Далее, настоящее изобретение относится к лекарственному средству с содержанием по меньшей мере одного соединения формулы (I) или его физиологически приемлемой соли, причем соединение или соединения формулы (I) можно вводить как таковые в виде вещества или предпочтительно в смеси с одним или несколькими обычными фармакологически пригодными носителями или вспомогательными веществами.
Предлагаемые согласно изобретению соединения являются стабильными в твердом состоянии и в растворах в области значений рН от 2 до 9 и тем самым могут вводиться в обычные галеновые композиции.
Предлагаемые согласно изобретению лекарственные средства можно вводить перорально или парентерально, однако, также, в принципе возможно ректальное применение. Пригодными твердыми или жидкими галеновыми формами композиций являются, например, грануляты, порошки, таблетки, драже, (микро)капсулы, суппозитории, сиропы, эмульсии, суспензии, аэрозоли, капли или инъецируемые растворы в ампульной форме, а также препараты с протрагированным высвобождением биологически активного вещества, при получении которых обычно находят применение фармакологически пригодные носители или вспомогательные вещества, как порофоры, связующие, средства для покрытия, способствующие набуханию средства, придающие скользкость средства или смазки, вкусовые вещества, подсластители или способствующие растворению вещества, как, например, карбонат магния, диоксид титана, лактоза, маннит и другие сахара, тальк, молочный белок, желатин, крахмал, витамины, целлюлоза и ее производные, животные или растительные масла, полиэтиленгликоли и растворители, как, например, стерильная вода, спирты, глицерин и многоатомные спирты.
В случае необходимости дозированные единицы для орального введения можно микроинкапсулировать для замедления или продления в течение более длительного промежутка времени высвобождения, как, например, путем нанесения покрытия или введения биологически активного вещества в форме частиц в пригодные полимеры, воски или тому подобное.
Предпочтительно фармацевтические препараты получают и вводят в виде дозированных единиц, причем каждая единица в качестве активного компонента содержит определенную дозу одного или нескольких производных бенгамида формулы (I). В случае твердых дозированных единиц, как таблетки, капсулы и суппозитории, эта доза может составлять вплоть до примерно 500 мг, предпочтительно, однако, примерно 0,1-200 мг, а в случае растворов для инъекций в ампулах – вплоть до примерно 200 мг, предпочтительно, однако, примерно 0,5-100 мг в сутки.
Вводимая суточная доза зависит от массы тела, возраста, пола и состояния млекопитающего. Смотря по обстоятельствам, однако, можно вводить также более высокие или более низкие суточные дозы. Введение суточной дозы можно осуществлять путем одноразового введения в форме отдельной дозированной единицы или, однако, в виде нескольких меньших дозированных единиц, как также путем многократного введения разделенных доз через определенные интервалы.
Предлагаемые согласно изобретению лекарственные средства получают тем, что одно или несколько из предлагаемых согласно изобретению соединений формулы (I) необязательно вместе с одним или несколькими обычными носителями или вспомогательными веществами доводят до пригодной формы введения.
Следующие примеры должны служить для более подробного пояснения изобретения, без ограничения каким-либо образом объема охраны изобретения.
Если не приводятся никакие другие указания, данные в процентах относятся к массе, а соотношение компонентов в смеси в случае жидкостей относятся к объему.
Пример 1
Хранение при температуре -135°С Myxococcus virescens ST200611 (DSM 15898)
Агаровую пластинку (1% свежих хлебопекарных дрожжей, 1% CaCl2 x 2H2O, 20 мМ ГЕПЕС, 0,00005% цианокобаламина, 1,5% агара, рН=7,2) инокулируют штаммом Myxococcus virescens ST200611 (DSM 15898) и инкубируют в течение примерно 7 суток при температуре 30°С. Клетки этой поверхностной культуры соскабливают стерильным шпателем с агаровой поверхности, ресуспендируют в 0,5 мл казитоновой среды (1% казитона (Difco), 0,15% MgSO4 x 7H2O, рН=7,0) и хранят при температуре -135°С.
Пример 2
Получение предкультуры Myxococcus virescens ST200611 (DSM 15898) в колбе Эрленмейера
100 мл Питательного раствора (1% свежих хлебопекарных дрожжей, 1% CaCl2 x 2H2O, 20 мМ ГЕПЕС, 0,00005% цианокобаламина, рН=7,2) в стерильной колбе Эрленмейера емкостью 300 мл инокулируют с помощью штамма Myxococcus virescens ST200611 (DSM 15898) и инкубируют на вращающейся машине для встряхивания в течение 4 суток при температуре 30°С и со скоростью 180 оборотов в минуту. 5 мл этой предкультуры затем используют для получения основных культур.
Пример 3
Получение жидкой основной культуры Myxococcus virescens ST200611 (DSM 15898)
Стерильную колбу Эрленмейера емкостью 300 мл с 100 мл следующего питательного раствора (0,5% дрожжевого экстракта, 0,5% казитона, 0,1% CaCl2 x 2H2O, 0,2% MgSO4 x 7H2O, 0,00005% цианокобаламина, рН=7,4) инокулируют с помощью 5 мл предкультуры (см. пример 2) или выращенной на свежей агаровой пластинке культуры (1% свежих хлебопекарных дрожжей, 1% CaCl2 x 2H2O, 20 мМ ГЕПЕС, 0,00005% цианокобаламина, рН=7,2, дополнительно 1,5% агара) и инкубируют на машине для встряхивания при температуре 30°С и скорости 180 оборотов в минуту. Максимального продуцирования предлагаемых согласно изобретению бенгамидов достигают спустя 72-96 часов. Для инокуляции ферментеров емкостью от 10 л до 200 л достаточно 72-96-часовой погруженной культуры (количество инокулята составляет примерно 5-10%) из такого же питательного раствора, как описано в примере 2.
Пример 4
Получение жидкой основной культуры Myxococcus virescens ST200611 (DSM 15898) при добавлении гидроксилизина для продуцирования производного бенгамида формулы (IV)
Стерильную колбу Эрленмейера емкостью 300 мл с 100 мл следующего питательного раствора (0,5% дрожжевого экстракта, 0,5% казитона, 0,1% CaCl2 x 2H2O, 0,2% MgSO4x7H2O, 0,00005% цианокобаламина, а также 1 мМ гидроксилизина, рН=7,4) инокулируют с помощью 5 мл предкультуры из примера 2 или выращенной на свежей агаровой пластинке культуры (1% свежих хлебопекарных дрожжей, 1% CaCl2 x 2H2O, 20 мМ ГЕПЕС, 0,00005% цианокобаламина, рН=7,2, дополнительно 1,5% агара) и инкубируют на машине для встряхивания при температуре 30°С и скорости 180 оборотов в минуту. Максимального продуцирования производного бенгамида формулы (IV) достигают спустя 72-96 часов. Анализ осуществляют посредством ВЭЖХ-МС. Для инокуляции ферментеров емкостью от 10 л до 200 л достаточно 72-96-часовой погруженной культуры (количество инокулята составляет примерно 5-10%) из такого же питательного раствора, как описано в примере 2.
Пример 5
Получение производных бенгамида в ферментере
Ферментеры емкостью 10 л и 30 л функционируют в следующих условиях:
| инокулят |
примерно 5% |
примерно 9% |
| ферментер |
30 л |
10 л |
| питательная среда: |
см. пример 2 |
см. пример 2 |
| температура инкубации: |
30°С |
30°С |
| скорость мешалки: |
112 об/мин |
150 об/мин |
| аэрация: |
8 л/мин |
4 л/мин |
| регулирование рН: |
с рН=7,8 до рН=7,5 |
с рН=8,1 до рН=7,5 |
| регулирование рО2: |
никакое |
никакое |
Регулирование значения рН всегда осуществляют с помощью 10%-ного раствора КОН, соответственно 10%-ной H2SO4. За счет неоднократной добавки Clerol FBA 265 (Cognis Deutschland GmbH) можно подавлять пенообразование. Максимум продуцирования достигается спустя примерно 72-96 часов.
Пример 6
Выделение производных бенгамида формул (II) и (III), а также бенгамидов Е и F из выращиваемых при постоянном встряхивании культур Myxococcus virescens ST200611 (DSM 15898)
По окончании ферментации Myxococcus virescens ST200611 (DSM 15898) культуральный бульон из примера 3 (30 л культурального бульона) вместе с биомассой лиофилизируют и лиофилизат экстрагируют метанолом (2 раза по 5 л). Метанольный экстракт уменьшают в вакууме до объема 1,2 л и затем вносят в предварительно подготовленную колонку, которая заполнена примерно 15 л материала СНР-20Р (MCI®-гель, 75-150 микрон, Mitsubishi Chemical Corporation). Элюируют с помощью 95%-ного метанола. Собирают поток из колонки (120 мл/мин) и в вакууме уменьшают до объема 1,5 л.
Пример 7
Предварительное разделение производных бенгамида формул (II) и (III), а также бенгамидов Е и F путем хроматографии с обращенной фазой С18
1,5 л Полученного согласно примеру 6 раствора вносят в колонку Phenomenex Luna®, 10 микрон, С18(2) (размер: 50 мм х 250 мм) с предварительной колонкой Luna®, 10 микрон, С18(2) (размер: 21,2 см х 60 мм) и элюируют в течение 60 минут с помощью градиента от 5% до 95% ацетонитрила в воде (0,1% ацетата аммония, рН=4,6 устанавливают с помощью уксусной кислоты). Поток составляет 150 мл/мин, объем фракций составляет 200 мл. Бенгамиды находятся во фракциях 5-9, 10-11 и 12-14.
Пример 8
Очистка производных бенгамида формул (II) и (III), а также бенгамидов Е и F
Отдельные фракции из примера 7 лиофилизируют и еще раз очищают путем ВЭЖХ при использовании колонки Phenomenex Luna®, 10 мкм, С18(2) (размер: 21 мм х 250 мм) с предварительной колонкой XTerra®Prep MS C18, 10 мкм (Waters; размер: 19 мм х 10 мм). Элюируют в течение 40 минут с помощью градиента от 5% до 40% ацетонитрила в воде (с добавкой 0,1% ацетата аммония, рН=8,8 устанавливают с помощью триэтиламина). Поток из колонки (50 мл/мин) собирают фракциями (фракции по 7,5 мл). Фракция 5-9 из примера 7 содержит соединение формулы (III) и после хроматографии и лиофилизации дает 86 мг бенгамида Е (чистота >95%). Фракция 10-11 из примера 7 после хроматографии дает 145 мг бенгамида формулы (II) (чистота >95%, смесь диастереомеров в соотношении 70:30) и 5 мг бенгамида F (чистота >95%). Из фракции 12-14 из примера 7 получают 35 мг бенгамида формулы (III) (чистота >95%) в виде смеси диастереомеров в соотношении 75:25. В случае диастереомеров речь идет, соответственно, о соответствующих эпимерах С-16.
Пример 9
Выделение гидроксибенгамида формулы (IV) из выращиваемых при постоянном встряхивании культур Myxococcus virescens ST200611 (DSM 15898)
По окончании ферментации Myxococcus virescens ST200611 (DSM 15898) культуральный бульон из примера 5 (10 л культурального бульона) вместе с биомассой лиофилизируют и лиофилизат экстрагируют метанолом (2 раза по 3 л). Метанольный экстракт уменьшают в вакууме до объема 400 мл и затем вносят в предварительно подготовленную колонку, которая заполнена 0,6 л материала СНР-20Р (MCI®-гель, 75-150 микрон, Mitsubishi Chemical Corporation). Элюируют с помощью 5-95% метанола в воде. Поток из колонки (100 мл/мин) собирают в течение 60 минут фракциями (0,5 минут на фракцию). Содержащие желательное производное фракции (фракция 45-109) объединяют и в вакууме уменьшают до объема 700 мл.
Пример 10
Предварительная очистка гидроксибенгамида формулы (IV) путем хроматографии с обращенной фазой С-18
Раствор из примера 9 затем вносят в колонку Phenomenex Luna®, 10 микрон, С18(2) (размер: 50 мм х 250 мм) с предварительной колонкой Luna®, 10 микрон, С18(2) (размер: 21,2 см х 60 мм) и элюируют в течение 60 минут с помощью градиента от 5% до 40% ацетонитрила в воде (0,1% ацетата аммония, рН=48,8 устанавливают с помощью триэтиламина). Поток составляет 150 мл/мин, объем фракций составляет 225 мл. Фракция 22 содержит желательное производное бенгамида.
Пример 11
Очистка гидроксибенгамида формулы (IV)
Фракцию 22 из примера 10 лиофилизируют и еще раз очищают посредством ВЭЖХ при использовании колонки Phenomenex Luna®, 10 мкм, С18(2) (размер: 21 мм х 250 мм) с предварительной колонкой Waters XTerra®Prep MS C18, 10 мкм (размер: 19 мм х10 мм). Элюируют в течение 60 минут с помощью градиента от 5% до 95% ацетонитрила в воде (с добавкой 0,1% ацетата аммония, рН=4,6 устанавливают с помощью уксусной кислоты). Поток из колонки (50 мл/мин) собирают фракциями (фракции по 7,5 мл). Содержащие бенгамид фракции (фракция 26-28) объединяют, обессоливают и подвергают сушке вымораживанием. При этом получают 7 мг бенгамида формулы (IV) в виде смеси диастереомеров в соотношении 75:25.
Пример 12
Характеристика соединения формулы (II)
Суммарная формула: С18Н32N2O6
Молекулярная масса: 372,47
Смесь диастереомеров: 75:25
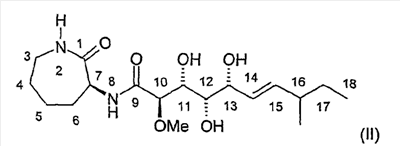
Таблица 2
Химические сдвиги по ЯМР бенгамида формулы (II),
смесь диастереомеров, с=3 мг/мл в ДМСО, 300 К |
| Положение |
1Н |
13С |
| 1 |
– |
173,99 |
| 2 |
7,91 |
– |
| 3 |
3,19/3,06 |
40,56 |
| 4 |
1,74/1,20 |
28,75 |
| 5 |
1,87/1,64 |
27,55 |
| 6 |
1,87/1,36 |
30,72 |
| 7 |
4,39 |
51,27 |
| 8 |
7,78 |
– |
| 9 |
– |
169,61 |
| 10 |
3,69 |
81,60 |
| 10-ОМе |
3,25 |
57,32 |
| 11 |
3,58 |
70,72 |
| 11-ОН |
4,46 |
– |
| 12 |
3,33 |
72,80 |
| 12-ОН |
4,36 |
– |
| 13 |
3,97 |
72,46 |
| 13-ОН |
4,56 |
– |
| 14 |
5,37 |
129,05 |
| 15 |
5,48 |
136,57 |
| 16 |
1,99 |
37,41 |
| 16-Ме |
0,93 |
19,90 |
| 17 |
1,26 |
29,15 |
| 18 |
0,81 |
11,58 |
Пример 13
Характеристика соединения формулы (III)
Суммарная формула: С19Н34N2O6
Молекулярная масса: 386,49
Смесь диастереомеров: 75:25
Таблица 3
Химические сдвиги по ЯМР бенгамида формулы (III),
смесь диастереомеров, с=3 мг/мл в ДМСО, 300 К |
| Положение |
1Н |
13С |
| 1 |
– |
171,95 |
| 2 |
2,91 |
35,28 |
| 3 |
3,61/3,21 |
49,20 |
| 4 |
1,71/1,31 |
26,13 |
| 5 |
1,82/1,67 |
27,11 |
| 6 |
1,84/1,32 |
30,80 |
| 7 |
4,55 |
51,14 |
| 8 |
7,84 |
– |
| 9 |
– |
169,54 |
| 10 |
3,69 |
81,55 |
| 10-ОМе |
3,25 |
57,28 |
| 11 |
3,57 |
70,69 |
| 11-ОН |
4,45 |
– |
| 12 |
3,33 |
72,77 |
| 12-ОН |
4,37 |
– |
| 13 |
3,97 |
72,47 |
| 13-ОН |
4,56 |
– |
| 14 |
5,37 |
129,04 |
| 15 |
5,48 |
136,58 |
| 16 |
1,99 |
37,41 |
| 16-Ме |
0,93 |
19,89 |
| 17 |
1,26 |
29,15 |
| 18 |
0,81 |
11,58 |
Пример 14
Характеристика соединения формулы (IV)
Суммарная формула: С18Н32N2O7
Молекулярная масса: 388,46
Смесь диастереомеров: 75:25
Таблица 4
Химические сдвиги по ЯМР бенгамида формулы (IV),
смесь диастереомеров, с=3,1 мг/мл в ДМСО, 300 К |
| Положение |
1Н |
13С |
| 1 |
– |
173,45 |
| 2 |
7,55 |
– |
| 3 |
3,35/3,02 |
45,05 |
| 4 |
3,74 |
63,48 |
| 4-ОН |
4,60 |
– |
| 5 |
1,81/1,75 |
34,28 |
| 6 |
1,68/1,64 |
24,25 |
| 7 |
4,32 |
51,18 |
| 8 |
7,77 |
– |
| 9 |
– |
169,63 |
| 10 |
3,70 |
81,59 |
| 10-ОМе |
3,26 |
57,30 |
| 11 |
3,58 |
70,73 |
| 11-ОН |
4,47 |
– |
| 12 |
3,34 |
72,82 |
| 12-ОН |
4,38 |
– |
| 13 |
3,97 |
72,47 |
| 13-ОН |
4,56 |
– |
| 14 |
5,37 |
129,06 |
| 15 |
5,48 |
136,57 |
| 16 |
1,99 |
37,41 |
| 16-Ме |
0,93 |
19,90 |
| 17 |
1,26 |
29,15 |
| 18 |
0,81 |
11,58 |
Пример 15
Характеристика бенгамида Е
Суммарная формула: С17Н30N2O6
Молекулярная масса: 358,44
Таблица 5
Химические сдвиги по ЯМР бенгамида E, с=3 мг/мл
в ДМСО, 300 К |
| Положение |
1Н |
13С |
| 1 |
– |
174,01 |
| 2 |
7,91 |
– |
| 3 |
3,19/3,06 |
40,56 |
| 4 |
1,74/1,20 |
28,75 |
| 5 |
1,87/1,64 |
27,56 |
| 6 |
1,87/1,36 |
30,72 |
| 7 |
4,39 |
51,27 |
| 8 |
7,78 |
– |
| 9 |
– |
169,60 |
| 10 |
3,69 |
81,61 |
| 10-ОМе |
3,25 |
57,30 |
| 11 |
3,56 |
70,74 |
| 11-ОН |
4,49 |
– |
| 12 |
3,33 |
72,78 |
| 12-ОН |
4,38 |
– |
| 13 |
3,96 |
72,38 |
| 13-ОН |
4,57 |
– |
| 14 |
5,38 |
127,68 |
| 15 |
5,58 |
137,85 |
| 16 |
2,24 |
30,08 |
| 17 |
0,95 |
22,27 |
| 18 |
0,95 |
22,17 |
Пример 16
Характеристика бенгамида F
Суммарная формула: С18Н32N2O6
Молекулярная масса: 372,47
Таблица 6
Химические сдвиги по ЯМР бенгамида F, с=3 мг/мл
в ДМСО, 300 К |
| Положение |
1H |
| 1 |
– |
| 2 |
2,91 |
| 3 |
3,62/3,21 |
| 4 |
1,69/1,33 |
| 5 |
1,84/1,69 |
| 6 |
1,84/1,33 |
| 7 |
4,56 |
| 8 |
7,84 |
| 9 |
– |
| 10 |
3,70 |
| 10-OMe |
3,25 |
| 11 |
3,57 |
| 12 |
3,33 |
| 13 |
3,97 |
| 14 |
5,38 |
| 15 |
5,59 |
| 16 |
2,25 |
| 17 |
0,95 |
| 18 |
0,95 |
Пример 17
Разделение диастереомеров соединения формулы (II)
Разделение смеси диастереомеров соединения формулы (II) из примера 8 осуществляют на колонке с хиральной фазой (AD/H, Daicel, 20 мм х 200 мм, поток 0,5 мл, элюирующее средство: ацетонитрил:метанол=4:1+0,1% ацетата аммония). Оптическую чистоту контролируют на аналитической колонке AD/H (Diacel) (4,6 мм х 250 мм; 30°С; элюирующее средство: ацетонитрил:метанол=4:1+0,1% ацетата аммония; поток 0,75 мл; выход пика 1:9,9 минут, выход пика 2:10,9 минут).
Таблица 7
Химические сдвиги по ЯМР диастереомеров бенгамида
формулы (II), с=3 мг/мл в ДМСО, 300 К |
 |
1Н(А) |
1Н(В) |
13С(А) |
13С(В) |
| 1 |
– |
– |
173,99 |
173,99 |
| 2 |
7,91 |
7,91 |
– |
– |
| 3 |
3,19/3,06 |
3,19/3,06 |
40,56 |
40,56 |
| 4 |
1,74/1,20 |
1,74/1,20 |
28,75 |
28,75 |
| 5 |
1,87/1,64 |
1,87/1,64 |
27,55 |
27,55 |
| 6 |
1,87/1/36 |
1,87/1/36 |
30,72 |
30,72 |
| 7 |
4,39 |
4,39 |
51,27 |
51,27 |
| 8 |
7,78 |
7,78 |
– |
– |
| 9 |
– |
– |
169,61 |
169,61 |
| 10 |
3,69 |
3,69 |
81,60 |
81,60 |
| 10-OMe |
3,25 |
3,25 |
57,32 |
57,32 |
| 11 |
3,58 |
3,58 |
70,72 |
70,77 |
| 11-OH |
4,46 |
4,47 |
– |
– |
| 12 |
3,33 |
3,33 |
72,80 |
72,85 |
| 12-OH |
4,36 |
4,36 |
– |
– |
| 13 |
3,97 |
3,97 |
72,46 |
72,37 |
| 13-OH |
4,56 |
4,56 |
– |
– |
| 14 |
5,37 |
5,38 |
129,05 |
129,01 |
| 15 |
5,48 |
5,49 |
136,57 |
136,44 |
| 16 |
1,99 |
1,99 |
37,41 |
37,28 |
| 16-Me |
0,93 |
0,92 |
19,90 |
19,86 |
| 17 |
1,26 |
1,26 |
29,15 |
29,06 |
| 18 |
0,81 |
0,82 |
11,58 |
11,48 |
Пример 18
Определения клеточной пролиферации в случае различных линий опухолевых клеток
Для определения клеточной пролиферации использовали линии опухолевых клеток Нер-G2 (ATCC  НВ-8065) и COLO 205 (ATCC НВ-8065) и COLO 205 (ATCC  CCL-222). Клеточные линии высевали на среду для культивирования клеток по 1000 клеток на лунку [Hep-G2], соответственно 3500 клеток на лунку [Colo205] и инкубировали в течение 4 часов при температуре 37°С и в атмосфере с 5% СО2. CCL-222). Клеточные линии высевали на среду для культивирования клеток по 1000 клеток на лунку [Hep-G2], соответственно 3500 клеток на лунку [Colo205] и инкубировали в течение 4 часов при температуре 37°С и в атмосфере с 5% СО2.
Среда для Hep-G2: модифицированная по способу Дульбекко среда Игла/Ham’s F12-Mix (Gibco); NEAA (10%; не незаменимые аминокислоты, Gibco), пируват натрия (1%, Gibco), L-глутамин (1%, Gibco), фетальная телячья сыворотка (5%; РАА).
Среда для COLO 205: RPMI 1640 (Gibco), L-глутамин (1%, Gibco), ГЕПЕС (1%, Gibco), фетальная телячья сыворотка (10%, РАА).
Спустя 4 часа добавляли в различных разведениях соединения формул (II), (III), (IV) и бенгамиды Е и F, растворенные в ДМСО/среда для культивирования клеток, и инкубировали 72 часа при температуре 37°С и в атмосфере с 5% СО2. Определение содержания внутриклеточного АТФ осуществляли при использовании тест-реагента CellTiterGlo (Promega).
Результаты теста на клеточную пролиферацию представлены в таблице 1.
Формула изобретения
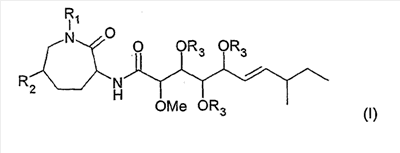
1. Соединение формулы (I)
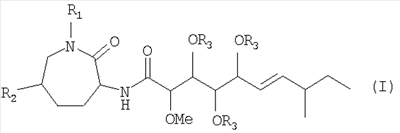
причем
R1 означает Н или (С1-С6)-алкил;
R2 означает Н или ОН; и
R3 означает Н;
или его физиологически приемлемая соль.
2. Соединение по п.1, причем R1 означает Н или метил.
3. Соединение по п.2, причем R1 означает Н или метил, R2 означает Н или ОН и R3 означает Н.
4. Соединение по п.1, представляющее собой соединение формулы (II)
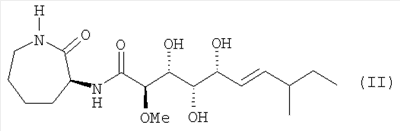
5. Соединение по п.1, представляющее собой соединение формулы (III)
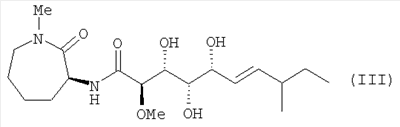
6. Соединение по п.1, представляющее собой соединение формулы (IV)
7. Применение соединения формулы (I) или его физиологически приемлемой соли по любому из пп.1-6 для получения лекарственного средства для ингибирования пролиферации клеток.
8. Применение соединения формулы (I) или его физиологически приемлемой соли по любому из пп.1-6 для получения лекарственного средства для лечения и/или профилактики раковых заболеваний.
9. Лекарственное средство для ингибирования пролиферации клеток, содержащее по меньшей мере одно соединение формулы (I) или его физиологически приемлемую соль по любому из пп.1-6.
10. Способ получения соединения формулы (V)
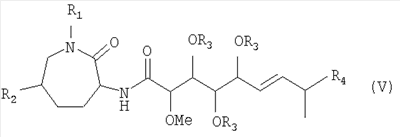
причем
R1 означает Н или (С1-С6)-алкил;
R2 означает Н или ОН;
R3 означает Н; и
R4 означает метил или этил;
или физиологически приемлемой соли соединения формулы (V),
отличающийся тем, что
1. штамм Myxococcus virescens ST200611 (DCM 15898) в пригодных условиях ферментируют в культуральной среде вплоть до накопления в культуральной среде одного или нескольких из соединений формулы (V);
2. соединение формулы (V) выделяют из культуральной среды; и
3. соединение формулы (V), в случае необходимости, дериватизируют и/или, в случае необходимости, превращают в физиологически приемлемую соль.
11. Способ по п.10, причем R4 означает этил.
12. Способ по любому из пп.10 или 11, причем независимо друг от друга R1 означает Н или метил, R3 означает Н, и R4 означает этил.
13. Способ по п.12, причем R2 означает ОН, и культуральная среда содержит гидроксилизин.
14. Штамм микроорганизма Myxococcus virescens ST200611 (DSM 15898) для получения соединения формулы (V).
15. Применение штамма микроорганизма Myxococcus virescens ST200611 (DSM 15898) для получения соединения формулы (V)

причем
R1 означает Н или (С1-С6)-алкил;
R2 означает Н или ОН;
R3 означает Н; и
R4 означает метил или этил;
или его физиологически приемлемой соли.
|
|