|
|
(21), (22) Заявка: 2006105194/04, 13.07.2004
(24) Дата начала отсчета срока действия патента:
13.07.2004
(30) Конвенционный приоритет:
21.07.2003 US 60/488,451
30.07.2003 EP 03077382.4
(43) Дата публикации заявки: 27.06.2006
(46) Опубликовано: 10.06.2009
(56) Список документов, цитированных в отчете о
поиске:
US 5110965 А, 05.05.1992. ЕР 0471583 В1, 24.05.1995. RU 95120199 А, 10.11.1997.
(85) Дата перевода заявки PCT на национальную фазу:
21.02.2006
(86) Заявка PCT:
EP 2004/007841 20040713
(87) Публикация PCT:
WO 2005/014527 20050217
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег.  517 517
|
(72) Автор(ы):
ХЕУС Мартин (NL),
ЛАММЕРС Ханс (NL),
ЛИПЕЙДЖ Джим (US)
(73) Патентообладатель(и):
АКЦО НОБЕЛЬ Н.В. (NL)
|
(54) ВОДНЫЙ РАСТВОР НАТРИЕВОЙ СОЛИ HEDTA
(57) Реферат:
Изобретение относится к водному раствору натриевой соли xNa+yH+ хелатообразующего соединения формулы (I), где х=2,1-2,7, у=0,9-0,3 и х+у=3. Изобретение также относится к водному раствору, упакованному в контейнер в количестве по меньшей мере 0,5 кг, и способу получения водного раствора, содержащего по меньшей мере 45 мас.% натриевой соли xNa+yH+ хелатобразующего соединения формулы (I), 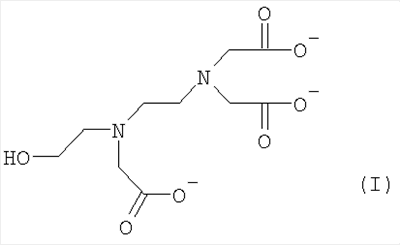
из Na3-HEDTA, включающему стадии электродиализа водного раствора, содержащего менее 42 мас.% Na3-HEDTA, с использованием биполярной мембраны, таким образом, превращая раствор тринатриевой соли в раствор натриевой соли формулы (I) с х=2,1-2,7, у=0,9-0,3 и х+у=3. 3 н. и 3 з.п. ф-лы, 2 табл.
Изобретение относится к водному раствору натриевой соли хелатообразующего соединения HEDTA [N-(2-гидроксиэтил)этилен-диамин-N,N’,N’-триуксусная кислота], содержащему вышеуказанный водный раствор контейнеру и применению этого водного раствора для получения хелатного комплекса железа. Изобретение относится, далее, к способу получения такого водного раствора вышеуказанной натриевой соли HEDTA.
Некоторые натриевые соли хелатообразующего соединения HEDTA известны из уровня техники. Например, в патенте США 5491259 описывается способ получения HEDTA из ее тринатриевой соли (то есть Na3-HEDTA). Этот способ осуществляют при использовании кислой среды со значением рН от 1,0 до 3,0, устанавливаемым в водном загрузочном растворе, содержащем полностью протонированную HEDTA вместе с неорганической натриевой солью. Затем этот водный раствор пропускают через диафильтрационную мембрану для разделения органических и неорганических компонентов.
Динатриевая соль HEDTA (то есть Na2-HEDTA) также известна. Например, в Европейских патентах 0054277 и 0058430 описываются микроскопические капсулы, содержащие суспензии красителей с вышеуказанной динатриевой солью HEDTA.
K. Nakamoto и др., в J. Am. Chem. Soc., 85, 311-312 (1963), опубликованы инфракрасные спектры HEDTA и ее моно-, ди- и тринатриевой соли.
Обычно, когда применяют HEDTA для хелатообразующих ионов, используют тринатриевую соль HEDTA (Na3-HEDTA). Так, в соответствии с патентом США 5110965, хелатные соединения железа могут быть получены из коммерчески доступного 41,3 мас.%-ного водного раствора тринатриевой соли HEDTA путем введения во взаимодействие оксида железа (в виде его магнетита) с Na3-HEDTA и подкисления среды до низкого значения рН.
Однако применение тринатриевой соли HEDTA связано с некоторыми большими недостатками при использовании в коммерческом масштабе. Важной проблемой является высокая вязкость концентрированных растворов тринатриевой соли HEDTA, которая делает такой раствор трудным в обращении. Так, высокая вязкость ограничивает практическую концентрацию до значений ниже 45 мас.%. Далее, выше определенных концентраций тринатриевая соль HEDTA имеет тенденцию к осаждению из водного раствора, когда подвергается воздействию низких температур, вызывая необходимость нагревания контейнеров, прежде чем раствор можно выливать. Далее обнаружено, что водные растворы Na3-HEDTA являются коррозионно-агрессивными по отношению к алюминию и, следовательно, ограничивают его применение в подвергающихся коррозии устройствах. Эти проблемы становятся особенно актуальными, когда соль HEDTA используют в широкомасштабных производствах, особенно когда применяют контейнеры с содержанием 0,5 кг или более. На практике контейнеры могут содержать от 25 кг до 1000 кг водной соли HEDTA и даже более.
Объектом настоящего изобретения является получение альтернативы для водных растворов тринатриевой соли HEDTA, которая имеет низкую вязкость, не осаждается при низкой температуре, с которой можно манипулировать в контейнерах при более высоких концентрациях и в меньшей степени обладает коррозионными свойствами.
Настоящее изобретение относится к водным растворам натриевых солей HEDTA, удовлетворяющим указанным условиям. В этом отношении неожиданно обнаружено, что указанные проблемы не возникают при использовании отдельного водного раствора натриевой соли xNa+yH+ хелатообразующего соединения формулы (I):
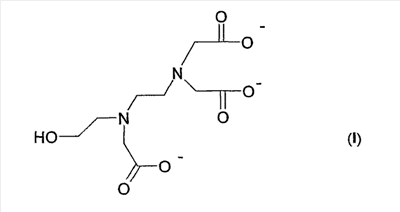
где х = 2,1-2,7, y = 0,9-0,3 и х+y = 3.
Кроме того, настоящее изобретение относится к контейнерам, содержащим по меньшей мере 0,5 кг водного раствора вышеуказанной натриевой соли HEDTA, поскольку обнаружено, что вышеуказанные проблемы не возникают при использовании контейнеров, содержащих по меньшей мере 0,5 кг указанного раствора. Подразумевается, что термин “контейнер”, используемый во всем данном описании, включает не только резервуары, в которых натриевая соль HEDTA согласно настоящему изобретению может храниться и/или транспортироваться, но также емкости, цистерны, баки, сосуды, трубопроводы или заливочные линии, которые могут содержать указанную натриевую соль и которые используют в производственном процессе. Контейнеры согласно изобретению содержат по меньшей мере 0,5 кг указанного раствора, предпочтительно по меньшей мере 1 кг и более предпочтительно 25 кг или более. Предпочтительно указанные контейнеры не содержат более чем 2000 кг, более предпочтительно 1500 кг указанного раствора. Предпочтительно контейнеры, содержащие по меньшей мере 0,5 кг водного раствора согласно настоящему изобретению, изготовляют из поливинилхлорида, полиэтилена, нержавеющей стали или битуминизированной стали.
Для использования насколько возможно меньшего количества кислоты для нейтрализации предпочтительным является получение водного раствора, который является по возможности близким к раствору тринатриевой соли без недостатков тринатриевой соли. Обнаружено, что наиболее благоприятных условий относительно использования нейтрализующей кислоты, вязкости, осаждения и коррозионно-агрессивных свойств достигают для х, составляющего около 2,4, например, в пределах от 2,3 до 2,5.
Далее обнаружено, что соль согласно изобретению может быть растворена в воде в концентрации 45 мас.% или выше без ухудшения вышеуказанных преимуществ. Для удовлетворения вышеуказанным условиям водный раствор имеет значение рН от 7 до 11.
Согласно другому объекту изобретения предусмотрено применение водного раствора, содержащего натриевую соль xNa+yH+ хелатообразующего соединения формулы (I), где х = 2,1-2,7, y = 0,9-0,3 и х+y = 3, для получения хелатного комплекса железа. Получение этого типа комплекса как такового известно из уровня техники, например, как указано выше, в патенте США 5110965. Когда используют водную соль HEDTA согласно настоящему изобретению, для специалиста очевиден способ получения таких комплексов. Также могут быть образованы комплексы с другими металлами, чем железо, такими как другие металлы группы VIII, переходные металлы, редкоземельные металлы и т.п. Если получают комплексы Fe, водный раствор соли HEDTA предпочтительно содержит 5-7 мас.% комплекса железа.
Объектом изобретения также является способ получения вышеуказанных водных растворов соли HEDTA. В этом отношении изобретение относится к способу получения водного раствора, содержащего по меньшей мере 45 мас.% натриевой соли xNa+yH+ хелатообразующего соединения формулы (I), где х = 2,1-2,7, y = 0,9-0,3 и х+y=3, из тринатриевой соли N-(2-гидроксиэтил)этилендиамин-N,N’,N’-триуксусной кислоты (Na3-HEDTA), включающему стадию электродиализа при комнатной температуре, то есть 20°С, водного раствора, содержащего менее 42 мас.% Na3-HEDTA, или при другой температуре максимально при концентрации, при которой вязкость является той же самой или ниже, чем вязкость 42 мас.%-ного раствора Na3-HEDTA при температуре 20°С, используя биполярную мембрану и катионообменную мембрану, таким образом, превращая раствор Na3-HEDTA в раствор натриевой соли xNa+yH+ формулы (I) с х = 2,1-2,7, y = 0,9-0,3 и х+y = 3.
Способы электродиализа с биполярными мембранами (EDBM) известны из уровня техники. Обзор таких способов можно найти у M. Bailly, Desalination, 144, 157-162 (2002). Когда используют такой способ получения натриевой соли HEDTA согласно настоящему изобретению, предпочтительно применяют щелочной электролит, такой как гидроксид натрия или калия, карбонат (гидрокарбонат) натрия и т.п. Подходящими биполярными мембранами являются, например, Neosepta® BP1E фирмы Tokuyama Corporation Ltd. (Япония), FT-BPTM фирмы FumaTech GmbH (Германия) или Morgane® BPM фирмы Solvay (Бельгия). Катионообменную мембрану используют для отделения кислотного пространства от щелочного пространства и также для переноса ионов натрия из кислотного пространства в щелочное пространство. Катионообменные мембраны для этого применения должны быть кислото- и щелочноустойчивыми. Подходящими катионообменными мембранами являются, например, Neosepta® CMB (Tokuyama Corp.), FT-FKLTM и FT-FKBTM (обе – фирмы FumaTech GmbH), однако могут быть использованы любые другие катионообменные мембраны, если только они кислото- и щелочноустойчивы и стабильны в растворе HEDTA в условиях способа электродиализа.
Чем выше температура во время электродиализа, тем ниже вязкость раствора Na3-HEDTA. Таким образом, чем выше выбирают температуры, тем выше, чем 42 мас.%, могут быть использованы концентрации Na3-HEDTA. Однако, когда вязкость раствора становится выше, чем вязкость 42 мас.%-ного раствора при температуре 20°С, то есть выше, чем примерно 25 сП, транспорт такого раствора через тонкие каналы электродиализных ячеек обычно становится слишком затруднительным для достижения эффективного процесса. Поэтому предпочтительно осуществлять процесс при температурах, достаточно высоких для обеспечения того, чтобы вязкость не была выше, чем примерно 25 сП, но достаточно низких для обеспечения того, чтобы мембраны все еще действовали должным образом. Когда используют типы чувствительных к нагреву мембран, процесс электродиализа предпочтительно осуществляют при низких температурах, ниже комнатной температуры.
Способ электродиализа с биполярной мембраной можно осуществлять вплоть до температуры 90°С, которая представляет собой максимальную температуру, которую может выдерживать большинство катионообменных мембран. Предпочтительно температура должна быть ниже примерно 60°С, когда используют биполярные мембраны FT-BPTM фирмы FumaTech или Morgane® BPM фирмы Solvay, или ниже примерно 45°С, когда используют биполярную мембрану Neosepta® BP1E фирмы Tokuyama Corp. С практической точки зрения способ наиболее предпочтительно осуществляют при температуре от 20°С до 45°С.
Замечено, что, благодаря электроосмосу, вода вместе с ионами натрия мигрирует из пространства с HEDTA через катионообменную мембрану в щелочное пространство. Таким образом, концентрация HEDTA возрастает во время процесса подкисления.
Кроме того, замечено, что, хотя и менее предпочтительно, водный раствор, содержащий по меньшей мере 45 мас.% натриевой соли xNa+yH+ хелатообразующего соединения формулы (I), где х = 2,1-2,7, y = 0,9-0,3 и х+y = 3, также может быть приготовлен из Na3-HEDTA с помощью процесса электролиза, включающего стадию электрохимического подкисления, как, например, описывается P. Boyaval, J. Seta и С. Gavach в Enzyme Microb. Technol., 15, 683-686 (август 1993).
Изобретение далее поясняется следующими примерами.
Пример 1
Раствор Na3-HEDTA с рН = 11,05, имеющий концентрацию 41 мас.% Na3-HEDTA, выражаемую в виде значения Fe-TSV (количество суммарного комплексообразующего железа), превращают в натриевую соль xNa+yH+ хелатообразующего соединения формулы (I), где х = 2,1-2,7, y = 0,9-0,3 и х+y = 3, путем циркулирования раствора через электродиализный пакет биполярной мембраны (Neosepta® BP1; например, фирмы Tokuyama Corporation Ltd.), используя обычный насос. Благодаря нагреву, осуществляемому во время процесса подкисления, температура раствора натриевой соли HEDTA повышается от 30°С в начале эксперимента до 45°С в конце эксперимента. Во время эксперимента значение рН в пространстве с HEDTA измеряют при использовании обычного калиброванного рН-метра с комбинированным стеклянным электродом. Во время подкисления, при использовании вышеуказанного электродиализного пакета биполярной мембраны, значение рН раствора натриевой соли HEDTA уменьшается. Обнаружено, что, когда значение рН достигает величины 9,6 при температуре 35°С, поток текучего раствора натриевой соли HEDTA, который измеряют при использовании обычного расходомера, начинает быстро увеличиваться от 40 л/ч до выше 200 л/ч без изменения регулирования насоса и/или других условий. Это указывает на то, что вязкость раствора натриевой соли HEDTA в вышеуказанных условиях быстро уменьшается. Конечный раствор натриевой соли HEDTA, который получают, имеет значение рН = 9,1, которое соответствует натриевой соли xNa+yH+ HEDTA, где х = 2,7 и y = 0,3. Вязкость вышеуказанного конечного раствора, измеряемая с помощью вискозиметра Брукфилда, составляет 16,2 сП при температуре 20°С и 7,7 сП при температуре 50°С.
Пример 2
Натриевые соли xNa+yH+ хелатообразующего соединения формулы (I), имеющие различные значения х и y, получают путем подкисления, используя электродиализный пакет биполярной мембраны, как описывается в примере 1, до достижения желательного значения рН. Вязкость полученных таким образом растворов HEDTA измеряют в широкой области концентраций при двух различных температурах (20°С и 50°С), используя вискозиметр Брукфилда.
В нижеприводимых таблицах представлена вязкость (в сантипуазах) по отношению к концентрации HEDTA (в виде количества суммарного комплексообразующего железа, Fe-TSV, выражаемого в виде соли Na3-HEDTA) для соли xNa+yH+ формулы (I), в которой х = 3 (сравнительный пример), х = 2,4 и х = 2,1, и y = 0, y = 0,6 и y = 0,9, соответственно.
Таблица I
Вязкость солей HEDTA относительно Fe-TSV при 20°С |
| Концентрация (мас.%) |
х = 3
вязкость (сП) |
х =2,4
вязкость (сП) |
х = 2,1
вязкость (сП) |
| 10 |
2 |
2 |
2 |
| 30 |
7,1 |
5,2 |
4,3 |
| 40 |
19 |
12,7 |
10 |
| 50 |
 * * |
54 |
32,9 |
| *: вязкость при содержании 50 мас.% Na3-HEDTA не может быть определена вследствие загустевания продукта. |
При низкой концентрации (10 мас.%) нет значительного различия в вязкости между Na3-HEDTA (уровень техники) и Na2,4-HEDTA и Na2,1-HEDTA (настоящее изобретение). При более высоких концентрациях различия вязкости становятся большими. При 50 мас.% Na3-HEDTA уже нельзя использовать, так как она загустевает, в то время как Na2,4-HEDTA и Na2,1-HEDTA все еще свободно можно использовать.
Таблица II
Вязкость солей HEDTA относительно Fe-TSV при 50°С |
| Концентрация (мас.%) |
х = 3
вязкость (сП) |
х = 2,4
вязкость (сП) |
х = 2,1
вязкость (сП) |
| 10 |
1 |
1 |
1 |
| 30 |
3,1 |
2,3 |
2,3 |
| 40 |
6,7 |
5,2 |
4,2 |
| 50 |
21,1 |
14,2 |
10,1 |
При более высокой температуре (50°С) различия вязкости между Na3-HEDTA (уровень техники) и Na2,4-HEDTA и Na2,1-HEDTA остаются, хотя и меньше, чем при температуре 20°С.
Преимущества низкой вязкости состоят в том, что легче опорожнять баки/контейнеры, заливочные линии, поддерживать потоки во время подачи насосом/манипулирования с продуктом и т.д.
Пример 3
Классификация средств транспортировки водных растворов HEDTA также связана с коррозионным потенциалом. Тесты в отношении коррозии проводили в соответствии со стандартом NACE TM-01-69, используя 40 мас.%-ный не содержащий щелочи раствор Na3-HEDTA на алюминии 7075 Т6, которые показали, что скорость коррозии алюминия является выше допустимого предела (максимальная средняя величина скорости коррозии 6,2 мм/год). Этот тест с 40 мас.%-ным водным раствором Na2,3H0,7-HEDTA показывает среднюю величину скорости коррозии для алюминия 7075 Т6 меньше 1 мм/год. Это позволяет манипулировать с продуктом в алюминиевых контейнерах и производственном оборудовании.
Формула изобретения
1. Водный раствор, содержащий натриевую соль xNa+yH+ хелатообразующего соединения формулы (I):
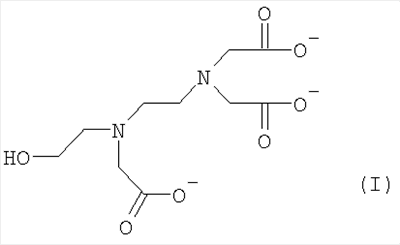
где х=2,1-2,7, у=0,9-0,3 и х+у=3.
2. Водный раствор по п.1, содержащий по меньшей мере 45 мас.% натриевой соли xNa+yH+ хелатообразующего соединения формулы (I), где х=2,1-2,7, у=0,9-0,3 и х+у=3.
3. Водный раствор по п.1 или 2, упакованный в контейнер в количестве по меньшей мере 0,5 кг.
4. Применение водного раствора по п.1 или 2 для получения хелатного комплекса железа.
5. Способ получения водного раствора, содержащего по меньшей мере 45 мас.% натриевой соли xNa+yH+ хелатообразующего соединения формулы (I), где х=2,1-2,7, у=0,9-0,3 и х+у=3, из тринатриевой соли N-(2-гидроксиэтил)этилендиамин-N,N’,N’-триуксусной кислоты (Na3-HEDTA), включающий стадию электродиализа при температуре 20°С водного раствора, содержащего менее 42 мас.% Na3-HEDTA, или при другой температуре, при которой вязкость раствора при максимальной концентрации не превышает вязкость 42 мас.%-ного раствора Na3-HEDTA при температуре 20°С, с использованием биполярной и катионной мембраны, таким образом превращая раствор Na3-HEDTA в раствор натриевой соли xNa+yH+ соединения формулы (I), где х=2,1-2,7, у=0,9-0,3 и х+у=3.
6. Способ по п.5, где используют щелочной электролит.
|
|