Патент на изобретение №2163611
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ 1-(n-R-ФЕНИЛАЗО)-3-НИТРОНАФТАЛИНОВ
(57) Реферат: Изобретение относится к способу получения азокрасителей сочетанием азосоставляющей с диазосоставляющей. Сущность изобретения заключается в том, что в качестве азосоставляющей используют гидридный 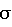 -аддукт 1,3-динитронафталина, образующийся при взаимодействии 1,3-динитронафталина с тетрагидридоборатом калия при 0°С, а в качестве диазосоставляющей – тетрафторборат фенилдиазония, и сочетание ведут при 0-5°С. Способ позволяет интенсифицировать процесс азосочетания при получении 1-(n-R-фенилазо)-3-нитронафталинов. -аддукт 1,3-динитронафталина, образующийся при взаимодействии 1,3-динитронафталина с тетрагидридоборатом калия при 0°С, а в качестве диазосоставляющей – тетрафторборат фенилдиазония, и сочетание ведут при 0-5°С. Способ позволяет интенсифицировать процесс азосочетания при получении 1-(n-R-фенилазо)-3-нитронафталинов.
Изобретение относится к области органической химии, в частности, способу получения 1-(n-R-фенилазо)-3-нитронафталинов, которые могут быть использованы в качестве красителей. Целью настоящего изобретения явилась разработка нового способа синтеза азокрасителей, содержащих нитрогруппу в ядре азокомпоненты. Поставленная цель достигается при использовании в качестве азосоставляющей гидридного 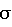 -аддукта, образующегося при взаимодействии 1,3-динитронафталина с тетрагидридоборатом калия. Азосоединения образуются в результате замещения одной нитрогруппы в динитронафталине на арилазогруппу при действии на -аддукта, образующегося при взаимодействии 1,3-динитронафталина с тетрагидридоборатом калия. Азосоединения образуются в результате замещения одной нитрогруппы в динитронафталине на арилазогруппу при действии на 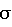 – аддукт тетрафторборатами арилдиазония (схема): – аддукт тетрафторборатами арилдиазония (схема):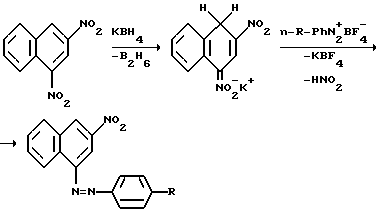 где R = H, OCH3, N(CH3)2, N(C2H5)2, NO2 При получении нитроазонафталинов нет необходимости выделять промежуточный 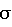 – аддукт из реакционной смеси, т.е. реакция может быть проведена в одну стадию. Таким образом, использование КВН4 для восстановления динитронафталина позволяет использовать это нитросоединение в качестве азосоставляющей в реакции азосочетания, что существенно расширяет синтетические возможности последней.
Сущность способа заключается в следующем. К раствору 1,3-динитронафталина в тетрагидрофуране при перемешивании и охлаждении до 0oC прибавляют раствор эквимолярного количества KBH4 в 50%-ном водном метаноле. Через 15… 20 мин к темно-фиолетовому раствору прибавляют по каплям раствор тетрафторобората фенилдиазония в ацетонитриле, перемешивают, поддерживая температуру в пределах 0…5oC. По окончании реакции раствор отфильтровывают от неорганических солей, отгоняют растворитель, остаток перекристаллизовывают. Выход азосоединений 30…50%.
Суть изобретения иллюстрируется следующими примерами.
Пример 1. 1-Фенилазо-3-нитронафталин.
К раствору 0.218 г (1.0 ммоль) 1,3-динитронафталина в 5 мл тетрагидрофурана при перемешивании и охлаждении до 0oC прибавляют по каплям раствор 0.06 г (1,15 ммоль) татрагидробората калия в 2 мл 50%-ного водного метанола. Через 15…20 мин. Прибавляют по каплям раствор 0.192 г (1 ммоль) тетрафторобората фенилдиазония в 5 мл ацетонитрила, поддерживая температуру в пределах 0.5oC. После прибавления всего количества соли диазония реакционную смесь солей, раствор упаривают на роторном вакуумном испарителе. Остаток перекристаллизовывают из диоксана и этанола. Выход желтого кристаллического продукта 31%. Тпл = 135…138oC. Электронный спектр в ацетонитриле, – аддукт из реакционной смеси, т.е. реакция может быть проведена в одну стадию. Таким образом, использование КВН4 для восстановления динитронафталина позволяет использовать это нитросоединение в качестве азосоставляющей в реакции азосочетания, что существенно расширяет синтетические возможности последней.
Сущность способа заключается в следующем. К раствору 1,3-динитронафталина в тетрагидрофуране при перемешивании и охлаждении до 0oC прибавляют раствор эквимолярного количества KBH4 в 50%-ном водном метаноле. Через 15… 20 мин к темно-фиолетовому раствору прибавляют по каплям раствор тетрафторобората фенилдиазония в ацетонитриле, перемешивают, поддерживая температуру в пределах 0…5oC. По окончании реакции раствор отфильтровывают от неорганических солей, отгоняют растворитель, остаток перекристаллизовывают. Выход азосоединений 30…50%.
Суть изобретения иллюстрируется следующими примерами.
Пример 1. 1-Фенилазо-3-нитронафталин.
К раствору 0.218 г (1.0 ммоль) 1,3-динитронафталина в 5 мл тетрагидрофурана при перемешивании и охлаждении до 0oC прибавляют по каплям раствор 0.06 г (1,15 ммоль) татрагидробората калия в 2 мл 50%-ного водного метанола. Через 15…20 мин. Прибавляют по каплям раствор 0.192 г (1 ммоль) тетрафторобората фенилдиазония в 5 мл ацетонитрила, поддерживая температуру в пределах 0.5oC. После прибавления всего количества соли диазония реакционную смесь солей, раствор упаривают на роторном вакуумном испарителе. Остаток перекристаллизовывают из диоксана и этанола. Выход желтого кристаллического продукта 31%. Тпл = 135…138oC. Электронный спектр в ацетонитриле,  макс, нм: 220, 225, 295, 360. ИК-спектр, см-1 макс, нм: 220, 225, 295, 360. ИК-спектр, см-1  (C=C) 1600, (C=C) 1600,  as (NO2) 1535, as (NO2) 1535,  s (NO2) 1345. Спектр ЯМР 1Н в CDCl3, s (NO2) 1345. Спектр ЯМР 1Н в CDCl3,  , м.д. (J, Гц): 8.85 дд (1H, H8, Jн8-н7 9.0; Jн8-н6 2.0), 8.75д (1H, H2, Jн2-н4 2.0), 8.39д (1H, H4, Jн4-н2 2.0) 7.98 дд (1H, H5, Jн5-н6 9.0; Jн5-н7 2.0), 7.67 м (2H, H6,7), 7.99 д (2H, H2′,6′, Jн2′-н3′ = Jн6′-н5′ = 9.0), 7.47 м (3H, H3′-5′). Найдено, %: C 69.1, 69.2; H 4.2, 4.1; N 15.1, 14.9. C16H11N3O2. Вычислено, %: C 69.30, H 4.01, N 15.17.
Пример 2. 1-(4′-Метоксифенилазо)-3-нитронафталин.
К раствору 0.218 г (1.0 ммоль) 1,3-динитронафталина в 5 мл тетрагидрофурана при перемешивании и охлаждении до 0oC прибавляют по каплям раствор 0.06 г (1.15 ммоль) татрагидробората калия в 2 мл 50%-ного водного метанола. Через 15…20 мин прибавляют по каплям раствор 0.222 г (1 ммоль) тетрафторобората n-метоксифенилдиазония в 5 мл ацетонитрила. Температуру поддерживают не выше 5oC. Затем реакционную смесь перемешивают 30 мин., отфильтровывают и отгоняют растворитель в вакууме. Остаток растворяют в дихлорметане и пропускают через колонку с силикагелем (элюент – бензол) После перекристаллизации из этанола получают оранжевое кристаллическое вещество. Выход 40%. Тпл 146.. . 148oC. Электронный спектр в ацетонитриле, , м.д. (J, Гц): 8.85 дд (1H, H8, Jн8-н7 9.0; Jн8-н6 2.0), 8.75д (1H, H2, Jн2-н4 2.0), 8.39д (1H, H4, Jн4-н2 2.0) 7.98 дд (1H, H5, Jн5-н6 9.0; Jн5-н7 2.0), 7.67 м (2H, H6,7), 7.99 д (2H, H2′,6′, Jн2′-н3′ = Jн6′-н5′ = 9.0), 7.47 м (3H, H3′-5′). Найдено, %: C 69.1, 69.2; H 4.2, 4.1; N 15.1, 14.9. C16H11N3O2. Вычислено, %: C 69.30, H 4.01, N 15.17.
Пример 2. 1-(4′-Метоксифенилазо)-3-нитронафталин.
К раствору 0.218 г (1.0 ммоль) 1,3-динитронафталина в 5 мл тетрагидрофурана при перемешивании и охлаждении до 0oC прибавляют по каплям раствор 0.06 г (1.15 ммоль) татрагидробората калия в 2 мл 50%-ного водного метанола. Через 15…20 мин прибавляют по каплям раствор 0.222 г (1 ммоль) тетрафторобората n-метоксифенилдиазония в 5 мл ацетонитрила. Температуру поддерживают не выше 5oC. Затем реакционную смесь перемешивают 30 мин., отфильтровывают и отгоняют растворитель в вакууме. Остаток растворяют в дихлорметане и пропускают через колонку с силикагелем (элюент – бензол) После перекристаллизации из этанола получают оранжевое кристаллическое вещество. Выход 40%. Тпл 146.. . 148oC. Электронный спектр в ацетонитриле,  макс, нм: 222, 250, 318, 378. ИК-спектр, см-1: макс, нм: 222, 250, 318, 378. ИК-спектр, см-1:  (CH3) 2835, 2930, (CH3) 2835, 2930,  (C=C) 1603, (C=C) 1603,  as (NO2) 1535, as (NO2) 1535,  s (NO2) 1344, s (NO2) 1344,  (COC) 1256. Спектр ЯМР 1H в CDCl3 (COC) 1256. Спектр ЯМР 1H в CDCl3  , м.д. (J, Гц): 8.82 дд (1H, H8, Jн8-н7 8.0; Jн8-н6 2.0), 8.70 д (1H, H2, Jн2-н4 2.0), 8.37 д (1H, H4, Jн4-н2 2.0) 7.69 дд (1H, H5, Jн5-н6 8.0; Jн5-н7 2.0), 7.64 м (2H, H6,7), 7.97 д (2H, H2′,6′ Jн2′-н3′ = Jн6′-н5′= 9.0), 6.96 д (2H, H3′,5′ Jн3′-н2′ = Jн5′-н6′= 9.0), 3.82 с (3H, OCH3). Найдено, %: C 66.3, 66.4; H 4.4, 4.4; N 13.5, 13.4. C17H13N3O3. Вычислено, %: C 66.43, H 4.27, N 13.68.
Пример 3. 1-(4′-N,N-диметиламинофенилазо)-3- нитронафталин.
К раствору 0.218 г (1.0 ммоль) 1,3-динитронафталина в 5 мл тетрагидрофурана при перемешивании и охлаждении до 0oC прибавляют по каплям раствор 0.06 г (1.15 ммоль) татрагидробората калия в 2 мл 50%-ного водного метанола. Через 15…20 мин прибавляют по каплям раствор 0.235 г (1.0 ммоль) тетрафторобората n-N, N- диметиламинофенилдиазония в 5 мл ацетонитрила. Температуру поддерживают в пределах 0…oC. Перемешивание продолжают 60 мин, затем реакционную смесь отфильтровывают и отгоняют растворитель под вакуумом. Остаток растворяют в дихлорметане и пропускают через колонку с силикагелем (элюент – бензол). После перекристаллизации из этанола получают красное кристаллическое вещество. Выход 38%. Тпл 195…197oC. Электронный спектр в ацетонитриле, , м.д. (J, Гц): 8.82 дд (1H, H8, Jн8-н7 8.0; Jн8-н6 2.0), 8.70 д (1H, H2, Jн2-н4 2.0), 8.37 д (1H, H4, Jн4-н2 2.0) 7.69 дд (1H, H5, Jн5-н6 8.0; Jн5-н7 2.0), 7.64 м (2H, H6,7), 7.97 д (2H, H2′,6′ Jн2′-н3′ = Jн6′-н5′= 9.0), 6.96 д (2H, H3′,5′ Jн3′-н2′ = Jн5′-н6′= 9.0), 3.82 с (3H, OCH3). Найдено, %: C 66.3, 66.4; H 4.4, 4.4; N 13.5, 13.4. C17H13N3O3. Вычислено, %: C 66.43, H 4.27, N 13.68.
Пример 3. 1-(4′-N,N-диметиламинофенилазо)-3- нитронафталин.
К раствору 0.218 г (1.0 ммоль) 1,3-динитронафталина в 5 мл тетрагидрофурана при перемешивании и охлаждении до 0oC прибавляют по каплям раствор 0.06 г (1.15 ммоль) татрагидробората калия в 2 мл 50%-ного водного метанола. Через 15…20 мин прибавляют по каплям раствор 0.235 г (1.0 ммоль) тетрафторобората n-N, N- диметиламинофенилдиазония в 5 мл ацетонитрила. Температуру поддерживают в пределах 0…oC. Перемешивание продолжают 60 мин, затем реакционную смесь отфильтровывают и отгоняют растворитель под вакуумом. Остаток растворяют в дихлорметане и пропускают через колонку с силикагелем (элюент – бензол). После перекристаллизации из этанола получают красное кристаллическое вещество. Выход 38%. Тпл 195…197oC. Электронный спектр в ацетонитриле,  макс, нм: 222, 248, 275, 460. ИК-спектр, см-1: макс, нм: 222, 248, 275, 460. ИК-спектр, см-1:  (CH3) 2860, 2930, (CH3) 2860, 2930,  (C= C) 1610, (C= C) 1610,  as (NO2) 1530, as (NO2) 1530,  s (NO2) 1350. Спектр ЯМР 1H в CDCl3, s (NO2) 1350. Спектр ЯМР 1H в CDCl3,  , м.д. (J, Гц): 8.88 дд (1H, H8, Jн8-н7 9.0; Jн8-н6 2.0), 8.69 д (1H, H2, Jн2-н4 2.0), 8.41 д (1H, H4, Jн4-н2 2.0), 7.95 дд (1H, H5, Jн5-н7 9.0; Jн5-н7 2.0), 7.64 м (2H, H6,7), 7.94 д (2H, H2′,6′, Jн2′-н3′ = Jн6′-н5′= 9.0), 6.70 д (2H, H3′,5′, Jн3′-н2′ = Jн5′-н6′ = 9.0) 3.04 с (6H, CH3). Найдено, %: C 67.8, 67.6; H 5.3, 5.3; N 17.3, 17.5. C18H16N4O2. Вычислено, %: C 67.48, H 5.04, N 17.49.
Аналогичным образом получают 1-(4′-N,N-диэтиламинофенилазо)-3- нитронафталин. Темно-красное кристаллическое вещество. Выход 48%. Тпл. 155… 156oC (из этанола). Электронный спектр в ацетонитриле, , м.д. (J, Гц): 8.88 дд (1H, H8, Jн8-н7 9.0; Jн8-н6 2.0), 8.69 д (1H, H2, Jн2-н4 2.0), 8.41 д (1H, H4, Jн4-н2 2.0), 7.95 дд (1H, H5, Jн5-н7 9.0; Jн5-н7 2.0), 7.64 м (2H, H6,7), 7.94 д (2H, H2′,6′, Jн2′-н3′ = Jн6′-н5′= 9.0), 6.70 д (2H, H3′,5′, Jн3′-н2′ = Jн5′-н6′ = 9.0) 3.04 с (6H, CH3). Найдено, %: C 67.8, 67.6; H 5.3, 5.3; N 17.3, 17.5. C18H16N4O2. Вычислено, %: C 67.48, H 5.04, N 17.49.
Аналогичным образом получают 1-(4′-N,N-диэтиламинофенилазо)-3- нитронафталин. Темно-красное кристаллическое вещество. Выход 48%. Тпл. 155… 156oC (из этанола). Электронный спектр в ацетонитриле,  макс, нм: 220, 250, 280, 470. ИК-спектр, см-1: макс, нм: 220, 250, 280, 470. ИК-спектр, см-1:  (CH2CH3) 2860, 2880, 2920, 2975, (CH2CH3) 2860, 2880, 2920, 2975,  (C=C) 1600, (C=C) 1600,  as (NO2) 1520, as (NO2) 1520,  s (NO2) 1350. Спектр ЯМР 1H в CDCl3, s (NO2) 1350. Спектр ЯМР 1H в CDCl3,  , м.д. (J, Гц): 8.74 дд (1H, H8, Jн8-н7 9.0; Jн8-н6 2.0), 8.52 д (1H, H2 Jн2-н4 2.0), 8.28 д (1H, H4 Jн4-н2 2.0) 7.81 дд (1H, H5, Jн5-н6 9.0; Jн5-н7 2.0), 7.54 м (2H, H6,7), 7.76 д (2H, H2′,6′, Jн2′-н3′ = Jн6′-н5′= 9.0), 6.59 д (2H, H3′,5′, Jн3′-н2′= Jн5′-н6′= 9.0) 3.34 кв (4H, CH2, Jсн2-сн3 7.0), 1.12 (6H, CH3, Jсн3-сн2 7.0). Найдено, %: C 68.4, 68.7; H 5.5 5.6; N 16.2, 16.4. C20H20N4O2. Вычислено, %: C 68.94, H 5.80, N 16.08.
Таким образом, предлагаемый метод синтеза нитроазонафталинов, содержащих нитрогруппу в азокомпоненте, является новым способом получения азосоединений, которые могут быть использованы в качестве азокрасителей. , м.д. (J, Гц): 8.74 дд (1H, H8, Jн8-н7 9.0; Jн8-н6 2.0), 8.52 д (1H, H2 Jн2-н4 2.0), 8.28 д (1H, H4 Jн4-н2 2.0) 7.81 дд (1H, H5, Jн5-н6 9.0; Jн5-н7 2.0), 7.54 м (2H, H6,7), 7.76 д (2H, H2′,6′, Jн2′-н3′ = Jн6′-н5′= 9.0), 6.59 д (2H, H3′,5′, Jн3′-н2′= Jн5′-н6′= 9.0) 3.34 кв (4H, CH2, Jсн2-сн3 7.0), 1.12 (6H, CH3, Jсн3-сн2 7.0). Найдено, %: C 68.4, 68.7; H 5.5 5.6; N 16.2, 16.4. C20H20N4O2. Вычислено, %: C 68.94, H 5.80, N 16.08.
Таким образом, предлагаемый метод синтеза нитроазонафталинов, содержащих нитрогруппу в азокомпоненте, является новым способом получения азосоединений, которые могут быть использованы в качестве азокрасителей.
Формула изобретения
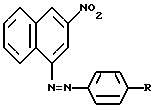 где R – Н, ОСН3, N(СН3)2, N(С2Н5)2, NО2, сочетанием азосоставляющей с диазосоставляющей, отличающийся тем, что в качестве азосоставляющей используют гидридный 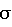 -аддукт 1,3-динитронафталина, образующийся при взаимодействии 1,3-динитронафталина с тетрагидридоборатом калия при 0oC, а в качестве диазосоставляющей – тетрафторборат фенилдиазония и сочетание ведут при 0 – 5oC. -аддукт 1,3-динитронафталина, образующийся при взаимодействии 1,3-динитронафталина с тетрагидридоборатом калия при 0oC, а в качестве диазосоставляющей – тетрафторборат фенилдиазония и сочетание ведут при 0 – 5oC.
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 02.12.2000
Номер и год публикации бюллетеня: 5-2003
Извещение опубликовано: 20.02.2003
|
||||||||||||||||||||||||||
