Патент на изобретение №2163600
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ
(57) Реферат: Изобретение относится к области синтетической органической химии, а именно к методу получения гетероциклического соединения  -токоферола (витамина E). Описывается способ получения -токоферола (витамина E). Описывается способ получения  -токоферола (витамина E), при котором 2,3,4-пентатрион-3-оксим циклоконденсируют с бутаноном, полученный 2,3,6-триметил-1,4-бензохинон-1-оксим деоксимируют в триметил-n-бензохинон, восстанавливают в триметилгидрохинон, конденсируют с изофитолом и выделяют целевой продукт известными приемами. Способ позволяет получить триметилгидрохинон с достаточно высоким выходом (до 50%) и высокой чистотой, что повышает чистоту витамина E. -токоферола (витамина E), при котором 2,3,4-пентатрион-3-оксим циклоконденсируют с бутаноном, полученный 2,3,6-триметил-1,4-бензохинон-1-оксим деоксимируют в триметил-n-бензохинон, восстанавливают в триметилгидрохинон, конденсируют с изофитолом и выделяют целевой продукт известными приемами. Способ позволяет получить триметилгидрохинон с достаточно высоким выходом (до 50%) и высокой чистотой, что повышает чистоту витамина E.
Изобретение относится к области синтетической органической химии, а именно к методу получения гетероциклического соединения  -токоферола /витамина E/ -токоферола /витамина E/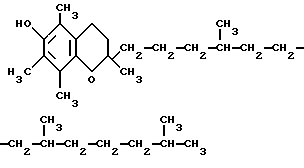 Витамин E является важнейшим фактором воспроизводства животных и человека. Применяется при лечении сердечных заболеваний/Weitzel, Gchoh H Z physiol chem 1956, 304, 297/, при сосудистых расстройствах /Mason К. The vitamins. N. Y. 1954, 625/, при лечении туберкулеза /Сб. Витамины. Пищевая промышленность за рубежом. М. Пищепромиздат, 1958. N 4 е.с. 115-121/. Очень важна роль витамина E в животноводстве /Рекомендации по применению витаминных концентратов в животноводстве. М. “Колос”, 1965, с.6/. В связи с важнейшими областями применения витамина E в настоящее время разработано много схем синтеза этого соединения. Практически во всех схемах синтеза молекула  -токоферола строится из триметилгидрохинона по реакции с изофитолом. Поэтому главная задача – получение триметилгидрохинона.
Многие ранее разработанные схемы синтеза -токоферола строится из триметилгидрохинона по реакции с изофитолом. Поэтому главная задача – получение триметилгидрохинона.
Многие ранее разработанные схемы синтеза  -токоферола предлагали в качестве исходного соединения для синтеза ароматические вещества, чаще всего с тремя метильными группами в кольце.
Это, например схема синтеза, по которой псевдокумидин путем ацилирования, нитрования, омыления, диазотирования, восстановления до n-диаминопсевдокумола, окисления до псевдокумохинона, восстановления, реакции с фитолом превращался в токоферол -токоферола предлагали в качестве исходного соединения для синтеза ароматические вещества, чаще всего с тремя метильными группами в кольце.
Это, например схема синтеза, по которой псевдокумидин путем ацилирования, нитрования, омыления, диазотирования, восстановления до n-диаминопсевдокумола, окисления до псевдокумохинона, восстановления, реакции с фитолом превращался в токоферол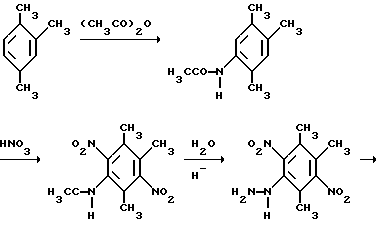 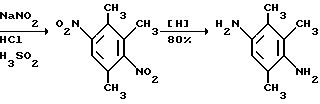 /L. Smith, Yournal of the amer. Chem. Soc. 1934. V. 56, p 472/. По другой схеме псевдокумол сульфируют, нитруют, десульфируют, восстанавливают, окисляют до псевдокумохинона, восстанавливают до гидрохинона и вводят в реакцию с фитолом 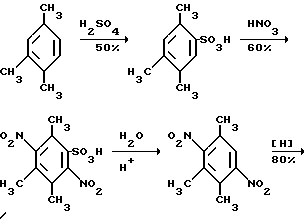 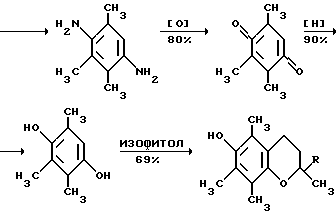  /Yiyao Gongye, 1983, N 6, p. 3-5/. По Японскому патенту /Патент Японии N 10852 (1967 г.)/: 3,6-диметил-4-нитрофенол хлорметилируют, восстанавливают в 2.3.6-триметил-4-аминофенол, окисляют в триметилгидрохинон, который с фитолом дает  -токоферол -токоферол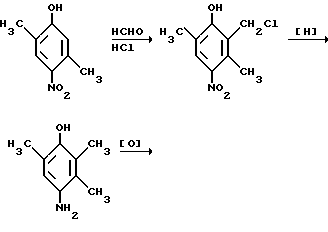 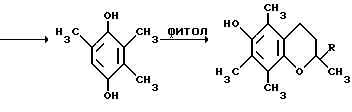 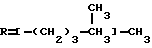 Существуют также схемы, по которым мезитилен нитруют, восстанавливают в мезитилгидроксиламин, перегруппировывают по Бамбергеру в триметилгидрохинон и затем превращают в  токоферол /Bamberger E, Rising A, Berichte, 1900, Bd 33, S. 3623-3636; Berichte, 1926, Bd 59, S.418/ токоферол /Bamberger E, Rising A, Berichte, 1900, Bd 33, S. 3623-3636; Berichte, 1926, Bd 59, S.418/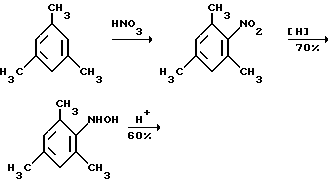 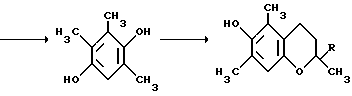 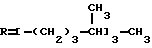 Общим недостатком всех указанных схем является использование в качестве исходных соединений ароматического сырья, которое добывается из природных источников и является дефицитным. В связи с этим в последние годы разработаны схемы получения  -токоферола из алифатических соединений. Ключевым моментом этих схем является “построение” молекулы триметил-гидрохинона из алифатических фрагментов. Это, например, схема, по которой 4-хлорпентанон-2 конденсируют с бутаноном, образующийся 1,4,5-триметил-циклогексенон-3 дегидрируют в 2,3,5-триметилфенол, окисляют в триметил-n-бензохинон, восстанавливают в триметилгидрохинон и превращают в -токоферола из алифатических соединений. Ключевым моментом этих схем является “построение” молекулы триметил-гидрохинона из алифатических фрагментов. Это, например, схема, по которой 4-хлорпентанон-2 конденсируют с бутаноном, образующийся 1,4,5-триметил-циклогексенон-3 дегидрируют в 2,3,5-триметилфенол, окисляют в триметил-n-бензохинон, восстанавливают в триметилгидрохинон и превращают в  -токоферол /Yournal of the Organic Сhemistry, 1972. V. 37, N 14, p. 2340-2343/ -токоферол /Yournal of the Organic Сhemistry, 1972. V. 37, N 14, p. 2340-2343/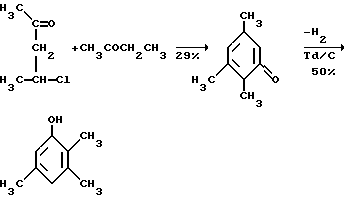 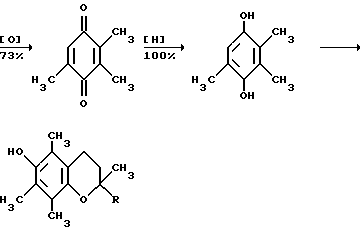 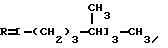 Другая схема /Yournal of the Organic Сhemistry, 1972. V. 37, N 14, p. 2340-2343/ предлагает циклизировать метилвинилкетон с диэтилкетоном, полученный 1,2,4-триметилциклогексен-1-он-3 дегидрируют, полученный 2,3,6-триметилфенол окисляют в триметилбензохинон, восстанавливают в триметилгидрохинон и превращают в  -токоферол -токоферол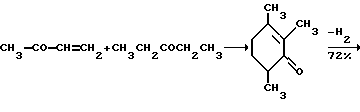 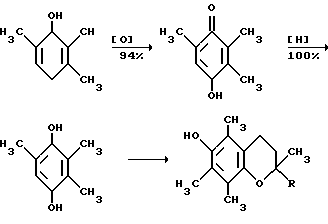  Вышеприведенные схемы имеют важное достоинство – они не нуждаются в дефицитном ароматическом сырье. Недостатком этих схем синтеза – многостадийность и, как следствие этого, – низкий выход целевого продукта /0,5-40%/. Наиболее близкой является схема /”Journal of the Organic Chemistry”, 1972. V. 37, N 14, p. 2340-2343/, по которой приводится метод синтеза триметилнитрохинона с выходом 59% исходя из 2,5,6-триметил-2-циклогексен-1-она (94%х72%х77%). Эта схема принята за прототип. Однако принятая за прототип схема обладает существенным недостатком – низким выходом целевого продукта /35%/. Техническим результатом изобретения является совершенствование технологий и разработка общей схемы синтеза  -токоферола /витамина E/.
Этот результат достигается циклизацией 2,3,4-пентантрион-3-оксима с бутаноном, деоксимированием полученного 2,3,6-триметил-1,4-бензохинон-1-оксима в триметилгидрохинон, конденсацией с изофитолом и выделением -токоферола /витамина E/.
Этот результат достигается циклизацией 2,3,4-пентантрион-3-оксима с бутаноном, деоксимированием полученного 2,3,6-триметил-1,4-бензохинон-1-оксима в триметилгидрохинон, конденсацией с изофитолом и выделением  -токоферола известным способом -токоферола известным способом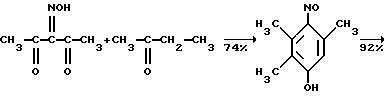 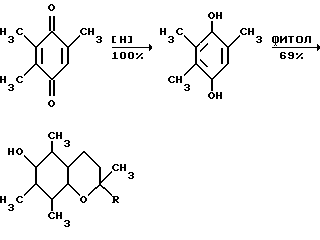 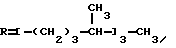 На современном уровне представлений о химии витамина E возможность синтеза  -токоферола из 2,3,4-пентантрион-3-оксима и бутанона является неочевидной и применяется впервые.
От наиболее близкого аналога заявляемый способ отличается тем, что 2,3,4-пентантрион-3-оксим вводят в циклизацию с бутаноном, полученный 2,3,6-триметил-n-бензохинон-1-оксим деоксимируют в триметил-n-бензохинон, восстанавливают в триметилгидрохинон, получают и выделяют -токоферола из 2,3,4-пентантрион-3-оксима и бутанона является неочевидной и применяется впервые.
От наиболее близкого аналога заявляемый способ отличается тем, что 2,3,4-пентантрион-3-оксим вводят в циклизацию с бутаноном, полученный 2,3,6-триметил-n-бензохинон-1-оксим деоксимируют в триметил-n-бензохинон, восстанавливают в триметилгидрохинон, получают и выделяют  -токоферол известным способом.
Изобретательский уровень данного способа определяется тем, что предложена новая последовательность реакций, приводящая к образованию триметилхинона. Впервые -токоферол известным способом.
Изобретательский уровень данного способа определяется тем, что предложена новая последовательность реакций, приводящая к образованию триметилхинона. Впервые  -токоферол получают исходя из 2,3,4-пентантрион-3-оксима и бутанона.
На современном уровне представлений о химии витамина E возможность синтеза -токоферол получают исходя из 2,3,4-пентантрион-3-оксима и бутанона.
На современном уровне представлений о химии витамина E возможность синтеза  – токоферола из 2,3,4-пентантрион-3-оксима и бутанона является неочевидной и явно не вытекает из известных сведений о природе витамина E.
В настоящее время производство синтетического витамина E из алифатического сырья в России не существует, хотя потребность только в животноводстве составляет порядка 600 т/год.
Способ осуществляется следующим образом.
В результате исследования реакций циклоароматизации изонитрозо- – токоферола из 2,3,4-пентантрион-3-оксима и бутанона является неочевидной и явно не вытекает из известных сведений о природе витамина E.
В настоящее время производство синтетического витамина E из алифатического сырья в России не существует, хотя потребность только в животноводстве составляет порядка 600 т/год.
Способ осуществляется следующим образом.
В результате исследования реакций циклоароматизации изонитрозо- -дикарбонильных соединений с кетонами были разработаны новые путем синтеза полифункциональных ароматических систем, содержащих нитрозогруппу /Беляев Е.Ю, Гидаспов Б.В. Ароматические нитрозосоединения. Л.: Химия, 1989. С. 102-110, Беляев Е.Ю., Товбис М.С., Ельцов А.В. Жор Х, 1978. Т.14. Вып. 11. С. 2375/.
Примером такой циклизации является образование 2,3,-4-пентатрион-3-оксима /I/ и метилэтилкетона 2,3,5-триметил-4-нитрозофенола /II/ /Товбис М.С., Беляев Е. Ю. , Орловская Н.Ф., Аганова И.Г., А.С. 1409624 (1988) СССР, БИ. 1988. N 26/ -дикарбонильных соединений с кетонами были разработаны новые путем синтеза полифункциональных ароматических систем, содержащих нитрозогруппу /Беляев Е.Ю, Гидаспов Б.В. Ароматические нитрозосоединения. Л.: Химия, 1989. С. 102-110, Беляев Е.Ю., Товбис М.С., Ельцов А.В. Жор Х, 1978. Т.14. Вып. 11. С. 2375/.
Примером такой циклизации является образование 2,3,-4-пентатрион-3-оксима /I/ и метилэтилкетона 2,3,5-триметил-4-нитрозофенола /II/ /Товбис М.С., Беляев Е. Ю. , Орловская Н.Ф., Аганова И.Г., А.С. 1409624 (1988) СССР, БИ. 1988. N 26/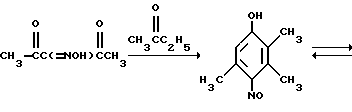 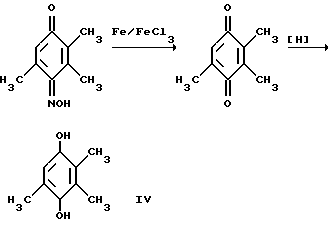 Полученный таким образом нитрозофенол /II/ сначала деоксимируют до триметилбензохинона /III/. Затем хинон /III/ восстанавливают обычным способом до триметилгидрохинона /IV/. Примеры конкретного осуществления способа. 1. Конденсация 2,3,4-пентантрион-3-оксима с бутаноном. 2,3,6-Тpиметил-1,4-бeнзoxинoн-1-оксим получали циклизацией 2,3,4-пентантрион-3-оксима с бутаноном в присутствии порошкообразного гидроксида натрия следующим образом. Готовили суспензию из 0,0323 моль /1,29 г/ измельченного гидрооксида натрия (размер частиц < 0,3 мм) и 3,0 мл ДМСО. К полученной суспензии при охлаждении и перемешивании приливали раствор 0,0100 моль (1,29 г) 2,3,4-пентантрион-3 оксима в 0,0274 моль (2,45 мл) бутанона. По окончании прибавления реагентов смесь выдерживали в течение 24 часов при комнатной температуре при перемешивании. Затем реакционную массу разбавляли ледяной водой (30 мл) и добавляли при перемешивании и охлаждении HCl конц. до кислой реакции (pH 3). Полученный осадок отфильтровывали и высушивали при 60oC. Выход 2,3,6-триметил-1,4-бензохинон-1-оксима 1,2210 г (74% от теор.). Т.пл. 172oC. Найдено, % C = 65,91, H = 6,82, N = 8,51. Вычислено, % C = 65,46, H = 6,67, N = 8,48. 2. Деоксимирование. 0,01 Моль (1,65%) 2,3,6-триметил-1,4-бензохинон-1-оксима растворяли в 15 мл метилцеллозольва и 1,5 мл ацетона. К этому раствору прибавляли 0,0100 моль (1,4) окиси меди (1) 4,7 мл HCl конц., предварительно разбавленной 6 мл воды. Раствор кипятили 45 мин. Затем перегоняли с паром. Триметилбензохинон экстрагировали из дистиллята диэтиловым эфиром. Эфирный экстракт сушат над сульфатом натрия б/в, эфир упаривают. Выход триметилбензохинона 1,3804 г (92% от теор.) Т. пл. 32oC. Найдено, % C = 71,60, H = 6,51. Вычислено, % C = 72,00, H = 6,67. 3. Восстановление триметилбензохинона. К раствору 0,0100 моль (1,5 г) триметилбензохинона в 5 мл диэтилового эфира прибавляли 1 г цинковой пыли. При перемешивании и охлаждении к этой смеси прикапывали 3 мл HCl конц. Раствор приобретал бледно-желтое окрашивание, затем становился бесцветным. Промывали эфирный раствор водой (10 млх3), сушили над безводным Na2SO4. Выход триметилгидрохинона после упаривания растворителя – количественный. Т.пл. 168-170oC (разл.) Найдено, % C = 71,62, H = 7,75. Вычислено, % C = 71,05, H = 7,90. 4. Предварительно готовили фитилхлорид. К 0,9000 г изофитола приливали 200 г HCl и перемешивали при 20oC 10 мин. Затем добавляли 5,00 мл воды, перемешивали, отделяли верхний слой в делительной воронке, трижды промывали водой (3х2,00 мл). 5. Смешивали 0,500 мл CH3COOH, полученный фитилхлорид (0,9542 г), триметилгидрохинон (0,4600 г), хлористый цинк (0,05 г) и эфират трехфтористого бора (0,03 г). Смесь нагревали при пропускании азота 4 часа при 120oC. после охлаждения разбавляли водой (5,00 мл), отделяли верхний слой, промывали его водой, помещали в колбу, добавляли уксусный ангидрид (0,70 г) и при температуре 120oC нагревали 2 часа с отгонкой образующейся уксусной кислоты. Остаток перегоняли под вакуумом и отбирали фракцию с Ткип 205-208oC/ 0,3 мм рт. ст. выход D, L-  -токоферилацетата 0,98950 г (69% в пересчете на изофитол).
Найдено, % C = 79,02, H = 11,17.
Вычислено, % C = 78,81, H = 11,02.
Использование предлагаемого способа имеет ряд преимуществ по сравнению с известными схемами и позволяет получать триметилгидрохинон /IV/ с достаточно высоким выходом (до 50%) высокой чистотой, что повышает чистоту витамина E. -токоферилацетата 0,98950 г (69% в пересчете на изофитол).
Найдено, % C = 79,02, H = 11,17.
Вычислено, % C = 78,81, H = 11,02.
Использование предлагаемого способа имеет ряд преимуществ по сравнению с известными схемами и позволяет получать триметилгидрохинон /IV/ с достаточно высоким выходом (до 50%) высокой чистотой, что повышает чистоту витамина E.
Формула изобретения
 -токоферола (витамина Е), отличающийся тем, что 2,3,4-пентатрион-3-оксим циклоконденсируют с бутаноном, полученный 2,3,6-триметил-1,4-бензохинон-1-оксим деоксимируют в триметил-n-бензохинон, восстанавливают в триметилгидрохинон, конденсируют с изофитолом и выделяют целевой продукт известными приемами. -токоферола (витамина Е), отличающийся тем, что 2,3,4-пентатрион-3-оксим циклоконденсируют с бутаноном, полученный 2,3,6-триметил-1,4-бензохинон-1-оксим деоксимируют в триметил-n-бензохинон, восстанавливают в триметилгидрохинон, конденсируют с изофитолом и выделяют целевой продукт известными приемами.
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 05.12.2002
Номер и год публикации бюллетеня: 13-2004
Извещение опубликовано: 10.05.2004
|
||||||||||||||||||||||||||
