|
|
(21), (22) Заявка: 2005106259/04, 07.08.2003
(24) Дата начала отсчета срока действия патента:
07.08.2003
(30) Конвенционный приоритет:
08.08.2002 JP 2002-232074
05.11.2002 JP 2002-321729
(43) Дата публикации заявки: 27.08.2005
(46) Опубликовано: 27.05.2009
(56) Список документов, цитированных в отчете о
поиске:
ЕР 1213296 А1, 12.06.2002. US 5274111 А, 28.12.1993. ЕР 1167357 А1, 02.01.2002. SU 545258 A3, 30.01.1977.
(85) Дата перевода заявки PCT на национальную фазу:
09.03.2005
(86) Заявка PCT:
JP 03/10048 20030807
(87) Публикация PCT:
WO 2004/014932 20040219
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег.  517 517
|
(72) Автор(ы):
ТЕРАНИСИ Хиротака (JP),
ФУСИМИ Нобухико (JP),
ЙОНЕКУБО Сигеру (JP),
СИМИЗУ Казуо (JP),
СИБАЗАКИ Тосихиде (JP),
ИСАДЗИ Масаюки (JP)
(73) Патентообладатель(и):
КИССЕИ ФАРМАСЬЮТИКАЛ КО., ЛТД. (JP)
|
(54) ПРОИЗВОДНЫЕ ПИРАЗОЛА, ЛЕКАРСТВЕННЫЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЭТИ ПРОИЗВОДНЫЕ, ИХ ПРИМЕНЕНИЕ В МЕДИЦИНЕ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ
(57) Реферат:
Настоящее изобретение относится к производным пиразола, представленным общей формулой (I), а также к их фармацевтически приемлемым солям, обладающим ингибирующей активностью против SGLT1 человека, к фармацевтической композиции, ингибитору SGLT1 человека и лекарственным средствам на их основе, к их применению для изготовления фармацевтической композиции и к промежуточным соединениям для их получения.
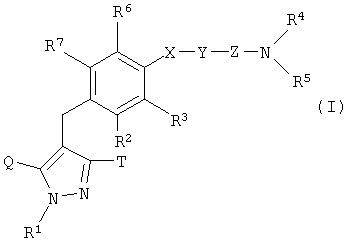 , ,
где R1 представляет собой Н, гидрокси(С2-6)алкильную группу, один из Q и Т означает группу, представленную общей формулой:
или группу, представленную общей формулой:
в то время как другой представляет собой С1-6алкильную группу; R2 представляет собой атом водорода, атом галогена, С1-6алкильную группу или группу формулы: -A-R8, где А представляет собой атом кислорода и R8 представляет собой С6гетероциклоалкильную группу, содержащую атом кислорода в качестве гетероатома; X представляет собой простую связь или атом кислорода; Y представляет собой С1-6алкиленовую группу или С2-6алкениленовую группу; Z представляет собой карбонильную группу или сульфонильную группу; R4 и R5 являются одинаковыми или различными, и каждый представляет собой атом водорода или С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранные из заместителей (i). Значения заместителей (i) приведены в формуле изобретения. 10 н. и 18 з.п. ф-лы, 3 табл.
Область, к которой относится изобретение
Настоящее изобретение относится к производным пиразола; к их фармацевтически приемлемым солям или пролекарствам, которые полезны в качестве лекарственных средств; к содержащим их фармацевтическим композициям; и к промежуточным соединениям для их получения.
Более конкретно, настоящее изобретение относится к производным пиразола, обладающим ингибирующей активностью по отношению к SGLT1 человека; к их фармацевтически приемлемым солям или пролекарствам, которые полезны в качестве средств для предупреждения или лечения заболевания, ассоциированного с гипергликемией, такого как диабет, нарушенная толерантность к глюкозе, аномальное содержание глюкозы в крови натощак, осложнения при диабете или ожирение; а также к фармацевтическим композициям, содержащим указанные производные; к их применению в качестве фармацевтических средств; и к промежуточным соединениям для их получения.
Предшествующий уровень техники
Диабет является одним из заболеваний, связанных с образом жизни и развивающихся на фоне изменения пищевых привычек и отсутствия физической нагрузки. Поэтому пациентам с диабетом показана диетотерапия и лечебная гимнастика. Кроме того, если достаточный контроль и продолжительность такой терапии представляют определенные трудности, то одновременно проводят лекарственную терапию. Кроме того, широкомасштабные клинические испытания подтвердили, что для предупреждения диабета и предотвращения развития его осложнений необходимо осуществление строгого и длительного контроля за уровнем сахара в крови у пациента путем проведения соответствующего лечения (см. ссылки 1 и 2). Более того, многие эпидемиологические исследования по нарушенной толерантности к глюкозе и возникновению макроангиопатии показали, что нарушенная толерантность к глюкозе пограничного типа также является фактором риска развития макроангиопатии и диабета. Таким образом, главное усилие необходимо направить на предотвращение гипергликемии после приема пищи (см. ссылку 3).
В последние годы из-за все возрастающего числа пациентов, страдающих диабетом, наблюдается большой прогресс в разработке различных антидиабетических средств. Так, например, для предотвращения гипергликемии после приема пищи используются ингибиторы  -глюкозидазы, которые замедляют гидролиз углеродов и их абсорбцию в тонком кишечнике. Сообщалось также, что акарбоза, один из ингибиторов -глюкозидазы, которые замедляют гидролиз углеродов и их абсорбцию в тонком кишечнике. Сообщалось также, что акарбоза, один из ингибиторов  -глюкозидазы, обладает действием, предупреждающим развитие диабета или снижающим частоту заболеваний диабетом при ее введении пациентам с нарушенной толерантностью к глюкозе (см. ссылку 4). Однако, поскольку, несмотря на недавно практикующееся изменение состава сахаров в пище, ингибиторы -глюкозидазы, обладает действием, предупреждающим развитие диабета или снижающим частоту заболеваний диабетом при ее введении пациентам с нарушенной толерантностью к глюкозе (см. ссылку 4). Однако, поскольку, несмотря на недавно практикующееся изменение состава сахаров в пище, ингибиторы  -гликозидазы не снижают повышенных уровней глюкозы при потреблении моносахарида глюкозы (см. ссылку 5), то необходимо разработать такие средства, которые обладали бы более широким спектром активности, направленной на ингибирование абсорбции углеводов. -гликозидазы не снижают повышенных уровней глюкозы при потреблении моносахарида глюкозы (см. ссылку 5), то необходимо разработать такие средства, которые обладали бы более широким спектром активности, направленной на ингибирование абсорбции углеводов.
При этом известно, что в тонком кишечнике присутствует SGLT1, натрий-зависимый транспортер глюкозы 1, который регулирует абсорбцию углеводов. Также сообщалось, что недостаточная абсорбция глюкозы и галактозы у пациентов приводит к дисфункции, обусловленной врожденными дефектами SGLT1 человека (см. ссылки 6-8). Кроме того, было подтверждено, что SGLT1 участвует в абсорбции глюкозы и галактозы (см. ссылки 9 и 10).
Кроме того, было установлено, что у OLETF-крыс и у крыс с симптомами диабета, индуцированного стрептозотоцином (см. ссылки 11-12), наблюдается увеличение уровня мРНК и белка SGLT1 и ускоряется абсорбция глюкозы. Обычно у пациентов с диабетом повышены гидролиз углеводов и их абсорбция. Так, например, было установлено, что уровни мРНК и белка SGLT1 значительно увеличиваются в тонком кишечнике человека (см. ссылку 13).
Поэтому блокирование активности SGLT1 у человека ингибирует абсорбцию углеводов, таких как глюкоза, в тонком кишечнике, и поэтому может предотвращать повышение уровня сахара в крови. В частности, считается, что замедление абсорбции глюкозы, происходящее в соответствии с вышеуказанным механизмом, является эффективным для нормализации гипергликемии после приема пищи. Кроме того, очевидно, что поскольку увеличение уровня SGLT1 в тонком кишечнике приводит к увеличению абсорбции углеводов, то для предупреждения или лечения диабета крайне необходимо разработать такие лекарственные средства, которые обладали бы сильной ингибирующей активностью по отношению к SGLT1 человека.
Ссылка 1: The Diabetes Control and Complications Trial Research Group, N. Engl. J. Med., 1993.9, Vol.329, No.14, p.977-986;
Ссылка 2: UK Prospective Diabetes Study Group, Lancet, 1998.9, Vol.352, No.9131, p.837-853;
Ссылка 3: MaJcoto, TOMINAGA, Endocrinology&Diabetology, 2001.11, Vol.13, No.5, p.534-542;
Ссылка 4: Jean-Louis Chiasson and 5 persons. Lancet, 2002.6, Vol.359, No.9323, p.2072-2077;
Ссылка 5: Hiroyuki, ODAKA and 3 persons. Journal of Japanese Society of Nutrition and Food Science, 1992, Vol.45, No.1, p.27-31;
Ссылка 6: Tadao, BABA and 1 person. Supplementary volume of Nippon Rinsho, Ryoikibetsu Shokogun, 1998, No.19, p.552-554;
Ссылка 7: Michihiro, KASAHARA and 2 persons, Saishin Igaku, 1996.1, Vol.51, No.1, p.84-90;
Ссылка 8: Tomofusa, TSUCHIYA and 1 person, Nippon Rinsho, 1997.8, Vol.55, No.8, p.2131-2139;
Ссылка 9: Yoshikatsu, KANAI, Kidney and Dialysis, 1998.12, Vol.45, extra edition, p.232-237;
Ссылка 10: E. Turk and 4 persons. Nature, 1991.3, Vol.350, p.354-356;
Ссылка 11: Y. Fujita and 5 persons, Diabetologia, 1998, Vol.41, p.1459-1466;
Ссылка 12: J. Dyer and 5 persons. Biochemical Society Transactions, 1997, Vol.25, p.479S;
Ссылка 13: J. Dyer and 4 persons, American Journal of Physiology, 2002.2, Vol.282, No.2, p.G241-G248.
Описание изобретения
Авторами настоящего изобретения были проведены серьезные исследования, направленные на получение соединений, обладающих ингибирующей активностью по отношению к SGLT1 человека. В результате этих исследований было обнаружено, что некоторые производные пиразола, представленные нижеследующей общей формулой (I), обладают ингибирующей активностью против SGLT1 человека в тонком кишечнике и превосходной ингибирующей активностью, направленной на снижение уровня глюкозы в крови, как будет показано ниже, и этот факт был положен в основу настоящего изобретения.
Настоящее изобретение относится к новым производным пиразола, которые обладают превосходной ингибирующей активностью, направленной на подавление увеличения уровня глюкозы в крови благодаря своему ингибирующему действию на SGLT1 человека и ингибирующему действию на абсорбцию углеводов, таких как глюкоза, в тонком кишечнике; а также к их фармацевтически приемлемым солям или пролекарствам; к содержащим их фармацевтическим композициям; к их применению в качестве фармацевтических средств; и к промежуточным соединениям для их получения.
Таким образом, настоящее изобретение относится:
[1] к производному пиразола, представленному общей формулой:
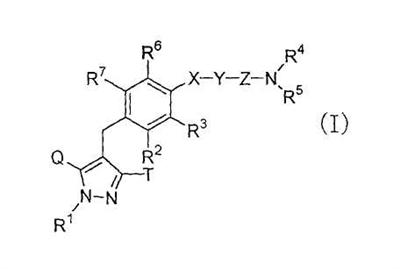
где R1 представляет собой атом водорода, С1-6алкильную группу, С2-6алкенильную группу, гидрокси(С2-6)алкильную группу, С3-7циклоалкильную группу, С3-7циклоалкил-замещенную (С1-6)алкильную группу, арильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из атома галогена, гидроксигруппы, аминогруппы, С1-6алкильной группы и С1-6алкоксигруппы; или арил(С1-6)алкильную группу, которая может иметь на кольце одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из атома галогена, гидроксигруппы, аминогруппы, С1-6алкильной группы и С1-6алкоксигруппы;
один из Q и Т представляет собой группу, представленную формулой:
или группу, представленную формулой:
в то время как другой представляет собой С1-6алкильную группу, галоген(С1-6)алкильную группу, С1-6алкокси-замещенную (С1-6)алкильную группу или С3-7циклоалкильную группу;
R2 представляет собой атом водорода, атом галогена, гидроксигруппу, С1-6алкильную группу, С1-6алкоксигруппу, С1-6алкилтиогруппу, галоген(С1-6)алкильную группу, галоген(С1-6алкокси)группу, С1-6алкокси-замещенную С1-6алкоксигруппу, С3-7циклоалкил-замещенную С2-6алкоксигруппу или группу общей формулы: -А-R8, где А представляет собой простую связь, атом кислорода, метиленовую группу, этиленовую группу, -ОСН2 или -СН2О-; и R8 представляет собой С3-7циклоалкильную группу, С2-6гетероциклоакильную группу, арильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранные из группы, состоящей из атома галогена, гидроксигруппы, аминогруппы, С1-6алкильной группы, С1-6алкоксигруппы, С2-6алкенилоксигруппы, галоген(С1-6)алкильной группы, гидрокси(С1-6)алкильной группы, карбоксигруппы, С2-7алкоксикарбонильной группы, цианогруппы и нитрогруппы, или гетероарильную группу, которая может иметь заместитель, выбранный из группы, состоящей из атома галогена и С1-6алкильной группы;
Х представляет собой простую связь, атом кислорода или атом серы;
Y представляет собой простую связь, С1-6алкиленовую группу или С2-6алкениленовую группу, при условии, что если Y представляет собой простую связь, то Х также представляет собой простую связь;
Z представляет собой карбонильную группу или сульфонильную группу;
R4 и R5 являются одинаковыми или различными, и каждый представляет собой атом водорода или С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из нижеследующей группы заместителей (i), либо R4 и R5 вместе связаны со смежным атомом азота с образованием циклической С2-6аминогруппы, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы;
R3, R6 и R7 являются одинаковыми или различными, и каждый представляет собой атом водорода, атом галогена, С1-6алкильную группу или С1-6алкоксигруппу; и
группа заместителей (i) состоит из гидроксигруппы, аминогруппы, моно- или ди(С1-6алкил)аминогруппы, моно- или ди[гидрокси(С1-6алкил)]аминогруппы, уреидогруппы, сульфамидной группы, моно- или ди(С1-6алкил)уреидогруппы, моно- или ди(С1-6алкил)сульфамидной группы, С2-7ациламиногруппы, С1-6алкилсульфониламиногруппы, группы общей формулы -CON(R9)R10, где R9 и R10 являются одинаковыми или различными, и каждый представляет собой атом водорода или С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из гидроксигруппы, аминогруппы, моно- или ди(С1-6алкил)аминогруппы, моно- или ди[гидрокси(С1-6алкил)]аминогруппы, уреидогруппы, моно- или ди(С1-6алкил)уреидогруппы, С2-7ациламиногруппы, С1-6алкилсульфониламиногруппы и карбамоильной группы, либо R9 и R10 вместе связаны со смежным атомом азота с образованием циклической С2-6аминогруппы, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы, С3-7циклоалкильной группы, С2-6гетероциклоалкильной группы, арильной группы, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из атома галогена, гидроксигруппы, аминогруппы, С1-6алкильной группы и С1-6алкоксигруппы, гетероарильной группы, которая может иметь заместитель, выбранный из группы, состоящей из атома галогена и С1-6алкильной группы, циклической С2-6аминогруппы, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы, и циклической ароматической С1-4аминогруппы, которая может иметь С1-6алкильную группу в качестве заместителя, или к его фармацевтически приемлемой соли;
[2] к производному пиразола, описанному в вышеуказанном пункте [1], где Y представляет собой С1-6алкиленовую группу или С2-6алкениленовую группу; один из R4 и R5 представляет собой С1-6алкильную группу, которая имеет одинаковые или различные 1-3 заместителя, выбранных из нижеследующей группы заместителей (i), другой представляет собой атом водорода или С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 группы, выбранные из нижеследующей группы заместителей (i); и группа заместителей (i) состоит из гидроксигруппы, аминогруппы, моно- или ди(С1-6алкил)аминогруппы, моно- или ди[гидрокси(С1-6алкил)]аминогруппы, уреидогруппы, сульфамидной группы, моно- или ди(С1-6алкил)уреидогруппы, моно- или ди(С1-6алкил)сульфамидной группы, С2-7ациламиногруппы, С1-6алкилсульфониламиногруппы, группы общей формулы: -CON(R9)R10, где R9 и R10 являются одинаковыми или различными, и каждый представляет собой атом водорода или С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из гидроксигруппы, аминогруппы, моно- или ди(С1-6алкил)аминогруппы, моно- или ди[гидрокси(С1-6алкил)]аминогруппы, уреидогруппы, моно- или ди(С1-6алкил)уреидогруппы, С2-7ацилаламиногруппы, С1-6алкилсульфониламиногруппы и карбамоильной группы, либо R9 и R10 вместе связаны со смежным атомом азота с образованием циклической С2-6аминогруппы, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы; С3-7циклоалкильной группы, С2-6гетероциклоалкильной группы, арильной группы, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из атома галогена, гидроксигруппы, аминогруппы, С1-6алкильной группы и С1-6алкоксигруппы, гетероарильной группы, которая может иметь заместитель, выбранный из группы, состоящей из атома галогена и С1-6алкильной группы, циклической С2-6аминогруппы, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы, и циклической ароматической С1-4аминогруппы, которая может иметь С1-6алкильную группу в качестве заместителя, или к его фармацевтически приемлемой соли;
[3] к производному пиразола, описанному в вышеуказанном пункте [2], где один из R4 и R5 представляет собой С1-6алкильную группу, которая имеет заместитель, выбранный из нижеследующей группы заместителей (iA), другой представляет собой атом водорода; и группа заместителей (iA) является группой общей формулы: -CON(R9А)R10А, где R9А и R10А вместе связаны со смежным атомом азота с образованием циклической С2-6аминогруппы, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы; или к его фармацевтически приемлемой соли;
[4] к производному пиразола, описанному в любом из вышеуказанных пунктов [1]-[3], где Х представляет собой простую связь, и Y представляет собой триметиленовую группу или 1-пропениленовую группу, или к его фармацевтически приемлемой соли;
[5] к производному пиразола, описанному в любом из вышеуказанных пунктов [1]-[3], где Х представляет собой атом кислорода, и Y представляет собой этиленовую группу или триметиленовую группу, или к его фармацевтически приемлемой соли;
[6] к производному пиразола, описанному в вышеуказанном пункте [1], где Х представляет собой простую связь; Y представляет собой простую связь; один из R4 и R5 представляет собой С1-6алкильную группу, которая имеет одинаковые или различные 1-3 заместителя, выбранных из нижеследующей группы заместителей (iB), другой представляет собой атом водорода или С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из нижеследующей группы заместителей (iB); группа заместителей (iB) состоит из уреидогруппы, сульфамидной группы, моно- или ди(С1-6алкил)уреидогруппы, моно- или ди(С1-6алкил)сульфамидной группы, С1-6алкилсульфониламиногруппы, группы общей формулы: -CON(R9В)R10В, где один из R9В и R10В представляет собой С1-6алкильную группу, которая имеет одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из гидроксигруппы, аминогруппы, моно- или ди(С1-6алкил)аминогруппы, моно- или ди[гидрокси(С1-6алкил)]аминогруппы, уреидогруппы, моно- или ди(С1-6алкил)уреидогруппы, С2-7ациламиногруппы, С1-6алкилсульфониламиногруппы и карбамоильной группы, другой представляет собой атом водорода, С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из гидроксигруппы, аминогруппы, моно- или ди(С1-6алкил)аминогруппы, моно- или ди[гидрокси(С1-6алкил)]аминогруппы, уреидогруппы, моно- или ди(С1-6алкил)уреидогруппы, С2-7ациламиногруппы, С1-6алкилсульфониламиногруппы и карбамоильной группы; либо R9 и R10 вместе связаны со смежным атомом азота с образованием циклической С2-6аминогруппы, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы; С3-7циклоалкильной группы, С2-6гетероциклоалкильной группы, арильной группы, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из атома галогена, гидроксигруппы, аминогруппы, С1-6алкильной группы и С1-6алкоксигруппы, гетероарильной группы, которая может иметь заместитель, выбранный из группы, состоящей из атома галогена и С1-6алкильной группы, циклической С2-6аминогруппы, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы, и циклической ароматической С1-4аминогруппы, которая может иметь С1-6алкильную группу в качестве заместителя, или к его фармацевтически приемлемой соли;
[7] к производному пиразола, описанному в любом одном из вышеуказанных пунктов [1]-[6], где R1 представляет собой атом водорода или гидрокси(С2-6)алкильную группу; Т означает группу, представленную формулой:
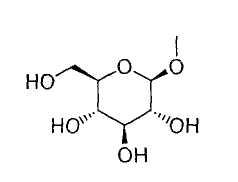
или группу, представленную формулой:
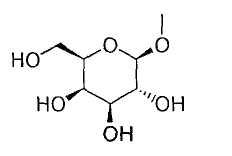
Q представляет собой С1-6алкильную группу или галоген(С1-6)алкильную группу, и R3, R6 и R7 представляют собой атом водорода; или к его фармацевтически приемлемой соли;
[8] к производному пиразола, описанному в любом одном из вышеуказанных пунктов [1]-[6], где один из Q и Т означает группу, представленную формулой:
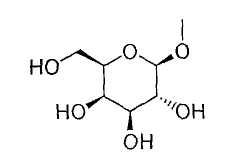
и другой представляет собой С1-6алкильную группу, галоген(С1-6)алкильную группу, С1-6алкокси-замещенную (С1-6)алкильную группу или С3-7циклоалкильную группу, или к его фармацевтически приемлемой соли;
[9] к производному пиразола, описанному в вышеуказанных пунктах [7] или [8], где Т означает группу, представленную формулой:
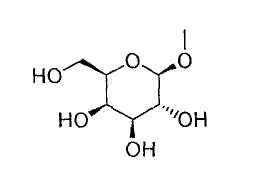
или к его фармацевтически приемлемой соли;
[10] к производному пиразола, описанному в вышеуказанных пунктах [7] или [9], где Q представляет собой изопропильную группу, или к его фармацевтически приемлемой соли;
[11] к пролекарству производного пиразола, описанного в любом из вышеуказанных пунктов [1]-[10]; или к его фармацевтически приемлемой соли;
[12] к пролекарству, описанному в вышеуказанном пункте [11], где Т означает группу, представленную формулой:
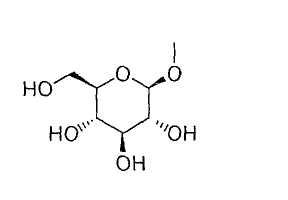
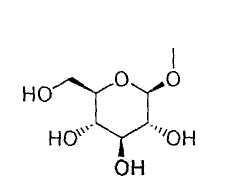
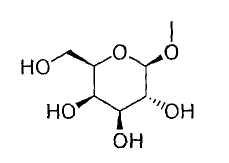
или группу, представленную формулой:
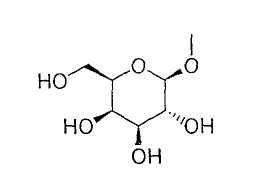
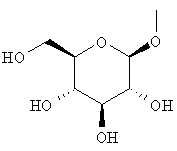
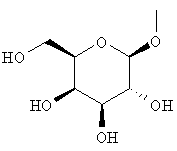
где гидроксигруппа в положении 4 замещена глюкопиранозильной группой или галактопиранозильной группой, или гидроксигруппа в положении 6 замещена глюкопиранозильной группой, галактопиранозильной группой, С2-7ацильной группой, С1-6алкокси-замещенной (С2-7)ацильной группой, С2-7алкоксикарбонил-замещенной (С2-7)ацильной группой, С2-7алкоксикарбонильной группой, арил(С2-7)алкоксикарбонильной группой или С1-6алкокси-замещенной (С2-7)алкоксикарбонильной группой;
[13] к производному пиразола, описанному в вышеуказанном пункте [1], которое представляет собой соединение, выбранное из следующей группы, включающей:
4-[(4-{3-[1-карбамоил-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол;
3-( -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол; -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[2-(диметиламино)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[2-(диметиламино)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол;
4-[(4-{3-[1-(2-аминоэтилкарбамоил)-1-(метил)этилкарбамоил]пропил}фенил)метил]-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-изопропилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-изопропилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{(1Е)-3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{(1Е)-3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-ди(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-ди(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-галактопиранозилокси)-1-(3-гидроксипропил)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-1-(3-гидроксипропил)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол;
4-{[2-фтор-4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-1Н-пиразол;
4-{[2-хлор-4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол; и их фармацевтически приемлемые соли; -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол; и их фармацевтически приемлемые соли;
[14] к производному пиразола, описанному в вышеуказанном пункте [13], которое представляет собой соединение, выбранное из следующей группы, включающей:
3-( -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол; -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол;
4-{[2-фтор-4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол; и -D-галактопиранозилокси)-5-изопропил-1Н-пиразол; и
их фармацевтически приемлемые соли;
[15] к фармацевтической композиции, содержащей в качестве активного ингредиента производное пиразола, описанное в одном из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемую соль или пролекарство;
[16] к ингибитору SGLT1 человека, содержащему в качестве активного ингредиента производное пиразола, описанное в одном из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемую соль или пролекарство;
[17] к средству для ингибирования гипергликемии, возникающей после приема пищи, содержащему в качестве активного ингредиента производное пиразола, описанное в одном из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемую соль или пролекарство;
[18] к средству для предупреждения или лечения заболевания, ассоциированного с гипергликемией, содержащему в качестве активного ингредиента производное пиразола, описанное в одном из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемую соль или пролекарство;
[19] к средству для предупреждения или лечения заболевания, описанного в вышеуказанном пункте [18], где указанным заболеванием, ассоциированным с гипергликемией, является заболевание, выбранное из группы, состоящей из диабета, нарушенной толерантности к глюкозе, осложнений диабета, ожирения, гиперинсулинемии, гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии, нарушения липидного метаболизма, атеросклероза, гипертензии, застойной сердечной недостаточности, отеков, гиперурикемии и подагры;
[20] к средству для ингибирования прогрессирования нарушенной толерантности к глюкозе или для нормализации аномального содержания глюкозы в крови натощак, приводящего к диабету у индивидуума, содержащему в качестве активного ингредиента производное пиразола, описанное в одном из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемую соль или пролекарство;
[21] к средству для предупреждения или лечения заболевания, ассоциированного с увеличением уровня галактозы в крови, содержащему в качестве активного ингредиента производное пиразола, описанное в одном из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемую соль или пролекарство;
[22] к средству для предупреждения или лечения заболевания, описанного в вышеуказанном пункте [21], где указанным заболеванием, ассоциированным с увеличением уровня галактозы в крови, является галактоземия;
[23] к фармацевтической композиции, описанной в вышеуказанном пункте [15], где дозированной лекарственной формой является композиция с пролонгированным высвобождением;
[24] к средству, описанному в любом из вышеуказанных пунктов [16]-[22], где дозированной формой является композиция с пролонгированным высвобождением;
[25] к способу предупреждения или лечения заболевания, ассоциированного с гипергликемией, включающему введение эффективного количества производного пиразола, описанного в любом из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемой соли или пролекарства;
[26] к способу ингибирования прогрессирования у индивидуума нарушения толерантности к глюкозе, приводящего к диабету, включающему введение эффективного количества производного пиразола, описанного в одном из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемой соли или пролекарства;
[27] к применению производного пиразола, описанного в любом из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемой соли или пролекарства для изготовления фармацевтической композиции для предупреждения или лечения заболевания, ассоциированного с гипергликемией;
[28] к применению производного пиразола, описанного в любом из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемой соли или пролекарства для изготовления фармацевтической композиции для ингибирования прогрессирования у индивидуума нарушенной толерантности к глюкозе, приводящей к диабету;
[29] к фармацевтической комбинации, содержащей (А) производное пиразола, описанное в любом из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемую соль или пролекарство, и (В), по крайней мере, один компонент, выбранный из группы, состоящий из усилителя чувствительности к инсулину, ингибитора абсорбции глюкозы, бигуанида, стимулятора секреции инсулина, ингибитора SGLT2, инсулина или его аналога, антагониста рецептора глюкагона, стимулятора киназы инсулинового рецептора, ингибитора трипептидилпептидазы II, ингибитора дипептидилпептидазы IV, ингибитора протеин-тирозин-фосфатазы 1В, ингибитора гликоген-фосфорилазы, ингибитора глюкозо-6-фосфатазы, ингибитора фруктозо-бифосфатазы, ингибитора пируват-дегидрогеназы, ингибитора глюконеогенеза в печени, D-хироинозита, ингибитора киназы-3 гликоген-синтазы, глюкагон-подобного пептида-1, аналога глюкагон-подобного пептида-1, агониста глюкагон-подобного пептида-1, амилина, аналога амилина, агониста амилина, ингибитора альдозоредуктазы, ингибитора образования конечных продуктов при высоком уровне гипергликемии, ингибитора протеинкиназы С, антагониста рецептора  -аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липид-пероксидазы, ингибитора дипептидазы N-ацетилированной- -аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липид-пероксидазы, ингибитора дипептидазы N-ацетилированной- -кислоты, инсулиноподобного фактора роста-I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервной ткани, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, антидиарейного средства, катартического средства, ингибитора гидроксиметилглутарил-кофермент-А-редуктазы, производного фибриновой кислоты, агониста -кислоты, инсулиноподобного фактора роста-I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервной ткани, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, антидиарейного средства, катартического средства, ингибитора гидроксиметилглутарил-кофермент-А-редуктазы, производного фибриновой кислоты, агониста  3-адренорецептора, ингибитора ацил-кофермент-А-холестеролацилтрансферазы, пробкола, агониста рецептора тиреоидного гормона, ингибитора абсорбции холестерина, ингибитора липазы, ингибитора микросомального переноса белка триглицеридов, ингибитора липоскигеназы, ингибитора карнитин-пальмитоил-трансферазы, ингибитора сквален-синтазы, стимулятора рецептора липопротеина низкой плотности, производного никотиновой кислоты, секвестранта желчной кислоты, ингибитора ко-транспортера натрия/желчной кислоты, ингибитора переноса белка сложного эфира холестерина, агента для подавления аппетита, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелин-конвертирующего фермента, антагониста рецептора эндотелина, диуретика, антагониста кальция, антигипертензивного сосудорасширяющего агента, блокатора симпатического ствола, антигипертензивного агента центрального действия, агониста 3-адренорецептора, ингибитора ацил-кофермент-А-холестеролацилтрансферазы, пробкола, агониста рецептора тиреоидного гормона, ингибитора абсорбции холестерина, ингибитора липазы, ингибитора микросомального переноса белка триглицеридов, ингибитора липоскигеназы, ингибитора карнитин-пальмитоил-трансферазы, ингибитора сквален-синтазы, стимулятора рецептора липопротеина низкой плотности, производного никотиновой кислоты, секвестранта желчной кислоты, ингибитора ко-транспортера натрия/желчной кислоты, ингибитора переноса белка сложного эфира холестерина, агента для подавления аппетита, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелин-конвертирующего фермента, антагониста рецептора эндотелина, диуретика, антагониста кальция, антигипертензивного сосудорасширяющего агента, блокатора симпатического ствола, антигипертензивного агента центрального действия, агониста  2-адренорецептора, антитромбоцитарного агента, ингибитора синтеза мочевой кислоты, средства, способствующего выведению мочевой кислоты, и средства для защелачивания мочи; 2-адренорецептора, антитромбоцитарного агента, ингибитора синтеза мочевой кислоты, средства, способствующего выведению мочевой кислоты, и средства для защелачивания мочи;
[30] к способу предупреждения или лечения заболевания, ассоциированного с гипергликемией, включающему введение эффективного количества (А) производного пиразола, описанного в любом одном из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемой соли или пролекарства; и (В), по крайней мере, одного компонента, выбранного из группы, состоящий из усилителя чувствительности к инсулину, ингибитора абсорбции глюкозы, бигуанида, стимулятора секреции инсулина, ингибитора SGLT2, инсулина или его аналога, антагониста рецептора глюкагона, стимулятора киназы инсулинового рецептора, ингибитора трипептидилпептидазы II, ингибитора дипептидилпептидазы IV, ингибитора протеин-тирозин-фосфатазы 1В, ингибитора гликоген-фосфорилазы, ингибитора глюкозо-6-фосфатазы, ингибитора фруктозо-бифосфатазы, ингибитора пируват-дегидрогеназы, ингибитора глюконеогенеза в печени, D-хироинозита, ингибитора киназы-3 гликоген-синтазы, глюкагон-подобного пептида-1, аналога глюкагон-подобного пептида-1, агониста глюкагон-подобного пептида-1, амилина, аналога амилина, агониста амилина, ингибитора альдозоредуктазы, ингибитора образования конечных продуктов при значительной гипергликемии, ингибитора протеинкиназы С, антагониста рецептора  -аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липид-пероксидазы, ингибитора дипептидазы N-ацетилированной- -аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липид-пероксидазы, ингибитора дипептидазы N-ацетилированной- -кислоты, инсулиноподобного фактора роста-I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервной ткани, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, антидиарейного средства, катартического средства, ингибитора гидроксиметилглутарил-кофермент-А-редуктазы, производного фибриновой кислоты, агониста -кислоты, инсулиноподобного фактора роста-I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервной ткани, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, антидиарейного средства, катартического средства, ингибитора гидроксиметилглутарил-кофермент-А-редуктазы, производного фибриновой кислоты, агониста  3-адренорецептора, ингибитора ацил-кофермент-А-холестеролацилтрансферазы, пробкола, агониста рецептора тиреоидного гормона, ингибитора абсорбции холестерина, ингибитора липазы, ингибитора микросомального переноса белка триглицеридов, ингибитора липоскигеназы, ингибитора карнитин-пальмитоил-трансферазы, ингибитора сквален-синтазы, стимулятора рецептора липопротеина низкой плотности, производного никотиновой кислоты, секвестранта желчной кислоты, ингибитора ко-транспортера натрия/желчной кислоты, ингибитора переноса белка сложного эфира холестерина, агента для подавления аппетита, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелин-конвертирующего фермента, антагониста рецептора эндотелина, диуретика, антагониста кальция, антигипертензивного сосудорасширяющего агента, блокатора симпатического ствола, антигипертензивного агента центрального действия, агониста 3-адренорецептора, ингибитора ацил-кофермент-А-холестеролацилтрансферазы, пробкола, агониста рецептора тиреоидного гормона, ингибитора абсорбции холестерина, ингибитора липазы, ингибитора микросомального переноса белка триглицеридов, ингибитора липоскигеназы, ингибитора карнитин-пальмитоил-трансферазы, ингибитора сквален-синтазы, стимулятора рецептора липопротеина низкой плотности, производного никотиновой кислоты, секвестранта желчной кислоты, ингибитора ко-транспортера натрия/желчной кислоты, ингибитора переноса белка сложного эфира холестерина, агента для подавления аппетита, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелин-конвертирующего фермента, антагониста рецептора эндотелина, диуретика, антагониста кальция, антигипертензивного сосудорасширяющего агента, блокатора симпатического ствола, антигипертензивного агента центрального действия, агониста  2-адренорецептора, антитромбоцитарного агента, ингибитора синтеза мочевой кислоты, средства, способствующего выведению мочевой кислоты, и средства для защелачивания мочи; 2-адренорецептора, антитромбоцитарного агента, ингибитора синтеза мочевой кислоты, средства, способствующего выведению мочевой кислоты, и средства для защелачивания мочи;
[31] к способу ингибирования прогрессирования у индивидуума нарушенной толерантности к глюкозе, приводящей к диабету, включающему введение эффективного количества (А) производного пиразола, описанного в любом одном из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемой соли или пролекарства; и (В), по крайней мере, одного компонента, выбранного из группы, состоящий из усилителя чувствительности к инсулину, ингибитора абсорбции глюкозы, бигуанида, стимулятора секреции инсулина, ингибитора SGLT2, инсулина или его аналога, антагониста рецептора глюкагона, стимулятора киназы инсулинового рецептора, ингибитора трипептидилпептидазы II, ингибитора дипептидилпептидазы IV, ингибитора протеин-тирозин-фосфатазы 1В, ингибитора гликоген-фосфорилазы, ингибитора глюкозо-6-фосфатазы, ингибитора фруктозо-бифосфатазы, ингибитора пируват-дегидрогеназы, ингибитора глюконеогенеза в печени, D-хироинозита, ингибитора киназы-3 гликоген-синтазы, глюкагон-подобного пептида-1, аналога глюкагон-подобного пептида-1, агониста глюкагон-подобного пептида-1, амилина, аналога амилина, агониста амилина, ингибитора альдозоредуктазы, ингибитора образования конечных продуктов при значительной гипергликемии, ингибитора протеинкиназы С, антагониста рецептора  -аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липид-пероксидазы, ингибитора дипептидазы N-ацетилированной- -аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липид-пероксидазы, ингибитора дипептидазы N-ацетилированной- -кислоты, инсулиноподобного фактора роста-I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервной ткани, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, антидиарейного средства, катартического средства, ингибитора гидроксиметилглутарил-кофермент-А-редуктазы, производного фибриновой кислоты, агониста -кислоты, инсулиноподобного фактора роста-I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервной ткани, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, антидиарейного средства, катартического средства, ингибитора гидроксиметилглутарил-кофермент-А-редуктазы, производного фибриновой кислоты, агониста  3-адренорецептора, ингибитора ацил-кофермент-А-холестеролацилтрансферазы, пробкола, агониста рецептора тиреоидного гормона, ингибитора абсорбции холестерина, ингибитора липазы, ингибитора микросомального переноса белка триглицеридов, ингибитора липоскигеназы, ингибитора карнитин-пальмитоил-трансферазы, ингибитора сквален-синтазы, стимулятора рецептора липопротеина низкой плотности, производного никотиновой кислоты, секвестранта желчной кислоты, ингибитора ко-транспортера натрия/желчной кислоты, ингибитора переноса белка сложного эфира холестерина, агента для подавления аппетита, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелин-конвертирующего фермента, антагониста рецептора эндотелина, диуретика, антагониста кальция, антигипертензивного сосудорасширяющего агента, блокатора симпатического ствола, антигипертензивного агента центрального действия, агониста 3-адренорецептора, ингибитора ацил-кофермент-А-холестеролацилтрансферазы, пробкола, агониста рецептора тиреоидного гормона, ингибитора абсорбции холестерина, ингибитора липазы, ингибитора микросомального переноса белка триглицеридов, ингибитора липоскигеназы, ингибитора карнитин-пальмитоил-трансферазы, ингибитора сквален-синтазы, стимулятора рецептора липопротеина низкой плотности, производного никотиновой кислоты, секвестранта желчной кислоты, ингибитора ко-транспортера натрия/желчной кислоты, ингибитора переноса белка сложного эфира холестерина, агента для подавления аппетита, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелин-конвертирующего фермента, антагониста рецептора эндотелина, диуретика, антагониста кальция, антигипертензивного сосудорасширяющего агента, блокатора симпатического ствола, антигипертензивного агента центрального действия, агониста  2-адренорецептора, антитромбоцитарного агента, ингибитора синтеза мочевой кислоты, средства, способствующего выведению мочевой кислоты, и средства для защелачивания мочи; 2-адренорецептора, антитромбоцитарного агента, ингибитора синтеза мочевой кислоты, средства, способствующего выведению мочевой кислоты, и средства для защелачивания мочи;
[32] к использованию (А) производного пиразола, описанного в любом одном из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемой соли или пролекарства; и (В), по крайней мере, одного компонента, выбранного из группы, состоящей из усилителя чувствительности к инсулину, ингибитора абсорбции глюкозы, бигуанида, стимулятора секреции инсулина, ингибитора SGLT2, инсулина или его аналога, антагониста рецептора глюкагона, стимулятора киназы инсулинового рецептора, ингибитора трипептидилпептидазы II, ингибитора дипептидилпептидазы IV, ингибитора протеин-тирозин-фосфатазы 1В, ингибитора гликоген-фосфорилазы, ингибитора глюкозо-6-фосфатазы, ингибитора фруктозо-бифосфатазы, ингибитора пируват-дегидрогеназы, ингибитора глюконеогенеза в печени, D-хироинозита, ингибитора киназы-3 гликоген-синтазы, глюкагон-подобного пептида-1, аналога глюкагон-подобного пептида-1, агониста глюкагон-подобного пептида-1, амилина, аналога амилина, агониста амилина, ингибитора альдозоредуктазы, ингибитора образования конечных продуктов при значительной гипергликемии, ингибитора протеинкиназы С, антагониста рецептора  -аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липид-пероксидазы, ингибитора дипептидазы N-ацетилированной- -аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липид-пероксидазы, ингибитора дипептидазы N-ацетилированной- -кислоты, инсулиноподобного фактора роста-I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервной ткани, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, антидиарейного средства, катартического средства, ингибитора гидроксиметилглутарил-кофермент-А-редуктазы, производного фибриновой кислоты, агониста -кислоты, инсулиноподобного фактора роста-I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервной ткани, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, антидиарейного средства, катартического средства, ингибитора гидроксиметилглутарил-кофермент-А-редуктазы, производного фибриновой кислоты, агониста  3-адренорецептора, ингибитора ацил-кофермент-А-холестеролацилтрансферазы, пробкола, агониста рецептора тиреоидного гормона, ингибитора абсорбции холестерина, ингибитора липазы, ингибитора микросомального переноса белка триглицеридов, ингибитора липоскигеназы, ингибитора карнитин-пальмитоил-трансферазы, ингибитора сквален-синтазы, стимулятора рецептора липопротеина низкой плотности, производного никотиновой кислоты, секвестранта желчной кислоты, ингибитора ко-транспортера натрия/желчной кислоты, ингибитора переноса белка сложного эфира холестерина, агента для подавления аппетита, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелин-конвертирующего фермента, антагониста рецептора эндотелина, диуретика, антагониста кальция, антигипертензивного сосудорасширяющего агента, блокатора симпатического ствола, антигипертензивного агента центрального действия, агониста 3-адренорецептора, ингибитора ацил-кофермент-А-холестеролацилтрансферазы, пробкола, агониста рецептора тиреоидного гормона, ингибитора абсорбции холестерина, ингибитора липазы, ингибитора микросомального переноса белка триглицеридов, ингибитора липоскигеназы, ингибитора карнитин-пальмитоил-трансферазы, ингибитора сквален-синтазы, стимулятора рецептора липопротеина низкой плотности, производного никотиновой кислоты, секвестранта желчной кислоты, ингибитора ко-транспортера натрия/желчной кислоты, ингибитора переноса белка сложного эфира холестерина, агента для подавления аппетита, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелин-конвертирующего фермента, антагониста рецептора эндотелина, диуретика, антагониста кальция, антигипертензивного сосудорасширяющего агента, блокатора симпатического ствола, антигипертензивного агента центрального действия, агониста  2-адренорецептора, антитромбоцитарного агента, ингибитора синтеза мочевой кислоты, средства, способствующего выведению мочевой кислоты и средства для защелачивания мочи, для изготовления фармацевтической композиции для предупреждения или лечения заболевания, ассоциированного с гипергликемией; 2-адренорецептора, антитромбоцитарного агента, ингибитора синтеза мочевой кислоты, средства, способствующего выведению мочевой кислоты и средства для защелачивания мочи, для изготовления фармацевтической композиции для предупреждения или лечения заболевания, ассоциированного с гипергликемией;
[33] к применению (А) производного пиразола, описанного в любом одном из вышеуказанных пунктов [1]-[14], его фармацевтически приемлемой соли или пролекарства; и (В), по крайней мере, одного компонента, выбранного из группы, состоящий из усилителя чувствительности к инсулину, ингибитора абсорбции глюкозы, бигуанида, стимулятора секреции инсулина, ингибитора SGLT2, инсулина или его аналога, антагониста рецептора глюкагона, стимулятора киназы инсулинового рецептора, ингибитора трипептидилпептидазы II, ингибитора дипептидилпептидазы IV, ингибитора протеин-тирозин-фосфатазы 1В, ингибитора гликоген-фосфорилазы, ингибитора глюкозо-6-фосфатазы, ингибитора фруктозо-бифосфатазы, ингибитора пируват-дегидрогеназы, ингибитора глюконеогенеза в печени, D-хироинозита, ингибитора киназы-3 гликоген-синтазы, глюкагон-подобного пептида-1, аналога глюкагон-подобного пептида-1, агониста глюкагон-подобного пептида-1, амилина, аналога амилина, агониста амилина, ингибитора альдозоредуктазы, ингибитора образования конечных продуктов при значительной гипергликемии, ингибитора протеинкиназы С, антагониста рецептора  -аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липид-пероксидазы, ингибитора дипептидазы N-ацетилированной- -аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липид-пероксидазы, ингибитора дипептидазы N-ацетилированной- -кислоты, инсулиноподобного фактора роста-I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервной ткани, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, антидиарейного средства, катартического средства, ингибитора гидроксиметилглутарил-кофермент-А-редуктазы, производного фибриновой кислоты, агониста -кислоты, инсулиноподобного фактора роста-I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервной ткани, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, антидиарейного средства, катартического средства, ингибитора гидроксиметилглутарил-кофермент-А-редуктазы, производного фибриновой кислоты, агониста  3-адренорецептора, ингибитора ацил-кофермент-А-холестеролацилтрансферазы, пробкола, агониста рецептора тиреоидного гормона, ингибитора абсорбции холестерина, ингибитора липазы, ингибитора микросомального переноса белка триглицеридов, ингибитора липоскигеназы, ингибитора карнитин-пальмитоил-трансферазы, ингибитора сквален-синтазы, стимулятора рецептора липопротеина низкой плотности, производного никотиновой кислоты, секвестранта желчной кислоты, ингибитора ко-транспортера натрия/желчной кислоты, ингибитора переноса белка сложного эфира холестерина, агента для подавления аппетита, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелин-конвертирующего фермента, антагониста рецептора эндотелина, диуретика, антагониста кальция, антигипертензивного сосудорасширяющего агента, блокатора симпатического ствола, антигипертензивного агента центрального действия, агониста 3-адренорецептора, ингибитора ацил-кофермент-А-холестеролацилтрансферазы, пробкола, агониста рецептора тиреоидного гормона, ингибитора абсорбции холестерина, ингибитора липазы, ингибитора микросомального переноса белка триглицеридов, ингибитора липоскигеназы, ингибитора карнитин-пальмитоил-трансферазы, ингибитора сквален-синтазы, стимулятора рецептора липопротеина низкой плотности, производного никотиновой кислоты, секвестранта желчной кислоты, ингибитора ко-транспортера натрия/желчной кислоты, ингибитора переноса белка сложного эфира холестерина, агента для подавления аппетита, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелин-конвертирующего фермента, антагониста рецептора эндотелина, диуретика, антагониста кальция, антигипертензивного сосудорасширяющего агента, блокатора симпатического ствола, антигипертензивного агента центрального действия, агониста  2-адренорецептора, антитромбоцитарного агента, ингибитора синтеза мочевой кислоты, средства, способствующего выведению мочевой кислоты, и средства для защелачивания мочи, для изготовления фармацевтической композиции для ингибирования прогрессирования у индивидуума нарушения толерантности к глюкозе, приводящего к диабету; 2-адренорецептора, антитромбоцитарного агента, ингибитора синтеза мочевой кислоты, средства, способствующего выведению мочевой кислоты, и средства для защелачивания мочи, для изготовления фармацевтической композиции для ингибирования прогрессирования у индивидуума нарушения толерантности к глюкозе, приводящего к диабету;
[34] к производному пиразола, представленному общей формулой:
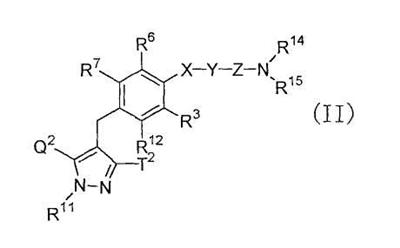
где R11 представляет собой атом водорода, С1-6алкильную группу; С2-6алкенильную группу; гидрокси(С2-6)алкильную группу, которая может иметь защитную группу; С3-7циклоалкильную группу; С3-7циклоалкил-замещенную (С1-6)алкильную группу; арильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из атома галогена, гидроксигруппы, которая может иметь защитную группу, аминогруппы, которая может иметь защитную группу, С1-6алкильной группы и С1-6алкоксигруппы; или арил(С1-6)алкильную группу, которая может иметь на кольце одинаковые или различные 1-3 заместителя, выбранные из группы, состоящей из атома галогена, гидроксигруппы, которая может иметь защитную группу, аминогруппы, которая может иметь защитную группу, С1-6алкильной группы и С1-6алкоксигруппы;
один из Q2 и Т2 представляет собой 2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилоксигруппу или 2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилоксигруппу или 2,3,4,6-тетра-О-ацетил- -D-галактопиранозилоксигруппу, в то время как другой представляет собой С1-6алкильную группу, галоген(С1-6)алкильную группу, С1-6алкокси-замещенную (С1-6)алкильную группу или С3-7циклоалкильную группу; -D-галактопиранозилоксигруппу, в то время как другой представляет собой С1-6алкильную группу, галоген(С1-6)алкильную группу, С1-6алкокси-замещенную (С1-6)алкильную группу или С3-7циклоалкильную группу;
R12 представляет собой атом водорода, атом галогена, гидроксигруппу, которая может иметь защитную группу, С1-6алкильную группу, С1-6алкоксигруппу, С1-6алкилтиогруппу, галоген(С1-6)алкильную группу, галоген(С1-6алкокси)группу, С1-6алкокси-замещенную (С1-6алкокси)группу, С3-7циклоалкил-замещенную С2-6алкоксигруппу или группу общей формулы: -А-R18, где А представляет собой простую связь, атом кислорода, метиленовую группу, этиленовую группу, -ОСН2 или -СН2О-; и R18 представляет собой С3-7циклоалкильную группу, С2-6гетероциклоакильную группу, арильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из атома галогена, гидроксигруппы, которая может иметь защитную группу, аминогруппы, которая может иметь защитную группу, С1-6алкильной группы, С1-6алкоксигруппы, С2-6алкенилоксигруппы, галоген(С1-6)алкильной группы, гидрокси(С1-6)алкильной группы, которая может иметь защитную группу, карбоксигруппы, которая может иметь защитную группу, С2-7алкоксикарбонильной группы, цианогруппы и нитрогруппы; или гетероарильную группу, которая может иметь заместитель, выбранный из группы, состоящей из атома галогена и С1-6алкильной группы;
Х представляет собой простую связь, атом кислорода или атом серы;
Y представляет собой простую связь, С1-6алкиленовую группу или С2-6алкениленовую группу, при условии, что если Y представляет собой простую связь, то Х также представляет собой простую связь;
Z представляет собой карбонильную группу или сульфонильную группу;
R14 и R15 являются одинаковыми или различными, и каждый представляет собой атом водорода или С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из нижеследующей группы заместителей (ii), либо R14 и R15 вместе связаны со смежным атомом азота с образованием циклической С2-6аминогруппы, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы, которая может иметь защитную группу;
R3, R6 и R7 являются одинаковыми или различными, и каждый представляет собой атом водорода, атом галогена, С1-6алкильную группу или С1-6алкоксигруппу; и
группа заместителей (ii) состоит из гидроксигруппы, которая может иметь защитную группу; аминогруппы, которая может иметь защитную группу; моно- или ди(С1-6алкил)аминогруппы, которая может иметь защитную группу; моно- или ди[гидрокси(С1-6алкил)]аминогруппы, которая может иметь защитную группу; уреидогруппы; сульфамидной группы; моно- или ди(С1-6алкил)уреидогруппы; моно- или ди(С1-6алкил)сульфамидной группы; С2-7ациламиногруппы; С1-6алкилсульфониламиногруппы; группы общей формулы -CON(R19)R20, где R19 и R20 являются одинаковыми или различными, и каждый представляет собой атом водорода или С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из гидроксигруппы, которая может иметь защитную группу; аминогруппы, которая может иметь защитную группу; моно- или ди(С1-6алкил)аминогруппы, которая может иметь защитную группу; моно- или ди[гидрокси(С1-6алкил)]аминогруппы, которая может иметь защитную группу; уреидогруппы; моно- или ди(С1-6алкил)уреидогруппы; С2-7ациламиногруппы; С1-6алкилсульфониламиногруппы и карбамоильной группы, либо R19 и R20 вместе связаны со смежным атомом азота с образованием циклической С2-6аминогруппы, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы, которая может иметь защитную группу; С3-7циклоалкильной группы; С2-6гетероциклоалкильной группы; арильной группы, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из атома галогена, гидроксигруппы, которая может иметь защитную группу, аминогруппы, которая может иметь защитную группу, С1-6алкильной группы и С1-6алкоксигруппы; гетероарильной группы, которая может иметь заместитель, выбранный из группы, состоящей из атома галогена и С1-6алкильной группы, циклической С2-6аминогруппы, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы, которая может иметь защитную группу; и циклической ароматической С1-4аминогруппы, которая может иметь С1-6алкильную группу в качестве заместителя, или к его соли; и т.п.;
В настоящем изобретении термин  С1-6алкильная группа С1-6алкильная группа означает прямую или разветвленную алкильную группу, имеющую 1-6 атомов углерода, такую как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, неопентильная группа, трет-пентильная группа, гексильная группа или т.п.; термин означает прямую или разветвленную алкильную группу, имеющую 1-6 атомов углерода, такую как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, неопентильная группа, трет-пентильная группа, гексильная группа или т.п.; термин  С1-6алкиленовая группа С1-6алкиленовая группа означает прямую или разветвленную алкиленовую группу, имеющую 1-6 атомов углерода, такую как метиленовая группа, этиленовая группа, триметиленовая группа, тетраметиленовая группа, пропиленовая группа, 1,1-диметилэтиленовая группа или т.п.; термин означает прямую или разветвленную алкиленовую группу, имеющую 1-6 атомов углерода, такую как метиленовая группа, этиленовая группа, триметиленовая группа, тетраметиленовая группа, пропиленовая группа, 1,1-диметилэтиленовая группа или т.п.; термин  гидрокси(С1-6)алкильная группа гидрокси(С1-6)алкильная группа означает вышеуказанную С1-6алкильную группу, замешенную гидроксигруппой; термин означает вышеуказанную С1-6алкильную группу, замешенную гидроксигруппой; термин  С2-6алкильная группа С2-6алкильная группа означает прямую или разветвленную алкильную группу, имеющую 2-6 атомов углерода, такую как этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, неопентильная группа, трет-пентильная группа, гексильная группа или т.п.; термин означает прямую или разветвленную алкильную группу, имеющую 2-6 атомов углерода, такую как этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, неопентильная группа, трет-пентильная группа, гексильная группа или т.п.; термин  гидрокси(С2-6)алкильная группа гидрокси(С2-6)алкильная группа означает вышеуказанную С2-6алкильную группу, замещенную гидроксигруппой, такую как 2-гидроксиэтильная группа, 3-гидроксипропильная группа или т.п.; термин означает вышеуказанную С2-6алкильную группу, замещенную гидроксигруппой, такую как 2-гидроксиэтильная группа, 3-гидроксипропильная группа или т.п.; термин  С1-6алкоксигруппа С1-6алкоксигруппа означает прямую или разветвленную алкоксигруппу, имеющую 1-6 атомов углерода, такую как метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа, пентилоксигруппа, изопентилоксигруппа, неопентилоксигруппа, трет-пентилоксигруппа, гексилоксигруппа или т.п; термин означает прямую или разветвленную алкоксигруппу, имеющую 1-6 атомов углерода, такую как метоксигруппа, этоксигруппа, пропоксигруппа, изопропоксигруппа, бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа, пентилоксигруппа, изопентилоксигруппа, неопентилоксигруппа, трет-пентилоксигруппа, гексилоксигруппа или т.п; термин  С1-6алкокси-замещенная С1-6алкильная группа С1-6алкокси-замещенная С1-6алкильная группа означает вышеуказанную С1-6алкильную группу, замещенную вышеуказанной С1-6алкоксигруппой; термин означает вышеуказанную С1-6алкильную группу, замещенную вышеуказанной С1-6алкоксигруппой; термин  С1-6алкокси-замещенная С1-6алкоксигруппа С1-6алкокси-замещенная С1-6алкоксигруппа означает вышеуказанную С1-6алкоксигруппу, замещенную вышеуказанной С1-6алкоксигруппой, такую как метоксиметоксигруппа или т.п.; термин означает вышеуказанную С1-6алкоксигруппу, замещенную вышеуказанной С1-6алкоксигруппой, такую как метоксиметоксигруппа или т.п.; термин  С2-6алкенильная группа С2-6алкенильная группа означает прямую или разветвленную алкенильную группу, имеющую 2-6 атомов углерода, такую как винильная группа, аллильная группа, 1-пропенильная группа, изопропенильная группа, 1-бутинильная группа, 2-бутенильная группа, 2-метилаллильная группа или т.п.; термин означает прямую или разветвленную алкенильную группу, имеющую 2-6 атомов углерода, такую как винильная группа, аллильная группа, 1-пропенильная группа, изопропенильная группа, 1-бутинильная группа, 2-бутенильная группа, 2-метилаллильная группа или т.п.; термин  С2-6алкениленовая группа С2-6алкениленовая группа означает прямую или разветвленную алкениленовую группу, имеющую 2-6 атомов углерода, такую как виниленовая группа, пропениленовая группа или т.п.; термин означает прямую или разветвленную алкениленовую группу, имеющую 2-6 атомов углерода, такую как виниленовая группа, пропениленовая группа или т.п.; термин  С2-6алкенилоксигруппа С2-6алкенилоксигруппа означает вышеуказанную С1-6алкоксигруппу, за исключением метоксигруппы, которая имеет ненасыщенную связь, такую как аллилоксигруппа или т.п.; термин означает вышеуказанную С1-6алкоксигруппу, за исключением метоксигруппы, которая имеет ненасыщенную связь, такую как аллилоксигруппа или т.п.; термин  С1-6алкилтиогруппа С1-6алкилтиогруппа означает прямую или разветвленную алкилтиогруппу, имеющую 1-6 атомов углерода, такую как метилтиогруппа, этилтиогруппа, пропилтиогруппа, изопропилтиогруппа, бутилтиогруппа, изобутилтиогруппа, втор-бутилтиогруппа, трет-бутилтиогруппа, пентилтиогруппа, изопентилтиогруппа, неопентилтиогруппа, трет-пентилтиогруппа, гексилтиогруппа или т.п.; термин означает прямую или разветвленную алкилтиогруппу, имеющую 1-6 атомов углерода, такую как метилтиогруппа, этилтиогруппа, пропилтиогруппа, изопропилтиогруппа, бутилтиогруппа, изобутилтиогруппа, втор-бутилтиогруппа, трет-бутилтиогруппа, пентилтиогруппа, изопентилтиогруппа, неопентилтиогруппа, трет-пентилтиогруппа, гексилтиогруппа или т.п.; термин  моно- или ди(С1-6алкил)аминогруппа моно- или ди(С1-6алкил)аминогруппа означает аминогруппу, монозамещенную вышеуказанной С1-6алкильной группой или дизамещенную одинаковыми или различными С1-6алкильными группами, определенными выше; термин означает аминогруппу, монозамещенную вышеуказанной С1-6алкильной группой или дизамещенную одинаковыми или различными С1-6алкильными группами, определенными выше; термин  моно- или ди[гидрокси(С1-6алкил)]аминогруппа моно- или ди[гидрокси(С1-6алкил)]аминогруппа означает аминогруппу, монозамещенную вышеуказанной гидрокси(С1-6)алкильной группой или дизамещенную одинаковыми или различными гидрокси(С1-6)алкильными группами, определенными выше; термин означает аминогруппу, монозамещенную вышеуказанной гидрокси(С1-6)алкильной группой или дизамещенную одинаковыми или различными гидрокси(С1-6)алкильными группами, определенными выше; термин  моно- или ди(С1-6алкил)уреидогруппа моно- или ди(С1-6алкил)уреидогруппа означает уреидогруппу, монозамещенную вышеуказанной С1-6алкильной группой или дизамещенную одинаковыми или различными С1-6алкильными группами, определенными выше; термин означает уреидогруппу, монозамещенную вышеуказанной С1-6алкильной группой или дизамещенную одинаковыми или различными С1-6алкильными группами, определенными выше; термин  моно- или ди(С1-6алкил)сульфамидная группа моно- или ди(С1-6алкил)сульфамидная группа означает сульфамидную группу, монозамещенную вышеуказанной С1-6алкильной группой или дизамещенную одинаковыми или различными С1-6алкильными группами, определенными выше; термин означает сульфамидную группу, монозамещенную вышеуказанной С1-6алкильной группой или дизамещенную одинаковыми или различными С1-6алкильными группами, определенными выше; термин  С2-7ациламиногруппа С2-7ациламиногруппа означает аминогруппу, замещенную прямой или разветвленной ацильной группой, имеющей 2-7 атомов углерода, такую как ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, валерильная группа, пивалоильная группа, гексаноильная группа или т.п.; термин означает аминогруппу, замещенную прямой или разветвленной ацильной группой, имеющей 2-7 атомов углерода, такую как ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, валерильная группа, пивалоильная группа, гексаноильная группа или т.п.; термин  С1-6алкилсульфониламиногруппа С1-6алкилсульфониламиногруппа означает аминогруппу, замещенную прямой или разветвленной алкилсульфонильной группой, имеющей 1-6 атомов углерода, такой как метансульфонильная группа, этансульфонильная группа или т.п.; термин означает аминогруппу, замещенную прямой или разветвленной алкилсульфонильной группой, имеющей 1-6 атомов углерода, такой как метансульфонильная группа, этансульфонильная группа или т.п.; термин  С3-7циклоалкильная группа С3-7циклоалкильная группа означает циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу или циклогептильную группу; термин означает циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу или циклогептильную группу; термин  С3-7циклоалкил-замещенная С1-6алкильная группа С3-7циклоалкил-замещенная С1-6алкильная группа означает вышеуказанную С1-6алкильную группу, замещенную вышеуказанной С3-7циклоалкильной группой; термин означает вышеуказанную С1-6алкильную группу, замещенную вышеуказанной С3-7циклоалкильной группой; термин  С3-7циклоалкил-замещенная С2-6алкоксигруппа С3-7циклоалкил-замещенная С2-6алкоксигруппа означает вышеуказанную С1-6алкокси группу, за исключением метоксигруппы, замещенную вышеуказанной С3-7циклоалкильной группой; термин означает вышеуказанную С1-6алкокси группу, за исключением метоксигруппы, замещенную вышеуказанной С3-7циклоалкильной группой; термин  С2-6гетероциклоалкильная группа С2-6гетероциклоалкильная группа означает вышеуказанную С3-7циклоалкильную группу, содержащую в кольце одинаковые или различные 1 или 2 гетероатома, не являющиеся атомами в положении связывания и выбранные из атома азота, атома кислорода и атома серы, и примерами такой группы являются морфолин, тиоморфолин, тетрагидрофуран, тетрагидропиран, азиридин, азетидин, пирролидин, имидазолидин, оксазолин, пиперидин, пиперазин, пиразолидин или т.п.; термин означает вышеуказанную С3-7циклоалкильную группу, содержащую в кольце одинаковые или различные 1 или 2 гетероатома, не являющиеся атомами в положении связывания и выбранные из атома азота, атома кислорода и атома серы, и примерами такой группы являются морфолин, тиоморфолин, тетрагидрофуран, тетрагидропиран, азиридин, азетидин, пирролидин, имидазолидин, оксазолин, пиперидин, пиперазин, пиразолидин или т.п.; термин  атом галогена атом галогена означает атом фтора, атом хлора, атом брома или атом иода; термин означает атом фтора, атом хлора, атом брома или атом иода; термин  галоген(С1-6)алкильная группа галоген(С1-6)алкильная группа означает вышеуказанную С1-6алкильную группу, замещенную одинаковыми или различными 1-5 атомами галогена, определенными выше, такую как трифторметильная группа, пентафторэтильная группа или т.п.; термин означает вышеуказанную С1-6алкильную группу, замещенную одинаковыми или различными 1-5 атомами галогена, определенными выше, такую как трифторметильная группа, пентафторэтильная группа или т.п.; термин  галоген(С1-6)алкоксигруппа галоген(С1-6)алкоксигруппа означает вышеуказанную С1-6алкоксигруппу, замещенную одинаковыми или различными 1-5 атомами галогена, определенными выше; термин означает вышеуказанную С1-6алкоксигруппу, замещенную одинаковыми или различными 1-5 атомами галогена, определенными выше; термин  С2-7алкоксикарбонильная группа С2-7алкоксикарбонильная группа означает прямую или разветвленную алкоксикарбонильную группу, имеющую 2-7 атомов углерода, такую как метоксикарбонильная группа, этоксикарбонильная группа, пропоксикарбонильная группа, изопропоксикарбонильная группа, бутоксикарбонильная группа, изобутилоксикарбонильная группа, втор-бутоксикарбонильная группа, трет-бутоксикарбонильная группа, пентилоксикарбонильная группа, изопентилоксикарбонильная группа, неопентилоксикарбонильная группа, трет-пентилоксикарбонильная группа, гексилоксикарбонильная группа или т.п.; термин означает прямую или разветвленную алкоксикарбонильную группу, имеющую 2-7 атомов углерода, такую как метоксикарбонильная группа, этоксикарбонильная группа, пропоксикарбонильная группа, изопропоксикарбонильная группа, бутоксикарбонильная группа, изобутилоксикарбонильная группа, втор-бутоксикарбонильная группа, трет-бутоксикарбонильная группа, пентилоксикарбонильная группа, изопентилоксикарбонильная группа, неопентилоксикарбонильная группа, трет-пентилоксикарбонильная группа, гексилоксикарбонильная группа или т.п.; термин  арильная группа арильная группа означает моно-трициклическую ароматическую углеводородную группу, такую как фенильная группа, нафтильная группа или т.п.; термин означает моно-трициклическую ароматическую углеводородную группу, такую как фенильная группа, нафтильная группа или т.п.; термин  арил(С1-6)алкильная группа арил(С1-6)алкильная группа означает вышеуказанную С1-6алкильную группу, замещенную вышеуказанной арильной группой; термин означает вышеуказанную С1-6алкильную группу, замещенную вышеуказанной арильной группой; термин  гетероарильная группа гетероарильная группа означает 5- или 6-членную гетероарильную группу, содержащую в кольце одинаковые или различные 1-4 гетероатома, не являющиеся атомами в положении связывания и выбранные из атома азота, атома кислорода и атома серы, которая является производной тиазола, оксазола, изотиазола, изоксазола, пиридина, пиримидина, пиризина, пиридазина, пиррола, тиофена, имидазола, пиразола, оксадиазола, тиадиазола, тетразола, фуразана или т.п.; термин означает 5- или 6-членную гетероарильную группу, содержащую в кольце одинаковые или различные 1-4 гетероатома, не являющиеся атомами в положении связывания и выбранные из атома азота, атома кислорода и атома серы, которая является производной тиазола, оксазола, изотиазола, изоксазола, пиридина, пиримидина, пиризина, пиридазина, пиррола, тиофена, имидазола, пиразола, оксадиазола, тиадиазола, тетразола, фуразана или т.п.; термин  циклическая С2-6аминогруппа циклическая С2-6аминогруппа означает 5- или 6-членную моноциклическую аминогруппу с 2-6 атомами углерода, которая может содержать в кольце один гетероатом, не являющийся атомом азота в положении связывания и выбранный из атома азота, атома кислорода и атома серы, и примерами такой группы являются морфолиногруппа, тиоморфолиногруппа, 1-азиридинильная группа, 1-азетидинильная группа, 1-пирролидинильная группа, пиперидиногруппа, 1-имидазолидинильная группа, 1-пиперазинильная группа, пиразолидинильная группа или т.п.; термин означает 5- или 6-членную моноциклическую аминогруппу с 2-6 атомами углерода, которая может содержать в кольце один гетероатом, не являющийся атомом азота в положении связывания и выбранный из атома азота, атома кислорода и атома серы, и примерами такой группы являются морфолиногруппа, тиоморфолиногруппа, 1-азиридинильная группа, 1-азетидинильная группа, 1-пирролидинильная группа, пиперидиногруппа, 1-имидазолидинильная группа, 1-пиперазинильная группа, пиразолидинильная группа или т.п.; термин  ароматическая циклическая С1-4аминогруппа ароматическая циклическая С1-4аминогруппа означает 5-членную ароматическую моноциклическую аминогруппу с 1-4 атомами углерода, которая может содержать 1-3 атома азота, не являющиеся атомами азота в положении связывания, такую как 1-имидазолильная группа, 1-пирролильная группа, пиразолильная группа, 1-тетразолильная группа или т.п.; термин означает 5-членную ароматическую моноциклическую аминогруппу с 1-4 атомами углерода, которая может содержать 1-3 атома азота, не являющиеся атомами азота в положении связывания, такую как 1-имидазолильная группа, 1-пирролильная группа, пиразолильная группа, 1-тетразолильная группа или т.п.; термин  гидроксизащитная группа гидроксизащитная группа означает гидроксизащитную группу, используемую в общих методах органического синтеза, такую как бензильная группа, метоксиметильная группа, ацетильная группа, пивалоильная группа, бензоильная группа, трет-бутилдиметилсилильная группа, триизопропилсилильная группа, аллильная группа или т.п.; термин означает гидроксизащитную группу, используемую в общих методах органического синтеза, такую как бензильная группа, метоксиметильная группа, ацетильная группа, пивалоильная группа, бензоильная группа, трет-бутилдиметилсилильная группа, триизопропилсилильная группа, аллильная группа или т.п.; термин  аминозащитная группа аминозащитная группа означает аминозащитную группу, используемую в общих методах органического синтеза, такую как бензилоксикарбонильная группа, трет-бутоксикарбонильная группа, бензильная группа, трифторацетильная группа или т.п.; и термин означает аминозащитную группу, используемую в общих методах органического синтеза, такую как бензилоксикарбонильная группа, трет-бутоксикарбонильная группа, бензильная группа, трифторацетильная группа или т.п.; и термин  карбоксизащитная группа карбоксизащитная группа означает карбоксизащитную группу, используемую в общих методах органического синтеза, такую как бензильная группа, трет-бутилдиметилсилильная группа, аллильная группа или т.п. означает карбоксизащитную группу, используемую в общих методах органического синтеза, такую как бензильная группа, трет-бутилдиметилсилильная группа, аллильная группа или т.п.
В настоящем изобретении, например, R1, предпочтительно, представляет собой атом водорода и гидрокси(С2-6)алкильную группу и, более предпочтительно, атом водорода; Т, предпочтительно, представляет собой группу формулы:
или группу формулы:
где Q, предпочтительно, представляет собой С1-6алкильную группу или галоген(С1-6)алкильную группу и, более предпочтительно, С1-6алкильную группу; С1-6алкильная группа в Q, предпочтительно, представляет собой этильную группу или изопропильную группу и, наиболее предпочтительно, изопропильную группу; Х, предпочтительно, представляет собой простую связь или атом кислорода. Кроме того, если Х представляет собой простую связь, то Y, предпочтительно, представляет собой С1-6алкиленовую группу или С2-6алкиниленовую группу и, более предпочтительно, триметиленовую группу или 1-пропениленовую группу; и если Х представляет собой атом кислорода, то Y, предпочтительно, представляет собой С1-6алкиленовую группу и, более предпочтительно, этиленовую группу или триметиленовую группу. Z, предпочтительно, представляет собой карбонильную группу; R2, предпочтительно, представляет собой атом водорода, атом галогена, С1-6алкильную группу, С1-6алкоксигруппу, С1-6алкокси-замещенную С1-6алкоксигруппу, С3-7циклоалкил-замещенную С2-6алкоксигруппу или группу общей формулы: -А-R8, где А и R8 имеют значения, определенные выше, и, более предпочтительно, они представляют собой атом водорода, атом хлора, атом фтора или метильную группу; один из R4 и R5, предпочтительно, представляет собой С1-6алкильную группу, которая имеет 1-3 гидроксигруппы или группу общей формулы -CON(R9)R10, где R9 и R10 являются одинаковыми или различными, и каждый представляет собой атом водорода или С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранные из группы, состоящей из гидроксигруппы, аминогруппы, моно- или ди(С1-6алкил)аминогруппы, моно- или ди[гидрокси(С1-6алкил)]аминогруппы, уреидогруппы, моно- или ди(С1-6алкил)уреидогруппы, С2-7ациламиногруппы, С1-6алкилсульфониламиногруппы и карбамоильной группы, либо R9 и R10, вместе связаны со смежным атомом азота с образованием циклической С2-6аминогруппы, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы, в то время как другой из R4 и R5, предпочтительно, представляет собой атом водорода; и, более предпочтительно, один из R4 и R5 представляет собой С1-6алкильную группу, которая имеет группу-заместитель общей формулы: -CON(R9А)R10А, где R9А и R10А вместе связаны со смежным атомом азота с образованием циклической С2-6аминогруппы, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы, в то время как другой из R4 и R5, предпочтительно, представляет собой атом водорода; R3, R6 и R7, предпочтительно, представляют собой атом водорода или атом галогена и, более предпочтительно, все они, предпочтительно представляют собой атом водорода.
Конкретными соединениями настоящего изобретения являются соединения, описанные в примерах 1-116. В частности, предпочтительными являются нижеследующие соединения или их фармацевтически приемлемые соли:
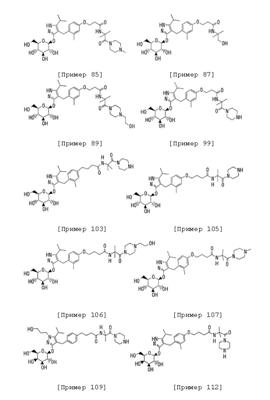
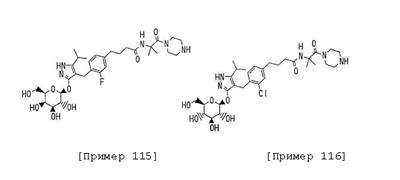 , ,
и более предпочтительными являются
3-( -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол; -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол;
4-{[2-фтор-4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол или их фармацевтически приемлемые соли. -D-галактопиранозилокси)-5-изопропил-1Н-пиразол или их фармацевтически приемлемые соли.
Так, например, соединения настоящего изобретения, представленные вышеуказанной общей формулой (I), могут быть получены в соответствии со следующими способами:
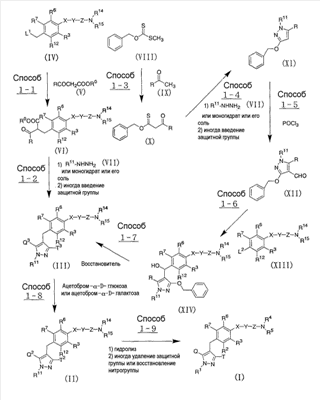
где L1 представляет собой удаляемую группу, такую как атом галогена, мезилоксигруппа, тозилоксигруппа или т.п.; L2 представляет собой MgBr, MgCl, MgI, ZnI, ZnBr, ZnCl или атом лития; R представляет собой С1-6алкильную группу, галоген(С2-6)алкильную группу, С1-6алкокси-замещенную С1-6алкильную группу или С3-7циклоалкильную группу; R0 представляет собой С1-6алкильную группу; один из Q3 и Т3 представляет собой гидроксигруппу, другой представляет собой С1-6алкильную группу, галоген(С2-6)алкильную группу, С1-6алкокси-замещенную С1-6алкильную группу или С3-7циклоалкильную группу; и R1, R2, R3, R4, R5, R6, R7, R11, R12, R14, R15, Q, Q2, Т, Т2, Х, Y и Z имеют значения, определенные выше.
Способ 1-1
Соединение, представленное вышеуказанной общей формулой (VI), может быть получено конденсацией бензильного производного, представленного вышеуказанной общей формулой (IV), с кетоацетатом, представленным вышеуказанной общей формулой (V) в присутствии основания, такого как гидрид натрия или трет-бутоксид калия в инертном растворителе. В качестве инертных растворителей, используемых в данной реакции, могут служить, например, 1,2-диметоксиэтан, тетрагидрофуран, N,N-диметилформамид, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от комнатной температуры до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 1-2
Производное бензилпиразола, представленное вышеуказанной общей формулой (III), может быть получено конденсацией соединения, представленного вышеуказанной общей формулой (VI), с соединением гидразина, представленным вышеуказанной общей формулой (VII), или его моногидратом или солью в присутствии или в отсутствии основания, в инертном растворителе, и введением гидроксизащитной группы стандартным способом, если это необходимо. В качестве инертного растворителя, используемого в данной реакции, могут служить, например, толуол, тетрагидрофуран, хлороформ, метанол, этанол, смесь указанных растворителей и т.п., и в качестве основания могут служить, например, триэтиламин, N,N-диизопропилэтиламин, пиридин, метоксид натрия, этоксид натрия и т.п. Температура реакции обычно составляет интервал от комнатной температуры до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции. Полученное бензилпиразольное производное, представленное вышеуказанной общей формулой (III), может быть также использовано в последующей реакции после его соответствующего превращения в соль стандартным способом.
Способ 1-3
Соединение, представленное вышеуказанной общей формулой (Х), может быть получено конденсацией сложноэфирного соединения дитиокарбоната, представленного вышеуказанной общей формулой (VIII), с кетонным соединением, представленным вышеуказанной общей формулой (IX) в присутствии основания, такого как амид натрия, в инертном растворителе. В качестве инертного растворителя, используемого в данной реакции, могут служить, например, толуол и т.п. Температура реакции обычно составляет интервал от -20°С до комнатной температуры, и время реакции обычно составляет от 30 минут до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 1-4
Производное бензилоксипиразола, представленное вышеуказанной общей формулой (XI), может быть получено конденсацией соединения, представленного вышеуказанной общей формулой (Х), с соединением гидразина, представленным вышеуказанной общей формулой (VII), или его моногидратом или солью в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин, в инертном растворителе, и введением водород-защитной группы обычным способом, если это необходимо. В качестве инертного растворителя, используемого в данной реакции конденсации, могут служить, например, ацетонитрил и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 1-5
Производное альдегида пиразола, представленное вышеуказанной общей формулой (XII), может быть получено взаимодействием соединения, представленного вышеуказанной общей формулой (XI), с реактивом Вильсмайера с использованием оксихлорида фосфора и N,N-диметилформамида в различных растворителях. В качестве растворителя, используемого в данной реакции, могут служить, например, N,N-диметилформамид и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 30 минут до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 1-6
Соединение, представленное вышеуказанной общей формулой (XIV), может быть получено конденсацией соединения, представленного вышеуказанной общей формулой (XII), с реактивом Гриньяра, реактивом Реформатского или литиевым реактивом, представленным вышеуказанной общей формулой (XIII), в инертном растворителе. В качестве растворителя, используемого в данной реакции, могут служить, например, тетрагидрофуран, диэтиловый эфир, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от -78°С до комнатной температуры, и время реакции обычно составляет от 30 минут до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 1-7
Производное бензилпиразола, представленное вышеуказанной общей формулой (III), может быть получено каталитическим гидрированием соединения, представленного вышеуказанной общей формулой (XIV), с использованием палладиевого катализатора, такого как порошкообразный палладий на угле, в отсутствии или в присутствии кислоты, такой как хлористоводородная кислота, в инертном растворителе, и в случае, если соединение, представленное вышеуказанной общей формулой (XIV), имеет любой атом серы, то полученное соединение обрабатывают водным раствором трифторуксусной кислоты и диметилсульфида, обычно при температуре от 0°С до температуры дефлегмации, в течение от 30 минут до 1 дня, если это необходимо. В качестве растворителя, используемого при каталитическом гидрировании, могут служить, например, метанол, этанол, тетрагидрофуран, этилацетат, уксусная кислота, изопропанол, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от комнатной температуры до температуры дефлегмации, и время реакции обычно составляет от 30 минут до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции. Полученное производное бензилпиразола, представленное вышеуказанной общей формулой (III), может быть также использовано в последующей реакции после его соответствующего превращения в соль стандартным способом.
Способ 1-8
[1] В случае, если в производном бензилпиразола, представленном вышеуказанной общей формулой (III), один из Q3 и Т3 представляют собой С1-6алкильную группу, С1-6алкокси-замещенную С1-6алкильную группу или С3-7циклоалкильную группу, то соответствующее соединение настоящего изобретения, представленное вышеуказанной общей формулой (II), может быть получено путем гликозидирования соответствующего производного бензилпиразола, представленного вышеуказанной общей формулой (III), с использованием ацетобром- -D-глюкозы или ацетобром- -D-глюкозы или ацетобром- -D-галактозы в присутствии основания, такого как карбонат серебра, гидрид натрия или т.п., в инертном растворителе. В качестве инертного растворителя, используемого в данной реакции, могут служить, например, тетрагидрофуран, диметоксиэтан, N,N-диметилформамид, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от комнатной температуры до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции. -D-галактозы в присутствии основания, такого как карбонат серебра, гидрид натрия или т.п., в инертном растворителе. В качестве инертного растворителя, используемого в данной реакции, могут служить, например, тетрагидрофуран, диметоксиэтан, N,N-диметилформамид, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от комнатной температуры до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
[2] В случае, если в производном бензилпиразола, представленном вышеуказанной общей формулой (III), один из Q3 и Т3 представляют собой галоген(С1-6)алкильную группу, то соответствующее соединение настоящего изобретения, представленное вышеуказанной общей формулой (II), может быть получено путем гликозидирования соответствующего производного бензилпиразола, представленного вышеуказанной общей формулой (III), с использованием ацетобром- -D-глюкозы или ацетобром- -D-глюкозы или ацетобром- -D-галактозы в присутствии основания, такого как карбонат калия или т.п., в инертном растворителе. В качестве инертного растворителя, используемого в данной реакции, могут служить, например, тетрагидрофуран, ацетонитрил, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от комнатной температуры до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции. -D-галактозы в присутствии основания, такого как карбонат калия или т.п., в инертном растворителе. В качестве инертного растворителя, используемого в данной реакции, могут служить, например, тетрагидрофуран, ацетонитрил, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от комнатной температуры до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
[3] В случае, если в производном бензилпиразола, представленном вышеуказанной общей формулой (III), один из Q3 и Т3 представляют собой С1-6алкильную группу, С1-6алкокси-замещенную С1-6алкильную группу или С3-7циклоалкильную группу, то соответствующее соединение настоящего изобретения, представленное вышеуказанной общей формулой (II), может быть также получено путем гликозидирования соответствующего производного бензилпиразола, представленного вышеуказанной общей формулой (III), с использованием ацетобром- -D-глюкозы или ацетобром- -D-глюкозы или ацетобром- -D-галактозы в присутствии основания, такого как гидроксид натрия, гидроксид калия, карбонат калия или т.п., и катализатора межфазного переноса, такого как бензилтри(н-бутил)аммонийхлорид, бензилтри(н-бутил)аммонийбромид, гидросульфат тетра(н-бутил)аммония или т.п., в инертном растворителе, содержащем воду. В качестве инертного растворителя, используемого в данной реакции, могут служить, например, дихлорметан, толуол, бензотрифторид, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 30 минут до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции. -D-галактозы в присутствии основания, такого как гидроксид натрия, гидроксид калия, карбонат калия или т.п., и катализатора межфазного переноса, такого как бензилтри(н-бутил)аммонийхлорид, бензилтри(н-бутил)аммонийбромид, гидросульфат тетра(н-бутил)аммония или т.п., в инертном растворителе, содержащем воду. В качестве инертного растворителя, используемого в данной реакции, могут служить, например, дихлорметан, толуол, бензотрифторид, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 30 минут до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Полученное гликозидированное производное бензилпиразола, представленное вышеуказанной общей формулой (II), может быть также использовано в последующей реакции после его соответствующего превращения в соль и выделения стандартным способом.
Способ 1-9
Производное пиразола настоящего изобретения, представленное вышеуказанной общей формулой (I), может быть получено щелочным гидролизом соединения, представленного вышеуказанной общей формулой (II), и удалением защитной группы или восстановления нитрогруппы полученного соединения, если это необходимо. В качестве растворителя, используемого в реакции гидролиза, могут служить, например, метанол, этанол, тетрагидрофуран, вода, смесь указанных растворителей и т.п. В качестве основания могут служить, например, гидроксид натрия, метоксид натрия, этоксид натрия и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 30 минут до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции. Как было указано выше, в случае, если после гидролиза, соединения имеют защитные группы в R11, R12, R14 и/или R15, то такая защитная группа может быть удалена стандартным способом. Кроме того, после завершения вышеуказанной реакции, соединения, имеющие нитрогруппу в R2 и представленные вышеуказанной общей формулой (I), могут быть также превращены в соответствующее соединение, имеющее аминогруппу, посредством каталитического восстановления с использованием платинового катализатора, такого как оксид платины, в инертном растворителе, таком как этилацетат, при температуре, обычно составляющей интервал от комнатной температуры до температуры дефлегмации, обычно, в течение от 30 минут до 1 дня стандартным способом.
Соединения, представленные вышеуказанной общей формулой (III) и используемые в качестве исходных веществ, могут быть получены в виде трех следующих таутомеров, где R11 представляет собой атом водорода, образующихся в зависимости от различных реакционных условий, и такими соединениями, представленными вышеуказанной общей формулой (III), являются все соединения:
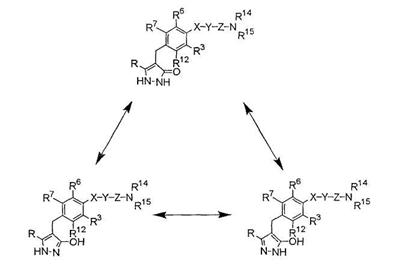
где R, R3, R6, R7, R12, R14, R15, Х, Y и Z имеют значения, определенные выше.
Из соединений настоящего изобретения, представленных вышеуказанной общей формулой (I), соединение, где R1 представляет собой С1-6алкильную группу, С2-6алкенильную группу, гидрокси(С2-6)алкильную группу, С3-7циклоалкильную группу, С3-7циклоалкил-замещенную (С1-6)алкильную группу или арилзамещенную С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из атома галогена, гидроксигруппы, аминогруппы, С1-6алкильной группы и С1-6алкоксигруппы, может быть получено, например, в соответствии со следующей методикой:
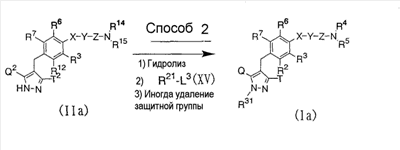
где L3 представляет собой удаляемую группу, такую как атом галогена, мезилоксигруппа, тозилоксигруппа или т.п.; R21 представляет собой С1-6алкильную группу, С2-6алкенильную группу, гидрокси(С2-6)алкильную группу, которая может иметь защитную группу, С3-7циклоалкильную группу, С3-7циклоалкил-замещенную С1-6алкильную группу или арил-замещенную С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из атома галогена, гидроксигруппы, которая может иметь защитную группу, аминогруппы, которая может иметь защитную группу, С1-6алкильной группы и С1-6алкоксигруппы; R31 представляет собой С1-6алкильную группу, С2-6алкенильную группу, гидрокси(С2-6)алкильную группу, С3-7циклоалкильную группу, С3-7циклоалкил-замещенную С1-6алкильную группу или арил-замещенную С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранных из группы, состоящей из атома галогена, гидроксигруппы, аминогруппы, С1-6алкильной группы и С1-6алкоксигруппы, и R2, R3, R4, R5, R6, R7, R12, R14, R15, Q, Q2, Т, Т2, Х, Y и Z имеют значения, определенные выше.
Способ 2
Производное пиразола настоящего изобретения, представленное вышеуказанной общей формулой (Ia), может быть получено гидролизом соединения, представленного вышеуказанной общей формулой (IIa), по методу, аналогично описанному в вышеуказанном способе 1-9, и N-алкилирования с использованием N-алкилирующего агента, представленного вышеуказанной общей формулой (XV), в присутствии основания, такого как карбонат цезия или карбонат калия в инертном растворителе, и в случае, если данные соединения имеют защитную группу, то также удалением защитной группы стандартным способом, если это необходимо. В качестве инертного растворителя, используемого в реакции N-алкилирования, могут служить, например, ацетонитрил, этанол, 1,2-диметоксиэтан, тетрагидрофуран, N,N-диметилформамид, диметилсульфоксид, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от комнатной температуры до температуры дефлегмации, и время реакции обычно составляет от 10 минут до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Из соединений настоящего изобретения, представленных вышеуказанной общей формулой (I), соединение, где R1 представляет собой атом водорода, может быть также получено, например, в соответствии со следующей методикой:
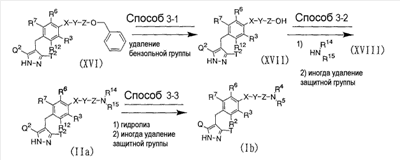
где R2, R3, R4, R5, R6, R7, R12, R14, R15, Q, Q2, Т, Т2, Х, Y и Z имеют значения, определенные выше.
Способ 3-1
Соединение, представленное вышеуказанной общей формулой (XVII), может быть получено каталитическим гидрированием соединения, представленного вышеуказанной общей формулой (XVI), с использованием палладиевого катализатора, такого как порошкообразный палладий на угле, в инертном растворителе, с удалением бензильной группы. В качестве растворителя, используемого при каталитическом гидрировании, могут служить, например, метанол, этанол, тетрагидрофуран, этилацетат, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 2 дней, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 3-2
Соединение настоящего изобретения, представленное вышеуказанной общей формулой (IIa), может быть получено конденсацией соединения, представленного вышеуказанной общей формулой (XVII), с аминным производным, представленным вышеуказанной общей формулой (XVIII), в присутствии конденсирующего агента, такого как гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида или дициклогексилкарбодиимид, в отсутствии или в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин, в инертном растворителе, после соответствующего добавления 1-гидроксибензотриазола, если это необходимо. В качестве растворителя, используемого в реакции конденсации, могут служить, например, N,N-диметилформамид, дихлорметан, тетрагидрофуран, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 2 дней, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 3-3
Производное пиразола настоящего изобретения, представленное вышеуказанной общей формулой (Ib), может быть получено щелочным гидролизом соединения, представленного вышеуказанной общей формулой (IIa), и удалением защитной группы стандартным способом, если это необходимо. В качестве растворителя, используемого в реакции гидролиза, могут служить, например, метанол, этанол, тетрагидрофуран, вода, смесь указанных растворителей и т.п. В качестве основания могут служить, например, гидроксид натрия, метоксид натрия, этоксид натрия и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 30 минут до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции. В случае если после гидролиза, соединения имеют защитные группы в R12, R14 и/или R15, то такая защитная группа может быть удалена стандартным способом, как описано в способе 1-9.
Из соединений настоящего изобретения, представленных вышеуказанной общей формулой (I), соединение, где R1 представляет собой атом водорода, Х представляет собой простую связь, и Y представляет собой С2-6алкиленовую группу или С2-6алкениленовую группу, может быть получено, например, в соответствии со следующей методикой:
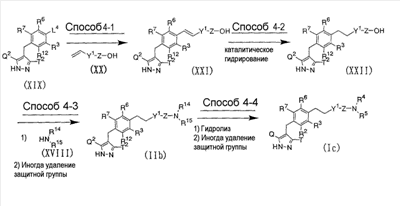
где L4 представляет собой удаляемую группу, такую как атом хлора, атом брома, атом иода, трифторметилсульфонилоксигруппа или т.п.; Y1 представляет собой простую связь или С1-4алкиленовую группу, и R2, R3, R4, R5, R6, R7, R12, R14, R15, Q, Q2, Т, Т2 и Z имеют значения, определенные выше.
Способ 4-1
Производное пиразола настоящего изобретения, представленное вышеуказанной общей формулой (XXI), может быть получено, подвергая производное пиразола, представленного вышеуказанной общей формулой (XIX), реакции Хека с олефиновым производным, представленным вышеуказанной общей формулой (ХХ), с использованием палладиевого катализатора, такого как порошкообразный палладий на угле, ацетат палладия, тетракис(трифенилфосфин)палладий, дибензилиденацетонпалладий или дихлорид бис(трифенилфосфин)палладия, в отсутствии или в присутствии фосфинового лиганда, такого как трис(2-метилфенил)фосфин или трифенилфосфин, и в присутствии основания, такого как триэтиламин, трет-бутоксид натрия, трет-бутоксид калия или фторид цезия, в инертном растворителе. В качестве растворителя, используемого в данной реакции, могут служить, например, ацетонитрил, толуол, тетрагидрофуран, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 4-2
Соединение, представленное вышеуказанной общей формулой (XXII), может быть получено каталитическим гидрированием соединения, представленного вышеуказанной общей формулой (XXI), с использованием палладиевого катализатора, такого как порошкообразный палладий на угле, в инертном растворителе. В качестве растворителя, используемого при каталитическом гидрировании, могут служить, например, метанол, этанол, тетрагидрофуран, этилацетат, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 2 дней, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 4-3
Соединение настоящего изобретения, представленное вышеуказанной общей формулой (IIb), может быть получено конденсацией соединения, представленного вышеуказанной общей формулой (XXII), с аминным производным, представленным вышеуказанной общей формулой (XXIII), в присутствии конденсирующего агента, такого как гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида или дициклогексилкарбодиимид, и основания, такого как триэтиламин или N,N-диизопропилэтиламин, в инертном растворителе после соответствующего добавления 1-гидроксибензотриазола, если это необходимо, и удалением защитной группы стандартным способом, если это необходимо. В качестве растворителя, используемого в реакции конденсации, могут служить, например, N,N-диметилформамид, дихлорметан, тетрагидрофуран, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 2 дней, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 4-4
Производное пиразола настоящего изобретения, представленное вышеуказанной общей формулой (Ic), может быть получено щелочным гидролизом соединения, представленного вышеуказанной общей формулой (IIb), и удалением защитной группы стандартным способом, если это необходимо. В качестве растворителя, используемого в реакции гидролиза, могут служить, например, метанол, этанол, тетрагидрофуран, вода, смесь указанных растворителей и т.п. В качестве основания могут служить, например, гидроксид натрия, метоксид натрия, этоксид натрия и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 30 минут до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции. В случае если соединения после гидролиза, имеют защитные группы в R12, R14 и/или R15, то такая защитная группа может быть удалена стандартным способом, как описано в способе 1-9.
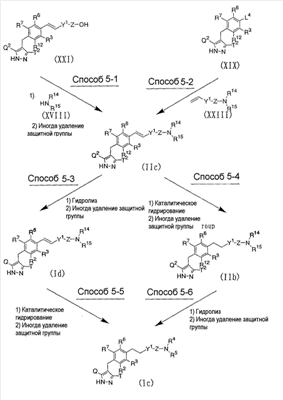
где L4, R2, R3, R4, R5, R6, R7, R12, R14, R15, Q, Q2, Т, Т2, Y1 и Z имеют значения, определенные выше.
Способ 5-1
Соединение настоящего изобретения, представленное вышеуказанной общей формулой (IIc), может быть получено конденсацией соединения, представленного вышеуказанной общей формулой (XXI), с аминным производным, представленным вышеуказанной общей формулой (XVIII), в присутствии конденсирующего агента, такого как гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида или дициклогексилкарбодиимид, и основания, такого как триэтиламин или N,N-диизопропилэтиламин, в инертном растворителе, после соответствующего добавления 1-гидроксибензотриазола, если это необходимо, с последующим удалением защитной группы стандартным способом, если это необходимо. В качестве растворителя, используемого в реакции конденсации, могут служить, например, N,N-диметилформамид, дихлорметан, тетрагидрофуран, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 2 дней, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 5-2
Производное пиразола настоящего изобретения, представленное вышеуказанной общей формулой (IIc), может быть получено, подвергая производное пиразола, представленного вышеуказанной общей формулой (XIX), реакции Хека с олефиновым производным, представленным вышеуказанной общей формулой (ХХШ), с использованием палладиевого катализатора, такого как порошкообразный палладий на угле, ацетат палладия, тетракис(трифенилфосфин)палладий, дибензилиденацетонпалладий или дихлорид бис(трифенилфосфин)палладия, в отсутствии или в присутствии фосфинового лиганда, такого как трис(2-метилфенил)фосфин или трифенилфосфин, в присутствии основания, такого как триэтиламин, трет-бутоксид натрия, трет-бутоксид калия или фторид цезия, в инертном растворителе. В качестве растворителя, используемого в данной реакции, могут служить, например, ацетонитрил, толуол, тетрагидрофуран, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 2 дней, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 5-3
Производное пиразола настоящего изобретения, представленное вышеуказанной общей формулой (Id), может быть получено щелочным гидролизом соединения, представленного вышеуказанной общей формулой (IIc), и удалением защитной группы стандартным способом, если это необходимо. В качестве растворителя, используемого в реакции гидролиза, могут служить, например, метанол, этанол, тетрагидрофуран, вода, смесь указанных растворителей и т.п. В качестве основания могут служить, например, гидроксид натрия, метоксид натрия, этоксид натрия и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 30 минут до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции. В случае если после гидролиза, соединения имеют защитные группы в R12, R14 и/или R15, то такая защитная группа может быть удалена стандартным способом, как описано в способе 1-9.
Способ 5-4
Соединение, представленное вышеуказанной общей формулой (IIb), может быть получено каталитическим гидрированием соединения, представленного вышеуказанной общей формулой (IIc), с использованием палладиевого катализатора, такого как порошкообразный палладий на угле, в инертном растворителе. В качестве растворителя, используемого при каталитическом гидрировании, могут служить, например, метанол, этанол, тетрагидрофуран, этилацетат, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 2 дней, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 5-5
Соединение, представленное вышеуказанной общей формулой (Ic), может быть получено каталитическим гидрированием соединения, представленного вышеуказанной общей формулой (Id), с использованием палладиевого катализатора, такого как порошкообразный палладий на угле, в инертном растворителе. В качестве растворителя, используемого при каталитическом гидрировании, могут служить, например, метанол, этанол, тетрагидрофуран, этилацетат, смесь указанных растворителей и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 1 часа до 2 дней, в зависимости от используемого исходного вещества, растворителя и температуры реакции.
Способ 5-6
Производное пиразола настоящего изобретения, представленное вышеуказанной общей формулой (Ic), может быть получено щелочным гидролизом соединения, представленного вышеуказанной общей формулой (IIb), и удалением защитной группы стандартным способом, если это необходимо. В качестве растворителя, используемого в реакции гидролиза, могут служить, например, метанол, этанол, тетрагидрофуран, вода, смесь указанных растворителей и т.п. В качестве основания могут служить, например, гидроксид натрия, метоксид натрия, этоксид натрия и т.п. Температура реакции обычно составляет интервал от 0°С до температуры дефлегмации, и время реакции обычно составляет от 30 минут до 1 дня, в зависимости от используемого исходного вещества, растворителя и температуры реакции. В случае если после гидролиза, соединения имеют защитные группы в R12, R14 и/или R15, то такая защитная группа может быть удалена стандартным способом, как описано в способе 1-9.
Соединения настоящего изобретения, представленные вышеуказанной общей формулой (I) и полученные вышеописанными способами, могут быть выделены и очищены стандартными методами выделения, такими как фракционированная перекристаллизация, очистка с использованием хроматографии, экстракция растворителем и твердофазная экстракция.
Производные пиразола настоящего изобретения, представленные вышеуказанной общей формулой (I), могут быть превращены в их фармацевтически приемлемые соли стандартным способом. Примерами таких солей являются кислотно-аддитивные соли, образованные минеральными кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; кислотно-аддитивные соли, образованные органическими кислотами, такими как муравьиная кислота, уксусная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, пропионовая кислота, лимонная кислота, янтарная кислота, винная кислота, фумаровая кислота, масляная кислота, щавелевая кислота, малоновая кислота, малеиновая кислота, молочная кислота, яблочная кислота, угольная кислота, глутаминовая кислота, аспарагиновая кислота и т.п., соли, образованные неорганическими основаниями, такие как соль натрия, соль калия и т.п., и соли, образованные органическими основаниями, такими как N-метил-D-глюкамин,
N,N’-дибензилэтилендиамин, 2-аминоэтанол,
трис(гидроксиметил)аминометан, аргинин, лизин и т.п.
Соединения настоящего изобретения, представленные вышеуказанной общей формулой (I), включают их сольваты с фармацевтически приемлемыми растворителями, такими как этанол и вода.
Производные пиразола настоящего изобретения, представленные вышеуказанной общей формулой (I), и их пролекарства, имеющие ненасыщенную связь, существует в виде двух геометрических изомеров. В настоящем изобретении может быть использован либо цис(Z)-изомер, либо транс(Е)-изомер.
Производные пиразола настоящего изобретения, представленные вышеуказанной общей формулой (I), и их пролекарства, имеющие ассиметрический атом углерода, существует в виде двух оптических изомеров, R-изомера и S-изомера, за исключением глюкопиранозилоксигруппы или галактопиранозилоксигруппы. В настоящем изобретении могут быть использованы любые из этих изомеров, а также их смесь.
Пролекарство соединения настоящего изобретения, представленного вышеуказанной общей формулой (I), может быть получено путем введения соответствующей группы, образующей пролекарство, в любую одну или несколько групп, выбранных из гидроксигруппы в глюкопиранозильном фрагменте или в галактопиранозильном фрагменте, или необязательно в R1, R2, R4 или R5, циклической аминогруппы в случае, если R1 представляет собой атом водорода, и аминогруппы в случае, если R1, R2, R4 или R5 представляют собой заместитель, имеющий аминогруппу, соединения, представленного вышеуказанной общей формулой (I), с использованием соответствующего реагента с получением пролекарства, такого как галоидное соединение или т.п. стандартным способом, с последующим выделением и очисткой стандартным способом, если это необходимо. В качестве образующей пролекарство группы, используемой в гидроксигруппе или в аминогруппе, могут служить, например, С2-7ацильная группа, С1-6алкокси-замещенная (С2-7)ацильная группа, С2-7алкоксикарбонил-замещенная (С2-7)ацильная группа, С2-7алкоксикарбонильная группа, арил-замещенная (С2-7)алкоксикарбонильная группа или С1-6алкокси-замещенная (С2-7)алкоксикарбонильная группа или т.п. В качестве образующей пролекарство группы, используемой в циклической аминогруппе, могут служить, например, С2-7ацильная группа, С1-6алкокси-замещенная (С2-7)ацильная группа, С2-7алкоксикарбонил-замещенная (С2-7)ацильная группа, С2-7алкоксикарбонильная группа, С2-7алкокси-замещенная (С2-7)алкоксикарбонильная группа, (С2-7ацилокси)метильная группа, 1-(С2-7ацилокси)этильная группа, (С2-7алкоксикарбонил)оксиметильная группа, 1-[(С2-7алкоксикарбонил)окси]этильная группа, (С3-7циклоалкил)оксикарбонилоксиметильная группа, 1-[(С3-7циклоалкил)оксикарбонилокси]этильная группа или т.п. Термин  С2-7ацильная группа С2-7ацильная группа означает прямую или разветвленную ацильную группу, имеющую 2-7 атомов углерода, такую как ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, валерильная группа, пивалоильная группа, гексаноильная группа или т.п.; термин означает прямую или разветвленную ацильную группу, имеющую 2-7 атомов углерода, такую как ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, валерильная группа, пивалоильная группа, гексаноильная группа или т.п.; термин  С1-6алкокси-замещенная С2-7ацильная группа С1-6алкокси-замещенная С2-7ацильная группа означает вышеуказанную С2-7ацильную группу, замещенную вышеуказанной С1-6алкоксигруппой; термин означает вышеуказанную С2-7ацильную группу, замещенную вышеуказанной С1-6алкоксигруппой; термин  С2-7алкоксикарбонил-замещенная С2-7ацильная группа С2-7алкоксикарбонил-замещенная С2-7ацильная группа означает вышеуказанную С2-7ацильную группу, замещенную вышеуказанной С2-7алкоксикарбонильной группой; термин означает вышеуказанную С2-7ацильную группу, замещенную вышеуказанной С2-7алкоксикарбонильной группой; термин  арил-замещенная С2-7алкоксикарбонильная группа арил-замещенная С2-7алкоксикарбонильная группа означает вышеуказанную С2-7алкоксикарбонильную группу, замещенную вышеуказанной арильной группой, такую как бензилоксикарбонильная группа; термин означает вышеуказанную С2-7алкоксикарбонильную группу, замещенную вышеуказанной арильной группой, такую как бензилоксикарбонильная группа; термин  С1-6алкокси-замещенная С2-7алкоксикарбонильная группа С1-6алкокси-замещенная С2-7алкоксикарбонильная группа означает вышеуказанную С2-7алкоксикарбонильную группу, замещенную вышеуказанной С1-6алкоксигруппой; термин означает вышеуказанную С2-7алкоксикарбонильную группу, замещенную вышеуказанной С1-6алкоксигруппой; термин  (С2-7ацилокси)метильная группа (С2-7ацилокси)метильная группа означает гидроксиметильную группу, О-замещенную вышеуказанной С2-7ацильной группой; термин означает гидроксиметильную группу, О-замещенную вышеуказанной С2-7ацильной группой; термин  1-(С2-7ацилокси)этильная группа 1-(С2-7ацилокси)этильная группа означает 1-гидроксиэтильную группу, О-замещенную вышеуказанной С2-7ацильной группой; термин означает 1-гидроксиэтильную группу, О-замещенную вышеуказанной С2-7ацильной группой; термин  (С2-7алкоксикарбонил)оксиметильная группа (С2-7алкоксикарбонил)оксиметильная группа означает гидроксиметильную группу, замещенную вышеуказанной С2-7алкоксикарбонильной группой; и термин означает гидроксиметильную группу, замещенную вышеуказанной С2-7алкоксикарбонильной группой; и термин  1-[(С2-7алкоксикарбонил)окси]этильная группа 1-[(С2-7алкоксикарбонил)окси]этильная группа означает 1-гидроксиэтильную группу, О-замещенную вышеуказанной С2-7алкоксикарбонильной группой. Кроме того, термин означает 1-гидроксиэтильную группу, О-замещенную вышеуказанной С2-7алкоксикарбонильной группой. Кроме того, термин  (С3-7циклоалкил)оксикарбонильная группа (С3-7циклоалкил)оксикарбонильная группа означает циклическую алкоксикарбонильную группу, имеющую вышеуказанную С3-7циклоалкильную группу; термин означает циклическую алкоксикарбонильную группу, имеющую вышеуказанную С3-7циклоалкильную группу; термин  (С3-7циклоалкил)оксикарбонилоксиметильная группа (С3-7циклоалкил)оксикарбонилоксиметильная группа означает гидроксиметильную группу, О-замещенную вышеуказанной (С3-7циклоалкил)оксикарбонильной группой; и термин означает гидроксиметильную группу, О-замещенную вышеуказанной (С3-7циклоалкил)оксикарбонильной группой; и термин  1-[(С3-7циклоалкил)оксикарбонилокси]этильная группа 1-[(С3-7циклоалкил)оксикарбонилокси]этильная группа означает 1-гидроксиэтильную группу, О-замещенную вышеуказанной (С3-7циклоалкил)оксикарбонильной группой. Кроме того, примерами группы, образующей пролекарство, могут служить глюкопиранозильная группа или галактопиранозильная группа. Так, например, эти группы, предпочтительно, вводят в гидроксигруппу в положении 4 или 6 глюкопиранозильной группы или галактопиранозильной группы, и, более предпочтительно, указанные группы вводят в гидроксигруппу в положении 4 или 6 глюкопиранозильной группы. означает 1-гидроксиэтильную группу, О-замещенную вышеуказанной (С3-7циклоалкил)оксикарбонильной группой. Кроме того, примерами группы, образующей пролекарство, могут служить глюкопиранозильная группа или галактопиранозильная группа. Так, например, эти группы, предпочтительно, вводят в гидроксигруппу в положении 4 или 6 глюкопиранозильной группы или галактопиранозильной группы, и, более предпочтительно, указанные группы вводят в гидроксигруппу в положении 4 или 6 глюкопиранозильной группы.
Производные пиразола настоящего изобретения, представленные вышеуказанной общей формулой (I), обладают, например, сильной ингибирующей активностью по отношению к SGLT1 человека в тесте, подтверждающем их ингибирующую активность по отношению к SGLT1 человека, как описано ниже, и превосходной ингибирующей активностью, направленной на подавление увеличения уровня глюкозы в крови, в тесте, подтверждающем указанную ингибирующую активность на крысах. Таким образом, производные пиразола настоящего изобретения, представленные вышеуказанной общей формулой (I), обладают превосходной SGLT1-ингибирующей активностью в тонком кишечнике и могут в значительной степени ингибировать увеличение уровня глюкозы в крови и/или снижать уровень галактозы в крови путем ингибирования или замедления абсорбции глюкозы и галактозы. Поэтому фармацевтическая композиция, содержащая в качестве активного ингредиента производное пиразола настоящего изобретения, представленное вышеуказанной общей формулой (I), его фармацевтически приемлемую соль и пролекарство, является в высокой степени полезной в качестве средства для ингибирования гипергликемии после приема пищи, для ингибирования прогрессирования нарушенной толерантности к глюкозе (IGT) или для нормализации аномального содержания глюкозы в крови натощак (IFG), приводящего к диабету у индивидуума, и средства для предупреждения или лечения заболевания, ассоциированного с гипергликемией, такого как диабет, нарушенная толерантность к глюкозе, аномальное содержание уровня глюкозы в крови натощак, осложнений диабета (например, ретинопатии, невропатии, нефропатии, язвы, макроангиопатии), ожирения, гиперинсулинемии, гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии, нарушения липидного метаболизма, атеросклероза, гипертензии, застойной сердечной недостаточности, отеков, гиперурицемии, подагры или т.п., которые ассоциируются с SGLT1-активностью в тонком кишечнике, и средства для предупреждения или лечения заболевания, ассоциированного с увеличением уровня галактозы в крови, такого как галактоземия.
Кроме того, соединения настоящего изобретения могут быть соответствующим образом использованы в комбинации, по крайней мере, с одним компонентом, выбранным из лекарственных средств, не являющихся ингибиторами SGLT2. Примерами лекарственных средств, которые могут быть использованы в комбинации с соединениями настоящего изобретения, являются усилитель чувствительности к инсулину, ингибитор абсорбции глюкозы, бигуанид, стимулятор секреции инсулина, ингибитор SGLT2, инсулин или его аналог, антагонист рецептора глюкагона, стимулятор киназы инсулинового рецептора, ингибитор трипептидилпептидазы II, ингибитор дипептидилпептидазы IV, ингибитор протеин-тирозин-фосфатазы 1В, ингибитор гликоген-фосфорилазы, ингибитор глюкозо-6-фосфатазы, ингибитор фруктозо-бифосфатазы, ингибитор пируват-дегидрогеназы, ингибитор глюконеогенеза в печени, D-хироинозит, ингибитор киназы-3 гликоген-синтазы, глюкагон-подобный пептид-1, аналог глюкагон-подобного пептида-1, агонист глюкагон-подобного пептида-1, амилин, аналог амилина, агонист амилина, ингибитор альдозоредуктазы, ингибитор образования конечных продуктов при значительной гипергликемии, ингибитор протеинкиназы С, антагонист рецептора  -аминомасляной кислоты, антагонист натриевых каналов, ингибитор фактора транскрипции NF-kB, ингибитор липид-пероксидазы, ингибитор дипептидазы N-ацетилированной- -аминомасляной кислоты, антагонист натриевых каналов, ингибитор фактора транскрипции NF-kB, ингибитор липид-пероксидазы, ингибитор дипептидазы N-ацетилированной- -связанной кислоты, инсулиноподобный фактор роста-I, тромбоцитарный фактор роста (PDGF), аналог тромбоцитарного фактора роста (PDGF) (например, PDGF-АА, PDGF-ВВ, PDGF-АВ), эпидермальный фактор роста (EGF), фактор роста нервной ткани, производное карнитина, уридин, 5-гидрокси-1-метилгидантоин, EGB-761, бимокломол, сулодексид, Y-128, антидиарейное средство, катартическое средство, ингибитор гидроксиметилглутарил-кофермент-А-редуктазы, производное фибриновой кислоты, агонист -связанной кислоты, инсулиноподобный фактор роста-I, тромбоцитарный фактор роста (PDGF), аналог тромбоцитарного фактора роста (PDGF) (например, PDGF-АА, PDGF-ВВ, PDGF-АВ), эпидермальный фактор роста (EGF), фактор роста нервной ткани, производное карнитина, уридин, 5-гидрокси-1-метилгидантоин, EGB-761, бимокломол, сулодексид, Y-128, антидиарейное средство, катартическое средство, ингибитор гидроксиметилглутарил-кофермент-А-редуктазы, производное фибриновой кислоты, агонист  3-адренорецептора, ингибитор ацил-кофермент-А-холестеролацилтрансферазы, пробкол, агонист рецептора тиреоидного гормона, ингибитор абсорбции холестерина, ингибитор липазы, ингибитор микросомального переноса белка триглицеридов, ингибитор липоскигеназы, ингибитор карнитин-пальмитоил-трансферазы, ингибитор сквален-синтазы, стимулятор рецептора липопротеина низкой плотности, производное никотиновой кислоты, секвестрант желчной кислоты, ингибитор ко-транспортера натрия/желчной кислоты, ингибитор переноса белка сложного эфира холестерина, средство для подавления аппетита, ингибитор ангиотензин-конвертирующего фермента, ингибитор нейтральной эндопептидазы, антагонист рецептора ангиотензина II, ингибитор эндотелин-конвертирующего фермента, антагонист рецептора эндотелина, диуретик, антагонист кальция, антигипертензивного сосудорасширяющее средство, блокатор симпатического ствола, гипотензивное средство центрального действия, агонист 3-адренорецептора, ингибитор ацил-кофермент-А-холестеролацилтрансферазы, пробкол, агонист рецептора тиреоидного гормона, ингибитор абсорбции холестерина, ингибитор липазы, ингибитор микросомального переноса белка триглицеридов, ингибитор липоскигеназы, ингибитор карнитин-пальмитоил-трансферазы, ингибитор сквален-синтазы, стимулятор рецептора липопротеина низкой плотности, производное никотиновой кислоты, секвестрант желчной кислоты, ингибитор ко-транспортера натрия/желчной кислоты, ингибитор переноса белка сложного эфира холестерина, средство для подавления аппетита, ингибитор ангиотензин-конвертирующего фермента, ингибитор нейтральной эндопептидазы, антагонист рецептора ангиотензина II, ингибитор эндотелин-конвертирующего фермента, антагонист рецептора эндотелина, диуретик, антагонист кальция, антигипертензивного сосудорасширяющее средство, блокатор симпатического ствола, гипотензивное средство центрального действия, агонист  2-адренорецептора, антитромбоцитарное средство, ингибитор синтеза мочевой кислоты, средство, способствующее выведению мочевой кислоты, и средство для защелачивания мочи. 2-адренорецептора, антитромбоцитарное средство, ингибитор синтеза мочевой кислоты, средство, способствующее выведению мочевой кислоты, и средство для защелачивания мочи.
В случае использования соединения настоящего изобретения в комбинации с одним или несколькими из вышеуказанных лекарственных средств настоящее изобретение включает одновременное введение дозированных форм в виде одного препарата или в виде отдельных препаратов одним и тем же способом или различными способами и введение в различных дозированных форм в интервалы времени в виде отдельных препаратов одним и тем же способом или различными способами. Фармацевтическая комбинация, содержащая соединения настоящего изобретения и вышеуказанные лекарственное(ые) средство(а), включает как дозированные формы, используемые в виде одного препарата, так и отдельных препаратов, вводимых в комбинации, как указано выше.
Соединения настоящего изобретения могут давать еще более благоприятный эффект, превышающий аддитивное действие, направленное на предупреждение или лечение вышеуказанных заболеваний, если они используются в соответствующей комбинации с одним или несколькими указанными выше лекарственными средствами. При этом вводимая доза может быть снижена по сравнению с дозой любого лекарственного средства, вводимого отдельно, либо побочные эффекты совместно вводимых лекарственных средств, не являющихся ингибиторами SGLT1, могут быть устранены или ослаблены.
Ниже представлены примеры конкретных соединений, используемых в качестве лекарственных средств для получения вышеуказанной комбинации, а также предпочтительные заболевания, которые могут быть подвергнуты лечению с использованием этих комбинаций. Однако настоящее изобретение не ограничивается этими соединениями, и указанные конкретные соединения включают свободные соединения, а также фармацевтически приемлемые соли этих или других соединений.
Примерами усилителей чувствительности к инсулину являются агонисты рецептора- , активированного стимулятором пролиферации пероксисомы, такие как троглитазон, гидрохлорид пиоглитазона, малеат розиглитазона, натрий-дарглитазон, GI-262570, изаглитазон, LG-100641, NC-2100, T-174, DRF-2189, CLX-0921, CS-011, GW-1929, циглитазон, натрий-энглитазон и NIP-221; агонисты рецептора- , активированного стимулятором пролиферации пероксисомы, такие как троглитазон, гидрохлорид пиоглитазона, малеат розиглитазона, натрий-дарглитазон, GI-262570, изаглитазон, LG-100641, NC-2100, T-174, DRF-2189, CLX-0921, CS-011, GW-1929, циглитазон, натрий-энглитазон и NIP-221; агонисты рецептора- , активированного стимулятором пролиферации пероксисомы, такие как GW-9578 и BM-170744; агонисты рецептора- , активированного стимулятором пролиферации пероксисомы, такие как GW-9578 и BM-170744; агонисты рецептора- / / , активированного стимулятором пролиферации пероксисомы, такие как GW-409544, KRP-297, NN-622, CLX-0940, LR-90, SB-219994, DRF-4158 и DRF-MDX8, агонисты рецептора ретиноида Х, такие как ALRT-268, AGN-4204, MX-6054, AGN-194204, LG-100754 и бексаротен, и другие усилители чувствительности к инсулину, такие как регликсан, ONO-5816, MBX-102, CRE-1625, FK-614, CLX-0901, CRE-1633, NN-2344, BM-13125, BM-501050, HQL-975, CLX-0900, MBX-668, MBX-675, S-152261, GW-544, AZ-242, LY-510929, AR-HO49020 и GW-501516. Усилители чувствительности к инсулину используются, предпочтительно, для лечения диабета, нарушенной толерантности к глюкозе, осложнений диабета, ожирения, гиперинсулинемии, гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии, нарушения липидного метаболизма или атеросклероза, и, более предпочтительно, диабета, нарушенной толерантности к глюкозе или гиперинсулинемии, поскольку устранение нарушения передачи инсулинового сигнала в периферических тканях и усиление поглощения глюкозы тканями из крови приводит к снижению уровня глюкозы в крови. , активированного стимулятором пролиферации пероксисомы, такие как GW-409544, KRP-297, NN-622, CLX-0940, LR-90, SB-219994, DRF-4158 и DRF-MDX8, агонисты рецептора ретиноида Х, такие как ALRT-268, AGN-4204, MX-6054, AGN-194204, LG-100754 и бексаротен, и другие усилители чувствительности к инсулину, такие как регликсан, ONO-5816, MBX-102, CRE-1625, FK-614, CLX-0901, CRE-1633, NN-2344, BM-13125, BM-501050, HQL-975, CLX-0900, MBX-668, MBX-675, S-152261, GW-544, AZ-242, LY-510929, AR-HO49020 и GW-501516. Усилители чувствительности к инсулину используются, предпочтительно, для лечения диабета, нарушенной толерантности к глюкозе, осложнений диабета, ожирения, гиперинсулинемии, гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии, нарушения липидного метаболизма или атеросклероза, и, более предпочтительно, диабета, нарушенной толерантности к глюкозе или гиперинсулинемии, поскольку устранение нарушения передачи инсулинового сигнала в периферических тканях и усиление поглощения глюкозы тканями из крови приводит к снижению уровня глюкозы в крови.
Примерами ингибиторов абсорбции глюкозы являются соединения, не являющиеся ингибиторами SGLT1, например, ингибиторы  -глюкозидазы, такие как акарбоза, воглибоза, миглитол, CKD-711, эмиглитат, MDL-25637, камиглибоза и MDL-73945, и ингибиторы -глюкозидазы, такие как акарбоза, воглибоза, миглитол, CKD-711, эмиглитат, MDL-25637, камиглибоза и MDL-73945, и ингибиторы  -амилазы, такие как AZM-127. Ингибиторы абсорбции глюкозы используются, предпочтительно, для лечения диабета, нарушенной толерантности к глюкозе, осложнений диабета, ожирения или гиперинсулинемии, и, более предпочтительно, для лечения нарушенной толерантности к глюкозе, поскольку эти соединения ингибируют ферментативный гидролиз углеводов, содержащихся в пище, и подавляют или замедляют абсорбцию глюкозы в организме. -амилазы, такие как AZM-127. Ингибиторы абсорбции глюкозы используются, предпочтительно, для лечения диабета, нарушенной толерантности к глюкозе, осложнений диабета, ожирения или гиперинсулинемии, и, более предпочтительно, для лечения нарушенной толерантности к глюкозе, поскольку эти соединения ингибируют ферментативный гидролиз углеводов, содержащихся в пище, и подавляют или замедляют абсорбцию глюкозы в организме.
Примерами бигуанидов являются фенформин, гидрохлорид буформина, гидрохлорид метформина или т.п. Бигуандиды, предпочтительно, используются для лечения диабета, нарушенной толерантности к глюкозе, осложнений диабета или гиперинсулинемии, и, более предпочтительно, для лечения диабета, нарушенной толерантности к глюкозе или гиперинсулинемии, поскольку их действие, направленное на ингибирование глюконеогенеза в печени, ускорение анаэробного гликолиза в тканях или снижение инсулинорезистентности в периферической ткани приводит к снижению уровня глюкозы в крови.
Примерами стимуляторов секреции инсулина являются толбутамид, хлорпропамид, толазамид, ацетоксамид, гликлопирамид, глибурид (глибенкламид), гликлазид, 1-бутил-3-метанилил-мочевина, карбутамид, глиборнурид, глипизид, глихидон, глизоксапид, глибутиазол, глибузол, гликексамид, натрий-глимидин, глипинамид, фенбутамид, толцикламид, глимепирид, натеглинид, гидрат митиглинид-кальция, репаглинид или т.п. Кроме того, стимуляторами секреции инсулина являются активаторы глюкокиназы, такие как RO-28-1675. Стимуляторы секреции инсулина предпочтительно, используются для лечения диабета, нарушенной толерантности к глюкозе или осложнений диабета, и, более предпочтительно, для лечения диабета или нарушенной толерантности к глюкозе, поскольку их действие на панкреатические  -клетки и стимуляция серкеции инсулина приводит к снижению уровня глюкозы в крови. -клетки и стимуляция серкеции инсулина приводит к снижению уровня глюкозы в крови.
Примерами ингибиторов SGLT2 являются Т-1095 и соединения, описанные в публикациях заявок на патент Японии  Hei10-237089 и 2001-288178 и в публикациях Международных заявок Hei10-237089 и 2001-288178 и в публикациях Международных заявок  WO01/16147, WO01/27128, WO01/68660, WO01/74834, WO01/74835, WO02/28872, WO02/36602, WO02/44192, WO02/53573. Ингибиторы SGLT2 предпочтительно, используются для лечения диабета, нарушенной толерантности к глюкозе, осложнений диабета, ожирения или гиперинсулинемии, и, более предпочтительно, для лечения диабета, нарушенной толерантности к глюкозе, ожирения или гиперинсулинемии, поскольку их ингибирование реабсорбции глюкозы в проксимальных почечных канальцах приводит к снижению уровня глюкозы в крови. WO01/16147, WO01/27128, WO01/68660, WO01/74834, WO01/74835, WO02/28872, WO02/36602, WO02/44192, WO02/53573. Ингибиторы SGLT2 предпочтительно, используются для лечения диабета, нарушенной толерантности к глюкозе, осложнений диабета, ожирения или гиперинсулинемии, и, более предпочтительно, для лечения диабета, нарушенной толерантности к глюкозе, ожирения или гиперинсулинемии, поскольку их ингибирование реабсорбции глюкозы в проксимальных почечных канальцах приводит к снижению уровня глюкозы в крови.
Примерами инсулина или аналогов инсулина являются человеческий инсулин, инсулин животных, аналоги человеческого или животного инсулина или т.п. Эти препараты предпочтительно, используются для лечения диабета, нарушенной толерантности к глюкозе или осложнений диабета, и, более предпочтительно, для лечения диабета или нарушенной толерантности к глюкозе.
Примерами антагонистов рецептора глюкагона являются BAY-27-9955, NNC-92-1687 или т.п.; примерами стимуляторов киназы рецептора инсулина являются TER-17411, L-783281, KRX-613 или т.п.; примерами ингибиторов трипептидил-пептидазы II являются UCL-1397 или т.п.; примерами ингибиторов дипептидилпептидазы IV являются NVP-DPP728A, TSL-225, P-32/98 или т.п.; примерами ингибиторов протеинтирозинфосфатазы 1В являются РТР-112, OC-86839, PNU-177496 или т.п.; примерами ингибиторов гликогенфосфатазы являются NN-4201, CP-368296 или т.п.; примерами ингибиторов фруктозобифосфатазы являются R-132917 или т.п.; примерами ингибиторов пируватдегидрогеназы являются AZD-7545 или т.п.; примерами ингибиторов глюконеогенеза в печени являются FR-225659 или т.п.; примерами аналогов глюкагон-подобного пептида-1 являются эксендин-4, CJC-1131 или т.п; примерами агонистов глюкагон-подобного пептида 1 являются AZM-134, LY-315902 или т.п., и примерами амилина, аналогов амилина или агонистов амилина являются ацетат прамлинтида или т.п. Эти лекарственные средства, ингибиторы глюкозо-6-фосфатазы, D-хироинозит, ингибиторы киназы-3 гликоген-синтазы и глюкагон-подобный пептид 1, предпочтительно, используются для лечения диабета, нарушенной толерантности к глюкозе, осложнений диабета или гиперинсулинемии, и, более предпочтительно, для лечения диабета или нарушенной толерантности к глюкозе.
Примерами ингибиторов альдозо-редуктазы являются аскорбилгамоленат, толрестат, эпалрестат, ADN-138, BAL-ARI8, ZD-5522, ADN-311, GP-1447, IDD-598, фидарестат, сорбинил, поналрестат, ризарестат, зенарестат, миналрестат, метосорбинил, AL-1567, имирестат, М-16209, ТАТ, AD-5467, зополрестат, AS-3201, NZ-314, SG-210, JTT-811, линдолрестат или т.п. Ингибиторы альдозо-редуктазы предпочтительно используются для лечения осложнений диабета, поскольку они ингибируют альдозо-редуктазную активность и снижают избыточное накопление внутриклеточного сорбита в ускоренном полиоловом пути, которые ответственны за устойчивую гипергликемию в тканях при осложнении диабета.
Примерами ингибиторов образования конечных продуктов при гипергликемии являются пиридоксамин, ОРВ-9195, ALT-946, ALT-711, гидрохлорид пимагедина или т.п. Ингибиторы образования конечных продуктов при гипергликемии, предпочтительно, используются для лечения осложнений диабета, поскольку они ингибируют образование конечных продуктов при гипергликемии, которое ускоряется при устойчивой гипергликемии в тканях, и, тем самым, способствуют снижению степени повреждения клеток.
Примерами ингибиторов протеинкиназы С являются LY-333531, мидостаурин или т.п. Ингибиторы протеинкиназы С предпочтительно используются для лечения осложнений диабета, поскольку они ингибируют активность протеинкиназы С, которая ускоряет развитие устойчивой гипергликемии при диабете.
Примерами антагонистов рецептора  -аминомасляной кислоты являются топирамат или т.п.; примерами антагонистов натриевых каналов являются гидрохлорид мексилетина, окскарбазепин или т.п.; примерами ингибиторов фактора транскрипции NF-kB являются декслипотам или т.п.; примерами ингибиторов липид-пероксидазы являются мезилат тирилазада или т.п.; примерами ингибиторов дипептидазы N-ацетилированной- -аминомасляной кислоты являются топирамат или т.п.; примерами антагонистов натриевых каналов являются гидрохлорид мексилетина, окскарбазепин или т.п.; примерами ингибиторов фактора транскрипции NF-kB являются декслипотам или т.п.; примерами ингибиторов липид-пероксидазы являются мезилат тирилазада или т.п.; примерами ингибиторов дипептидазы N-ацетилированной- -кислоты являются GPI-5693 или т.п.; и примерами производных карнитина являются карнитин, гидрохлорид левацекарнина, хлорид левокарнитина, левокарнитин, ST-261 или т.п. Эти лекарственные средства, инсулиноподобный фактор роста-I, тромбоцитарный фактор роста, аналоги тромбоцитарного фактора роста, эпидермальный фактор роста, фактор роста нервной ткани, уридин, 5-гидрокси-1-метилгидантоин, EGB-761, бимокломол, сулодексид и Y-128, предпочтительно, используются для лечения осложнений диабета. -кислоты являются GPI-5693 или т.п.; и примерами производных карнитина являются карнитин, гидрохлорид левацекарнина, хлорид левокарнитина, левокарнитин, ST-261 или т.п. Эти лекарственные средства, инсулиноподобный фактор роста-I, тромбоцитарный фактор роста, аналоги тромбоцитарного фактора роста, эпидермальный фактор роста, фактор роста нервной ткани, уридин, 5-гидрокси-1-метилгидантоин, EGB-761, бимокломол, сулодексид и Y-128, предпочтительно, используются для лечения осложнений диабета.
Примерами антидиарейных средств или катартических средств являются поликарбофил-кальций, таннат альбумина, субнитрат висмута или т.п. Эти лекарственные средства, предпочтительно, используются для лечения диареи, запоров или других заболевания, сопровождающих диабет или т.п.
Примерами ингибиторов гидроксиметилглутарил-кофермент-А-редуктазы являются натрий-церивастатин, натрий-правастатин, ловастатин, симвастатин, натрий-флувастатин, гидрат аторвастатин-кальция, SC-45355, SQ-33600, CP-83101, BB-476, L-669262, S-2468, DMP-565, U-20685, BAY-x-2678, BAY-10-2987, кальций-питавастатин, кальций-розувастатин, колестолон, далвастатин, ацитемат, мевастатин, крилвастатин, BMS-180431, BMY-21950, гленвастатин, карвастатин, BMY-22089, бервастатин или т.п. Ингибиторы гидроксиметилглутарил-кофермент-А-редуктазы, предпочтительно, используются для лечения гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии, нарушения липидного метаболизма или атеросклероза, и, более предпочтительно, для лечения гиперлипидемии, гиперхолестеринемии или атеросклероза, поскольку ингибирование гидроксиметилглутарил-кофермент-А-редуктазы приводит к снижению уровня холестерина в крови.
Примерами производных фибриновой кислоты являются безафибрат, беклобрат, бинифибрат, ципрофибрат, клинофибрат, клофибрат, клофибрат алюминия, клофибриновая кислота, этофибрат, фенофибрат, гемфиброзил, никофибрат, пирифибрат, ронифибрат, симфибрат, теофибрат, AHL-157 или т.п. Производные фибриновой кислоты предпочтительно, используются для лечения гиперинсулинемии, гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии, нарушения липидного метаболизма или атеросклероза, и, более предпочтительно, для лечения гиперлипидемии, гиперхолестеринемии или атеросклероза, поскольку активация липопротеин-липазы в печени и усиление окисления жирных кислот приводит к снижению уровня триглицеридов в крови.
Примерами агонистов  3-адренорецептора являются BRL-28410, SR-58611A, ICI-198157, ZD-2079, BMS-194449, BRL-37344, CP-331679, CP-114271, L-750355, BMS-187413, SR-59062A, BMS-210285, LY-377604, SWR-0342SA, AZ-40140, SB-226552, D-7114, BRL-35135, FR-149175, BRL-26830A, CL-316243, AJ-9677, GW-427353, N-5984, GW-2696, YM178 или т.п. Агонисты 3-адренорецептора являются BRL-28410, SR-58611A, ICI-198157, ZD-2079, BMS-194449, BRL-37344, CP-331679, CP-114271, L-750355, BMS-187413, SR-59062A, BMS-210285, LY-377604, SWR-0342SA, AZ-40140, SB-226552, D-7114, BRL-35135, FR-149175, BRL-26830A, CL-316243, AJ-9677, GW-427353, N-5984, GW-2696, YM178 или т.п. Агонисты  3-адренорецептора предпочтительно, используются для лечения ожирения, гиперинсулинемии, гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии или нарушения липидного метаболизма, и, более предпочтительно, для лечения ожирения или гиперинсулинемии, поскольку стимуляция 3-адренорецептора предпочтительно, используются для лечения ожирения, гиперинсулинемии, гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии или нарушения липидного метаболизма, и, более предпочтительно, для лечения ожирения или гиперинсулинемии, поскольку стимуляция  3-адренорецептора в жировой ткани и усиление окисления жирных кислот приводит к индуцированию потребления энергии. 3-адренорецептора в жировой ткани и усиление окисления жирных кислот приводит к индуцированию потребления энергии.
Примерами ингибиторов ацил-кофермент-А-холестеролацилтрансферазы являются NTE-122, MCC-147, PD-132301-2, DUP-129, U-73482, U-76807, RP-70676, P-06139, CP-113818, RP-73163, FR-129169, FY-038, EAB-309, KY-455, LS-3115, FR-145237, T-2591, J-104127, R-755, FCE-28654, YIC-C8-434, авазимиб, CI-976, RP-64477, F-1394, элдацимиб, CS-505, CL-283546, YM-17E, лецимибид, 447С88, YM-750, E-5324, KW-3033, HL-004, эфлуцимиб или т.п. Ингибиторы ацил-кофермент-А-холестеролацилтрансферазы предпочтительно, используются для лечения гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии или нарушения липидного метаболизма, и, более предпочтительно, для лечения гиперлипидемии или гиперхолестеринемии, поскольку ингибирование ацил-кофермент-А-холестеролацилтрансферазы приводит к снижению уровня холестерина в крови.
Примерами агонистов рецептора тиреоидного гормона являются натрий-лиотиронин, натрий-левотироксин, КВ-2611 или т.п.; примерами ингибиторов абсорбции холестерина являются эзетимиб, SCH-48461 или т.п.; примерами ингибиторов липазы являются орлистат, ALT-962, AZM-131, RED-103004 или т.п.; примерами ингибиторов карнитинпальмитоил-трансферазы являются этомоксир или т.п.; примерами ингибиторов сквален-синтазы являются SDZ-268-198, BMS-188494, А-87049, RPR-101821, ZD-9720, RPR-107393, ER-27856 или т.п.; примерами производных никотиновой кислоты являются никотиновая кислота, никотинамид, никомол, ницеритрол, аципимокс, никорандил или т.п.; примерами секвестрантов желчной кислоты являются колестирамин, колестилан, гидрохлорид колесевелама, GT-102-279 или т.п.; примерами ингибиторов ко-транспортера натрия/желчной кислоты являются 264W94, S-8921, SD-5613 или т.п.; и примерами ингибиторов переноса белка сложного эфира холестерина являются PNU-107368Е, SC-795, JTT-705, СР-529414 или т.п. Эти лекарственные средства, пробкол, ингибиторы микросомального переноса белка триглицеридов, ингибиторы липоскигеназы и стимуляторы рецептора липопротеина низкой плотности, предпочтительно, используются для лечения гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии или нарушения липидного метаболизма.
Примерами средств для подавления аппетита являются ингибиторы поглощения моноамина, ингибиторы поглощения серотонина, стимуляторы высвобождения серотонина, агонисты серотонина (в частности, 5НТ2С-агонисты), ингибиторы поглощения норадреналина, стимуляторы высвобождения норадреналина, агонисты  1-адренорецептора, агонисты 1-адренорецептора, агонисты  2-адренорецептора, агонисты допамина, антагонисты рецептора каннабиноида, антагонисты рецептора 2-адренорецептора, агонисты допамина, антагонисты рецептора каннабиноида, антагонисты рецептора  -аминомасляной кислоты, антагонисты Н3-гистамина, L-гистидин, лептин, аналоги лептина, агонисты рецептора лептина, агонисты рецептора меланокортина (в частности, агонисты МС3-R, агонисты МС4-R), -аминомасляной кислоты, антагонисты Н3-гистамина, L-гистидин, лептин, аналоги лептина, агонисты рецептора лептина, агонисты рецептора меланокортина (в частности, агонисты МС3-R, агонисты МС4-R),  -меланоцит-стимулирующий гормон, транскрипт, регулируемый кокаином и амфетамином, белок акажу (махагонии), агонисты энтеростатина, кальцитонин, пептид, связанный с геном кальцитонина, бомбезин, агонисты холецистокинина (в частности, агонисты ССК-А), кортикотропин-высвобождающий гормон, аналог кортикотропин-высвобождающего гормона, урокортин, соматотропин, аналоги соматостатина, агонисты рецептора соматостатина, пептид, активирующий аденилат-циклазу гипофиза, нейротропный фактор головного мозга, цилиарный нейротропный фактор, тиротропин-высвобождающий гормон, нейротензин, саувагин, антагонисты нейропептида Y, антагонисты опиоидных пептидов, антагонисты галанина, антагонисты меланин-концентрирующего гормона, ингибиторы белка агути и антагонисты рецептора орексина. Конкретными примерами ингибиторов поглощения моноамина являются мазиндол или т.п.; примерами ингибиторов поглощения серотонина являются гидрохлорид дексфенфлурамина, фенфлурамин, гидрохлорид сибутрамина, малеат флувоксамина, гидрохлорид сертралина или т.п.; примерами агонистов серотонина являются инотриптан, (+)-норфенфлурамин или т.п.; примерами ингибиторов поглощения норадреналина являются бупропион, GW-320659 или т.п.; примерами стимуляторов высвобождения норадреналина являются ролипрам, YM-992 или т.п.; примерами агонистов -меланоцит-стимулирующий гормон, транскрипт, регулируемый кокаином и амфетамином, белок акажу (махагонии), агонисты энтеростатина, кальцитонин, пептид, связанный с геном кальцитонина, бомбезин, агонисты холецистокинина (в частности, агонисты ССК-А), кортикотропин-высвобождающий гормон, аналог кортикотропин-высвобождающего гормона, урокортин, соматотропин, аналоги соматостатина, агонисты рецептора соматостатина, пептид, активирующий аденилат-циклазу гипофиза, нейротропный фактор головного мозга, цилиарный нейротропный фактор, тиротропин-высвобождающий гормон, нейротензин, саувагин, антагонисты нейропептида Y, антагонисты опиоидных пептидов, антагонисты галанина, антагонисты меланин-концентрирующего гормона, ингибиторы белка агути и антагонисты рецептора орексина. Конкретными примерами ингибиторов поглощения моноамина являются мазиндол или т.п.; примерами ингибиторов поглощения серотонина являются гидрохлорид дексфенфлурамина, фенфлурамин, гидрохлорид сибутрамина, малеат флувоксамина, гидрохлорид сертралина или т.п.; примерами агонистов серотонина являются инотриптан, (+)-норфенфлурамин или т.п.; примерами ингибиторов поглощения норадреналина являются бупропион, GW-320659 или т.п.; примерами стимуляторов высвобождения норадреналина являются ролипрам, YM-992 или т.п.; примерами агонистов  2-адренорецептора являются амфетамин, декстроамфетамин, фентермин, бензфетамин, метамфетамин, фендиметразин, фенметразин, диэтилпропион, фенилпропаноламин, клобензорекс или т.п.; примерами агонистов допамина являются ER-230, допрексин, мезилат бромкриптина или т.п.; примерами антагонистов рецептора каннабиноида являются римонабант или т.п.; примерами антагонистов рецептора 2-адренорецептора являются амфетамин, декстроамфетамин, фентермин, бензфетамин, метамфетамин, фендиметразин, фенметразин, диэтилпропион, фенилпропаноламин, клобензорекс или т.п.; примерами агонистов допамина являются ER-230, допрексин, мезилат бромкриптина или т.п.; примерами антагонистов рецептора каннабиноида являются римонабант или т.п.; примерами антагонистов рецептора  -аминомасляной кислоты являются топирамат или т.п.; примерами антагонистов Н3-гистамина являются GT-2394 или т.п.; примерами лептина, аналогов лептина или агонистов рецептора лептина являются LY-355101 или т.п.; примерами холецистокинина (в частности, агонистов ССК-А) являются SK-146131, SSR-125180, BP-3.200, A-71623, FPL-15849, GI-248573, GW-7178, GI-181771, GW-7854, A-71378 или т.п, и примерами антагонистов нейропептида Y являются SR-120819-A, PD-160170, NGD-95-1, BIBP-3226, 1229-U-91, CGP-71683, BIBO-3304, CP-671906-01, J-115814 или т.п. Средства для подавления аппетита, предпочтительно, используются для лечения диабета, нарушеной толерантности к глюкозе, осложнений диабета, ожирения, гиперинсулинемии, гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии, нарушения липидного метаболизма, атеросклероза, гипертензии, застойной сердечной недостаточности, отеков, гиперурикемии или подагры, и, более предпочтительно, для лечения ожирения, поскольку эти средства стимулируют или ингибируют активности интрацеребральных моноаминов или биологически активных пептидов в центральной нервной системе, ответственной за регуляцию аппетита и подавление аппетита, что приводит к снижению потребления энергии. -аминомасляной кислоты являются топирамат или т.п.; примерами антагонистов Н3-гистамина являются GT-2394 или т.п.; примерами лептина, аналогов лептина или агонистов рецептора лептина являются LY-355101 или т.п.; примерами холецистокинина (в частности, агонистов ССК-А) являются SK-146131, SSR-125180, BP-3.200, A-71623, FPL-15849, GI-248573, GW-7178, GI-181771, GW-7854, A-71378 или т.п, и примерами антагонистов нейропептида Y являются SR-120819-A, PD-160170, NGD-95-1, BIBP-3226, 1229-U-91, CGP-71683, BIBO-3304, CP-671906-01, J-115814 или т.п. Средства для подавления аппетита, предпочтительно, используются для лечения диабета, нарушеной толерантности к глюкозе, осложнений диабета, ожирения, гиперинсулинемии, гиперлипидемии, гиперхолестеринемии, гипертриглицеридемии, нарушения липидного метаболизма, атеросклероза, гипертензии, застойной сердечной недостаточности, отеков, гиперурикемии или подагры, и, более предпочтительно, для лечения ожирения, поскольку эти средства стимулируют или ингибируют активности интрацеребральных моноаминов или биологически активных пептидов в центральной нервной системе, ответственной за регуляцию аппетита и подавление аппетита, что приводит к снижению потребления энергии.
Примерами ингибиторов ангиотензин-конвертирующего фермента являются каптоприл, малеат эналаприла, алацеприл, гидрохлорид делаприла, рамиприл, лизиноприл, гидрохлорид имидаприла, гидрохлорид беназеприла, моногидрат церонаприла, цилазаприл, натрий-фозиноприл, периндоприл, эрбумин, кальций-мовелтиприл, гидрохлорид хинаприла, гидрохлорид спираприла, гидрохлорид темокаприла, трандолаприл, кальций-зофеноприл, гидрохлорид моэксиприла, рентиаприл или т.п. Ингибиторы ангиотензин-конвертирующих ферментов, предпочтительно, используются для лечения осложнений диабета или гипертензии.
Примерами ингибиторов нейтральной эндопептидазы являются омапатрилат, MDL-100240, фазидотрил, сампатрилат, GW-660511X, миксанприл, SA-7060, E-4030, SLV-306, экадотрил или т.п. Ингибиторы нейтральной эндопептидазы предпочтительно используются для лечения осложнений диабета или гипертензии.
Примерами антагонистов рецептора ангиотензина II являются кандесартан-цилексетил, кандесартан-цилексетил/гидрохлортиазид, калий-лозартан, мезилат эпросартана, валсартан, телмисартан, ирбесартан, ЕХР-3174, L-158809, EXP-3312, олмесартан, тазосартан, KT-3-671, GA-0113, RU-64276, EMD-90423, BR-9701 или т.п. Антагонисты рецептора ангиотензина II предпочтительно используются для лечения осложнений диабета или гипертензии.
Примерами ингибиторов эндотелин-конвертирующего фермента являются CGS-31447, CGS-35066, SM-19712 или т.п.; примерами антагонистов рецептора эндотелина являются L-749805, ТВС-3214, BMS-182874, BQ-610, TA-0201, SB-215355, PD-180988, натрий-ситаксентан, BMS-193884, дарусентан, TBC-3711, бозентан, натрий-тезосентан, J-104132, YM-598, S-0139, SB-234551, RPR-118031A, ATZ-1993, RO-61-1790, ABT-546, энлазентан, BMS-207940 или т.п. Эти лекарственные средства предпочтительно используются для лечения осложнений диабета или гипертензии, и, более предпочтительно, для лечения гипертензии.
Примерами диуретиков являются хлорталидон, метолазон, циклопентиазид, трихлорметиазид, гидрохлортиазид, гидрофлуметиазид, бензилгидрохлортиазид, пенфлутизид, метиклотиазид, индапамид, трипамид, мефрузид, азоземид, этакриновая кислота, тораземид, пиретанид, фуроземид, буметанид, метикран, канреноат калия, спиронолактон, триамтерен, аминофиллин, гидрохлорид циклетанина, LLU- , PNU-80873А, изосорбид, D-маннит, D-сорбит, фруктоза, глицерин, ацетазоламид, метазоламид, FR-179544, ОРС-31260, ликсиваптан, гидрохлорид кониваптана или т.п. Диуретические лекарственные средства, предпочтительно, используются для лечения осложнений диабета, гипертензии, застойной сердечной недостаточности или отеков, и, более предпочтительно, для лечения гипертензии, застойной сердечной недостаточности или отеков, поскольку эти средства способствуют усилению мочевыделения, что приводит к снижению кровяного давления или к уменьшению отеков. , PNU-80873А, изосорбид, D-маннит, D-сорбит, фруктоза, глицерин, ацетазоламид, метазоламид, FR-179544, ОРС-31260, ликсиваптан, гидрохлорид кониваптана или т.п. Диуретические лекарственные средства, предпочтительно, используются для лечения осложнений диабета, гипертензии, застойной сердечной недостаточности или отеков, и, более предпочтительно, для лечения гипертензии, застойной сердечной недостаточности или отеков, поскольку эти средства способствуют усилению мочевыделения, что приводит к снижению кровяного давления или к уменьшению отеков.
Примерами антагонистов кальция являются аранидипин, гидрохлорид эфонидипина, гидрохлорид никардипина, гидрохлорид барнидипина, гидрохлорид бенидипина, гидрохлорид манидипина, клинидипин, низолдипин, нитрендипин, нифедипин, нилвадипин, фелодипин, безилат амилодипина, пранидипин, гидрохлорид лерканидипина, исрадипин, элгодипин, азелнидипин, лацидипин, гидрохлорид ватанидипина, лемилдипин, гидрохлорид дилтиазема, малеат клентиазема, гидрохлорид верапамила, S-верапамил, гидрохлорид фазудила, гидрохлорид бепридила, гидрохлорид галлопамила или т.п.; примерами антигипертензивных сосудорасширяющих средств являются индапамид, гидрохлорид тодралазина, гидрохлорид гидралазина, кадралазин, будралазин или т.п.; примерами блокаторов симпатического ствола являются гидрохлорид амосулалола, гидрохлорид теразозина, гидрохлорид буназозина, гидрохлорид празозина, мезилат доксазозина, гидрохлорид пропранолола, атенолол, тартрат метопролола, карведилол, нипрадилол, гидрохлорид целипролола, небиволол, гидрохлорид бетаксолола, пиндолол, гидрохлорид тертатолола, гидрохлорид бевантолола, малеат тимолола, гидрохлорид картеолола, гемифумарат бисопролола, малонат бопиндолола, нипрадилол, сульфат пенбутолола, гидрохлорид ацебутолола, гидрохлорид тилизолола, надолол, урапидил, индорамин или т.п.; примерами антигипертензивных средств центрального действия являются резерпин или т.п., и примерами агонистов  2-адренорецептора являются гидрохлорид клонидина, метилдопа, CHF-1035, ацетат гуанабенза, гидрохлорид гуанфацина, моксонидин, лофексидин, гидрохлорид талипексола или т.п. Эти лекарственные средства предпочтительно используются для лечения гипертензии. 2-адренорецептора являются гидрохлорид клонидина, метилдопа, CHF-1035, ацетат гуанабенза, гидрохлорид гуанфацина, моксонидин, лофексидин, гидрохлорид талипексола или т.п. Эти лекарственные средства предпочтительно используются для лечения гипертензии.
Примерами антитромбоцитарных средств являются гидрохлорид тиклопидина, дипиридамол, цилостазол, этиликозапентад, гидрохлорид сарпогрелата, дигидрохлорид дилазепа, трапидил, берапрост-натрий, аспирин или т.п. Указанные антитромбоцитарные средства предпочтительно, используются для лечения атеросклероза или застойной сердечной недостаточности.
Примерами ингибиторов синтеза мочевой кислоты являются аллопуринол, оксипуринол или т.п.; примерами средств, способствующих выведению мочевой кислоты, являются бензбромарон, пробенецид или т.п., и примерами средств для защелачивания мочи являются бикарбонат натрия, цитрат калия, цитрат натрия или т.п. Эти лекарственные средства предпочтительно используются для лечения гиперурикемии или подагры.
В случае использования комбинации с лекарственными средствами, не являющимися ингибиторами SGLT1, например, для лечения диабета, предпочтительной является комбинация, по крайней мере, с одним компонентом, выбранным из группы, состоящей из усилителя чувствительности к инсулину, ингибитора абсорбции глюкозы, бигуанида, стимулятора секреции инсулина, ингибиторов SGLT2, инсулина или его аналога, антагониста рецептора глюкагона, стимулятора киназы инсулинового рецептора, ингибитора трипептидилпептидазы II, ингибитора дипептидилпептидазы IV, ингибитора протеин-тирозин-фосфатазы 1В, ингибитора гликоген-фосфорилазы, ингибитора глюкозо-6-фосфатазы, ингибитора фруктозо-бифосфатазы, ингибитора пируват-дегидрогеназы, ингибитора глюконеогенеза в печени, D-хироинозита, ингибитора киназы-3 гликоген-синтазы, глюкагон-подобного пептида-1, аналога глюкагон-подобного пептида-1, агониста глюкагон-подобного пептида-1, амилина, аналога амилина, агониста амилина и средства для подавления аппетита; более предпочтительной является комбинация, по крайней мере, с одним компонентом, выбранным из группы, состоящей из усилителя чувствительности к инсулину, бигуанида, стимулятора секреции инсулина, ингибиторов SGLT2, инсулина или его аналога, антагониста рецептора глюкагона, стимулятора киназы инсулинового рецептора, ингибитора трипептидилпептидазы II, ингибитора дипептидилпептидазы IV, ингибитора протеин-тирозин-фосфатазы 1В, ингибитора гликоген-фосфорилазы, ингибитора глюкозо-6-фосфатазы, ингибитора фруктозо-бифосфатазы, ингибитора пируват-дегидрогеназы, ингибитора глюконеогенеза в печени, D-хироинозита, ингибитора киназы-3 гликоген-синтазы, глюкагон-подобного пептида-1, аналога глюкагон-подобного пептида-1, агониста глюкагон-подобного пептида-1, амилина, аналога амилина и агониста амилина; и наиболее предпочтительной является комбинация, по крайней мере, с одним компонентом, выбранным из группы, состоящей из усилителя чувствительности к инсулину, бигуанида, стимулятора секреции инсулина, ингибитора SGLT2 и инсулина или его аналога. Аналогичным образом, для лечения осложнений диабета, предпочтительной является комбинация, по крайней мере, с одним компонентом, выбранным из группы, состоящей из усилителя чувствительности к инсулину, ингибитора абсорбции глюкозы, бигуанида, стимулятора секреции инсулина, ингибитора SGLT2, инсулина или его аналога, антагониста рецептора глюкагона, стимулятора киназы инсулинового рецептора, ингибитора трипептидилпептидазы II, ингибитора дипептидилпептидазы IV, ингибитора протеин-тирозин-фосфатазы 1В, ингибитора гликогенфосфорилазы, ингибитора глюкозо-6-фосфатазы, ингибитора фруктозобифосфатазы, ингибитора пируватдегидрогеназы, ингибитора глюконеогенеза в печени, D-хироинозита, ингибитора киназы-3 гликоген-синтазы, глюкагон-подобного пептида-1, аналога глюкагон-подобного пептида-1, агониста глюкагон-подобного пептида-1, амилина, аналога амилина, агониста амилина, ингибитора альдозоредуктазы, ингибитора образования конечных продуктов при значительной гипергликемии, ингибитора протеинкиназы С, антагониста рецептора  -аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липидпероксидазы, ингибитора дипептидазы N-ацетилированной- -аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липидпероксидазы, ингибитора дипептидазы N-ацетилированной- -кислоты, инсулиноподобного фактора роста-I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервной ткани, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелин-конвертирующего фермента, антагониста рецептора эндотелина и диуретика, и, более предпочтительной является комбинация, по крайней мере, с одним компонентом, выбранным из группы, состоящей из ингибитора альдозо-редуктазы, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы и антагониста рецептора ангиотензина II. Кроме того, для лечения ожирения, предпочтительной является комбинация, по крайней мере, с одним компонентом, выбранным из группы, состоящей из усилителя чувствительности к инсулину, ингибитора абсорбции глюкозы, бигуанида, стимулятора секреции инсулина, ингибитора SGLT2, инсулина или его аналога, антагониста рецептора глюкагона, стимулятора киназы инсулинового рецептора, ингибитора трипептидилпептидазы II, ингибитора дипептидилпептидазы IV, ингибитора протеинтирозин-фосфатазы 1В, ингибитора гликоген-фосфорилазы, ингибитора глюкозо-6-фосфатазы, ингибитора фруктозо-бифосфатазы, ингибитора пируват-дегидрогеназы, ингибитора глюконеогенеза в печени, D-хироинозита, ингибитора киназы-3 гликоген-синтазы, глюкагон-подобного пептида-1, аналога глюкагон-подобного пептида-1, агониста глюкагон-подобного пептида-1, амилина, аналога амилина, агониста амилина, агониста -кислоты, инсулиноподобного фактора роста-I, тромбоцитарного фактора роста, аналога тромбоцитарного фактора роста, эпидермального фактора роста, фактора роста нервной ткани, производного карнитина, уридина, 5-гидрокси-1-метилгидантоина, EGB-761, бимокломола, сулодексида, Y-128, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы, антагониста рецептора ангиотензина II, ингибитора эндотелин-конвертирующего фермента, антагониста рецептора эндотелина и диуретика, и, более предпочтительной является комбинация, по крайней мере, с одним компонентом, выбранным из группы, состоящей из ингибитора альдозо-редуктазы, ингибитора ангиотензин-конвертирующего фермента, ингибитора нейтральной эндопептидазы и антагониста рецептора ангиотензина II. Кроме того, для лечения ожирения, предпочтительной является комбинация, по крайней мере, с одним компонентом, выбранным из группы, состоящей из усилителя чувствительности к инсулину, ингибитора абсорбции глюкозы, бигуанида, стимулятора секреции инсулина, ингибитора SGLT2, инсулина или его аналога, антагониста рецептора глюкагона, стимулятора киназы инсулинового рецептора, ингибитора трипептидилпептидазы II, ингибитора дипептидилпептидазы IV, ингибитора протеинтирозин-фосфатазы 1В, ингибитора гликоген-фосфорилазы, ингибитора глюкозо-6-фосфатазы, ингибитора фруктозо-бифосфатазы, ингибитора пируват-дегидрогеназы, ингибитора глюконеогенеза в печени, D-хироинозита, ингибитора киназы-3 гликоген-синтазы, глюкагон-подобного пептида-1, аналога глюкагон-подобного пептида-1, агониста глюкагон-подобного пептида-1, амилина, аналога амилина, агониста амилина, агониста  3-адренорецептора и средства для подавления аппетита, и, более предпочтительной является комбинация, по крайней мере, с одним компонентом, выбранным из группы, состоящей из ингибитора SGLT2, агониста 3-адренорецептора и средства для подавления аппетита, и, более предпочтительной является комбинация, по крайней мере, с одним компонентом, выбранным из группы, состоящей из ингибитора SGLT2, агониста  3-адренорецептора и средства для подавления аппетита. 3-адренорецептора и средства для подавления аппетита.
При применении фармацевтических композиций настоящего изобретения для практического лечения используются различные дозированные формы в зависимости от цели их применения. Примерами таких дозированных форм являются порошки, гранулы, мелкие гранулы, сухие сиропы, таблетки, капсулы, инъекции, растворы, мази, суппозитории, припарки и т.п., которые вводят перорально или парентерально. Фармацевтическими композициями настоящего изобретения также являются композиции пролонгированного высвобождения, включая мукоадгезивные композиции для введения через желудочно-кишечный тракт (см., например, публикации Международных заявок  WO99/10010, WO99/26606 и публикацию заявки на патент Японии WO99/10010, WO99/26606 и публикацию заявки на патент Японии  2001-2567). 2001-2567).
Указанные фармацевтические композиции могут быть получены путем смешивания с соответствующими фармацевтическими добавками, либо путем разбавления указанными добавками или растворения с указанными добавками, таких как эксципиенты; дезинтегрирующие агенты; связующие агенты; лубриканты; разбавители; буферы; агенты, придающие изотоничность; антисептики; увлажнители; эмульгирующие агенты; диспергирующие агенты; стабилизаторы; вещества, способствующие растворению, и т.п., и составление смеси в композицию стандартными методами. В случае использования соединений настоящего изобретения в комбинации с лекарственными средствами, не являющимися интгибиторами SGLT1, они могут быть получены путем приготовления каждого активного ингредиента в смеси друг с другом или отдельно.
При применении фармацевтических композиций настоящего изобретения для практического лечения дозу соединения настоящего изобретения, представленного вышеуказанной общей формулы (I), его фармацевтически приемлемой соли или пролекарства, используемых в качестве активного ингредиента, назначают в зависимости от возраста, пола, массы, тяжести симптомов и фазы лечения каждого отдельного пациента, и эта доза приблизительно составляет от 0,1 до 1000 мг в день для взрослого человека в случае перорального введения и приблизительно в пределах от 0,01 до 300 мг в день для взрослого человека в случае парентерального введения, при этом суточная доза может быть соответствующим образом введена в виде одной разовой дозы или нескольких дробных доз в день. Кроме того, в случае использования соединений настоящего изобретения в комбинации с лекарственными средствами, не являющимися интгибиторами SGLT1, доза соединений настоящего изобретения может быть снижена в зависимости от дозы лекарственных средств, не являющихся ингибиторами SGLT1.
Примеры
Настоящее изобретение более подробно проиллюстрировано в следующих Сравнительных примерах, Примерах и Примерах испытаний. Однако настоящее изобретение ими не ограничивается.
Сравнительный пример 1
2-амино-2-метилпропионамид
К раствору 2-бензилоксикарбониламино-2-метилпропионовой кислоты (1 г) в N,N-диметилформамиде (10 мл) добавляли 1-гидроксибензотриазол (0,63 г), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (1,21 г), триэтиламин (1,76 мл) и 28% водного раствора аммиака (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду, и полученную смесь экстрагировали этилацетатом. Органический слой последовательно промывали 0,5 моль/л хлористо-водородной кислоты, водой, 1 моль/л водного раствора гидроксида натрия, водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и получали 2-бензилоксикарбониламино-2-метилпропионамид (0,26 г). Это вещество растворяли в метаноле (5 мл). К раствору добавляли порошкообразный 10% палладий на угле (30 мг) и смесь перемешивали в атмосфере водорода в течение 3 ч. Нерастворившееся вещество удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,11 г).
1H-ЯМР (ДМСО-d6)  м.д.: 1,15 (6H, с), 1,9 (2H, шир.с), 6,83 (1H, шир.с), 7,26 (1H, шир.с). м.д.: 1,15 (6H, с), 1,9 (2H, шир.с), 6,83 (1H, шир.с), 7,26 (1H, шир.с).
Сравнительный пример 2
4-[(4-бромфенил)метил]-1,2-дигидро-5-изопропил-3Н-пиразол-3-он
К суспензии гидрида натрия (60%, 3,86 г) в тетрагидрофуране (250 мл) добавляли этил-4-метил-3-оксопентаноат (15,2 г) и смесь перемешивали при 0°С в течение 10 минут. К реакционной смеси добавляли раствор 4-бромбензилбромида (20 г) в тетрагидрофуране (100 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и растворитель удаляли при пониженном давлении. К раствору полученного остатка в толуоле (10 мл) добавляли моногидрат гидразина (8,01 г) и смесь перемешивали при 100°С в течение ночи. После охлаждения реакционной смеси до комнатной температуры, растворитель удаляли при пониженном давлении. К остатку добавляли этилацетат (20 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Осажденные кристаллы собирали фильтрованием. Собранные кристаллы последовательно промывали водой и н-гексаном и сушили при 40°С при пониженном давлении с получением указанного в заголовке соединения (11,5 г).
1H-ЯМР (ДМСО-d6)  м.д.: 1,07 (6H, д, J=7,1 Гц), 2,75-2,9 (1H, м), 3,55 (2H, с), 7,05-7,15 (2H, м), 7,35-7,45 (2H, м). м.д.: 1,07 (6H, д, J=7,1 Гц), 2,75-2,9 (1H, м), 3,55 (2H, с), 7,05-7,15 (2H, м), 7,35-7,45 (2H, м).
Сравнительный пример 3
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразол
К суспензии 4-[(4-бромфенил)метил]-1,2-дигидро-5-изопропил-3Н-пиразол-3-она (5,0 г) в дихлорметане (50 мл) добавляли ацетобром- -D-глюкозу (7,0 г), бензилтри(н-бутил)аммонийхлорид (5,3 г) и 5 моль/л водного раствора гидроксида натрия (8,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. Органический слой отделяли и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1) с получением указанного в заголовке соединения (4,12 г). -D-глюкозу (7,0 г), бензилтри(н-бутил)аммонийхлорид (5,3 г) и 5 моль/л водного раствора гидроксида натрия (8,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. Органический слой отделяли и растворитель удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1) с получением указанного в заголовке соединения (4,12 г).
1H-ЯМР (CDCl3)  м.д.: 1,1-1,25 (6H, м), 1,86 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,85-2,95 (1H, м), 3,58 (1H, д, J=16,2 Гц), 3,64 (1H, д, J=16,2 Гц), 3,8-3,95 (1H, м), 4,15 (1H, дд, J=12,4 Гц, 2,2 Гц), 4,32 (1H, дд, J=12,4 Гц, 3,9 Гц), 5,15-5,35 (3H, м), 5,53 (1H, д, J=7,5 Гц), 6,95-7,05 (2H, м), 7,3-7,4 (2H, м). м.д.: 1,1-1,25 (6H, м), 1,86 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,85-2,95 (1H, м), 3,58 (1H, д, J=16,2 Гц), 3,64 (1H, д, J=16,2 Гц), 3,8-3,95 (1H, м), 4,15 (1H, дд, J=12,4 Гц, 2,2 Гц), 4,32 (1H, дд, J=12,4 Гц, 3,9 Гц), 5,15-5,35 (3H, м), 5,53 (1H, д, J=7,5 Гц), 6,95-7,05 (2H, м), 7,3-7,4 (2H, м).
Сравнительный пример 4
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразол
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола (3,0 г) и 3-бутеновой кислоты (1,0 г) в ацетонитриле (15 мл) добавляли триэтиламин (2,4 г), ацетат палладия (II) (0,11 г) и трис(2-метилфенил)фосфин (0,29 г) и смесь кипятили с обратным холодильником в течение ночи в защищенном от света помещении. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат-дихлорметан/метанол=10/1) с получением указанного в заголовке соединения (1,74 г). -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола (3,0 г) и 3-бутеновой кислоты (1,0 г) в ацетонитриле (15 мл) добавляли триэтиламин (2,4 г), ацетат палладия (II) (0,11 г) и трис(2-метилфенил)фосфин (0,29 г) и смесь кипятили с обратным холодильником в течение ночи в защищенном от света помещении. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат-дихлорметан/метанол=10/1) с получением указанного в заголовке соединения (1,74 г).
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6H, м), 1,84 (3H, с), 2,01 (3H, с), 2,02 (3H, с), 2,05 (3H, с), 2,8-2,95 (1H, м), 3,2-3,3 (2H, м), 3,59 (1H, д, J=16,0 Гц), 3,66 (1H, д, J=16,0 Гц), 3,8-3,9 (1H, м), 4,18 (1H, дд, J=12,3 Гц, 1,8 Гц), 4,33 (1H, дд, J=12,3 Гц, 3,8 Гц), 5,15-5,35 (3H, м), 5,4-5,5 (1H, м), 6,2-6,3 (1H, м), 6,4-6,5 (1H, м), 7,0-7,1 (2H, м), 7,2-7,3 (2H, м). м.д.: 1,1-1,2 (6H, м), 1,84 (3H, с), 2,01 (3H, с), 2,02 (3H, с), 2,05 (3H, с), 2,8-2,95 (1H, м), 3,2-3,3 (2H, м), 3,59 (1H, д, J=16,0 Гц), 3,66 (1H, д, J=16,0 Гц), 3,8-3,9 (1H, м), 4,18 (1H, дд, J=12,3 Гц, 1,8 Гц), 4,33 (1H, дд, J=12,3 Гц, 3,8 Гц), 5,15-5,35 (3H, м), 5,4-5,5 (1H, м), 6,2-6,3 (1H, м), 6,4-6,5 (1H, м), 7,0-7,1 (2H, м), 7,2-7,3 (2H, м).
Сравнительный пример 5
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксивинил]фенил}метил)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксивинил]фенил}метил)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 4, с использованием акриловой кислоты вместо 3-бутеновой кислоты.
1H-ЯМР (CDCl3)  м.д.: 1,19 (6H, д, J=7,3 Гц), 1,84 (3H, с), 2,01 (3H, с), 2,04 (3H, с), 2,05 (3H, с), 2,85-3,0 (1H, м), 3,66 (1H, д, J=16,2 Гц), 3,73 (1H, д, J=16,2 Гц), 3,85-3,95 (1H, м), 4,2 (1H, дд, J=12,6 Гц, 2,2 Гц), 4,34 (1H, дд, J=12,6 Гц, 4,1 Гц), 5,15-5,35 (3H, м), 5,5 (1H, д, J=7,7 Гц), 6,4 (1H, д, J=15,7 Гц), 7,15-7,2 (2H, м), 7,4-7,5 (2H, м), 7,71 (1H, д, J=15,7 Гц). м.д.: 1,19 (6H, д, J=7,3 Гц), 1,84 (3H, с), 2,01 (3H, с), 2,04 (3H, с), 2,05 (3H, с), 2,85-3,0 (1H, м), 3,66 (1H, д, J=16,2 Гц), 3,73 (1H, д, J=16,2 Гц), 3,85-3,95 (1H, м), 4,2 (1H, дд, J=12,6 Гц, 2,2 Гц), 4,34 (1H, дд, J=12,6 Гц, 4,1 Гц), 5,15-5,35 (3H, м), 5,5 (1H, д, J=7,7 Гц), 6,4 (1H, д, J=15,7 Гц), 7,15-7,2 (2H, м), 7,4-7,5 (2H, м), 7,71 (1H, д, J=15,7 Гц).
Пример 1
4-({4-[3-(карбамоилметилкарбамоил)пропил]фенил}метил)-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола (0,34 г) в N,N-диметилформамиде (1 мл) добавляли гидрохлорид глицинамида (0,12 г), 1-гидроксибензотриазол (0,09 г), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,15 г) и триэтиламин (0,27 мл) и смесь перемешивали при комнатной температуре в течение ночи. Нерастворившееся вещество удаляли фильтрованием. К фильтрату добавляли 0,5 моль/л водного раствора гидроксида натрия (0,5 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/90) с получением 4-({4-[(1Е)-3-(карбамоилметилкарбамоил)проп-1-енил]фенил}метил)-3-( -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола (0,34 г) в N,N-диметилформамиде (1 мл) добавляли гидрохлорид глицинамида (0,12 г), 1-гидроксибензотриазол (0,09 г), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,15 г) и триэтиламин (0,27 мл) и смесь перемешивали при комнатной температуре в течение ночи. Нерастворившееся вещество удаляли фильтрованием. К фильтрату добавляли 0,5 моль/л водного раствора гидроксида натрия (0,5 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/90) с получением 4-({4-[(1Е)-3-(карбамоилметилкарбамоил)проп-1-енил]фенил}метил)-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразола (0,03 г). Полученное вещество растворяли в метаноле (1 мл). К раствору добавляли порошкообразный 10% палладий на угле (0,01 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (0,02 г). -D-глюкопиранозилокси)-5-изопропил-1Н-пиразола (0,03 г). Полученное вещество растворяли в метаноле (1 мл). К раствору добавляли порошкообразный 10% палладий на угле (0,01 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (0,02 г).
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6H, м), 1,85-1,95 (2H, м), 2,25 (2H, т, J=7,6 Гц), 2,6 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,4 (4H, м), 3,6-3,9 (6H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,2 (6H, м), 1,85-1,95 (2H, м), 2,25 (2H, т, J=7,6 Гц), 2,6 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,4 (4H, м), 3,6-3,9 (6H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 2
4-{[4-(3-карбамоилпропил)фенил]метил}-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием аммонийхлорида вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,6 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,3-3,45 (4H, м), 3,6-3,8 (3H, м), 3,8-3,9 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,6 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,3-3,45 (4H, м), 3,6-3,8 (3H, м), 3,8-3,9 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 3
4-({4-[3-(2-карбамоилэтилкарбамоил)пропил]фенил}метил)-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 3-аминопропионамида вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,8-1,95 (2H, м), 2,15 (2H, т, J=7,3 Гц), 2,4 (2H, т, J=6,7 Гц), 2,56 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (6H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,8-1,95 (2H, м), 2,15 (2H, т, J=7,3 Гц), 2,4 (2H, т, J=6,7 Гц), 2,56 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (6H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 4
4-({4-[3-(2-аминоэтилкарбамоил)пропил]фенил}метил)-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием гидрохлорида N-бензилоксикарбонил-1,2-диаминоэтана вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,85-1,95 (2H, м), 2,19 (2H, т, J=7,6 Гц), 2,58 (2H, т, J=7,5 Гц), 2,8 (2H, т, J=6,1 Гц), 2,85-2,95 (1H, м), 3,2-3,4 (6Н, м), 3,6-3,9 (4Н, м), 5,0-5,1 (1Н, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,2 (6H, м), 1,85-1,95 (2H, м), 2,19 (2H, т, J=7,6 Гц), 2,58 (2H, т, J=7,5 Гц), 2,8 (2H, т, J=6,1 Гц), 2,85-2,95 (1H, м), 3,2-3,4 (6Н, м), 3,6-3,9 (4Н, м), 5,0-5,1 (1Н, м), 7,0-7,15 (4H, м).
Пример 5
4-({4-[3-(3-аминопропилкарбамоил)пропил]фенил}метил)-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием гидрохлорида N-бензилоксикарбонил-1,3-диаминопропана вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,6-1,7 (2H, м), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,7 Гц), 2,57 (2H, т, J=7,5 Гц), 2,68 (2H, т, J=7,1 Гц), 2,85-2,95 (1H, м), 3,22 (2H, т, J=6,7 Гц), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,2 (6H, м), 1,6-1,7 (2H, м), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,7 Гц), 2,57 (2H, т, J=7,5 Гц), 2,68 (2H, т, J=7,1 Гц), 2,85-2,95 (1H, м), 3,22 (2H, т, J=6,7 Гц), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 6
4-({4-[3-(4-аминобутилкарбамоил)пропил]фенил}метил)-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием гидрохлорида N-бензилоксикарбонил-1,4-диаминобутана вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,45-1,65 (4H, м), 1,8-1,95 (2H, м), 2,16 (2H, т, J=7,5 Гц), 2,57 (2H, т, J=7,7 Гц), 2,83 (2H, т, J=7,0 Гц), 2,85-3,0 (1H, м), 3,17 (2H, т, J=6,6 Гц), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,2 (6H, м), 1,45-1,65 (4H, м), 1,8-1,95 (2H, м), 2,16 (2H, т, J=7,5 Гц), 2,57 (2H, т, J=7,7 Гц), 2,83 (2H, т, J=7,0 Гц), 2,85-3,0 (1H, м), 3,17 (2H, т, J=6,6 Гц), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 7
4-[(4-{3-[(S)-1-карбамоил-2-(4-гидроксифенил)этилкарбамоил]пропил}фенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием гидрохлорида L-тирозинамида вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,7-1,8 (2H, м), 2,1-2,2 (2H, м), 2,44 (2H, т, J=7,5 Гц), 2,76 (1H, дд, J=13,9 Гц, 9,3 Гц), 2,85-2,95 (1H, м), 3,04 (1H, дд, J=13,9 Гц, 5,5 Гц), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 4,57 (1H, дд, J=9,3 Гц, 5,5 Гц), 5,0-5,1 (1H, м), 6,65-6,75 (2H, м), 6,95-7,15 (6H, м). м.д.: 1,1-1,2 (6H, м), 1,7-1,8 (2H, м), 2,1-2,2 (2H, м), 2,44 (2H, т, J=7,5 Гц), 2,76 (1H, дд, J=13,9 Гц, 9,3 Гц), 2,85-2,95 (1H, м), 3,04 (1H, дд, J=13,9 Гц, 5,5 Гц), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 4,57 (1H, дд, J=9,3 Гц, 5,5 Гц), 5,0-5,1 (1H, м), 6,65-6,75 (2H, м), 6,95-7,15 (6H, м).
Пример 8
4-{[4-(3-бензилкарбамоилпропил)фенил]метил}-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием бензиламина вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,85-1,95 (2H, м), 2,22 (2H, т, J=7,5 Гц), 2,57 (2H, т, J=7,5 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 4,33 (2H, с), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м), 7,15-7,45 (5H, м). м.д.: 1,05-1,2 (6H, м), 1,85-1,95 (2H, м), 2,22 (2H, т, J=7,5 Гц), 2,57 (2H, т, J=7,5 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 4,33 (2H, с), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м), 7,15-7,45 (5H, м).
Пример 9
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-фенетилкарбамоилпропил)фенил]метил}-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-фенетилкарбамоилпропил)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием фенетиламина вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,75-1,9 (2H, м), 2,12 (2H, т, J=7,5 Гц), 2,51 (2H, т, J=7,7 Гц), 2,77 (2H, т, J=7,5 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (6H, м), 3,6-3,9 (4H, м), 5,0-5,15 (1H, м), 6,95-7,05 (2H, м), 7,05-7,3 (7H, м). м.д.: 1,05-1,15 (6H, м), 1,75-1,9 (2H, м), 2,12 (2H, т, J=7,5 Гц), 2,51 (2H, т, J=7,7 Гц), 2,77 (2H, т, J=7,5 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (6H, м), 3,6-3,9 (4H, м), 5,0-5,15 (1H, м), 6,95-7,05 (2H, м), 7,05-7,3 (7H, м).
Пример 10
3-( -D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(3-пиридилметилкарбамоил)пропил]фенил}метил)-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-({4-[3-(3-пиридилметилкарбамоил)пропил]фенил}метил)-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 3-пиколиламина вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,85-1,95 (2H, м), 2,22 (2H, т, J=7,6 Гц), 2,56 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 4,37 (2H, с), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м), 7,35-7,45 (1H, м), 7,7-7,8 (1H, м), 8,4-8,45 (1H, м), 8,45-8,5 (1H, м). м.д.: 1,1-1,15 (6H, м), 1,85-1,95 (2H, м), 2,22 (2H, т, J=7,6 Гц), 2,56 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 4,37 (2H, с), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м), 7,35-7,45 (1H, м), 7,7-7,8 (1H, м), 8,4-8,45 (1H, м), 8,45-8,5 (1H, м).
Пример 11
3-( -D-глюкопиранозилокси)-5-изопропил-4-[(4-{3-[2-(2-пиридил)этилкарбамоил]пропил}фенил)метил]-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-[(4-{3-[2-(2-пиридил)этилкарбамоил]пропил}фенил)метил]-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 2-(2-аминоэтил)пиридина вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,75-1,9 (2H, м), 2,11 (2H, т, J=7,5 Гц), 2,51 (2H, т, J=7,6 Гц), 2,85-3,0 (3H, м), 3,25-3,45 (4H, м), 3,52 (2H, т, J=6,9 Гц), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 6,95-7,15 (4H, м), 7,2-7,35 (2H, м), 7,7-7,8 (1H, м), 8,4-8,5 (1H, м). м.д.: 1,1-1,15 (6H, м), 1,75-1,9 (2H, м), 2,11 (2H, т, J=7,5 Гц), 2,51 (2H, т, J=7,6 Гц), 2,85-3,0 (3H, м), 3,25-3,45 (4H, м), 3,52 (2H, т, J=6,9 Гц), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 6,95-7,15 (4H, м), 7,2-7,35 (2H, м), 7,7-7,8 (1H, м), 8,4-8,5 (1H, м).
Пример 12
3-( -D-глюкопиранозилокси)-5-изопропил-4-[(4-{3-[2-(диметиламино)этилкарбамоил]пропил}фенил)метил]-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-[(4-{3-[2-(диметиламино)этилкарбамоил]пропил}фенил)метил]-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием N,N-диметилэтилендиамина вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,6 Гц), 2,25 (6H, с), 2,42 (2H, т, J=6,9 Гц), 2,57 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,4 (6H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,6 Гц), 2,25 (6H, с), 2,42 (2H, т, J=6,9 Гц), 2,57 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,4 (6H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 13
3-( -D-глюкопиранозилокси)-5-изопропил-4-[(4-{3-[2-(морфолин-4-ил)этилкарбамоил]пропил}фенил)метил]-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-[(4-{3-[2-(морфолин-4-ил)этилкарбамоил]пропил}фенил)метил]-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 4-(2-аминоэтил)морфолина вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,6 Гц), 2,4-2,55 (6H, м), 2,58 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (6H, м), 3,6-3,9 (8H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,6 Гц), 2,4-2,55 (6H, м), 2,58 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (6H, м), 3,6-3,9 (8H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 14
3-( -D-глюкопиранозилокси)-4-{[4-(3-{2-[бис(2-гидроксиэтил)амино]этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-{[4-(3-{2-[бис(2-гидроксиэтил)амино]этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием N,N-бис(2-гидроксиэтил)этилендиамина вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,8-1,95 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,5-2,7 (8H, м), 2,85-2,95 (1H, м), 3,25 (2H, т, J=6,4 Гц), 3,3-3,4 (4H, м), 3,5-3,9 (8H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,15 (6H, м), 1,8-1,95 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,5-2,7 (8H, м), 2,85-2,95 (1H, м), 3,25 (2H, т, J=6,4 Гц), 3,3-3,4 (4H, м), 3,5-3,9 (8H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 15
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{3-[бис(2-гидроксиэтил)амино]пропилкарбамоил}пропил)фенил]метил}-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{3-[бис(2-гидроксиэтил)амино]пропилкарбамоил}пропил)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием N,N-бис(2-гидроксиэтил)-1,3-диаминопропана вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,6-1,75 (2H, м), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,5 Гц), 2,5-2,75 (8H, м), 2,8-2,95 (1H, м), 3,21 (2H, т, J=6,7 Гц), 3,25-3,45 (4H, м), 3,5-3,9 (8H, м), 5,0-5,15 (1Н, м), 7,0-7,2 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,6-1,75 (2H, м), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,5 Гц), 2,5-2,75 (8H, м), 2,8-2,95 (1H, м), 3,21 (2H, т, J=6,7 Гц), 3,25-3,45 (4H, м), 3,5-3,9 (8H, м), 5,0-5,15 (1Н, м), 7,0-7,2 (4H, м).
Пример 16
3-( -D-глюкопиранозилокси)-5-изопропил-4-[(4-{3-[3-(диметиламино)пропилкарбамоил]пропил}фенил)метил]-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-[(4-{3-[3-(диметиламино)пропилкарбамоил]пропил}фенил)метил]-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием N,N-диметил-1,3-диаминопропана вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,6-1,75 (2H, м), 1,8-1,95 (2H, м), 2,16 (2H, т, J=7,5 Гц), 2,22 (6H, с), 2,3-2,35 (2H, м), 2,57 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,17 (2H, т, J=6,9 Гц), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,15 (6H, м), 1,6-1,75 (2H, м), 1,8-1,95 (2H, м), 2,16 (2H, т, J=7,5 Гц), 2,22 (6H, с), 2,3-2,35 (2H, м), 2,57 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,17 (2H, т, J=6,9 Гц), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 17
3-( -D-глюкопиранозилокси)-4-[(4-{3-[2-(имидазол-1-ил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[2-(имидазол-1-ил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 1-(2-аминоэтил)имидазола вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,8-2,0 (4H, м), 2,17 (2H, т, J=7,6 Гц), 2,57 (2H, т, J=7,7 Гц), 2,85-2,95 (1H, м), 3,14 (2H, т, J=6,8 Гц), 3,3-3,45 (4H, м), 3,6-3,9 (4H, м), 4,03 (2H, т, J=7,0 Гц), 5,0-5,1 (1H, м), 6,9-7,0 (1H, м), 7,0-7,15 (5H, м), 7,6-7,7 (1H, м). м.д.: 1,1-1,15 (6H, м), 1,8-2,0 (4H, м), 2,17 (2H, т, J=7,6 Гц), 2,57 (2H, т, J=7,7 Гц), 2,85-2,95 (1H, м), 3,14 (2H, т, J=6,8 Гц), 3,3-3,45 (4H, м), 3,6-3,9 (4H, м), 4,03 (2H, т, J=7,0 Гц), 5,0-5,1 (1H, м), 6,9-7,0 (1H, м), 7,0-7,15 (5H, м), 7,6-7,7 (1H, м).
Пример 18
3-( -D-глюкопиранозилокси)-4-({4-[3-(2-гидроксиэтил)карбамоилпропил]фенил}метил)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-({4-[3-(2-гидроксиэтил)карбамоилпропил]фенил}метил)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 2-аминоэтанола вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,8-1,95 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,57 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,27 (2H, т, J=5,8 Гц), 3,3-3,5 (4H, м), 3,57 (2H, т, J=5,9 Гц), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,15 (6H, м), 1,8-1,95 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,57 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,27 (2H, т, J=5,8 Гц), 3,3-3,5 (4H, м), 3,57 (2H, т, J=5,9 Гц), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 19
3-( -D-глюкопиранозилокси)-4-[(4-{3-[2-гидрокси-1-(гидроксиметил)этил]карбамоилпропил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[2-гидрокси-1-(гидроксиметил)этил]карбамоилпропил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 2-амино-1,3-пропандиола вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,8-1,95 (2H, м), 2,21 (2H, т, J=7,6 Гц), 2,58 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,3-3,45 (4H, м), 3,55-3,95 (9H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,8-1,95 (2H, м), 2,21 (2H, т, J=7,6 Гц), 2,58 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,3-3,45 (4H, м), 3,55-3,95 (9H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 20
3-( -D-глюкопиранозилокси)-4-[(4-{3-[2-гидрокси-1-гидроксиметил-1-(метил)этил]карбамоилпропил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[2-гидрокси-1-гидроксиметил-1-(метил)этил]карбамоилпропил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 2-амино-2-метил-1,3-пропандиола вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,22 (3H, с), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,7 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,55-3,9 (8H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,15 (6H, м), 1,22 (3H, с), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,7 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,55-3,9 (8H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 21
3-( -D-глюкопиранозилокси)-4-[(4-{3-[2-гидрокси-1,1-бис(гидроксиметил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[2-гидрокси-1,1-бис(гидроксиметил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием трис(гидроксиметил)аминометана вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,8-1,95 (2H, м), 2,23 (2H, т, J=7,5 Гц), 2,59 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (10H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,2 (6H, м), 1,8-1,95 (2H, м), 2,23 (2H, т, J=7,5 Гц), 2,59 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (10H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 22
4-[(4-{3-[(S)-1-(карбамоил)этилкарбамоил]пропил}фенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием гидрохлорида L-аланинамида вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1-32 (3H, д, J=7,2 Гц), 1,8-1,95 (2H, м), 2,15-2,25 (2H, м), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 4,32 (1H, кв., J=7,2 Гц), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (6H, м), 1-32 (3H, д, J=7,2 Гц), 1,8-1,95 (2H, м), 2,15-2,25 (2H, м), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 4,32 (1H, кв., J=7,2 Гц), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 23
4-[(4-{3-[(S)-1-карбамоил-2-гидроксиэтилкарбамоил]пропил}фенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием гидрохлорида L-серинамида вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,85-1,95 (2H, м), 2,2-2,3 (2H, м), 2,59 (2H, т, J=7,4 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (6H, м), 4,4 (1H, т, J=5,2 Гц), 5,0-5,1 (1H, м), 7,05-7,15 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,85-1,95 (2H, м), 2,2-2,3 (2H, м), 2,59 (2H, т, J=7,4 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (6H, м), 4,4 (1H, т, J=5,2 Гц), 5,0-5,1 (1H, м), 7,05-7,15 (4H, м).
Пример 24
4-[(4-{3-[1-карбамоил-1-(метил)этилкарбамоил]пропил}фенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 2-амино-2-метилпропионамида вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,44 (6H, с), 1,8-1,95 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,4 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,44 (6H, с), 1,8-1,95 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,4 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 25
4-[(4-{3-[2-(ацетиламино)этилкарбамоил]пропил}фенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием N-ацетилэтилендиамина вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,8-1,95 (5H, м), 2,16 (2H, т, J=7,6 Гц), 2,57 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,2-3,45 (8H, м), 3,6-3,9 (4H, м), 5,0-5,15 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,8-1,95 (5H, м), 2,16 (2H, т, J=7,6 Гц), 2,57 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,2-3,45 (8H, м), 3,6-3,9 (4H, м), 5,0-5,15 (1H, м), 7,0-7,15 (4H, м).
Пример 26
4-({4-[(1Е)-3-карбамоилпроп-1-енил]фенил}метил)-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразола -D-глюкопиранозилокси)-5-изопропил-1Н-пиразола
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола (32 мг) в N,N-диметилформамиде (1 мл) добавляли аммонийхлорид (8 мг), 1-гидроксибензотриазол (9 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (15 мг) и триэтиламин (21 мг) и смесь перемешивали при комнатной температуре в течение ночи. Нерастворившееся вещество удаляли фильтрованием, к фильтрату добавляли 0,5 моль/л водного раствора гидроксида натрия (0,5 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/90), получая указанное в заголовке соединение (7 мг). -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола (32 мг) в N,N-диметилформамиде (1 мл) добавляли аммонийхлорид (8 мг), 1-гидроксибензотриазол (9 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (15 мг) и триэтиламин (21 мг) и смесь перемешивали при комнатной температуре в течение ночи. Нерастворившееся вещество удаляли фильтрованием, к фильтрату добавляли 0,5 моль/л водного раствора гидроксида натрия (0,5 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/90), получая указанное в заголовке соединение (7 мг).
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 2,8-2,95 (1H, м), 3,05-3,15 (2H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,15 (1H, м), 6,15-6,35 (1H, м), 6,48 (1H, д, J=15,6 Гц), 7,1-7,2 (2H, м), 7,2-7,3 (2H, м). м.д.: 1,05-1,2 (6H, м), 2,8-2,95 (1H, м), 3,05-3,15 (2H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,15 (1H, м), 6,15-6,35 (1H, м), 6,48 (1H, д, J=15,6 Гц), 7,1-7,2 (2H, м), 7,2-7,3 (2H, м).
Пример 27
3-( -D-глюкопиранозилокси)-4-[(4-{(1Е)-2-[2-гидрокси-1-гидроксиметил-1-(метил)этилкарбамоил]винил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{(1Е)-2-[2-гидрокси-1-гидроксиметил-1-(метил)этилкарбамоил]винил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 26, с использованием 2-амино-2-метил-1,3-пропандиола и 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксивинил]фенил}метил)-5-изопропил-1Н-пиразола вместо аммонийхлорида и 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксивинил]фенил}метил)-5-изопропил-1Н-пиразола вместо аммонийхлорида и 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,3 (3H, с), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (8H, м), 5,05-5,15 (1H, м), 6,64 (1H, д, J=15,9 Гц), 7,2-7,3 (2H, м), 7,4-7,5 (3H, м). м.д.: 1,05-1,2 (6H, м), 1,3 (3H, с), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (8H, м), 5,05-5,15 (1H, м), 6,64 (1H, д, J=15,9 Гц), 7,2-7,3 (2H, м), 7,4-7,5 (3H, м).
Пример 28
3-( -D-глюкопиранозилокси)-4-[(4-{(1Е)-2-[2-гидрокси-1,1-бис(гидроксиметил)этилкарбамоил]винил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{(1Е)-2-[2-гидрокси-1,1-бис(гидроксиметил)этилкарбамоил]винил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 26, с использованием трис(гидроксиметил)аминометана и 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксивинил]фенил}метил)-5-изопропил-1Н-пиразола вместо аммонийхлорида и 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксивинил]фенил}метил)-5-изопропил-1Н-пиразола вместо аммонийхлорида и 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,67 (1H, дд, J=12,1 Гц, 5,3 Гц), 3,7-3,9 (9H, м), 5,05-5,15 (1H, м), 6,69 (1H, д, J=15,7 Гц), 7,24 (2H, д, J=8,3 Гц), 7,45 (2H, д, J=8,3 Гц), 7,48 (1H, д, J=15,7 Гц). м.д.: 1,05-1,2 (6H, м), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,67 (1H, дд, J=12,1 Гц, 5,3 Гц), 3,7-3,9 (9H, м), 5,05-5,15 (1H, м), 6,69 (1H, д, J=15,7 Гц), 7,24 (2H, д, J=8,3 Гц), 7,45 (2H, д, J=8,3 Гц), 7,48 (1H, д, J=15,7 Гц).
Пример 29
4-[(4-{(1Е)-2-[1-карбамоил-1-(метил)этилкарбамоил]винил}фенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 26, с использованием 2-амино-2-метилпропионамида и 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксивинил]фенил}метил)-5-изопропил-1Н-пиразола вместо аммонийхлорида и 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксивинил]фенил}метил)-5-изопропил-1Н-пиразола вместо аммонийхлорида и 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,52 (6H, с), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,67 (1H, дд, J=11,9 Гц, 5,1 Гц), 3,7-3,9 (3H, м), 5,0-5,15 (1H, м), 6,6 (1H, д, J=15,8 Гц), 7,24 (2H, д, J=8,4 Гц), 7,4-7,5 (3H, м). м.д.: 1,05-1,15 (6H, м), 1,52 (6H, с), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,67 (1H, дд, J=11,9 Гц, 5,1 Гц), 3,7-3,9 (3H, м), 5,0-5,15 (1H, м), 6,6 (1H, д, J=15,8 Гц), 7,24 (2H, д, J=8,4 Гц), 7,4-7,5 (3H, м).
Пример 30
3-( -D-глюкопиранозилокси)-4-[(4-{3-[1-(2-гидроксиэтилкарбамоил)-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[1-(2-гидроксиэтилкарбамоил)-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
К раствору 2-бензилоксикарбониламино-2-метилпропионовой кислоты (0,5 г) в дихлорметане (5 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,61 г), 1-гидроксибензотриазол (0,43 г) и 2-аминоэтанол (1,16 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и полученную смесь экстрагировали дихлорметаном. Органический слой последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток растворяли в метаноле (5 мл). К раствору добавляли порошкообразный 10% палладий на угле (0,10 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 4 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением 2-(2-амино-2-метилпропиониламино)этанола (0,11 г). К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола (70 мг) в N,N-диметилформамиде (0,5 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (32 мг), 1-гидроксибензотриазол (23 мг) и 2-(2-амино-2-метилпропиониламино)этанол (0,11 г) и смесь перемешивали при комнатной температуре в течение ночи. Нерастворившееся вещество удаляли фильтрованием, к фильтрату добавляли 5 моль/л водного раствора гидроксида натрия (0,25 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. К смеси добавляли уксусную кислоту (0,09 мл) и смесь разбавляли водой (1 мл). Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/90) с получением 3-( -D-глюкопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола (70 мг) в N,N-диметилформамиде (0,5 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (32 мг), 1-гидроксибензотриазол (23 мг) и 2-(2-амино-2-метилпропиониламино)этанол (0,11 г) и смесь перемешивали при комнатной температуре в течение ночи. Нерастворившееся вещество удаляли фильтрованием, к фильтрату добавляли 5 моль/л водного раствора гидроксида натрия (0,25 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. К смеси добавляли уксусную кислоту (0,09 мл) и смесь разбавляли водой (1 мл). Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/90) с получением 3-( -D-глюкопиранозилокси)-4-(4-{(1Е)-3-[1-(2-гидроксиэтилкарбамоил)-1-метилэтилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразол (14 мг). Полученное вещество растворяли в метаноле (0,5 мл). К раствору добавляли порошкообразный 10% палладий на угле (7 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 2 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (11 мг). -D-глюкопиранозилокси)-4-(4-{(1Е)-3-[1-(2-гидроксиэтилкарбамоил)-1-метилэтилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразол (14 мг). Полученное вещество растворяли в метаноле (0,5 мл). К раствору добавляли порошкообразный 10% палладий на угле (7 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 2 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (11 мг).
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,6 Гц), 2,58 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (6H, м), 3,56 (2H, т, J=5,8 Гц), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,6 Гц), 2,58 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (6H, м), 3,56 (2H, т, J=5,8 Гц), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 31
4-[(4-{3-[1-карбамоилметилкарбамоил-1-(метил)этилкарбамоил]пропил}фенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 30, с использованием гидрохлорида глицинамида и триэтиламина вместо 2-аминоэтанола.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,22 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,7 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (6H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,22 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,7 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (6H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Сравнительный пример 6
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 3, с использованием ацетобром- -D-галактозы вместо ацетобром- -D-галактозы вместо ацетобром- -D-глюкозы. -D-глюкозы.
1H-ЯМР (CDCl3)  м.д.: 1,17 (6H, д, J=7,3 Гц), 1,88 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,17 (3H, с), 2,8-2,95 (1H, м), 3,59 (1H, д, J=16,0 Гц), 3,66 (1H, д, J=16,0 Гц), 4,05-4,25 (3H, м), 5,1 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,35-5,45 (2H, м), 5,57 (1H, д, J=8,2 Гц), 6,95-7,05 (2H, м), 7,3-7,4 (2H, м). м.д.: 1,17 (6H, д, J=7,3 Гц), 1,88 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,17 (3H, с), 2,8-2,95 (1H, м), 3,59 (1H, д, J=16,0 Гц), 3,66 (1H, д, J=16,0 Гц), 4,05-4,25 (3H, м), 5,1 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,35-5,45 (2H, м), 5,57 (1H, д, J=8,2 Гц), 6,95-7,05 (2H, м), 7,3-7,4 (2H, м).
Сравнительный пример 7
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 4, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6H, м), 1,83 (3H, с), 1,99 (3H, с), 2,00 (3H, с), 2,17 (3H, с), 2,8-2,95 (1H, м), 3,26 (2H, д, J=6,9 Гц), 3,6 (1H, д, J=16,2 Гц), 3,69 (1H, д, J=16,2 Гц), 4,05-4,3 (3H, м), 5,1 (1H, дд, J=10,1 Гц, 3,5 Гц), 5,3-5,5 (3H, м), 6,2-6,3 (1H, м), 6,45 (1H, д, J=15,9 Гц), 7,0-7,1 (2H, м), 7,2-7,3 (2H, м), 10,0-12,0 (1H, шир.). м.д.: 1,1-1,2 (6H, м), 1,83 (3H, с), 1,99 (3H, с), 2,00 (3H, с), 2,17 (3H, с), 2,8-2,95 (1H, м), 3,26 (2H, д, J=6,9 Гц), 3,6 (1H, д, J=16,2 Гц), 3,69 (1H, д, J=16,2 Гц), 4,05-4,3 (3H, м), 5,1 (1H, дд, J=10,1 Гц, 3,5 Гц), 5,3-5,5 (3H, м), 6,2-6,3 (1H, м), 6,45 (1H, д, J=15,9 Гц), 7,0-7,1 (2H, м), 7,2-7,3 (2H, м), 10,0-12,0 (1H, шир.).
Пример 32
3-( -D-галактопиранозилокси)-4-[(4-{3-[2-гидрокси-1-гидроксиметил-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-{3-[2-гидрокси-1-гидроксиметил-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и 2-амино-2-метил-1,3-пропандиола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и 2-амино-2-метил-1,3-пропандиола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,22 (3H, с), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,4 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,52 (1H, дд, J=9,8 Гц, 3,6 Гц), 3,55-3,8 (10H, м), 3,85-3,9 (1H, м), 5,05-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,15 (6H, м), 1,22 (3H, с), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,4 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,52 (1H, дд, J=9,8 Гц, 3,6 Гц), 3,55-3,8 (10H, м), 3,85-3,9 (1H, м), 5,05-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 33
4-[(4-{3-[1-карбамоил-1-(метил)этилкарбамоил]пропил}фенил)метил]-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,44 (6H, с), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,6 Гц), 2,57 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,52 (1H, дд, J=9,7 Гц, 3,4 Гц), 3,55-3,65 (1H, м), 3,65-3,8 (5H, м), 3,85-3,9 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,15 (6H, м), 1,44 (6H, с), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,6 Гц), 2,57 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,52 (1H, дд, J=9,7 Гц, 3,4 Гц), 3,55-3,65 (1H, м), 3,65-3,8 (5H, м), 3,85-3,9 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 34
4-[(4-{3-[2-аминоэтилсульфамоил)пропил]фенил}метил)-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Суспензию аллисульфоната натрия (2,0 г) в тионилхлориде (10,4 мл) нагревали при 70°С и перемешивали в течение 1,5 дней. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении. Полученный остаток растворяли в сухом тетрагидрофуране (10 мл) и растворитель удаляли при пониженном давлении. Полученный остаток снова растворяли в сухом тетрагидрофуране (10 мл) и растворитель удаляли при пониженном давлении, получая аллилсульфонилхлорид (1,26 г). К суспензии гидрохлорида N-бензилоксикарбонил-1,2-диаминоэтана (0,82 г) и триэтиламина (0,63 г) в дихлорметане (5 мл) добавляли аллилсульфонилхлорид (0,25 г) при комнатной температуре и смесь перемешивали в течение ночи. Реакцию гасили добавлением воды и органический слой полученной смеси отделяли. Органический слой последовательно промывали 1 моль/л хлористоводородной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и получали N-(2-бензилоксикарбониламиноэтил)аллилсульфонамид (82 мг). Полученное вещество растворяли в ацетонитриле (0,25 мл). К раствору добавляли 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразол (70 мг), триэтиламин (57 мг), ацетат палладия (II)(3 мг) и трис(2-метилфенил)фосфин (7 мг) и смесь кипятили с обратным холодильником в течение ночи в защищенном от света помещении. Растворитель удаляли при пониженном давлении и остаток растворяли в метаноле (0,5 мл). К раствору добавляли 5 моль/л водного раствора гидроксида натрия (0,25 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/метанол=90/10-10/90) с получением 4-({4-[(1Е)-3-(2-бензилоксикарбониламиноэтилсульфамоил)проп-1-енил]фенил}метил)-3-( -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразол (70 мг), триэтиламин (57 мг), ацетат палладия (II)(3 мг) и трис(2-метилфенил)фосфин (7 мг) и смесь кипятили с обратным холодильником в течение ночи в защищенном от света помещении. Растворитель удаляли при пониженном давлении и остаток растворяли в метаноле (0,5 мл). К раствору добавляли 5 моль/л водного раствора гидроксида натрия (0,25 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/метанол=90/10-10/90) с получением 4-({4-[(1Е)-3-(2-бензилоксикарбониламиноэтилсульфамоил)проп-1-енил]фенил}метил)-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразола (14 мг). Полученное вещество растворяли в метаноле (0,5 мл). К раствору добавляли порошкообразный 10% палладий на угле (5 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (10 мг). -D-глюкопиранозилокси)-5-изопропил-1Н-пиразола (14 мг). Полученное вещество растворяли в метаноле (0,5 мл). К раствору добавляли порошкообразный 10% палладий на угле (5 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (10 мг).
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 2,0-2,1 (2H, м), 2,65-2,75 (4H, м), 2,85-2,95 (1Н, м), 2,95-3,05 (4H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,05-7,2 (4H, м). м.д.: 1,1-1,2 (6H, м), 2,0-2,1 (2H, м), 2,65-2,75 (4H, м), 2,85-2,95 (1Н, м), 2,95-3,05 (4H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,05-7,2 (4H, м).
Пример 35
4-[(4-{3-[1-карбамоил-1-(метил)этилкарбамоил]пропил}фенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
К суспензии соли бензил-2-амино-2-метилпропионата и п-толуолсульфоновой кислоты (Tetrahedron, 1001, vol. 47,  2, рр. 259-270; 3,9 г) и триэтиламина (2,7 г) в дихлорметане (15 мл) добавляли аллилсульфонилхлорид (0,75 г) при комнатной температуре и смесь перемешивали в течение ночи. Реакцию гасили добавлением воды, и органический слой полученной смеси отделяли. Органический слой последовательно промывали 1 моль/л хлористо-водородной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и получали N-[1-бензилоксикарбонил-1-(метил)этил]аллилсульфонамид (0,48 г). К раствору 3-(2,3,4,6-тетра-О-ацетил- 2, рр. 259-270; 3,9 г) и триэтиламина (2,7 г) в дихлорметане (15 мл) добавляли аллилсульфонилхлорид (0,75 г) при комнатной температуре и смесь перемешивали в течение ночи. Реакцию гасили добавлением воды, и органический слой полученной смеси отделяли. Органический слой последовательно промывали 1 моль/л хлористо-водородной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и затем сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и получали N-[1-бензилоксикарбонил-1-(метил)этил]аллилсульфонамид (0,48 г). К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола (0,40 г), N-[1-бензилоксикарбонил-1-(метил)этил]аллилсульфонамида (0,48 г) в ацетонитриле (1 мл) добавляли триэтиламин (0,32 г), ацетат палладия (II)(14 мг) и трис(2-метилфенил)фосфин (39 мг) и смесь кипятили с обратным холодильником в течение ночи в защищенном от света помещении. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1-этилацетат) с получением 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола (0,40 г), N-[1-бензилоксикарбонил-1-(метил)этил]аллилсульфонамида (0,48 г) в ацетонитриле (1 мл) добавляли триэтиламин (0,32 г), ацетат палладия (II)(14 мг) и трис(2-метилфенил)фосфин (39 мг) и смесь кипятили с обратным холодильником в течение ночи в защищенном от света помещении. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1-этилацетат) с получением 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{(1Е)-3-[1-бензилоксикарбонил-1-(метил)этилсульфамоил]проп-1-енил}фенил)метил}-5-изопропил-1Н-пиразола (0,11 г). Полученное вещество растворяли в метаноле (1 мл). К раствору добавляли порошкообразный 10% палладий на угле (50 мг) и смесь перемешивали при комнатной температуре в течение 2 часов в атмосфере водорода. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{(1Е)-3-[1-бензилоксикарбонил-1-(метил)этилсульфамоил]проп-1-енил}фенил)метил}-5-изопропил-1Н-пиразола (0,11 г). Полученное вещество растворяли в метаноле (1 мл). К раствору добавляли порошкообразный 10% палладий на угле (50 мг) и смесь перемешивали при комнатной температуре в течение 2 часов в атмосфере водорода. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилсульфамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола (95 мг). К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилсульфамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола (95 мг). К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилсульфамоил]пропил}фенил)метил}-5-изопропил-1Н-пиразола (50 мг) в N,N-диметилформамиде (0,5 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (19 мг) и 1-гидроксибензотриазол (13 мг). В смесь в течение примерно 2 минут барботировали газообразный аммиак и полученную смесь перемешивали при комнатной температуре в течение ночи. Нерастворившееся вещество удаляли фильтрованием. К фильтрату добавляли 5 моль/л водного раствора гидроксида натрия (0,25 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (0,09 мл) и смесь разбавляли водой (1 мл). Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/90) с получением указанного в заголовке соединения (14 мг). -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилсульфамоил]пропил}фенил)метил}-5-изопропил-1Н-пиразола (50 мг) в N,N-диметилформамиде (0,5 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (19 мг) и 1-гидроксибензотриазол (13 мг). В смесь в течение примерно 2 минут барботировали газообразный аммиак и полученную смесь перемешивали при комнатной температуре в течение ночи. Нерастворившееся вещество удаляли фильтрованием. К фильтрату добавляли 5 моль/л водного раствора гидроксида натрия (0,25 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (0,09 мл) и смесь разбавляли водой (1 мл). Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/90) с получением указанного в заголовке соединения (14 мг).
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,43 (6H, с), 2,0-2,15 (2H, м), 2,7 (2H, т, J=7,4 Гц), 2,8-2,95 (1H, м), 2,95-3,1 (2H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,15 (1H, м), 7,05-7,2 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,43 (6H, с), 2,0-2,15 (2H, м), 2,7 (2H, т, J=7,4 Гц), 2,8-2,95 (1H, м), 2,95-3,1 (2H, м), 3,25-3,45 (4H, м), 3,6-3,9 (4H, м), 5,0-5,15 (1H, м), 7,05-7,2 (4H, м).
Сравнительный пример 8
Бензилгидроксипивалат
К суспензии гидроксипивалиновой кислоты (3 г) и карбоната калия (3,9 г) в N,N-диметилформамиде (25 мл) добавляли бензилбромид (2,9 мл) и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировади диэтиловым эфиром. Органический слой два раза промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и получали указанное в заголовке соединение (4,7 г).
1H-ЯМР (CDCl3)  м.д.: 1,22 (6H, с), 2,33 (1H, т, J=6,7 Гц), 3,58 (2H, д, J=6,7 Гц), 5,15 (2H, с), 7,3-7,4 (5H, м). м.д.: 1,22 (6H, с), 2,33 (1H, т, J=6,7 Гц), 3,58 (2H, д, J=6,7 Гц), 5,15 (2H, с), 7,3-7,4 (5H, м).
Сравнительный пример 9
4-(2-Бензилоксикарбонил-2-метипропокси)бензальдегид
К раствору 4-гидроксибензальдегида (2,7 г), бензилгидроксипивалата (4,7 г) и трифенилфосфина (6,4 г) в тетрагидрофуране (22 мл) добавляли диэтилазодикарбоксилат (40% толуольный раствор, 11 мл) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь выливали в воду и полученную смесь экстрагировади диэтиловым эфиром. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=6/1-4/1) с получением указанного в заголовке соединения (0,97 г).
1H-ЯМР (CDCl3)  м.д.: 1,36 (6H, с), 4,07 (2H, с), 5,15 (2H, с), 6,9-7,0 (2H, м), 7,2-7,35 (5H, м), 7,75-7,85 (2H, м), 9,89 (1H, с). м.д.: 1,36 (6H, с), 4,07 (2H, с), 5,15 (2H, с), 6,9-7,0 (2H, м), 7,2-7,35 (5H, м), 7,75-7,85 (2H, м), 9,89 (1H, с).
Сравнительный пример 10
[4-(2-бензилоксикарбонил-2-метипропокси)фенил]метанол
К раствору 4-(2-бензилоксикарбонил-2-метилпропокси)бензальдегида (0,97 г) в тетрагидрофуране (20 мл) добавляли борогидрид натрия (59 мг) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали 0,5 моль/л хлористо-водородной кислоты и полученную смесь экстрагировади диэтиловым эфиром. Органический слой последовательно промывали водой и насыщенным раствором соли и затем сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=6/1-3/2) с получением указанного в заголовке соединения (0,95 г).
1H-ЯМР (CDCl3)  м.д.: 1,34 (6H, с), 1,51 (1H, т, J=5,9 Гц), 3,99 (2H, с), 4,62 (2H, д, J=5,9 Гц), 5,15 (2H, с), 6,8-6,9 (2H, м), 7,25-7,35 (7H, м). м.д.: 1,34 (6H, с), 1,51 (1H, т, J=5,9 Гц), 3,99 (2H, с), 4,62 (2H, д, J=5,9 Гц), 5,15 (2H, с), 6,8-6,9 (2H, м), 7,25-7,35 (7H, м).
Сравнительный пример 11
4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-он
К раствору [4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метанола (0,95 г) в тетрагидрофуране (8 мл) добавляли триэтиламин (0,48 мл) и метансульфонилхлорид (0,26 мл) при охлаждении льдом и смесь перемешивали в течение 1 часа. Нерастворившееся вещество удаляли фильтрованием. Полученный раствор [4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метилмезилата в тетрагидрофуране добавляли к суспензии гидрида натрия (60%, 139 мг) и этил-4-метил-3-оксопентаноата (0,52 г) в тетрагидрофуране (15 мл) и смесь кипятили с обратным холодильником в течение 15 часов. К реакционной смеси добавляли 1 моль/л хлористо-водородной кислоты и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении. К раствору полученного остатка в этаноле (10 мл) добавляли моногидрат гидразина (0,16 мл) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=30/1-20/1) с получением указанного в заголовке соединения (0,25 г).
1H-ЯМР (CDCl3)  м.д.: 1,15 (6H, д, J=6,9 Гц), 1,32 (6H, с), 2,85-2,95 (1H, м), 3,66 (2H, с), 3,94 (2H, с), 5,13 (2H, с), 6,7-6,8 (2H, м), 7,05-7,15 (2H, м), 7,2-7,35 (5H, м). м.д.: 1,15 (6H, д, J=6,9 Гц), 1,32 (6H, с), 2,85-2,95 (1H, м), 3,66 (2H, с), 3,94 (2H, с), 5,13 (2H, с), 6,7-6,8 (2H, м), 7,05-7,15 (2H, м), 7,2-7,35 (5H, м).
Сравнительный пример 12
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразол
К раствору 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она (0,25 г), ацетобром- -D-глюкозы (0,48 г) и бензилтри(н-бутил)аммонийхлорида (0,18 г) в дихлорметане (5 мл) добавляли 5 моль/л водного раствора гидроксида натрия (0,35 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь очищали колоночной хроматографией на аминопропилированном силикагеле (элюент: н-гексан/этилацетат=1/1-1/3) с получением указанного в заголовке соединения (0,28 г). -D-глюкозы (0,48 г) и бензилтри(н-бутил)аммонийхлорида (0,18 г) в дихлорметане (5 мл) добавляли 5 моль/л водного раствора гидроксида натрия (0,35 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь очищали колоночной хроматографией на аминопропилированном силикагеле (элюент: н-гексан/этилацетат=1/1-1/3) с получением указанного в заголовке соединения (0,28 г).
1H-ЯМР (CDCl3)  м.д.: 1,16 (6H, д, J=7,1 Гц), 1,32 (6H, с), 1,86 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, С), 2,85-2,95 (1H, м), 3,56 (1H, д, J=16,0 Гц), 3,62 (1H, д, J=16,0 Гц), 3,8-3,9 (1H, м), 3,92 (1H, д, J=8,7 Гц), 3,94 (1H, д, J=8,7 Гц), 4,15 (1H, дд, J=12,5 Гц, 2, 4 Гц), 4,31 (1H, дд, J=12,5 Гц, 4,2 Гц), 5,13 (2H, с), 5,15-5,3 (3H, м), 5,55-5,65 (1H, м), 6,7-6,75 (2H, м), 6,95-7,05 (2H, м), 7,25-7,35 (5H, м). м.д.: 1,16 (6H, д, J=7,1 Гц), 1,32 (6H, с), 1,86 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, С), 2,85-2,95 (1H, м), 3,56 (1H, д, J=16,0 Гц), 3,62 (1H, д, J=16,0 Гц), 3,8-3,9 (1H, м), 3,92 (1H, д, J=8,7 Гц), 3,94 (1H, д, J=8,7 Гц), 4,15 (1H, дд, J=12,5 Гц, 2, 4 Гц), 4,31 (1H, дд, J=12,5 Гц, 4,2 Гц), 5,13 (2H, с), 5,15-5,3 (3H, м), 5,55-5,65 (1H, м), 6,7-6,75 (2H, м), 6,95-7,05 (2H, м), 7,25-7,35 (5H, м).
Сравнительный пример 13
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбокси-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-{[4-(2-карбокси-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразол
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразол (0,28 г) растворяли в метаноле (6 мл). К раствору добавляли порошкообразный 10% палладий на угле (54 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении, получая указанное в заголовке соединение (0,25 г). -D-глюкопиранозилокси)-4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразол (0,28 г) растворяли в метаноле (6 мл). К раствору добавляли порошкообразный 10% палладий на угле (54 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении, получая указанное в заголовке соединение (0,25 г).
1H-ЯМР (CDCl3)  м.д.: 1,16 (6Н, a, J=6,7 Гц), 1,33 (6Н, с), 1,88 (3Н, с), 2,01 (3Н, с), 2,03 (3Н, с), 2,05 (3Н, с), 2,85-3,0 (1Н, м), 3,54 (1H, д, J=15,8 Гц), 3,6 (1H, д, J=15,8 Гц), 3,8-3,9 (1H, м), 3,91 (1H, д, J=8,8 Гц), 3,93 (1H, д, J=8,8 Гц), 4,15 (1H, дд, J=12,5 Гц, 2,0 Гц), 4,32 (1H, дд, J=12,5H, 4,0 Гц), 5,15-5,3 (3H, м), 5,4-5,45 (1H, м), 6,7-6,8 (2H, м), 6,95-7,05 (2H, м). м.д.: 1,16 (6Н, a, J=6,7 Гц), 1,33 (6Н, с), 1,88 (3Н, с), 2,01 (3Н, с), 2,03 (3Н, с), 2,05 (3Н, с), 2,85-3,0 (1Н, м), 3,54 (1H, д, J=15,8 Гц), 3,6 (1H, д, J=15,8 Гц), 3,8-3,9 (1H, м), 3,91 (1H, д, J=8,8 Гц), 3,93 (1H, д, J=8,8 Гц), 4,15 (1H, дд, J=12,5 Гц, 2,0 Гц), 4,32 (1H, дд, J=12,5H, 4,0 Гц), 5,15-5,3 (3H, м), 5,4-5,45 (1H, м), 6,7-6,8 (2H, м), 6,95-7,05 (2H, м).
Пример 36
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбамоил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбамоил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразол
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбокси-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразола (0,13 г) в N,N-диметилформамиде (2 мл) добавляли гидрохлорид L-аланинамида (46 мг), триэтиламин (0,08 мл), 1-гидроксибензотриазол (38 мг) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,11 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Органический слой последовательно промывали водой, насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли и затем сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=20/1-10/1) с получением указанного в заголовке соединения (0,14 г). -D-глюкопиранозилокси)-4-{[4-(2-карбокси-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразола (0,13 г) в N,N-диметилформамиде (2 мл) добавляли гидрохлорид L-аланинамида (46 мг), триэтиламин (0,08 мл), 1-гидроксибензотриазол (38 мг) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,11 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Органический слой последовательно промывали водой, насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли и затем сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=20/1-10/1) с получением указанного в заголовке соединения (0,14 г).
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6H, м), 1,29 (3H, с), 1,32 (3H, с),1,38 (3H, д, J=7,5 Гц), 1,89 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,85-2,95 (1H, м), 3,57 (1H, д, J=16,0 Гц), 3,62 (1H, д, J=16,0 Гц), 3,8-3,9 (2H, м), 3,94 (1H, д, J=9,1 Гц), 4,14 (1H, дд, J=12,5 Гц, 2,4 Гц), 4,3 (1H, дд, J=12,5 Гц, 4,1 Гц), 4,4-4,55 (1H, м), 5,15-5,4 (4H, м), 5,58 (1H, д, J=8,0 Гц), 6,2-6,35 (1H, шир.), 6,67 (1H, д, J=7,3 Гц), 6,7-6,8 (2H, м), 7,0-7,1 (2H, м). м.д.: 1,1-1,2 (6H, м), 1,29 (3H, с), 1,32 (3H, с),1,38 (3H, д, J=7,5 Гц), 1,89 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,85-2,95 (1H, м), 3,57 (1H, д, J=16,0 Гц), 3,62 (1H, д, J=16,0 Гц), 3,8-3,9 (2H, м), 3,94 (1H, д, J=9,1 Гц), 4,14 (1H, дд, J=12,5 Гц, 2,4 Гц), 4,3 (1H, дд, J=12,5 Гц, 4,1 Гц), 4,4-4,55 (1H, м), 5,15-5,4 (4H, м), 5,58 (1H, д, J=8,0 Гц), 6,2-6,35 (1H, шир.), 6,67 (1H, д, J=7,3 Гц), 6,7-6,8 (2H, м), 7,0-7,1 (2H, м).
Пример 37
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-гидрокси-1,1-ди(метил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-гидрокси-1,1-ди(метил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 36, с использованием 2-амино-2-метил-1-пропанола вместо гидрохлорида L-аланинамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6Н, м), 1,25 (6Н, с), 1,27 (6Н, с), 1,89 (3Н, с), 1,97 (3Н, с), 2,01 (3Н, с), 2,02 (3Н, с), 2,85-3,0 (1Н, м), 3,5 (2H, с), 3,6 (2H, с), 3,89 (2H, с), 3,9-4,0 (1H, м), 4,11 (1H, дд, J=12,3 Гц, 2,2 Гц), 4,3 (1H, дд, J=12,3 Гц, 4,0 Гц), 5,05-5,15 (2H, м), 5,25-5,35 (1H, м), 5,48 (1H, д, J=7,9 Гц), 6,75-6,9 (3H, м), 7,0-7,1 (2H, м). м.д.: 1,1-1,2 (6Н, м), 1,25 (6Н, с), 1,27 (6Н, с), 1,89 (3Н, с), 1,97 (3Н, с), 2,01 (3Н, с), 2,02 (3Н, с), 2,85-3,0 (1Н, м), 3,5 (2H, с), 3,6 (2H, с), 3,89 (2H, с), 3,9-4,0 (1H, м), 4,11 (1H, дд, J=12,3 Гц, 2,2 Гц), 4,3 (1H, дд, J=12,3 Гц, 4,0 Гц), 5,05-5,15 (2H, м), 5,25-5,35 (1H, м), 5,48 (1H, д, J=7,9 Гц), 6,75-6,9 (3H, м), 7,0-7,1 (2H, м).
Пример 38
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбамоил-1-(метил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[1-карбамоил-1-(метил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 36, с использованием 2-амино-2-метилпропионамида вместо гидрохлорида L-аланинамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,27 (6H, с), 1,49 (6H, с), 1,89 (3H, с), 1,97 (3H, с), 2,01 (3H, с), 2,02 (3H, с), 2,85-3,0 (1H, м), 3,6 (2H, с), 3,9-4,0 (3H, м), 4,11 (1H, дд, J=12,3 Гц, 2,4 Гц), 4,3 (1H, дд, J=12,3 Гц, 4,0 Гц), 5,05-5,15 (2H, м), 5,25-5,35 (1H, м), 5,48 (1H, д, J=8,4 Гц), 6,75-6,85 (2H, м), 7,0-7,1 (2H, м). м.д.: 1,1-1,2 (6H, м), 1,27 (6H, с), 1,49 (6H, с), 1,89 (3H, с), 1,97 (3H, с), 2,01 (3H, с), 2,02 (3H, с), 2,85-3,0 (1H, м), 3,6 (2H, с), 3,9-4,0 (3H, м), 4,11 (1H, дд, J=12,3 Гц, 2,4 Гц), 4,3 (1H, дд, J=12,3 Гц, 4,0 Гц), 5,05-5,15 (2H, м), 5,25-5,35 (1H, м), 5,48 (1H, д, J=8,4 Гц), 6,75-6,85 (2H, м), 7,0-7,1 (2H, м).
Пример 39
4-[(4-{2-[(S)-1-(карбамоил)этилкарбамоил]-2-метилпропокси}фенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбамоил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразола (0,14 г) в метаноле (4 мл) добавляли метоксид натрия (28% метанольный раствор, 0,04 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением указанного в заголовке соединения (94 мг). -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбамоил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразола (0,14 г) в метаноле (4 мл) добавляли метоксид натрия (28% метанольный раствор, 0,04 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) с получением указанного в заголовке соединения (94 мг).
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,29 (3H, с), 1,3 (3H, с), 1,35 (3H, д, J=7,5 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,8 (3H, м), 3,8-3,9 (1H, м), 3,94 (2H, с), 4,3-4,45 (1H, м), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м). м.д.: 1,05-1,15 (6H, м), 1,29 (3H, с), 1,3 (3H, с), 1,35 (3H, д, J=7,5 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,8 (3H, м), 3,8-3,9 (1H, м), 3,94 (2H, с), 4,3-4,45 (1H, м), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 40
3-( -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-ди(метил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-ди(метил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 39, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-(диметил)этилкарбамоил]-2-метилпропокси}фенил]метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-(диметил)этилкарбамоил]-2-метилпропокси}фенил]метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбамоил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбамоил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразола.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,25 (6H, с), 1,27 (6H, с), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,5 (2H, с), 3,6-3,7 (2H, м), 3,74 (1H, д, J=16,0 Гц), 3,8-3,95 (3H, м), 5,0-5,15 (1H, м), 6,75-6,9 (2H, м), 7,05-7,15 (2H, м). м.д.: 1,05-1,15 (6H, м), 1,25 (6H, с), 1,27 (6H, с), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,5 (2H, с), 3,6-3,7 (2H, м), 3,74 (1H, д, J=16,0 Гц), 3,8-3,95 (3H, м), 5,0-5,15 (1H, м), 6,75-6,9 (2H, м), 7,05-7,15 (2H, м).
Пример 41
4-[(4-{2-[1-карбамоил-1-(метил)этилкарбамоил]-2-метилпропокси}фенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 39, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбамоил-1-(метил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбамоил-1-(метил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбамоил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбамоил)этилкарбамоил]-2-метилпропокси}фенил)метил]-5-изопропил-1Н-пиразола.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6Н, м), 1,27 (6Н, с), 1,49 (6Н, с), 2,8-2,95 (1Н, м), 3,25-3,45 (4H, м), 3,6-3,8 (3H, м), 3,8-3,9 (1H, м), 3,93 (2H, с), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м). м.д.: 1,05-1,15 (6Н, м), 1,27 (6Н, с), 1,49 (6Н, с), 2,8-2,95 (1Н, м), 3,25-3,45 (4H, м), 3,6-3,8 (3H, м), 3,8-3,9 (1H, м), 3,93 (2H, с), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 42
3-( -D-глюкопиранозилокси)-4-{[4-(3-{1-[2-гидрокси-1-(гидроксиметил)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-{[4-(3-{1-[2-гидрокси-1-(гидроксиметил)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 30, с использованием 2-амино-1,3-пропандиола вместо 2-аминоэтанола.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,43 (6H, с), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,5-3,95 (9H, м), 5,0-5,15 (1H, м), 7,0-7,2 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,43 (6H, с), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,5-3,95 (9H, м), 5,0-5,15 (1H, м), 7,0-7,2 (4H, м).
Пример 43
3-( -D-глюкопиранозилокси)-4-{[4-(3-{1-[2-гидрокси-1,1-бис(гидроксиметил)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-{[4-(3-{1-[2-гидрокси-1,1-бис(гидроксиметил)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 30, с использованием трис(гидроксиметил)аминометана вместо 2-аминоэтанола.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-3,0 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (10H, м), 5,0-5,15 (1H, м), 7,0-7,2 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-3,0 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (10H, м), 5,0-5,15 (1H, м), 7,0-7,2 (4H, м).
Сравнительный пример 14
4-бром-2-метилбензиловый спирт
К раствору 4-бром-2-метилбензойной кислоты (10 г) в тетрагидрофуране (60 мл) добавляли комплекс боран-диметилсульфид (7,07 г) при охлаждении льдом. Реакционную смесь перемешивали при комнатной температуре в течение 5 минут и при 75°С в течение 2 дней. Реакционную смесь охлаждали до комнатной температуры. К реакционной смеси добавляли насыщенный водный раствор карбоната калия и органический слой отделяли. Органический слой промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и получали указанное в заголовке соединение (9,0 г).
1H-ЯМР (CDCl3)  м.д.: 1,55-1,65 (1H, м), 2,36 (3H, с), 4,64 (2H, д, J=5,4 Гц), 7,2-7,25 (1H, м), 7,3-7,35 (2H, м). м.д.: 1,55-1,65 (1H, м), 2,36 (3H, с), 4,64 (2H, д, J=5,4 Гц), 7,2-7,25 (1H, м), 7,3-7,35 (2H, м).
Сравнительный пример 15
4-[(4-бром-2-метилфенил)метил]-1,2-дигидро-5-изопропил-3Н-пиразол-3-он
К раствору 4-бром-2-метилбензилового спирта (9,0 г) в дихлорметане (50 мл) добавляли тионилхлорид (3,8 мл) при охлаждении льдом и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и получали 4-бром-2-метилбензилхлорид (9,8 г). К суспензии гидрида натрия (60%, 2,1 г) в тетрагидрофуране (90 мл) добавляли этил-4-метил-3-оксопентаноат (7,5 г) при охлаждении льдом и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 4-бром-2-метилбензилхлорид (9,8 г) и полученную смесь перемешивали при 70°С в течение 3 дней. Реакционную смесь выливали в насыщенный водный раствор аммонийхлорида и смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении. К раствору остатка в толуоле (20 мл) добавляли моногидрат гидразина (5,4 мл) и смесь перемешивали при 90°С в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток обрабатывали смесью н-гексан-диэтиловый эфир (10/1) для кристаллизации. Кристаллы собирали фильтрованием и последовательно промывали н-гексаном, водой и н-гексаном, затем сушили при пониженном давлении, получая указанное в заголовке соединение (12,4 г).
1H-ЯМР (ДМСО-d6)  м.д.: 1,05 (6H, д, J=6,8 Гц), 2,28 (3H, с), 2,65-2,8 (1H, м), 3,45 (2H, с), 6,82 (1H, д, J=8,2 Гц), 7,24 (1H, дд, J=8,2 Гц, 1,8 Гц), 7,33 (1H, д, J=1,8 Гц), 8,5-12,0 (2H, шир.). м.д.: 1,05 (6H, д, J=6,8 Гц), 2,28 (3H, с), 2,65-2,8 (1H, м), 3,45 (2H, с), 6,82 (1H, д, J=8,2 Гц), 7,24 (1H, дд, J=8,2 Гц, 1,8 Гц), 7,33 (1H, д, J=1,8 Гц), 8,5-12,0 (2H, шир.).
Сравнительный пример 16
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бром-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-бром-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 3, с использованием 4-[(4-бром-2-метилфенил)метил]-1,2-дигидро-5-изопропил-3Н-пиразол-3-она вместо 4-[(4-бромфенил)метил]-1,2-дигидро-5-изопропил-3Н-пиразол-3-она.
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6Н, м), 1,81 (3Н, с), 1,99 (3Н, с), 2,02 (3Н, с), 2,06 (3Н, с), 2,28 (3Н, с), 2,75-2,9 (1Н, м), 3,49 (1H, д, J=16,7 Гц), 3,59 (1H, д, J=16,7 Гц), 3,8-3,9 (1H, м), 4,05-4,2 (1H, м), 4,3 (1H, дд, J=12,4 Гц, 4,0 Гц), 5,1-5,3 (3H, м), 5,5-5,6 (1H, м), 6,76 (1H, д, J=8,2 Гц), 7,1-7,2 (1H, м), 7,25-7,3 (1H, м). м.д.: 1,1-1,2 (6Н, м), 1,81 (3Н, с), 1,99 (3Н, с), 2,02 (3Н, с), 2,06 (3Н, с), 2,28 (3Н, с), 2,75-2,9 (1Н, м), 3,49 (1H, д, J=16,7 Гц), 3,59 (1H, д, J=16,7 Гц), 3,8-3,9 (1H, м), 4,05-4,2 (1H, м), 4,3 (1H, дд, J=12,4 Гц, 4,0 Гц), 5,1-5,3 (3H, м), 5,5-5,6 (1H, м), 6,76 (1H, д, J=8,2 Гц), 7,1-7,2 (1H, м), 7,25-7,3 (1H, м).
Сравнительный пример 17
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]-2-метилфенил}метил)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]-2-метилфенил}метил)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 4, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бром-2-метилфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бром-2-метилфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6H, м), 1,78 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,06 (3H, с), 2,29 (3H, с), 2,75-2,9 (1H, м), 3,13 (2H, д, J=7,3 Гц), 3,54 (1H, д, J=16,8 Гц), 3,64 (1H, д, J=16,8 Гц), 3,8-3,9 (1H, м), 4,05-4,15 (1H, м), 4,25-4,35 (1H, м), 5,1-5,3 (3H, м), 5,5-5,6 (1H, м), 6,15-6,25 (1H, м), 6,46 (1H, д, J=16,1 Гц), 6,85 (1H, д, J=7,9 Гц), 7,05 (1H, д, J=7,9 Гц), 7,15 (1H, с). м.д.: 1,1-1,2 (6H, м), 1,78 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,06 (3H, с), 2,29 (3H, с), 2,75-2,9 (1H, м), 3,13 (2H, д, J=7,3 Гц), 3,54 (1H, д, J=16,8 Гц), 3,64 (1H, д, J=16,8 Гц), 3,8-3,9 (1H, м), 4,05-4,15 (1H, м), 4,25-4,35 (1H, м), 5,1-5,3 (3H, м), 5,5-5,6 (1H, м), 6,15-6,25 (1H, м), 6,46 (1H, д, J=16,1 Гц), 6,85 (1H, д, J=7,9 Гц), 7,05 (1H, д, J=7,9 Гц), 7,15 (1H, с).
Сравнительный пример 18
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1E)-2-карбоксивинил]-2-метилфенил}метил)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-({4-[(1E)-2-карбоксивинил]-2-метилфенил}метил)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 4, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бром-2-метилфенил)метил]-5-изопропил-1Н-пиразола и акриловой кислоты вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бром-2-метилфенил)метил]-5-изопропил-1Н-пиразола и акриловой кислоты вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола и 3-бутеновой кислоты, соответственно. -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола и 3-бутеновой кислоты, соответственно.
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6H, м), 1,73 (3H, с), 1,99 (3H, с), 2,04 (3H, с), 2,06 (3H, с), 2,35 (3H, с), 2,8-2,9 (1H, м), 3,58 (1H, д, J=17,2 Гц), 3,69 (1H, д, J=17,2 Гц), 3,85-3,95 (1H, м), 4,21 (1H, дд, J=12,4 Гц, 2,2 Гц), 4,35 (1H, дд, J=12,4 Гц, 3,9 Гц), 5,15-5,3 (3H, м), 5,45 (1H, д, J=7,8 Гц), 6,4 (1H, д, J=15,8 Гц), 6,93 (1H, д, J=7,8 Гц), 7,2-7,3 (1H, м), 7,3-7,4 (1H, м), 7,69 (1H, д, J=15,8 Гц). м.д.: 1,1-1,2 (6H, м), 1,73 (3H, с), 1,99 (3H, с), 2,04 (3H, с), 2,06 (3H, с), 2,35 (3H, с), 2,8-2,9 (1H, м), 3,58 (1H, д, J=17,2 Гц), 3,69 (1H, д, J=17,2 Гц), 3,85-3,95 (1H, м), 4,21 (1H, дд, J=12,4 Гц, 2,2 Гц), 4,35 (1H, дд, J=12,4 Гц, 3,9 Гц), 5,15-5,3 (3H, м), 5,45 (1H, д, J=7,8 Гц), 6,4 (1H, д, J=15,8 Гц), 6,93 (1H, д, J=7,8 Гц), 7,2-7,3 (1H, м), 7,3-7,4 (1H, м), 7,69 (1H, д, J=15,8 Гц).
Пример 44
4-[(4-{3-[1-карбамоил-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]-2-метилфенил}метил)-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]-2-метилфенил}метил)-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,44 (6H, с), 1,8-1,9 (2H, м), 2,2 (2H, т, J=7,6 Гц), 2,3 (3H, С), 2,55 (2H, т, J=7,6 Гц), 2,75-2,9 (1H, м), 3,2-3,4 (4H, м), 3,6-3,9 (4H, м), 4,95-5,1 (1H, м), 6,8-6,9 (2H, м), 6,9-7,0 (1H, м). м.д.: 1,1-1,2 (6H, м), 1,44 (6H, с), 1,8-1,9 (2H, м), 2,2 (2H, т, J=7,6 Гц), 2,3 (3H, С), 2,55 (2H, т, J=7,6 Гц), 2,75-2,9 (1H, м), 3,2-3,4 (4H, м), 3,6-3,9 (4H, м), 4,95-5,1 (1H, м), 6,8-6,9 (2H, м), 6,9-7,0 (1H, м).
Пример 45
4-[(4-{(1Е)-2-[1-карбамоил-1-(метил)этилкарбамоил]винил}-2-метилфенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 26, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-2-карбоксивинил]-2-метилфенил}метил)-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-2-карбоксивинил]-2-метилфенил}метил)-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и аммонийхлорида, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и аммонийхлорида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,52 (6H, с), 2,36 (3H, с), 2,75-2,9 (1H, м), 3,2-3,4 (4H, м), 3,6-3,85 (4H, м), 5,0-5,1 (1H, м), 6,58 (1H, д, J=15,8 Гц), 7,0 (1H, д, J=7,9 Гц), 7,2-7,3 (1H, м), 7,33 (1H, с), 7,43 (1H, д, J=15,8 Гц). м.д.: 1,05-1,15 (6H, м), 1,52 (6H, с), 2,36 (3H, с), 2,75-2,9 (1H, м), 3,2-3,4 (4H, м), 3,6-3,85 (4H, м), 5,0-5,1 (1H, м), 6,58 (1H, д, J=15,8 Гц), 7,0 (1H, д, J=7,9 Гц), 7,2-7,3 (1H, м), 7,33 (1H, с), 7,43 (1H, д, J=15,8 Гц).
Пример 46
3-( -D-глюкопиранозилокси)-4-[(4-{(1Е)-2-[2-гидрокси-1-гидроксиметил-1-(метил)этилкарбамоил]винил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{(1Е)-2-[2-гидрокси-1-гидроксиметил-1-(метил)этилкарбамоил]винил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 26, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-2-карбоксивинил]-2-метилфенил}метил)-5-изопропил-1Н-пиразола и 2-амино-2-метил-1,3-пропандиола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-2-карбоксивинил]-2-метилфенил}метил)-5-изопропил-1Н-пиразола и 2-амино-2-метил-1,3-пропандиола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и аммонийхлорида, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и аммонийхлорида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,3 (3H, с), 2,36 (3H, с), 2,75-2,9 (1H, м), 3,25-3,45 (4H, м), 3,6-3,85 (8H, м), 5,04 (1H, д, J=6,1 Гц), 6,62 (1H, д, J=15,5 Гц), 6,99 (1H, д, J=7,6 Гц), 7,26 (1H, д, J=7,6 Гц), 7,32 (1H, с), 7,42 (1H, д, J=15,5 Гц). м.д.: 1,05-1,15 (6H, м), 1,3 (3H, с), 2,36 (3H, с), 2,75-2,9 (1H, м), 3,25-3,45 (4H, м), 3,6-3,85 (8H, м), 5,04 (1H, д, J=6,1 Гц), 6,62 (1H, д, J=15,5 Гц), 6,99 (1H, д, J=7,6 Гц), 7,26 (1H, д, J=7,6 Гц), 7,32 (1H, с), 7,42 (1H, д, J=15,5 Гц).
Пример 47
3-( -D-глюкопиранозилокси)-5-изопропил-4-[(4-{(1Е)-2-[2-(сульфамоиламино)этилкарбамоил]винил}-2-метилфенил)метил]-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-[(4-{(1Е)-2-[2-(сульфамоиламино)этилкарбамоил]винил}-2-метилфенил)метил]-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 26, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксивинил]-2-метилфенил}метил)-5-изопропил-1Н-пиразола и N-сульфамоилэтилендиамина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксивинил]-2-метилфенил}метил)-5-изопропил-1Н-пиразола и N-сульфамоилэтилендиамина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и аммонийхлорида, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и аммонийхлорида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 2,36 (3H, с), 2,75-2,9 (1H, м), 3,19 (2H, т, J=6,3 Гц), 3,25-3,4 (4H, м), 3,47 (2H, т, J=6,3 Гц), 3,6-3,7 (1H, м), 3,7-3,9 (3H, м), 5,04 (1H, д, J=7,3 Гц), 6,54 (1H, д, J=15,7 Гц), 7,0 (1H, д, J=7,9 Гц), 7,27 (1H, д, J=7,9 Гц), 7,33 (1H, с), 7,47 (1H, д, J=15,7 Гц). м.д.: 1,05-1,2 (6H, м), 2,36 (3H, с), 2,75-2,9 (1H, м), 3,19 (2H, т, J=6,3 Гц), 3,25-3,4 (4H, м), 3,47 (2H, т, J=6,3 Гц), 3,6-3,7 (1H, м), 3,7-3,9 (3H, м), 5,04 (1H, д, J=7,3 Гц), 6,54 (1H, д, J=15,7 Гц), 7,0 (1H, д, J=7,9 Гц), 7,27 (1H, д, J=7,9 Гц), 7,33 (1H, с), 7,47 (1H, д, J=15,7 Гц).
Сравнительный пример 19
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола (0,4 г) в N,N-диметилформамиде (2 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,18 г), 1-гидроксибензотриазол (0,13 г), соль п-толуолсульфоновой кислоты бензил-2-амино-2-метилпропионата и (1,16 г) и триэтиламин (0,64 г) при комнатной температуре и смесь перемешивали в течение ночи. К реакционной смеси добавляли воду и полученную смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1-этилацетат) с получением 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола (0,4 г) в N,N-диметилформамиде (2 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,18 г), 1-гидроксибензотриазол (0,13 г), соль п-толуолсульфоновой кислоты бензил-2-амино-2-метилпропионата и (1,16 г) и триэтиламин (0,64 г) при комнатной температуре и смесь перемешивали в течение ночи. К реакционной смеси добавляли воду и полученную смесь экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1-этилацетат) с получением 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразола (0,18 г). Полученное вещество растворяли в метаноле (2 мл). К раствору добавляли порошкообразный 10% палладий на угле (50 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 4 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (0,15 г). -D-галактопиранозилокси)-4-({4-[(1Е)-3-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразола (0,18 г). Полученное вещество растворяли в метаноле (2 мл). К раствору добавляли порошкообразный 10% палладий на угле (50 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 4 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (0,15 г).
1H-ЯМР (CDCl3)  м.д.: 1,05-1,2 (6Н, м), 1,57 (3Н, с), 1,59 (3Н, с), 1,85 (3Н, с), 1,85-1,95 (2Н, м), 1,99 (3Н, с), 2,02 (3Н, с), 2,1-2,2 (5Н, м), 2,6 (2Н, т, J=7,4 Гц), 2,8-2,95 (1H, м), 3,59 (1H, д, J=16,1 Гц), 3,68 (1H, д, J=16,1 Гц), 4,0-4,1 (1H, м), 4,14 (1H, дд, J=11,0 Гц, 8,2 Гц), 4,27 (1H, дд, J=11,0 Гц, 5,6 Гц), 5,08 (1H, дд, J=10,3 Гц, 3,5 Гц), 5,37 (1H, д, J=8,1 Гц), 5,4-5,5 (2H, м), 6,19 (1H, с), 6,95-7,1 (4H, м). м.д.: 1,05-1,2 (6Н, м), 1,57 (3Н, с), 1,59 (3Н, с), 1,85 (3Н, с), 1,85-1,95 (2Н, м), 1,99 (3Н, с), 2,02 (3Н, с), 2,1-2,2 (5Н, м), 2,6 (2Н, т, J=7,4 Гц), 2,8-2,95 (1H, м), 3,59 (1H, д, J=16,1 Гц), 3,68 (1H, д, J=16,1 Гц), 4,0-4,1 (1H, м), 4,14 (1H, дд, J=11,0 Гц, 8,2 Гц), 4,27 (1H, дд, J=11,0 Гц, 5,6 Гц), 5,08 (1H, дд, J=10,3 Гц, 3,5 Гц), 5,37 (1H, д, J=8,1 Гц), 5,4-5,5 (2H, м), 6,19 (1H, с), 6,95-7,1 (4H, м).
Сравнительный пример 20
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 19, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола. -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,05-1,2 (6H, м), 1,57 (3H, с), 1,58 (3H, с), 1,85 (3H, с), 1,85-1,95 (2H, м), 2,0 (3H, с), 2,03 (3H, с), 2,05 (3H, с), 2,15 (2H, т, J=7,6 Гц), 2,6 (2H, т, J=7,5 Гц), 2,8-2,95 (1H, м), 3,58 (1H, д, J=15,7 Гц), 3,66 (1H, д, J=15,7 Гц), 3,8-3,9 (1H, м), 4,17 (1H, дд, J=11,9 Гц, 2,2 Гц), 4,34 (1H, дд, J=11,9 Гц, 3,4 Гц), 5,15-5,3 (3H, м), 5,35-5,45 (1Н, м), 6,18 (1H, с), 6,95-7,1 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,57 (3H, с), 1,58 (3H, с), 1,85 (3H, с), 1,85-1,95 (2H, м), 2,0 (3H, с), 2,03 (3H, с), 2,05 (3H, с), 2,15 (2H, т, J=7,6 Гц), 2,6 (2H, т, J=7,5 Гц), 2,8-2,95 (1H, м), 3,58 (1H, д, J=15,7 Гц), 3,66 (1H, д, J=15,7 Гц), 3,8-3,9 (1H, м), 4,17 (1H, дд, J=11,9 Гц, 2,2 Гц), 4,34 (1H, дд, J=11,9 Гц, 3,4 Гц), 5,15-5,3 (3H, м), 5,35-5,45 (1Н, м), 6,18 (1H, с), 6,95-7,1 (4H, м).
Сравнительный пример 21
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 19, с использованием 3-2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]-2-метилфенил}метил)-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]-2-метилфенил}метил)-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола. -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,05-1,15 (6H, м), 1,57 (3H, с), 1,58 (3H, с), 1,76 (3H, с), 1,85-1,95 (2H, м), 1,99 (3H, с), 2,02 (3H, с), 2,05 (3H, с), 2,1-2,2 (2H, м), 2,25 (3H, с), 2,5-2,6 (2H, м), 2,7-2,85 (1H, м), 3,51 (1H, д, J=16,8 Гц), 3,61 (1H, д, J=16,8 Гц), 3,8-3,9 (1H, м), 4,1-4,2 (1H, м), 4,32 (1H, дд, J=12,2 Гц, 3,4 Гц), 5,15-5,3 (3H, м), 5,38 (1H, д, J=8,1 Гц), 6,23 (1H, с ), 6,77 (1H, д, J=7,8 Гц), 6,85 (1H, д, J=7,8 Гц), 6,93 (1H, с). м.д.: 1,05-1,15 (6H, м), 1,57 (3H, с), 1,58 (3H, с), 1,76 (3H, с), 1,85-1,95 (2H, м), 1,99 (3H, с), 2,02 (3H, с), 2,05 (3H, с), 2,1-2,2 (2H, м), 2,25 (3H, с), 2,5-2,6 (2H, м), 2,7-2,85 (1H, м), 3,51 (1H, д, J=16,8 Гц), 3,61 (1H, д, J=16,8 Гц), 3,8-3,9 (1H, м), 4,1-4,2 (1H, м), 4,32 (1H, дд, J=12,2 Гц, 3,4 Гц), 5,15-5,3 (3H, м), 5,38 (1H, д, J=8,1 Гц), 6,23 (1H, с ), 6,77 (1H, д, J=7,8 Гц), 6,85 (1H, д, J=7,8 Гц), 6,93 (1H, с).
Пример 48
3-( -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола (30 мг) в N,N-диметилформамиде (0,5 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (12 мг), 1-гидроксибензотриазол (9 мг) и 1-(2-гидроксиэтил)пиперазин (54 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 0,5 моль/л водного раствора гидроксида натрия (0,25 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (0,1 мл) и смесь разбавляли водой (1 мл). Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкл, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/60), получая указанное в заголовке соединение (4 мг). -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола (30 мг) в N,N-диметилформамиде (0,5 мл) добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (12 мг), 1-гидроксибензотриазол (9 мг) и 1-(2-гидроксиэтил)пиперазин (54 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 0,5 моль/л водного раствора гидроксида натрия (0,25 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (0,1 мл) и смесь разбавляли водой (1 мл). Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкл, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/60), получая указанное в заголовке соединение (4 мг).
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,7 Гц), 2,35-2,55 (6H, м), 2,58 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,52 (1H, дд, J=9,7 Гц, 3,4 Гц), 3,55-3,8 (12H, м), 3,87 (1H, д, J=3,4 Гц), 5,08 (1H, д, J=8,0 Гц), 7,0-7,15 (4H, м). м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,7 Гц), 2,35-2,55 (6H, м), 2,58 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,52 (1H, дд, J=9,7 Гц, 3,4 Гц), 3,55-3,8 (12H, м), 3,87 (1H, д, J=3,4 Гц), 5,08 (1H, д, J=8,0 Гц), 7,0-7,15 (4H, м).
Пример 49
3-( -D-глюкопиранозилокси)-4-{[4-(3-{1-[2-гидрокси-1-(гидроксиметил)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-{[4-(3-{1-[2-гидрокси-1-(гидроксиметил)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил}метил]-5-изопропил-1Н-пиразола и 2-амино-1,3-пропандиола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил}метил]-5-изопропил-1Н-пиразола и 2-амино-1,3-пропандиола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина, соответственно. -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,43 (6H, с), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,5-3,95 (9H, м), 5,0-5,15 (1H, м), 7,0-7,2 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,43 (6H, с), 1,8-1,95 (2H, м), 2,19 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,5-3,95 (9H, м), 5,0-5,15 (1H, м), 7,0-7,2 (4H, м).
Пример 50
3-( -D-глюкопиранозилокси)-4-{[4-(3-{1-[2-гидрокси-1,1-бис(гидроксиметил)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-{[4-(3-{1-[2-гидрокси-1,1-бис(гидроксиметил)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и трис(гидроксиметил)аминометана вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и трис(гидроксиметил)аминометана вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина, соответственно. -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-3,0 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (10H, м), 5,0-5,15 (1H, м), 7,0-7,2 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,5 Гц), 2,85-3,0 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (10H, м), 5,0-5,15 (1H, м), 7,0-7,2 (4H, м).
Пример 51
3-( -D-галактопиранозилокси)-4-[(4-{3-[1-(2-гидроксиэтилкарбамоил)-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-{3-[1-(2-гидроксиэтилкарбамоил)-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием 2-аминоэтанола вместо 1-(2-гидроксиэтил)пиперазина.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,42 (6H, с), 1,8-1,9 (2H, м), 2,19 (2H, т, J=7,6 Гц), 2,57 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,28 (2H, т, J=5,8 Гц), 3,45-3,65 (4H, м), 3,65-3,8 (5H, м), 3,86 (1H, д, J=2,7 Гц), 5,08 (1H, д, J=7,9 Гц), 7,0-7,15 (4H, м). м.д.: 1,1-1,15 (6H, м), 1,42 (6H, с), 1,8-1,9 (2H, м), 2,19 (2H, т, J=7,6 Гц), 2,57 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,28 (2H, т, J=5,8 Гц), 3,45-3,65 (4H, м), 3,65-3,8 (5H, м), 3,86 (1H, д, J=2,7 Гц), 5,08 (1H, д, J=7,9 Гц), 7,0-7,15 (4H, м).
Пример 52
3-( -D-галактопиранозилокси)-5-изопропил-4-[(4-(3-{1-[2-(диметиламино)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-4-[(4-(3-{1-[2-(диметиламино)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием N,N-диметилэтилендиамина вместо 1-(2-гидроксиэтил)пиперазина.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,41 (6H, с), 1,8-1,9 (2H, м), 2,19 (2H, т, J=7,7 Гц), 2,24 (6H, с), 2,42 (2H, т, J=6,8 Гц), 2,58 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,28 (2H, т, J=6,8 Гц), 3,52 (1H, дд, J=9,7 Гц, 3,3 Гц), 3,55-3,65 (1H, м), 3,65-3,8 (5H, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=7,4 Гц), 7,0-7,15 (4H, м). м.д.: 1,1-1,15 (6H, м), 1,41 (6H, с), 1,8-1,9 (2H, м), 2,19 (2H, т, J=7,7 Гц), 2,24 (6H, с), 2,42 (2H, т, J=6,8 Гц), 2,58 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,28 (2H, т, J=6,8 Гц), 3,52 (1H, дд, J=9,7 Гц, 3,3 Гц), 3,55-3,65 (1H, м), 3,65-3,8 (5H, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=7,4 Гц), 7,0-7,15 (4H, м).
Пример 53
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[2-(диметиламино)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[2-(диметиламино)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и N,N-диметилэтилендиамина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и N,N-диметилэтилендиамина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина, соответственно. -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,41 (6H, с), 1,8-1,9 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,23 (6H, с), 2,41 (2H, т, J=6,8 Гц), 2,57 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,2-3,45 (6H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,15 (6H, м), 1,41 (6H, с), 1,8-1,9 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,23 (6H, с), 2,41 (2H, т, J=6,8 Гц), 2,57 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,2-3,45 (6H, м), 3,6-3,9 (4H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 54
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[3-(диметиламино)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[3-(диметиламино)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и N,N-диметил-1,3-пропандиамина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и N,N-диметил-1,3-пропандиамина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина, соответственно. -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,41 (6H, с), 1,6-1,7 (2H, м), 1,8-1,9 (2H, м), 2,19 (2H, т, J=7,7 Гц), 2,22 (6H, с), 2,35 (2H, т, J=7,6 Гц), 2,57 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,18 (2H, т, J=6,6 Гц), 3,3-3,45 (4H, м), 3,6-3,8 (3H, м), 3,8-3,9 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,15 (6H, м), 1,41 (6H, с), 1,6-1,7 (2H, м), 1,8-1,9 (2H, м), 2,19 (2H, т, J=7,7 Гц), 2,22 (6H, с), 2,35 (2H, т, J=7,6 Гц), 2,57 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,18 (2H, т, J=6,6 Гц), 3,3-3,45 (4H, м), 3,6-3,8 (3H, м), 3,8-3,9 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 55
3-( -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола. -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,16 (2H, т, J=7,5 Гц), 2,35-2,55 (6H, м), 2,58 (2H, т, J=7,3 Гц), 2,85-3,0 (1H, м), 3,25-3,45 (4H, м), 3,55-3,9 (10H, м), 5,0-5,15 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,16 (2H, т, J=7,5 Гц), 2,35-2,55 (6H, м), 2,58 (2H, т, J=7,3 Гц), 2,85-3,0 (1H, м), 3,25-3,45 (4H, м), 3,55-3,9 (10H, м), 5,0-5,15 (1H, м), 7,0-7,15 (4H, м).
Пример 56
4-[(4-{3-[1-(2-аминоэтилкарбамоил)-1-(метил)этилкарбамоил]пропил}фенил)метил]-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием этилендиамина вместо 1-(2-гидроксиэтил)пиперазина.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,41 (6H, с), 1,8-1,9 (2H, м), 2,19 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,6 Гц), 2,7 (2H, т, J=5,9 Гц), 2,85-2,95 (1Н, м), 3,24 (2H, т, J=5,9 Гц), 3,51 (1H, дд, J=9,8 Гц, 3, 2 Гц), 3,55-3,65 (1H, м), 3,65-3,8 (5H, м), 3,86 (1H, д, J=3,2 Гц), 5,07 (1H, д, J=7,9 Гц), 7,0-7,15 (4H, м). м.д.: 1,1-1,2 (6H, м), 1,41 (6H, с), 1,8-1,9 (2H, м), 2,19 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,6 Гц), 2,7 (2H, т, J=5,9 Гц), 2,85-2,95 (1Н, м), 3,24 (2H, т, J=5,9 Гц), 3,51 (1H, дд, J=9,8 Гц, 3, 2 Гц), 3,55-3,65 (1H, м), 3,65-3,8 (5H, м), 3,86 (1H, д, J=3,2 Гц), 5,07 (1H, д, J=7,9 Гц), 7,0-7,15 (4H, м).
Пример 57
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием пиперазина вместо 1-(2-гидроксиэтил)пиперазина.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,1-2,2 (2H, м), 2,58 (2H, т, J=7,4 Гц), 2,65-2,8 (4H, м), 2,85-2,95 (1H, м), 3,45-3,8 (11H, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=8,0 Гц), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,1-2,2 (2H, м), 2,58 (2H, т, J=7,4 Гц), 2,65-2,8 (4H, м), 2,85-2,95 (1H, м), 3,45-3,8 (11H, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=8,0 Гц), 7,0-7,15 (4H, м).
Пример 58
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина, соответственно. -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,6 Гц), 2,5-2,85 (6H, м), 2,85-3,0 (1H, м), 3,25-3,45 (4H, м), 3,5-3,9 (8H, м), 5,0-5,15 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,6 Гц), 2,5-2,85 (6H, м), 2,85-3,0 (1H, м), 3,25-3,45 (4H, м), 3,5-3,9 (8H, м), 5,0-5,15 (1H, м), 7,0-7,15 (4H, м).
Пример 59
3-( -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола. -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,8-1,9 (2H, м), 2,1-2,2 (2H, м), 2,3 (3H, с), 2,35-2,6 (8H, м), 2,75-2,9 (1H, м), 3,25-3,4 (4H, м), 3,45-3,75 (9H, м), 3,8 (1H, д, J=11,1 Гц), 4,95-5,05 (1H, м), 6,8-7,0 (3H, м). м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,8-1,9 (2H, м), 2,1-2,2 (2H, м), 2,3 (3H, с), 2,35-2,6 (8H, м), 2,75-2,9 (1H, м), 3,25-3,4 (4H, м), 3,45-3,75 (9H, м), 3,8 (1H, д, J=11,1 Гц), 4,95-5,05 (1H, м), 6,8-7,0 (3H, м).
Пример 60
3-( -D-галактопиранозилокси)-4-{[4-(3-{1-[2-гидрокси-1,1-бис(гидроксиметил)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-{[4-(3-{1-[2-гидрокси-1,1-бис(гидроксиметил)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием трис(гидроксиметил)аминометана вместо 1-(2-гидроксиэтил)пиперазина.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,52 (1H, дд, J=9,7 Гц, 3,4 Гц), 3,55-3,9 (13H, м), 5,07 (1H, д, J=7,5 Гц), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,18 (2H, т, J=7,5 Гц), 2,58 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,52 (1H, дд, J=9,7 Гц, 3,4 Гц), 3,55-3,9 (13H, м), 5,07 (1H, д, J=7,5 Гц), 7,0-7,15 (4H, м).
Пример 61
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием 1-метилпиперазина вместо 1-(2-гидроксиэтил)пиперазина.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,42 (6H, с), 1,8-1,9 (2H, м), 2,1-2,2 (2H, м), 2,25 (3H, с), 2,3-2,45 (4H, м), 2,58 (2H, т, J=7,4 Гц), 2,85-2,95 (1H, м), 3,52 (1H, дд, J=9,6 Гц, 3,2 Гц), 3,55-3,8 (1Н, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=7,4 Гц), 7,0-7,15 (4H, м). м.д.: 1,1-1,15 (6H, м), 1,42 (6H, с), 1,8-1,9 (2H, м), 2,1-2,2 (2H, м), 2,25 (3H, с), 2,3-2,45 (4H, м), 2,58 (2H, т, J=7,4 Гц), 2,85-2,95 (1H, м), 3,52 (1H, дд, J=9,6 Гц, 3,2 Гц), 3,55-3,8 (1Н, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=7,4 Гц), 7,0-7,15 (4H, м).
Пример 62
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-изопропилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-изопропилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 48, с использованием 1-изопропилпиперазина вместо 1-(2-гидроксиэтил)пиперазина.
1H-ЯМР (CD3OD)  м.д.: 1,03 (6H, д, J=6,6 Гц), 1,05-1,15 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,1-2,2 (2H, м), 2,35-2,7 (7H, м), 2,8-2,95 (1H, м), 3,52 (1H, дд, J=9,8 Гц, 3,4 Гц), 3,55-3,8 (10H, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=7,8 Гц), 7,0-7,15 (4H, м). м.д.: 1,03 (6H, д, J=6,6 Гц), 1,05-1,15 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,1-2,2 (2H, м), 2,35-2,7 (7H, м), 2,8-2,95 (1H, м), 3,52 (1H, дд, J=9,8 Гц, 3,4 Гц), 3,55-3,8 (10H, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=7,8 Гц), 7,0-7,15 (4H, м).
Пример 63
3-( -D-глюкопиранозилокси)-5-изопропил-4-({4-[(1E)-2-{1-[2-(диметиламино)этилкарбамоил)-1-(метил)этилкарбамоил}винил]фенил}метил)-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-({4-[(1E)-2-{1-[2-(диметиламино)этилкарбамоил)-1-(метил)этилкарбамоил}винил]фенил}метил)-1Н-пиразол
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-2-карбоксивинил]фенил}метил)-5-изопропил-1Н-пиразола (1,2 г) в N,N-диметилформамиде (15 мл) и дихлорметане (10 мл) добавляли триэтиламин (15 мл). К смеси добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,56 г), 1-гидроксибензотриазол (0,4 г) и раствор 2-амино-2-метилпропионовой кислоты (2,0 г) в воде (15 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь нейтрализовали добавлением 2 моль/л водного раствора уксусной кислоты и смесь экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат-дихлорметан/метанол=7/1-3/1), получая 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-2-карбоксивинил]фенил}метил)-5-изопропил-1Н-пиразола (1,2 г) в N,N-диметилформамиде (15 мл) и дихлорметане (10 мл) добавляли триэтиламин (15 мл). К смеси добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,56 г), 1-гидроксибензотриазол (0,4 г) и раствор 2-амино-2-метилпропионовой кислоты (2,0 г) в воде (15 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь нейтрализовали добавлением 2 моль/л водного раствора уксусной кислоты и смесь экстрагировали этилацетатом. Органический слой последовательно промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат-дихлорметан/метанол=7/1-3/1), получая 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{(1Е)-2-[1-карбокси-1-(метил)этилкарбамоил]винил}фенил)метил]-5-изопропил-1Н-пиразол (0,44 г). Это вещество растворяли в N,N-диметилформамиде (0,3 мл). К раствору добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,18 г), 1-гидроксибензотриазол (0,13 г) и N,N-диметилэтилендиамин (0,55 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 5 моль/л водного раствора гидроксида натрия (1,5 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (1 мл) и смесь разбавляли водой (3 мл). Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкл, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/60), получая указанное в заголовке соединение (71 мг). -D-глюкопиранозилокси)-4-[(4-{(1Е)-2-[1-карбокси-1-(метил)этилкарбамоил]винил}фенил)метил]-5-изопропил-1Н-пиразол (0,44 г). Это вещество растворяли в N,N-диметилформамиде (0,3 мл). К раствору добавляли гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,18 г), 1-гидроксибензотриазол (0,13 г) и N,N-диметилэтилендиамин (0,55 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 5 моль/л водного раствора гидроксида натрия (1,5 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (1 мл) и смесь разбавляли водой (3 мл). Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкл, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/60), получая указанное в заголовке соединение (71 мг).
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,49 (6H, с), 2,27 (6H, с), 2,46 (2H, т, J=6,7 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (6H, м), 3,6-3,9 (4H, м), 5,05-5,15 (1H, м), 6,61 (1H, д, J=15,7 Гц), 7,2-7,3 (2H, м), 7,35-7,5 (3H, м). м.д.: 1,05-1,15 (6H, м), 1,49 (6H, с), 2,27 (6H, с), 2,46 (2H, т, J=6,7 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (6H, м), 3,6-3,9 (4H, м), 5,05-5,15 (1H, м), 6,61 (1H, д, J=15,7 Гц), 7,2-7,3 (2H, м), 7,35-7,5 (3H, м).
Пример 64
3-( -D-глюкопиранозилокси)-5-изопропил-4-({4-[(1Е)-2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}винил]фенил}метил)-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-({4-[(1Е)-2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}винил]фенил}метил)-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 63, с использованием пиперазина вместо N,N-диметилэтилендиамина.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,51 (6H, с), 2,65-2,8 (4H, м), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,5-3,9 (8H, м), 5,05-5,15 (1H, м), 6,55 (1H, д, J=15,8 Гц), 7,2-7,3 (2H, м), 7,4-7,55 (3H, м). м.д.: 1,05-1,15 (6H, м), 1,51 (6H, с), 2,65-2,8 (4H, м), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,5-3,9 (8H, м), 5,05-5,15 (1H, м), 6,55 (1H, д, J=15,8 Гц), 7,2-7,3 (2H, м), 7,4-7,55 (3H, м).
Пример 65
3-( -D-глюкопиранозилокси)-4-[(4-{(1Е)-2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил)карбонил}-1-(метил)этилкарбамоил]винил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{(1Е)-2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил)карбонил}-1-(метил)этилкарбамоил]винил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 63, с использованием 1-(2-гидроксиэтил)пиперазина вместо N,N-диметилэтилендиамина.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,51 (6H, с), 2,35-2,65 (6H, м), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,55-3,9 (10H, м), 5,05-5,15 (1H, м), 6,55 (1H, д, J=15,8 Гц), 7,2-7,3 (2H, м), 7,4-7,5 (3H, м). м.д.: 1,1-1,2 (6H, м), 1,51 (6H, с), 2,35-2,65 (6H, м), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,55-3,9 (10H, м), 5,05-5,15 (1H, м), 6,55 (1H, д, J=15,8 Гц), 7,2-7,3 (2H, м), 7,4-7,5 (3H, м).
Пример 66
3-( -D-глюкопиранозилокси)-4-[(4-{3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием (S)-2-амино-1-пропанола вместо гидрохлорида глицинамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (9H, м), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,7 Гц), 2,57 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,25-3,5 (6H, м), 3,6-3,8 (3H, м), 3,83 (1H, д, J=11,9 Гц), 3,85-4,0 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (9H, м), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,7 Гц), 2,57 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,25-3,5 (6H, м), 3,6-3,8 (3H, м), 3,83 (1H, д, J=11,9 Гц), 3,85-4,0 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 67
3-( -D-галактопиранозилокси)-4-[(4-{3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-{3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и (S)-2-амино-1-пропанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и (S)-2-амино-1-пропанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (9H, м), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,6 Гц), 2,57 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,35-3,55 (3H, м), 3,55-3,65 (1H, м), 3,65-4,0 (7H, м), 5,0-5,15 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (9H, м), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,6 Гц), 2,57 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,35-3,55 (3H, м), 3,55-3,65 (1H, м), 3,65-4,0 (7H, м), 5,0-5,15 (1H, м), 7,0-7,15 (4H, м).
Пример 68
3-( -D-галактопиранозилокси)-4-[(4-{3-[2-гидрокси-1,1-ди(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-{3-[2-гидрокси-1,1-ди(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и 2-амино-2-метил-1-пропанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и 2-амино-2-метил-1-пропанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,25 (6H, с), 1,8-1,9 (2H, м), 2,15 (2H, т, J=7,6 Гц), 2,56 (2H, т, J=7,5 Гц), 2,8-2,95 (1H, м), 3,45-3,65 (4H, м), 3,65-3,8 (5H, м), 3,8-3,9 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,15 (6H, м), 1,25 (6H, с), 1,8-1,9 (2H, м), 2,15 (2H, т, J=7,6 Гц), 2,56 (2H, т, J=7,5 Гц), 2,8-2,95 (1H, м), 3,45-3,65 (4H, м), 3,65-3,8 (5H, м), 3,8-3,9 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 69
4-[(4-{3-[(S)-5-амино-5-(карбамоил)пентилкарбамоил]пропил}фенил)метил]-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида (S)-2-бензилоксикарбониламино-6-аминогексанамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида (S)-2-бензилоксикарбониламино-6-аминогексанамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,3-1,6 (5H, м), 1,6-1,75 (1H, м), 1,8-1,9 (2H, м), 2,15 (2H, т, J=7,7 Гц), 2,56 (2H, т, J=7,3 Гц), 2,8-2,95 (1H, м), 3,15 (2H, т, J=7,0 Гц), 3,28 (1H, т, J=6,4 Гц), 3,52 (1H, дд, J=9,8 Гц, 3,1 Гц), 3,55-3,65 (1H, м), 3,65-3,8 (5H, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=7,9 Гц), 7,0-7,15 (4H, м). м.д.: 1,05-1,15 (6H, м), 1,3-1,6 (5H, м), 1,6-1,75 (1H, м), 1,8-1,9 (2H, м), 2,15 (2H, т, J=7,7 Гц), 2,56 (2H, т, J=7,3 Гц), 2,8-2,95 (1H, м), 3,15 (2H, т, J=7,0 Гц), 3,28 (1H, т, J=6,4 Гц), 3,52 (1H, дд, J=9,8 Гц, 3,1 Гц), 3,55-3,65 (1H, м), 3,65-3,8 (5H, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=7,9 Гц), 7,0-7,15 (4H, м).
Пример 70
4-[(4-{3-[(S)-2-амино-1-(метил)этилкарбамоил]пропил}фенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола (1,6 г) в метаноле (20 мл) добавляли порошкообразный 10% палладий на угле и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворившееся вещество удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола (1,6 г) в метаноле (20 мл) добавляли порошкообразный 10% палладий на угле и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворившееся вещество удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(3-карбоксипропил)фенил]метил}-5-изопропил-1Н-пиразола (1,5 г). Полученное вещество растворяли в N,N-диметилформамид (15 мл). К раствору добавляли (S)-2-амино-1-пропанол (0,89 г), 1-гидрокси-бензотриазол (0,48 г) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,68 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду, полученную смесь два раза экстрагировали дихлорметаном. Экстракты промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и получали 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(3-карбоксипропил)фенил]метил}-5-изопропил-1Н-пиразола (1,5 г). Полученное вещество растворяли в N,N-диметилформамид (15 мл). К раствору добавляли (S)-2-амино-1-пропанол (0,89 г), 1-гидрокси-бензотриазол (0,48 г) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,68 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду, полученную смесь два раза экстрагировали дихлорметаном. Экстракты промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и получали 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол (1,64 г). Полученный 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол (1,64 г). Полученный 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол (0,19 г) растворяли в дихлорметане (2 мл). К раствору добавляли триэтиламин (0,058 мл) и метансульфонилхлорид (0,032 мл) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду и полученную смесь два раза экстрагировали дихлорметаном. Экстракты промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Остаток растворяли в N,N-диметилформамиде (1 мл). К раствору добавляли азид натрия (0,18 г) и смесь перемешивали при 100°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры. К смеси добавляли пять моль/л водного раствора гидроксида натрия (1,5 мл) и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (1 мл) и воду (2 мл). Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/90), получая 4-[(4-{3-[(1S)-2-азидо-1-(метил)этилкарбамоил]пропил}фенил)метил]-3-( -D-глюкопиранозилокси)-4-[(4-{3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол (0,19 г) растворяли в дихлорметане (2 мл). К раствору добавляли триэтиламин (0,058 мл) и метансульфонилхлорид (0,032 мл) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду и полученную смесь два раза экстрагировали дихлорметаном. Экстракты промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Остаток растворяли в N,N-диметилформамиде (1 мл). К раствору добавляли азид натрия (0,18 г) и смесь перемешивали при 100°С в течение ночи. Реакционную смесь охлаждали до комнатной температуры. К смеси добавляли пять моль/л водного раствора гидроксида натрия (1,5 мл) и смесь перемешивали в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (1 мл) и воду (2 мл). Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкм, 120А, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/90), получая 4-[(4-{3-[(1S)-2-азидо-1-(метил)этилкарбамоил]пропил}фенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол (18 мг). Полученное вещество растворяли в метаноле (1 мл). К раствору добавляли порошкообразный 10% палладий на угле (0,01 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 4 часов. Нерастворившееся вещество удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (12 мг). -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол (18 мг). Полученное вещество растворяли в метаноле (1 мл). К раствору добавляли порошкообразный 10% палладий на угле (0,01 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 4 часов. Нерастворившееся вещество удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (12 мг).
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (9H, м), 1,8-1,95 (2H, м), 2,1-2,25 (2H, м), 2,5-2,65 (4H, м), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (5H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (9H, м), 1,8-1,95 (2H, м), 2,1-2,25 (2H, м), 2,5-2,65 (4H, м), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,6-3,9 (5H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 71
4-[(4-{3-[2-амино-1,1-ди(метил)этилкарбамоил]пропил}фенил)метил]-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и 2-амино-1-бензилоксикарбониламино-2-(метил)пропана вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и 2-амино-1-бензилоксикарбониламино-2-(метил)пропана вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,27 (6H, с), 1,8-1,9 (2H, м), 2,16 (2H, т, J=7,7 Гц), 2,57 (2H, т, J=7,6 Гц), 2,8-2,95 (3H, м), 3,51 (1H, дд, J=9,8 Гц, 3,7 Гц), 3,55-3,65 (1H, м), 3,65-3,8 (5H, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=7,7 Гц), 7,0-7,15 (4H, м). м.д.: 1,05-1,15 (6H, м), 1,27 (6H, с), 1,8-1,9 (2H, м), 2,16 (2H, т, J=7,7 Гц), 2,57 (2H, т, J=7,6 Гц), 2,8-2,95 (3H, м), 3,51 (1H, дд, J=9,8 Гц, 3,7 Гц), 3,55-3,65 (1H, м), 3,65-3,8 (5H, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=7,7 Гц), 7,0-7,15 (4H, м).
Пример 72
4-[(4-{3-[(R)-2-амино-1-(гидроксиметил)пентилкарбамоил]пропил}фенил)метил]-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 1, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и (R)-2-амино-6-бензилоксикарбониламино-1-гексанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и (R)-2-амино-6-бензилоксикарбониламино-1-гексанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно. -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6Н, м), 1,2-1,7 (6Н, м), 1,8-1,95 (2Н, м), 2,2 (2Н, т, J=7,5 Гц), 2,57 (2H, т, J=7,6 Гц), 2,65 (2H, т, J=7,3z), 2,8-3,0 (1H, м), 3,4-3,65 (4H, м), 3,65-3,95 (7H, м), 5,0-5,15 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (6Н, м), 1,2-1,7 (6Н, м), 1,8-1,95 (2Н, м), 2,2 (2Н, т, J=7,5 Гц), 2,57 (2H, т, J=7,6 Гц), 2,65 (2H, т, J=7,3z), 2,8-3,0 (1H, м), 3,4-3,65 (4H, м), 3,65-3,95 (7H, м), 5,0-5,15 (1H, м), 7,0-7,15 (4H, м).
Пример 73
3-( -D-глюкопиранозилокси)-4-[(4-{(1Е)-3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{(1Е)-3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 26, с использованием (S)-2-амино-1-пропанола вместо аммонийхлорида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (9H, м), 2,8-2,95 (1H, м), 3,09 (2H, д, J=7,4 Гц), 3,25-3,55 (6H, м), 3,6-3,9 (4H, м), 3,9-4,0 (1H, м), 5,05-5,15 (1H, м), 6,2-6,3 (1H, м), 6,47 (1H, д, J=15,9 Гц), 7,1-7,2 (2H, м), 7,2-7,3 (2H, м). м.д.: 1,05-1,2 (9H, м), 2,8-2,95 (1H, м), 3,09 (2H, д, J=7,4 Гц), 3,25-3,55 (6H, м), 3,6-3,9 (4H, м), 3,9-4,0 (1H, м), 5,05-5,15 (1H, м), 6,2-6,3 (1H, м), 6,47 (1H, д, J=15,9 Гц), 7,1-7,2 (2H, м), 7,2-7,3 (2H, м).
Пример 74
3-( -D-глюкопиранозилокси)-4-{[4-(3-{(S)-1-[2-гидрокси-1-(гидроксиметил)этилкарбамоил]этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-{[4-(3-{(S)-1-[2-гидрокси-1-(гидроксиметил)этилкарбамоил]этилкарбамоил}пропил)фенил]метил}-5-изопропил-1Н-пиразол
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола (7,13 г) в N,N-диметилформамиде (30 мл) добавляли 1-гидроксибензотриазол (2,31 г), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (3,25 г) и бензил-(S)-2-аминопропионат (8,34 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь два раза экстрагировали этилацетатом. Экстракты последовательно промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/2), получая 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1Е)-3-карбоксипроп-1-енил]фенил}метил)-5-изопропил-1Н-пиразола (7,13 г) в N,N-диметилформамиде (30 мл) добавляли 1-гидроксибензотриазол (2,31 г), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (3,25 г) и бензил-(S)-2-аминопропионат (8,34 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь два раза экстрагировали этилацетатом. Экстракты последовательно промывали водой и насыщенным раствором соли и сушили над сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/2), получая 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{(1Е)-3-[(S)-1-(бензилоксикарбонил)этилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразол (3,25 г). Это вещество растворяли в метаноле (40 мл). К раствору добавляли порошкообразный 10% палладий на угле (1,0 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Нерастворившееся вещество удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{(1Е)-3-[(S)-1-(бензилоксикарбонил)этилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразол (3,25 г). Это вещество растворяли в метаноле (40 мл). К раствору добавляли порошкообразный 10% палладий на угле (1,0 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Нерастворившееся вещество удаляли фильтрованием и фильтрат концентрировали при пониженном давлении с получением 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[(S)-1-(карбокси)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола (2,25 г). К раствору полученного 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[(S)-1-(карбокси)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола (2,25 г). К раствору полученного 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[(S)-1-(карбокси)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола (0,09 г) в N,N-диметилформамиде (0,5 мл) добавляли 1-гидроксибензотриазол (0,026 г), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,037 г) и 2-амино-1,3-пропандиол (0,12 г) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 5 моль/л водного раствора гидроксида натрия (0,5 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (0,3 мл) и воду (1 мл). Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкл, 120Å, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/90), получая указанное в заголовке соединение (0,017 г). -D-глюкопиранозилокси)-4-[(4-{3-[(S)-1-(карбокси)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола (0,09 г) в N,N-диметилформамиде (0,5 мл) добавляли 1-гидроксибензотриазол (0,026 г), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,037 г) и 2-амино-1,3-пропандиол (0,12 г) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 5 моль/л водного раствора гидроксида натрия (0,5 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (0,3 мл) и воду (1 мл). Нерастворившееся вещество удаляли фильтрованием и фильтрат очищали препаративной колоночной хроматографией с обращенной фазой (Shiseido CAPCELL PAK UG120 ODS, 5 мкл, 120Å, 20×50 мм, скорость потока: 30 мл/минута, линейный градиент: вода/ацетонитрил=90/10-10/90), получая указанное в заголовке соединение (0,017 г).
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,32 (3H, д, J=6,8 Гц), 1,8-1,95 (2H, м), 2,15-2,3 (2H, м), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,5-3,95 (9H, м), 4,25-4,35 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,2 (6H, м), 1,32 (3H, д, J=6,8 Гц), 1,8-1,95 (2H, м), 2,15-2,3 (2H, м), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (4H, м), 3,5-3,95 (9H, м), 4,25-4,35 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 75
3-( -D-глюкопиранозилокси)-4-[(4-{3-[(S)-1-(2-гидроксиэтилкарбамоил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[(S)-1-(2-гидроксиэтилкарбамоил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 74, с использованием 2-аминоэтанола вместо 2-амино-1,3-пропандиола.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,31 (3H, д, J=7,0 Гц), 1,8-1,95 (2H, м), 2,15-2,25 (2H, м), 2,58 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (6H, м), 3,58 (2H, т, J=5,7 Гц), 3,6-3,8 (3H, м), 3,83 (1H, д, J=11,9 Гц), 4,25-4,35 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,15 (6H, м), 1,31 (3H, д, J=7,0 Гц), 1,8-1,95 (2H, м), 2,15-2,25 (2H, м), 2,58 (2H, т, J=7,6 Гц), 2,85-2,95 (1H, м), 3,25-3,45 (6H, м), 3,58 (2H, т, J=5,7 Гц), 3,6-3,8 (3H, м), 3,83 (1H, д, J=11,9 Гц), 4,25-4,35 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 76
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{(S)-1-[(4-метилпиперазин-1-ил)карбонил]этилкарбамоил}пропил)фенил]метил}-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{(S)-1-[(4-метилпиперазин-1-ил)карбонил]этилкарбамоил}пропил)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 74, с использованием 1-метилпиперазина вместо 2-амино-1,3-пропандиола.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6Н, м), 1,26 (3Н, д, J=7,0 Гц), 1,8-1,95 (2H, м), 2,2 (2H, т, J=7,4 Гц), 2,25-2,55 (7H, м), 2,57 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,45-3,75 (6H, м), 3,77 (1H, д, J=16,0 Гц), 3,83 (1H, д, J=11,7 Гц), 4,75-4,9 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,05-1,2 (6Н, м), 1,26 (3Н, д, J=7,0 Гц), 1,8-1,95 (2H, м), 2,2 (2H, т, J=7,4 Гц), 2,25-2,55 (7H, м), 2,57 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,45-3,75 (6H, м), 3,77 (1H, д, J=16,0 Гц), 3,83 (1H, д, J=11,7 Гц), 4,75-4,9 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Пример 77
3-( -D-глюкопиранозилокси)-4-[(4-{3-[(S)-1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[(S)-1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 74, с использованием 1-(2-гидроксиэтил)пиперазина вместо 2-амино-1,3-пропандиола.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,26 (3H, д, J=6,9 Гц), 1,8-1,95 (2H, м), 2,2 (2H, т, J=7,4 Гц), 2,4-2,65 (8H, м), 2,85-2,95 (1H, м), 3,2-3,45 (4H, м), 3,45-3,75 (8H, м), 3,77 (1H, д, J=16,4 Гц), 3,83 (1H, д, J=11,9 Гц), 4,75-4,9 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м). м.д.: 1,1-1,15 (6H, м), 1,26 (3H, д, J=6,9 Гц), 1,8-1,95 (2H, м), 2,2 (2H, т, J=7,4 Гц), 2,4-2,65 (8H, м), 2,85-2,95 (1H, м), 3,2-3,45 (4H, м), 3,45-3,75 (8H, м), 3,77 (1H, д, J=16,4 Гц), 3,83 (1H, д, J=11,9 Гц), 4,75-4,9 (1H, м), 5,0-5,1 (1H, м), 7,0-7,15 (4H, м).
Сравнительный пример 22
(4-бензилокси-2-метилфенил)метанол
К раствору 4-бром-3-метилфенола (10 г) в N,N-диметилформамиде (50 мл) добавляли карбонат калия (8,87 г) и бензилбромид (6,36 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и получали 4-бензилокси-1-бром-2-метилбензол (14,6 г). Полученное вещество растворяли в тетрагидрофуране (200 мл). К раствору добавляли н-бутиллитий (2,66 моль/л раствор в н-гексане, 21,7 мл) при -78°С в атмосфере аргона и смесь перемешивали в течение 10 минут. К реакционной смеси добавляли N,N-диметилформамид (10,1 мл), полученную смесь оставляли для нагревания до 0°С и перемешивали в течение 30 минут. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и получали 4-бензилокси-2-метилбензальдегид. Полученное вещество растворяли в этаноле (100 мл). К раствору добавляли борогидрид натрия (1,99 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли метанол и полученную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали диэтиловым эфиром. Органический слой последовательно промывали насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=6/1-3/1-1/1) с получением указанного в заголовке соединения (10,5 г).
1H-ЯМР (CDCl3)  м.д.: 1,37 (1H, т, J=5,8 Гц), 2,36 (3H, с), 4,64 (2H, д, J=5,8 Гц), 5,06 (2H, с), 6,79 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,84 (1H, д, J=2,4 Гц), 7,23 (1H, д, J=8,4 Гц), 7,25-7,45 (5H, м). м.д.: 1,37 (1H, т, J=5,8 Гц), 2,36 (3H, с), 4,64 (2H, д, J=5,8 Гц), 5,06 (2H, с), 6,79 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,84 (1H, д, J=2,4 Гц), 7,23 (1H, д, J=8,4 Гц), 7,25-7,45 (5H, м).
Сравнительный пример 23
4-[(4-бензилокси-2-метилфенил)метил]-1,2-дигидро-5-изопропил-3Н-пиразол-3-он
К раствору (4-бензилокси-2-метилфенил)метанола (10,5 г) в тетрагидрофуране (80 мл) добавляли триэтиламин (7,36 мл) и метансульфонилхлорид (3,91 мл) при охлаждении льдом. После перемешивания смеси в течение 1 часа нерастворившееся вещество удаляли фильтрованием. Полученный раствор (4-бензилокси-2-метилфенил)метилмезилата в тетрагидрофуране добавляли к суспензии гидрида натрия (60%, 2,11 г) и этил-4-метил-3-оксопентаноата (7,99 г) в тетрагидрофуране (160 мл) и смесь кипятили с обратным холодильником в течение 15 часов. К реакционной смеси добавляли 1 моль/л хлористоводородной кислоты и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении. Остаток растворяли в толуоле (30 мл). К раствору добавляли моногидрат гидразина (6,68 мл) и смесь перемешивали при 100°С в течение ночи. Реакционную смесь выливали в воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток обрабатывали н-гексаном. Осажденные кристаллы собирали фильтрованием и сушили при пониженном давлении с получением указанного в заголовке соединения (12,3 г).
1H-ЯМР (ДМСО-d6)  м.д.: 1,04 (6H, д, J=6,8 Гц), 2,24 (3H, с), 2,65-2,8 (1H, м), 3,44 (2H, с), 5,02 (2H, с), 6,69 (1H, дд, J=8,7 Гц, 2,4 Гц), 6,75-6,85 (2H, м), 7,25-7,45 (5H, м). м.д.: 1,04 (6H, д, J=6,8 Гц), 2,24 (3H, с), 2,65-2,8 (1H, м), 3,44 (2H, с), 5,02 (2H, с), 6,69 (1H, дд, J=8,7 Гц, 2,4 Гц), 6,75-6,85 (2H, м), 7,25-7,45 (5H, м).
Сравнительный пример 24
4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол -D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 12, с использованием 4-[(4-бензилокси-2-метилфенил)метил]-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и 2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилбромида (Kunz, H.; Harreus, A. Liebigs Ann. Chem. 1982, 41-48, Verlarde S.; Urbina J.; Pena M.R. J. Org. Chem. 1996, 61, 9541-9545) вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-глюкопиранозилбромида (Kunz, H.; Harreus, A. Liebigs Ann. Chem. 1982, 41-48, Verlarde S.; Urbina J.; Pena M.R. J. Org. Chem. 1996, 61, 9541-9545) вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-глюкозы, соответственно. -D-глюкозы, соответственно.
1H-ЯМР (CDCl3)  м.д.: 1,04 (9H, с), 1,05-1,2 (33H, м), 2,27 (3H, с), 2,7-2,85 (1H, м), 3,45-3,6 (2H, м), 3,8-3,9 (1H, м), 4,11 (1H, дд, J=12,6 Гц, 4,8 Гц), 4,17 (1H, дд, J=12,6 Гц, 1,8 Гц), 5,0 (2H, с), 5,15-5,3 (2H, м), 5,37 (1H, т, J=9,5 Гц), 5,65 (1H, д, J=7,8 Гц), 6,64 (1H, дд, J=8,4 Гц, 2,8 Гц), 6,77 (1H, д, J=2,8 Гц), 6,83 (1H, д, J=8,4 Гц), 7,25-7,45 (5H, м). м.д.: 1,04 (9H, с), 1,05-1,2 (33H, м), 2,27 (3H, с), 2,7-2,85 (1H, м), 3,45-3,6 (2H, м), 3,8-3,9 (1H, м), 4,11 (1H, дд, J=12,6 Гц, 4,8 Гц), 4,17 (1H, дд, J=12,6 Гц, 1,8 Гц), 5,0 (2H, с), 5,15-5,3 (2H, м), 5,37 (1H, т, J=9,5 Гц), 5,65 (1H, д, J=7,8 Гц), 6,64 (1H, дд, J=8,4 Гц, 2,8 Гц), 6,77 (1H, д, J=2,8 Гц), 6,83 (1H, д, J=8,4 Гц), 7,25-7,45 (5H, м).
Сравнительный пример 25
4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол -D-глюкопиранозилокси)-1Н-пиразол
4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол (5 г) растворяли в тетрагидрофуране (18 мл). К раствору добавляли порошкообразный 10% палладий на угле (500 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (4,45 г). -D-глюкопиранозилокси)-1Н-пиразол (5 г) растворяли в тетрагидрофуране (18 мл). К раствору добавляли порошкообразный 10% палладий на угле (500 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (4,45 г).
1H-ЯМР (CDCl3)  м.д.: 1,0-1,2 (42H, м), 2,24 (3H, с), 2,7-2,85 (1H, м), 3,52 (2H, с), 3,8-3,9 (1H, м), 4,09 (1H, дд, J=12,4 Гц, 4,7 Гц), 4,15 (1H, дд, J=12,4 Гц, 1,9 Гц), 4,6 (1H, с), 5,15-5,25 (2H, м), 5,36 (1H, т, J=9,2 Гц), 5,65 (1H, д, J=8,0 Гц), 6,5 (1H, дд, J=8,3 Гц, 2,9 Гц), 6,61 (1H, д, J=2,9 Гц), 6,78 (1H, д, J=8,3 Гц). м.д.: 1,0-1,2 (42H, м), 2,24 (3H, с), 2,7-2,85 (1H, м), 3,52 (2H, с), 3,8-3,9 (1H, м), 4,09 (1H, дд, J=12,4 Гц, 4,7 Гц), 4,15 (1H, дд, J=12,4 Гц, 1,9 Гц), 4,6 (1H, с), 5,15-5,25 (2H, м), 5,36 (1H, т, J=9,2 Гц), 5,65 (1H, д, J=8,0 Гц), 6,5 (1H, дд, J=8,3 Гц, 2,9 Гц), 6,61 (1H, д, J=2,9 Гц), 6,78 (1H, д, J=8,3 Гц).
Сравнительный пример 26
Бензил-4-бромбутират
К смеси 4-броммасляной кислоты (1 г), бензилового спирта (0,65 г) и трифенилфосфина (1,57 г) в тетрагидрофуране (12 мл) добавляли диэтилазодикарбоксилат (40% толуольный раствор, 2,88 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-нексан/этилацетат=20/1) с получением указанного в заголовке соединения (0,69 г).
1H-ЯМР (CDCl3)  м.д.: 2,15-2,25 (2H, м), 2,56 (2H, т, J=7,1 Гц), 3,46 (2H, т, J=6,5 Гц), 5,13 (2H, с), 7,25-7,4 (5H, м). м.д.: 2,15-2,25 (2H, м), 2,56 (2H, т, J=7,1 Гц), 3,46 (2H, т, J=6,5 Гц), 5,13 (2H, с), 7,25-7,4 (5H, м).
Сравнительный пример 27
4-({4-[3-(бензилоксикарбонил)пропокси]-2-метилфенил}метил)-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол -D-глюкопиранозилокси)-1Н-пиразол
К раствору 4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола (0,2 г) в N,N-диметилформамиде (3 мл) добавляли бензил-4-бромбутират (0,1 г), карбонат цезия (0,18 г) и каталитическое количество иодида натрия и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/1-2/1) с получением указанного в заголовке соединения (0,16 г). -D-глюкопиранозилокси)-1Н-пиразола (0,2 г) в N,N-диметилформамиде (3 мл) добавляли бензил-4-бромбутират (0,1 г), карбонат цезия (0,18 г) и каталитическое количество иодида натрия и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/1-2/1) с получением указанного в заголовке соединения (0,16 г).
1H-ЯМР (CDCl3)  м.д.: 1,04 (9Н, с), 1,05-1,2 (33Н, м), 2,05-2,15 (2Н, м), 2,25 (3Н, с), 2,56 (2Н, т, J=7,3 Гц), 2,7-2,85 (1Н, м), 3,53 (2H, с), 3,8-3,9 (1H, м), 3,94 (2H, т, J=6,2 Гц), 4,1 (1H, дд, J=12,5 Гц, 4,1 Гц), 4,16 (1H, дд, J=12,5 Гц, 2,0 Гц), 5,13 (2H, с), 5,15-5,25 (2H, м), 5,36 (1H, т, J=9,6 Гц), 5,65 (1H, д, J=8,1 Гц), 6,54 (1H, дд, J=8,5 Гц, 2,7 Гц), 6,64 (1H, д, J=2,7 Гц), 6,81 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м). м.д.: 1,04 (9Н, с), 1,05-1,2 (33Н, м), 2,05-2,15 (2Н, м), 2,25 (3Н, с), 2,56 (2Н, т, J=7,3 Гц), 2,7-2,85 (1Н, м), 3,53 (2H, с), 3,8-3,9 (1H, м), 3,94 (2H, т, J=6,2 Гц), 4,1 (1H, дд, J=12,5 Гц, 4,1 Гц), 4,16 (1H, дд, J=12,5 Гц, 2,0 Гц), 5,13 (2H, с), 5,15-5,25 (2H, м), 5,36 (1H, т, J=9,6 Гц), 5,65 (1H, д, J=8,1 Гц), 6,54 (1H, дд, J=8,5 Гц, 2,7 Гц), 6,64 (1H, д, J=2,7 Гц), 6,81 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м).
Сравнительный пример 28
1,2-дигидро-4-[(4-иодфенил)метил]-5-изопропил-3Н-пиразол-3-он
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 23, с использованием 4-иодбензилового спирта вместо (4-бензилокси-2-метилфенил)метанола.
1H-ЯМР (CD3OD)  м.д.: 1,12 (6H, д, J=7,3 Гц), 2,8-2,95 (1H, м), 3,63 (2H, с), 6,9-7,0 (2H, м), 7,5-7,6 (2H, м). м.д.: 1,12 (6H, д, J=7,3 Гц), 2,8-2,95 (1H, м), 3,63 (2H, с), 6,9-7,0 (2H, м), 7,5-7,6 (2H, м).
Сравнительный пример 29
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-иодфенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-иодфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 12, с использованием 1,2-дигидро-4-[(4-иодфенил)метил]-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-галактозы вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-галактозы вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-глюкозы, соответственно. -D-глюкозы, соответственно.
1H-ЯМР (CDCl3)  м.д.: 1,15-1,2 (6Н, м), 1,88 (3Н, с), 1,99 (3Н, с), 2,03 (3Н, с), 2,18 (3Н, с), 2,8-2,95 (1Н, м), 3,58 (1H, д, J=16,0 Гц), 3,65 (1H, д, J=16,0 Гц), 4,0-4,1 (1H, м), 4,15-4,25 (2H, м), 5,09 (1H, дд, J=10,7 Гц, 3,5 Гц), 5,35-5,45 (2H, м), 5,56 (1H, д, J=8,3 Гц), 6,85-6,95 (2H, м), 7,5-7,6 (2H, м). м.д.: 1,15-1,2 (6Н, м), 1,88 (3Н, с), 1,99 (3Н, с), 2,03 (3Н, с), 2,18 (3Н, с), 2,8-2,95 (1Н, м), 3,58 (1H, д, J=16,0 Гц), 3,65 (1H, д, J=16,0 Гц), 4,0-4,1 (1H, м), 4,15-4,25 (2H, м), 5,09 (1H, дд, J=10,7 Гц, 3,5 Гц), 5,35-5,45 (2H, м), 5,56 (1H, д, J=8,3 Гц), 6,85-6,95 (2H, м), 7,5-7,6 (2H, м).
Сравнительный пример 30
{4-[2-(бензилоксикарбонил)этокси]фенил}метанол
К раствору 3-[4-(гидроксиметил)фенокси]пропионовой кислоты (0,98 г) и карбоната калия (0,9 г) в N,N-диметилформамиде (5 мл) добавляли бензилбромид (0,65 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=2/1-1/1) с получением указанного в заголовке соединения (1,1 г).
1H-ЯМР (CDCl3)  м.д.: 1,5-1,55 (1H, м), 2,85 (2H, т, J=6,4 Гц), 4,28 (2H, т, J=6,4 Гц), 4,62 (2H, д, J=5,9 Гц), 5,18 (2H, с), 6,85-6,9 (2H, м), 7,25-7,4 (7H, м). м.д.: 1,5-1,55 (1H, м), 2,85 (2H, т, J=6,4 Гц), 4,28 (2H, т, J=6,4 Гц), 4,62 (2H, д, J=5,9 Гц), 5,18 (2H, с), 6,85-6,9 (2H, м), 7,25-7,4 (7H, м).
Сравнительный пример 31
4-гидрокси-2-метилбензальдегид
К раствору 4-бром-3-метилфенола (14 г) и N,N-диизопропиламина (39,1 мл) в дихлорметане (150 мл) добавляли хлорметилметиловый эфир (11,4 мл) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 5 дней. Реакционную смесь выливали в насыщенный водный раствор лимонной кислоты и полученную смесь экстрагировали диэтиловым эфиром. Экстракт последовательно промывали водой, 1 моль/л водного раствора гидроксида натрия, водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и получали 4-бром-3-метил-1-(метоксиметокси)бензол (16,7 г). Полученное вещество растворяли в тетрагидрофуране (250 мл). К раствору добавляли н-бутиллитий (2,64 моль/л раствор в н-гексане, 32,7 мл) при -78°С в атмосфере аргона и смесь перемешивали при той же температуре в течение 15 минут. К реакционной смеси добавляли N,N-диметилформамид (16,6 мл) и смесь перемешивали при охлаждении льдом в течение 1 часа. Реакционную смесь выливали в насыщенный водный раствор аммонийхлорида и полученную смесь экстрагировали диэтиловым эфиром. Экстракт промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и получали 2-метил-4-(метоксиметокси)бензальдегид (12,9 г). Полученное вещество растворяли в смеси тетрагидрофурана (70 мл) и метанола (10 мл). К раствору добавляли концентрированную хлористоводородную кислоту (6 мл) и смесь перемешивали при 50°С в течение 1,5 часов. Реакционную смесь выливали в насыщенный водный раствор бикарбоната натрия и полученную смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Остаток растворяли в этилацетате (30 мл), нагревая при 60°С. К раствору осторожно добавляли н-гексан (100 мл) и смесь перемешивали при той же температуре в течение 10 минут. Смесь охлаждали до комнатной температуры. К смеси добавляли н-гексан (170 мл) и полученную смесь перемешивали в течение ночи. Осажденные кристаллы собирали фильтрованием, промывали н-гексаном и затем сушили при пониженном давлении, получая указанное в заголовке соединение (5,6 г).
1H-ЯМР (CDCl3)  м.д.: 2,63 (3H, с), 5,47 (1H, с), 6,7 (1H, д, J=2,3 Гц), 6,79 (1H, дд, J=8,4 Гц, 2,3 Гц), 7,73 (1H, д, J=8,4 Гц), 10,11 (1H, с). м.д.: 2,63 (3H, с), 5,47 (1H, с), 6,7 (1H, д, J=2,3 Гц), 6,79 (1H, дд, J=8,4 Гц, 2,3 Гц), 7,73 (1H, д, J=8,4 Гц), 10,11 (1H, с).
Сравнительный пример 32
4-(2-карбоксиэтокси)-2-метилбензальдегид
К смеси 4-гидрокси-2-метилбензальдегида (5 г) и трет-бутоксида калия (4,12 г) в тетрагидрофуране (60 мл) добавляли  -пропиолактон (4,6 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь выливали в 1 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Остаток суспендировали в смеси этилацетата (20 мл) и н-гексана (100 мл). Нерастворившееся вещество собирали фильтрованием, промывали н-гексаном и сушили при пониженном давлении, получая указанное в заголовке соединение (7,2 г). -пропиолактон (4,6 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь выливали в 1 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Остаток суспендировали в смеси этилацетата (20 мл) и н-гексана (100 мл). Нерастворившееся вещество собирали фильтрованием, промывали н-гексаном и сушили при пониженном давлении, получая указанное в заголовке соединение (7,2 г).
1H-ЯМР (CDCl3)  м.д.: 2,65 (3H, с), 2,89 (2H, т, J=6,4 Гц), 4,32 (2H, т, J=6,4 Гц), 6,76 (1H, д, J=2,5 Гц), 6,85 (1H, дд, J=8,7 Гц, 2,5 Гц), 7,76 (1H, д, J=8,7 Гц), 10,12 (1H, с). м.д.: 2,65 (3H, с), 2,89 (2H, т, J=6,4 Гц), 4,32 (2H, т, J=6,4 Гц), 6,76 (1H, д, J=2,5 Гц), 6,85 (1H, дд, J=8,7 Гц, 2,5 Гц), 7,76 (1H, д, J=8,7 Гц), 10,12 (1H, с).
Сравнительный пример 33
4-[2-(бензилоксикарбонил)этокси]-2-метилбензальдегид
К суспензии 4-(2-карбоксиэтокси)-2-метилбензальдегида (7,2 г) и карбоната калия (14,3 г) в N,N-диметилформамиде (70 мл) добавляли бензилбромид (8,2 мл) при комнатной температуре и смесь перемешивали в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=4/1-3/1) с получением указанного в заголовке соединения (6,47 г).
1H-ЯМР (CDCl3)  м.д.: 2,64 (3H, с), 2,88 (2H, т, J=6,3 Гц), 4,34 (2H, т, J=6,3 Гц), 5,19 (2H, с), 6,73 (1H, д, J=2,4 Гц), 6,83 (1H, дд, J=8,5 Гц, 2,4 Гц), 7,3-7,4 (5H, м), 7,75 (1H, д, J=8,5 Гц), 10,12 (1H, с). м.д.: 2,64 (3H, с), 2,88 (2H, т, J=6,3 Гц), 4,34 (2H, т, J=6,3 Гц), 5,19 (2H, с), 6,73 (1H, д, J=2,4 Гц), 6,83 (1H, дд, J=8,5 Гц, 2,4 Гц), 7,3-7,4 (5H, м), 7,75 (1H, д, J=8,5 Гц), 10,12 (1H, с).
Сравнительный пример 34
{4-[2-(бензилоксикарбонил)этокси]-2-метилфенил}метанол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 10, с использованием 4-[2-(бензилоксикарбонил)этокси]-2-метилбензальдегида вместо 4-(2-бензилоксикарбонил-2-метилпропокси)бензальдегида.
1H-ЯМР (CDCl3)  м.д.: 1,38 (1H, т, J=5,7 Гц), 2,35 (3H, с), 2,84 (2H, т, J=6,4 Гц), 4,26 (2H, т, J=6,4 Гц), 4,63 (2H, д, J=5,7 Гц), 5,18 (2H, с), 6,7-6,75 (2H, м), 7,22 (1H, д, J=8,2 Гц), 7,3-7,4 (5H, м). м.д.: 1,38 (1H, т, J=5,7 Гц), 2,35 (3H, с), 2,84 (2H, т, J=6,4 Гц), 4,26 (2H, т, J=6,4 Гц), 4,63 (2H, д, J=5,7 Гц), 5,18 (2H, с), 6,7-6,75 (2H, м), 7,22 (1H, д, J=8,2 Гц), 7,3-7,4 (5H, м).
Сравнительный пример 35
4-({4-[2-(бензилоксикарбонил)этокси]фенил}метил)-1,2-дигидро-5-изопропил-3Н-пиразол-3-он
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 11, с использованием {4-[2-(бензилоксикарбонил)этокси]фенил}метанола вместо [4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метанола.
1H-ЯМР (ДМСО-d6)  м.д.: 1,05-1,1 (6H, м), 2,75-2,85 (3H, м), 3,5 (2H, с), 4,16 (2H, т, J=5,9 Гц), 5,14 (2H, с), 6,75-6,8 (2H, м), 7,0-7,05 (2H, м), 7,3-7,4 (5H, м). м.д.: 1,05-1,1 (6H, м), 2,75-2,85 (3H, м), 3,5 (2H, с), 4,16 (2H, т, J=5,9 Гц), 5,14 (2H, с), 6,75-6,8 (2H, м), 7,0-7,05 (2H, м), 7,3-7,4 (5H, м).
Сравнительный пример 36
4-({4-[2-(бензилоксикарбонил)этокси]-2-метилфенил}метил)-5-изопропил-3Н-пиразол-3-он
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 11, с использованием {4-[2-(бензилоксикарбонил)этокси]-2-метилфенил}метанола вместо [4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метанола.
1H-ЯМР (CDCl3)  м.д.: 1,12 (6H, д, J=6,8 Гц), 2,3 (3H, с), 2,75-2,9 (3H, м), 3,6 (2H, с), 4,23 (2H, т, J=6,2 Гц), 5,17 (2H, с), 6,62 (1H, дд, J=8,5 Гц, 2,7 Гц), 6,7 (1H, д, J=2,7 Гц), 6,94 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м). м.д.: 1,12 (6H, д, J=6,8 Гц), 2,3 (3H, с), 2,75-2,9 (3H, м), 3,6 (2H, с), 4,23 (2H, т, J=6,2 Гц), 5,17 (2H, с), 6,62 (1H, дд, J=8,5 Гц, 2,7 Гц), 6,7 (1H, д, J=2,7 Гц), 6,94 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м).
Сравнительный пример 37
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[2-(бензилоксикарбонил)этокси]фенил}метил)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-({4-[2-(бензилоксикарбонил)этокси]фенил}метил)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 12, с использованием 4-({4-[2-(бензилоксикарбонил)этокси]фенил}метил)-1,2-дигидро-5-изопропил-3Н-пиразол-3-она вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она.
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6H, м), 1,87 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,82 (2H, т, J=6,4 Гц), 2,85-2,95 (1H, м), 3,57 (1H, д, J=15,9 Гц), 3,63 (1H, д, J=15,9 Гц), 3,8-3,9 (1H, м), 4,1-4,15 (1H, м), 4,22 (2H, т, J=6,4 Гц), 4,31 (1H, дд, J=12,4 Гц, 4,0 Гц), 5,16 (2H, с), 5,2-5,3 (3H, м), 5,58 (1H, д, J=7,6 Гц), 6,7-6,8 (2H, м), 7,0-7,05 (2H, м), 1,3-1,4 (5H, м). м.д.: 1,1-1,2 (6H, м), 1,87 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,06 (3H, с), 2,82 (2H, т, J=6,4 Гц), 2,85-2,95 (1H, м), 3,57 (1H, д, J=15,9 Гц), 3,63 (1H, д, J=15,9 Гц), 3,8-3,9 (1H, м), 4,1-4,15 (1H, м), 4,22 (2H, т, J=6,4 Гц), 4,31 (1H, дд, J=12,4 Гц, 4,0 Гц), 5,16 (2H, с), 5,2-5,3 (3H, м), 5,58 (1H, д, J=7,6 Гц), 6,7-6,8 (2H, м), 7,0-7,05 (2H, м), 1,3-1,4 (5H, м).
Сравнительный пример 38
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[2-(бензилоксикарбонил)этокси]фенил}метил)-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-({4-[2-(бензилоксикарбонил)этокси]фенил}метил)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 12, с использованием 4-({4-[2-(бензилоксикарбонил)этокси]фенил}метил)-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-галактозы вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-галактозы вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-глюкозы, соответственно. -D-глюкозы, соответственно.
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6H, м), 1,88 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,17 (3H, с), 2,8-2,9 (3H, м), 3,58 (1H, д, J=16,1 Гц), 3,65 (1H, д, J=16,1 Гц), 4,0-4,25 (5H, м), 5,09 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,17 (2H, с), 5,4-5,45 (2H, м), 5,55 (1H, д, J=8,2 Гц), 6,7-6,8 (2H, м), 7,0-7,05 (2H, м), 7,25-7,35 (5H, м). м.д.: 1,1-1,2 (6H, м), 1,88 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,17 (3H, с), 2,8-2,9 (3H, м), 3,58 (1H, д, J=16,1 Гц), 3,65 (1H, д, J=16,1 Гц), 4,0-4,25 (5H, м), 5,09 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,17 (2H, с), 5,4-5,45 (2H, м), 5,55 (1H, д, J=8,2 Гц), 6,7-6,8 (2H, м), 7,0-7,05 (2H, м), 7,25-7,35 (5H, м).
Сравнительный пример 39
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[2-(бензилоксикарбонил)этокси]-2-метилфенил}метил)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-({4-[2-(бензилоксикарбонил)этокси]-2-метилфенил}метил)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 12, с использованием 4-({4-[2-(бензилоксикарбонил)этокси]-2-метилфенил}метил)-5-изопропил-3Н-пиразол-3-она вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она.
1H-ЯМР (CDCl3)  м.д.: 1,05-1,15 (6H, м), 1,8 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,06 (3H, с), 2,25 (3H, с), 2,7-2,85 (3H, м), 3,49 (1H, д, J=16,2 Гц), 3,59 (1H, д, J=16,2 Гц), 3,8-3,9 (1Н, м), 4,12 (1H, дд, J=12,4 Гц, 2,3 Гц), 4,21 (2H, т, J=6,6 Гц), 4,3 (1H, дд, J=12,4 Гц, 4,0 Гц), 5,15-5,3 (5H, м), 5,56 (1H, д, J=8,0 Гц), 6,57 (1H, дд, J=8,5 Гц, 2,4 Гц), 6,67 (1H, д, J=2,4 Гц), 6,8 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м). м.д.: 1,05-1,15 (6H, м), 1,8 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,06 (3H, с), 2,25 (3H, с), 2,7-2,85 (3H, м), 3,49 (1H, д, J=16,2 Гц), 3,59 (1H, д, J=16,2 Гц), 3,8-3,9 (1Н, м), 4,12 (1H, дд, J=12,4 Гц, 2,3 Гц), 4,21 (2H, т, J=6,6 Гц), 4,3 (1H, дд, J=12,4 Гц, 4,0 Гц), 5,15-5,3 (5H, м), 5,56 (1H, д, J=8,0 Гц), 6,57 (1H, дд, J=8,5 Гц, 2,4 Гц), 6,67 (1H, д, J=2,4 Гц), 6,8 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м).
Сравнительный пример 40
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)фенил]метил}-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)фенил]метил}-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 13, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[2-(бензилоксикарбонил)этокси]фенил}метил)-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[2-(бензилоксикарбонил)этокси]фенил}метил)-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно. -D-глюкопиранозилокси)-4-({4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразола и гидрохлорида глицинамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,89 (3H, с), 1,97 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,71 (2H, т, J=6,2 Гц), 2,85-2,95 (1H, м), 3,6 (2H, с), 3,9-3,95 (1H, м), 4,1-4,15 (1H, м), 4,18 (2H, т, J=6,2 Гц), 4,3 (1H, дд, J=12,4 Гц, 4,0 Гц), 5,05-5,15 (2H, м), 5,25-5,35 (1H, м), 5,48 (1H, д, J=8,0 Гц), 6,75-6,8 (2H, м), 7,0-7,05 (2H, м). м.д.: 1,1-1,15 (6H, м), 1,89 (3H, с), 1,97 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,71 (2H, т, J=6,2 Гц), 2,85-2,95 (1H, м), 3,6 (2H, с), 3,9-3,95 (1H, м), 4,1-4,15 (1H, м), 4,18 (2H, т, J=6,2 Гц), 4,3 (1H, дд, J=12,4 Гц, 4,0 Гц), 5,05-5,15 (2H, м), 5,25-5,35 (1H, м), 5,48 (1H, д, J=8,0 Гц), 6,75-6,8 (2H, м), 7,0-7,05 (2H, м).
Сравнительный пример 41
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-{[4-(2-карбоксиэтокси)фенил]метил}-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-{[4-(2-карбоксиэтокси)фенил]метил}-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 13, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[2-(бензилоксикарбонил)этокси]фенил}метил)-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[2-(бензилоксикарбонил)этокси]фенил}метил)-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-({4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразола.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,9 (3H, с), 1,95 (3H, с), 1,99 (3H, с), 2,16 (3H, с), 2,71 (2H, т, J=6,1 Гц), 2,85-2,95 (1H, м), 3,61 (2H, с), 4,05-4,2 (5H, м), 5,19 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,25-5,35 (1H, м), 5,4-5,45 (1H, м), 5,46 (1H, д, J=8,1 Гц), 6,75-6,8 (2H, м), 7,0-7,05 (2H, м). м.д.: 1,1-1,2 (6H, м), 1,9 (3H, с), 1,95 (3H, с), 1,99 (3H, с), 2,16 (3H, с), 2,71 (2H, т, J=6,1 Гц), 2,85-2,95 (1H, м), 3,61 (2H, с), 4,05-4,2 (5H, м), 5,19 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,25-5,35 (1H, м), 5,4-5,45 (1H, м), 5,46 (1H, д, J=8,1 Гц), 6,75-6,8 (2H, м), 7,0-7,05 (2H, м).
Сравнительный пример 42
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 13, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[2-(бензилоксикарбонил)этокси]-2-метилфенил}метил)-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[2-(бензилоксикарбонил)этокси]-2-метилфенил}метил)-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-({4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-5-изопропил-1Н-пиразола.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,82 (3H, с), 1,96 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,26 (3H, с), 2,7 (2H, т, J=6,2 Гц), 2,75-2,9 (1H, м), 3,53 (1H, д, J=16,4 Гц), 3,58 (1H, д, J=16,4 Гц), 3,85-3,95 (1H, м), 4,08 (1H, дд, J=12,4 Гц, 2,4 Гц), 4,17 (2H, т, J=6,2 Гц), 4,28 (1H, дд, J=12,4 Гц, 4,l Гц), 5,0-5,15 (2H, м), 5,27 (1H, т, J=9,6 Гц), 5,43 (1H, д, J=7,9 Гц), 6,61 (1H, дд, J=8,5 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,77 (1H, д, J=8,5 Гц). м.д.: 1,1-1,15 (6H, м), 1,82 (3H, с), 1,96 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,26 (3H, с), 2,7 (2H, т, J=6,2 Гц), 2,75-2,9 (1H, м), 3,53 (1H, д, J=16,4 Гц), 3,58 (1H, д, J=16,4 Гц), 3,85-3,95 (1H, м), 4,08 (1H, дд, J=12,4 Гц, 2,4 Гц), 4,17 (2H, т, J=6,2 Гц), 4,28 (1H, дд, J=12,4 Гц, 4,l Гц), 5,0-5,15 (2H, м), 5,27 (1H, т, J=9,6 Гц), 5,43 (1H, д, J=7,9 Гц), 6,61 (1H, дд, J=8,5 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,77 (1H, д, J=8,5 Гц).
Сравнительный пример 43
4-({4-[3-карбоксипропокси)2-метилфенил]метил}-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол -D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 25, с использованием 4-({4-[3-(бензилоксикарбонил)пропокси]-2-метилфенил}метил)-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола. -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,04 (9H, с), 1,05-1,2 (33H, м), 2,05-2,15 (2H, м), 2,25 (3H, с), 2,5-2,6 (2H, м), 2,7-2,8 (1H, м), 3,52 (2H, с), 3,8-3,9 (1H, м), 3,95-4,0 (2H, м), 4,05-4,15 (1H, м), 4,17 (1H, дд, J=12,4 Гц, 1,9 Гц), 5,15-5,3 (2H, м), 5,36 (1H, т, J=9,4 Гц), 5,53 (1H, д, J=8,3 Гц), 6,57 (1H, дд, J=8,4 Гц, 2,7 Гц), 6,67 (1H, д, J=2,7 Гц), 6,81 (1H, д, J=8,4 Гц). м.д.: 1,04 (9H, с), 1,05-1,2 (33H, м), 2,05-2,15 (2H, м), 2,25 (3H, с), 2,5-2,6 (2H, м), 2,7-2,8 (1H, м), 3,52 (2H, с), 3,8-3,9 (1H, м), 3,95-4,0 (2H, м), 4,05-4,15 (1H, м), 4,17 (1H, дд, J=12,4 Гц, 1,9 Гц), 5,15-5,3 (2H, м), 5,36 (1H, т, J=9,4 Гц), 5,53 (1H, д, J=8,3 Гц), 6,57 (1H, дд, J=8,4 Гц, 2,7 Гц), 6,67 (1H, д, J=2,7 Гц), 6,81 (1H, д, J=8,4 Гц).
Сравнительный пример 44
Гидрохлорид бензил-2-амино-2-метилпропионата
К раствору 2-(трет-бутоксикарбониламино)-2-метилпропионовой кислоты (4,06 г) в N,N-диметилформамиде (40 мл) добавляли карбонат калия (4,15 г) и бензилбромид (2,85 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. Остаток (твердый) обрабатывали н-гексаном и собирали фильтрованием. Кристаллы сушили при пониженном давлении и получали бензил-2-(трет-бутоксикарбониламино)-2-метилпропионат (4,44 г). К полученному бензил-2-(трет-бутоксикарбониламино)-2-метилпропионату (4,44 г) добавляли хлористоводородную кислоту (4 моль/л раствор в 1,4-диоксане, 15 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли диэтиловым эфиром и полученную смесь перемешивали в течение 1 часа. Нерастворившееся вещество собирали фильтрованием и промывали диэтиловым эфиром, и затем сушили при пониженном давлении, получая указанное в заголовке соединение (3,4 г).
1H-ЯМР (ДМСО-d6)  м.д.: 1,49 (6H, с), 5,25 (2H, с), 7,3-7,45 (5H, м), 8,54 (3H, шир.с). м.д.: 1,49 (6H, с), 5,25 (2H, с), 7,3-7,45 (5H, м), 8,54 (3H, шир.с).
Сравнительный пример 45
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола (0,14 г) в N,N-диметилформамиде (3 мл) добавляли гидрохлорид бензил-2-амино-2-метилпропионата (57 мг), 1-гидроксибензотриазол (31 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (60 мг) и триэтиламин (0,087 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=40/1-20/1), получая указанное в заголовке соединение (0,15 г). -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола (0,14 г) в N,N-диметилформамиде (3 мл) добавляли гидрохлорид бензил-2-амино-2-метилпропионата (57 мг), 1-гидроксибензотриазол (31 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (60 мг) и триэтиламин (0,087 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=40/1-20/1), получая указанное в заголовке соединение (0,15 г).
1H-ЯМР (CDCl3)  м.д.: 1,1-1,15 (6H, м), 1,56 (6H, с), 1,81 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,05 (3H, с), 2,25 (3H, с), 2,6 (2H, т, J=6,1 Гц), 2,75-2,85 (1H, м), 3,5 (1H, д, J=16,7 Гц), 3,59 (1H, д, J=16,7 Гц), 3,8-3,9 (1Н, м), 4,05-4,2 (3H, м), 4,29 (1H, дд, J=12,5 Гц, 4,0 Гц), 5,1-5,3 (5H, м), 5,56 (1H, д, J=8,1 Гц), 6,53 (1H, шир.с), 6,57 (1H, дд, J=8,5 Гц, 2,5 Гц), 6,67 (1H, д, J=2,5 Гц), 6,8 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м). м.д.: 1,1-1,15 (6H, м), 1,56 (6H, с), 1,81 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,05 (3H, с), 2,25 (3H, с), 2,6 (2H, т, J=6,1 Гц), 2,75-2,85 (1H, м), 3,5 (1H, д, J=16,7 Гц), 3,59 (1H, д, J=16,7 Гц), 3,8-3,9 (1Н, м), 4,05-4,2 (3H, м), 4,29 (1H, дд, J=12,5 Гц, 4,0 Гц), 5,1-5,3 (5H, м), 5,56 (1H, д, J=8,1 Гц), 6,53 (1H, шир.с), 6,57 (1H, дд, J=8,5 Гц, 2,5 Гц), 6,67 (1H, д, J=2,5 Гц), 6,8 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м).
Сравнительный пример 46
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(бензилоксикарбонил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(бензилоксикарбонил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 45, с использованием соли бензил-(S)-2-аминопропионата и п-толуолсульфоновой кислоты вместо гидрохлорида бензил-2-амино-2-метилпропионата.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,38 (3H, д, J=7,3 Гц), 1,82 (3H, с), 1,95 (3H, с), 2,0 (3H, с), 2,01 (3H, с), 2,25 (3H, с), 2,6-2,7 (2H, м), 2,75-2,9 (1H, м), 3,52 (1H, д, J=16,5 Гц), 3,58 (1H, д, J=16,5 Гц), 3,85-3,95 (1H, м), 4,07 (1H, дд, J=12,2 Гц, 2,5 Гц), 4,1-4,2 (2H, м), 4,27 (1H, дд, J=12,2 Гц, 4,2 Гц), 4,4-4,5 (1H, м), 5,0-5,2 (4H, м), 5,28 (1H, т, J=9,5 Гц), 5,43 (1H, д, J=7,9 Гц), 6,58 (1H, дд, J=8,5 Гц, 2,2 Гц), 6,69 (1H, д, J=2,2 Гц), 6,76 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м). м.д.: 1,05-1,15 (6H, м), 1,38 (3H, д, J=7,3 Гц), 1,82 (3H, с), 1,95 (3H, с), 2,0 (3H, с), 2,01 (3H, с), 2,25 (3H, с), 2,6-2,7 (2H, м), 2,75-2,9 (1H, м), 3,52 (1H, д, J=16,5 Гц), 3,58 (1H, д, J=16,5 Гц), 3,85-3,95 (1H, м), 4,07 (1H, дд, J=12,2 Гц, 2,5 Гц), 4,1-4,2 (2H, м), 4,27 (1H, дд, J=12,2 Гц, 4,2 Гц), 4,4-4,5 (1H, м), 5,0-5,2 (4H, м), 5,28 (1H, т, J=9,5 Гц), 5,43 (1H, д, J=7,9 Гц), 6,58 (1H, дд, J=8,5 Гц, 2,2 Гц), 6,69 (1H, д, J=2,2 Гц), 6,76 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м).
Сравнительный пример 47
4-[(4-{3-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол -D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 45, с использованием 4-{[4-(3-карбоксипропокси)-2-метилфенил]метил}-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола
1H-ЯМР (CD3OD)  м.д.: 1,0-1,2 (42H, м), 1,52 (6H, с), 1,95-2,1 (2H, м), 2,25 (3H, с), 2,34 (2H, т, J=7,3 Гц), 2,7-2,85 (1H, м), 3,52 (2H, с), 3,8-3,95 (3H, м), 4,05-4,2 (2H, м), 5,1-5,25 (4H, м), 5,36 (1Н, т, J=9,1 Гц), 5,65 (1H, д, J=8,3 Гц), 6,05 (1H, шир.с), 6,53 (1H, 3д, J=8,2 Гц, 2,5 Гц), 6,65 (1H, д, J=2,5 Гц), 6,81 (1H, д, J=8,2 Гц), 7,25-7,4 (5H, м). м.д.: 1,0-1,2 (42H, м), 1,52 (6H, с), 1,95-2,1 (2H, м), 2,25 (3H, с), 2,34 (2H, т, J=7,3 Гц), 2,7-2,85 (1H, м), 3,52 (2H, с), 3,8-3,95 (3H, м), 4,05-4,2 (2H, м), 5,1-5,25 (4H, м), 5,36 (1Н, т, J=9,1 Гц), 5,65 (1H, д, J=8,3 Гц), 6,05 (1H, шир.с), 6,53 (1H, 3д, J=8,2 Гц, 2,5 Гц), 6,65 (1H, д, J=2,5 Гц), 6,81 (1H, д, J=8,2 Гц), 7,25-7,4 (5H, м).
Сравнительный пример 48
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол (0,15 г) растворяли в метаноле (5 мл). К раствору добавляли порошкообразный 10% палладий на угле (50 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении, получая указанное в заголовке соединение (0,13 г). -D-глюкопиранозилокси)-4-[(4-{2-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол (0,15 г) растворяли в метаноле (5 мл). К раствору добавляли порошкообразный 10% палладий на угле (50 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении, получая указанное в заголовке соединение (0,13 г).
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,47 (6H, с), 1,82 (3H, с), 1,96 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,26 (3H, с), 2,6 (2H, т, J=6,3 Гц), 2,75-2,9 (1H, м), 3,52 (1H, д, J=16,4 Гц), 3,58 (1H, д, J=16,4 Гц), 3,85-3,95 (1H, м), 4,07 (1H, дд, J=12,4 Гц, 2,2 Гц), 4,16 (2H, т, J=6,3 Гц), 4,27 (1H, дд, J=12,4 Гц, 4,0 Гц), 5,0-5,15 (2H, м), 5,28 (1H, т, J=9,5 Гц), 5,43 (1H, д, J=8,2 Гц), 6,61 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,71 (1Н, д, J=2,6 Гц), 6,77 (1Н, д, J=8,5Гц). м.д.: 1,05-1,15 (6H, м), 1,47 (6H, с), 1,82 (3H, с), 1,96 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,26 (3H, с), 2,6 (2H, т, J=6,3 Гц), 2,75-2,9 (1H, м), 3,52 (1H, д, J=16,4 Гц), 3,58 (1H, д, J=16,4 Гц), 3,85-3,95 (1H, м), 4,07 (1H, дд, J=12,4 Гц, 2,2 Гц), 4,16 (2H, т, J=6,3 Гц), 4,27 (1H, дд, J=12,4 Гц, 4,0 Гц), 5,0-5,15 (2H, м), 5,28 (1H, т, J=9,5 Гц), 5,43 (1H, д, J=8,2 Гц), 6,61 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,71 (1Н, д, J=2,6 Гц), 6,77 (1Н, д, J=8,5Гц).
Сравнительный пример 49
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбокси)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбокси)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 48, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(бензилоксикарбонил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(бензилоксикарбонил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-[(4-{2-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,39 (3H, д, J=7,3 Гц), 1,82 (3H, с), 1,96 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,26 (3H, с), 2,6-2,7 (2H, м), 2,75-2,9 (1H, м), 3,52 (1H, д, J=16,6 Гц), 3,58 (1H, д, J=16,6 Гц), 3,85-3,95 (1H, м), 4,07 (1H, дд, J=12,4 Гц, 2,5 Гц), 4,1-4,25 (2H, м), 4,27 (1H, дд, J=12,4 Гц, 4,0 Гц), 4,4 (1H, кв., J=7,3 Гц), 5,0-5,15 (2H, м), 5,28 (1H, т, J=9,4 Гц), 5,43 (1H, д, J=8,0 Гц), 6,62 (1H, дд,J=8,3 Гц, 2,7 Гц), 6,72 (1H, д, J=2,7 Гц), 6,77 (1H, д, J=8,3 Гц). м.д.: 1,05-1,15 (6H, м), 1,39 (3H, д, J=7,3 Гц), 1,82 (3H, с), 1,96 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,26 (3H, с), 2,6-2,7 (2H, м), 2,75-2,9 (1H, м), 3,52 (1H, д, J=16,6 Гц), 3,58 (1H, д, J=16,6 Гц), 3,85-3,95 (1H, м), 4,07 (1H, дд, J=12,4 Гц, 2,5 Гц), 4,1-4,25 (2H, м), 4,27 (1H, дд, J=12,4 Гц, 4,0 Гц), 4,4 (1H, кв., J=7,3 Гц), 5,0-5,15 (2H, м), 5,28 (1H, т, J=9,4 Гц), 5,43 (1H, д, J=8,0 Гц), 6,62 (1H, дд,J=8,3 Гц, 2,7 Гц), 6,72 (1H, д, J=2,7 Гц), 6,77 (1H, д, J=8,3 Гц).
Сравнительный пример 50
4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-1Н-пиразол -D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 48, с использованием 4-[(4-{3-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-[(4-{2-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (42H, м), 1,44 (6H, с), 1,95-2,05 (2H, м), 2,26 (3H, с), 2,35 (2H, т, J=7,4 Гц), 2,75-2,85 (1H, м), 3,5-3,6 (2H, м), 3,9-4,0 (3H, м), 4,09 (1H, дд, J=12,4 Гц, 1,8 Гц), 4,17 (1H, дд, J=12,4 Гц, 4,2 Гц), 5,05-5,2 (2H, м), 5,39 (1H, т, J=9,5 Гц), 5,58 (1H, д, J=7,9 Гц), 6,58 (1H, дд, J=8,4 Гц, 2,6 Гц), 6,7 (1H, д, J=2,6 Гц), 6,8 (1H, д, J=8,4 Гц). м.д.: 1,05-1,2 (42H, м), 1,44 (6H, с), 1,95-2,05 (2H, м), 2,26 (3H, с), 2,35 (2H, т, J=7,4 Гц), 2,75-2,85 (1H, м), 3,5-3,6 (2H, м), 3,9-4,0 (3H, м), 4,09 (1H, дд, J=12,4 Гц, 1,8 Гц), 4,17 (1H, дд, J=12,4 Гц, 4,2 Гц), 5,05-5,2 (2H, м), 5,39 (1H, т, J=9,5 Гц), 5,58 (1H, д, J=7,9 Гц), 6,58 (1H, дд, J=8,4 Гц, 2,6 Гц), 6,7 (1H, д, J=2,6 Гц), 6,8 (1H, д, J=8,4 Гц).
Сравнительный пример 51
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{4-[1-карбокси-1-(метил)этилкарбамоил]бутил}фенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-{4-[1-карбокси-1-(метил)этилкарбамоил]бутил}фенил)метил]-5-изопропил-1Н-пиразол
Смесь 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-иодфенил)метил]-5-изопропил-1Н-пиразола (0,43 г), 4-пентиновой кислоты (94 мг), тетракис(трифенилфосфин)палладия (0) (37 мг), иодида калия (I)(12 мг) и триэтиламина (0,45 мл) в тетрагидрофуране (5 мл) перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Реакционную смесь выливали в 0,5 моль/л хлористо-водородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/2-этилацетат), получая 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-иодфенил)метил]-5-изопропил-1Н-пиразола (0,43 г), 4-пентиновой кислоты (94 мг), тетракис(трифенилфосфин)палладия (0) (37 мг), иодида калия (I)(12 мг) и триэтиламина (0,45 мл) в тетрагидрофуране (5 мл) перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Реакционную смесь выливали в 0,5 моль/л хлористо-водородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/2-этилацетат), получая 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-(4-карбоксибут-1-инил)фенил]метил}-5-изопропил-1Н-пиразол (0,37 г). Полученное вещество растворяли в N,N-диметилформамиде (6 мл). К раствору добавляли гидрохлорид бензил-2-амино-2-метилпропионата (0,15 г), 1-гидроксибензотриазол (86 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,22 г) и триэтиламин (0,32 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт последовательно промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=20/1), получая 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-(4-карбоксибут-1-инил)фенил]метил}-5-изопропил-1Н-пиразол (0,37 г). Полученное вещество растворяли в N,N-диметилформамиде (6 мл). К раствору добавляли гидрохлорид бензил-2-амино-2-метилпропионата (0,15 г), 1-гидроксибензотриазол (86 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,22 г) и триэтиламин (0,32 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в 0,5 моль/л хлористоводородной кислоты и полученную смесь экстрагировали этилацетатом. Экстракт последовательно промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=20/1), получая 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{4-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]бут-1-инил}фенил)метил]-5-изопропил-1Н-пиразол (0,36 г). Это вещество растворяли в метаноле (5 мл). К раствору добавляли порошкообразный 10% палладий на угле (50 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 2 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (0,31 г). -D-галактопиранозилокси)-4-[(4-{4-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]бут-1-инил}фенил)метил]-5-изопропил-1Н-пиразол (0,36 г). Это вещество растворяли в метаноле (5 мл). К раствору добавляли порошкообразный 10% палладий на угле (50 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 2 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (0,31 г).
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,44 (6H, с), 1,55-1,65 (4H, м), 1,88 (3H, с), 1,95 (3H, с), 1,99 (3H, с), 2,1-2,2 (5H, м), 2,5-2,6 (2H, м), 2,85-3,0 (1H, м), 3,55-3,7 (2H, м), 4,05-4,2 (3H, м), 5,19 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,25-5,35 (1H, м), 5,4-5,45 (1H, м), 5,46 (1H, д, J=8,1 Гц), 7,0-7,1 (4H, м). м.д.: 1,1-1,2 (6H, м), 1,44 (6H, с), 1,55-1,65 (4H, м), 1,88 (3H, с), 1,95 (3H, с), 1,99 (3H, с), 2,1-2,2 (5H, м), 2,5-2,6 (2H, м), 2,85-3,0 (1H, м), 3,55-3,7 (2H, м), 4,05-4,2 (3H, м), 5,19 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,25-5,35 (1H, м), 5,4-5,45 (1H, м), 5,46 (1H, д, J=8,1 Гц), 7,0-7,1 (4H, м).
Сравнительный пример 78
4-[(4-{2-[1-карбамоил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола (0,2 г) в N,N-диметилформамиде (3 мл) добавляли 2-амино-2-метилпропионамид (47 мг), 1-гидроксибензотриазол (50 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (118 мг) и триэтиламина (0,13 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=20/1-10/1), получая 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола (0,2 г) в N,N-диметилформамиде (3 мл) добавляли 2-амино-2-метилпропионамид (47 мг), 1-гидроксибензотриазол (50 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (118 мг) и триэтиламина (0,13 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=20/1-10/1), получая 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбамоил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол (1,12 г). Это вещество растворяли в метаноле (3 мл). К раствору добавляли метоксид натрия (28% метанольный раствор, 0,06 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (0,1 мл) и полученную смесь концентрировали при пониженном давлении. Остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) и получали указанное в заголовке соединение (80 мг). -D-глюкопиранозилокси)-4-[(4-{2-[1-карбамоил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол (1,12 г). Это вещество растворяли в метаноле (3 мл). К раствору добавляли метоксид натрия (28% метанольный раствор, 0,06 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (0,1 мл) и полученную смесь концентрировали при пониженном давлении. Остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол) и получали указанное в заголовке соединение (80 мг).
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,47 (6H, с), 2,29 (3Н, с), 2,62 (2Н, т, J=6,1 Гц), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,6-3,75 (3H, м), 3,81 (1H, д, J=11,9 Гц), 4,18 (2H, т, J=6,1 Гц), 4,95-5,05 (1H, м), 6,63 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,72 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,4 Гц). м.д.: 1,05-1,15 (6H, м), 1,47 (6H, с), 2,29 (3Н, с), 2,62 (2Н, т, J=6,1 Гц), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,6-3,75 (3H, м), 3,81 (1H, д, J=11,9 Гц), 4,18 (2H, т, J=6,1 Гц), 4,95-5,05 (1H, м), 6,63 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,72 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,4 Гц).
Сравнительный пример 79
4-[(4-{2-[1-карбамоил-1-(метил)этилкарбамоил]этокси}фенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 78, с использованием 3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксипропокси)фенил]метил}-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксипропокси)фенил]метил}-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола
1H-ЯМР (CD3OD)  м.д.: 1,5-1,15 (6H, м), 1,47 (6H, с), 2,63 (2H, т, J=6,2 Гц), 2,85-2,95 (1H, м), 3,3-3,4 (4H, м), 3,6-3,75 (3H, м), 3,8-3,85 (1H, м), 4,19 (2H, т, J=6,2 Гц), 5,05-5,1 (1H, м), 6,8-6,85 (2H, м), 7,1-7,15 (2H, м). м.д.: 1,5-1,15 (6H, м), 1,47 (6H, с), 2,63 (2H, т, J=6,2 Гц), 2,85-2,95 (1H, м), 3,3-3,4 (4H, м), 3,6-3,75 (3H, м), 3,8-3,85 (1H, м), 4,19 (2H, т, J=6,2 Гц), 5,05-5,1 (1H, м), 6,8-6,85 (2H, м), 7,1-7,15 (2H, м).
Пример 80
3-( -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-ди(метил)этилкарбамоил]этокси}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-ди(метил)этилкарбамоил]этокси}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксипропокси)фенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метил-1-пропанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксипропокси)фенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метил-1-пропанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,27 (6H, с), 2,59 (2H, т, J=6,2 Гц), 2,85-2,95 (1H, м), 3,3-3,4 (4H, м), 3,57 (2H, с), 3,6-3,85 (4H, м), 4,16 (2H, т, J=6,2 Гц), 5,05-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м). м.д.: 1,1-1,15 (6H, м), 1,27 (6H, с), 2,59 (2H, т, J=6,2 Гц), 2,85-2,95 (1H, м), 3,3-3,4 (4H, м), 3,57 (2H, с), 3,6-3,85 (4H, м), 4,16 (2H, т, J=6,2 Гц), 5,05-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Сравнительный пример 52
1-(2-амино-2-метилпропионил)-4-метилпиперазин
К раствору 2-бензилоксикарбониламино-2-метилпропионовой кислоты (2,37 г) в тетрагидрофуране (20 мл) добавляли 1,1′-карбонилбис-1Н-имидазол (1,78 г) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 1-метилпиперазин (2,0 мл) и смесь перемешивали при 40°С в течение в течение 3,5 дней. К реакционной смеси добавляли метанол и полученную смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=20/1), получая 1-(2-бензилоксикарбониламино-2-метилпропионил)-4-метилпиперазин (1,99 г). Это вещество растворяли в метаноле (10 мл). К раствору добавляли порошкообразный 10% палладий на угле (0,4 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (1,14 г).
1H-ЯМР (CD3OD)  м.д.: 1,39 (6H, с), 2,3 (3H, с), 2,44 (4H, т, J=5,1 Гц), 3,77 (4H, шир.с). м.д.: 1,39 (6H, с), 2,3 (3H, с), 2,44 (4H, т, J=5,1 Гц), 3,77 (4H, шир.с).
Сравнительный Пример 53
2-(2-амино-2-метилпропиониламино)этанол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 52, с использованием 2-аминоэтанола вместо 1-метилпиперазина.
1H-ЯМР (CD3OD)  м.д.: 1,31 (6H, с), 3,25-3,35 (2H, м), 3,6 (2H, т, J=5,8 Гц). м.д.: 1,31 (6H, с), 3,25-3,35 (2H, м), 3,6 (2H, т, J=5,8 Гц).
Пример 81
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[(4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)фенил]метил}-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-{[(4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)фенил]метил}-5-изопропил-1Н-пиразола и 1-(2-амино-2-метилпропионил)-4-метилпиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)фенил]метил}-5-изопропил-1Н-пиразола и 1-(2-амино-2-метилпропионил)-4-метилпиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,45 (6H, с), 2,2 (3H, с), 2,3-2,5 (4H, м), 2,6 (2H, т, J=5,7 Гц), 2,85-2,95 (1H, м), 3,3-3,4 (4H, м), 3,6-3,9 (8H, м), 4,18 (2H, т, J=5,7 Гц), 5,05-5,1 (1H, м), 6,75-6,85 (2H, м), 7,1-7,15 (2H, м). м.д.: 1,05-1,2 (6H, м), 1,45 (6H, с), 2,2 (3H, с), 2,3-2,5 (4H, м), 2,6 (2H, т, J=5,7 Гц), 2,85-2,95 (1H, м), 3,3-3,4 (4H, м), 3,6-3,9 (8H, м), 4,18 (2H, т, J=5,7 Гц), 5,05-5,1 (1H, м), 6,75-6,85 (2H, м), 7,1-7,15 (2H, м).
Пример 82
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)фенил]метил}-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-{[4-(2-карбоксиэтокси)фенил]метил}-5-изопропил-1Н-пиразола и 1-(2-амино-2-метилпропионил)-4-метилпиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-{[4-(2-карбоксиэтокси)фенил]метил}-5-изопропил-1Н-пиразола и 1-(2-амино-2-метилпропионил)-4-метилпиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,45 (6H, с), 2,17 (3H, с), 2,35 (4H, шир.с), 2,6 (2H, т, J=5,6 Гц), 2,85-2,95 (1H, м), 3,52 (1H, дд, J=9,7 Гц, 3,2 Гц), 3,55-3,9 (11H, м), 4,18 (2H, т, J=5,6 Гц), 5,08 (1H, д, J=7,6 Гц), 6,75-6,85 (2H, м), 7,05-7,2 (2H, м). м.д.: 1,05-1,2 (6H, м), 1,45 (6H, с), 2,17 (3H, с), 2,35 (4H, шир.с), 2,6 (2H, т, J=5,6 Гц), 2,85-2,95 (1H, м), 3,52 (1H, дд, J=9,7 Гц, 3,2 Гц), 3,55-3,9 (11H, м), 4,18 (2H, т, J=5,6 Гц), 5,08 (1H, д, J=7,6 Гц), 6,75-6,85 (2H, м), 7,05-7,2 (2H, м).
Пример 83
3-( -D-глюкопиранозилокси)-4-[(4-{2-[1-(2-гидроксиэтилкарбамоил)-1-(метил)этилкарбамоил]этокси}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[1-(2-гидроксиэтилкарбамоил)-1-(метил)этилкарбамоил]этокси}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)фенил]метил}-5-изопропил-1Н-пиразола и 2-(2-амино-2-метилпропиониламино)этанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)фенил]метил}-5-изопропил-1Н-пиразола и 2-(2-амино-2-метилпропиониламино)этанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,45 (6H, с), 2,63 (2H, т, J=6,2 Гц), 2,85-2,95 (1H, м), 3,24 (2H, т, J=5,9 Гц), 3,3-3,4 (4H, м), 3,51 (2H, т, J=5,9 Гц), 3,6-3,85 (4H, м), 4,19 (2H, т, J=6,2 Гц), 5,05-5,1 (1H, м), 6,8-6,85 (2H, м), 7,1-7,15 (2H, м). м.д.: 1,1-1,15 (6H, м), 1,45 (6H, с), 2,63 (2H, т, J=6,2 Гц), 2,85-2,95 (1H, м), 3,24 (2H, т, J=5,9 Гц), 3,3-3,4 (4H, м), 3,51 (2H, т, J=5,9 Гц), 3,6-3,85 (4H, м), 4,19 (2H, т, J=6,2 Гц), 5,05-5,1 (1H, м), 6,8-6,85 (2H, м), 7,1-7,15 (2H, м).
Пример 84
3-( -D-глюкопиранозилокси)-4-[(4-{2-[(S)-2-гидрокси-1-(метил)этилкарбамоил]этокси}фенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[(S)-2-гидрокси-1-(метил)этилкарбамоил]этокси}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)фенил]метил}-5-изопропил-1Н-пиразола и (S)-2-амино-1-пропанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)фенил]метил}-5-изопропил-1Н-пиразола и (S)-2-амино-1-пропанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (9H, м), 2,55-2,65 (2H, м), 2,85-2,95 (1H, м), 3,3-3,4 (4H, м), 3,44 (1H, дд, J=10,9 Гц, 5,7 Гц), 3,4 9 (1H, дд, J=10,9 Гц, 5,6 Гц), 3,6-3,75 (3H, м), 3,8-3,85 (1H, м), 3,9-4,0 (1H, м), 4,15-4,25 (2H, м), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м). м.д.: 1,1-1,15 (9H, м), 2,55-2,65 (2H, м), 2,85-2,95 (1H, м), 3,3-3,4 (4H, м), 3,44 (1H, дд, J=10,9 Гц, 5,7 Гц), 3,4 9 (1H, дд, J=10,9 Гц, 5,6 Гц), 3,6-3,75 (3H, м), 3,8-3,85 (1H, м), 3,9-4,0 (1H, м), 4,15-4,25 (2H, м), 5,0-5,1 (1H, м), 6,75-6,85 (2H, м), 7,05-7,15 (2H, м).
Пример 85
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-метилпиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-метилпиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,45 (6H, с), 2,18 (3H, с), 2,29 (3H, с), 2,36 (4H, шир.с), 2,6 (2H, т, J=5,7 Гц), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,55-3,75 (7H, м), 3,82 (1H, д, J=11,8 Гц), 4,17 (2H, т, J=5,7 Гц), 5,0-5,15 (1H, м), 6,63 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,87 (1H, д, J=8,4 Гц). м.д.: 1,1-1,15 (6H, м), 1,45 (6H, с), 2,18 (3H, с), 2,29 (3H, с), 2,36 (4H, шир.с), 2,6 (2H, т, J=5,7 Гц), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,55-3,75 (7H, м), 3,82 (1H, д, J=11,8 Гц), 4,17 (2H, т, J=5,7 Гц), 5,0-5,15 (1H, м), 6,63 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,87 (1H, д, J=8,4 Гц).
Пример 86
3-( -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-бис(гидроксиметил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-бис(гидроксиметил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием трис(гидроксиметил)аминометана вместо 2-амино-2-метилпропионамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 2,29 (3H, с), 2,68 (2H, т, J=6,1 Гц), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,6-3,75 (9H, м), 3,81 (1H, д, J=12,0 Гц), 4,18 (2H, т, J=6,1 Гц), 5,0-5,05 (1H, м), 6,65 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,74 (1H, д, J=2,3 Гц), 6,86 (1H, д, J=8,4 Гц). м.д.: 1,05-1,15 (6H, м), 2,29 (3H, с), 2,68 (2H, т, J=6,1 Гц), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,6-3,75 (9H, м), 3,81 (1H, д, J=12,0 Гц), 4,18 (2H, т, J=6,1 Гц), 5,0-5,05 (1H, м), 6,65 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,74 (1H, д, J=2,3 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 87
3-( -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-ди(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-ди(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 2-амино-2-метил-1-пропанола вместо 2-амино-2-метилпропионамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,27 (6H, с), 2,29 (3H,с), 2,58 (2H, т, J=6,2 Гц), 2,75-2,85 (1H, м), 3,2-3,4 (4H, м), 3,57 (2H, с), 3,6-3,75 (3H, м), 3,82 (1H, д, J=11,9 Гц), 4,16 (2H, т, J=6,2 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,0O Гц), 6,72 (1H, д, J=2,0 Гц), 6,86 (1H, д, J=8,4 Гц). м.д.: 1,05-1,2 (6H, м), 1,27 (6H, с), 2,29 (3H,с), 2,58 (2H, т, J=6,2 Гц), 2,75-2,85 (1H, м), 3,2-3,4 (4H, м), 3,57 (2H, с), 3,6-3,75 (3H, м), 3,82 (1H, д, J=11,9 Гц), 4,16 (2H, т, J=6,2 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,0O Гц), 6,72 (1H, д, J=2,0 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 88
3-( -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1-гидроксиметил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1-гидроксиметил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 78, с использованием 2-амино-2-метил-1,3-пропандиола вместо 2-амино-2-метилпропионамида.
1H-ЯМР (CD3OD)  м.д.: l,l-1,15 (6H, м), 1,25 (3H, с), 2,29 (3H, с), 2,63 (2H, т, J=6,2 Гц), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,6-3,7 (7H, м), 3,81 (1H, д, J=11,8 Гц), 4,17 (2H, т, J=6,2 Гц), 5,0-5,05 (1H, м), 6,63 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,73 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,4 Гц). м.д.: l,l-1,15 (6H, м), 1,25 (3H, с), 2,29 (3H, с), 2,63 (2H, т, J=6,2 Гц), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,6-3,7 (7H, м), 3,81 (1H, д, J=11,8 Гц), 4,17 (2H, т, J=6,2 Гц), 5,0-5,05 (1H, м), 6,63 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,73 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 89
3-( -D-глюкопиранозилокси)-4-[(4-{2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил)этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил)этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6Н, м), 1,45 (6Н, с), 2,3 (3Н, с), 2,35-2,55 (6Н, м), 2,6 (2Н, т, J=5,7 Гц), 2,75-2,9 (1H, м), 3,25-3,4 (4H, м), 3,57 (2H, т, J=5,8 Гц), 3,6-3,8 (7H, м), 3,82 (1H, д, J=11,9 Гц), 4,17 (2H, т, J=5,7 Гц), 5,0-5,05 (1H, м), 6,63 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,71 (1H, д, J=2,4 Гц), 6,87 (1H, д, J=8,4 Гц). м.д.: 1,05-1,2 (6Н, м), 1,45 (6Н, с), 2,3 (3Н, с), 2,35-2,55 (6Н, м), 2,6 (2Н, т, J=5,7 Гц), 2,75-2,9 (1H, м), 3,25-3,4 (4H, м), 3,57 (2H, т, J=5,8 Гц), 3,6-3,8 (7H, м), 3,82 (1H, д, J=11,9 Гц), 4,17 (2H, т, J=5,7 Гц), 5,0-5,05 (1H, м), 6,63 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,71 (1H, д, J=2,4 Гц), 6,87 (1H, д, J=8,4 Гц).
Пример 90
3-( -D-глюкопиранозилокси)-4-[(4-{2-[1-(2-гидроксиэтилкарбамоил)-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[1-(2-гидроксиэтилкарбамоил)-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 2-аминоэтанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 2-аминоэтанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,45 (6H, с), 2,29 (3H, с), 2,63 (2H, т, J=6,2 Гц), 2,75-2,85 (1H, м), 3,24 (2H, т, J=5,9 Гц), 3,3-3,4 (4H, м), 3,51 (2H, т, J=5,9 Гц), 3,6-3,7 (3H, м), 3,82 (1H, д, J=12,0 Гц), 4,18 (2H, т, J=6,2 Гц), 5,0-5,05 (1H, м), 6,64 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,74 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,4 Гц). м.д.: 1,05-1,15 (6H, м), 1,45 (6H, с), 2,29 (3H, с), 2,63 (2H, т, J=6,2 Гц), 2,75-2,85 (1H, м), 3,24 (2H, т, J=5,9 Гц), 3,3-3,4 (4H, м), 3,51 (2H, т, J=5,9 Гц), 3,6-3,7 (3H, м), 3,82 (1H, д, J=12,0 Гц), 4,18 (2H, т, J=6,2 Гц), 5,0-5,05 (1H, м), 6,64 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,74 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 91
3-( -D-глюкопиранозилокси)-4-[(4-{2-[1-(3-гидроксипропилкарбамоил)-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[1-(3-гидроксипропилкарбамоил)-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил)этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 2-амино-1-пропанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил)этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 2-амино-1-пропанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,45 (6H, с), 1,55-1,65 (2H, м), 2,29 (3H, с), 2,62 (2H, т, J=6,1 Гц), 2,75-2,85 (1H, м), 3,2 (2H, т, J=6,6 Гц), 3,25-3,4 (4H, м), 3,51 (2H, т, J=6,2 Гц), 3,6-3,7 (3H, м), 3,82 (1H, д, J=12,0 Гц), 4,18 (2H, т, J=6,1 Гц), 5,0-5,15 (1H, м), 6,64 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,73 (1H, д, J=2,3 Гц), 6,87 (1H, д, J=8,4 Гц). м.д.: 1,05-1,15 (6H, м), 1,45 (6H, с), 1,55-1,65 (2H, м), 2,29 (3H, с), 2,62 (2H, т, J=6,1 Гц), 2,75-2,85 (1H, м), 3,2 (2H, т, J=6,6 Гц), 3,25-3,4 (4H, м), 3,51 (2H, т, J=6,2 Гц), 3,6-3,7 (3H, м), 3,82 (1H, д, J=12,0 Гц), 4,18 (2H, т, J=6,1 Гц), 5,0-5,15 (1H, м), 6,64 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,73 (1H, д, J=2,3 Гц), 6,87 (1H, д, J=8,4 Гц).
Пример 92
4-[(4-{2-[(S)-1-(карбамоил)этилкарбамоил]этокси}-2-метилфенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием гидрохлорида L-аланинамида вместо 2-амино-2-метилпропионамида.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,15 (6H, м), 1,36 (3H, д, J=7,2 Гц), 2,29 (3H, с), 2,6-2,85 (3H, м), 3,3-3,4 (4H, м), 3,6-3,7 (3H, м), 3,81 (1H, д, J=12,1 Гц), 4,15-4,25 (2H, м), 4,36 (1H, кв., J=7,2 Гц), 5,0-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,72 (1H, д, J=2,5 Гц), 6,86 (1H, д, J=8,4 Гц). м.д.: 1,1-1,15 (6H, м), 1,36 (3H, д, J=7,2 Гц), 2,29 (3H, с), 2,6-2,85 (3H, м), 3,3-3,4 (4H, м), 3,6-3,7 (3H, м), 3,81 (1H, д, J=12,1 Гц), 4,15-4,25 (2H, м), 4,36 (1H, кв., J=7,2 Гц), 5,0-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,72 (1H, д, J=2,5 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 93
3-( -D-глюкопиранозилокси)-4-[4-{2-[(S)-1-(2-гидроксиэтилкарбамоил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[4-{2-[(S)-1-(2-гидроксиэтилкарбамоил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбокси)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 2-аминоэтанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбокси)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 2-аминоэтанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,34 (3H, д, J=7,2 Гц), 2,29 (3H, с), 2,67 (2H, т, J=6,1 Гц), 2,75-2,85 (1H, м), 3,2-3,4 (6H, м), 3,55 (2H, т, J=5,8 Гц), 3,6-3,7 (3H, м), 3,82 (1H, д, J=12,0 Гц), 4,19 (2H, т, J=6,1 Гц), 4,3 5 (1H, кв., J=7,2 Гц), 4,95-5,05 (1H, м)f 6,63 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,73 (1H, д, J=2,3 Гц), 6,86 (1H, д, J=8,4 Гц). м.д.: 1,05-1,15 (6H, м), 1,34 (3H, д, J=7,2 Гц), 2,29 (3H, с), 2,67 (2H, т, J=6,1 Гц), 2,75-2,85 (1H, м), 3,2-3,4 (6H, м), 3,55 (2H, т, J=5,8 Гц), 3,6-3,7 (3H, м), 3,82 (1H, д, J=12,0 Гц), 4,19 (2H, т, J=6,1 Гц), 4,3 5 (1H, кв., J=7,2 Гц), 4,95-5,05 (1H, м)f 6,63 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,73 (1H, д, J=2,3 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 94
4-[(4-{2-[(S)-1-карбамоил-2-гидроксиэтилкарбамоил]этокси}-2-метилфенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием гидрохлорида L-серинамида вместо 2-амино-2-метилпропионамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 2,29 (3H, с), 2,65-2,9 (3H, м), 3,25-3,4 (4H, м), 3,55-3,9 (6H, м), 4,21 (2H, т, J=6,0 Гц), 4,4-4,5 (1H, м), 4,95-5,05 (1H, м), 6,64 (1H, дд, J=8,3 Гц, 2,2 Гц), 6,73 (1H, д, J=2,2 Гц), 6,86 (1H, д, J=8,3 Гц). м.д.: 1,05-1,2 (6H, м), 2,29 (3H, с), 2,65-2,9 (3H, м), 3,25-3,4 (4H, м), 3,55-3,9 (6H, м), 4,21 (2H, т, J=6,0 Гц), 4,4-4,5 (1H, м), 4,95-5,05 (1H, м), 6,64 (1H, дд, J=8,3 Гц, 2,2 Гц), 6,73 (1H, д, J=2,2 Гц), 6,86 (1H, д, J=8,3 Гц).
Пример 95
3-( -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1-(гидроксиметил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1-(гидроксиметил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 78, с использованием 2-амино-1,3-пропандиола вместо 2-амино-2-метилпропионамида.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 2,29 (3H, с), 2,65 (2H, т, J=6,2 Гц), 2,75-2,85 (1H, м), 3,3-3,4 (4H, м), 3,55-3,7 (7H, м), 3,86 (1H, д, J=11,6 Гц), 3,9-4,0 (1H, м), 4,19 (2H, т, J=6,2 Гц), 4,95-5,05 (1H, м), 6,63 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,72 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,4 Гц). м.д.: 1,05-1,15 (6H, м), 2,29 (3H, с), 2,65 (2H, т, J=6,2 Гц), 2,75-2,85 (1H, м), 3,3-3,4 (4H, м), 3,55-3,7 (7H, м), 3,86 (1H, д, J=11,6 Гц), 3,9-4,0 (1H, м), 4,19 (2H, т, J=6,2 Гц), 4,95-5,05 (1H, м), 6,63 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,72 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 96
3-( -D-глюкопиранозилокси)-4-[4-{2-[(S)-1-(3-гидроксипропилкарбамоил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[4-{2-[(S)-1-(3-гидроксипропилкарбамоил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбокси)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 3-амино-1-пропанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[(S)-1-(карбокси)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 3-амино-1-пропанола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,34 (3H, д, J=7,2 Гц), 1,6-1,7 (2H, м), 2,29 (3H, с), 2,66 (2H, т, J=6,2 Гц), 2,75-2,85 (1H, м), 3,2-3,4 (6H, м), 3,54 (2H, т, J=6,2 Гц), 3,6-3,7 (3H, м), 3,82 (1H, д, J=11,6 Гц), 4,19 (2H, т, J=6,2 Гц), 4,32 (1H, кв., J=7,2 Гц), 5,0-5,05 (1H, м), 6,63 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,72 (1H, д, J=2,5 Гц), 6,86 (1H, д, J=8,4 Гц). м.д.: 1,05-1,15 (6H, м), 1,34 (3H, д, J=7,2 Гц), 1,6-1,7 (2H, м), 2,29 (3H, с), 2,66 (2H, т, J=6,2 Гц), 2,75-2,85 (1H, м), 3,2-3,4 (6H, м), 3,54 (2H, т, J=6,2 Гц), 3,6-3,7 (3H, м), 3,82 (1H, д, J=11,6 Гц), 4,19 (2H, т, J=6,2 Гц), 4,32 (1H, кв., J=7,2 Гц), 5,0-5,05 (1H, м), 6,63 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,72 (1H, д, J=2,5 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 97
3-( -D-галактопиранозилокси)-4-[(4-{4-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]бутил}фенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-{4-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]бутил}фенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{4-[1-карбокси-1-(метил)этилкарбамоил]бутил}фенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{4-[1-карбокси-1-(метил)этилкарбамоил]бутил}фенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,55-1,65 (4H, м), 2,18 (2H, т, J=6,8 Гц), 2,4-2,65 (8H, м), 2,85-2,95 (1H, м), 3,5-3,8 (13H, м),3,85-3,9 (1Н, м), 5,08 (1H, д, J=7,8 Гц), 7,04 (2H, д, J=8,0 Гц), 7,1 (2H, д, J=8,0 Гц). м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,55-1,65 (4H, м), 2,18 (2H, т, J=6,8 Гц), 2,4-2,65 (8H, м), 2,85-2,95 (1H, м), 3,5-3,8 (13H, м),3,85-3,9 (1Н, м), 5,08 (1H, д, J=7,8 Гц), 7,04 (2H, д, J=8,0 Гц), 7,1 (2H, д, J=8,0 Гц).
Пример 98
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(4-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}бутил)фенил]метил}-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-4-{[4-(4-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}бутил)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{4-[1-карбокси-1-(метил)этилкарбамоил]бутил}фенил)метил]-5-изопропил-1Н-пиразола и 1-метилпиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{4-[1-карбокси-1-(метил)этилкарбамоил]бутил}фенил)метил]-5-изопропил-1Н-пиразола и 1-метилпиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,41 (6H, с), 1,55-1,65 (4H, м), 2,18 (2H, т, J=6,9 Гц), 2,24 (3H, с), 2,35 (4H, шир.с), 2,57 (2H, т, J=6,6 Гц), 2,85-2,95 (1H, м), 3,45-3,8 (11H, м), 3,85-3,95 (1H, м), 5,08 (1H, д, J=7,7 Гц), 7,04 (2H, д, J=7,9 Гц), 7,1 (2H, д, J=7,9 Гц). м.д.: 1,05-1,15 (6H, м), 1,41 (6H, с), 1,55-1,65 (4H, м), 2,18 (2H, т, J=6,9 Гц), 2,24 (3H, с), 2,35 (4H, шир.с), 2,57 (2H, т, J=6,6 Гц), 2,85-2,95 (1H, м), 3,45-3,8 (11H, м), 3,85-3,95 (1H, м), 5,08 (1H, д, J=7,7 Гц), 7,04 (2H, д, J=7,9 Гц), 7,1 (2H, д, J=7,9 Гц).
Пример 99
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола (40 мг) в N,N-диметилформамиде (1 мл) добавляли 1-бензилпиперазин (12 мг), 1-гидроксибензотриазол (8 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (16 мг) и триэтиламин (0,023 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=30/1-15/1), с получением 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола (40 мг) в N,N-диметилформамиде (1 мл) добавляли 1-бензилпиперазин (12 мг), 1-гидроксибензотриазол (8 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (16 мг) и триэтиламин (0,023 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=30/1-15/1), с получением 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-{1-[(4-бензилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразол (31 мг). Это вещество растворяли в метаноле (3 мл). К раствору добавляли метоксид натрия (28% метанольный раствор, 0,02 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (0,04 мл). Полученную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол), получая 4-{[4-(2-{1-[(4-бензилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-3-( -D-глюкопиранозилокси)-4-{[4-(2-{1-[(4-бензилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразол (31 мг). Это вещество растворяли в метаноле (3 мл). К раствору добавляли метоксид натрия (28% метанольный раствор, 0,02 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли уксусную кислоту (0,04 мл). Полученную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол), получая 4-{[4-(2-{1-[(4-бензилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-3-( -D-глюкопиранозилокси)-5-изопропил-4-1Н-пиразол (24 мг). Это вещество растворяли в метаноле (3 мл). К раствору добавляли порошкообразный 10% палладий на угле (10 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Нерастворившееся вещество удаляли при пониженном давлении и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (20 мг). -D-глюкопиранозилокси)-5-изопропил-4-1Н-пиразол (24 мг). Это вещество растворяли в метаноле (3 мл). К раствору добавляли порошкообразный 10% палладий на угле (10 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение ночи. Нерастворившееся вещество удаляли при пониженном давлении и растворитель фильтрата удаляли при пониженном давлении с получением указанного в заголовке соединения (20 мг).
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1-45 (6H, с), 2,3 (3H, с), 2,5-2,9 (7H, м), 3,25-3,4 (4H, м), 3,45-3,75 (7H, м), 3,81 (1H, д, J=11,5 Гц), 4,17 (2H, т, J=5,7 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,86 (1H, д, J=8,4 Гц). м.д.: 1,05-1,15 (6H, м), 1-45 (6H, с), 2,3 (3H, с), 2,5-2,9 (7H, м), 3,25-3,4 (4H, м), 3,45-3,75 (7H, м), 3,81 (1H, д, J=11,5 Гц), 4,17 (2H, т, J=5,7 Гц), 4,95-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,71 (1H, д, J=2,5 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 100
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(4-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}бутил)фенил]метил}-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-4-{[4-(4-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}бутил)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 99, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{4-[1-карбокси-1-(метил)этилкарбамоил]бутил}фенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{4-[1-карбокси-1-(метил)этилкарбамоил]бутил}фенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,41 (6H, с), 1,5-1,65 (4H, м), 2,17 (2H, т, J=7,1 Гц), 2,58 (2H, т, J=6,8 Гц), 2,72 (4H, шир.с), 2,85-2,95 (1H, м), 3,45-3,8 (1H, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=7,7 Гц), 7,04 (2H, д, J=8,0 Гц), 7,1 (2H, д, J=8,0 Гц). м.д.: 1,05-1,15 (6H, м), 1,41 (6H, с), 1,5-1,65 (4H, м), 2,17 (2H, т, J=7,1 Гц), 2,58 (2H, т, J=6,8 Гц), 2,72 (4H, шир.с), 2,85-2,95 (1H, м), 3,45-3,8 (1H, м), 3,8-3,9 (1H, м), 5,08 (1H, д, J=7,7 Гц), 7,04 (2H, д, J=8,0 Гц), 7,1 (2H, д, J=8,0 Гц).
Пример 101
4-[(4-{2-[(S)-5-амино-1-(карбамоил)пентилкарбамоил]этокси}-2-метилфенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 99, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и гидрохлорида (S)-2-амино-6-(бензилоксикарбониламино)гексанамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и гидрохлорида (S)-2-амино-6-(бензилоксикарбониламино)гексанамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно. -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,3-1,95 (6H, м), 2,3 (3H, с), 2,6-2,9 (5H, м), 3,3-3,4 (4H, м), 3,6-3,7 (3H, м), 3,82 (1H, д, J=11,8 Гц), 4,15-4,25 (2H, м), 4,38 (1H, дд, J=9,3 Гц, 4,8 Гц), 5,0-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,72 (1H, д, J=2,5 Гц), 6,86 (1H, д, J=8,4 Гц). м.д.: 1,1-1,2 (6H, м), 1,3-1,95 (6H, м), 2,3 (3H, с), 2,6-2,9 (5H, м), 3,3-3,4 (4H, м), 3,6-3,7 (3H, м), 3,82 (1H, д, J=11,8 Гц), 4,15-4,25 (2H, м), 4,38 (1H, дд, J=9,3 Гц, 4,8 Гц), 5,0-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,72 (1H, д, J=2,5 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 102
4-[(4-{2-[(S)-5-амино-5-(карбамоил)пентилкарбамоил]этокси}-2-метилфенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 99, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и гидрохлорида (S)-6-амино-2-(бензилоксикарбониламино)гексанамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и гидрохлорида (S)-6-амино-2-(бензилоксикарбониламино)гексанамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно. -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,3-1,8 (6H, м), 2,29 (3H, с), 2,59 (2H, т, J=6,1 Гц), 2,75-2,85 (1H, м), 3,21 (2H, т, J=6,9 Гц), 3,3-3,4 (5H, м), 3,6-3,7 (3H, м), 3,81 (1H, д, J=11,5 Гц), 4,18 (2H, т, J=6,1 Гц), 5,0-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,71 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,4 Гц). м.д.: 1,05-1,15 (6H, м), 1,3-1,8 (6H, м), 2,29 (3H, с), 2,59 (2H, т, J=6,1 Гц), 2,75-2,85 (1H, м), 3,21 (2H, т, J=6,9 Гц), 3,3-3,4 (5H, м), 3,6-3,7 (3H, м), 3,81 (1H, д, J=11,5 Гц), 4,18 (2H, т, J=6,1 Гц), 5,0-5,05 (1H, м), 6,62 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,71 (1H, д, J=2,4 Гц), 6,86 (1H, д, J=8,4 Гц).
Пример 103
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)-2-метилфенил]метил}-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)-2-метилфенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 99, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}-2-метилфенил]метил]-5-изопропил-1Н-пиразола и 1-(бензилоксикарбонил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}-2-метилфенил]метил]-5-изопропил-1Н-пиразола и 1-(бензилоксикарбонил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно. -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,16 (2H, т, J=7,2 Гц), 2,3 (3H, с), 2,55 (2H, т, J=7,5 Гц), 2,65-2,9 (5H, м), 3,2-3,45 (4H, м), 3,5-3,9 (8H, м), 4,95-5,05 (1H, м), 6,8-6,9 (2H, м), 6,9-7,0 (1H, м). м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,16 (2H, т, J=7,2 Гц), 2,3 (3H, с), 2,55 (2H, т, J=7,5 Гц), 2,65-2,9 (5H, м), 3,2-3,45 (4H, м), 3,5-3,9 (8H, м), 4,95-5,05 (1H, м), 6,8-6,9 (2H, м), 6,9-7,0 (1H, м).
Пример 104
4-{[4-(3-{1-[(S)-5-амино-5-(карбамоил)пентилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 99, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и гидрохлорида (S)-6-амино-2-(бензилоксикарбониламино)гексанамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола и гидрохлорида (S)-6-амино-2-(бензилоксикарбониламино)гексанамида вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно. -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,2-1,6 (11H, м), 1,6-1,75 (1H, м), 1,8-1,9 (2H, м), 2,19 (2H, т, J=7,8 Гц), 2,58 (2H, т, J=7,7 Гц), 2,85-2,95 (1H, м), 3,1-3,25 (2H, м), 3,25-3,35 (1H, м), 3,52 (1H, дд, J=9,7 Гц, 3,4 Гц), 3,55-3,65 (1H, м), 3,65-3,8 (5H, м), 3,86 (1H, д, J=3,1 Гц), 5,08 (1H, д, J=8,0 Гц), 7,0-7,15 (4H, м). м.д.: 1,1-1,2 (6H, м), 1,2-1,6 (11H, м), 1,6-1,75 (1H, м), 1,8-1,9 (2H, м), 2,19 (2H, т, J=7,8 Гц), 2,58 (2H, т, J=7,7 Гц), 2,85-2,95 (1H, м), 3,1-3,25 (2H, м), 3,25-3,35 (1H, м), 3,52 (1H, дд, J=9,7 Гц, 3,4 Гц), 3,55-3,65 (1H, м), 3,65-3,8 (5H, м), 3,86 (1H, д, J=3,1 Гц), 5,08 (1H, д, J=8,0 Гц), 7,0-7,15 (4H, м).
Пример 105
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол
К раствору 4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола (0,12 г) в N,N-диметилформамиде (3 мл) добавляли 1-(бензилоксикарбонил)пиперазин (43 мг), 1-гидроксибензотриазол (19 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (50 мг) и триэтиламин (0,027 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду. Осажденные кристаллы собирали фильтрованием, затем промывали водой и сушили при пониженном давлении, получая 4-[(4-{3-[1-{[4-(бензилоксикарбонил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола (0,12 г) в N,N-диметилформамиде (3 мл) добавляли 1-(бензилоксикарбонил)пиперазин (43 мг), 1-гидроксибензотриазол (19 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (50 мг) и триэтиламин (0,027 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду. Осажденные кристаллы собирали фильтрованием, затем промывали водой и сушили при пониженном давлении, получая 4-[(4-{3-[1-{[4-(бензилоксикарбонил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол (0,14 г). Это вещество растворяли в этаноле (4 мл). К раствору добавляли порошкообразный 10% палладий на угле (30 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 1,5 часа. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=10/1-5/1), получая 5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил}-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол (0,14 г). Это вещество растворяли в этаноле (4 мл). К раствору добавляли порошкообразный 10% палладий на угле (30 мг) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 1,5 часа. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=10/1-5/1), получая 5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил}-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол (89 мг). Это вещество растворяли в метаноле (6 мл). К раствору добавляли метоксид натрия (28% метанольный раствор, 0,087 мл) и смесь перемешивали при 50°С в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол), получая указанное в заголовке соединение (54 мг). -D-глюкопиранозилокси)-1Н-пиразол (89 мг). Это вещество растворяли в метаноле (6 мл). К раствору добавляли метоксид натрия (28% метанольный раствор, 0,087 мл) и смесь перемешивали при 50°С в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол), получая указанное в заголовке соединение (54 мг).
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,95-2,05 (2H, м), 2,29 (3H, с), 2,39 (2H, т, J=7,3 Гц), 2,55-2,9 (5H, м), 3,25-3,4 (4H, м), 3,5-3,7 (7H, м), 3,75-3,85 (1H, м), 3,95 (2H, т, J=6,0 Гц), 5,0-5,05 (1H, м), 6,61 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,71 (1H, д, J=2,3 Гц), 6,84 (1H, д, J=8,4 Гц). м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,95-2,05 (2H, м), 2,29 (3H, с), 2,39 (2H, т, J=7,3 Гц), 2,55-2,9 (5H, м), 3,25-3,4 (4H, м), 3,5-3,7 (7H, м), 3,75-3,85 (1H, м), 3,95 (2H, т, J=6,0 Гц), 5,0-5,05 (1H, м), 6,61 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,71 (1H, д, J=2,3 Гц), 6,84 (1H, д, J=8,4 Гц).
Пример 106
3-( -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
К раствору 4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола (40 мг) в N,N-диметилформамиде (2 мл) добавляли 1-(2-гидроксиэтил)пиперазин (7 мг), 1-гидроксибензотриазол (7 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (13 мг) и триэтиламин (0,018 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=15/1), получая 4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола (40 мг) в N,N-диметилформамиде (2 мл) добавляли 1-(2-гидроксиэтил)пиперазин (7 мг), 1-гидроксибензотриазол (7 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (13 мг) и триэтиламин (0,018 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=15/1), получая 4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол (27 мг). Это вещество растворяли в метаноле (2 мл). К раствору добавляли метоксид натрия (28% метанольный раствор, 0,015 мл) и смесь перемешивали при 50°С в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол), получая указанное в заголовке соединение (12 мг). -D-глюкопиранозилокси)-1Н-пиразол (27 мг). Это вещество растворяли в метаноле (2 мл). К раствору добавляли метоксид натрия (28% метанольный раствор, 0,015 мл) и смесь перемешивали при 50°С в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали твердофазной экстракцией на ODS (промывочный растворитель: дистиллированная вода, элюент: метанол), получая указанное в заголовке соединение (12 мг).
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,95-2,05 (2H, м), 2,29 (3Н, с), 2,35-2,5 (8H, м), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,55-3,75 (9H, м), 3,75-3,85 (1H, м), 3,94 (2H, т, J=6,1 Гц), 5,0-5,05 (1H, м), 6,61 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,7 (1H, д, J=2,4 Гц), 6,85 (1H, д, J=8,4 Гц). м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,95-2,05 (2H, м), 2,29 (3Н, с), 2,35-2,5 (8H, м), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,55-3,75 (9H, м), 3,75-3,85 (1H, м), 3,94 (2H, т, J=6,1 Гц), 5,0-5,05 (1H, м), 6,61 (1H, дд, J=8,4 Гц, 2,4 Гц), 6,7 (1H, д, J=2,4 Гц), 6,85 (1H, д, J=8,4 Гц).
Пример 107
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 106, с использованием 1-метилпиперазина вместо 1-(2-гидроксиэтил)пиперазина.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,95-2,05 (2H, м), 2,22 (3H, с), 2,25-2,45 (9H, м), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,55-3,75 (7H, м), 3,75-3,85 (1H, м), 3,95 (2H, т, J=6,0 Гц), 5,03 (1H, д, J=7,5 Гц), 6,61 (1H, дд, J=8,3 Гц, 2,6 Гц), 6,7 (1H, д, J=2,6 Гц), 6,85 (1H, д, J=8,3 Гц). м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,95-2,05 (2H, м), 2,22 (3H, с), 2,25-2,45 (9H, м), 2,75-2,85 (1H, м), 3,25-3,4 (4H, м), 3,55-3,75 (7H, м), 3,75-3,85 (1H, м), 3,95 (2H, т, J=6,0 Гц), 5,03 (1H, д, J=7,5 Гц), 6,61 (1H, дд, J=8,3 Гц, 2,6 Гц), 6,7 (1H, д, J=2,6 Гц), 6,85 (1H, д, J=8,3 Гц).
Пример 108
3-( -D-глюкопиранозилокси)-4-[(4-{3-[1-(2-гидроксиэтилкарбамоил)-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-{3-[1-(2-гидроксиэтилкарбамоил)-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 106, с использованием 2-аминоэтанола вместо 1-(2-гидроксиэтил)пиперазина.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,95-2,05 (2H, м), 2,28 (3Н, с), 2,39 (2H, т, J=7,4 Гц), 2,75-2,85 (1H, м), 3,2-3,4 (6H, м), 3,56 (2H, т, J=5,9 Гц), 3,6-3,7 (3H, м), 3,75-3,85 (1H, м), 3,94 (2H, т, J=6,1 Гц), 4,95-5,05 (1H, м), 6,61 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,71 (1H, д, J=2,3 Гц), 6,85 (1H, д, J=8,4 Гц). м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,95-2,05 (2H, м), 2,28 (3Н, с), 2,39 (2H, т, J=7,4 Гц), 2,75-2,85 (1H, м), 3,2-3,4 (6H, м), 3,56 (2H, т, J=5,9 Гц), 3,6-3,7 (3H, м), 3,75-3,85 (1H, м), 3,94 (2H, т, J=6,1 Гц), 4,95-5,05 (1H, м), 6,61 (1H, дд, J=8,4 Гц, 2,3 Гц), 6,71 (1H, д, J=2,3 Гц), 6,85 (1H, д, J=8,4 Гц).
Сравнительный пример 54
1-(3-бензоилоксипропил)-1,2-дигидро-4-[(4-иодфенил)метил]-5-изопропил-3Н-пиразол-3-он
К раствору 1,2-дигидро-4-[(4-иодфенил)метил]-5-изопропил-3Н-пиразол-3-она (5 г) и имидазола (1,19 г) в N,N-диметилформамиде (20 мл) и добавляли триизопропилсилилхлорид (3,1 г) при комнатной температуре и смесь перемешивали в течение 3 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и получали [(4-иодфенил)метил]-5-изопропил-3-триизопропилсилилокси-1Н-пиразол (7,27 г). К раствору полученного 4-[(4-иодфенил)метил]-5-изопропил-3-триизопропилсилилокси-1Н-пиразола (3 г) в N,N-диметилформамиде (10 мл) добавляли гидрид натрия (55%, 0,33 г) при охлаждении льдом и смесь перемешивали 20 минут. К реакционной смеси добавляли раствор 1-бензилокси-3-хлорпропана (3,0 г) в N,N-диметилформамиде (10 мл) и иодид калия (0,25 г) при той же температуре и полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=20/1-10/1), получая 1-(3-бензоилоксипропил)-4-[(4-иодфенил)метил]-5-изопропил-3-триизопропилсилилокси-1Н-пиразол (2,55 г). Это вещество растворяли в тетрагидрофуране (3 мл). К раствору добавляли 4 моль/л хлористоводородной кислоты (раствор в 1,4-диоксане, 10 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли этилацетатом и полученную смесь выливали в воду. Органический слой отделяли, затем промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. К остатку добавляли смешанный растворитель из н-гексана и этилацетата (20/1)(10 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Осажденные кристаллы собирали фильтрованием, промывали смешанным растворителем из н-гексана и этилацетата (20/1) и сушили при пониженном давлении, получая указанное в заголовке соединение (0,85 г).
1H-ЯМР (ДМСО-d6)  м.д.: 1,06 (6H, д, J=7,3 Гц), 2,1-2,2 (2H, м), 2,95-3,1 (1H, м), 3,6 (2H, с), 4,02 (2H, т, J=6,9 Гц), 4,27 (2H, т, J=6,1 Гц), 6,94 (2H, д, J=8,3 Гц), 7,5-7,7 (5H, м), 7,9-8,0 (2H, м), 9,51 (1H, с). м.д.: 1,06 (6H, д, J=7,3 Гц), 2,1-2,2 (2H, м), 2,95-3,1 (1H, м), 3,6 (2H, с), 4,02 (2H, т, J=6,9 Гц), 4,27 (2H, т, J=6,1 Гц), 6,94 (2H, д, J=8,3 Гц), 7,5-7,7 (5H, м), 7,9-8,0 (2H, м), 9,51 (1H, с).
Сравнительный пример 55
Бензил-2-амино-2-метилпропионат
Гидрохлорид бензил-2-амино-2-метилпропионата (1,48 г) растворяли в этилацетате (60 мл) и насыщенном водном растворе бикарбоната натрия (20 мл) и органический слой отделяли. Органический слой промывали насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и получали указанное в заголовке соединение (1,2 г).
1H-ЯМР (CDCl3)  м.д.: 1,37 (6H, с), 5,14 (2H,, с), 7,3-7,45 (5H, м). м.д.: 1,37 (6H, с), 5,14 (2H,, с), 7,3-7,45 (5H, м).
Сравнительный пример 56
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-1-(3-бензоилоксипропил)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-1-(3-бензоилоксипропил)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
К смеси 1-(3-бензоилоксипропил)-1,2-дигидро-4-[(4-иодфенил)метил]-5-изопропил-3Н-пиразол-3-она (0,85 г), ацетобром- -D-галактозы (0,91 г) и бензилтри(н-бутил)аммонийхлорида (0,53 г) в дихлорметане (2,55 мл) добавляли 5 моль/л водный раствор гидроксида натрия (0,85 мл) и смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь разбавляли дихлорметаном и смесь выливали в воду. Органический слой отделяли, затем промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. К раствору остатка в ацетонитриле (2,5 мл) добавляли 3-бутеновую кислоту (0,36 г), триэтиламин (1,71 г), ацетат палладия (II) (38 мг) и трис(2-метилфенил)фосфин (0,1 г) и смесь кипятили с обратным холодильником в течение 3 часов. Растворитель удаляли при пониженном давлении и остаток растворяли в этилацетате. Раствор промывали водой. Водный слой экстрагировали этилацетатом. Объединенные органические слои промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток растворяли в тетрагидрофуране (5 мл). К раствору добавляли бензил-2-амино-2-метилпропионат (1,63 г), 1-гидроксибензотриазол (0,46 г) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,65 г) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1), получая 3-(2,3,4,6-тетра-О-ацетил- -D-галактозы (0,91 г) и бензилтри(н-бутил)аммонийхлорида (0,53 г) в дихлорметане (2,55 мл) добавляли 5 моль/л водный раствор гидроксида натрия (0,85 мл) и смесь перемешивали при комнатной температуре в течение 6 часов. Реакционную смесь разбавляли дихлорметаном и смесь выливали в воду. Органический слой отделяли, затем промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении. К раствору остатка в ацетонитриле (2,5 мл) добавляли 3-бутеновую кислоту (0,36 г), триэтиламин (1,71 г), ацетат палладия (II) (38 мг) и трис(2-метилфенил)фосфин (0,1 г) и смесь кипятили с обратным холодильником в течение 3 часов. Растворитель удаляли при пониженном давлении и остаток растворяли в этилацетате. Раствор промывали водой. Водный слой экстрагировали этилацетатом. Объединенные органические слои промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток растворяли в тетрагидрофуране (5 мл). К раствору добавляли бензил-2-амино-2-метилпропионат (1,63 г), 1-гидроксибензотриазол (0,46 г) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,65 г) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/1), получая 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-1-(3-бензоилоксипропил)-4-[(4-{(1Е)-3-[1-карбокси-1-(метил)этилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразол (0,55 г). Это вещество растворяли в метаноле (5 мл). К раствору добавляли порошкообразный 10% палладий на угле (0,15 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении, получая указанного в заголовке соединения (0,48 г). -D-галактопиранозилокси)-1-(3-бензоилоксипропил)-4-[(4-{(1Е)-3-[1-карбокси-1-(метил)этилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразол (0,55 г). Это вещество растворяли в метаноле (5 мл). К раствору добавляли порошкообразный 10% палладий на угле (0,15 г) и смесь перемешивали при комнатной температуре в атмосфере водорода в течение 3 часов. Нерастворившееся вещество удаляли фильтрованием и растворитель фильтрата удаляли при пониженном давлении, получая указанного в заголовке соединения (0,48 г).
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6H, м), 1,53 (3H, с), 1,54 (3H, с), 1,85-2,2 (16H, м), 2,25-2,35 (2H, м), 2,61 (2H, т, J=7,1 Гц), 2,95-3,05 (1H, м), 3,67 (1H, д, J=16,7 Гц), 3,71 (1H, д, J=16,7 Гц), 3,95-4,05 (1H, м), 4,05-4,2 (4H, м), 4,36 (2H, т, J=5,7 Гц), 5,0-5,1 (1H, м), 5,3-5,45 (2H, м), 5,51 (1H, д, J=8,2 Гц), 6,19 (1H, с), 6,95-7,05 (4H, м), 7,4-7,5 (2H, м), 7,5-7,6 (1H, м), 8,0-8,1 (2H, м). м.д.: 1,1-1,2 (6H, м), 1,53 (3H, с), 1,54 (3H, с), 1,85-2,2 (16H, м), 2,25-2,35 (2H, м), 2,61 (2H, т, J=7,1 Гц), 2,95-3,05 (1H, м), 3,67 (1H, д, J=16,7 Гц), 3,71 (1H, д, J=16,7 Гц), 3,95-4,05 (1H, м), 4,05-4,2 (4H, м), 4,36 (2H, т, J=5,7 Гц), 5,0-5,1 (1H, м), 5,3-5,45 (2H, м), 5,51 (1H, д, J=8,2 Гц), 6,19 (1H, с), 6,95-7,05 (4H, м), 7,4-7,5 (2H, м), 7,5-7,6 (1H, м), 8,0-8,1 (2H, м).
Пример 109
3-( -D-галактопиранозилокси)-1-(3-гидроксипропил)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол -D-галактопиранозилокси)-1-(3-гидроксипропил)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 99, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-1-(3-бензоилоксипропил)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил]метил]-5-изопропил-1Н-пиразола и 1-(бензилоксикарбонил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-1-(3-бензоилоксипропил)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил]метил]-5-изопропил-1Н-пиразола и 1-(бензилоксикарбонил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно. -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,42 (6H, с), 1,8-2,0 (4H, м), 2,17 (2H, т, J=7,7 Гц), 2,58 (2H, т, J=7,4 Гц), 2,65-2,8 (4H, м), 3,05-3,2 (1H, м), 3,45-3,9 (14H, м), 4,08 (2H, т, J=7,0 Гц), 5,11 (1H, д, J=7,8 Гц), 7,0-7,15 (4H, м). м.д.: 1,1-1,2 (6H, м), 1,42 (6H, с), 1,8-2,0 (4H, м), 2,17 (2H, т, J=7,7 Гц), 2,58 (2H, т, J=7,4 Гц), 2,65-2,8 (4H, м), 3,05-3,2 (1H, м), 3,45-3,9 (14H, м), 4,08 (2H, т, J=7,0 Гц), 5,11 (1H, д, J=7,8 Гц), 7,0-7,15 (4H, м).
Пример 110
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(бензилоксикарбонил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(бензилоксикарбонил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол (37 г) растворяли в N,N-диметилформамиде (180 мл). К раствору добавляли 1-(бензилоксикарбонил)пиперазин (28,4 г), 1-гидроксибензотриазол (10,5 г) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (14,8 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь два раза экстрагировали этилацетатом. Экстракты промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/2-этилацетат), получая указанное в заголовке соединение (40,5 г). -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол (37 г) растворяли в N,N-диметилформамиде (180 мл). К раствору добавляли 1-(бензилоксикарбонил)пиперазин (28,4 г), 1-гидроксибензотриазол (10,5 г) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (14,8 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь два раза экстрагировали этилацетатом. Экстракты промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=1/2-этилацетат), получая указанное в заголовке соединение (40,5 г).
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6H, м), 1,56 (6H, с), 1,85-1,95 (5H, м), 1,98 (3H, с), 2,02 (3H, с), 2,12 (2H, т, J=7,5 Гц), 2,16 (3H, с), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,4-3,55 (4H, м), 3,55-3,75 (6H, м), 4,0-4,1 (1H, м), 4,1-4,2 (2H, м), 5,09 (1H, дд, J=10,6 Гц, 3,3 ГЦ), 5,14 (2H, с), 5,35-5,45 (2H, м), 5,56 (1H, д, J=7,8 Гц), 6,39 (1H, с), 6,95-7,1 (4H, м), 7,3-7,4 (5H, м). м.д.: 1,1-1,2 (6H, м), 1,56 (6H, с), 1,85-1,95 (5H, м), 1,98 (3H, с), 2,02 (3H, с), 2,12 (2H, т, J=7,5 Гц), 2,16 (3H, с), 2,58 (2H, т, J=7,5 Гц), 2,85-2,95 (1H, м), 3,4-3,55 (4H, м), 3,55-3,75 (6H, м), 4,0-4,1 (1H, м), 4,1-4,2 (2H, м), 5,09 (1H, дд, J=10,6 Гц, 3,3 ГЦ), 5,14 (2H, с), 5,35-5,45 (2H, м), 5,56 (1H, д, J=7,8 Гц), 6,39 (1H, с), 6,95-7,1 (4H, м), 7,3-7,4 (5H, м).
Пример 111
4-[(4-{3-[1-{[4-(бензилоксикарбонил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-1Н-пиразол
К раствору 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(бензилоксикарбонил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола (39,5 г) в метаноле (160 мл) добавляли метоксид натрия (28% метанольный раствор, 8,24 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли уксусную кислоту (2,7 мл) и полученную смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=10/1), получая указанное в заголовке соединение (21,3 г). -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(бензилоксикарбонил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразола (39,5 г) в метаноле (160 мл) добавляли метоксид натрия (28% метанольный раствор, 8,24 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли уксусную кислоту (2,7 мл) и полученную смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=10/1), получая указанное в заголовке соединение (21,3 г).
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,8-1,9 (2H, м), 2,16 (2H, т, J=7,8 Гц), 2,57 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,35-3,8 (15H, м), 3,85-3,9 (1H, м), 5,07 (1H, д, J=7,9 Гц), 5,12 (2H, с), 7,04 (2H, д, J=8,2 Гц), 7,11 (2H, д, J=8,2 Гц), 7,25-7,4 (5H, м). м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,8-1,9 (2H, м), 2,16 (2H, т, J=7,8 Гц), 2,57 (2H, т, J=7,6 Гц), 2,8-2,95 (1H, м), 3,35-3,8 (15H, м), 3,85-3,9 (1H, м), 5,07 (1H, д, J=7,9 Гц), 5,12 (2H, с), 7,04 (2H, д, J=8,2 Гц), 7,11 (2H, д, J=8,2 Гц), 7,25-7,4 (5H, м).
Сравнительный пример 57
[4-бензилокси-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метанол
К раствору тетрагидро-4Н-пиран-4-ола (3,62 г) и триэтиламина (5,6 мл) в тетрагидрофуране (35 мл) добавляли метансульфонилхлорид (2,93 мл) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 1 часа. Нерастворившееся вещество удаляли фильтрованием. К фильтрату добавляли N,N-диметилформамид (70 мл), 4-бензилокси-2-гидроксибензальдегид (5,39 г) и карбонат цезия (23 г) и смесь перемешивали при 80°С в течение 12 часов. Реакционную смесь выливали в воду и полученную смесь экстрагировали диэтиловым эфиром. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=4/1-2/1), получая 4-бензилокси-2-(тетрагидро-4Н-пиран-4-илокси)бензальдегид (4,58 г). Это вещество растворяли в этаноле (70 мл). К раствору добавляли борогидрид натрия (0,28 г) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли метанол и полученную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали диэтиловым эфиром. Экстракт последовательно промывали насыщенным водным раствором бикарбоната натрия, водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=3/1-1/1), получая указанное в заголовке соединение (4,45 г).
1H-ЯМР (CDCl3)  м.д.: 1,75-1,85 (2H, м), 1,95-2,05 (2H, м), 2,11 (1H, т, J=6,3 Гц), 3,5-3,65 (2H, м), 3,9-4,0 (2H, м), 4,45-4,55 (1H, м), 4,63 (2H, д, J=6,3 Гц), 5,05 (2H, с), 6,5-6,6 (2H, м), 7,19 (1H, д, J=7,7 Гц), 7,3-7,45 (5H, м). м.д.: 1,75-1,85 (2H, м), 1,95-2,05 (2H, м), 2,11 (1H, т, J=6,3 Гц), 3,5-3,65 (2H, м), 3,9-4,0 (2H, м), 4,45-4,55 (1H, м), 4,63 (2H, д, J=6,3 Гц), 5,05 (2H, с), 6,5-6,6 (2H, м), 7,19 (1H, д, J=7,7 Гц), 7,3-7,45 (5H, м).
Сравнительный пример 58
4-{[4-бензилокси-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-он
К раствору [4-бензилокси-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метанола (4,45 г) в тетрагидрофуране (28 мл) добавляли триэтиламин (2,27 мл) и метансульфонилхлорид (1,21 мл) при охлаждении льдом и смесь перемешивали в течение 1 часа. Нерастворившееся вещество удаляли фильтрованием. Полученный раствор [4-бензилокси-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метилмезилата в тетрагидрофуране добавляли к суспензии гидрида натрия (55%, 710 мг) и метил-4-метил-3-оксопентаноата (2,25 г) в тетрагидрофуране (56 мл) и смесь кипятили с обратным холодильником в течение 8 часов. К реакционной смеси добавляли 1 моль/л хлористоводородной кислоты и полученную смесь экстрагировали диэтиловым эфиром. Органический слой промывали водой и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении. К раствору остатка в толуоле (8 мл) добавляли моногидрат гидразина (3,43 мл) и смесь перемешивали при 100°С в течение 8 часов. Реакционную смесь очищали колоночной хроматографией на силикагеле (элюент: дихлорметан/метанол=20/1-10/1), получая указанное в заголовке соединение (1,69 г).
1H-ЯМР (CDCl3)  м.д.: 1,16 (6H, д, J=7,1 Гц), 1,75-1,9 (2H, м), 1,95-2,1 (2H, м), 2,9-3,05 (1H, м), 3,5-3,6 (2H, м), 3,64 (2H, с), 3,9-4,05 (2H, м), 4,4-4,5 (1H, м), 5,0 (2H, с), 6,45-6,55 (2H, м), 7,0 (1H, д, J=8,4 Гц), 7,25-7,45 (5H, м). м.д.: 1,16 (6H, д, J=7,1 Гц), 1,75-1,9 (2H, м), 1,95-2,1 (2H, м), 2,9-3,05 (1H, м), 3,5-3,6 (2H, м), 3,64 (2H, с), 3,9-4,05 (2H, м), 4,4-4,5 (1H, м), 5,0 (2H, с), 6,45-6,55 (2H, м), 7,0 (1H, д, J=8,4 Гц), 7,25-7,45 (5H, м).
Сравнительный пример 59
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 12, с использованием 4-[(4-бензилокси-2-метилфенил)метил]-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-галактозы вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-галактозы вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-глюкозы, соответственно. -D-глюкозы, соответственно.
1H-ЯМР (CDCl3)  м.д.: 1,05-1,2 (6H, м), 1,78 (3H, с), 1,98 (3H, с), 2,03 (3H, с), 2,16 (3H, с), 2,28 (3H, с), 2,75-2,85 (1H, м), 3,51 (1H, д, J=16,4 Гц), 3,62 (1H, д, J=16,4 Гц), 4,0-4,1 (1H, м), 4,1-4,2 (2H, м), 5,02 (2H, с), 5,07 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,35-5,45 (2H, м), 5,51 (1H, д, J=7,9 Гц), 6,66 (1H, дд, J=8,3 Гц, 2,8 Гц), 6,75-6,85 (2H, м), 7,2-7,45 (5H, м). м.д.: 1,05-1,2 (6H, м), 1,78 (3H, с), 1,98 (3H, с), 2,03 (3H, с), 2,16 (3H, с), 2,28 (3H, с), 2,75-2,85 (1H, м), 3,51 (1H, д, J=16,4 Гц), 3,62 (1H, д, J=16,4 Гц), 4,0-4,1 (1H, м), 4,1-4,2 (2H, м), 5,02 (2H, с), 5,07 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,35-5,45 (2H, м), 5,51 (1H, д, J=7,9 Гц), 6,66 (1H, дд, J=8,3 Гц, 2,8 Гц), 6,75-6,85 (2H, м), 7,2-7,45 (5H, м).
Сравнительный пример 60
4-{[4-бензилокси-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол -D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 12, с использованием 4-{[4-бензилокси-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и 2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилбромида вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-глюкопиранозилбромида вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-глюкозы, соответственно. -D-глюкозы, соответственно.
1H-ЯМР (CDCl3)  м.д.: 1,0-1,2 (42H, м), 1,7-1,85 (2H, м), 1,95-2,05 (2H, м), 2,85-2,95 (1H, м), 3,5-3,65 (4H, м), 3,8-3,9 (1H, м), 3,9-4,0 (2H, м), 4,12 (1H, дд, J=12,4 Гц, 5,l Гц), 4,19 (1H, дд, J=12,4 Гц, 1,8 Гц), 4,4-4,5 (1H, м), 4,99 (2H, с), 5,15-5,3 (2H, м), 5,36 (1H, т, J=9,4 Гц), 5,66 (1H, д, J=8,0 Гц), 6,42 (1H, дд, J=8,3 Гц, 2,3 Гц), 6,47 (1H, д, J=2,3 Гц), 6,86 (1H, д, J=8,3 Гц), 7,25-7,45 (5H, м). м.д.: 1,0-1,2 (42H, м), 1,7-1,85 (2H, м), 1,95-2,05 (2H, м), 2,85-2,95 (1H, м), 3,5-3,65 (4H, м), 3,8-3,9 (1H, м), 3,9-4,0 (2H, м), 4,12 (1H, дд, J=12,4 Гц, 5,l Гц), 4,19 (1H, дд, J=12,4 Гц, 1,8 Гц), 4,4-4,5 (1H, м), 4,99 (2H, с), 5,15-5,3 (2H, м), 5,36 (1H, т, J=9,4 Гц), 5,66 (1H, д, J=8,0 Гц), 6,42 (1H, дд, J=8,3 Гц, 2,3 Гц), 6,47 (1H, д, J=2,3 Гц), 6,86 (1H, д, J=8,3 Гц), 7,25-7,45 (5H, м).
Сравнительный пример 61
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 25, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-1Н-пиразол-3-она вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-галактопиранозилокси)-4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-1Н-пиразол-3-она вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола. -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6H, м), 1,83 (3H, с), 1,98 (3H, с), 2,03 (3H, с), 2,16 (3H, с), 2,25 (3H, с), 2,75-2,9 (1H, м), 3,5 (1H, д, J=16,6 Гц), 3,6 (1H, д, J=16,6 Гц), 4,0-4,05 (1H, м), 4,1-4,2 (2H, м), 4,78 (1H, шир.с), 5,06 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,35-5,45 (2H, м), 5,5 (1H, д, J=8,2 Гц), 6,52 (1H, дд, J=8,1 Гц, 2,6 Гц), 6,62 (1H, д, J=2,6 Гц), 6,76 (1H, д, J=8,1 Гц). м.д.: 1,1-1,2 (6H, м), 1,83 (3H, с), 1,98 (3H, с), 2,03 (3H, с), 2,16 (3H, с), 2,25 (3H, с), 2,75-2,9 (1H, м), 3,5 (1H, д, J=16,6 Гц), 3,6 (1H, д, J=16,6 Гц), 4,0-4,05 (1H, м), 4,1-4,2 (2H, м), 4,78 (1H, шир.с), 5,06 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,35-5,45 (2H, м), 5,5 (1H, д, J=8,2 Гц), 6,52 (1H, дд, J=8,1 Гц, 2,6 Гц), 6,62 (1H, д, J=2,6 Гц), 6,76 (1H, д, J=8,1 Гц).
Сравнительный пример 62
4-{[4-гидрокси-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол -D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 25, с использованием 4-{[4-бензилокси-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола. -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,0-1,2 (42H, м), 1,75-1,9 (2H, м), 1,95-2,1 (2H, м), 2,8-2,95 (1H, м), 3,52 (1H, д, J=16,5 Гц), 3,55-3,65 (3H, м), 3,8-3,9 (1H, м), 3,9-4,05 (2H, м), 4,05-4,2 (2H, м), 4,4-4,5 (1H, м), 5,14 (1H, шир.с), 5,15-5,3 (2H, м), 5,3-5,4 (1H, м), 5,65 (1H, д, J=8,1 Гц), 6,22 (1H, дд, J=8,2 Гц, 2,3 Гц), 6,37 (1H, д, J=2,3 Гц), 6,78 (1H, д, J=8,2 Гц). м.д.: 1,0-1,2 (42H, м), 1,75-1,9 (2H, м), 1,95-2,1 (2H, м), 2,8-2,95 (1H, м), 3,52 (1H, д, J=16,5 Гц), 3,55-3,65 (3H, м), 3,8-3,9 (1H, м), 3,9-4,05 (2H, м), 4,05-4,2 (2H, м), 4,4-4,5 (1H, м), 5,14 (1H, шир.с), 5,15-5,3 (2H, м), 5,3-5,4 (1H, м), 5,65 (1H, д, J=8,1 Гц), 6,22 (1H, дд, J=8,2 Гц, 2,3 Гц), 6,37 (1H, д, J=2,3 Гц), 6,78 (1H, д, J=8,2 Гц).
Сравнительный пример 63
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[3-(бензилоксикарбонил)пропокси]-2-метилфенил}метил)-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-({4-[3-(бензилоксикарбонил)пропокси]-2-метилфенил}метил)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 27, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-1Н-пиразола вместо 4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-галактопиранозилокси)-4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-1Н-пиразола вместо 4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола. -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,05-1,15 (6H, м), 1,81 (3H, с), 1,98 (3H, с), 2,02 (3H, с), 2,05-2,15 (2H, м), 2,16 (3H, с), 2,26 (3H, с), 2,56 (2H, т, J=7,1 Гц), 2,7-2,85 (1H, м), 3,5 (1H, д, J=16,5 Гц), 3,6 (1H, д, J=16,5 Гц), 3,9-4,0 (2H, м), 4,0-4,1 (1H, м), 4,1-4,2 (2H, м), 5,07 (1H, дд, J=10,6 Гц, 3,6 Гц), 5,13 (2H, с), 5,35-5,45 (2H, м), 5,52 (1H, д, J=8,2 Гц), 6,55 (1H, дд, J=8,6 Гц, 2,5 Гц), 6,66 (1H, д, J=2,5 Гц), 6,79 (1H, д, J=8,6 Гц), 7,25-7,4 (5H, м). м.д.: 1,05-1,15 (6H, м), 1,81 (3H, с), 1,98 (3H, с), 2,02 (3H, с), 2,05-2,15 (2H, м), 2,16 (3H, с), 2,26 (3H, с), 2,56 (2H, т, J=7,1 Гц), 2,7-2,85 (1H, м), 3,5 (1H, д, J=16,5 Гц), 3,6 (1H, д, J=16,5 Гц), 3,9-4,0 (2H, м), 4,0-4,1 (1H, м), 4,1-4,2 (2H, м), 5,07 (1H, дд, J=10,6 Гц, 3,6 Гц), 5,13 (2H, с), 5,35-5,45 (2H, м), 5,52 (1H, д, J=8,2 Гц), 6,55 (1H, дд, J=8,6 Гц, 2,5 Гц), 6,66 (1H, д, J=2,5 Гц), 6,79 (1H, д, J=8,6 Гц), 7,25-7,4 (5H, м).
Сравнительный пример 64
4-({4-[3-(бензилоксикарбонил)пропокси]-2-(тетрагидро-4Н-пиран-4-илокси)фенил}метил)-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол -D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 27, с использованием 4-{[4-гидрокси-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-гидрокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола. -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,0-1,2 (42H, м), 1,75-1,85 (2H, м), 1,95-2,15 (4H, м), 2,56 (2H, т, J=7,3 Гц), 2,8-2,95 (1H, м), 3,5-3,65 (4H, м), 3,8-3,9 (1H, м), 3,9-4,05 (4H, м), 4,05-4,25 (2H, м), 4,4-4,5 (1H, м), 5,13 (2H, с), 5,15-5,3 (2H, м), 5,36 (1H, т, J=9,5 Гц), 5,66 (1H, д, J=8,1 Гц), 6,3 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,38 (1H, д, J=2,5 Гц), 6,84 (1H, д, J=8,4 Гц), 7,25-7,4 (5H, м). м.д.: 1,0-1,2 (42H, м), 1,75-1,85 (2H, м), 1,95-2,15 (4H, м), 2,56 (2H, т, J=7,3 Гц), 2,8-2,95 (1H, м), 3,5-3,65 (4H, м), 3,8-3,9 (1H, м), 3,9-4,05 (4H, м), 4,05-4,25 (2H, м), 4,4-4,5 (1H, м), 5,13 (2H, с), 5,15-5,3 (2H, м), 5,36 (1H, т, J=9,5 Гц), 5,66 (1H, д, J=8,1 Гц), 6,3 (1H, дд, J=8,4 Гц, 2,5 Гц), 6,38 (1H, д, J=2,5 Гц), 6,84 (1H, д, J=8,4 Гц), 7,25-7,4 (5H, м).
Сравнительный пример 65
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-{[4-(3-карбоксипропокси)-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-{[4-(3-карбоксипропокси)-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 25, с использованием 2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[3-(бензилоксикарбонил)пропокси]-2-метилфенил}метил)-5-изопропил-1Н-пиразола вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-галактопиранозилокси)-4-({4-[3-(бензилоксикарбонил)пропокси]-2-метилфенил}метил)-5-изопропил-1Н-пиразола вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола. -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,05-1,15 (6H, м), 1,78 (3H, с), 1,98 (3H, с), 2,02 (3H, с), 2,05-2,15 (2H, м), 2,16 (3H, с), 2,27 (3H, с), 2,45-2,6 (2H, м), 2,75-2,85 (1H, м), 3,49 (1H, д, J=16,8 Гц), 3,6 (1H, д, J=16,8 Гц), 3,98 (2H, т, J=6,3 Гц), 4,0-4,1 (1H, м), 4,1-4,25 (2H, м), 5,06 (1H, дд, J=10,3 Гц, 3,4 Гц), 5,3-5,45 (3H, м), 6,58 (1H, дд, J=8,6 Гц, 2,4 Гц), 6,68 (1H, д, J=2,4 Гц), 6,78 (1H, д, J=8,6 Гц). м.д.: 1,05-1,15 (6H, м), 1,78 (3H, с), 1,98 (3H, с), 2,02 (3H, с), 2,05-2,15 (2H, м), 2,16 (3H, с), 2,27 (3H, с), 2,45-2,6 (2H, м), 2,75-2,85 (1H, м), 3,49 (1H, д, J=16,8 Гц), 3,6 (1H, д, J=16,8 Гц), 3,98 (2H, т, J=6,3 Гц), 4,0-4,1 (1H, м), 4,1-4,25 (2H, м), 5,06 (1H, дд, J=10,3 Гц, 3,4 Гц), 5,3-5,45 (3H, м), 6,58 (1H, дд, J=8,6 Гц, 2,4 Гц), 6,68 (1H, д, J=2,4 Гц), 6,78 (1H, д, J=8,6 Гц).
Сравнительный пример 66
4-{[4-(3-карбоксипропокси)-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол -D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 25, с использованием 4-({4-[3-(бензилоксикарбонил)пропокси]-2-(тетрагидро-4Н-пиран-4-илокси)фенил}метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-бензилокси-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола. -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,0-1,2 (42Н, м), 1,75-1,9 (2H, м), 1,95-2,15 (4H, м), 2,5-2,6 (2H, м), 2,8-2,95 (1H, м),, 3,45-3,65 (4H, м), 3,8-3,9 (1H, м), 3,9-4,05 (4H, м), 4,1-4,25 (2H, м), 4,4-4,55 (1H, м), 5,2-5,3 (2H, м), 5,36 (1H, т, J=9,2 Гц), 5,52 (1H, д, J=7,7 Гц), 6,33 (1H, дд, J=8,1 Гц, 2,1 Гц), 6,41 (1H, д, J=2,1 Гц), 6,84 (1H, д, J=8,1 Гц). м.д.: 1,0-1,2 (42Н, м), 1,75-1,9 (2H, м), 1,95-2,15 (4H, м), 2,5-2,6 (2H, м), 2,8-2,95 (1H, м),, 3,45-3,65 (4H, м), 3,8-3,9 (1H, м), 3,9-4,05 (4H, м), 4,1-4,25 (2H, м), 4,4-4,55 (1H, м), 5,2-5,3 (2H, м), 5,36 (1H, т, J=9,2 Гц), 5,52 (1H, д, J=7,7 Гц), 6,33 (1H, дд, J=8,1 Гц, 2,1 Гц), 6,41 (1H, д, J=2,1 Гц), 6,84 (1H, д, J=8,1 Гц).
Сравнительный пример 67
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-{3-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 45, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-{[4-(3-карбоксипропокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-{[4-(3-карбоксипропокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,05-1,15 (6H, м), 1,53 (6H, с), 1,83 (3H, с), 1,95-2,1 (8H, м), 2,15 (3H, с), 2,26 (3H, с), 2,34 (2H, т, J=7,2 Гц), 2,7-2,85 (1H, м), 3,5 (1H, д, J=16,6 Гц), 3,6 (1H, д, J=16,6 Гц), 3,85-3,95 (2H, м), 4,0-4,1 (1H, м), 4,1-4,2 (2H, м), 5,07 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,15 (2H, с), 5,35-5,45 (2H, м), 5,52 (1H, д, J=8,1 Гц), 6,06 (1H, с), 6,55 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,66 (1H, д, J=2,6 Гц), 6,79 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м). м.д.: 1,05-1,15 (6H, м), 1,53 (6H, с), 1,83 (3H, с), 1,95-2,1 (8H, м), 2,15 (3H, с), 2,26 (3H, с), 2,34 (2H, т, J=7,2 Гц), 2,7-2,85 (1H, м), 3,5 (1H, д, J=16,6 Гц), 3,6 (1H, д, J=16,6 Гц), 3,85-3,95 (2H, м), 4,0-4,1 (1H, м), 4,1-4,2 (2H, м), 5,07 (1H, дд, J=10,4 Гц, 3,5 Гц), 5,15 (2H, с), 5,35-5,45 (2H, м), 5,52 (1H, д, J=8,1 Гц), 6,06 (1H, с), 6,55 (1H, дд, J=8,5 Гц, 2,6 Гц), 6,66 (1H, д, J=2,6 Гц), 6,79 (1H, д, J=8,5 Гц), 7,25-7,4 (5H, м).
Сравнительный пример 68
4-{[4-{3-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]пропокси}-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол -D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 45, с использованием 4-{[4-(3-карбоксипропокси)-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,0-1,2 (42H, м), 1,54 (6H, с), 1,75-1,85 (2H, м), 2,0-2,1 (4H, м), 2,34 (2H, т, J=7,2 Гц), 2,8-2,95 (1H, м), 3,5-3,65 (4H, м), 3,8-4,05 (5H, м), 4,05-4,25 (2H, м), 4,4-4,5 (1H, м), 5,1-5,3 (4H, м), 5,36 (1H, т, J=9,5 Гц), 5,65 (1H, д, J=7,5 Гц), 6,09 (1H, шир.с), 6,29 (1H, дд, J=8,3 Гц, 2,2 Гц), 6,4 (1H, д, J=2,2 Гц), 6,83 (1H, д, J=8,3 Гц), 7,25-7,4 (5H, м). м.д.: 1,0-1,2 (42H, м), 1,54 (6H, с), 1,75-1,85 (2H, м), 2,0-2,1 (4H, м), 2,34 (2H, т, J=7,2 Гц), 2,8-2,95 (1H, м), 3,5-3,65 (4H, м), 3,8-4,05 (5H, м), 4,05-4,25 (2H, м), 4,4-4,5 (1H, м), 5,1-5,3 (4H, м), 5,36 (1H, т, J=9,5 Гц), 5,65 (1H, д, J=7,5 Гц), 6,09 (1H, шир.с), 6,29 (1H, дд, J=8,3 Гц, 2,2 Гц), 6,4 (1H, д, J=2,2 Гц), 6,83 (1H, д, J=8,3 Гц), 7,25-7,4 (5H, м).
Сравнительный пример 69
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 48, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-[(4-{2-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,05-1,15 (6H, м), 1,55 (3H, с), 1,56 (3H, с), 1,79 (3H, с), 1,98 (3H, с), 2,0-2,2 (8H, м), 2,26 (3H, с), 2,4 (2H, т, J=6,9 Гц), 2,7-2,85 (1H, м), 3,49 (1H, д, J=16,6 Гц), 3,59 (1H, д, J=16,6 Гц), 3,98 (2H, т, J=6,1 Гц), 4,0-4,2 (2H, м), 4,22 (1H, дд, J=10,9 Гц, 5,7 Гц), 5,0-5,1 (1H, м), 5,3-5,45 (3H, м), 6,24 (1H, с), 6,59 (1H, дд, J=8,2 Гц, 2,7 Гц), 6,69 (1H, д, J=2,7 Гц), 6,75 (1H, д, J=8,2 Гц). м.д.: 1,05-1,15 (6H, м), 1,55 (3H, с), 1,56 (3H, с), 1,79 (3H, с), 1,98 (3H, с), 2,0-2,2 (8H, м), 2,26 (3H, с), 2,4 (2H, т, J=6,9 Гц), 2,7-2,85 (1H, м), 3,49 (1H, д, J=16,6 Гц), 3,59 (1H, д, J=16,6 Гц), 3,98 (2H, т, J=6,1 Гц), 4,0-4,2 (2H, м), 4,22 (1H, дд, J=10,9 Гц, 5,7 Гц), 5,0-5,1 (1H, м), 5,3-5,45 (3H, м), 6,24 (1H, с), 6,59 (1H, дд, J=8,2 Гц, 2,7 Гц), 6,69 (1H, д, J=2,7 Гц), 6,75 (1H, д, J=8,2 Гц).
Сравнительный пример 70
4-{[4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропокси}-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразол -D-глюкопиранозилокси)-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 48, с использованием 4-{[4-{3-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]пропокси}-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-[(4-{2-[1-бензилоксикарбонил-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,0-1,2 (42H, м), 1,54 (6H, с), 1,7-1,9 (2H, м), 1,95-2,15 (4H, м), 2,35-2,45 (2H, м), 2,8-2,95 (1H, м), 3,45-3,65 (4H, м), 3,8-3,9 (1H, м), 3,9-4,05 (4H, м), 4,05-4,25 (2H, м), 4,4-4,55 (1H, м), 5,15-5,3 (2H, м), 5,36 (1H, т, J=9,4 Гц), 5,56 (1H, д, J=8,4 Гц), 6,17 (1H, шир.с), 6,32 (1H, д, J=8,1 Гц), 6,41 (1H, с), 6,82 (1H, д, J=8,1 Гц). м.д.: 1,0-1,2 (42H, м), 1,54 (6H, с), 1,7-1,9 (2H, м), 1,95-2,15 (4H, м), 2,35-2,45 (2H, м), 2,8-2,95 (1H, м), 3,45-3,65 (4H, м), 3,8-3,9 (1H, м), 3,9-4,05 (4H, м), 4,05-4,25 (2H, м), 4,4-4,55 (1H, м), 5,15-5,3 (2H, м), 5,36 (1H, т, J=9,4 Гц), 5,56 (1H, д, J=8,4 Гц), 6,17 (1H, шир.с), 6,32 (1H, д, J=8,1 Гц), 6,41 (1H, с), 6,82 (1H, д, J=8,1 Гц).
Пример 112
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 99, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-(бензилоксикарбонил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-(бензилоксикарбонил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно. -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,95-2,05 (2H, м), 2,29 (3H, с), 2,39 (2H, т, J=7,4 Гц), 2,55-2,9 (5H, м), 3,45-3,8 (11H, м), 3,85 (1H, д, J=3,2 Гц), 3,95 (2H, т, J=6,1 Гц), 5,04 (1H, д, J=7,5 Гц), 6,61 (1H, дд, J=8,2 Гц, 2,4 Гц), 6,71 (1H, д, J=2,4 Гц), 6,84 (1H, д, J=8,2 Гц). м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,95-2,05 (2H, м), 2,29 (3H, с), 2,39 (2H, т, J=7,4 Гц), 2,55-2,9 (5H, м), 3,45-3,8 (11H, м), 3,85 (1H, д, J=3,2 Гц), 3,95 (2H, т, J=6,1 Гц), 5,04 (1H, д, J=7,5 Гц), 6,61 (1H, дд, J=8,2 Гц, 2,4 Гц), 6,71 (1H, д, J=2,4 Гц), 6,84 (1H, д, J=8,2 Гц).
Пример 113
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 78, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-(2-гидроксиэтил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно. -D-глюкопиранозилокси)-4-{[4-(2-карбоксиэтокси)-2-метилфенил]метил}-5-изопропил-1Н-пиразола и 2-амино-2-метилпропионамида, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,95-2,05 (2H, м), 2,28 (3H, с), 2,3-2,55 (8H, м), 2,7-2,85 (1H, м), 3,45-3,8 (13H, м), 3,85 (1H, д, J=2,9 Гц), 3,94 (2H, т, J=6,0 Гц), 5,04 (1H, д, J=7,6 Гц), 6,6 (1H, д, J=8,5 Гц), 6,7 (1H, с), 6,85 (1H, д, J=8,5 Гц). м.д.: 1,05-1,15 (6H, м), 1,42 (6H, с), 1,95-2,05 (2H, м), 2,28 (3H, с), 2,3-2,55 (8H, м), 2,7-2,85 (1H, м), 3,45-3,8 (13H, м), 3,85 (1H, д, J=2,9 Гц), 3,94 (2H, т, J=6,0 Гц), 5,04 (1H, д, J=7,6 Гц), 6,6 (1H, д, J=8,5 Гц), 6,7 (1H, с), 6,85 (1H, д, J=8,5 Гц).
Пример 114
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 105, с использованием 4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропокси}-2-(тетрагидро-4Н-пиран-4-илокси)фенил]метил}-5-изопропил-3-(2,3,4,6-тетра-О-пивалоил- -D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-1Н-пиразола вместо 4-[(4-{3-[1-карбокси-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-1Н-пиразола. -D-глюкопиранозилокси)-1Н-пиразола.
1H-ЯМР (CD3OD)  м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,7-1,85 (2H, м), 1,95-2,1 (4H, м), 2,38 (2H, т, J=7,4 Гц), 2,6-2,8 (4H, м), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,5-3,75 (9H, м), 3,83 (1H, д, J=12,1 Гц), 3,9-4,0 (4H, м), 4,5-4,65 (1H, м), 5,07 (1H, д, J=7,1 Гц), 6,4 (1H, дд, J=8,3 Гц, 2,5 Гц), 6,54 (1H, д, J=2,5 Гц), 6,89 (1H, д, J=8,3 Гц). м.д.: 1,05-1,2 (6H, м), 1,42 (6H, с), 1,7-1,85 (2H, м), 1,95-2,1 (4H, м), 2,38 (2H, т, J=7,4 Гц), 2,6-2,8 (4H, м), 2,8-2,95 (1H, м), 3,25-3,45 (4H, м), 3,5-3,75 (9H, м), 3,83 (1H, д, J=12,1 Гц), 3,9-4,0 (4H, м), 4,5-4,65 (1H, м), 5,07 (1H, д, J=7,1 Гц), 6,4 (1H, дд, J=8,3 Гц, 2,5 Гц), 6,54 (1H, д, J=2,5 Гц), 6,89 (1H, д, J=8,3 Гц).
Сравнительный пример 71
4-[(4-бром-2-фторфенил)метил]-1,2-дигидро-5-изопропил-3Н-пиразол-3-он
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 2, с использованием 4-бром-2-фторбензилбромида вместо 4-бромбензилбромида.
1H-ЯМР (CDCl3)  м.д.: 1,17 (6H, д, J=7,1 Гц), 2,85-3,05 (1H, м), 3,67 (2H, с), 7,0-7,3 (3H, м). м.д.: 1,17 (6H, д, J=7,1 Гц), 2,85-3,05 (1H, м), 3,67 (2H, с), 7,0-7,3 (3H, м).
Сравнительный пример 72
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-бром-2-фторфенил)метил]-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-[(4-бром-2-фторфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 12, с использованием 4-[(4-бром-2-фторфенил)метил]-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-галактозы вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-галактозы вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она и ацетобром- -D-глюкозы, соответственно. -D-глюкозы, соответственно.
1H-ЯМР (CDCl3)  м.д.: 1,15-1,25 (6H, м), 1,92 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,18 (3H, с), 2,9-3,0 (1H, м), 3,59 (1H, д, J=16,1 Гц), 3,67 (1H, д, J=16,1 Гц), 4,05-4,25 (3H, м), 5,1 (1H, дд, J=10,4 Гц, 3,4 Гц), 5,35-5,45 (2H, м), 5,58 (1H, д, J=8,l Гц), 6,95-7,05 (1H, м), 7,1-7,2 (2H, м). м.д.: 1,15-1,25 (6H, м), 1,92 (3H, с), 1,99 (3H, с), 2,02 (3H, с), 2,18 (3H, с), 2,9-3,0 (1H, м), 3,59 (1H, д, J=16,1 Гц), 3,67 (1H, д, J=16,1 Гц), 4,05-4,25 (3H, м), 5,1 (1H, дд, J=10,4 Гц, 3,4 Гц), 5,35-5,45 (2H, м), 5,58 (1H, д, J=8,l Гц), 6,95-7,05 (1H, м), 7,1-7,2 (2H, м).
Сравнительный пример 73
3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]-2-фторфенил}метил)-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]-2-фторфенил}метил)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 4, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-бром-2-фторфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-[(4-бром-2-фторфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6H, м), 1,89 (3H, с), 1,99 (3H, с), 2,01 (3H, с), 2,17 (3H, с), 2,85-3,0 (1H, м), 3,27 (2H, д, J=6,9 Гц), 3,59 (1H, д, J=16,2 Гц), 3,7 (1H, д, J=16,2 Гц), 4,05-4,3 (3H, м), 5,1 (1H, дд, J=10,2 Гц, 3,5 Гц), 5,3-5,5 (3H, м), 6,2-6,35 (1H, м), 6,43 (1H, д, J=16,2 Гц), 6,9-7,15 (3H, м). м.д.: 1,1-1,2 (6H, м), 1,89 (3H, с), 1,99 (3H, с), 2,01 (3H, с), 2,17 (3H, с), 2,85-3,0 (1H, м), 3,27 (2H, д, J=6,9 Гц), 3,59 (1H, д, J=16,2 Гц), 3,7 (1H, д, J=16,2 Гц), 4,05-4,3 (3H, м), 5,1 (1H, дд, J=10,2 Гц, 3,5 Гц), 5,3-5,5 (3H, м), 6,2-6,35 (1H, м), 6,43 (1H, д, J=16,2 Гц), 6,9-7,15 (3H, м).
Сравнительный пример 74
1-(2-амино-2-метилпропионил)-4-(бензилоксикарбонил)пиперазин
К раствору 2-(трет-бутоксикарбониламино)-2-метилпропионовой кислоты (10 г) в тетрагидрофуране (20 мл) добавляли 1-(бензилоксикарбонил)пиперазин (16,3 г), 1-гидроксибензотриазол (8,02 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (11,4 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь выливали в воду и полученную смесь экстрагировали этилацетатом. Экстракт промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Остаток растворяли в смешанном растворителе из н-гексана и этилацетата (1/1) (40 мл), нагревая при 60°С, и раствор перемешивали при комнатной температуре в течение ночи. К смеси добавляли тот же самый растворитель (30 мл) и смесь снова перемешивали в течение ночи. Осажденные кристаллы собирали фильтрованием, затем промывали тем же самым растворителем и сушили при пониженном давлении, получая 4-бензилоксикарбонил-1-[2-(трет-бутоксикарбониламино)-2-метилпропионил]пиперазин (13,5 г). К раствору полученного 4-бензилоксикарбонил-1-[2-(трет-бутоксикарбониламино)-2-метилпропионил]пиперазина (5 г) в тетрагидрофуране (30 мл) добавляли хлористоводородную кислоту (4 моль/л раствор в 1,4-диоксане, 40 мл) и полученную смесь перемешивали при комнатной температуре в течение ночи. Осажденные кристаллы собирали фильтрованием. Полученные кристаллы растворяли в этилацетате и в насыщенном водном растворе бикарбоната натрия. Органический слой отделяли, промывали насыщенным раствором соли и сушили над безводным сульфатом натрия. Растворитель удаляли при пониженном давлении и получали указанное в заголовке соединение (3,65 г).
1H-ЯМР (CDCl3)  м.д.: 1,41 (6H, с), 3,45-3,55 (4H, м), 3,7-3,95 (4H, шир.), 5,15 (2H, с), 7,25-7,4 (5H, м). м.д.: 1,41 (6H, с), 3,45-3,55 (4H, м), 3,7-3,95 (4H, шир.), 5,15 (2H, с), 7,25-7,4 (5H, м).
Пример 115
4-{[2-фтор-4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол -D-галактопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 99, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]-2-фторфенил}метил)-5-изопропил-1Н-пиразола и 1-(2-амино-2-метилпропионил)-4-(бензилоксикарбонил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-галактопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]-2-фторфенил}метил)-5-изопропил-1Н-пиразола и 1-(2-амино-2-метилпропионил)-4-(бензилоксикарбонил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил]метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно. -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил]метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,6 Гц), 2,6 (2H, т, J=7,6 Гц), 2,7-2,85 (4H, м), 2,85-3,0 (1H, м), 3,45-3,85 (11H, м), 3,85-3,9 (1H, м), 5,09 (1H, д, J=7,8 Гц), 6,8-6,9 (2H, м), 7,0-7,15 (1H, м). м.д.: 1,1-1,2 (6H, м), 1,42 (6H, с), 1,8-1,95 (2H, м), 2,17 (2H, т, J=7,6 Гц), 2,6 (2H, т, J=7,6 Гц), 2,7-2,85 (4H, м), 2,85-3,0 (1H, м), 3,45-3,85 (11H, м), 3,85-3,9 (1H, м), 5,09 (1H, д, J=7,8 Гц), 6,8-6,9 (2H, м), 7,0-7,15 (1H, м).
Сравнительный пример 75
4-бром-2-хлорбензиловый спирт
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 14, с использованием 4-бром-2-хлорбензойной кислоты вместо 4-бром-2-метилбензойной кислоты.
1H-ЯМР (CDCl3)  м.д.: 1,9-2,0 (1H, м), 4,73 (2H, д, J=5,5 Гц), 7,3-7,45 (2H, м), 7,45-7,55 (1H, м). м.д.: 1,9-2,0 (1H, м), 4,73 (2H, д, J=5,5 Гц), 7,3-7,45 (2H, м), 7,45-7,55 (1H, м).
Сравнительный пример 76
4-[(4-бром-2-хлорфенил)метил]-1,2-дигидро-5-изопропил-3Н-пиразол-3-он
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 15, с использованием 4-бром-2-хлорбензилового спирта вместо 4-бром-2-метилбензилового спирта.
1H-ЯМР (ДМСО-d6) 5 м.д.: 1,07 (6H, д, J=6,9 Гц), 2,7-2,85 (1H, м), 3,61 (2H, с), 6,97 (1H, д, J=8,5 Гц), 7,46 (1H, дд, J=8,5 Гц, 2,0 Гц), 7,66 (1H, д, J=2,0 Гц).
Сравнительный пример 77
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бром-2-хлорфенил)метил]-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-[(4-бром-2-хлорфенил)метил]-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 12, с использованием 4-[(4-бром-2-хлорфенил)метил]-1,2-дигидро-5-изопропил-3Н-пиразол-3-она вместо 4-{[4-(2-бензилоксикарбонил-2-метилпропокси)фенил]метил}-1,2-дигидро-5-изопропил-3Н-пиразол-3-она.
1H-ЯМР (CDCl3)  м.д.: 1,17 (6H, д, J=7,0 Гц), 1,9 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,07 (3H, с), 2,85-3,0 (1H, м), 3,65 (1H, д, J=16,7 Гц), 3,74 (1H, д, J=16,7 Гц), 3,8-3,9 (1H, м), 4,05-4,2 (1H, м), 4,31 (1H, дд, J=12,8 Гц, 4,3 Гц), 5,1-5,35 (3H, м), 5,6 (1H, д, J=8,1 Гц), 6,93 (1H, д, J=8,2 Гц), 7,24 (1H, дд, J=8,2 Гц, 1,8 Гц), 7,49 (1H, д, J=1,8 Гц). м.д.: 1,17 (6H, д, J=7,0 Гц), 1,9 (3H, с), 2,01 (3H, с), 2,03 (3H, с), 2,07 (3H, с), 2,85-3,0 (1H, м), 3,65 (1H, д, J=16,7 Гц), 3,74 (1H, д, J=16,7 Гц), 3,8-3,9 (1H, м), 4,05-4,2 (1H, м), 4,31 (1H, дд, J=12,8 Гц, 4,3 Гц), 5,1-5,35 (3H, м), 5,6 (1H, д, J=8,1 Гц), 6,93 (1H, д, J=8,2 Гц), 7,24 (1H, дд, J=8,2 Гц, 1,8 Гц), 7,49 (1H, д, J=1,8 Гц).
Сравнительный пример 78
3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]-2-хлорфенил}метил)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]-2-хлорфенил}метил)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в сравнительном примере 4, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бром-2-хлорфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бром-2-хлорфенил)метил]-5-изопропил-1Н-пиразола вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола. -D-глюкопиранозилокси)-4-[(4-бромфенил)метил]-5-изопропил-1Н-пиразола.
1H-ЯМР (CDCl3)  м.д.: 1,1-1,2 (6H, м), 1,85 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,05 (3H, с), 2,85-3,0 (1H, м), 3,27 (2H, д, J=6,4 Гц), 3,68 (1H, д, J=16,7 Гц), 3,78 (1H, д, J=16,7 Гц), 3,8-3,9 (1H, м), 4,1-4,2 (1H, м), 4,32 (1H, дд, J=12,6 Гц, 3,8 Гц), 5,15-5,3 (3H, м), 5,43 (1H, д, J=7,8 Гц), 6,2-6,35 (1H, м), 6,42 (1H, д, J=16,1 Гц), 6,96 (1H, д, J=1,6 Гц), 7,13 (1H, дд, J=8,2 Гц, 1,6 Гц), 7,36 (1H, д, J=1,6 Гц). м.д.: 1,1-1,2 (6H, м), 1,85 (3H, с), 2,0 (3H, с), 2,02 (3H, с), 2,05 (3H, с), 2,85-3,0 (1H, м), 3,27 (2H, д, J=6,4 Гц), 3,68 (1H, д, J=16,7 Гц), 3,78 (1H, д, J=16,7 Гц), 3,8-3,9 (1H, м), 4,1-4,2 (1H, м), 4,32 (1H, дд, J=12,6 Гц, 3,8 Гц), 5,15-5,3 (3H, м), 5,43 (1H, д, J=7,8 Гц), 6,2-6,35 (1H, м), 6,42 (1H, д, J=16,1 Гц), 6,96 (1H, д, J=1,6 Гц), 7,13 (1H, дд, J=8,2 Гц, 1,6 Гц), 7,36 (1H, д, J=1,6 Гц).
Пример 116
4-{[2-хлор-4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол
Указанное в заголовке соединение получали способом, описанным в примере 99, с использованием 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]-2-хлорфенил}метил)-5-изопропил-1Н-пиразола и 1-(2-амино-2-метилпропионил)-4-(бензилоксикарбонил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-({4-[(1E)-3-карбоксипроп-1-енил]-2-хлорфенил}метил)-5-изопропил-1Н-пиразола и 1-(2-амино-2-метилпропионил)-4-(бензилоксикарбонил)пиперазина вместо 3-(2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно. -D-глюкопиранозилокси)-4-[(4-{2-[1-карбокси-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразола и 1-бензилпиперазина, соответственно.
1H-ЯМР (CD3OD)  м.д.: 1,1-1,2 (6Н, м), 1,43 (6Н, с), 1,8-1,95 (2Н, м), 2,17 (2Н, т, J=7,7 Гц), 2,59 (2H, т, J=7,6 Гц), 2,65-2,95 (5H, м), 3,25-3,45 (4H, м), 3,5-3,9 (8H, м), 5,09 (1H, д, J=7,1 Гц), 6,95-7,1 (2H, м), 7,2 (1H, д, J=1,3 Гц). м.д.: 1,1-1,2 (6Н, м), 1,43 (6Н, с), 1,8-1,95 (2Н, м), 2,17 (2Н, т, J=7,7 Гц), 2,59 (2H, т, J=7,6 Гц), 2,65-2,95 (5H, м), 3,25-3,45 (4H, м), 3,5-3,9 (8H, м), 5,09 (1H, д, J=7,1 Гц), 6,95-7,1 (2H, м), 7,2 (1H, д, J=1,3 Гц).
Пример испытаний 1
Анализ на ингибирующее действие, направленное против активности SGLT1 человека
1) Клонирование и конструирование вектора, экспрессирующего SGLT1 человека.
кДНК-библиотеку для ПЦР-амплификации получали обратной транскрипцией полной РНК, выделенной из тонкого кишечника человека (ген Ori), с использованием oligo-dT в качестве праймера. С использованием данной кДНК-библиотеки в качестве матрицы, ДНК-фрагмент, кодирующий 1-2005 п.н. SGLT1 человека (ACCESSION: М24847), который описан Hediger et al., амлифицировали ПЦР-методом и встраивали в сайт множественного клонирования pcDNA3.1(-) (Invitrogen). Встроенная ДНК-последовательность точно соответствовала описанной ранее последовательности.
2) Создание клеточной линии, стабильно экспрессирующей SGLT1 человека.
Экспрессирующий вектор для SGLT1 человека гидролизовали Sca I с получением линейной ДНК. Данную линейную ДНК трансфецировали в клетки СНО-К1 путем липофекции (реагент для трансфекции Effectene, QIAGEN). Резистентные к неомицину клеточные линии отбирали путем культивирования в среде, содержащей G418 (1 мг/мл, LIFE TECHNOLOGIES), и затем активность против поглощения метил- -D-глюкопиранозида измеряли методом, описанным ниже. Клеточную линию, которая обнаруживала самую высокую активность поглощения, отбирали и обозначали CS1-5-11D. Клетки CS1-5-11D культивировали в присутствии G418 при 200 мкг/мл. -D-глюкопиранозида измеряли методом, описанным ниже. Клеточную линию, которая обнаруживала самую высокую активность поглощения, отбирали и обозначали CS1-5-11D. Клетки CS1-5-11D культивировали в присутствии G418 при 200 мкг/мл.
3) Измерение ингибирующей активности против поглощения метил- -D-глюкопиранозида ( -D-глюкопиранозида ( -MG). -MG).
Клетки CS1-5-11D высевали в 96-луночный планшет для культивирования при плотности 3×104 клеток/лунка и культивировали в течение 2 дней, затем использовали в анализе на поглощение. Смесь немеченого (Sigma) и 14С-меченного  -MG (Amersham Pharmacia Biothech) добавляли к буферу для поглощения (буфер, рН 7,4, содержащий 140 мМ хлорида натрия, 2 мМ хлорида калия, 1 мМ хлорида кальция, 1 мМ хлорида магния, 10 мМ 2-[4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновой кислоты и 5 мМ трис(гидроксиметил)аминометана) при конечной концентрации 1 мМ. Тестируемое соединение растворяли в диметилсульфоксиде и затем соответствующим образом растворяли в дистиллированной воде. Раствор тестируемого соединения добавляли в буфер для поглощения, содержащий 1 мМ -MG (Amersham Pharmacia Biothech) добавляли к буферу для поглощения (буфер, рН 7,4, содержащий 140 мМ хлорида натрия, 2 мМ хлорида калия, 1 мМ хлорида кальция, 1 мМ хлорида магния, 10 мМ 2-[4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновой кислоты и 5 мМ трис(гидроксиметил)аминометана) при конечной концентрации 1 мМ. Тестируемое соединение растворяли в диметилсульфоксиде и затем соответствующим образом растворяли в дистиллированной воде. Раствор тестируемого соединения добавляли в буфер для поглощения, содержащий 1 мМ  -MG, который далее будет называться буфером для измерения. Для контрольной группы буфер для измерения не содержал тестируемого соединения. Для измерения фонового поглощения приготавливали буфер для измерения фонового поглощения, который вместо хлорида натрия содержал 140 мМ холинхлорида. После удаления культуральной среды для клеток CS1-5-11D в каждую лунку добавляли 180 мкл буфера для предварительной обработки (буфера для фонового поглощения, не содержащего -MG, который далее будет называться буфером для измерения. Для контрольной группы буфер для измерения не содержал тестируемого соединения. Для измерения фонового поглощения приготавливали буфер для измерения фонового поглощения, который вместо хлорида натрия содержал 140 мМ холинхлорида. После удаления культуральной среды для клеток CS1-5-11D в каждую лунку добавляли 180 мкл буфера для предварительной обработки (буфера для фонового поглощения, не содержащего  -MG) и инкубировали при 37оС в течение 10 минут. После повторения той же самой процедуры обработки буфер для предварительной обработки удаляли. В каждую лунку добавляли 75 мкл буфера для измерений или буфера для фонового поглощения и инкубировали при 37оС в течение 1 часа. После удаления буфера для измерения клетки два раза промывали 180 мкл на лунку промывочного буфера (буфера для фонового поглощения, содержащего 10 мМ не меченного -MG) и инкубировали при 37оС в течение 10 минут. После повторения той же самой процедуры обработки буфер для предварительной обработки удаляли. В каждую лунку добавляли 75 мкл буфера для измерений или буфера для фонового поглощения и инкубировали при 37оС в течение 1 часа. После удаления буфера для измерения клетки два раза промывали 180 мкл на лунку промывочного буфера (буфера для фонового поглощения, содержащего 10 мМ не меченного  -MG). Клетки солюбилизировали 75 мкл на лунку 0,2 моль/л гидроксида натрия. Клеточные лизаты переносили в PicoPlate (Packard), затем добавляли 150 мкл MicroScint-40 (Packard) и смешивали. Радиоактивность измеряли с использованием сцинтилляционного счетчика TopCount для микропланшетов (Packard). Разность между поглощением для контрольной группы и базальным поглощением брали за 100% и вычисляли величину поглощения метил- -MG). Клетки солюбилизировали 75 мкл на лунку 0,2 моль/л гидроксида натрия. Клеточные лизаты переносили в PicoPlate (Packard), затем добавляли 150 мкл MicroScint-40 (Packard) и смешивали. Радиоактивность измеряли с использованием сцинтилляционного счетчика TopCount для микропланшетов (Packard). Разность между поглощением для контрольной группы и базальным поглощением брали за 100% и вычисляли величину поглощения метил- -D-глюкопиранозида при каждой концентрации лекарственного средства. Концентрацию лекарственного средства, при которой ингибируется 50% поглощения метил- -D-глюкопиранозида при каждой концентрации лекарственного средства. Концентрацию лекарственного средства, при которой ингибируется 50% поглощения метил- -D-глюкопиранозида (величина IC50), вычисляли с использованием логарифмической кривой. Результаты представлены в таблице 1. -D-глюкопиранозида (величина IC50), вычисляли с использованием логарифмической кривой. Результаты представлены в таблице 1.
| Таблица 1 |
| Испытуемое соединение |
Величина IC50 (нМ) |
| Пример 15 |
113 |
| Пример 18 |
181 |
| Пример 21 |
12 |
| Пример 24 |
24 |
| Пример 27 |
237 |
| Пример 28 |
267 |
| Пример 29 |
431 |
| Пример 30 |
52 |
| Пример 31 |
96 |
| Пример 32 |
220 |
| Пример 33 |
174 |
| Пример 34 |
245 |
| Пример 35 |
115 |
| Пример 48 |
31 |
| Пример 57 |
39 |
| Пример 61 |
18 |
Пример испытаний 2
Анализ на ингибирование увеличения уровня глюкозы в крови у крыс
1) Получение крысиной модели диабета
Самцам крыс Wistar (Japan Charles River) в возрасте 8 недель внутрибрюшинно инъецировали никотинамид (230 мг/кг). Через пятнадцать минут после инъекции крысам в хвостовую вену внутривенно инъецировали стрептозотоцин (85 мг/кг) при анестезии эфиром. Спустя одну неделю, крыс выдерживали в условиях голодания в течение ночи и затем проводили тест на толерантность к глюкозе (2 г/кг). Крыс, у которых концентрация глюкозы в плазме через 1 час после введения глюкозы превышала 300 мг/дл, отбирали для проведения теста на толерантность к жидкой пище.
2) Тест на толерантность к жидкой пище
После выдерживания в условиях голодания в течение ночи крысам с диабетом группы обработки лекарственным средством перорально вводили тестируемое соединение (1 мг/кг), которое растворяли в дистиллированной воде, и крысам контрольной группы давали только дистиллированную воду. Сразу после введения соединения крысам перорально вводили 17,25 ккал/кг жидкой пищи ( 038, корм для контроля, содержащий декстрин и мальтозу; Oriental Yeast Co., Ltd.). Непосредственно перед введением и сразу после введения в течение всего процесса обработки из хвостовой артерии брали кровь и сразу обрабатывали гепарином. Полученную кровь центрифугировали и плазму собирали для количественной оценки концентрации глюкозы в плазме методом, использующим глюкозооксидазу. В таблице 2 приведены концентрации глюкозы в плазме перед обработкой (0 ч) и через 0,5 и 1 час после введения лекарственного средства. Величины, представленные в таблице, даны как среднее±стандартная ошибка. 038, корм для контроля, содержащий декстрин и мальтозу; Oriental Yeast Co., Ltd.). Непосредственно перед введением и сразу после введения в течение всего процесса обработки из хвостовой артерии брали кровь и сразу обрабатывали гепарином. Полученную кровь центрифугировали и плазму собирали для количественной оценки концентрации глюкозы в плазме методом, использующим глюкозооксидазу. В таблице 2 приведены концентрации глюкозы в плазме перед обработкой (0 ч) и через 0,5 и 1 час после введения лекарственного средства. Величины, представленные в таблице, даны как среднее±стандартная ошибка.
| Таблица 2 |
| Испытуемое соединение |
Концентрация глюкозы в плазме (мг/дл) |
| 0 ч |
0,5 ч |
1 ч |
| Контроль |
117±8 |
326±46 |
297+35 |
| Пример 21 |
118±9 |
156±15 |
178±19 |
| Контроль |
121±7 |
313±33 |
303±63 |
| Пример 30 |
121±6 |
163±8 |
187±9 |
| Контроль |
140±11 |
280±22 |
287±23 |
| Пример 32 |
125±8 |
223±20 |
278±32 |
| Пример 33 |
127±11 |
207±8 |
251±21 |
| Контроль |
116±11 |
241±15 |
237±10 |
| Пример 48 |
112±5 |
139±4 |
132±4 |
| Контроль |
133±9 |
236±9 |
210±11 |
| Пример 57 |
126±6 |
149±7 |
158±10 |
| Контроль |
122+6 |
277±16 |
272±21 |
| Пример 61 |
116±6 |
136±6 |
172±37 |
Пример испытаний 3
Тест на острую токсичность
Самцов мышей ICR (CLEA JAPAN, INC., 32-37 г, n=5) в возрасте 6 недель выдерживали в условиях голодания в течение 4 часов. Затем перорально вводили тестируемое соединение, растворенное в дистиллированной воде, в дозе 1 г/кг, после чего мышей наблюдали в течение 24 часов. Результаты представлены в следующей таблице 3.
| Таблица 3 |
| Тестируемое соединение |
Число погибших мышей |
| Пример 57 |
0/5 |
Промышленная применимость
Производные пиразола настоящего изобретения, представленные вышеуказанной общей формулой (I), их фармацевтически приемлемые соли и пролекарства обладают ингибирующей активностью, направленной против SGLT1 человека, и могут подавлять увеличение уровня глюкозы в крови путем ингибирования абсорбции углевода, такого как глюкоза, в тонком кишечнике, в частности, эти соединения могут нормализовать повышенные уровни глюкозы в крови после приема пищи посредством механизма замедления абсорбции углеводов. Поэтому настоящее изобретение позволяет получить превосходные средства для предупреждения или лечения заболевания, ассоциированного с гипергликемией, такого как диабет, нарушенная толерантность к глюкозе, осложнения диабета, ожирение или т.п. Кроме того, поскольку производные пиразола настоящего изобретения, представленные вышеуказанной общей формулой (II), и их соли имеют важное значение в качестве промежуточных соединений для получения производных пиразола, представленных вышеуказанной общей формулой (I), то с помощью указанных соединений могут быть легко получены соединения настоящего изобретения, представленные вышеуказанной общей формулой (I).
Формула изобретения
1. Производное пиразола, представленное общей формулой
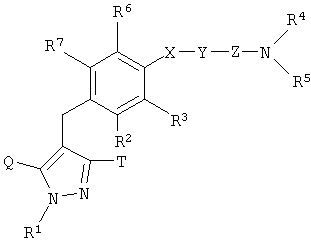
где R1 представляет собой атом водорода, гидрокси(С2-6)алкильную группу;
один из Q и Т представляет собой группу, представленную формулой
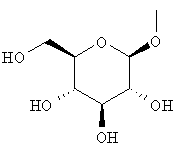
или группу, представленную формулой
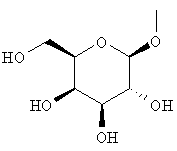
в то время как другой представляет собой С1-6алкильную группу;
R2 представляет собой атом водорода, атом галогена, С1-6алкильную группу или группу общей формулы: -A-R8, где А представляет собой атом кислорода и R8 представляет собой С6гетероциклоакильную группу, содержащую атом кислорода в качестве гетероатома;
X представляет собой простую связь или атом кислорода;
Y представляет собой C1-6алкиленовую группу или С2-6алкениленовую группу;
Z представляет собой карбонильную группу или сульфонильную группу;
R4 и R5 являются одинаковыми или различными, и каждый представляет собой атом водорода или С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранные из нижеследующей группы заместителей (i);
R3, R6 и R7 каждый представляет собой атом водорода; и
группа заместителей (i) состоит из:
гидроксигруппы;
аминогруппы;
моно- или ди(С1-6алкил)аминогруппы;
моно- или ди[гидрокси-(С1-6алкил)]аминогруппы;
сульфамидной группы;
С2-7ациламиногруппы;
группы общей формулы -CON(R9)R10, где R9 и R10 являются одинаковыми или различными, и каждый представляет собой атом водорода или С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранные из группы, состоящей из гидроксигруппы, аминогруппы, моно- или ди(С1-6алкил)аминогруппы и карбамоильной группы, либо R9 и R10 вместе связаны со смежным атомом азота с образованием 6-членной моноциклической аминогруппы с 4-мя атомами углерода, которая содержит в кольце один гетероатом, не являющийся атомом азота в положении связывания и выбранный из атома азота, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы;
арильной группы;
гетероарильной группы;
циклической С2-6аминогруппы; и
циклической ароматической С1-4аминогруппы,
или его фармацевтически приемлемая соль.
2. Производное пиразола по п.1, где Y представляет собой С1-6алкиленовую группу или С2-6алкениленовую группу; один из R4 и R5 представляет собой С1-6алкильную группу, которая имеет одинаковые или различные 1-3 заместителя, выбранные из нижеследующей группы заместителей (i), другой представляет собой атом водорода или С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 группы, выбранные из нижеследующей группы заместителей (i); и группа заместителей (i) состоит из:
гидроксигруппы;
аминогруппы;
моно- или ди(С1-6алкил)аминогруппы;
моно- или ди[гидрокси-(С1-6алкил)]аминогруппы;
сульфамидной группы; С2-7ациламиногруппы;
группы общей формулы -CON(R9)R10, где R9 и R10 являются одинаковыми или различными, и каждый представляет собой атом водорода или С1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранные из группы, состоящей из гидроксигруппы, аминогруппы, моно- или ди(С1-6алкил)аминогруппы и карбамоильной группы, либо R9 и R10 вместе связаны со смежным атомом азота с образованием 6-членной моноциклической аминогруппы с 4-мя атомами углерода, которая содержит в кольце один гетероатом, не являющийся атомом азота в положении связывания и выбранный из атома азота, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы;
арильной группы;
гетероарильной группы; циклической С2-6аминогруппы; и
циклической ароматической C1-4аминогруппы,
или его фармацевтически приемлемая соль.
3. Производное пиразола по п.2, где один из R4 и R5 представляет собой C1-6алкильную группу, которая имеет заместитель, выбранный из нижеследующей группы заместителей (iA), другой представляет собой атом водорода; и группа заместителей (iA) является группой общей формулы: -CON(R9A)R10A, где R9A и R10A вместе связаны со смежным атомом азота с образованием 6-членной моноциклической аминогруппы с 4-мя атомами углерода, которая содержит в кольце один гетероатом, не являющийся атомом азота в положении связывания и выбранный из атома азота, которая может иметь заместитель, выбранный из группы, состоящей из С1-6алкильной группы и гидрокси(С1-6)алкильной группы; или его фармацевтически приемлемая соль.
4. Производное пиразола по любому из пп.1-3, где X представляет собой простую связь, и Y представляет собой триметиленовую группу или 1-пропениленовую группу, или его фармацевтически приемлемая соль.
5. Производное пиразола по любому из пп.1-3, где X представляет собой атом кислорода, и Y представляет собой этиленовую группу или триметиленовую группу, или его фармацевтически приемлемая соль.
6. Производное пиразола по любому из пп.1-3, где R1 представляет собой атом водорода или гидрокси(С2-6)алкильную группу; Т означает группу, представленную формулой

или группу, представленную формулой

Q представляет собой С1-6алкильную группу, и R3, R6 и R7 представляют собой атом водорода; или его фармацевтически приемлемая соль.
7. Производное пиразола по любому из пп.1-3, где один из Q и Т означает группу, представленную формулой

и другой представляет собой С1-6алкильную группу, или его фармацевтически приемлемая соль.
8. Производное пиразола по п.6, где Т означает группу, представленную формулой

или его фармацевтически приемлемая соль.
9. Производное пиразола по п.7, где Т означает группу, представленную формулой

или его фармацевтически приемлемая соль.
10. Производное пиразола по п.6, где Q представляет собой изопропильную группу, или его фармацевтически приемлемая соль.
11. Производное пиразола по п.9, где Q представляет собой изопропильную группу, или его фармацевтически приемлемая соль.
12. Производное пиразола по п.1, которое представляет собой соединение, выбранное из следующей группы, включающей:
4-[(4-{3-[1-карбамоил-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-3-( -D-глюкопиранозилокси)-5-изопропил-1H-пиразол; -D-глюкопиранозилокси)-5-изопропил-1H-пиразол;
3-( -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол; -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[2-(диметиламино)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[2-(диметиламино)этилкарбамоил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол;
4-[(4-{3-[1-(2-аминоэтилкарбамоил)-1-(метил)этилкарбамоил]пропил}фенил)метил]-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил]фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил]фенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-изопропилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; и -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-изопропилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; и
их фармацевтически приемлемые соли.
13. Производное пиразола по п.1, которое представляет собой соединение, выбранное из следующей группы, включающей:
3-( -D-глюкопиранозилокси)-4-[(4-{3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]пропил} фенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]пропил} фенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{(1Е)-3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{(1Е)-3-[(S)-2-гидрокси-1-(метил)этилкарбамоил]проп-1-енил}фенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-ди(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{2-[2-гидрокси-1,1-ди(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол; -D-глюкопиранозилокси)-4-[(4-{2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]этокси}-2-метилфенил)метил]-5-изопропил-1H-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1H-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1H-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропокси}-2-метилфенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-галактопиранозилокси)-1-(3-гидроксипропил)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-1-(3-гидроксипропил)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол;
4-{[2-фтор-4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-1Н-пиразол;
4-{[2-хлор-4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-3-( -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол; и -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол; и
их фармацевтически приемлемые соли.
14. Производное пиразола по п.12, которое представляет собой соединение, выбранное из следующей группы, включающей:
3-( -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1H-пиразол; -D-галактопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}фенил)метил]-5-изопропил-1H-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{3-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]пропил}-2-метилфенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1H-пиразол; и -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-1H-пиразол; и
их фармацевтически приемлемые соли.
15. Производное пиразола по п.13, которое представляет собой соединение, выбранное из следующей группы, включающей:
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(4-метилпиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-4-[(4-{2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]этокси}-2-метил фенил)метил]-5-изопропил-1Н-пиразол; -D-глюкопиранозилокси)-4-[(4-{2-[1-{[4-(2-гидроксиэтил)пиперазин-1-ил]карбонил}-1-(метил)этилкарбамоил]этокси}-2-метил фенил)метил]-5-изопропил-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(2-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}этокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол; -D-глюкопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол;
3-( -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол; -D-галактопиранозилокси)-5-изопропил-4-{[4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропокси)-2-метилфенил]метил}-1Н-пиразол;
4-{[2-фтор-4-(3-{1-[(пиперазин-1-ил)карбонил]-1-(метил)этилкарбамоил}пропил)фенил]метил}-3-( -D-галактопиранозилокси)-5-изопропил-1Н-пиразол; и -D-галактопиранозилокси)-5-изопропил-1Н-пиразол; и
их фармацевтически приемлемые соли.
16. Фармацевтическая композиция, обладающая способностью ингибировать SGLT1 человека, содержащая в качестве активного ингредиента производное пиразола по п.1 или его фармацевтически приемлемую соль в эффективном количестве.
17. Ингибитор SGLT1 человека, содержащий в качестве активного ингредиента производное пиразола по п.1 или его фармацевтически приемлемую соль в эффективном количестве.
18. Средство для ингибирования гипергликемии после приема пищи, содержащее в качестве активного ингредиента производное пиразола по п.1 или его фармацевтически приемлемую соль в эффективном количестве.
19. Средство для предупреждения или лечения заболевания, ассоциированного с гипергликемией, содержащее в качестве активного ингредиента производное пиразола по п.1 или его фармацевтически приемлемую соль в эффективном количестве.
20. Средство для предупреждения или лечения заболевания по п.19, где указанным заболеванием, ассоциированным с гипергликемией, является заболевание, выбранное из группы, состоящей из диабета и нарушенной толерантности к глюкозе.
21. Средство для ингибирования прогрессирования нарушенной толерантности к глюкозе или для нормализации аномального содержания глюкозы в крови натощак, приводящих к диабету у индивидуума, содержащее в качестве активного ингредиента производное пиразола по п.1 или его фармацевтически приемлемую соль в эффективном количестве.
22. Средство для предупреждения или лечения заболевания, ассоциированного с увеличением уровня галактозы в крови, содержащее в качестве активного ингредиента производное пиразола по п.1 или его фармацевтически приемлемую соль в эффективном количестве.
23. Средство для предупреждения или лечения заболевания по п.23, где указанным заболеванием, ассоциированным с увеличением уровня галактозы в крови, является галактоземия.
24. Фармацевтическая композиция по п.16, где фармацевтическая композиция является композицией с пролонгированным высвобождением.
25. Средство по п.17, где средство является средством с пролонгированным высвобождением.
26. Применение производного пиразола по п.1 или его фармацевтически приемлемой соли для изготовления фармацевтической композиции для предупреждения или лечения заболевания, ассоциированного с гипергликемией.
27. Применение производного пиразола по п.1 или его фармацевтически приемлемой соли для изготовления фармацевтической композиции для ингибирования прогрессирования у индивидуума нарушенной толерантности к глюкозе, приводящей к диабету.
28. Производное пиразола, представленное общей формулой
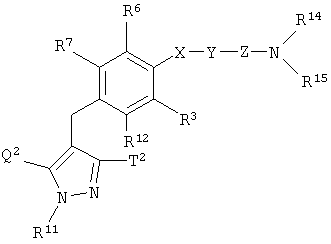
где R11 представляет собой атом водорода, гидрокси(С2-6)алкильную группу, которая может иметь защитную группу;
один из Q2 и Т2 представляет собой 2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилоксигруппу или 2,3,4,6-тетра-О-ацетил- -D-глюкопиранозилоксигруппу или 2,3,4,6-тетра-О-ацетил- -D-галактопиранозилоксигруппу, в то время как другой представляет собой С1-6алкильную группу; -D-галактопиранозилоксигруппу, в то время как другой представляет собой С1-6алкильную группу;
R12 представляет собой атом водорода, атом галогена, С1-6алкильную группу;
X представляет собой простую связь или атом кислорода;
Y представляет собой С1-6алкиленовую группу;
Z представляет собой карбонильную группу или сульфонильную группу;
R14 и R15 являются одинаковыми или различными, и каждый представляет собой атом водорода или C1-6алкильную группу, которая может иметь одинаковые или различные 1-3 заместителя, выбранные из нижеследующей группы заместителей (ii);
R3, R6 и R7 каждый представляет собой атом водорода; и
группа заместителей (ii) состоит из гидроксигруппы, группы общей формулы -CON(R19)R20, где R19 и R20 представляют собой атом водорода, или его фармацевтически приемлемая соль.
Приоритет по пунктам:
08.08.2002 по пп.1, 16-19, 26-28;
05.11.2002 по пп.12, 14, 24 и 25;
07.08.2003 по пп.2-11, 13, 15, 21 и 22.
|
|

 517
517 ,
,

 -глюкозидазы, которые замедляют гидролиз углеродов и их абсорбцию в тонком кишечнике. Сообщалось также, что акарбоза, один из ингибиторов
-глюкозидазы, которые замедляют гидролиз углеродов и их абсорбцию в тонком кишечнике. Сообщалось также, что акарбоза, один из ингибиторов 








 -D-глюкопиранозилокси)-5-изопропил-1Н-пиразол;
-D-глюкопиранозилокси)-5-изопропил-1Н-пиразол; -аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липид-пероксидазы, ингибитора дипептидазы N-ацетилированной-
-аминомасляной кислоты, антагониста натриевых каналов, ингибитора фактора транскрипции NF-kB, ингибитора липид-пероксидазы, ингибитора дипептидазы N-ацетилированной-
 С1-6алкильная группа
С1-6алкильная группа означает прямую или разветвленную алкильную группу, имеющую 1-6 атомов углерода, такую как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, неопентильная группа, трет-пентильная группа, гексильная группа или т.п.; термин
означает прямую или разветвленную алкильную группу, имеющую 1-6 атомов углерода, такую как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, пентильная группа, изопентильная группа, неопентильная группа, трет-пентильная группа, гексильная группа или т.п.; термин 










 м.д.: 1,15 (6H, с), 1,9 (2H, шир.с), 6,83 (1H, шир.с), 7,26 (1H, шир.с).
м.д.: 1,15 (6H, с), 1,9 (2H, шир.с), 6,83 (1H, шир.с), 7,26 (1H, шир.с). м.д.: 1,05-1,15 (6H, м), 1,75-1,9 (2H, м), 2,12 (2H, т, J=7,5 Гц), 2,51 (2H, т, J=7,7 Гц), 2,77 (2H, т, J=7,5 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (6H, м), 3,6-3,9 (4H, м), 5,0-5,15 (1H, м), 6,95-7,05 (2H, м), 7,05-7,3 (7H, м).
м.д.: 1,05-1,15 (6H, м), 1,75-1,9 (2H, м), 2,12 (2H, т, J=7,5 Гц), 2,51 (2H, т, J=7,7 Гц), 2,77 (2H, т, J=7,5 Гц), 2,8-2,95 (1H, м), 3,25-3,45 (6H, м), 3,6-3,9 (4H, м), 5,0-5,15 (1H, м), 6,95-7,05 (2H, м), 7,05-7,3 (7H, м).


