|
|
(21), (22) Заявка: 2006146793/15, 26.12.2006
(24) Дата начала отсчета срока действия патента:
26.12.2006
(43) Дата публикации заявки: 20.07.2008
(46) Опубликовано: 10.05.2009
(56) Список документов, цитированных в отчете о
поиске:
HANG J. et al., Microsomal epoxidehydrolase, endotixin and lung function decline in cotton textile worker, Am. J. Respir. Crit. Care Med., 2005, Jan 15, 171 (2), pp 165-170. SCHWAHN В. et al., Polimorphisms in the methilentetrahydrofolate reductase gene: clinical consequenses. Am. J. Pharmacogenomics, 2001, 1 (3), pp.189-20. THOMSON MD et al.,Whole genome amplification of buccal cell DNA: genoty concordance before and after multiple displacement amplification, Clin. Chem. Lab. Med., 2005, 43 (2), pp.157-162. FALCHI A. et al., Prevalence of genetic risk factors for coronary artery disease in Corsica island (France), Exp. Mol. Pathol., 2005 Dec 79(3), pp.210-213.
Адрес для переписки:
630091, г.Новосибирск, Красный пр-кт, 52, НГМУ, патентоведу С.Н. Никаноровой
|
(72) Автор(ы):
Песков Сергей Александрович (RU),
Масленников Аркадий Борисович (RU),
Ефремов Анатолий Васильевич (RU),
Потеряева Елена Леонидовна (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования Новосибирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию (ГОУ ВПО НГМУ Росздрава) (RU)
|
(54) СПОСОБ ОБНАРУЖЕНИЯ ИНДИВИДУАЛЬНОЙ ПРЕДРАСПОЛОЖЕННОСТИ К РАЗВИТИЮ ВИСЦЕРОПАТИЙ У РАБОЧИХ ПЫЛЕОПАСНЫХ ПРОФЕССИЙ
(57) Реферат:
Изобретение относится к области медицины, в частности к медицине труда и профпатологии, конкретнее к средствам обнаружения у рабочих пылеопасных профессий предрасположенности к развитию висцеропатий.
Сущность предлагаемого способа обнаружения индивидуальной предрасположенности к развитию хронической пылевой патологии у рабочих пылеопасных профессий заключается в том, что у обследуемого в клетках буккального эпителия определяют наличие мутаций в гене метилентетрагидрофолатредуктазы (MTHFR) и при обнаружении генотипа 677Т/677Т гена MTHFR делают вывод о предрасположенности обследуемого к развитию профессиональных заболеваний бронхолегочной системы, а при обнаружении генотипа 677С/677С гена MTHFR делают вывод об отсутствии такой предрасположенности. Преимущество изобретения заключается в повышении чувствительности способа. 1 з.п. ф-лы, 4 табл., 1 ил.
Изобретение относится к области медицины, в частности к медицине труда и профпатологии, конкретнее к средствам обнаружения у рабочих кадров предрасположенности к развитию висцеропатий от техногенного воздействия промышленных пылевых аэрозолей при проведении периодических медицинских осмотров и при углубленном обследовании.
Известен способ оценки риска ущерба здоровью, связанного с профессиональной деятельностью (RU 2189589). Способ заключается в том, что проводят оценку условий труда и комплексную оценку состояния здоровья работающих, рассчитывают относительный риск и этиологическую долю вклада производственных факторов в развитие патологии и при значениях относительного риска до 1,4 и этиологической доле менее 33% заболевания оценивают как общие заболевания, при относительном риске от 1,5 до 5 и этиологической доле 33-80% оценивают как производственно обусловленные заболевания, а при относительном риске выше 5 и этиологической доле 81-100% – как профессиональные заболевания. Однако данный способ устанавливает лишь факт ухудшения общего состояния здоровья рабочих, подвергающихся техногенной пылевой экспозиции, но не обеспечивает установления факта индивидуальной предрасположенности работника к развитию производственно обусловленных висцеропатий (ПОВ) – профессиональных заболеваний (ПЗ), в том числе в ассоциации с общесоматическими заболеваниями.
Известен способ количественной оценки риска развития профессионального хронического бронхита (RU2174367), при котором используют особенности фенотипических проявлений – дерматоглифические данные дистальных фаланг кистей. Риск оценивают при помощи дополнительных данных о стаже работы в контакте с пылью или раздражающими дыхательные пути веществами, о половой принадлежности, о курении. Индивидуальный риск рассчитывают по формуле ИР=ОРпол·ОРстаж·ОРкур·ОРдерм, где ОРпол, ОРстаж, ОРкур и ОРдерм – величины относительного риска в зависимости соответственно от пола обследуемого, от стажа работы в контакте с пневмотропными поллютантами, от курения и от фенотипически обусловленных дерматоглифических признаков, которые оценивают в соответствии с приведенными в описании изобретения критериями. Величину индивидуального риска менее 0,1 оценивают как крайне низкую, 0,4-2,5 как низкую, 2,6-10 как высокую, более 10 как крайне высокую. Величина индивидуального риска позволяет лишь предположить меньшую или большую вероятность профессионального хронического бронхита. Данный способ не позволяет установить наличие или отсутствие индивидуальной предрасположенности рабочего пылеопасной профессии к ПОВ.
Благодаря исследованиям генома человека, в том числе генов, мутации которых приводят к наследственным болезням либо предрасполагают к заболеваниям, имеется реальная возможность проводить определение предрасположенности человека к тому или иному заболеванию.
Известен способ обнаружения предрасположенности к кардиоваскулярному заболеванию (RU 2004123610). Данный способ основан на анализе генотипа, но имеет другое назначение.
Раскрытие изобретения
Сущность предлагаемого способа обнаружения индивидуальной предрасположенности к развитию висцеропатий у рабочих пылеопасных профессий заключается в том, что у обследуемого в клетках буккального эпителия определяют наличие мутаций в гене метилентетрагидрофолатредуктазы (MTHFR) и при обнаружении генотипа 677Т/677Т гена MTHFR делают вывод о предрасположенности рабочего к развитию висцеропатий, а при обнаружении генотипа 677С/677С гена MTHFR делают вывод об отсутствии предрасположенности у обследуемого к развитию висцеропатий.
В основу работы положено представление о том, что распространенные генетические варианты, существующие в генеральной популяции с частотой более 1%, могут участвовать в развитии заболеваний человека и патологических состояний, вносить значимый вклад в индивидуальную чувствительность к воздействию факторов внешней среды. Ген MTHFR выбран на основании имеющихся данных о его ключевой роли в регуляции обменных процессов, участии в патогенезе эндотелиальной дисфункции и полиорганной патологии. Роль полиморфизмов данного гена в развитии производственно обусловленных висцеропатий у рабочих пылеопасных профессий ранее не была изучена.
Иллюстративный материал
На чертеже даны результаты молекулярно-генетической детекции аллелей 677С и 677Т в структуре экзона 4 гена MTHFR (сканограмма гельэлектрофореза в 10% ПААГ продуктов рестрикции эндонуклеазой HinfI специфичных амплификатов).
Обоснование способа
Характеристика групп рабочих, обследованных молекулярно-генетическими методами
Проведено обследование 201 мужчины – рабочих пылеопасных профессий, которые при прохождении периодического медицинского осмотра (ПМО) дали добровольное согласие на прохождение генетического тестирования. Все обследованные пациенты не являлись кровными родственниками, на момент прохождения ПМО продолжали работать в условиях контакта с пылевыми промышленными аэрозолями. Средний возраст обследованных составил 49,04±4,55 лет. Среди рабочих 114 человек не имели производственно обусловленной профессиональной хронической пылевой патологии легких (ХППЛ) (они были выделены в первую группу), а у 87 человек ранее был уставлен диагноз профессиональной хронической пылевой патологии легких (они были выделены во вторую группу).
Диагностика общесоматической патологии проводилась по критериям ВОЗ и МКБ-10 (Международная классификация болезней 10-го пересмотра).
Первая группа обследованных была отобрана из рабочих предприятий ОАО «Новосибирскэнерго», проходивших очередной периодический медицинский осмотр (ПМО). Критерии включения пациентов в исследование (для сопоставимости их по полу, возрасту и стажу работы с пациентами второй и контрольной групп) были следующими: средний возраст 47,82±5,09 лет; стаж работы в контакте с пылевым аэрозолем не менее 1 года (средний стаж 15,67±7,51); отсутствие профессиональных ХППЛ. Критерии исключения пациентов из исследования были следующими: наличие клинических и других проявлений обострения или декомпенсации имеющейся хронической соматической патологии, а также наличие профессиональных ХППЛ; наличие острых воспалительных заболеваний на момент госпитализации.
 1. – С.21-25; Приказ Росздрава 83 от 16.08.04 г. «Об утверждении перечней вредных и (или) опасных производственных факторов и работ, при выполнении которых проводятся предварительные и периодические медицинские осмотры (обследования), и порядка проведения этих осмотров (обследований)»). Средний возраст пациентов данной группы – 50,06±3,65 лет; средний стаж пылевого воздействия (СПВ) 12,7±2,86. Критерии включения пациентов с профессиональной ХППЛ в обследование были следующими: продолжение работы в условиях пылевого воздействия на момент обследования; наличие клинических и рентгенологических проявлений хронической пылевой патологии и положительное решение профпатологической экспертной комиссии о профессиональном характере хронической патологии легких (силикоз и антракосиликоз, пневмокониоз электросварщика, пылевой обструктивный и необструктивный бронхит). Критерии исключения пациентов из обследования были следующими: наличие выраженных осложнений профессиональной ХППЛ (дыхательной недостаточности, хронического легочного сердца и сердечной недостаточности); наличие сопутствующей тяжелой хронической соматической патологии с функциональными нарушениями и в стадии декомпенсации, а также сахарного диабета, ожирения, системных и аутоиммунных заболеваний на момент госпитализации. 1. – С.21-25; Приказ Росздрава 83 от 16.08.04 г. «Об утверждении перечней вредных и (или) опасных производственных факторов и работ, при выполнении которых проводятся предварительные и периодические медицинские осмотры (обследования), и порядка проведения этих осмотров (обследований)»). Средний возраст пациентов данной группы – 50,06±3,65 лет; средний стаж пылевого воздействия (СПВ) 12,7±2,86. Критерии включения пациентов с профессиональной ХППЛ в обследование были следующими: продолжение работы в условиях пылевого воздействия на момент обследования; наличие клинических и рентгенологических проявлений хронической пылевой патологии и положительное решение профпатологической экспертной комиссии о профессиональном характере хронической патологии легких (силикоз и антракосиликоз, пневмокониоз электросварщика, пылевой обструктивный и необструктивный бронхит). Критерии исключения пациентов из обследования были следующими: наличие выраженных осложнений профессиональной ХППЛ (дыхательной недостаточности, хронического легочного сердца и сердечной недостаточности); наличие сопутствующей тяжелой хронической соматической патологии с функциональными нарушениями и в стадии декомпенсации, а также сахарного диабета, ожирения, системных и аутоиммунных заболеваний на момент госпитализации.
Генотипирование мутаций в локусах генов MTHFR
Для выделения геномной ДНК используют клетки буккального эпителия, полученные во время ПМО или при углубленном обследовании методом соскоба со слизистой внутренней поверхности щеки обследуемых лиц. Клетки буккального эпителия забирают в специальные контейнеры (Greiner, ФРГ), содержащие стерильный 0,9М раствор NaCl, замораживают при -20°С и хранят до выделения ДНК. Выделение геномной ДНК, пригодной для проведения полимеразной цепной реакции (ПЦР), проводится с использованием набора InstaGene Matrix (Bio-Rad Laboratories, США) согласно протоколу фирмы производителя.
Методом ПЦР (Дейвис К. Анализ генома: Методы. – М.: Мир, 1990. – 247 с.; Херрингтон С., Макги Д. Молекулярная клиническая диагностика: методы. – М.: Мир, 1999. – 558 с., ил.; Erlich H.A. PCR-Technology. – Perkin-Elmer Cetus, 1993. – 247 р.) с использованием олигонуклеотидных праймеров (праймеры синтезированы фирмой ARK Scientific GmbH Biosystems, ФРГ, с классом очистки “PCR-grade”) амплифицируется фрагмент гена MTHFR с известной нуклеотидной последовательностью, содержащий анализируемую мутацию и полиморфизм (табл.1).
Полимеразная цепная реакция проводится в объеме 20 мкл реакционной смеси (67 мМ Трис-HCl рН 8,8 (при +20°С), 16,6 мМ сульфата аммония, 1,5 мМ хлористого магния, 0,01% Твин-20), содержащей 0,2 мМ каждого дезоксинуклеотидтрифосфата, 2,5 пкМ каждого праймера, 150-200 нг геномной ДНК и 1 ед. термофильной TaqSE ДНКполимеразы (производства ООО «Си-бЭнзим», Россия). Для ПЦР используются программируемые термоциклеры БИС М-108 (Россия) и режим термоциклирования, указанный в табл.1. С целью исключения неспецифичного синтеза в каждой серии экспериментов используется система «нулевых» и «положительных» контролей.
Специфичность продуктов ПЦР, их качество и полученное количество оценивается с помощью электрофореза амплификатов в ТАЕ-буфере в 3% агарозных гелях или в ТВЕ-буфере в 10% полиакриламидных гелях (Остерман Л.А. Методы исследования белков и нуклеиновых кислот: Электрофорез и ультрацентрифугирование белков и нуклеиновых кислот (практическое пособие). – М.: Наука, 1981. – 288 с.; Sambrock J., Russell D.W. Molecular Cloning: A laboratory Manual / 3rd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 2001).
Визуализацию результатов проводят на компьютерной системе UV-GelDoc1000 (Bio-Rad Laboratories, США) после окрашивания гелей в водном растворе бромистого этидия (0,5 мкг/мл).
Для идентификации аллелей 677С и 677Т в структуре четвертого экзона гена MTHFR используется методология анализа полиморфизма длин рестрикционных фрагментов продуктов ПЦР (Дейвис К. Анализ генома: Методы. – М.: Мир, 1990. – 247 с.; Херрингтон С., Макги Д. Молекулярная клиническая диагностика: методы. – М.: Мир, 1999. – 558 с., ил.), поскольку анализируемые нуклеотидные замены приводят к изменению сайтов эндонуклеаз HinfI и MnlI соответственно и изменяют картину электрофореза продуктов гидролиза ферментами продуктов ПЦР (см. чертеж).
Гидролиз продуктов полимеразной цепной реакции MTHFR, содержащих полиморфные сайты для соответствующих эндонуклеаз, осуществляется специфичными ферментами эндонуклеазами в температурных условиях, рекомендованных фирмой-производителем (ООО «СибЭнзим», Россия). Так как используемый при проведении ПЦР состав буфера существенно не влияет на эффективность и специфичность гидролиза ДНК, дополнительной очистки продуктов амплификации не проводят. При этом для рестрикции используется не более 5 мкл реакционной ПЦР смеси, содержащей специфичный амплификат. Общий объем рестрикционной смеси, содержащей однократный рекомендованный буферный раствор (поставляется с каждой эндонуклеазой), амплификат и двухкратный избыток расчетного количества фермента, составляет 20 мкл. Время рестрикции составляет 16 часов. Для типирования аллелей 10 мкл реакционной смеси анализируют методом электрофореза в ТВЕ-буфере в 10% полиакриламидных гелях (Bio-Rad Laboratories, США) с использованием лидирующих маркерных красителей и маркера молекулярного веса ДНК (pUC19/MspI).
Визуализация и профильный анализ результатов электрофореза выполняются на системе UV-GelDoc1000 (Bio-Rad Laboratories, США) после окрашивания гелей в водном растворе бромистого этидия (0,5 мкг/мл). Полнота и специфичность гидролиза эндонуклеазами продуктов ПЦР оценивается в каждой серии экспериментов по контрольным образцам, заведомо содержащим мутацию в гетеро- и гомозиготной форме.
Методика статистического анализа результатов исследования
Для обработки цифровых результатов исследований применяли методы вариационной статистики с расчетом средних величин (М) и доверительных интервалов (±m).
На первом этапе проводилось определение достоверности нормальности распределения с использованием критериев Колмогорова-Смирнова и Лилиефорса. При определении критерия оценки достоверности различий между двумя выборками учитывали количество и профиль распределения вариант внутри каждой выборки. При нормальном распределении использовали t-критерий Стьюдента. Достоверными считали различия при р<0,05; вероятность различий составляла 95% и более. Если распределение достоверно отличалось от нормального, использовался непараметрический критерий  2. Для определения степени взаимосвязи изучаемых параметров проводился корреляционный анализ (Гланц С. Медико-биологическая статистика / С.Гланц; пер. с англ. – М.: Практика, 1999. – 460 с.; Медик В.А. Статистика в медицине и биологии: в 2 т. Т.1. Теоретическая статистика: руководство / В.А.Медик, М.С.Токмачев, Б.Б.Фишман. – М.: Медицина, 2000. – 456 с.). 2. Для определения степени взаимосвязи изучаемых параметров проводился корреляционный анализ (Гланц С. Медико-биологическая статистика / С.Гланц; пер. с англ. – М.: Практика, 1999. – 460 с.; Медик В.А. Статистика в медицине и биологии: в 2 т. Т.1. Теоретическая статистика: руководство / В.А.Медик, М.С.Токмачев, Б.Б.Фишман. – М.: Медицина, 2000. – 456 с.).
Генетико-статистические методы анализа результатов
Соответствие распределения аллелей и генотипов равновесию Харди-Вайнберга проверяли по критерию  2 (Животовский Л.А. Популяционная биометрия / Л.А.Животовский. – М.: Наука, 1991. – 270 с.): 2 (Животовский Л.А. Популяционная биометрия / Л.А.Животовский. – М.: Наука, 1991. – 270 с.):
 2= 2= (Nf-Nt)2/Nf (Nf-Nt)2/Nf
где Nt – теоретически ожидаемая численность генотипов, Nf – фактическая численность генотипов.
Наблюдаемая гетерозиготность вычислялась по формуле:
Ho=No/N,
где Nо – общее количество всех гетерозигот в выборке, а N – объем обследованной выборки.
Для сравнения частот аллелей в различных группах проводили попарное сравнение показателей с использованием критерия:
 2=N1N2(p1-p2)2/Np(1-p), 2=N1N2(p1-p2)2/Np(1-p),
где р=(p1N1+p2N2)/N – средневзвешенная частота аллеля, N1 и N2 – численность аллелей в сравниваемых группах, p1 и р2 – частоты аллелей в этих же группах.
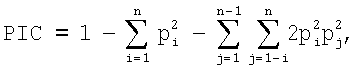
где pi – частота первого аллеля, pj – частота второго аллеля, a n – число вариантов.
Генетический маркер, имеющий PIC=0,5, считается высокоинформативным для анализа генома; если 0,25
Оценку различия частот генотипов и аллелей между разными группами осуществляли по критерию  2 с поправкой Йетса на непрерывность или по точному тесту Фишера при объеме выборки менее 5. Наличие или отсутствие ассоциации аллельных вариантов или генотипов полиморфных генетических маркеров с заболеванием тестировали по критерию 2 с поправкой Йетса на непрерывность или по точному тесту Фишера при объеме выборки менее 5. Наличие или отсутствие ассоциации аллельных вариантов или генотипов полиморфных генетических маркеров с заболеванием тестировали по критерию  2 и коэффициенту ассоциативной связи (Минцер О.П. Методы обработки медицинской информации / О.П.Минцер, Б.Н.Угаров, В.В.Власов. – Киев: Вiща школа, 1982. – 198 с.). 2 и коэффициенту ассоциативной связи (Минцер О.П. Методы обработки медицинской информации / О.П.Минцер, Б.Н.Угаров, В.В.Власов. – Киев: Вiща школа, 1982. – 198 с.).
Для вычисления и сравнения средних величин цифровых данных, а также для оценки достоверности полученных результатов пользовались общепринятыми формулами вариационной статистики. Для выяснения характера внутренних взаимоотношений и оценки генетического полиморфизма использовали методы корреляционного и однофакторного дисперсионного анализа (Лакин Г.Ф. Биометрия / Г.Ф.Лакин. – M.: Высш. школа, 1973. – 343 с.; Животовский Л.А. Популяционная биометрия / Л.А.Животовский. – M.: Наука, 1991. – 270 с.). Достоверность коэффициентов корреляций оценивали по специальной таблице, в которой приведены критические значения коэффициента корреляций с 95 и 99% доверительными границами для различного числа наблюдений.
Для всех статистических тестов в качестве критерия статистической достоверности рассматривался уровень значимости более 95%. Большая часть статистического анализа выполнена с использованием пакета программ Microsoft Excel и Statistica 6,0.
Исследование особенностей распределения аллельных вариантов гена MTHFR у рабочих пылеопасных профессий без ХППЛ и у рабочих с ХППЛ.
При проведенной статистической оценке соответствия распределения частот генотипов равновесию Харди-Вайнберга как в группе рабочих пылеопасных профессий, так и в группе больных с ХППЛ профессиональной этиологии (хотя это селективные выборки) существенных отклонений от равновесия не выявлено (р>0,05). Наблюдаемая гетерозиготность исследованного генетического маркера в сравниваемых группах существенно не различалась, как и показатель PIC, свидетельствующий о достаточно высокой его информативности для популяционных исследований.
В первой группе рабочих (без профессиональной ХППЛ) редким аллелем оказался 677Т (частота 0,382), а редким генотипом – 677Т/677Т (0,132).
Во второй группе рабочих (с профессиональной ХППЛ) редким аллелем, наоборот, оказался аллель 677С (частота 0,391), а редким генотипом 677С/677С (частота 0,103). Выявлено высоко достоверное различие по частотам данных аллелей и гомозиготных генотипов в двух исследованных группах (табл.2). Какой-либо существенной разницы по частотам гетерозиготных генотипов 677С/677Т не обнаружено.
Для представителей обследованных групп характерны однотипные условия труда и профессиональная пылевая экспозиция. Однако при пролонгированном воздействии на организм такого мощного стресс-фактора как пыль у рабочих из первой группы (средний СПВ – 15,67±7,51 лет, который достоверно выше, чем у больных профессиональной ХППЛ, р<0,001), несмотря на постепенное развитие различных висцеропатий (фиксирующихся при ежегодных ПМО), все же, в отличие от рабочих из второй группы, не развился симптомокомплекс, характерный для профессиональной ХППЛ.
Поскольку аллель 677Т и генотип 677Т/677Т, видимо, ассоциированы с повышенной предрасположенностью к развитию ХППЛ профессиональной этиологии, был проведен анализ особенностей распределения аллелей и генотипов во второй группе рабочих в зависимости от срока формирования специфичного симптомокомплекса и установления диагноза профессиональной ХППЛ. Учитывая средний стаж контакта рабочих с пылевым фактором до установления диагноза профессионального заболевания, который составил 12,7±2,86 лет, группа больных с профессиональной ХППЛ была разбита на две подгруппы – со стажем до развития профессиональной ХППЛ менее 13 лет (первая подгруппа) и со стажем до развития профессиональной ХППЛ 13 лет и более (вторая подгруппа). Результаты анализа этих подгрупп представлены в табл.3.
В подгруппах обследованных зафиксированы существенные значимые различия в особенностях частотного распределения аллелей и генотипов в зависимости от стажа работы во вредных условиях труда. Более раннее развитие профессиональной ХППЛ ассоциировано с носительством аллеля 677Т и наличием гомозиготного генотипа 677Т/677Т. При стаже пылевой экспозиции до развития профессиональной ХППЛ менее 13 лет ни у одного из обследованных больных генотип 677С/677С не был обнаружен. В то время как среди больных с поздним формированием ПЗ частота этого генотипа оказалась равной 0,22. Для них характерным оказалось преобладание аллеля 677С (с приближением к значению в группе рабочих без профессиональной ХППЛ), значительное увеличение представительства гетерозиготного генотипа 677С/677Т на фоне достоверного (по сравнению с подгруппой больных с ранним началом ХППЛ) снижения суммарной частоты гомозиготных генотипов за счет, прежде всего, неблагоприятного генотипа 677Т/677Т.
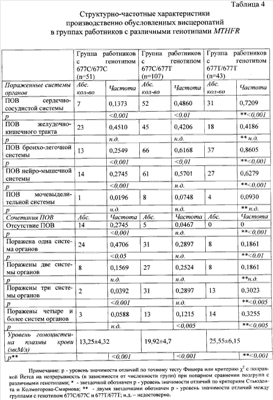
Для носителей гомозиготного генотипа 677С/677С гена MTHFR оказались характерными: наименьшая частота и степень поражения сердечно-сосудистой, бронхолегочной и нейромышечной систем, наименьшая частота сочетанных нозологических форм ПОВ (47,06% имели изолированную висцеропатию и 27,45% не имели ее совсем), наименьшие показатели уровня гомоцистеина плазмы крови. Полной противоположностью оказались носители другого гомозиготного генотипа 677Т/677Т, у которых (на фоне достоверно более высокого уровня гомоцистеина плазмы крови) достоверно преобладали ПОВ основных органов и систем (кроме висцеропатий желудочно-кишечного тракта, где различие недостоверно), носившие наиболее тяжелый и сочетанный характер – поражение трех и более систем отмечено у 62,78%. Среди сравниваемых групп по структурно-частотным характеристикам ПОВ и уровню гомоцистеина носители гетерозиготного генотипа 677С/677Т занимали промежуточное положение, однако, все же приближались по показателям к группе пациентов с генотипом 677Т/677Т.
Учитывая имеющиеся достоверные структурно-частотные характеристики, для определения степени сопряженности, направления и формы существующих взаимосвязей между носительством различных аллелей и генотипов MTHFR, качественными и количественными признаками, характеризующими группы работников, был проведен корреляционный анализ.
В результате проведенного анализа была установлена протективность носительства аллеля 677С гена MTHFR по отношению к срокам формирования патологического фенотипа производственно обусловленных висцеропатий, степени его выраженности и тяжести клинических проявлений. Особенно это значимо проявляется у носителей генотипа 677С/677С, у которых выявлена ассоциация с наиболее поздним сроком развития ПОВ от начала контакта с пылевым производственным фактором (r=0,136, р<0,05), не характерно развитие полиорганных сочетанных ПОВ (r=-0,425, р<0,001) и гипергомоцистеинемических состояний (r=-0,491, р<0,001), имеется корреляция с меньшей степенью выраженности клинических проявлений (r=0,445, р<0,001) и меньшей скоростью прогрессирования ПОВ (r=0,473, р<0,001).
Обратная картина ассоциативных связей между анализируемыми признаками была характерна для носителей аллеля 677Т. Наиболее неблагоприятная ситуация в плане предрасположенности к развитию ПОВ выявлена у носителей генотипа 677Т/677Т гена MTHFR. Именно его наличие у работников пылеопасных профессий ассоциировано с наиболее ранними сроками манифестации (r=0,221, р<0,001), сочетанными поливисцеропатиями (r=0,293, р<0,001), с наиболее выраженными клиническими проявлениями (r=0,289, р<0,001) и скоростью прогрессирования патологического процесса (r=0,326, p<0,001), с наибольшими величинами уровня гомоцистеина плазмы крови (r=0,405, р<0,001). В отличие от носительства аллеля 677С и генотипа 677С/677С гена MTHFR, носительство генотипа 677Т/677Т ассоциировано с предрасположенностью к поражению бронхолегочной (r=0,299, р<0,001), сердечно-сосудистой (r=0,287, р<0,001) и нейромышечной (r=0,139, р<0,05) систем. Величины всех полученных коэффициентов достоверных ассоциациативных связей указывают на среднюю степень силы их выраженности.
Диагностическая чувствительность (ДЧ) предлагаемого способа была рассчитана по формуле:
ДЧ=А:(А+В),
где А – количество рабочих с профессиональной ХППЛ и гомозиготным генотипом 677Т/677Т;
В – количество рабочих без профессиональной ХППЛ и с гомозиготным генотипом 677С/677С. Чувствительность предлагаемого способа составила 76%.
Диагностическая специфичность (ДС) предлагаемого способа была рассчитана по формуле:
ДС=В:(А+В).
Диагностическая специфичность способа составила 74%.
В качестве иллюстрации приводим наши наблюдения.
Наблюдение 1. Больной Ч., 55 лет, поступил в специализированное отделение профпатологии на углубленное обследование с диагнозом силикоз II, интерстициально-гранулематозный вариант, пылевой обструктивный бронхит (заболевания профессиональные), сопутствующая патология: ишемическая болезнь сердца, стенокардия напряжения, постинфарктный кардиосклероз (острый инфаркт миокарда перенес в 45 лет), варикозная болезнь нижних конечностей. Диагноз профессиональной ХППЛ был установлен после 13 лет пылевой производственной экспозиции (в 43 года). За прошедший промежуток времени неоднократно находился на стационарном обследовании и лечении. При лабораторном исследовании обнаружена умеренная гипергомоцистеинемия (78 мкМ/л). При молекулярно-генетическом тестировании больного обнаружено носительство аллеля 677Т гена MTHFR (гомозиготный генотип 677Т/677Т) (см. чертеж), что свидетельствовало о вкладе этого генетического фактора в развитие и прогрессирование индивидуального патологического клинического фенотипа пациента.
С учетом клинической картины и данных обследования рабочего пылеопасной профессии при углубленном обследовании обнаружена индивидуальная предрасположенность к развитию и прогрессированию имеющихся поливисцеропатий. Пациенту даны категоричные рекомендации по изменению условий труда и рациональному трудоустройству (противопоказан контакт с производственным пылевым фактором, промышленными аэрозолями) и разработана персонифицированная программа индивидуальных лечебно-профилактических мероприятий.
Наблюдение 2. Рабочий Н., 42 года, стаж пылевого воздействия 10 лет. В результате ПМО выявлен хронический обструктивный бронхит (заболевание не профессиональное). Данные лабораторного обследования: умеренная гомоцистеинемия (25,5 мкМ/л). В результате молекулярно-генетического тестирования установлено носительство аллеля 677Т гена MTHFR (выявлен гомозиготный генотип 677Т/677Т) (см. чертеж).
С учетом клинической картины и лабораторных данных обследования рабочего пылеопасной профессии при ПМО обнаружена индивидуальная предрасположенность к развитию и прогрессированию висцеропатий и поливисцеропатий (к развитию профессиональной ХППЛ, сердечно-сосудистой, нейромышечной патологии и прогрессированию имеющегося хронического обструктивного бронхита). Рабочему даны категоричные рекомендации по изменению условий труда и рациональному трудоустройству (без контакта с пылевым фактором, промышленными аэрозолями), разработана программа индивидуальных лечебно-профилактических мероприятий.
Наблюдение 3. Рабочий М., 38 лет, стаж пылевого воздействия 5 лет. При лабораторном обследовании (в условиях ПМО) установлены показатели гомоцистеина в сыворотке крови в пределах нормальных физиологических значений (менее 10,0 мкМ/л). В результате молекулярно-генетического тестирования установлено носительство аллеля 677С гена MTHFR (имелся гомозиготный генотип 677С/677С) (см. чертеж).
С учетом лабораторных данных обследования рабочего пылеопасной профессии не обнаружена индивидуальная предрасположенность к развитию висцеропатий и полипатий. Рабочий трудоспособен в своей профессии и отнесен в группу динамического наблюдения «условно здоровые».
| Таблица 1 |
| Характеристика амплифицированных участков генов, последовательность олигонуклеотидных праймеров, режим термоциклирования |
| Ген |
Зона ПЦР |
Нуклеотидная структура использованных праймеров |
Режим термоциклирования |
| MTHFR |
Четвертый экзон
(фрагмент 198 п.н.) |
5′-TGAAGGAGAAGGTGTCTGCGGGA-3′
5′-AGGACGGTGCGGTGAGAGTG-3′ |
Начальная денатурация: 94°С 4 мин; 33 цикла: денатурация – 0.8 мин при 94°С, отжиг – 0,8 мин при 58°С, синтез – 0,8 мин при 72°С; элонгация: 5 мин при 72°С. |
| Таблица 2 |
| Характеристика частотного распределения генотипов и аллелей гена MTHFR в обследованных группах |
 |
Группа рабочих пылеопасных профессий без ХППЛ(1 группа) (n=114) |
Группа рабочих пылеопасных профессий с ХППЛ профессиональной этиологии (2 группа) (n=87) |
 2 (d.f.=1) 2 (d.f.=1) |
p |
| Генотипы |
Абс. кол-во |
Частота |
Абс. кол-во |
Частота |
 |
 |
| 677С/677С |
42 |
0,368 |
9 |
0,103 |
18,321 |
<0,001 |
| 677С/677Т |
57 |
0,5 |
50 |
0,575 |
1,115 |
>0,05 |
| 677Т/677Т |
15 |
0,132 |
28 |
0,322 |
10,581 |
0,01 |
| Аллели |
 |
 |
 |
 |
 |
 |
| 677С |
141 |
0,618 |
68 |
0,391 |
20,373 |
<0,001 |
| 677Т |
87 |
0,382 |
106 |
0,609 |
| Н |
0,500 |
0,575 |
 |
 |
| PIC |
0,360 |
0,363 |
 |
 |
| Таблица 3 |
| Распределение генотипов и аллелей гена MTHFR в подгруппах второй группы рабочих в зависимости от стажа пылевой экспозиции до развития ХППЛ профессиональной этиологии |
 |
2 группа (полностью и с разбивкой по СПВ до развития ХППЛ) |
| Анализируемые группы и подгруппы |
Все рабочие 2-й группы (n=87) |
Рабочие со стажем менее 13 лет (n=46) |
Рабочие со стажем 13 лет и более (n=41) |
 |
 |
| Стаж ПВ до развития ХППЛ |
12,7±2,86 |
10±1,13 |
15,73±2,2 |
 |
<0,001 |
| Генотипы |
Абс. кол-во |
Частота |
Абс. кол-во |
Частота |
Абс. кол-во |
Частота |
 2 (d.f.=1) 2 (d.f.=1) |
p |
| 677С/677С |
9 |
0,103 |
0 |
0 |
9 |
0,220 |
11,291 |
<0,001 |
| 677С/677Т |
50 |
0,575 |
19 |
0,413 |
31 |
0,756 |
10,434 |
<0,01 |
| 677Т/677Т |
28 |
0,322 |
27 |
0,587 |
1 |
0,024 |
31,491 |
<0,001 |
| Аллели |
 |
 |
 |
 |
 |
 |
 |
 |
| 677С |
68 |
0,391 |
19 |
0,206 |
49 |
0,597 |
27,855 |
<0,001 |
| 677Т |
106 |
0,609 |
73 |
0,794 |
33 |
0,403 |
| Н |
0,575 |
0,413 |
0,756 |
11,142 |
<0,001 |
Формула изобретения
1. Способ обнаружения индивидуальной предрасположенности к развитию хронической пылевой патологии у рабочих пылеопасных профессий, включающий генетическое обследование пациента, отличающийся тем, что выявляют предрасположенность к профессиональным заболеваниям бронхолегочной системы у рабочих, контактирующих с пылевыми промышленными аэрозолями, посредством определения в клетках буккального эпителия наличия мутации в гене MTHFR и при обнаружении генотипа 677Т/677Т делают вывод о предрасположенности обследуемого к развитию профессиональных заболеваний бронхолегочной системы, а при обнаружении генотипа 677С/677С делают вывод об отсутствии такой предрасположенности.
2. Способ по п.1, отличающийся тем, что профессиональные заболевания дыхательной системы включают следующие: силикоз, антрасиликоз, пневмокониоз электросварщика, пылевой обструктивный бронхит, пылевой необструктивный бронхит.
РИСУНКИ
|
|