|
|
(21), (22) Заявка: 2007121930/02, 14.06.2007
(24) Дата начала отсчета срока действия патента:
14.06.2007
(46) Опубликовано: 20.04.2009
(56) Список документов, цитированных в отчете о
поиске:
ПОЛЬКИН С.И. и др. Технология бактериального выщелачивания цветных и редких металлов. – М.: Недра, 1982. Barbosa О., Montemius A., Precions Metals, 89: Proc. Jnt. Symp.TMS Ann. Mut.. Las Vegas. Nov. Febr. 27 – March.2, 1989. – Warrendale (Pa), 1989. RU 2033444 C1, 20.04.1992. RU 2275436 C2, 27.04.2006. RU 2245380 C1, 27.01.2005. EP 0124213 A1, 07.11.1984. US 5698170 A, 16.12.1997. WO 0112865 A1, 22.02.2001.
Адрес для переписки:
620144, г.Екатеринбург, ул. 8 Марта, 142, кв.29, С.Н.Костромину
|
(72) Автор(ы):
Гуров Владимир Алексеевич (RU)
(73) Патентообладатель(и):
Гуров Владимир Алексеевич (RU),
Гизатуллин Ирик Сибагатович (RU),
Общество с ограниченной ответственностью “Научно-производственное предприятие “ГЕОТЭП” (RU),
Фирма Каримпекс (Carimpex) (AT)
|
(54) ЭКОЛОГИЧЕСКИ ЧИСТЫЙ СПОСОБ КОМПЛЕКСНОГО ИЗВЛЕЧЕНИЯ ЦВЕТНЫХ, РЕДКИХ И ДРАГОЦЕННЫХ МЕТАЛЛОВ ИЗ РУД И МАТЕРИАЛОВ
(57) Реферат:
Изобретение относится к гидрометаллургии, а именно к способу извлечения цветных (Cu, Zn, Со, Ni и др.), редких (U, редких земель, Y, Re, Tl, In и др.) и драгоценных (Au, Ag, Pt, Pd и др.) металлов из руд и материалов. Способ включает выщелачивание руд в две стадии. На первой стадии обработку руд и материалов ведут первым оборотным выщелачивающим раствором с введением серной кислоты и солей трехвалентного железа в количестве, обеспечивающем в конце выщелачивания в продуктивном растворе мольное соотношение концентраций ионов трехвалентного и двухвалентного железа не ниже 1:1. На второй стадии обработку руд и материалов проводят вторым оборотным выщелачивающим раствором с введением серной кислоты, солей роданидов и трехвалентного железа в количестве, обеспечивающем в продуктивном растворе мольное соотношение концентраций ионов роданида и трехвалентного железа не выше 2:1 и не ниже 0,5:1, а соотношение концентраций ионов трехвалентного и двухвалентного железа также не ниже 1:1. Затем проводят отдельную переработку продуктивных растворов каждой стадии химическим осаждением, сорбцией и/или электролизом и возврат оборотных растворов на соответствующую стадию. Техническим результатом является повышение степени извлечения цветных, редких и драгоценных металлов. 4 з.п. ф-лы, 5 табл.
Изобретение относится к металлургии, а именно к мокрым способам извлечения цветных (Cu, Zn, Со, Ni и др.), редких (U, редких земель, Y, Re, Tl, In и др.) и драгоценных (Au, Ag, Pt, Pd и др.) металлов из руд и материалов, и может быть использовано при агитационном выщелачивании, а также кучном, кюветном, подземном и других способах фильтрационного выщелачивания.
Известен способ комплексного извлечения цветных и драгоценных металлов из руд, содержащих сульфиды металлов, включающий их обработку водной кислотной композицией в присутствии ионов трехвалентного железа и материалом, содержащим марганец, способный к химическому восстановлению (см. патент США  4740234, МКИ С22В 11/04 за 1988 г.). Способ предусматривает двухстадийную обработку руд. На первой стадии осуществляют растворение сульфидов под действием окислителей, ионов трехвалентного железа и марганецсодержащего материала, например пиролюзита. В результате цветные металлы переходят в раствор, а драгоценные металлы высвобождаются для последующего выщелачивания на второй стадии цианированием. 4740234, МКИ С22В 11/04 за 1988 г.). Способ предусматривает двухстадийную обработку руд. На первой стадии осуществляют растворение сульфидов под действием окислителей, ионов трехвалентного железа и марганецсодержащего материала, например пиролюзита. В результате цветные металлы переходят в раствор, а драгоценные металлы высвобождаются для последующего выщелачивания на второй стадии цианированием.
Соотношение концентраций ионов трех- и двухвалентного железа в продуктивных растворах на первой стадии выщелачивания не регламентируется. В результате возможно снижение извлечения цветных металлов на первой стадии, а если на второй стадии применять выщелачивание солями роданидов (тиоцианатов) и трехвалентного железа, то может наблюдаться снижение степени извлечения драгоценных металлов. Цианирование с экологической точки зрения является весьма вредным и опасным процессом.
Известен также способ комплексного двухстадийного извлечения цветных, редких и драгоценных металлов из руд и концентратов, содержащих сульфидную серу, с использованием бактериального выщелачивания (см. книгу С.И.Полькина, Э.В.Адамова, В.В.Панина «Технология бактериального выщелачивания цветных и редких металлов». М.: Недра, 1982 г.). На первой стадии выщелачивают цветные и редкие металлы сернокислыми растворами в присутствии кислорода воздуха, ионов двух- и трехвалентного железа, а также бактерий Thiobacillus ferrooxidans и/или Thiobacillus thiooxidans, а на второй стадии, цианированием извлекают драгоценные металлы.
Соотношение концентраций ионов трех – и двухвалентного железа в продуктивных растворах на первой стадии выщелачивания не регламентируется. В результате, возможно снижение степени извлечения цветных металлов на первой стадии и драгоценных металлов на второй стадии. Цианирование также ухудшает экологическую чистоту процесса.
Наиболее близким к предлагаемому изобретению в части выщелачивания драгоценных металлов на второй стадии является способ, предусматривающий выщелачивание золота и серебра из руд растворами роданидов (тиоцианатов) в присутствии окислителей, в том числе трехвалентного железа (см. статью «Thermoschemistry of thiocyanate systems for leaching gold and silver ores» Barbosa O., Montemius A., Precions Metals, 89: Proc. Jnt. Symp. TMS Ann. Mut, Las Vegas. Nov. Febr. 27 – March.2, 1989. – Warrendale (Pa), 1989). В способе рекомендуется для наиболее эффективного выщелачивания золота поддерживать в растворе значение рН 1-3, концентрацию ионов роданида 0,5-0,01 м и окислительно-восстановительный потенциал 600-700 мВ; для выщелачивания серебра требуется потенциал на 100 мВ ниже. Соотношение в растворе концентраций ионов роданида и трехвалентного железа, а также ионов трехвалентного и двухвалентного железа не регламентируется.
В рекомендованных условиях в зависимости от соотношения в растворе концентраций ионов роданида и трехвалентного железа, а также ионов трехвалентного и двухвалентного железа, возможно снижение степени извлечения драгоценных металлов.
Задачей изобретения является повышение степени извлечения цветных и редких металлов на первой стадии и драгоценных и редких металлов на второй стадии, а также повышение экологической чистоты процесса в целом.
Поставленная задача достигается тем, что введение в выщелачивающий раствор серной кислоты и солей трехвалентного железа на первой стадии поддерживают в количестве, обеспечивающем в конце выщелачивания в продуктивном растворе мольное соотношение концентраций ионов трехвалентного и двухвалентного железа не ниже 1:1, а на второй стадии введение серной кислоты, солей роданидов и трехвалентного железа в выщелачивающий раствор поддерживают в количестве, обеспечивающем в продуктивном растворе мольное соотношение концентраций ионов роданида и трехвалентного железа не выше 2:1 и не ниже 0,5:1, а соотношение концентраций ионов трехвалентного и двухвалентного железа также не ниже 1:1.
Сущность изобретения состоит в определении оптимального мольного соотношения концентраций ионов трехвалентного и двухвалентного железа, а также концентраций ионов роданида и трехвалентного железа, при которых процесс выщелачивания протекает с большим извлечением цветных металлов на первой стадии и драгоценных металлов на второй стадии.
В рудах, содержащих сульфидную серу, цветные, редкие и драгоценные металлы, ценные компоненты либо образуют химическое соединение с сульфидной серой (цветные металлы), либо ассоциированы с сульфидами, которые блокируют доступ используемого растворителя к ним (драгоценные и редкие металлы), либо сульфиды снижают окислительно-восстановительный потенциал выщелачивающего раствора ниже уровня, необходимого для растворения металлов. Как правило, условия и растворители при выщелачивании цветных и драгоценных металлов существенно отличаются. Кроме того, и коллективная переработка продуктивных растворов этих металлов значительно усложняется. Поэтому обычно и применяют двухстадийное выщелачивание. На первой стадии осуществляется максимальная выработка сульфидов, в процессе которой обеспечивается извлечение в раствор цветных и/или редких металлов, высвобождение драгоценных и редких металлов и повышение потенциала выщелачивающего раствора.
Так при выщелачивании руд, содержащих сульфидную серу, с введением серной кислоты и солей трехвалентного железа взаимодействие, например, с пиритом, как наиболее распространенным сульфидным минералом, протекает по реакции:
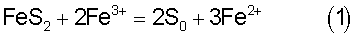
Стандартный окислительно-восстановительный потенциал системы Fe3+/Fe2+, Eh0 Fe=0,771 В. Потенциал растворения пирита равен 0,53 В. Реальный потенциал пары Fe3+/Fe2+ рассчитывается по уравнению: Fe=0,771 В. Потенциал растворения пирита равен 0,53 В. Реальный потенциал пары Fe3+/Fe2+ рассчитывается по уравнению:
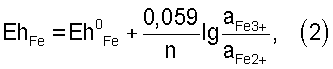
где n – число электронов, а – равновесные мольные концентрации соответствующих ионов. Из уравнения (2) следует, что потенциал пары железа зависит от соотношения концентраций ионов трех – и двухвалентного железа в растворе. Если это соотношение ниже 1:1, потенциал системы железа становится ниже стандартного, то есть ниже 0,771 В, и приближается по величине к потенциалу сульфидного минерала. Процесс выработки сульфидов замедляется и в конечном итоге выработка сульфидов снижается. И наоборот, чем это соотношение выше 1:1, тем выше выработка сульфидов. Тем выше степень извлечения цветных металлов на первой стадии и драгоценных металлов – на второй стадии. Реальные потенциалы большинства сульфидных минералов в кислой среде, таких как пирит, сфалерит, халькопирит, арсенопирит, ковелин, халькозин, варьируют в основном в интервале 0,2-0,6 В, достигая в случае халькопирита 0,768 В, то есть почти стандартного потенциала системы железа (см. книгу С.И.Полькина, Э.В.Адамова, В.В.Панина «Технология бактериального выщелачивания цветных и редких металлов». М.: Недра, 1982 г.). Но если обратиться к уравнению реального потенциала железа (2), то видно, что его величина будет равна 0,771 В в случае соотношения мольных концентраций ионов трех- и двухвалентного железа в растворе, равного 1:1. Другими словами, такое соотношение ионов можно считать граничным, при котором выработка сульфидов минимальна. Если, например, вести выработку сульфидной серы на первой стадии агитационным противоточным или фильтрационным выщелачиванием, поддерживая соотношение концентраций ионов трех- и двухвалентного железа в выщелачивающем растворе больше 1:1, то в ходе процесса в продуктивном растворе это соотношение может быть и ниже величины 1:1. Но по мере выработки сульфидов оно будет повышаться и в конце процесса станет также выше 1:1 и в продуктивном растворе, что и будет свидетельствовать о максимально возможной выработке сульфидов. Поддерживать это соотношение возможно как непосредственным введением в раствор солей трехвалентного железа, так и окислением ионов двухвалентного железа, используя обработку руды и/или раствора добавкой окислителя: воздуха, кислорода, пиролюзита и др., в том числе с применением бактерий Thiobacillus ferrooxidans и/или Thiobacillus thiooxidans. Если руда содержит минералы трехвалентного железа, то это соотношение можно поддерживать дополнительным введением в раствор серной кислоты, растворяя эти минералы.
Руда может содержать и другие восстановители трехвалентного железа, например мышьяк, а также минералы самого двухвалентного железа или цветные и редкие металлы в восстановленной форме, например уран в виде UO2. В каждом из этих случаев в оборотном растворе будут накапливаться ионы двухвалентного железа и его соотношение с трехвалентным железом будет влиять на степень извлечения цветных и редких металлов на первой стадии и драгоценных металлов (как будет показано ниже) на второй стадии.
Таким образом, если на первой стадии введение серной кислоты и трехвалентного железа в выщелачивающий раствор поддерживать в количестве, обеспечивающем в продуктивном растворе в конце выщелачивания мольное соотношение концентраций ионов трехвалентного и двухвалентно го железа не ниже 1:1, извлечение цветных металлов на первой стадии и последующее извлечение драгоценных металлов на второй стадии будет выше.
Необходимо также отметить, что мольное соотношение концентраций ионов трехвалентного и двухвалентного железа не ниже 1:1 в продуктивном растворе в конце выщелачивания на первой стадии будет служить гарантией того, что это соотношение как минимум сохранится и на второй стадии и, как будет показано ниже, обеспечит повышение извлечения драгоценных металлов.
Сущность изобретения в части выщелачивания драгоценных металлов состоит в определении оптимального мольного соотношения концентраций ионов трехвалентного и двухвалентного железа, а также концентраций ионов роданида и трехвалентного железа, при которых процесс выщелачивания протекает с большим извлечением драгоценных металлов.
Выщелачивание, например, золота раствором, содержащим ионы роданида и трехвалентного железа, протекает по реакции:

Стандартный окислительно-восстановительный потенциал системы Au/Au(SCN)4  – при растворении золота, Eh0 – при растворении золота, Eh0 Au = 0,655 В (см. Справочник по электрохимии. / Под редакцией А.М. Сухотина. – Л.: Химия, 1981). Стандартный потенциал системы Fe3+/Fe2+, Eh0 Au = 0,655 В (см. Справочник по электрохимии. / Под редакцией А.М. Сухотина. – Л.: Химия, 1981). Стандартный потенциал системы Fe3+/Fe2+, Eh0 Fe=0,771 В. Таким образом, разность потенциалов железа и золота показывает, что термодинамическая вероятность протекания процесса растворения золота в стандартных условиях достаточно высока. Реальные же потенциалы этих систем согласно формуле Нернста будут иметь вид: Fe=0,771 В. Таким образом, разность потенциалов железа и золота показывает, что термодинамическая вероятность протекания процесса растворения золота в стандартных условиях достаточно высока. Реальные же потенциалы этих систем согласно формуле Нернста будут иметь вид:
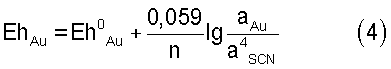
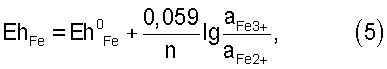
где n – число электронов, аAu – равновесная мольная концентрация (активность) роданидного комплекса золота, а – равновесные концентрации соответствующих ионов.
Отсюда видно, что потенциал системы золота зависит от соотношения равновесных концентраций роданидного золота и иона роданида в растворе, а потенциал системы железа связан с соотношением равновесных концентраций трех- и двухвалентного железа.
Электродвижущая сила (ЭДС) процесса равна разности потенциалов железа и золота и вычисляется по формуле:
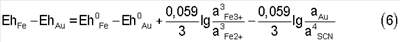
Но при наступлении равновесия реакции (3) EhFe – EhAu=0. Тогда, преобразуя выражение (6), получим:
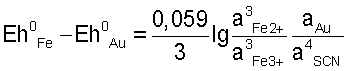 или или
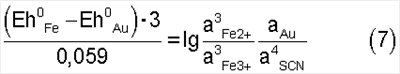
Подставив значения стандартных потенциалов в левую часть уравнения (7) будем иметь:
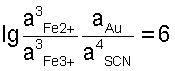
Если обратить внимание на реакцию (3), то видно, что выражение под знаком логарифма в уравнении (7) является выражением константы равновесия этой реакции, то есть
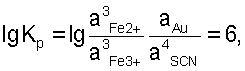 откуда откуда 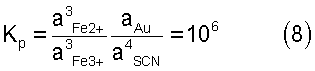
Величина константы равновесия показывает, что при наступлении равновесия в стандартных условиях произведение равновесных концентраций продуктов реакции (3) будет в миллион раз больше произведения концентраций исходных веществ. Или направление реакции практически целиком сдвинуто в сторону растворения золота.
Однако, известно, что ионы трехвалентного железа образуют с ионами роданида ряд комплексных соединений с соответствующими константами нестойкости (см. книгу Ю.Ю.Лурье «Справочник по аналитической химии» М.: Химия, 1971): Fe(SCN)2+ с K1=10-3; Fe (SCN)2+ с K1,2=10-4,33; Fe (SCN)3 с К1,2,3=10-4,63, которые способны связывать ионы как роданида, так и железа, изменяя равновесие реакции (3), а значит и ее направление. Сравнивая значения констант нестойкости можно увидеть, что наиболее прочным является комплекс Fe(SCN)2+ с K1=10-3, который в основном и определяет равновесие в системе и диссоциирует по реакции:
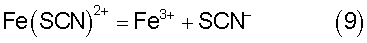
Выражение константы нестойкости для реакции (9) будет иметь вид:
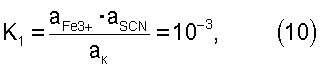
где ак – равновесная мольная концентрация железо-роданидного комплекса. Преобразуя выражение (10) в уравнение aFe3+·aSCN=ак·10-3 и подставив выражение произведения концентраций ионов железа и роданида в уравнение (8) получим:
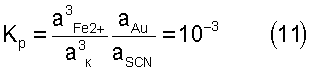
Из сравнения выражений константы нестойкости роданидного комплекса железа (10) и константы равновесия реакции растворения золота (11) видно, что, с одной стороны, отрицательная степень значения последней свидетельствует о сдвиге равновесия в обратную сторону, то есть в сторону осаждения золота. Отсюда следует вывод, что процесс растворения золота в присутствии ионов роданида и железа обратим. С другой стороны, направление реакции зависит от равновесных концентраций ионов двухвалентного железа, роданида и роданидного комплекса трехвалентного железа, концентрация которого, в свою очередь, зависит от концентраций ионов трехвалентного железа и роданида.
Если из уравнения (11) выразить равновесную концентрацию золота, то выражение будет иметь вид:
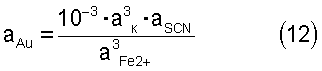
Откуда видно, что, поддерживая определенные концентрации соответствующих ионов в растворе, можно управлять процессом выщелачивания. Однако равновесные концентрации роданида и комплекса в растворе аналитически определить не представляется возможным из-за наличия подвижного динамического равновесия и относительной нестойкости железо-роданидного комплекса. Это не относится к иону двухвалентного железа, который не образует комплексов и его равновесная концентрация равна общей концентрации. Поэтому необходимо равновесные концентрации ионов выразить через общие концентрации, которые можно определять аналитически. Для этого вновь вернемся к реакции диссоциации железо-роданидного комплекса (9):
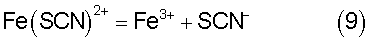
Откуда следует, что для простого бинарного соединения данного комплекса, диссоциирующего на один моль железа и один моль роданида, общие мольные концентрации (С) ионов железа и роданида будут равны сумме равновесных концентраций комплекса и соответствующего иона, а именно:

Отсюда выразим равновесную концентрацию комплекса через общие концентрации ионов:
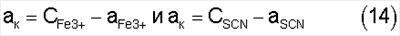
Далее выразим равновесные концентрации ионов железа и роданида через общие концентрации. Так из выражений (14) следует, что
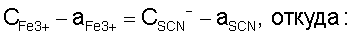

Теперь, если выражения (14, 15) для ак и aSCN подставить в уравнение (12), то получим уравнение зависимости равновесной концентрации золота в растворе от общих концентраций ионов двух-, трехвалентного железа и роданида:
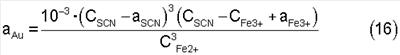
Из выражения (16) видно, что равновесная концентрация золота зависит не только от величины общих концентраций ионов двух -, трехвалентного железа и роданида, но и от соотношения между ними. В связи с вышеизложенным сущностью настоящего изобретения является определение оптимальных мольных соотношений общих концентраций ионов роданида и трехвалентного железа (CSCN:СFe3+), а также ионов трехвалентного и двухвалентного железа (CFe3+:CFe2+), при которых равновесная концентрация золота максимальна, а значит, вероятность протекания процесса выщелачивания с большим извлечением золота повышается.
Для определения оптимальных соотношений проведем приближенный расчет равновесных концентраций золота для различных соотношений общих концентраций CSCN:CFe3+ от 0,5:1 до 2:1. (Расчет приближенный, так как для упрощения расчета в нем не учитывалась ионная сила раствора и коэффициенты активности ионов). Для этого примем два варианта общих концентраций иона роданида, как рекомендовано в приведенном выше аналоге: 1·10-2 м и 0,5 м. Причем концентрация роданида принимается постоянной для всего интервала соотношений, а концентрация трехвалентного железа будет переменной. Для упрощения расчета примем постоянной и мольную концентрацию двухвалентного железа, которую можно на практике поддерживать с использованием какого-либо дополнительного окислителя (кислорода, воздуха, пиролюзита и других).
Приведем пример расчета для одного соотношения CSCN:СFe3+=0,5:1, для остальных он будет аналогичен. Общая концентрация роданида принимается равной 1·10-2 м, общая концентрация двухвалентного железа – в десять раз меньшей или 1·10-3 м. Для соотношения 0,5:1 общая концентрация ионов трехвалентного железа составит 2·10-2 м. Далее, если в выражение константы нестойкости комплекса (10) подставить значения концентраций равновесных ионов из выражений (14, 15), то получим:
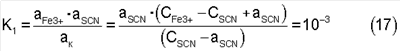
Обозначив aSCN через x и подставив принятые значения общих концентраций ионов в выражение (17) получим уравнение:
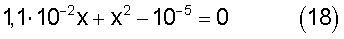
Решая уравнение (18) методом последовательных приближений, находим, что х=0,84·10-3 или aSCN=0,84·10-3. Тогда ак=CSCN-aSCN=1·10-2-0,84·10-3=9,16·10-3. Отсюда равновесная концентрация золота по формуле (16) будет равна:
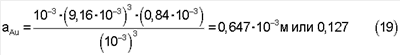
Примеры 1-10.
В табл.1 приведены примеры расчетных показателей ионного равновесия в растворе для различных соотношений общих концентраций ионов CSCN:СFe3+ от 0,5:1 до 2:1. Примеры 1-4 – для общей концентрации роданида 1·10-2 м и примеры 5-8 – для общей концентрации роданида 0,5 м.
Как следует из табл.1, с увеличением соотношения CSCN:CFe3+ от 0,5:1 до 2:1 равновесная концентрация золота в случае общей концентрации роданида 1·10-2 м изменяется от 0,127 до 0,087 г/л, проходя через максимум в 0,207 г/л при соотношении CSCN:CFe3+=1:1. В случае общей концентрации роданида 0,5 м, аналогично, равновесная концентрация золота, изменяясь от 0,197 до 6,1 г/л, проходит через максимум в 9,65 г/л, но при соотношении CSCN:CFe3+=1,5:1. На наш взгляд, такое поведение золота связано со степенью диссоциации роданидного комплекса железа, которая в разбавленных растворах увеличивается, а в концентрированных – уменьшается. Степень диссоциации слабых электролитов рассчитывается, как отношение равновесной концентрации иона, находящегося в недостатке, к общей концентрации этого иона (см. книгу Б.П. Надеинского «Теоретические обоснования и расчеты в аналитической химии», М.: «Высшая школа», 1959). Приведенные данные в таблице показывают, что степень диссоциации комплекса также проходит через максимум, который соответствует соотношению ионов роданида и трехвалентного железа 1:1. Но в случае разбавленных растворов этот максимум составляет 27%, а в концентрированных растворах – только 4,4%. Причем, если в разбавленных растворах роданида максимумы равновесной концентрации золота и степени диссоциации совпадают при соотношении CSCN:CFe3+=1:1, то в концентрированных растворах максимум золота наблюдается при большем соотношении CSCN:CFe3+=1,5:1 и меньшей степени диссоциации комплекса – 0,6%. Это связано с тем, что равновесная концентрация золота, рассчитанная по формуле (12), зависит от произведения равновесных концентраций ионов роданида и комплекса. Но, если посмотреть изменение концентрации комплекса с увеличением соотношения CSCN:CFe3+, то концентрация комплекса как в разбавленных, так и в концентрированных растворах роданида уменьшается примерно вдвое. Равновесная же концентрация роданида в разбавленных растворах увеличивается только в 6,8 раза, а в концентрированных – в 250 раз. То есть решающее значение в увеличении равновесной концентрации золота или произведения а3 к·aSCN в формуле (12) в разбавленных растворах имеется концентрация комплекса, а в концентрированных – концентрация роданида. Другими словами в разбавленных растворах роданида максимум золота будет приближаться к соотношению CSCN – CFe3+=0,5:1, а в концентрированных – к соотношению CSCN:CFe3+=2:1. Действительно можно подсчитать, что при уменьшении общей концентрации CSCN до 1·10-3 м максимум концентрации золота будет соответствовать соотношению CSCN:СFe3+=0,5:1, а при увеличении общей концентрации CSCN до 1 м максимум концентрации золота будет соответствовать соотношению CSCN:CFe3+=2:1. Концентрацию CSCN=1·10-3 м или 58 мг/л можно считать минимально предельной для практического использования при переработке, например, забалансовых руд кучным выщелачиванием, и наоборот, концентрацию CSCN=1 м или 58 г/л можно считать максимально предельной для переработки концентратов и других богатых по золоту материалов. Отсюда следует вывод, что и интервал соотношений CSCN:CFe3+ от 0,5:1 до 2:1 можно считать оптимальным. То есть, если при выщелачивании руд и материалов поддерживать в продуктивных растворах соотношение CSCN:CFe3+ не ниже 0,5:1 и не выше 2:1, то при прочих равных условиях концентрация золота и его извлечение – будут выше. к·aSCN в формуле (12) в разбавленных растворах имеется концентрация комплекса, а в концентрированных – концентрация роданида. Другими словами в разбавленных растворах роданида максимум золота будет приближаться к соотношению CSCN – CFe3+=0,5:1, а в концентрированных – к соотношению CSCN:CFe3+=2:1. Действительно можно подсчитать, что при уменьшении общей концентрации CSCN до 1·10-3 м максимум концентрации золота будет соответствовать соотношению CSCN:СFe3+=0,5:1, а при увеличении общей концентрации CSCN до 1 м максимум концентрации золота будет соответствовать соотношению CSCN:CFe3+=2:1. Концентрацию CSCN=1·10-3 м или 58 мг/л можно считать минимально предельной для практического использования при переработке, например, забалансовых руд кучным выщелачиванием, и наоборот, концентрацию CSCN=1 м или 58 г/л можно считать максимально предельной для переработки концентратов и других богатых по золоту материалов. Отсюда следует вывод, что и интервал соотношений CSCN:CFe3+ от 0,5:1 до 2:1 можно считать оптимальным. То есть, если при выщелачивании руд и материалов поддерживать в продуктивных растворах соотношение CSCN:CFe3+ не ниже 0,5:1 и не выше 2:1, то при прочих равных условиях концентрация золота и его извлечение – будут выше. 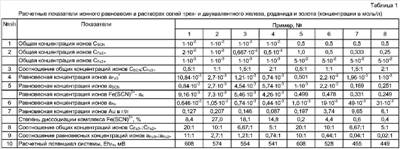
Относительно соотношения в растворе CFe3+:СFe2+ из данных табл.1 видно, что с увеличением соотношения CSCN:СFe3+ от 0,5:1 до 2:1 соотношение CFe3+:CFe2+ уменьшается как в разбавленных, так и в концентрированных растворах, одинаково от 20:1 до 5:1. При этом минимальному соотношению 5:1 в разбавленных растворах соответствует концентрация золота 0,087 г/л. Если уменьшить это соотношение до 1:1, например, увеличением концентрации двухвалентного железа в пять раз, то концентрация золота в соответствии с формулой (16) уменьшится в 125 раз и составит 0,7 мг/л. В более разбавленных растворах она будет еще ниже. Но такую концентрацию золота, как известно из практики переработки руд кучным выщелачиванием, можно принять минимально предельной для промышленного использования. Аналогично, при переходе к концентрированным растворам соотношению CFe3+:CFe2+=1:1 будет соответствовать концентрация золота около 50 мг/л, которую также можно принять минимально предельной для промышленной переработки концентратов. Поэтому и соотношение CFe3+:CFe2+=1:1, на наш взгляд, можно принять минимально предельным. Таким образом, если при выщелачивании руд и материалов поддерживать в продуктивных растворах соотношение CSCN:CFe3+ не ниже 0,5:1 и не выше 2:1, а соотношение CFe3+:CFe2+ не ниже 1:1 – то при прочих равных условиях концентрация золота и его извлечение будут – выше. И хотя расчет приближенный, из уравнения (16) следует, что введение в расчет коэффициентов активности ионов может изменить только абсолютные значения концентраций золота, но закономерность прохождения их через максимум сохранится.
Безусловно, что изменение соотношений ионов роданида, трех- и двухвалентного железа скажется и на величине окислительно-восстановительного потенциала в растворе и не проще ли поддерживать величину потенциала на определенном уровне? На наш взгляд, точнее будет все-таки поддерживать соотношение концентраций ионов, так как в связи со сложным вещественным составом руд и материалов, величина потенциала не будет в полной мере отражать соотношение концентраций только указанных ионов и каждый раз этот оптимальный потенциал необходимо определять опытным путем. Соотношение же концентраций ионов легко определяется аналитически и распространяется на любые руды и концентраты. Чтобы продемонстрировать это, рассчитаем реальные потенциалы в интервале соотношений равновесных концентраций ионов трех- и двухвалентного железа, приведенных в табл.1, относительно хлорсеребряного электрода сравнения, наиболее часто применяемого на практике. Расчет проведем именно по ионам железа, так как в рассматриваемой системе только они являются потенциалопределяющими, поскольку и окисленная и восстановленная их форма находится в растворе. Расчет проведем по формуле:
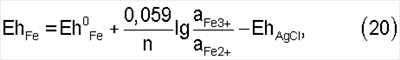
где EhAgCl=0,222В – потенциал хлорсеребряного электрода сравнения в насыщенном растворе KCl при 25°С. Результаты расчета приведены в табл.1. Как следует из табл.1, в разбавленных растворах с увеличением соотношения концентраций ионов роданида и трехвалентного железа и уменьшением соотношения концентраций ионов трех – и двухвалентного железа потенциал раствора снижается с 608 до 541 мВ, а в концентрированных растворах – с 608 до 449 мВ. Если эти данные сравнить с интервалом потенциалов в 600-700 мВ, рекомендованных в приведенном аналоге, то видно, что в нашем случае интервал оптимальных потенциалов значительно ниже.
Относительно других драгоценных металлов, таких как серебро и металлы платиновой группы можно сказать, что все они имеют окислительно-восстановительный потенциал значительно более низкий, чем потенциал золота, и в то же время все образуют прочные роданидные комплексы. Поэтому, на наш взгляд, все остальные драгоценные металлы также с большим извлечением будут выщелачиваться в указанном выше оптимальном интервале соотношений концентраций ионов роданида, трех- и двухвалентного железа.
Необходимо еще отметить, что соотношение ионов CSCN:СFe3+ не ниже 0,5:1 и не выше 2:1, а соотношение CFe3+:CFe2+ не ниже 1:1, необходимо поддерживать именно в продуктивных растворах. В выщелачивающих растворах эти соотношения могут выходить за рамки приведенных граничных значений. Если, например, вести переработку на второй стадии агитационным противоточным или фильтрационным выщелачиванием, поддерживая соотношение CFe3+:СFe2+ в выщелачивающем растворе значительно больше 1:1, а соотношение CSCN:CFe3+ значительно ниже 0,5:1, то в ходе процесса в продуктивном растворе это соотношение за счет взаимодействия с остаточной сульфидной серой (или другими восстановителями) и восстановления части трехвалентного железа может измениться. Главное, чтобы в продуктивных (выходных) растворах эти соотношения находились в обозначенных пределах. Поддерживать эти соотношения возможно как непосредственным введением в выщелачивающий раствор солей роданида и трехвалентного железа, так и окислением ионов двухвалентного железа в нем, используя обработку руды и/или раствора добавкой окислителя: воздуха, кислорода, пиролюзита и др., в том числе с применением бактерий Thiobacillus ferrooxidans и/или Thiobacillus thiooxidans. Если руда содержит минералы трехвалентного железа, то это соотношение можно поддерживать дополнительным введением в выщелачивающий раствор серной кислоты, растворяя эти минералы.
Относительно редких металлов можно сказать следующее. Часть из них, такие как уран, редкие земли, кадмий, рений и др. могут выщелачиваться как попутно с цветными металлами, так и самостоятельно на первой стадии растворами серной кислоты в присутствии ионов трехвалентного железа. Другая часть, такие как таллий, индий, ртуть и другие, способные образовывать роданидные комплексы, могут извлекаться попутно с драгоценными металлами на второй стадии.
В отношении экологической чистоты процесса замена цианирования роданидным выщелачиванием драгоценных металлов существенно повышает экологическую безопасность и чистоту способа, так как роданиды не являются сильнодействующими ядовитыми веществами и значительно менее вредны для окружающей среды.
Таким образом, если на первой стадии введение серной кислоты и солей трехвалентного железа в выщелачивающий раствор поддерживать в количестве, обеспечивающем в продуктивном растворе в конце выщелачивания мольное соотношение концентраций ионов трехвалентного и двухвалентного железа не ниже 1:1, а на второй стадии введение серной кислоты, солей роданидов и трехвалентного железа поддерживать в количестве, обеспечивающем в продуктивном растворе мольное соотношение концентраций ионов роданида и трехвалентного железа не выше 2:1 и не ниже 0,5:1, а соотношение ионов трехвалентного и двухвалентного железа также не ниже 1:1, извлечение цветных и редких металлов на первой стадии и последующее извлечение драгоценных и редких металлов на второй стадии будет выше и поставленная задача будет решена.
По предлагаемому способу в лабораторных условиях проводили двухстадийное выщелачивание измельченной руды, содержащей: Fe2О3 – 70%, сульфидной серы – 0,7%, Cu – 0,5%, Zn – 0,7% и Au – 4,8 г/т. Навески руды в каждом из трех опытов составляли по 1 кг. Выщелачивание осуществляли в полиэтиленовых сосудах при перемешивании на механических мешалках, отношении Ж:Т=2:1 и температуре 20°С. Минералы меди и цинка были представлены в основном халькопиритом и сфалеритом, железа – гематитом. На первой стадии выщелачивание проводили раствором серной кислоты, введение которой в трех опытах поддерживали в одинаковом количестве. Периодически перемешивание останавливали и в растворе анализировали содержание ионов трех- и двухвалентного железа. После этого в пульпу вводили 85% пиролюзит в расчетном количестве, обеспечивающем мольное соотношение концентраций ионов трех – и двухвалентного железа: в опыте 1-2:1, в опыте 2-1:1, в опыте 3-0,5:1. Выщелачивание продолжали 24 часа. После чего пульпы всех трех опытов отфильтровывали, кеки промывали водой и в растворе определяли содержание цинка и меди, по которым рассчитывалась степень извлечения этих металлов. Результаты представлены в табл.2.
Таблица 2
Результаты выщелачивания первой стадии |
| Показатели продуктивного раствора |
Ед. изм. |
Опыт,  |
| 1 |
2 |
3 |
| Концентрация иона Fe3+ |
г/л
м |
2,2
4·10-2 |
1,6
2,9·10-2 |
1,0
1,8·10-2 |
| Концентрация иона Fe2+ |
г/л
м |
1,1
2·10-2 |
1,5
2,7·10-2 |
2,3
4,1·10-2 |
Мольное соотношение
CFe3+·CFe2+ |
– |
2,0: 1 |
1,1:1 |
0,44:1 |
| Концентрация Zn |
г/л |
3,05 |
2,84 |
1,86 |
| Концентрация Cu |
-«- |
2,06 |
1,98 |
1,22 |
| Степень извлечения Zn |
% |
87,0 |
81,1 |
53,2 |
| Степень извлечения Cu |
-«- |
82,3 |
79,1 |
49,0 |
Как видно из данных табл.2, поддержание в продуктивном растворе соотношения концентраций ионов трехвалентного и двухвалентного железа от 1,1:1 до 2,0:1 в опытах 1, 2, то есть не ниже 1:1, привело к извлечению цинка и меди 81,1-87,0% и 79,1-82,3% соответственно. Снижение же этого соотношения в опыте 3 до 0,44:1 существенно уменьшило извлечение этих металлов до 49,0-53,2%.
Далее промытый кек руды из опыта 1 (см. табл.2) был разделен на 5 равных частей и распульпован в каждом из пяти последующих опытов (см. табл.3, опыты 4-8) водой при отношении Ж:Т=2:1, такое же количество руды было взято из опыта 3 и также распульповано (опыт 9). Затем проводилось выщелачивание с перемешиванием и введением серной кислоты и роданида натрия. При этом концентрация иона роданида поддерживалась во всех опытах одинаковой в количестве 0,58 г/л или 1·10-2 м, а серной кислоты вводилось различное количество. Периодически перемешивание останавливали и в растворе анализировали содержание ионов роданида, трех – и двухвалентного железа. После этого в пульпу вводили серную кислоту в расчетном количестве, обеспечивающем мольное соотношение концентраций ионов роданида и трехвалентного железа в опытах 4-8 от 0,3:1 до 3:1, а в опыте 9-1:1. Мольное соотношение трех – и двухвалентного железа только фиксировалось. Выщелачивание продолжали 24 часа. После чего пульпы всех шести опытов отфильтровывали, кеки промывали водой и в растворе определяли содержание золота, по которому рассчитывалась степень его извлечения. Результаты представлены в табл.3.
Таблица 3
Результаты выщелачивания второй стадии |
| Показатели продуктивного раствора |
Ед. изм. |
Опыт,  |
| 4 |
5 |
6 |
7 |
8 |
9 |
| Концентрация иона SCN– |
г/л м |
0,58
1·10-2 |
0,58
1·10-2 |
0,58
1·10-2 |
0,58
1·10-2 |
0,58
1·10-2 |
0,58
1·10-2 |
| Концентрация иона Fe3+ |
г/л м |
1,70
3·10-2 |
1,15
2·10-2 |
0,57
1·10-2 |
0,28
5·10-2 |
0,18
3,2·10-3 |
0,56
1·10-2 |
Мольное соотношение
CSCN –:СFe3+ –:СFe3+ |
– |
0,33:1 |
0,5:1 |
1:1 |
2:1 |
3:1 |
1:1 |
| Концентрация иона Fe2+ |
г/л м |
0,12
2,1·103 |
0,12
2,1·10-3 |
0,12
2,1·10-3 |
0,12
2,1·10-3 |
0,12
2,1·10-3 |
1,1
2·10-2 |
| Мольное соотношение СFe3+:СFe2+ |
– |
15:1 |
10:1 |
5:1 |
2,5:1 |
1,5:1 |
0,5:1 |
| Концентрация Au |
мг/л |
1,12 |
1,80 |
2,02 |
1,72 |
1,24 |
0,25 |
| Степень извлечения Au |
% |
46,7 |
75,0 |
84,1 |
71,6 |
51,6 |
21,0 |
Как следует из данных табл.3, поддержание мольного соотношения концентраций CSCN –:СFe3+ в опытах 5-7 от 0,5:1 до 2:1, обеспечило извлечение золота в количестве 71,6 – 84,1%, причем мольное соотношение СFe3+:СFe2+ составило от 2,5:1 до 10:1, то есть выше 1:1. При уменьшении соотношения CSCN –:СFe3+ в опытах 5-7 от 0,5:1 до 2:1, обеспечило извлечение золота в количестве 71,6 – 84,1%, причем мольное соотношение СFe3+:СFe2+ составило от 2,5:1 до 10:1, то есть выше 1:1. При уменьшении соотношения CSCN –:CFe3+ до 0,33:1 в опыте 4 извлечение золота резко снижается до 46,7%, не смотря на соотношение СFe3+:СFe2+=15:1. Аналогично, при увеличении соотношения CSCN –:CFe3+ до 0,33:1 в опыте 4 извлечение золота резко снижается до 46,7%, не смотря на соотношение СFe3+:СFe2+=15:1. Аналогично, при увеличении соотношения CSCN –:CFe3+ до 3:1 в опыте 8 извлечение золота также резко снижается до 51,6%, хотя соотношение CFe3+:CFe2+=1,5:1 остается выше 1:1. Снижение соотношения CFe3+:CFe2+ в опыте 9 до 0,5:1, то есть ниже 1:1 привело к еще большему уменьшению извлечения золота – до 21,0%, хотя соотношение CSCN –:CFe3+ до 3:1 в опыте 8 извлечение золота также резко снижается до 51,6%, хотя соотношение CFe3+:CFe2+=1,5:1 остается выше 1:1. Снижение соотношения CFe3+:CFe2+ в опыте 9 до 0,5:1, то есть ниже 1:1 привело к еще большему уменьшению извлечения золота – до 21,0%, хотя соотношение CSCN –:CFe3+=1:1 находится в оптимальном интервале. –:CFe3+=1:1 находится в оптимальном интервале.
Таким образом, результаты опытов показывают, что поддержание на первой стадии выщелачивания в продуктивном растворе мольного соотношения концентраций ионов трехвалентного и двухвалентного железа не ниже 1:1, а на второй стадии – мольного соотношения концентраций ионов роданида и трехвалентного железа не выше 2:1 и не ниже 0,5:1, а соотношения концентраций ионов трехвалентного и двухвалентного железа также не ниже 1:1 существенно повышает степень извлечения цветных и драгоценных металлов.
Как следует из данных табл.4, 5, при соблюдении требуемых соотношений ионов в растворе при выщелачивании цветных металлов и золота как водным, так и оборотным растворами обеспечивается практически одинаковое извлечение металлов.
Пример 11 (c использованием при выщелачивании оборотных растворов)
Полученный на первой стадии в опыте 2 (см. табл.2) продуктивный раствор цветных металлов в объеме 2,0 л состава, г/л: Fe3+ – 1,6; Fe2+ – 1,5; Cu – 1,98; Zn – 2,84, был переработан по следующей схеме. Вначале он был обработан карбонатом кальция с доведением значения рН пульпы до 4,3 с одновременным барботажем сжатого воздуха (для окисления Fe2+). Полученная пульпа гидратов железа и гипса была отфильтрована и осадок промыт на фильтре водой в количестве, необходимом для доведения общего объема фильтрата до 2,0 л. Полученный очищенный от железа раствор меди и цинка был обработан едким натром с доведением значения рН до 7,0. Данная суспензия также была отфильтрована, а осадок коллективного концентрата меди и цинка промыт водой с получением 2,0 л маточного раствора сульфата натрия состава, г/л: Fe3+ – отс.; Fe2+– отс.; Cu – 0,005; Zn – 0,05; Na2SO4 – 11,0. Полученный оборотный раствор был вновь использован для выщелачивания свежей порций руды в 1 кг по методике, описанной для опыта 2, где для приготовления раствора серной кислоты применялась водопроводная вода. Результаты выщелачивания на чистой воде и оборотном растворе приведены в табл.4.
Полученный на второй стадии продуктивный раствор золота в опыте 6 (см. табл.3) в объеме 0,4 л состава, г/л: SCN– – 0,58; Fe3+ – 0,57; Fe2+ – 0,12; Au – 2,02 мг/л, был обработан ионообменным анионитом марки А-510 фирмы Пьюролайт, предварительно заряженным в SCN– – форму до снижения содержания золота в маточнике сорбции менее 0,02 мг/л. После отделения сорбента маточный раствор имел состав, г/л: SCN– – 0,59; Fe3+ – 0,50; Fe2+ – 0,10; Au – 0,02 мг/л.
Из кека от выщелачивания руды оборотным выщелачивающим раствором на первой стадии была отобрана проба 200 г (на сухое), которая была распульпована в оборотном маточном растворе от выщелачивания в опыте 6. Далее было проведено выщелачивание по методике, описанной для опыта 6, где для приготовления выщелачивающего раствора применялась водопроводная вода.
| Таблица 4 |
| Результаты выщелачивания первой стадии водным и оборотным раствором |
| Показатели продуктивного раствора |
Ед. изм. |
Опыт,  |
| 2 |
2-1 |
| Выщелачивающий раствор |
– |
водным |
оборотный |
| Концентрация иона Fe3+ |
г/л
м |
1,6
2,9·10-2 |
1,4
2,5·10-2 |
| Концентрация иона Fe2+ |
г/л
м |
1,5
2,7·10-2 |
1,4
2,5·10-2 |
Мольное соотношение
CFe3+:CFe2+ |
– |
1,1:1 |
1:1 |
| Концентрация Zn |
г/л |
2,84 |
2,90 |
| Концентрация Cu |
-«- |
1,98 |
1,96 |
| Степень извлечения Zn |
% |
81,1 |
81,4 |
| Степень извлечения Cu |
-«- |
79,1 |
78,4 |
| Таблица 5 |
| Результаты выщелачивания второй стадии водным и оборотным раствором |
| Показатели продуктивного раствора |
Ед. изм. |
Опыт,  |
| 6 |
6-1 |
| Выщелачивающий раствор |
– |
водный |
оборотный |
| Концентрация иона SCN– |
г/л
м |
0,58
1·10-2 |
0,59
1·10-2 |
| Концентрация иона Fe3+ |
г/л
м |
0,57
1·10-2 |
0,60
1,1·10-2 |
Мольное соотношение
CSCN –:СFe3+ –:СFe3+ |
– |
1:1 |
1:1 |
| Концентрация иона Fe2+ |
г/л
м |
0,12
2,1·10-3 |
0,12
2,1·10-3 |
Мольное соотношение
СFe3+:СFe2+ |
– |
5:1 |
5:1 |
| Концентрация Au |
мг/л |
2,02 |
2,05 |
| Степень извлечения Au |
% |
84,1 |
84,2 |
Формула изобретения
1. Способ комплексного извлечения цветных, редких и драгоценных металлов из руд, включающий выщелачивание руд в две стадии: на первой стадии – оборотным выщелачивающим раствором с введением серной кислоты, солей трехвалентного железа и получением продуктивных растворов цветных и/или редких металлов, на второй стадии – оборотным выщелачивающим раствором с получением продуктивных растворов драгоценных и/или редких металлов, отдельную переработку продуктивных растворов каждой стадии химическим осаждением, сорбцией и/или электролизом и возврат оборотных растворов на соответствующую стадию, отличающийся тем, что вторую стадию ведут выщелачиванием оборотным выщелачивающим раствором с введением серной кислоты, солей роданидов (тиоцианатов) и трехвалентного железа, на первой стадии введение серной кислоты и трехвалентного железа в выщелачивающий раствор поддерживают в количестве, обеспечивающем в конце выщелачивания в продуктивном растворе мольное соотношение концентраций ионов трехвалентного и двухвалентного железа не ниже 1:1, а на второй стадии введение серной кислоты, солей роданидов и трехвалентного железа в выщелачивающий раствор поддерживают в количестве, обеспечивающем в продуктивном растворе мольное соотношение концентраций ионов роданида и трехвалентного железа не выше 2:1 и не ниже 0,5:1, а мольное соотношение концентраций ионов трехвалентного и двухвалентного железа не ниже 1:1.
2. Способ по п.1, отличающийся тем, что на первой стадии в конце выщелачивания поддерживают мольное соотношение концентраций ионов трехвалентного и двухвалентного железа в продуктивном растворе не ниже 1:1 путем добавления в выщелачивающий раствор и/или руду окислителя, например воздуха или кислорода.
3. Способ по п.2, отличающийся тем, что на первой стадии наряду с воздухом или кислородом в выщелачивающий раствор добавляют бактерии Thiobacillus ferrooxidans и/или Thiobacillus thiooxidans.
4. Способ по п.1, отличающийся тем, что на второй стадии поддерживают в продуктивном растворе мольное соотношение концентраций ионов роданида и трехвалентного железа не выше 2:1 и не ниже 0,5:1, а ионов трехвалентного и двухвалентного железа не ниже 1:1 путем добавления в выщелачивающий раствор и/или руду окислителя, например воздуха или кислорода.
5. Способ по п.4, отличающийся тем, что на второй стадии наряду с воздухом или кислородом в выщелачивающий раствор добавляют бактерии Thiobacillus ferrooxidans и/или Thiobacillus thiooxidans.
|
|