|
|
(21), (22) Заявка: 2007135592/13, 25.09.2007
(24) Дата начала отсчета срока действия патента:
25.09.2007
(46) Опубликовано: 20.04.2009
(56) Список документов, цитированных в отчете о
поиске:
RU 2241745 С2, 10.10.2002. RU 2300430 С2, 10.06.2007. SU 369136 A1, 01.01.1973. КОЧЕТКОВ В.В. и др. Выделение и характеристики бактерий деструкторов пестицидов. Прикладная биохимия и микробиология, 1997, т.33,  3, с.310-313. 3, с.310-313.
Адрес для переписки:
450062, г.Уфа, ул. Космонатов, 1, ГОУ ВПО “Уфимский государственный нефтяной технический университет”, патентный отдел
|
(72) Автор(ы):
Ягафарова Гузель Габдулловна (RU),
Головцов Михаил Владимирович (RU),
Леонтьева Светлана Валерьевна (RU),
Сафаров Альберт Хамитович (RU),
Ягафаров Ильгизар Римович (RU),
Барахнина Вера Борисовна (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования “Уфимский государственный нефтяной технический университет” (RU)
|
(54) СПОСОБ ВЫДЕЛЕНИЯ И АКТИВАЦИИ КОНСОРЦИУМА АБОРИГЕННЫХ МИКРООРГАНИЗМОВ-ДЕСТРУКТОРОВ НЕФТИ И НЕФТЕПРОДУКТОВ
(57) Реферат:
Изобретение относится к биотехнологии. Способ включает отбор проб с нефтезагрязненных почв и грунтов, выделение консорциума аборигенных нефтеокисляющих микроорганизмов, причем после выделения проводят активацию консорциума аборигенных нефтеокисляющих микроорганизмов с использованием смеси биотрина с отходом спиртового производства – барды, при соотношении компонентов 1:1 в количестве не менее 0,01 мас.%. Изобретение позволяет сократить продолжительность выделения аборигенных нефтеокисляющих микроорганизмов-деструкторов, упростить технологию наработки биомассы штаммов-деструкторов. 6 ил., 4 табл.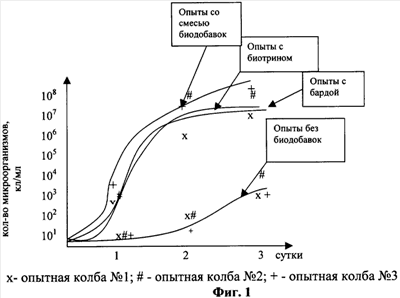
Изобретение относится к области охраны окружающей среды и может быть использовано при восстановлении нефтезагрязненных земель.
Способ включает отбор проб с нефтезагрязненной почв и грунтов, выделение ассоциации активных аборигенных штаммов-деструкторов нефти и нефтепродуктов, активацию полученной ассоциации и дальнейшую наработку биомассы ассоциации в ферментерах при оптимальных параметрах культивирования. Способ повышает вероятность поиска наиболее активных представителей углеводородокисляющих микроорганизмов для очистки конкретного участка нефтезагрязненных земель, позволяет сократить затраты на производство и транспортировку биопрепаратов.
Известно, что в почве и грунте, особенно загрязненной нефтью и нефтепродуктами, содержатся аэробные штаммы, способные биотрансформировать нефть и нефтепродукты. Среди них часто встречаются микроорганизмы родов Arthrobacter, Rhodococcus, Pseudomonas, Bacillus и др.
Известно использование биопрепаратов на основе активных штаммов-деструкторов нефти и нефтепродуктов [А.с. СССР  1076446, кл. C12N 15/09, 1978, патент РФ 1076446, кл. C12N 15/09, 1978, патент РФ  2019527, кл. C02F 3/34, E02B 15/04, 1993, патент РФ 2019527, кл. C02F 3/34, E02B 15/04, 1993, патент РФ  2142996, кл. C12N 1/26, C02F 3/34, В09С 1/10, 1999]. Недостатками этих способов являются продолжительность времени, необходимого на наработку биопрепарата, высокая стоимость и низкая эффективность. 2142996, кл. C12N 1/26, C02F 3/34, В09С 1/10, 1999]. Недостатками этих способов являются продолжительность времени, необходимого на наработку биопрепарата, высокая стоимость и низкая эффективность.
Известен способ выделения деструкторов нефти и нефтепродуктов из числа аборигенных штаммов микроорганизмов [Патент РФ  2241745. Способ выделения деструкторов нефти и нефтепродуктов. Сатубалдин К.К., Салангинас Л.А.]. (прототип). Суть способа: производится отбор проб с нефтезагрязненной поверхности, затем проводится селекция углеводородокисляющих бактерий с последующим пересевом полученных культур и наработка в отдельности всех отселектированных микроорганизмов в ферментерах при параметрах культивирования, оптимальных для выделенных микроорганизмов. Недостатком известного способа является продолжительность выделения аборигенных нефтеокисляющих микроорганизмов, связанная с селекцией штаммов-деструкторов, а также сложность наработки бактериального препарата на их основе (требуется сложное аппаратурное оформление). Кроме того, не предусмотрена предварительная активация ассоциации нефтеокисляющих штаммов-деструкторов. 2241745. Способ выделения деструкторов нефти и нефтепродуктов. Сатубалдин К.К., Салангинас Л.А.]. (прототип). Суть способа: производится отбор проб с нефтезагрязненной поверхности, затем проводится селекция углеводородокисляющих бактерий с последующим пересевом полученных культур и наработка в отдельности всех отселектированных микроорганизмов в ферментерах при параметрах культивирования, оптимальных для выделенных микроорганизмов. Недостатком известного способа является продолжительность выделения аборигенных нефтеокисляющих микроорганизмов, связанная с селекцией штаммов-деструкторов, а также сложность наработки бактериального препарата на их основе (требуется сложное аппаратурное оформление). Кроме того, не предусмотрена предварительная активация ассоциации нефтеокисляющих штаммов-деструкторов.
Задачей данного изобретения является сокращение продолжительности выделения аборигенных нефтеокисляющих микроорганизмов-деструкторов, упрощение технологии наработки биомассы штаммов-деструкторов.
Суть способа: производится отбор проб с нефтезагрязненных почвы и грунтов и выделение углеводородокисляющих микроорганизмов из образца конкретного участка нефтезагрязненной земли. Далее проводится активация полученной ассоциации с использованием смеси биодобавок биотрина и спиртовой барды, взятых в соотношении 1:1 в качестве фактора роста.
Известно, что информация на деструкцию нефти и нефтепродуктов в основном закодирована в плазмидах бактериальных клеток [Ягафарова Г.Г. Разработка биотехнологии очистки почвы и воды от некоторых хлорфенольных соединений и углеводородов нефти: Дис. на соискание уч. ст. д-ра технических наук. – Уфа, 1994]. Учитывая, что в число ассоциации аборигенных микроорганизмов будут входить как психрофильные, так мезафильные и термофильные микроорганизмы, селекция микроорганизмов не проводилась, а наработка биомассы осуществлялась при 25-30°С.
Способ осуществляется следующим образом.
На первом этапе работ проводится отбор образцов нефтезагрязненных почв и грунтов, выделение микроорганизмов-деструкторов нефти и нефтепродуктов из числа диких штаммов.
Основные операции по отбору проб осуществляются согласно ГОСТ 17.4.3.01-83 «Охрана природы. Почвы. Общие требования к отбору проб».
Для выделения микроорганизмов-деструкторов нефти и нефтепродуктов используют жидкую питательную среду Маккланга следующего состава: NaNO3 – 2,0 г/л; КН2PO4 – 1,0 г/л; MnSO4 – 0,013 г/л; MgSO4·7H2O – 0,5 г/л; ZnSO4 – 0,002 г/л; Fe2(SO4)3 – 0,001 г/л. Среду стерилизуют при 110°С в течение 30 мин.
Один грамм пробы почвы переносится в стерильную фарфоровую ступку, слегка увлажняется стерильной солевой средой и растирается до пастообразного состояния. Содержимое переносится в колбу на 250 мл (ступку и пестик ополоснуть солевой средой, перенося остаток в ту же колбу). Общий объем смеси доводится до 100 мл.
В качестве единственного источника углерода и энергии добавляют стерильный гексадекан (1 мас.%).
Культивирование проводят в качалочных колбах на термостатированной качалке при температуре 30°С и частоте вращения 100 мин-1 в течение 3 суток. Через трое суток отмечают видимые изменения в системе жидкой фазы – помутнение среды, появление пигмента, расслоение, изменение цвета и др.
Анализ состава накопительной культуры различных физиологических групп микроорганизмов производят путем высева определенных объемов воды на агаризованную среду по методу Коха.
На следующем этапе проводится активация нефтеокисляющих штаммов с помощью биогенных и минеральных добавок.
Активация проводится в жидкой минеральной среде Маккланга. Единственным источником углерода и энергии является нефть и/или нефтепродукты (гексадекан, дизельное топливо, мазут).
Для биологической стимуляции роста микроорганизмов и в качестве фактора роста используется смесь биодобавок: биотрин (ТУ 9291-001-00479994-95) и отход спиртового производства – барда, в соотношении 1:1 в количестве не менее 0,01 мас.%
Биотрин представляет собой сухой продукт, полученный микробиологическим синтезом из углеводородсодержащего сырья. Биотрин является эффективной балансирующей добавкой. Биотрин содержит в своем составе до 40-42% сырого протеина. В биотрине имеется 17 важнейших аминокислот, в том числе незаменимых, а также широкий спектр витаминов, макро- и микроэлементов. Биотрин является экологически чистым продуктом, не содержит токсических элементов.
Отход спиртового производства, барда – имеет в достаточном количестве легко растворимые азотистые соединения и полезные вещества: протеин (20-22%), жир (5-7%), клетчатках (13-18%), зола (7-8%), комплекс микроэлементов (кобальт, марганец, ванадий, железо и др.).
Процесс активации ассоциации штаммов-деструкторов проводят при температуре t=25-30°С и рН 7. Необходимо периодическое перемешивание.
На третьем этапе проводится наращивание необходимого количества биомассы полученной ассоциаци.
Глубинное культивирование ассоциации аборигенных микроорганизмов проводят в биореакторе, снабженном компрессором и мешалкой (например, 114.207.012.01.00.00 Ферментатор объемом 1 м3, материал 12Х18Н10Т ГОСТ 5632-73 с перемешивающим устройством). Поддерживают заданную температуру, рН, pO2. Культивирование проводят в полной минеральной среде Маккланга. В качестве источника углерода используют жидкие парафины, а при их отсутствии дизельное топливо или сырую нефть не менее 1 мас.% Процесс проводится при температуре t=25-30°С и рН 7 в течение 1-3 суток до достижения биомассы 0,3-0,5 мас.% При этом численность нефтеокисляющих микроорганизмов в готовой суспензии должна составлять не менее 109 клеток/мл. В процессе культивирования контролируют температуру ведения ферментации, накопление биомассы (методом КОЕ на 12 час культивирования и далее через каждые 6 часов), микрокопирование препарата ферментационной жидкости, рН.
По окончании процесса культивирования наработанную суспензию сливают в емкости и используют в качестве биопрепарата для обработки нефтезагрязненных объектов.
На 1 м2 нефтезагрязненных земель (содержание нефти до 13 мас.%) используют 1-1,5 л полученной суспензии аборигенных микроорганизмов. Для очистки нефтезагрязненных вод от нефти и нефтепродуктов суспензию ассоциации штаммов-деструкторов добавляют в биореактор для очистки сточной воды в количестве 3-5 об.%
Пример 1
С целью изучения процесса выделения аборигенных микроорганизмов из образцов нефтезагрязненных земель: Полигон Северный (Волжский р-н, п.Водино) – образец  1 (общее содержание нетфи и нефтепродуктов 3 мас.%), Дружба-1 (Безенчукский р-н, 37-й км) – образец 1 (общее содержание нетфи и нефтепродуктов 3 мас.%), Дружба-1 (Безенчукский р-н, 37-й км) – образец  2 (общее содержание нетфи и нефтепродуктов 5 мас.%) или ЛПДС Самара (п.Просвет) – образец 2 (общее содержание нетфи и нефтепродуктов 5 мас.%) или ЛПДС Самара (п.Просвет) – образец  3 (общее содержание нетфи и нефтепродуктов 10 мас.%) были проведены эксперименты в стерильной жидкой минеральной среде Маккланга. 3 (общее содержание нетфи и нефтепродуктов 10 мас.%) были проведены эксперименты в стерильной жидкой минеральной среде Маккланга.
В качестве факторов роста в первой серии опытов добавляли биотрин в количестве 0,01 мас.%, во второй серии опытов добавляли спиртовую барду в количестве 0,01 мас.%, в третьей серии опытов добавляли смесь биодобавок (биотрин:барда = 1:1) в количестве 0,01 мас.%. В качестве единственного источника углерода и энергии добавляли стерильный гексадекан в количестве 1 мас.%. В опытные колбы  1, 1,  2 и 2 и  3 вносили по 1 г образцов техногеннозагрязненных земель 3 вносили по 1 г образцов техногеннозагрязненных земель  1, 1,  2 и 2 и  3 соответственно. Для сравнения ставили аналогичные опыты без добавления биодобавок. 3 соответственно. Для сравнения ставили аналогичные опыты без добавления биодобавок.
Культивирование проводили в качалочных колбах на термостатированной качалке при температуре 30°С и частоте вращения 100 мин-1.
О нефтеокисляющей способности аборигенной микрофлоры судили по уменьшению содержания гексадекана, приросту численности микроорганизмов и изменению рН среды.
Содержание гексадекана определяли спектрофотометрически на приборе UR-20 при 1460 см-1, предварительно экстрагируя его четыреххлористым углеродом.
Изменение рН культуральной жидкости определяли путем замера рН с помощью иономера И-130,2 М в начале и конце культивирования.
Численность микроорганизмов определяли чашечным методом Коха при высеве на агаризованную среду для гетеротрофных микроорганизмов (мясопептонный агар).
Результаты исследований представлены на фигурах 1-2 и таблице 1. После 3 суток культивирования в опытных колбах  1, 2 и 3 с добавлением биотрина и с добавлением барды наблюдалось помутнение культуральной жидкости и появление пленки. 1, 2 и 3 с добавлением биотрина и с добавлением барды наблюдалось помутнение культуральной жидкости и появление пленки.
Как видно из фигуры 1, во всех опытных колбах с биотрином и бардой наблюдалось увеличение общего количества микроорганизмов и изменение рН среды в сторону подщелачивания (таблица 1). При этом наибольший прирост микроорганизмов наблюдался в серии опытов со смесью биодобавок биотрин:барда.
Содержание гексадекана снизилось в среднем до 0,1 мас.% сериях опытов с одной биодобавкой и до 0,07 мас.% в серии опытов со смесью биодобавок (фигура 2). В контрольных колбах изменений содержания гексадекана, количества микроорганизмов и рН среды не наблюдалось.
В опытных колбах без биодобавок незначительный прирост количества микроорганизмов наблюдался лишь на 3 сутки, содержание гексадекана снизилось незначительно (до 0,7-0,9 мас.%).
Таким образом, биотрин и спиртовая барда являются активными стимуляторами роста аборигеных нефтеокисляющих микроорганизмов.
Пример 2
Для установления оптимальной концентрации смеси биодобавок биотрин:барда для активации аборигенных микроорганизмов ставили следующий опыт. В жидкую минеральную среду Маккланга добавляли стерильную нефть конкретного месторождения (Самарская обл.) в количестве 1 мас.% и различные количества смеси биодобавок (биотрин:барда = 1:1): 0,01, 0,03, 0,05, 0,10 мас.%. Для биодеградации нефти вводили суспензию ассоциации аборигенных микроорганизмов, полученную в примере 1 (образец  1) в количестве 3 об.%. Контролем служила колба без добавления биодобавок. 1) в количестве 3 об.%. Контролем служила колба без добавления биодобавок.
О биодеградации нефти судили по уменьшению ее количества, которое определяли спектрофотометрически на приборе UR-20 при 2923 см-1, предварительно экстрагируя ее четыреххлористым углеродом.
Как видно из результатов приведенных в таблице 2, степень биодеградации уже при содержании биодобавок 0,01 мас.% на 10% выше, чем без добавления биодобавок.
Таким образом, концентрация смеси биодобавок биотрина и барды в соотношении 1:1, равная 0,01 мас.%, уже достаточна для активации аборигенных микроорганизмов.
Пример 3
Для изучения процессов биодеградации нефти и нефтепродуктов были проведены эксперименты в жидкой минеральной среде Маккланга (стерильной). В качестве единственного источника углерода и энергии добавляли нефть конкретного месторождения (Самарская обл.), в количестве 1 мас.%. Для биодеградации нефти в среду вносили суспензию ассоциации активированных аборигенных микроорганизмов из нефтезагрязненных образцов ( 1, 1,  2 или 2 или  3) почв в количестве 3 об.%. 3) почв в количестве 3 об.%.
В качестве факторов роста добавляли смесь биодобавок биотрина и барды в соотношении 1:1 в количестве 0,01 мас.%. Культивирование проводили в качалочных колбах на термостатированной качалке при температуре 30°С и частоте вращения 100 мин-1. Для сравнения ставили аналогичные опыты без добавления биодобавок. Колбы с минеральной средой Маккланга, содержащие 1 мас.% нефти, но не инокулированные микроорганизмами, служили контролем.
О степени биодеградации нефти судили по уменьшению ее количества, а также косвенно по приросту численности бактерий и изменению рН среды.
Результаты исследований представлены на рисунках 1-3 и таблице 1.
Как видно из фигуры 3, биодеградация нефти произошла более чем на 90% во всех опытах с использованием активированной микрофлорой, в то время как в контрольных колбах естественная убыль нефти не превышала 5%.
При этом во всех опытных колбах наблюдалось увеличение общего количества микроорганизмов (фигура 4) и изменение рН среды в сторону подщелачивания (таблица 3). В контрольных колбах никаких изменений не наблюдалось.
Пример 4.
С целью исследования процесса биоразложения легких и тяжелых фракций углеводородов при помощи аборигенной микрофлоры с добавлением смеси биодобавок биотрина и барды в соотношении 1:1 были проведены эксперименты.
Для этого в серии опытов аборигенные штаммы микроорганизмов культивировали в стерильной минеральной среде со смесью биодобавок биотрина и барды в соотношении 1:1 (0,01 мас.%) с добавлением в качестве единственного источника углерода: гексадекан, дизельное топливо, нефть и мазут конкретного месторождения (Самарская обл.) в количестве 1 мас.%. Колбы без добавления биодобавок служили контролем.
Минеральную среду Маккланга (состав приведен выше) разливали по 50 мл в качалочные колбы объемом 250 мл и стерилизовали при 1 атм. 30 мин. Засевали из расчета 3% по объему суспензии аборигенных микроорганизмов. В качестве единственного источника углерода добавляли гексадекан, дизельное топливо, нефть или мазут в количестве 1 мас.%.
Условия культивирования описаны выше.
О биоразложении нефти и нефтепродуктов судили путем количественного анализа на спектрофотометре UR-20 при 2923 см-1 (нефти, дизельное топливо, мазут) и при 1460 см-1 (гексадекан). Предварительно нефть и нефтепродукты экстрагировали четыреххлористым углеродом
На фигуре 5 представлены результаты изучения зависимости биодеградации гексадекана, дизельного топлива, нефти, мазута в воде через 48 часов.
Из приведенных данных таблицы 4 и фигуры 5 видно, что аборигенные микроорганизмы способны использовать не только легкие фракции нефти, такие как гексадекан, но и дизельное топливо и более тяжелые фракции нефти, как мазут, т.е. разлагать широкий спектр углеводородов. Причем степень биодеградации при добавлении смеси биодобавок биотрин и барда в соотношении 1:1 в качестве стимулятора роста увеличивает степень биодеградации нефти и нефтепродуктов в среднем на 20%. Так в опытах с добавлением смеси биодобавок степень биодеградации гексадекана составила 99%, дизельного топлива 85%, нефти – 84%, мазута – 65%. В опытах без добавления биодобавок степень биодеградации составила 61; 52,8; 48,2 и 32,7% соответственно.
Пример 5
С целью определения окислительной способности аборигенной микрофлоры образцов почвы и в нефтезагрязненной почве с заданных участков исследовали 3 образца нефтезагрязненных почв и грунтов:
1. Полигон Северный (Волжский р-н, п.Водино) – образец  1. 1.
Общее содержание нефти и нефтепродуктов 3 мас.%.
2. Дружба-1 (Безенчукский р-н, 37-й км) – образец  2. 2.
Общее содержание нефти и нефтепродуктов 5 мас.%.
3. ЛПДС Самара (п.Просвет) – образец  3. 3.
Общее содержание нефти и нефтепродуктов 10 мас.%.
Исследования проводили в фарфоровых чашках объемом 100 мл. В первой серии опытов 50 мг загрязненных образцов почвы обрабатывали суспензией аборигенных микроорганизмов (3 об.%), взятых с этого же образца и смесью биодобавок биотрина и барды взятых в соотношении 1:1 (0,01 мас.%). Во второй серии опытов не добавляли биодобавки. Контролем служили чашки без внесения микроорганизмов.
Очистку почвы проводили при комнатной температуре в течение 90 суток. Влажность почвы поддерживали 60% от полной влагоемкости.
О степени биодеградации нефти судили по ее остаточному количеству в почве.
Результаты исследований представлены на фигуре 6.
Как видно из результатов, приведенных на фигуре 6, активированная ассоциация аборигенной микрофлоры способна деградировать нефть и нефтепродукты в почве и грунте. Причем при обработке почвы смесью биодобавок биотрина и барды, взятых в соотношении 1:1, степень биодеградации заметно возрастает. Так для образцов почвы  1, 2 и 3 она составила 80, 75 и 64% соответственно. Без обработки биодобавками – 60, 57 и 42%. 1, 2 и 3 она составила 80, 75 и 64% соответственно. Без обработки биодобавками – 60, 57 и 42%.
Таблица 1
Результаты измерения рН в опытных и контрольных колбах |
| Название опыта |
Начальное |
Через 3 суток |
Образец  1 с биотрином 1 с биотрином |
6,2 |
7,2 |
Образец  1 с бардой 1 с бардой |
6,2 |
7,2 |
Образец  1 без биодобавок 1 без биодобавок |
6,2 |
6,8 |
Образец  2 с биотрином 2 с биотрином |
6,2 |
7,1 |
Образец  2 с бардой 2 с бардой |
6,2 |
7,0 |
Образец  2 без биодобавок 2 без биодобавок |
6,2 |
6,9 |
Образец  3 с биотрином 3 с биотрином |
6,2 |
7,1 |
Образец  3 с бардой 3 с бардой |
6,2 |
7,1 |
Образец  3 без биодобавок 3 без биодобавок |
6,2 |
6,9 |
| Контроль |
6,2 |
6,2 |
Таблица 2
Влияние количества смеси биодобавок на степень биодеградании нефти |
| Концентрация биодобавок, % |
0 |
0,01 |
0,03 |
0,05 |
0,08 |
0,10 |
| Степень биодеградации нефти, % |
68 |
78 |
84 |
91 |
91 |
91 |
| Таблица 3 |
| Название опыта |
Начальное |
Через 3 суток |
Образец  1 с биодобавками 1 с биодобавками |
6,2 |
7,0 |
Образец  1 без биодобавок 1 без биодобавок |
6,2 |
6,8 |
Образец  2 с биодобавками 2 с биодобавками |
6,2 |
7,1 |
Образец  2 без биодобавок 2 без биодобавок |
6,2 |
6,7 |
Образец  3 с биодобавками 3 с биодобавками |
6,2 |
7,1 |
Образец  3 без биодобавок 3 без биодобавок |
6,2 |
6,8 |
| Контроль с биодобавками |
6,2 |
6,2 |
| Контроль без биодобавок |
6,2 |
6,2 |
Таблица 4
Динамика роста микроорганизмов в среде с углеводородами с добавлением смеси биодобавок |
| Вариант |
Количество микроорганизмов, растущих на МПА, кл/мл, час |
| 0 |
24 |
36 |
48 |
| 1. Гексадекан |
1·105 |
8·107 |
5·108 |
1·109 |
| 2. Диз. топливо |
1·105 |
9·107 |
7·108 |
9·108 |
| 3. Нефть |
1·105 |
8·107 |
3·108 |
5·108 |
| 4. Мазут |
1·105 |
9·106 |
2·107 |
4·107 |
Формула изобретения
Способ выделения и активации консорциума аборигенных нефтеокисляющих микроорганизмов, включающий отбор проб с нефтезагрязненных почв и грунтов, выделение консорциума аборигенных нефтеокисляющих микроорганизмов, отличающийся тем, что после выделения проводят активацию консорциума аборигенных нефтеокисляющих микроорганизмов с использованием смеси биотрина с отходом спиртового производства – барды при соотношении компонентов 1:1 в количестве не менее 0,01 мас.%.
РИСУНКИ
|
|