|
|
(21), (22) Заявка: 2005118107/14, 30.10.2003
(24) Дата начала отсчета срока действия патента:
30.10.2003
(30) Конвенционный приоритет:
12.11.2002 US 60/425,574
(43) Дата публикации заявки: 20.01.2006
(46) Опубликовано: 20.04.2009
(56) Список документов, цитированных в отчете о
поиске:
WO 2002/085400, 31.10.2002. RU 2177801, 10.01.2002. WO 2000/21979, 20.04.2000. WO 01/18171 А2, 15.03.2001. БЕЛИКОВ В.Г. Фармацевтическая химия. – М.: Высшая школа, 1993, т.1, с.43-47. KIM M.S. et al. Histone deacetylases induce angiogenesis by negative regulation of tumor suppressor genes. – Nature Medicine, 2001 Apr., vol.7,  4, с.437-443.VINORES S.A. et al. Increased vascular endothelial growth factor (VEGF) and transforming growth factor beta (TGFbeta) in experimental autoimmune uveoretinitis: upregulation of VEGF without neovascularization. – J. Neuroimmunol. 1998 Aug 14; 89 (1-2): 43-50. 4, с.437-443.VINORES S.A. et al. Increased vascular endothelial growth factor (VEGF) and transforming growth factor beta (TGFbeta) in experimental autoimmune uveoretinitis: upregulation of VEGF without neovascularization. – J. Neuroimmunol. 1998 Aug 14; 89 (1-2): 43-50.
(85) Дата перевода заявки PCT на национальную фазу:
14.06.2005
(86) Заявка PCT:
US 03/34617 20031030
(87) Публикация PCT:
WO 2004/043352 20040527
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
КЛИМКО Питер Г. (US),
БИНГАМЭН Дэвид П. (US)
(73) Патентообладатель(и):
АЛЬКОН, ИНК. (CH)
|
(54) ИНГИБИТОРЫ ГИСТОНДЕАЦЕТИЛАЗЫ ДЛЯ ЛЕЧЕНИЯ ОФТАЛЬМОЛОГИЧЕСКИХ НЕОВАСКУЛЯРНЫХ НАРУШЕНИЙ И ЗАБОЛЕВАНИЙ
(57) Реферат:
Изобретение относится к медицине, в частности к офтальмологии, и касается ингибирования неоваскуляризации сетчатки. Для этого предлагается использовать производное гидроксамовой кислоты, выбранное из субероиланилидгидроксамовой кислоты (SAHA), трихостатина А (Trichostatin А), и/или скриптаида (Scriptaid). Выбранные производные обеспечивают эффективное игибирование VEGF-индуцированной пролиферации и продолжительности жизни эндотелиальных клеток сетчатки. 1 табл.
Настоящее изобретение относится к ингибиторам гистондеацетилазы (HDAC) в офтальмологических композициях и способам их применения. Данные соединения особо полезны при лечении людей, страдающих от глазных неоваскулярных заболеваний или нарушений.
Предпосылки изобретения
Данная заявка заявляет приоритет заявки США  60/425574 от 12 ноября 2002. 60/425574 от 12 ноября 2002.
Существует много агентов, которые, как известно, ингибируют образование новых кровеносных сосудов (ангиогенез). Например, стероиды, действующие как ингибиторы ангиогенеза в присутствии гепарина или специфических фрагментов гепарина, раскрыты в работе Crum, et al., New Class of Steroids Inhibits Angiogenesis in the Presence of Heparin or Heparin Fragment, Science, Vol.230: 1375-1378, December 20, 1985. Авторы называют такие стероиды “ангиостатическими” стероидами. Включенные в данный класс стероиды, которые, как обнаружено, являются ангиостатическими, представляют собой дигидро- и тетрагидрометаболиты кортизола и кортексолона. В исследовании по текущим данным, направленном на проверку гипотезы, касающейся механизма, по которому стероиды ингибируют ангиогенез, где показано, что композиции гепарин/ангиостатический стероид вызывают растворение базальных мембранных структур, к которым присоединен зависящий от опоры эндотелий, в результате чего происходит капиллярная инволюция (см. работу Ingber, et al., Possible Mechanism for Inhibition of Angiogenesis by Angiostatic Steroids: Induction of Capillary Basement Membrane Dissolution, Endocrinology Vol.119: 1768-1775, 1986).
Группа тетрагидростероидов, полезных при ингибировании ангиогенеза, раскрыта в патенте США  4975537, Aristoff et al. Данные соединения раскрыты для применения при лечении травм головы, травм позвоночника, септического или травматического шока, удара и геморрагического шока. Кроме того, в данном патенте обсуждается применимость таких соединений при эмбриональной имплантации и при лечении рака, артрита и артериосклероза. Некоторые из стероидов, раскрытых в работе Aristoff et al., раскрыты в патенте США 4975537, Aristoff et al. Данные соединения раскрыты для применения при лечении травм головы, травм позвоночника, септического или травматического шока, удара и геморрагического шока. Кроме того, в данном патенте обсуждается применимость таких соединений при эмбриональной имплантации и при лечении рака, артрита и артериосклероза. Некоторые из стероидов, раскрытых в работе Aristoff et al., раскрыты в патенте США  4771042 в комбинации с гепарином или гепариновым фрагментом для ингибирования ангиогенеза у теплокровных животных. 4771042 в комбинации с гепарином или гепариновым фрагментом для ингибирования ангиогенеза у теплокровных животных.
Показано, что композиции гидрокортизона, “тетрагидрокортизола-S” и U-72745G, каждая в комбинации с бета-циклодекстрином, ингибируют неоваскуляризацию роговицы: Li et al., Angiostatic Steroids Potentiated by Sulphated Ciclodextrin Inhibit Corneal Neovascularization, Investigative Ophthalmology and Visual Science, Vol. 32(11): 2898-2905, October, 1991. Стероиды сами по себе до некоторой степени снижают неоваскуляризацию, но не эффективны при осуществлении регрессии неоваскуляризации.
Тетрагидрокортизол (THF) раскрыт как ангиостатический стероид в работе Folkman et al., Angiostatic Steroids, Ann. Surg., Vol. 206(3), 1987, где предполагается, что ангиостатические стероиды могут иметь потенциальное применение при заболеваниях с преобладанием аномальной неоваскуляризации, включающих диабетическую ретинопатию, неоваскулярную глаукому и ретролентальную фиброплазию.
Ранее показано, что некоторые нестероидные противовоспалительные лекарственные средства (NSAID) могут ингибировать ангиогенез и сосудистый отек в патологических условиях. Способность большинства NSAID оказывать влияние на проницаемость сосудов, приводящей к отеку и ангиогенезу, по-видимому, связана с их способностью блокировать цикло-оксигеназные ферменты (COX-1 и -2). Блокада COX-1 и -2 связана с уменьшением количества воспалительных медиаторов, таких как PGE2. Кроме того, в результате ингибирования PGE2, по-видимому, снижаются экспрессия и производство различных цитокинов, включая сосудистый эндотелиальный фактор роста (VEGF). Известно, что VEGF является причиной протечки сосудов и ангиогенеза глаза в предклинических моделях. Повышенные уровни VEGF обнаружены также в неоваскулярных тканях и внеклеточной жидкости из глаз пациентов с диабетической ретинопатией и возрастной дегенерацией желтого пятна. Таким образом, NSAID могут ингибировать протечку сосудов и ангиогенез посредством модуляции уровней PGE2 и влияния на экспрессию и активность VEGF. Данная теория подкреплена работой, включающей модели опухолей животных, которые демонстрируют, что системное введение ингибиторов COX-2 снижает уровни PGE2 и VEGF в тканях и предотвращает тем самым индуцированный опухолью ангиогенез. На данных моделях активность VEGF и ангиогенез восстанавливаются при добавлении экзогенного PGE2 при непрерывной блокаде COX-2. Однако NSAID, по-видимому, имеют меняющуюся активность на животных моделях глазной неоваскуляризации (NV), на которых селективные ингибиторы COX, по-видимому, не ингибируют хориоидальную неоваскуляризацию. На самом деле данные исследования поднимают вопрос о роли COX-1 и/или COX-2 в развитии CNV.
Как описано в являющейся общей собственностью заявке США  09/929381, обнаружено, что некоторые 3-бензоилфенилуксусные кислоты и производные, которые являются NSAID, полезны для лечения нарушений, связанных с ангиогенезом. 09/929381, обнаружено, что некоторые 3-бензоилфенилуксусные кислоты и производные, которые являются NSAID, полезны для лечения нарушений, связанных с ангиогенезом.
Гистоны представляют собой ядерные белки, которые образуют октамерные частицы, вокруг которых в нескольких витках намотана хромосомная ДНК. Данный способ хранения ДНК помогает вместить предельно длинные молекулы ДНК в ядрах, помогает стабилизировать ДНК в отношении повреждений и служит для регулировки доступности ДНК факторам транскрипции. Гистоны имеют длинные положительно заряженные лизиновые хвосты, которые электростатически притягиваются к негативно заряженной фосфатной основной цепи ДНК, помогая таким образом образованию комплекса ДНК-гистон. В данном состоянии факторы транскрипции не имеют доступа к ДНК, и, следовательно, генная экспрессия подавлена. Ацетилирование лизиновых атомов азота вызывает локальное разматывание комплекса ДНК-гистон и разрешает доступ фактору транскрипции, способствуя таким образом генной экспрессии. Семейство ферментов гистондеацетилаз (HDAC) катализирует превращение N-ацетилированных лизинов обратно в неацетилированное состояние, вызывая реформацию комплекса гистон-ДНК и, следовательно, подавляя генную транскрипцию.
Что касается онкогенной трансформации клетки, одна теория постулирует важность дисбаланса между проонкогенными и антионкогенными сигналами. Более конкретно, недостаток функциональных мутаций в генах, кодирующих белки, подавляющих опухоль, таких как p53 и p21, коррелирован с развитием рака. Агенты, которые промотируют экспрессию белков, подавляющих опухоль, и/или индуцируют дифференцировку слабодифференцированных раковых клеток, являются целью многих приемов для лечения рака.
Семейство ферментов HDAC, подавляя генную транскрипцию, останавливают продифференциацию и экспрессию белков, подавляющих опухоль. Поэтому ингибирование данного семейства ферментов исследуют в качестве противораковой терапевтической стратегии. В частности, показано, что некоторые HDAC-ингибиторы являются обещающими на предклинических моделях различных раковых заболеваний. Например, сообщается, что HDAC-ингибитор субероиланилидгидроксамовая кислота (SAHA) является сильнодействующим индуктором дифференцировки раковой клетки (Munster et al., Cancer Research, Vol.61: 8492-8497, 2001), задерживает рост раковых клеток in vitro (Butler et al., Proc. Natl. Acad. Sci. USA, Vol.35 99: 11700-11705, 2002), сокращает опухоли на животных моделях (Butler et al., Cancer Res., Vol. 60: 5165-5170, 2000), показывая почти полное отсутствие ограничивающей дозу токсичности в клинических испытаниях фазы I, не включающих подавление производства белых кровяных клеток, что является очень необычным для противоракового агента (Kelly et al., Proc. Amer. Soc. Clin. Oncol., Vol.20: 87a, 2001), и в настоящее время находится на фазе II клинических испытаний. Кроме того, в настоящее время показано, что активность фермента HDAC промотирует ангиогенез посредством ингибирования экспрессии белков, подавляющих опухоль (Kim et al.. Nature Medicine, Vol.7: 437-443, 2001), и что HDAC-ингибиторы, включая SAHA, могут ингибировать VEGF-индуцированную неоваскуляризацию (Deroanne et al., Oncogene, Vol.21: 427-436, 2002).
Краткое содержание изобретения
Настоящее изобретение касается применения HDAC-ингибиторов для лечения пациентов, страдающих от глазных неоваскулярных заболеваний или нарушений.
Подробное описание изобретения
Неоваскуляризация (NV) заднего сегмента является угрожающей зрению патологией, ответственной за две наиболее общих причины приобретенной слепоты в развитых странах: экссудативной возрастной дегенерации желтого пятна (AMD) и пролиферативной диабетической ретинопатии (PDR). В настоящее время единственными одобренными способами лечения NV заднего сегмента, которая происходит во время экссудативной AMD, являются лазерная фотокоагуляционная или фотодинамическая терапии при помощи Visudyne®; обе терапии включают окклюзию затронутой сосудистой сети, результатом которой является локализованное индуцированное лазером повреждение сетчатки. Хирургические вмешательства с витрэктомией и удалением мембраны являются единственными вариантами, доступными в настоящее время для пациентов с пролиферативной диабетической ретинопатией. Не существует абсолютного фармакологического лечения, одобренного для применения против NV заднего сегмента, хотя некоторые разные соединения испытываются клинически, включая, например, анекортавацетат (Alcon, Inc.), EYE 001 (Eyetech) и rhuFabV2 (Genentech) для AMD и LY333531 (Lilly) и Fluocinolone (Bausch & Lomb) для диабетического отека желтого пятна.
Кроме изменений в ретинальной микрососудистой системе, вызванных гипергликемией у диабетических пациентов, ведущей к отеку желтого пятна, пролиферация неоваскулярных мембран также связана с протечкой сосудов и отеком сетчатки. Если отек захватывает желтое пятно, то острота зрения ухудшается. При диабетической ретинопатии отек желтого пятна является основной причиной потери зрения. Как и при ангиогенных нарушениях, лазерную фотокоагуляцию применяют для стабилизации или ликвидации отечного состояния. Снижая дальнейшее развитие отека, лазерная фотокоагуляция представляет собой цитодеструктивную процедуру, которая, к сожалению, изменяет поле зрения пораженного глаза.
Эффективная фармакологическая терапия глазной NV и отека, вероятно, обеспечивает существенную эффективность для пациента при многих заболеваниях, избегая при этом агрессивных хирургических или поражающих лазерных процедур. Эффективное лечение NV и отека повышает качество жизни пациента и производительность в обществе. Кроме того, можно существенно снизить социальные издержки, связанные с обеспечением помощи слепым и здравоохранением.
Полагают, что ингибиторы HDAC (соединения) среди прочих применений ингибируют VEGF-индуцированную неоваскуляризацию и, следовательно, полезны для лечения пациентов-людей, страдающих от глазных NV заболеваний или нарушений, таких как диабетическая ретинопатия, хроническая глаукома, отслоение сетчатки, серповидно-клеточная ретинопатия, возрастная дегенерация желтого пятна, покраснение и воспаление радужной оболочки, увеит, новообразования, гетерохромный иридоциклит Фуча (Fuch), неоваскулярная глаукома, неоваскуляризация роговицы, неоваскуляризация в результате объединенной витрэктомии и удаления хрусталика, ретинальная ишемия, хориоидальная сосудистая недостаточность, хориоидальный тромбоз, ишемия сонной артерии, контузионное повреждение глаза, ретинопатия недоношенных, ретинальная закупорка вен, пролиферативная витреоретинопатия, ангиогенез роговицы, ретинальная микроваскулопатия и отек сетчатки (желтого пятна). Они особенно привлекательны тем, что дают низкую токсичность, зависящую от механизма (обзоры по классам соединений, которые действуют как ингибиторы HDAC и исследуются на онкологические применения, смотри: Marks et al., Nature Reviews Cancer, Vol.1: 194-202, 2001; Marks et al., Curr. Opin. Oncol., Vol.13: 477-483, 2001).
Особо предпочтительные ингибиторы HDAC настоящего изобретения включают следующие соединения:
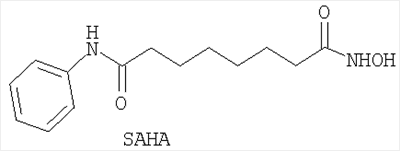 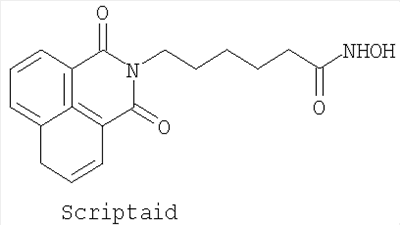
Соединение SAHA может быть синтезировано способами, подробно описанными в исходных ссылках. Соединение Scriptaid доступно коммерчески от Chembridge Corporation, 16981 Via Tazon, Suite G, San Diego, California, USA, 92127.
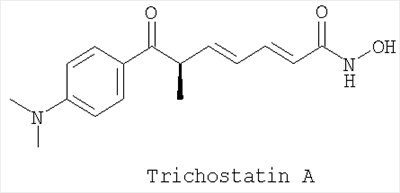
Другое конкретное предпочтительное соединение по настоящему изобретению является следующим:
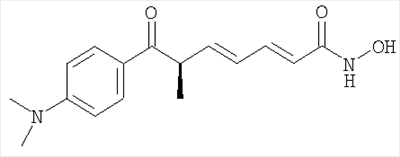
Трихостатин А, коммерчески доступный от Sigma, PO Box 14508, St. Louis, МО, 63178-9916
В область настоящего изобретения включены индивидуальные энантиомеры указанных соединений, а также их рацемические и нерацемические смеси. Как правило, индивидуальные энантиомеры можно обеспечить рядом способов, включая (но, не ограничиваясь этим): энантиоселективный синтез из подходящего энантиомерно чистого или обогащенного исходного материала; синтез из рацемических/нерацемических или ахиральных исходных материалов, применяя хиральный реагент, катализатор, растворитель et al. (см., например: Asymmetric Synthesis, J.D. Morrison and J.W. Scott, Eds. Academic Press Publishers, (New York) 1985), volumes 1-5; Principles of Asymmetric Synthesis, R.E. Gawley и J. Aube, Eds.; Elsevier Publishers (Amsterdam 1996)); и выделение из рацемических и нерацемических смесей рядом известных способов, 10 например, очисткой образца методом хиральной ВЭЖХ (A Practical Guide to Chiral Separations by HPLC, G. Subramanian, Ed., VCH Publishers, (New York 1994); Chiral Separations by HPLC, A.M.Krstulovic, Ed., Ellis Horwood Ltd. Publishers (1989)) или энантиоселективного гидролиза образцов эфиров карбоновых кислот с применением фермента (Ohno, M.; Otsuka, M., Organic Reactions, 37: 1 (1989)). Специалисты в данной области понимают, что рацемические и нерацемические смеси можно получить несколькими способами, включая (но не ограничиваясь этим) неэнантиоселективный синтез, частичное разделение или даже смешивание образцов, имеющих разные энантиомерные отношения. В рамках притязаний формулы изобретения можно отступить от подобных деталей, не отходя от принципов данного изобретения и не жертвуя его преимуществами. В притязания настоящего изобретения включены индивидуальные изомеры, по существу не содержащие соответствующих энантиомеров.
Настоящее изобретение касается также композиций, содержащих данные соединения, и способов их применения. Согласно способам настоящего изобретения композицию для локального введения, содержащую одно из указанных соединений и фармацевтически приемлемый носитель, вводят нуждающимся в этом млекопитающим. Данные композиции готовят в соответствии с известными в данной области способами для конкретного желательного способа введения.
Соединения настоящего изобретения можно вводить локально. Локальное введение при глазном применении включает местное введение, введение в стекловидное тело, окологлазное, транссклеральное, ретробульбарное, субтеноновое или при помощи внутриглазного устройства. Предпочтительное введение зависит от типа подлежащего лечению глазного неоваскулярного нарушения.
Композиции, применяемые согласно настоящему изобретению, содержат фармацевтически эффективное количество одного или нескольких соединений. Используемое здесь выражение “фармацевтически эффективное количество” обозначает количество, которое достаточно для снижения или предотвращения NV.
Следующие офтальмологические препараты для местного введения полезны согласно настоящему изобретению при введении 1-4 раза в день в соответствии с указанием клинициста.
ПРИМЕР 1
| Ингредиенты |
Количество (мас.%) |
| Соединение, в частности SAHA |
0,01-2% |
| Гидроксипропилметилцеллюлоза |
0,5% |
| Двухосновный фосфат натрия (безводный) |
0,2% |
| Хлорид натрия |
0,5% |
| Динатрий ЭДТА (динатрийэдетат) |
0,01% |
| Полисорбат 80 |
0,05% |
| Бензалконийхлорид |
0,01% |
| Гидроксид натрия/соляная кислота |
рН до 7,3-7,4 |
| Очищенная вода |
до 100% |
ПРИМЕР 2
| Ингредиенты |
Количество (мас.%) |
| Соединение, в частности SAHA |
0,01-2% |
| Метилцеллюлоза |
4,0% |
| Двухосновный фосфат натрия (безводный) |
0,2% |
| Хлорид натрия |
0,5% |
| Динатрий ЭДТА (динатрийэдетат) |
0,01% |
| Полисорбат 80 |
0,05% |
| Бензалконийхлорид |
0,01% |
| Гидроксид натрия/соляная кислота |
рН до 7,3-7,4 |
| Очищенная вода |
до 100% |
ПРИМЕР 3
| Ингредиенты |
Количество (мас.%) |
| Соединение, в частности SAHA |
0,01-2% |
| Гуаровая смола |
0,4-6,0% |
| Двухосновный фосфат натрия (безводный) |
0,2% |
| Хлорид натрия |
0,5% |
| Динатрий ЭДТА (динатрийэдетат) |
0,01% |
| Полисорбат 80 |
0,05% |
| Бензалконийхлорид |
0,01% |
| Гидроксид натрия/соляная кислота |
рН до 7,3-7,4 |
| Очищенная вода |
до 100% |
ПРИМЕР 4
| Ингредиенты |
Количество (мас.%) |
| Соединение, в частности SAHA |
0,01-2% |
| Вазелин, минеральное масло и ланолин |
Консистенция мази |
| Двухосновный фосфат натрия (безводный) |
0,2% |
| Хлорид натрия |
0,5% |
| Динатрий ЭДТА (динатрийэдетат) |
0,01% |
| Полисорбат 80 |
0,05% |
| Бензалконийхлорид |
0,01% |
| Гидроксид натрия/соляная кислота |
рН до 7,3-7,4 |
ПРИМЕР 5
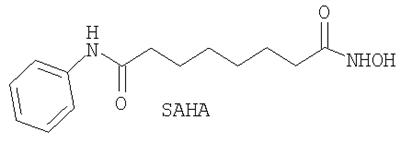
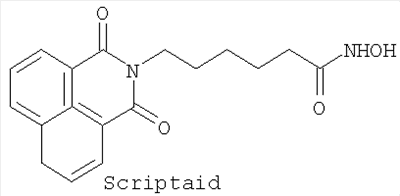
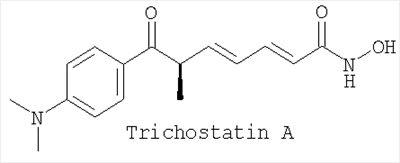
Сравнительная оценка субероиланилидгидроксамовой кислоты (SAHA), трихостатина A (Trichostatin A), и скриптаида (Scriptaid) при VEGF-индуцированной пролиферации эндотелиальных клеток сетчатки коровы/анализ продолжительности жизни.
На модели глазного ангиогенеза in vitro была изучена активность следующих ингибиторов гистондеацетилазы (HDACi) по настоящему изобретению: SAHA (САЗ  = 149647-78-9); Trichostatin A (CAS = 149647-78-9); Trichostatin A (CAS  = 58880-19-6); Scriptaid (CAS = 58880-19-6); Scriptaid (CAS  = 287383-59-9). = 287383-59-9).
На данной модели добавление VEGF в клеточную среду ингибировало задержку смерти/роста эндотелиальных клеток сетчатки коровы (BREC), индуцированную не включением сыворотки. Вещества, изменяющие в противоположную сторону этот VEGF-эффект, являются сильными антиангиогенными средствами.
Химические структуры соединений
Способ. Эндотелиальные клетки сетчатки коровы (BREC) (VEC Technologies) были выращены на покрытом фибронектином (50 мк/г) пластичном материале при 37°С и 5% CO2 в MCDB-131 полная среда (VEC Technologies). В случае, если требовались условия свободной от сыворотки среды (SFM), использовался MCDB-131, дополненный 5 мл/500 мл с 100Х антибиотик/противогрибковым средством, 10 мМ L-глутамином, и 0.1% BSA (все взято в Life Technologies).
Эндотелиальные клетки сетчатки коровы засевали по 8,000 клетка/лунка и оставляли для прикрепления и роста на 24 ч в полной среде (10% фетальной коровьей сыворотки) в объеме 0,2 мл/лунка. Фактор эндотелиального сосудистого роста (VEGF; R&D Systems, 25 нг/мл, лот II 164041) применялся с и без SAHA, Trichostatin А, и Scriptaid (1.0-1000 нМ) в SFM (0.1 мл/лунка) в начале последнего 24 часового интервала. Контрольные клетки находились в SFM без VEGF. Все лунки содержали 0,1% раствор диметилсульфоксида (DMSO) в течение последних 24 часов. Для каждого состояния использовалось 6 лунок.
К концу третьего дня относительное количество живых клеток в каждой группе лечения определяли с помощью набора Promega 96 для нерадиоактивного исследования. Как указывает производитель, 20 мкл смеси 20 частей MTS и одной части PMS, компоненты набора для исследования были добавлены в каждую лунку. Планшеты возвращали на три часа в инкубатор.
Фактическая оптическая плотность при 492 нм, полученная путем вычитания среднего значения пустой кюветы, фиксировалась и использовалась как величина живых клеток. Исследование проводилось три раза. Значения оптических плотностей стандартизовали, чтобы контрольное (-VEGF) среднее значение было эквивалентно 100% и данные трех исследований были объединены.
Результаты суммированы в таблице ниже.
Таблица
Ингибирование VEGF-индуцированной пролиферации/продолжительности жизни эндотелиальных клеток сетчатки коровы в среде без сыворотки. |
| Вещество |
Доза |
Количество клеток как процент контроля |
| нет |
– |
Определено как 100% |
| VEGF |
25 нг/мл |
176%a |
| VEGF + SAHA |
25 нг/мл + 1 нМ |
155% |
| VEGF + SAHA |
25 нг/мл + 10 нМ |
141%b |
| VEGF + SAHA |
25 нг/мл + 100 нМ |
155% |
| VEGF + SAHA |
25 нг/мл + 1000 нМ |
122%b |
| VEGF + Trichostatin A |
25 нг/мл + 1 нМ |
130%b |
| VEGF + Trichostatin A |
25 нг/мл + 10 нМ |
138%b |
| VEGF + Trichostatin A |
25 нг/мл + 100 нМ |
127%b |
| VEGF + Trichostatin A |
25 нг/мл + 1000 нМ |
127%b |
| VEGF + Scriptaid |
25 нг/мл + 1 нМ |
146%b |
| VEGF + Scriptaid |
25 нг/мл + 10 нМ |
162% |
| VEGF + Scriptaid |
25 нг/мл + 100 нМ |
160% |
| VEGF + Scriptaid |
25 нг/мл + 1000 нМ |
130%b |
aБольше чем контроль (нет VEGF) (р<0.0001, ANOVA).
bМеньше чем только с VEGF (p<0.01, ANOVA). |
В исследовании пролиферация/продолжительность жизни действие только VEGF приводило к большему числу живых клеток по сравнению с контролем, а три ингибитора HDAC обеспечивали частичное ингибирование этого VEGF-индуцированного эффекта. Токсичности обнаружено не было.
Данное изобретение описано со ссылкой на некоторые предпочтительные варианты, однако следует понимать, что его можно осуществить с применением других частных форм или вариаций, не отклоняясь от особых или существенных характеристик. Таким образом, описанные выше варианты считаются иллюстративными во всех отношениях, при этом объем данного изобретения определяется приложенной формулой изобретения, а не предшествующим описанием.
Формула изобретения
Применение производного гидроксамовой кислоты, выбранного из субероиланилидгидроксамовой кислоты (SAHA), трихостатинаА (TrichostatinA) и/или скриптаида (Scriptaid), представленных следующими структурами:
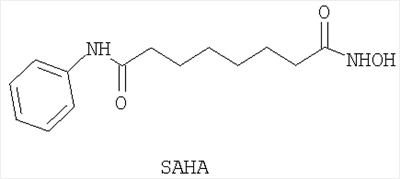 ; ; 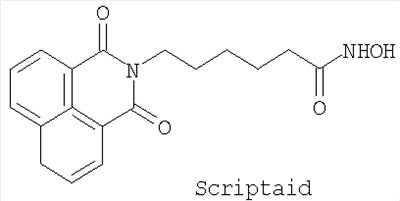 ; ;
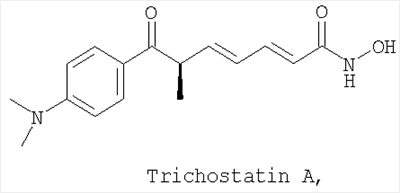
для ингибирования VEGF-индуцированной неоваскуляризации сетчатки.
|
|