|
|
(21), (22) Заявка: 2007140126/13, 29.10.2007
(24) Дата начала отсчета срока действия патента:
29.10.2007
(46) Опубликовано: 20.04.2009
(56) Список документов, цитированных в отчете о
поиске:
RU 2135173 С1, 27.08.1999. RU 2138260 С1, 27.09.1999. RU 2168983 С2, 20.06.2001. SU 150749 А1, 01.01.1962. SU 263807 А1, 05.11.1977.
Адрес для переписки:
305035, г.Курск, ул. Пирогова, 12б, И.Н. Медведеву
|
(72) Автор(ы):
Медведев Илья Николаевич (RU),
Краснова Евгения Геннадиевна (RU),
Завалишина Светлана Юрьевна (RU),
Беспарточный Борис Дмитриевич (RU)
(73) Патентообладатель(и):
Медведев Илья Николаевич (RU),
Беспарточный Борис Дмитриевич (RU)
|
(54) СПОСОБ КОРРЕКЦИИ ОСЛАБЛЕНИЯ ФУНКЦИЙ СТЕНКИ СОСУДОВ У НОВОРОЖДЕННЫХ ПОРОСЯТ С АНЕМИЕЙ
(57) Реферат:
Изобретение относится к области ветеринарии. Способ заключается в том, что вводят ферроглюкин по 150 мг (2 мл) внутримышечно, двукратно с интервалом 10 дней. Также вводят фоспренил внутримышечно, троекратно в разных шприцах в разные точки, первый раз 0,08 мл/кг одновременно с введением ферроглюкина. Второй раз фоспренил вводят в дозе 0,07 мл/кг через пять дней после первой инъекции ферроглюкина, и третий раз – в дозе 0,06 мл/кг одновременно со второй инъекцией ферроглюкина. Дополнительно вводят гамавит в дозе 0,015 мл/кг внутримышечно один раз в день в течение восьми дней, начиная с первой инъекции ферроглюкина. Способ позволяет сократить падеж у поросят, оздоровить стадо, профилактировать ослабление организма животных, увеличить привесы и получать в последующем от этих животных здоровое потомство. 1 табл., 1 ил.
Изобретение относится к ветеринарии и биологии, а именно к ангиологии.
Аналогов предлагаемого способа коррекции ослабления функций стенки сосудов у новорожденных поросят с анемией не существует.
В литературе имеются сведения о применении при анемии у поросят ферроглюкина (Внутренние незаразные болезни сельскохозяйственных животных. Под ред. В.М.Данилевского. М.: «Агропромиздат», 1991. – 576 с.).
 4. – с.13-15). 4. – с.13-15).
Однако никогда ранее лечебный комплекс, состоящий из ферроглюкина, фоспренила и гамавита, не применялся у новорожденных поросят с анемией с целью коррекции у них вазопатии.
Целью изобретения является коррекция ослабления функций стенки сосудов у новорожденных поросят с анемией.
Сущность заявляемого способа заключается в том, что для коррекции ослабления функций стенки сосудов новорожденным поросятам с анемией назначается ферроглюкин по 150 мг (2 мл) внутримышечно, двоекратно с интервалом 10 дней, фоспренил внутримышечно, троекратно в разных шприцах в разные точки, первый раз 0,08 мл/кг одновременно с препаратом железа, второй раз в дозе 0,07 мл/кг через пять дней после первой инъекции ферроглюкина, третий раз в дозе 0,06 мл/кг одновременно со второй инъекцией ферроглюкина и гамавит 0,015 мл/кг внутримышечно один раз в день, восемь дней, начиная с первой инъекции ферроглюкина.
Способ позволяет корректировать ослабление функций стенки сосудов у новорожденных поросят с анемией через 5 дней после завершения лечения. При соблюдении рекомендаций заявляемого способа возможна нормализация функций сосудистой стенки, что позволит существенно оздоровить поголовье поросят, увеличить привесы, снизить падеж и получать в последующем от этих животных здоровое потомство.
Заявляемый способ осуществляется следующим образом.
Для диагностики ослабления функций стенки сосудов новорожденным поросятам с анемией проводится следующее обследование.
 6. – С.17-20). В основе этого метода лежит вычисление степени торможения агрегации тромбоцитов в плазме, полученной из крови после временной венозной окклюзии. 6. – С.17-20). В основе этого метода лежит вычисление степени торможения агрегации тромбоцитов в плазме, полученной из крови после временной венозной окклюзии.
На сосуд, из которой еще не производился забор крови, накладывается манжетка сфигмоманометра и создается давление на 10 мм рт.ст. выше систолического. Через 3 минуты производится взятие 9 мл крови в 1 мл 3,8% раствора цитрата натрия. Ее немедленно центрифугируют 5 минут при 1000 об/мин для получения богатой тромбоцитами плазмы. Плазму отсасывают пипеткой и сразу же помещают в тающий лед, где хранят до начала исследований. Повторно пробу центрифугируют 20 минут при 3000 об/мин для получения бестромбоцитной плазмы (БТП). После подсчета количества тромбоцитов в богатой тромбоцитами плазме, полученной до венозного застоя (подробно описано ниже), ее разводят бедной тромбоцитами плазмой (БеТП), взятой до (1 проба) и после (2 проба) венозного застоя до концентрации 200000 тромбоцитов/мкл. Полученную смесь встряхивают и инкубируют 10 минут при 20-22°С. Затем проводят агрегацию тромбоцитов (AT) с коллагеном (разведение 1:2 основной суспензии) на стекле следующим способом (Шитикова А.С. В кн.: Гемостаз. Физиологические механизмы, принципы диагностики основных форм геморрагических заболеваний. Под ред. Н.Н.Петрищева, Л.П.Папаян. СПб., 1999. С.49-52).
Кровь забирают с цитратом натрия 3,8% в соотношении 9:1, центрифугируют 5 мин при 1000 об/мин для получения богатой тромбоцитами плазмы. Часть плазмы отбирают, а оставшуюся центрифугируют при 3000 об/мин, в течение 20 мин, получая БеТП. БТП стандартизируют по числу тромбоцитов путем разбавления исходной БТП аутологичным образцом БеТП (полученной до венозного застоя – 1-я проба или после него – 2-я проба) до 200·109/л. Концентрация кровяных пластинок в исходной БТП подсчитывается в камере Горяева (в 50 больших квадратах). Объемы смешиваемых БТП и БеТП определяют по формуле:
VБеТП=VБТП·[(N/200000)-1],
где VБеТП – объем бедной тромбоцитами плазмы,
VБТП – объем богатой тромбоцитами плазмы,
N – счетная концентрация тромбоцитов в исходной БТП (клеток/мкл).
Из отобранного объема стандартизированной плазмы на предметное стекло наносят 0,02 мл плазмы и другой пипеткой 0,02 мл р-ра индуктора коллагена в стандартной концентрации (разведение 1:2 основной суспензии). Стеклянной палочкой смешивают плазму с индукторами и включают секундомер. Смесь перемешивают так, чтобы жидкость занимала окружность диаметром около 2 см.
Покачивая стекло круговыми движениями в проходящем свете осветителя, на черном фоне следят через лупу за возникновением агрегатов. При появлении отчетливых агрегатов, просветлении раствора и прилипании части агрегатов к стеклу секундомер отключают, фиксируя время агрегации тромбоцитов.
Реакцию повторяют по 2-3 раза в 1-й и 2-й пробе, находя для каждой из них среднее арифметическое значение.
По степени торможения агрегации тромбоцитов после венозного застоя судят об антиагрегационной активности плазмы крови, обусловленной поступлением в кровоток простациклина из сосудистой стенки. Индекс антиагрегационной активности сосудистой стенки (ИААСС) при исследовании AT на стекле рассчитывали по формуле:
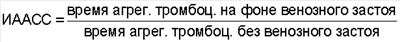
Нормальными значениями для коллагена можно считать ИААСС 1,45-1,50.
Определение антитромбогенных свойств сосудистой стенки, зависящих от продукции веществ, активирующих антитромбин III, оценивая его базальный уровнь до- и после временной дозированной ишемии стенки вены, приведены ниже (Баркаган З.С., Момот А.П. Основы диагностики нарушений гемостаза. М., 1999 – 214 с.).
Принцип метода основан на выявлении снижения активности (в отсутствии гепарина) в плазме антитромбина III (AT III), которую определяют по способности исследуемой плазмы инактивировать тромбин, для чего ее предварительно обрабатывают сорбентом гепарина, затем подвергают тепловой дефибринации и смешивают со стандартным количеством тромбина. После инкубации смеси в ней определяют остаточную коагуляционную активность тромбина. По уровню снижения активности тромбина в процентах от нормы оценивают активность AT III в исследуемой плазме.
Используются следующие реактивы. 1. Трис-HCl буфер 0,05 М, рН 7,4. 2. Раствор тромбина в буфере: 0,2 мл раствора должны свертывать 0,3 мл 0,4% раствора фибриногена за 15-16 сек. Рабочий раствор тромбина готовят в пластиковой или силиконированной пробирке, хранят при комнатной температуре и используют в тесте в день исследования. 3. Сорбент гепарина Гепасорб-1 (фирма “Технология-Стандарт”). 4. Свежеприготовленный раствор фибриногена в концентрации 3,5-4,0 г/л, который применяют для тестирования остаточной активности тромбина. Допускается замена раствора фибриногена нормальной бедной тромбоцитами цитратной плазмой, разведенной буфером в 2 раза. 5. Свежая нитратная бедная тромбоцитами плазма, полученная от 6-8 здоровых поросят, или лиофилизированная фирменная, с известной активностью AT III, которую используют для построения калибровочного графика.
Материалом для исследования служит цитратная бедная тромбоцитами плазма.
Для приготовления сорбированной и дефибринированной плазмы в пробирке смешивают 10 мг сорбента гепарина с 1,0 мл исследуемой плазмы. Постоянно встряхивая пробирку, перемешивают ее содержимое при комнатной температуре в течение 8 мин, исключая образование пены и осадка на ее дне. После этого смесь центрифугируют в течение 2 мин при 1000-1500 об/мин. Плазму в надосадке переносят в чистую пробирку и дефибринируют на водяной бане при +56°С в течение 6 мин, после чего вновь центрифугируют при 3000 об/мин в течение 10 мин, снимают надосадочную часть и исследуют в течение первых 2 ч.
Ход определения. В пробирку вносят 0,4 мл рабочего раствора тромбина и прогревают его на водяной бане при +37°С в течение 2 мин. Затем добавляют 0,1 мл исследуемой адсорбированной и дефибринированной плазмы, включают секундомер. Через 2 мин (точно!) 0,2 мл смеси переносят в пробирку с 0,3 мл раствора фибриногена (или разведенной нормальной плазмы), предварительно подогретой до +37°С. Немедленно включают секундомер и регистрируют время свертывания.
По калибровочной кривой находят активность AT III в процентах.
Построение калибровочной кривой проводят следующим образом. Плазму здоровых людей подвергают дефибринированию, как указано выше. Затем из нее готовят разведения для построения калибровочной кривой в соответствии с табл.1.
| Таблица 1 |
| Схема приготовления разведений плазмы для построения калибровочной кривой при определении активности АТ III |
| Номер разведения |
Плазма + буфер |
активность АТ III,% |
1
2
3 |
Плазма без буфера
0,2 мл + 0,2мл
0,1мл + 0,3мл |
100
50
25 |
С каждым из разведений определяют время свертывания по указанной выше методике. Все измерения проводят трижды, рассчитывают средний результат. При построении калибровочной кривой по логарифмической оси ординат откладывают время свертывания в секундах, по оси абсцисс – активность AT III в % в соответствии с указанными выше разведениями. Примерная калибровочная кривая приведена на чертеже.
Калибровочную кривую для одного типа и одной серии тромбина и буфера строят однократно. Периодически контролируют лишь активность рабочего раствора тромбина.
В норме без венозной окклюзии активность AT III составляет 85-115%. При взятии крови после временной венозной окклюзии, как описано в методе по оценке антиагрегационной активности сосудов, и определении в ней AT III возможно косвенно оценить уровень синтеза в стенке сосуда тканевых активаторов AT III. На фоне временной венозной окклюзии активность AT III повышается и находится в границах 120-143%. Рассчитывается индекс синтеза активаторов AT III в сосудах (ИСААС) путем деления величины активности AT III на фоне венозной окклюзии на величину AT III без нее. В норме он равен 1,20-1,40.
Активность синтеза тканевых активаторов плазминогена по времени лизиса эуглобулинового сгустка до- и после временной венозной окклюзии оценивали следующим образом.
Принцип метода заключается в осаждении эуглобулиновой фракции плазмы, при этом основные ингибиторы фибринолиза, в частоности  2-антиплазмином, остаются в надосадочной части и удаляются. Поэтому эуглобулиновый лизис отражает активность фибринолиза в условиях исключения ингибирующего действия антиплазминов. Его скорость отражает, в основном, количество плазминогена в плазме и степень его активации. Определяют время спонтанного лизиса сгустка, получаемого из эуглобулиновой фракции плазмы при добавлении к ней раствора хлорида кальция. 2-антиплазмином, остаются в надосадочной части и удаляются. Поэтому эуглобулиновый лизис отражает активность фибринолиза в условиях исключения ингибирующего действия антиплазминов. Его скорость отражает, в основном, количество плазминогена в плазме и степень его активации. Определяют время спонтанного лизиса сгустка, получаемого из эуглобулиновой фракции плазмы при добавлении к ней раствора хлорида кальция.
Используются следующие реактивы 1. 1% раствор уксусной кислоты. 2. 0,277% раствор хлорида кальция. 3. Буфер Михаэлиса или трис-НС буфер, 0.05 М, рН 7,3-7,4.
Материалом для исследования служит цитратная бедная тромбоцитами плазма до и после временной венозной окклюзии. Ход определения. Для получения эуглобулиновой фракции к 8,0 мл дистиллированной воды добавляют 0,15 мл 1% уксусной кислоты и 0,5 мл исследуемой плазмы. После 30-минутного охлаждения смеси в холодильнике при +2-8°С эуглобулины осаждают центрифугированием при 1500 об/мин в течение 7 мин. Надосадочную жидкость сливают, пробирку осушают опрокидыванием на фильтровальную бумагу. Осадок эуглобулинов разводят в 0,5 мл буфера и помещают на водяную баню (+37°С). Затем, не вынимая пробирку из бани, добавляют 0,5 мл раствора хлорида кальция, осторожно перемешивают покачиванием пробирки (не встряхивая!), включают секундомер и инкубируют на водяной бане при +37°С. Регистрируют время с момента добавления хлорида кальция до полного растворения сгустка.
Результат выражают в минутах. В норме время спонтанного лизиса эуглобулинового сгустка составляет 180-240 мин. После временной венозной окклюзии время лизиса снижается, находясь в границах 126-170 мин. При делении величины длительности спонтанного лизиса эуглобулинового сгустка до окклюзии на величину после рассчитан индекс фибринолитической активности сосудистой стенки (ИФАСС), в норме равный 1,35-1,45.
Для каждой лаборатории необходимо обследование группы здоровых новорожденных поросят, чтобы найти средние нормативные значения с расчетом S2 по всем трем методикам для последующих расчетов.
По каждой методике у каждого новорожденного поросенка с анемией для большей точности диагностики проводят тест 3-4 раза с вычислением среднеарифметических значений, которые используют в последующих расчетах и вычислении S2.
Для определения весомости отдельных исследуемых параметров у сосудистых больных поросят и вычисления у них общего антитромботического потенциала сосудов применялся системный многофакторный анализ, позволяющий переводить многомерные количественные характеристики исследуемого процесса с несопоставимыми абсолютными значениями в сопоставимые относительные величины (Применение методов морфометрии и статистического анализа в морфологических исследованиях. Сост. М.В.Углова, Б.А.Углов, В.В.Архипов и др., Куйбышев, 1982. – 47 с.). Расчет производился по формулам:
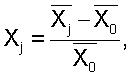
где Xj – исследуемый параметр, X0 – нормативный параметр, Xj – относительная разность.
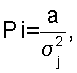
где Pi – весовой коэффициент (коэффициент влияния), а – постоянный множитель (в наших исследованиях а=0,1), 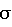 j – среднеквадратическое отклонение значения Xj в относительных единицах. j – среднеквадратическое отклонение значения Xj в относительных единицах.
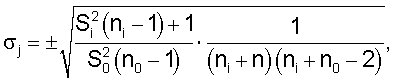
где Si 2 – дисперсия исследуемого параметра Xi, ni – количество наблюдений при определении Хi, S0 2 – дисперсия исследуемого параметра Xi, ni – количество наблюдений при определении Хi, S0 2 – дисперсия нормативного параметра X0, n0 – количество наблюдений при определении Х0. 2 – дисперсия нормативного параметра X0, n0 – количество наблюдений при определении Х0.
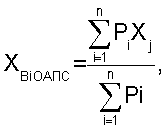
где XBi ОАПС – величина, интегрально характеризующая исследуемый процесс в заданный срок (в относительных единицах), является общим антитромботическим потенциалом сосудов (ОАПС).
Сочетанное применение описанных методов с последующей обработкой полученных значений ИААСС, ИСААС и ИФАСС системным многофакторным анализом с определением общего антитромботического потенциала сосудов (XBi ОАПС) – норма 0,180 и выше, позволяет выявлять у новорожденных поросят риск развития ослабления антитромботической активности сосудов (XBi ОАПС от 0,179 до 0,060), что требует нормализации кормления и содержания животных и назначение ферроглюкина и ежемесячного контроля состояния сосудистых функций. При значении XBi ОАПС от 0,059 и ниже – необходимо немедленно проводить лечение новорожденных поросят согласно заявленному способу.
Для коррекции ослабления функций стенки сосудов новорожденным поросятам с анемией назначается ферроглюкин по 150 мг (2 мл) внутримышечно, двоекратно с интервалом 10 дней, фоспренил внутримышечно, троекратно в разных шприцах в разные точки, первый раз 0,08 мл/кг одновременно с препаратом железа, второй раз в дозе 0,07 мл/кг через пять дней после первой инъекции ферроглюкина, третий раз в дозе 0,06 мл/кг одновременно со второй инъекцией ферроглюкина и гамавит 0,015 мл/кг внутримышечно один раз в день, восемь дней, начиная с первой инъекции ферроглюкина.
Внедрение данного способа коррекции функций стенки сосудов у новорожденных поросят с анемией в практику свиноводческих хозяйств позволит решить ряд насущных ветеринарных и экономических проблем современности. Эффективная коррекция у новорожденных поросят с анемией позволит сократить падеж у поросят, оздоровить стадо, профилактировать ослабление организма животных, увеличить привесы и получать в последующем от этих животных здоровое потомство.
Пример. У новорожденного поросенка  26 с анемией было выявлено нарушение эритропоэза и признаками снижения уровня содержания железа в его организме (сывороточное железо 12,8 мкмоль/л, сидероциты 1,0%, при количестве гемоглобина у него 83,0 г/л, эритроцитов – 4,03×1012/л. 26 с анемией было выявлено нарушение эритропоэза и признаками снижения уровня содержания железа в его организме (сывороточное железо 12,8 мкмоль/л, сидероциты 1,0%, при количестве гемоглобина у него 83,0 г/л, эритроцитов – 4,03×1012/л.
Поросенок был обследован в условиях свинарника по поводу клиники анемии. У поросенка была взята кровь и исследована по изложенной выше схеме с оценкой ИААСС, ИСААС и ИФАСС и вычислением общего антитромботического потенциала сосудов.
У животного были выявлены выраженные признаки угнетения антитромботической функции сосудистой стенки. ИААСС составлял – 1,07, ИСААС 1,10 и ИФАСС 1,14. Общий антитромботический потенциал сосудов составил XBi ОАПС = 0,055.
Поросенку было назначено лечение: ферроглюкин по 150 мг (2 мл) внутримышечно, двоекратно с интервалом 10 дней, фоспренил внутримышечно, троекратно в разных шприцах в разные точки, первый раз 0,08 мл/кг одновременно с препаратом железа, второй раз в дозе 0,07 мл/кг через пять дней после первой инъекции ферроглюкина, третий раз в дозе 0,06 мл/кг одновременно со второй инъекцией ферроглюкина и гамавит 0,015 мл/кг внутримышечно один раз в день, восемь дней, начиная с первой инъекции ферроглюкина.
Через 5 дней после завершения лечения признаки анемии купировались – сывороточное железо 19,9 мкмоль/л, сидероциты 7,9%, при количестве гемоглобина у него 119,6 г/л, эритроцитов – 4,97×1012/л), ИААСС составлял – 1,50, ИСААС 1,37 и ИФАСС 1,42, отмечена нормализация значения общего антитромботического потенциала сосудов (XBi ОАПС = 0,182). Дальнейшее наблюдение за данным поросенком не выявило отклонений от нормы в последующем, а исследованные параметры антитромботической активности сосудов оставались в нормальных границах.
Использование предлагаемого способа коррекции ослабления функций стенки сосудов у новорожденных поросят с анемией в свиноводстве поможет избежать нарушений у них микроциркуляции и трофики тканей, замедления роста и развития животных, сосудистых осложнений, оздоровить поголовье, оптимизировать привесы и своевременно получать достаточный объем мясной продукции.
Формула изобретения
Способ коррекции ослабления функций стенки сосудов у новорожденных поросят с анемией, отличающийся тем, что вводят ферроглюкин по 150 мг (2 мл) внутримышечно, двукратно с интервалом 10 дней, фоспренил внутримышечно, троекратно в разных шприцах в разные точки, первый раз 0,08 мл/кг одновременно с введением ферроглюкина, второй раз в дозе 0,07 мл/кг через пять дней после первой инъекции ферроглюкина, третий раз в дозе 0,06 мл/кг одновременно со второй инъекцией ферроглюкина, и дополнительно вводят гамавит в дозе 0,015 мл/кг внутримышечно один раз в день в течение восьми дней, начиная с первой инъекции ферроглюкина.
РИСУНКИ
|
|