|
(21), (22) Заявка: 2006144794/12, 15.12.2006
(24) Дата начала отсчета срока действия патента:
15.12.2006
(43) Дата публикации заявки: 20.06.2008
(46) Опубликовано: 20.04.2009
(56) Список документов, цитированных в отчете о
поиске:
RU 2081553 С1, 20.06.1997. RU 2067303 С1, 27.09.1996. SU 1554816 А1, 07.04.1990. SU 1655348 А1, 15.06.1991. SU 706771 А, 30.12.1979.
Адрес для переписки:
194156, Санкт-Петербург, пр. Пархоменко, 18, кв.36, С.В. Мурашеву
|
(72) Автор(ы):
Вержук Владимир Григорьевич (RU),
Мурашев Сергей Викторович (RU),
Белова Анна Юрьевна (RU)
(73) Патентообладатель(и):
Вержук Владимир Григорьевич (RU),
Мурашев Сергей Викторович (RU),
Белова Анна Юрьевна (RU)
|
(54) СПОСОБ ОПРЕДЕЛЕНИЯ СТЕПЕНИ ЛЕЖКОСТИ ПЛОДОВ (ВАРИАНТЫ)
(57) Реферат:
Изобретение относится к сельскому хозяйству и может быть использовано для определения долгосрочной, среднесрочной и краткосрочной лежкостей плодов. Способ осуществляют путем отбора проб плодов и проведения биохимического анализа. Производят предварительный анализ степени лежкости контрольных партий, который осуществляют определением величин естественных потерь массы контрольных плодов из каждой контрольной партии в условиях холодильного хранения в течение контрольного временного периода, минимальные величины которых соответствуют долгосрочной лежкости, а максимальные – краткосрочной, определением активности каталазы согласно варианту 1, активности пероксидазы согласно варианту 2, активности полифенолоксидазы согласно варианту 3 в контрольных плодах и сравнением активности каталазы, пероксидазы или полифенолоксидазы в контрольных плодах с величинами естественных потерь массы в контрольных плодах. Затем производят последующий анализ степени лежкости поступающих партий, который осуществляют определением активности каталазы, пероксидазы или полифенолоксидазы в контрольных плодах этих партий и использованием соответствий предварительного анализа. При этом контрольные партии и поступающие партии относятся к одному временному сбору. Изобретение позволяет получить наглядную и точную оценку пригодности плодов к хранению, а использование активностей каталазы, пероксидазы или полифенолоксидазы расширяет возможности осуществления способа. 3 н.п. ф-лы, 8 табл., 3 ил.
Изобретение относится к сельскому хозяйству и может быть использовано для определения долгосрочной, среднесрочной и краткосрочной лежкостей плодов.
Известны изменения в растительных тканях, в том числе в плодах, в зависимости от активности ферментов в них, С.С. Медведев «Физиология растений»: изд. Санкт-Петербургского университета, с.103, 2004.
Известен способ определения локализации пероксидазы в сочной растительной ткани, RU  2067303 C1, G01N 33/50, C12Q 1/28, 27.09.1996. 2067303 C1, G01N 33/50, C12Q 1/28, 27.09.1996.
Известен способ прогнозирования сроков съема плодов, осуществляющийся путем отбора проб плодов и проведения биохимического анализа, RU  2081553 C1, A01G 1/00, A01H 1/04, 20.06.1997. 2081553 C1, A01G 1/00, A01H 1/04, 20.06.1997.
Данное техническое решение принято в качестве ближайшего аналога настоящего изобретения.
В ближайшем аналоге проводят биохимический анализ на выделение этилена плодами, определение их готовности для съема и закладки на хранение, при этом степень лежкости прогнозируется в период их созревания, измерения проводят систематически с интервалом в несколько дней, что осложняет процесс осуществления способа.
В основу настоящего изобретения положено решение задачи, позволяющей определить пригодность плодов к хранению, повысить точность и наглядность для определения степени лежкости при прогнозировании и расширить возможности осуществления способа.
Согласно изобретению эта задача решается за счет того, что способ определения степени лежкости плодов осуществляют путем отбора проб плодов и проведения биохимического анализа.
ВАРИАНТ 1
Способ включает предварительный анализ степени лежкости контрольных партий, который осуществляют определением величин естественных потерь массы контрольных плодов из каждой контрольной партии в условиях холодильного хранения в течение контрольного временного периода, минимальные величины которых соответствуют долгосрочной лежкости, а максимальные – краткосрочной, определением активности каталазы в контрольных плодах и сравнением активности каталазы в контрольных плодах с величинами естественных потерь массы в контрольных плодах, и последующий анализ степени лежкости поступающих партий, который осуществляют определением активности каталазы в контрольных плодах этих партий и использованием соответствий предварительного анализа, при этом контрольные партии и поступающие партии относятся к одному временному сбору.
ВАРИАНТ2
Способ включает предварительный анализ степени лежкости контрольных партий, который осуществляют определением величин естественных потерь массы контрольных плодов из каждой контрольной партии в условиях холодильного хранения в течение контрольного временного периода, минимальные величины которых соответствуют долгосрочной лежкости, а максимальные – краткосрочной, определением активности каталазы в контрольных плодах и сравнением активности каталазы в контрольных плодах с величинами естественных потерь массы в контрольных плодах, и последующий анализ степени лежкости поступающих партий, который осуществляют определением активности каталазы в контрольных плодах этих партий и использованием соответствий предварительного анализа, при этом контрольные партии и поступающие партии относятся к одному временному сбору.
ВАРИАНТ 3
Способ включает предварительный анализ степени лежкости контрольных партий, который осуществляют определением величин естественных потерь массы контрольных плодов из каждой контрольной партии в условиях холодильного хранения в течение контрольного временного периода, минимальные величины которых соответствуют долгосрочной лежкости, а максимальные – краткосрочной, определением активности полифенолоксидазы в контрольных плодах и сравнением активности полифенолоксидазы в контрольных плодах с величинами естественных потерь массы в контрольных плодах, и последующий анализ степени лежкости поступающих партий, который осуществляют определением активности полифенолоксидазы в контрольных плодах этих партий и использованием соответствий предварительного анализа, при этом контрольные партии и поступающие партии относятся к одному временному сбору.
Заявителем не выявлены источники, содержащие информацию о технических решениях, идентичных настоящему изобретению, что позволяет сделать вывод о его соответствии критерию «новизна».
За счет реализации отличительных признаков изобретения (в совокупности с признаками, указанными в ограничительной части формулы) достигаются важные новые свойства объекта.
Наличие в способе оценки степени лежкости по активности каталазы (Вариант 1), активности пероксидазы (Вариант 2), активности полифенолоксидазы (Вариант 3) позволяет расширить возможности осуществления способа.
Размещение контрольных плодов в условиях холодильного хранения в течение контрольного временного периода, определение величины естественных потерь массы в этих плодах и получение зависимостей их от активности каталазы (Вариант 1), активности пероксидазы (Вариант 2), активности полифенолоксидазы (Вариант 3) позволяет определить пригодность плодов к хранению и повышает наглядность оценки состояния плодов.
Определение долгосрочной, среднесрочной и краткосрочной лежкости позволяет прогнозировать степень лежкости плодов.
Определение степеней лежкости по соответствию или отклонению зависимостей величин естественных потерь массы от активности каталазы (Вариант 1), активности пероксидазы (Вариант 2), активности полифенолоксидазы (Вариант 3) повышает точность прогнозирования.
Заявителю не известны какие-либо публикации, которые содержали бы сведения о влиянии отличительных признаков изобретения на достигаемый технический результат. В связи с этим, по мнению заявителя, можно сделать вывод о соответствии заявляемого технического решения критерию «изобретательский уровень».
Способ по вариантам 1, 2, 3 осуществляют следующим образом.
Берут несколько партий плодов, например семечковых культур, одного сорта или разных сортов, каждые из которых собраны на различных участках, имеют отличия по своим биохимическим свойствам и относятся к одному временному сбору.
Определяют контрольные партии и в каждой из них выбирают произвольно определенное количество контрольных плодов.
Определяют величины естественных потерь массы контрольных плодов в условиях холодильного хранения.
Проводят взвешивание контрольных плодов до холодильного хранения и через определенный непродолжительный интервал времени, например через 2 суток, проводят взвешивание их после холодильного хранения.
Определение величин естественных потерь массы контрольных плодов в условиях холодильного хранения проводят любым известным способом.
Определяют активность ферментов контрольных плодов.
Определение активности каталазы (Вариант 1), активности пероксидазы (Вариант 2), активности полифенолоксидазы (Вариант 3) проводят любым известным способом.
Определяют зависимость величин естественных потерь массы контрольных плодов от активности ферментов в них.
Сравнивают величины естественных потерь массы контрольных плодов в условиях холодильного хранения с активностью каталазы (Вариант 1), активностью пероксидазы (Вариант 2), активностью полифенолоксидазы (Вариант 3) и результаты обрабатывают, например наносят на графики, соответственно графики 1, 2 и 3.
При сравнении зависимостей на графиках 1 (Вариант 1), 2 (Вариант 2) и 3 (Вариант 3) определяют долгосрочную, среднесрочную и краткосрочную степени лежкости плодов.
Для вариантов 1 и 2 определяют:
– долгосрочную лежкость по зависимостям минимальной величины естественных потерь массы от максимальной активности каталазы (Вариант 1) и от максимальной активности пероксидазы (Вариант 2);
– среднесрочную лежкость по зависимостям средней величины естественных потерь массы от средней активности каталазы (Вариант 1) и от средней активности пероксидазы (Вариант 2);
– краткосрочную лежкость по зависимостям максимальной величины естественных потерь массы от минимальной активности каталазы (Вариант 1) и от минимальной активности пероксидазы (Вариант 2).
Для варианта 3 определяют:
– долгосрочную лежкость по зависимости минимальной величины естественных потерь массы от минимальной активности полифенолоксидазы;
– среднесрочную лежкость по зависимости средней величины естественных потерь массы от средней активности полифенолоксидазы;
– краткосрочную лежкость по зависимости максимальной величины естественных потерь массы от максимальной активности полифенолоксидазы.
При отклонении зависимостей активностей каталазы (Вариант 1), пероксидазы (Вариант 2), полифенолоксидазы (Вариант 3) и/или величин естественных потерь массы в этих вариантах степень лежкости плодов корректируют.
Определение степени лежкости плодов в поступающих партиях (при полном соответствии с контрольными партиями) осуществляют согласно полученным зависимостям.
Осуществление способа подтверждают примеры конкретного выполнения.
ВАРИАНТ 1
Пример 1
Берут четыре контрольные партии плодов айвы японской (хеномелес) (2003 г.).
В каждой контрольной партии (из четырех) выбирают 10 контрольных плодов айвы японской.
Определяют величины естественных потерь массы контрольных плодов айвы японской в условиях холодильного хранения.
Проводят первое контрольное взвешивание плодов до холодильного хранения, значение веса (m1) размещают на информационном носителе.
Закладывают на холодильное хранение при температуре от +1°С до +3°С эти 10 контрольных плодов, выдерживают 2 суток и проводят контрольное взвешивание, значение веса размещают на информационном носителе и снова помещают в условия холодильного хранения.
По истечению 2 суток холодильного хранения проводят конечное контрольное взвешивание, значение веса (m2) размещают на информационном носителе.
По результатам первого и конечного контрольных взвешиваний определяют величины естественных потерь массы на 1 кг массы в сутки:
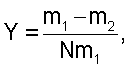
где Y – естественные потери массы в г/(кг·сут);
m1 – масса 10 плодов при первом контрольном взвешивании;
m2 – масса 10 плодов при конечном контрольном взвешивании;
N – количество суток между первым и конечным контрольными взвешиваниями.
Величины естественных потерь массы контрольных плодов айвы японской для четырех контрольных партий в условиях холодильного хранения приведены в таблице 1.
Из таблицы 1 видна динамика величин естественных потерь массы плодов айвы японской.
Определяют активность каталазы контрольных плодов айвы японской.
Берут 10 контрольных плодов айвы японской (до размещения их на холодильное хранение) из каждой контрольной партии, моют, очищают от кожуры, мякоть измельчают.
Определение активности каталазы проводят перманганатометрическим методом.
На весах отбирают пробу массой 10 г. Навеску переносят в ступку, приливают 20 мл дистиллированной воды и тщательно растирают.
После 30 минутной выдержки массу отфильтровывают. К 10 мл чистого фильтрата добавляют 50 мл дистиллированной воды и перемешивают.
Отбирают 4 пробы по 5 мл полученного раствора в конические колбы, добавляют в каждую по 20 мл дистиллированной воды.
Определяют две параллельные пробы, одна из которых – две контрольные колбы, другая – две опытные колбы.
Две контрольные колбы кипятят в течение 3 мин для инактивации ферментов и охлаждают.
В 2 контрольные колбы и в две опытные приливают по 3 мл 1% раствора Н2O2 и выдерживают при комнатной температуре 20 минут. По окончании инкубации к содержимому колб добавляют по 5 мл 10% раствора Н2SO4 и титруют 0,1 N раствором KMnO4 до слабо-розовой окраски, не исчезающей в течение 1 минуты.
Определяют среднее арифметическое из количеств 0,1 N KMnO4, пошедших на титрование контрольных и опытных параллельных проб. По разности между контрольным и опытным титрованием определяют количество разложившейся Н2О2 за время инкубации в расчете на 1 г растительного продукта.
Расчет ведут по формуле:
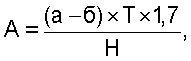
где А – активность фермента (по разложившейся Н2О2), мл;
а – количество 0,1 N KMnO4, израсходованное на контрольное титрование, мл;
б – количество 0,1 N KMnO4, израсходованное на опытное титрование, мл;
Т – поправка к титру 0,1 N KMnO4, Т=1;
1,7 – количество Н2O2, соответствующее каждому мл 0,1 N KMnO4, мл;
Н – навеска растительного материала, г.
Активность каталазы контрольных плодов айвы японской для четырех контрольных партий приведена в таблице 1.
Из таблицы 1 видна динамика активности каталазы плодов айвы японской.
Определяют зависимость величин естественных потерь массы от активности фермента.
Величины естественных потерь массы контрольных плодов айвы японской в условиях холодильного хранения и активность каталазы контрольных плодов айвы японской из таблицы 1 наносят на график 1.
При сравнении на графике 1 зависимостей величин естественных потерь массы от активности каталазы плодов айвы японской определяют степень лежкости плодов.
Из таблицы 1 и графика 1 видно:
– в 1-й контрольной партии минимальной величине естественных потерь массы плодов айвы японской (0,593 г/(кг·сутки)) соответствует максимальная активность каталазы (0,75 мл H2O2);
– во 2-й и 3-й контрольных партиях средним величинам естественных потерь массы плодов айвы японской (0,644 г/(кг·сутки)) и (0,652 г/(кг·сут)) соответствуют средние активности каталаз (0,23 мл Н2O2/г) и (0,27 мл Н2O2/г) соответственно;
– в 4-й контрольной партии максимальной величине естественных потерь массы плодов айвы японской (0,833 г/(кг·сутки)) соответствует минимальная активность каталазы (0,04 мл Н2O2/г).
Определяют:
– долгосрочную лежкость плодов айвы японской 1-й контрольной партии;
– среднесрочную лежкость плодов айвы японской 2-й и 3-й контрольных партий;
– краткосрочную лежкость плодов айвы японской 4-й контрольной партии.
Очевидно, что чем активнее каталаза, тем меньше величина потерь массы при холодильном хранении. Плоды с наиболее активной каталазой имеют долгосрочную лежкость. Плоды с наименее активной каталазой – краткосрочную лежкость. Плоды со средней активностью каталазы обладают среднесрочной лежкостью.
Пример 2
Берут четыре контрольные партии плодов груши (2005 г.).
В каждой контрольной партии (из четырех) выбирают 10 контрольных плодов груши.
Определяют величины естественных потерь массы контрольных плодов груши в условиях холодильного хранения по примеру 1.
Величины естественных потерь массы контрольных плодов груши для четырех контрольных партий в условиях холодильного хранения приведены в таблице 2.
Из таблицы 2 видна динамика величин естественных потерь массы плодов груши.
Определяют активность каталазы контрольных плодов груши.
Берут 10 контрольных плодов груши (до размещения их на холодильное хранение) из каждой контрольной партии, моют, очищают от кожуры, мякоть измельчают.
Определение активности каталазы контрольных плодов груши проводят по примеру 1.
Активность каталазы контрольных плодов груши для четырех контрольных партий приведены в таблице 2.
Из таблицы 2 видна динамика активности каталазы плодов груши.
Определяют зависимость величин естественных потерь массы от активности фермента.
Величины естественных потерь массы контрольных плодов груши в условиях холодильного хранения и активность каталазы контрольных плодов груши из таблицы 2 наносят на график 1.
При сравнении на графике 1 зависимостей величин естественных потерь массы от активности каталазы плодов груши определяют степень лежкости плодов.
Из таблицы 2 и графика 1 видно:
– в 1-й контрольной партии минимальной величине естественных потерь массы плодов груши (0,403 г/(кг·сутки)) соответствует максимальная активность каталазы (0,195 мл Н2O2/г);
– во 2-й контрольной партии средней величине естественных потерь массы плодов груши (0,588 г/(кг·сутки)) соответствует средняя активность каталазы (0,185 мл Н2O2/г);
– в 3-й контрольной партии средней величине естественных потерь массы груши (0,697 г/(кг·сутки)) соответствует минимальная активность каталазы (0,151 мл Н2О2/г);
– в 4-й контрольной партии максимальной величине естественных потерь массы плодов груши (0,780 г/(кг·сутки)) соответствует средняя активность каталазы (0,153 мл Н2O2/г).
Определяют:
– долгосрочную лежкость плодов груши 1-й контрольной партии;
– среднесрочную лежкость плодов груши 2-й контрольной партии;
– среднесрочную лежкость с корректировкой сроков для плодов груши 3-й контрольной партии;
– краткосрочную лежкость с корректировкой сроков для плодов груши 4-й контрольной партии.
При отклонении зависимостей, как в партиях 3 и 4, степень лежкости корректируют.
ВАРИАНТ 2
Пример 3
Берут четыре контрольные партии плодов груши (2005 г.).
В каждой контрольной партии (из четырех) выбирают 10 контрольных плодов груши.
Определяют величины естественных потерь массы контрольных плодов груши в условиях холодильного хранения по примеру 1.
Величины естественных потерь массы контрольных плодов груши для четырех контрольных партий в условиях холодильного хранения приведены в таблице 3.
Из таблицы 3 видна динамика величин естественных потерь массы плодов груши.
Определяют активность пероксидазы плодов груши.
Берут 10 контрольных плодов груши (до размещения их на холодильное хранение) из каждой контрольной партии, моют, очищают от кожуры, мякоть измельчают.
Определение активности пероксидазы плодов груши проводят йодометрическим методом.
На весах отбирают пробу 1 г, растирают в ступке с 20 мл ацетатного буфера (рН=4,7). Экстрагируют в течение 30 минут при комнатной температуре. Гомогенат отфильтровывают.
К 1 мл экстракта приливают 3 мл дистиллированной воды, 2 мл раствора аскорбиновой кислоты (1 мл АК в 1 мл воды), 2 мл 0,02 М раствора пирокатехина и 1 мл 0,1% раствора перекиси водорода. Смесь равномерно встряхивают в течение 2 минут.
Для инактивации фермента приливают 1 мл 10% раствора Н3PO4. Титруют 0,01 Н раствором йода в присутствии растворимого крахмала (1% раствор).
Активность пероксидазы выражают в мл J2, пошедшего на титрование.
Расчет активности пероксидазы ведут по формуле.
А=20·(Vк-Vо)-Х,
где А – активность пероксидазы мл J2/г;
Vк – мл йода, пошедшего на титрование контрольной пробы;
Vo – мл йода, пошедшего на титрование опытной пробы;
Х – активность пероксидазы, мл J2/г.
Активность пероксидазы контрольных плодов груши для четырех контрольных партий приведена в таблице 3.
Из таблицы 3 видна динамика активности пероксидазы плодов груши. Определяют зависимость величин естественных потерь массы от активности фермента.
Величины естественных потерь массы контрольных плодов груши в условиях холодильного хранения и активность пероксидазы контрольных плодов груши из таблицы 3 наносят на график 2.
При сравнении на графике 2 зависимостей величин естественных потерь массы от активности пероксидазы плодов груши определяют степень лежкости плодов.
Из таблицы 3 и графика 2 видно:
– в 1-й контрольной партии минимальной величине естественных потерь массы плодов груши (0,403 г/(кг·сутки)) соответствует максимальная активность пероксидазы (6,00 мл J2/г);
– во 2-й контрольной партии средней величине естественных потерь массы плодов груши (0,588 г/(кг·сутки)) соответствует средняя активность пероксидазы (4,00 мл J2/г);
– в 3-й контрольной партии средней величине естественных потерь массы плодов груши (0,697 г/(кг·сутки)) соответствует минимальная активность пероксидазы (2,00 мл J2/г);
– в 4-й контрольной партии максимальной величине естественных потерь массы плодов груши (0,780 г/(кг·сутки)) соответствует средняя активность пероксидазы (3,00 мл J2/г).
Определяют:
– долгосрочную лежкость плодов груши 1-й контрольной партии;
– среднесрочную лежкость плодов груши 2-й контрольной партии;
– краткосрочную лежкость с корректировкой сроков для плодов груши 3-й контрольной партии;
– среднесрочную лежкость с корректировкой сроков для плодов груши 4-й контрольной партии.
Очевидно, что чем активнее пероксидаза, тем меньше величина потерь массы при холодильном хранении. Плоды с наиболее активной пероксидазой имеют долгосрочную лежкость. Плоды с наименее активной пероксидазой имеют краткосрочную лежкость. Плоды со средней активностью пероксидазы обладают среднесрочной лежкостью. Однако при отклонении зависимостей, как в партиях 3 и 4, степень лежкости корректируют.
ВАРИАНТ 3
Пример 4
Берут четыре контрольные партии плодов айвы японской (хеномелес) (2003 г.).
В каждой контрольной партии (из четырех) выбирают 10 контрольных плодов айвы японской.
Определяют величины естественных потерь массы контрольных плодов айвы японской в условиях холодильного хранения по примеру 1.
Величины естественных потерь массы контрольных плодов айвы японской для четырех контрольных партий в условиях холодильного хранения приведены в таблице 4.
Из таблицы 4 видна динамика величин естественных потерь массы плодов айвы японской.
Определяют активность полифенолоксидазы плодов айвы японской.
Берут 10 контрольных плодов айвы японской (до размещения их на холодильное хранение) из каждой контрольной партии, моют, очищают от кожуры, мякоть измельчают.
Определение активности полифенолоксидазы проводят методом, основанным на окислении аскорбиновой кислоты полифенолоксидазой в присутствии аскорбиновой кислоты.
На весах отбирают навеску 5 г и проводят основное и контрольное определения.
Основное определение.
Навеску 5 г мякоти плодов айвы японской растирают в присутствии 20 мл фосфатного буфера при рН 6,3 (0,1 М), полученную суспензию доводят до объема 25-50 мл и отфильтровывают. Берут 5-10 мл фильтрата и помещают в стеклянный стаканчик. Добавляют 2 мл свежеприготовленного 0,2% раствора аскорбиновой кислоты и 1 мл свежеприготовленного раствора пирокатехина.
Реакционную смесь периодически встряхивают в течение 7 минут, затем останавливают реакцию прибавлением 2 мл 10% раствора Н2SO4.
В реакционную смесь добавляют несколько кристалликов KJ, 5 капель 1% раствора крахмала и оставшееся неокисленное количество аскорбиновой кислоты оттитровывают 0,01 N раствором KJO3 до появления постоянной синей окраски.
Контрольное определение.
При контрольном определении фермент инактивируют кислотой перед прибавлением растворов аскорбиновой кислоты и пирокатехина.
Сравнивают контрольное и основное определения.
Разница между контрольными и основными показателями определений показывает, какое количество аскорбиновой кислоты окислено полифенолоксидазой (1 мл 0,01 N раствор KJO3 эквивалентен 0,88 мл аскорбиновой кислоты).
Активность ферментов рассчитывают в мл окисленной аскорбиновой кислоты (АК) на 1 г ткани.
Активность полифенолоксидазы контрольных плодов айвы японской для четырех контрольных партий приведена в таблице 4.
Из таблицы 4 видна динамика активности полифенолоксидазы плодов айвы японской.
Определяют зависимость величин естественных потерь массы от активности фермента.
Величины естественных потерь массы контрольных плодов айвы японской в условиях холодильного хранения и активность полифенолоксидазы контрольных плодов айвы японской из таблицы 4 наносят на график 3.
При сравнении на графике 3 зависимостей величин естественных потерь массы от активности полифенолоксидазы плодов айвы японской определяют степень лежкости плодов.
Из таблицы 4 и графика 3 видно:
– в 1-й контрольной партии средней величине естественных потерь массы плодов айвы японской (0,751 г/(кг·сутки)) соответствует максимальная активность полифенолоксидазаы (62 мл АК/г);
– во 2-й контрольной партии максимальной величине естественных потерь массы плодов айвы японской (0,876 г/(кг·сутки)) соответствует средняя активность полифенолоксидазы (46 мл АК/г);
– в 3-й контрольной партии средней величине естественных потерь массы плодов айвы японской (0,541 г/(кг·сутки)) соответствует минимальная активность полифенолоксидазы (18 мл АК/г);
– в 4-й контрольной партии средней величине естественных потерь массы плодов айвы японской (0,505 г/(кг·сутки)) соответствует средняя активность полифенолоксидазы (26 мл АК/г).
Определяют:
– краткосрочную лежкость с корректировкой срока для плодов айвы японской 1-й контрольной партии;
– среднесрочную лежкость с корректировкой срока для плодов айвы японской 2-й контрольной партии;
– долгосрочную лежкость с корректировкой срока для плодов айвы японской 3-й контрольной партии;
– среднесрочную лежкость плодов айвы японской 4-й контрольной партии.
Очевидно, что плоды со средней активностью полифенолоксидазы обладают среднесрочной лежкостью, при отклонении зависимостей, как в партиях 1, 2 и 3, степень лежкости корректируют.
Пример 5
Берут четыре контрольные партии плодов груши (2005 г.). В каждой контрольной партии (из четырех) выбирают 10 контрольных плодов груши.
Определяют величины естественных потерь массы контрольных плодов груши в условиях холодильного хранения по примеру 1.
Величины естественных потерь массы контрольных плодов груши для четырех контрольных партий в условиях холодильного хранения приведены в таблице 5.
Из таблицы 5 видна динамика величин естественных потерь массы плодов груши.
Определяют активность полифенолоксидазы плодов груши.
Берут 10 контрольных плодов груши (до размещения их на холодильное хранение) из каждой контрольной партии, моют, очищают от кожуры, мякоть измельчают.
Определение активности полифенолоксидазы плодов груши проводят по примеру 4.
Активность полифенолоксидазы контрольных плодов груши для четырех контрольных партий приведена в таблице 5.
Из таблицы 5 видна динамика активности полифенолоксидазы плодов груши.
Определяют зависимость величин естественных потерь массы от активности фермента.
Величины естественных потерь массы контрольных плодов груши в условиях холодильного хранения и активность полифенолоксидазы контрольных плодов груши из таблицы 5 наносят на график 3.
По сравнению на графике 3 величин естественных потерь массы и активности полифенолоксидазы плодов груши определяют степень лежкости плодов.
Из таблицы 5 и графика 3 видно:
– в 1-й контрольной партии минимальной величине естественных потерь массы груши (0,403 г/(кг·сутки)) соответствует минимальная активность полифенолоксидазы (20 мл Ак/г);
– во 2-й контрольной партии средней величине естественных потерь массы плодов груши (0,588 г/(кг·сутки)) соответствует средняя активность полифенолоксидазы (40 мл АК/г);
– в 3-й контрольной партии средней величине естественных потерь массы плодов груши (0,697 г/(кг·сутки)) соответствует максимальная активность полифенолоксидазы (60 мл АК/г);
– в 4-й контрольной партии максимальной величине естественных потерь массы плодов груши (0,780 г/(кг·сутки)) соответствует средняя активность полифенолоксидазы (50 мл АК/г).
Определяют:
– долгосрочную лежкость с корректировкой срока для плодов груши 1-й контрольной партии;
– среднесрочную лежкость плодов груши 2-й контрольной партии;
– краткосрочную лежкость с корректировкой срока для плодов груши 3-й контрольной партии;
– среднесрочную лежкость с корректировкой срока для плодов груши 4-й контрольной партии.
Очевидно, что чем активнее полифенолоксидаза, тем больше величина потерь массы при холодильном хранении. Плоды с наиболее активной полифенолоксидазой имеют краткосрочную лежкость. Плоды с наименее активной полифенолоксидазой имеют долгосрочную лежкость.
При отклонении зависимостей, как в партиях 1, 3 и 4, степень лежкости корректируют.
Сроки хранения плодов, соответствующие долгосрочной, среднесрочной и краткосрочной лежкостей, приведены для варианта 1 в таблице 6 (примеры 1, 2), для варианта 2 в таблице 7 (пример 3) и для варианта 3 в таблице 8 (примеры 4 и 5).
Определение степени лежкости плодов по активности фермента в них, применяемое при биохимическом исследовании растительных тканей, и проверка лежкости плодов по результатам этого способа подтверждают целесообразность его использования, это обуславливает, по мнению заявителя, соответствие предложенного способа критерию «промышленная применимость».
Использование предложенного способа позволяет:
– определить пригодность плодов к хранению, оценить их состояние и повысить наглядность этой оценки за счет определения величин естественных потерь массы в плодах и получения зависимостей их от активности каталазы (Вариант 1), активности пероксидазы (Вариант 2), активности полифенолоксидазы (Вариант 3);
– прогнозировать степень лежкости плодов за счет определения долгосрочной, среднесрочной и краткосрочной лежкости плодов;
– повысить точность прогнозирования за счет определения степеней лежкости по соответствию или отклонению зависимостей величин естественных потерь массы от активности каталазы (Вариант 1), активности пероксидазы (Вариант 2), активности полифенолоксидазы (Вариант 3);
– расширить возможности осуществления способа за счет оценки степени лежкости по активности каталазы (Вариант 1), активности пероксидазы (Вариант 2), активности полифенолоксидазы (Вариант 3).
| Таблица 1 |
Зависимость естественных потерь массы плодов айвы японской от активности каталазы (2003 год)
Вариант 1, пример 1. |
Контрольные партии  |
Естественные потери массы, г/(кг·сутки) |
Активность каталазы, мл Н2О2/г |
| 1 |
0,593 |
0,75 |
| 2 |
0,644 |
0,23 |
| 3 |
0,652 |
0,27 |
| 4 |
0,833 |
0,04 |
| Таблица 2 |
Зависимость естественных потерь массы плодов груши от активности каталазы (2005 год)
Вариант 1, пример 2. |
Контрольные партии  |
Естественные потери массы, г/(кг·сутки) |
Активность каталазы, мл H2O2/г |
| 1 |
0,403 |
0,195 |
| 2 |
0,588 |
0,185 |
| 3 |
0,697 |
0,151 |
| 4 |
0,780 |
0,153 |
| Таблица 3 |
Зависимость естественных потерь массы плодов груши от активности пероксидазы (2005 год)
Вариант 2, пример 3. |
Контрольные партии  |
Естественные потери массы, г/(кг·сутки) |
Активность пероксидазымл J2/г |
| 1 |
0,403 |
6,0 |
| 2 |
0,588 |
4,0 |
| 3 |
0,697 |
2,0 |
| 4 |
0,780 |
3,0 |
| Таблица 4 |
Зависимость естественных потерь массы плодов айвы японской от активности полифенолоксидазы (2004 год)
Вариант 3, пример 4. |
Контрольные партии  |
Естественные потери массы, г/(кг·сутки) |
Активность полифенолоксидазы, мл АК/г |
| 1 |
0,751 |
62 |
| 2 |
0,876 |
46 |
| 3 |
0,541 |
18 |
| 4 |
0,505 |
26 |
| Таблица 5 |
Зависимость естественных потерь массы плодов груши от активности полифенолоксидазы (2005 год)
Вариант 3, пример 5. |
Контрольные партии  |
Естественные потери массы г/(кг*сутки) |
Активность полифенолоксидазы, мл АК/г |
| 1 |
0,403 |
20 |
| 2 |
0,588 |
40 |
| 3 |
0,697 |
60 |
| 4 |
0,780 |
50 |
| Таблица 6 |
| Сроки хранения плодов (Вариант 1) |
| Партии, порядковый номер |
Степень лежкости |
Прогнозируемая лежкость, месяцы |
Корректированная лежкость, месяцы |
Сохранность, % |
| Плоды айвы японской (Пример 1) |
| 1 |
долгосрочная |
6 |
нет |
85 |
| 2 |
среднесрочная |
3 |
нет |
89 |
| 3 |
среднесрочная |
3 |
нет |
92 |
| 4 |
краткосрочная |
до 1 |
нет |
22 |
| Плоды груши (Пример 2) |
| 1 |
долгосрочная |
6 |
нет |
81 |
| 2 |
среднесрочная |
3 |
нет |
84 |
| 3 |
среднесрочная |
3 |
1,5 |
72 |
| 4 |
краткосрочная |
1 |
0,5 |
33 |
| Таблица 7 |
| Сроки хранения плодов (Вариант 2) |
| Партии, порядковый номер |
Степень лежкости |
Прогнозируемая лежкость, месяцы |
Корректированная лежкость, месяцы |
Сохранность, % |
| Плоды груши (Пример 3) |
| 1 |
долгосрочная |
6 |
нет |
89 |
| 2 |
среднесрочная |
3 |
нет |
92 |
| 3 |
краткосрочная |
1 |
0,5 |
30 |
| 4 |
среднесрочная |
3 |
1 |
43 |
| Таблица 8 |
| Сроки хранения плодов (Вариант 3) |
| Партии, порядковый номер |
Степень лежкости |
Прогнозируемая лежкость, месяцы |
Корректированная лежкость, месяцы |
Сохранность, % |
| Плоды айвы японской (Пример 4) |
| 1 |
краткосрочная |
1 |
0,5 |
25 |
| 2 |
среднесрочная |
3 |
2 |
69 |
| 3 |
долгосрочная |
6 |
5 |
81 |
| 4 |
среднесрочная |
3 |
нет |
72 |
| Плоды груши (Пример 5) |
| 1 |
долгосрочная |
6 |
5 |
71 |
| 2 |
среднесрочная |
3 |
нет |
80 |
| 3 |
среднесрочная |
1 |
0,5 |
26 |
| 4 |
краткосрочная |
3 |
2 |
63 |
Формула изобретения
1. Способ определения степени лежкости плодов, осуществляемый путем отбора проб плодов и проведения биохимического анализа, отличающийся тем, что способ включает предварительный анализ степени лежкости контрольных партий, который осуществляют определением величин естественных потерь массы контрольных плодов из каждой контрольной партии в условиях холодильного хранения в течение контрольного временного периода, минимальные величины которых соответствуют долгосрочной лежкости, а максимальные – краткосрочной, определением активности каталазы в контрольных плодах и сравнением активности каталазы в контрольных плодах с величинами естественных потерь массы в контрольных плодах, и последующий анализ степени лежкости поступающих партий, который осуществляют определением активности каталазы в контрольных плодах этих партий и использованием соответствий предварительного анализа, при этом контрольные партии и поступающие партии относятся к одному временному сбору.
2. Способ определения степени лежкости плодов, осуществляемый путем отбора проб плодов и проведения биохимического анализа, отличающийся тем, что способ включает предварительный анализ степени лежкости контрольных партий, который осуществляют определением величин естественных потерь массы контрольных плодов из каждой контрольной партии в условиях холодильного хранения в течение контрольного временного периода, минимальные величины которых соответствуют долгосрочной лежкости, а максимальные – краткосрочной, определением активности пероксидазы в контрольных плодах и сравнением активности пероксидазы в контрольных плодах с величинами естественных потерь массы в контрольных плодах и последующий анализ степени лежкости поступающих партий, который осуществляют определением активности пероксидазы в контрольных плодах этих партий и использованием соответствий предварительного анализа, при этом контрольные партии и поступающие партии относятся к одному временному сбору.
3. Способ определения степени лежкости плодов, осуществляемый путем отбора проб плодов и проведения биохимического анализа, отличающийся тем, что способ включает предварительный анализ степени лежкости контрольных партий, который осуществляют определением величин естественных потерь массы контрольных плодов из каждой контрольной партии в условиях холодильного хранения в течение контрольного временного периода, минимальные величины которых соответствуют долгосрочной лежкости, а максимальные – краткосрочной, определением активности полифенолоксидазы в контрольных плодах и сравнением активности полифенолоксидазы в контрольных плодах с величинами естественных потерь массы в контрольных плодах и последующий анализ степени лежкости поступающих партий, который осуществляют определением активности полифенолоксидазы в контрольных плодах этих партий и использованием соответствий предварительного анализа, при этом контрольные партии и поступающие партии относятся к одному временному сбору.
РИСУНКИ
|