|
(21), (22) Заявка: 2007124991/15, 03.09.2007
(24) Дата начала отсчета срока действия патента:
03.09.2007
(46) Опубликовано: 27.03.2009
(56) Список документов, цитированных в отчете о
поиске:
ЯКУБОВА Р.Р. и др. Способ оценки дестабилизации мембран эритроцитов. Лаб. дело 1990, №5, с.26-29. RU 2231792 С2, 27.06.2004. RU 2277711 С1, 10.06.2006. SU 1481687 A1, 23.05.1989. SU 1219967 A1, 23.03.1986. SU 1469464 A1, 30.03.1989.
Адрес для переписки:
308015, г.Белгород, ул. Победы, 85, Белгородский государственный университет, ОИС
|
(72) Автор(ы):
Липунова Елена Андреевна (RU),
Никитин Валерий Михайлович (RU),
Скоркина Марина Юрьевна (RU)
(73) Патентообладатель(и):
Государственное образовательное учреждение высшего профессионального образования “Белгородский государственный университет” (RU)
|
(54) СПОСОБ ОПРЕДЕЛЕНИЯ РЕАКТИВНОСТИ ЭРИТРОЦИТОВ КРОВИ
(57) Реферат:
Способ относится к области физиологии и мембранологии и может быть использован в диагностике функциональной полноценности клеток. Способ включает стабилизацию крови гепарином, отмывание эритроцитов, приготовление суспензии эритроцитов, при этом осуществляют воздействие измененной средой в виде фармакологического блокатора кальциевых каналов или блокатора  -адренергических рецепторов на эритроциты крови в течение 15 минут на воздухе при комнатной температуре, готовят разведения в соотношении кровь/инкубационная среда 1:50, причем первое разведение в 0,2% растворе NaCl, а второе – в 0,65% растворе NaCl, инкубируют разведения в течение часа и определяют морфометрические индексы эритроцитов. Затем определяют коэффициент резервной поверхности эритроцитов крови для каждого временного интервала -адренергических рецепторов на эритроциты крови в течение 15 минут на воздухе при комнатной температуре, готовят разведения в соотношении кровь/инкубационная среда 1:50, причем первое разведение в 0,2% растворе NaCl, а второе – в 0,65% растворе NaCl, инкубируют разведения в течение часа и определяют морфометрические индексы эритроцитов. Затем определяют коэффициент резервной поверхности эритроцитов крови для каждого временного интервала  ТК. Для каждого ТК. Для каждого  ТК определяют количество функционально неполноценных эритроцитов, для которых коэффициент резервной поверхности больше единицы. Строят временную функциональную зависимость ТК определяют количество функционально неполноценных эритроцитов, для которых коэффициент резервной поверхности больше единицы. Строят временную функциональную зависимость 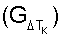 реактивности эритроцитов крови путем вычисления реактивности эритроцитов крови путем вычисления 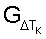 для каждого для каждого  ТК, а реактивность эритроцитов крови определяют как величину временного интервала воздействия на нее средой с измененным составом, по истечении которого соотношение ТК, а реактивность эритроцитов крови определяют как величину временного интервала воздействия на нее средой с измененным составом, по истечении которого соотношение 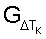 не менее 0,15. Предлагаемый способ технически прост, позволяет наблюдать за состоянием живых эритроцитов крови, подбирать дозу активаторов или блокаторов мембранных рецепторов с наименьшей повреждающей активностью. 3 з.п. ф-лы, 2 ил. не менее 0,15. Предлагаемый способ технически прост, позволяет наблюдать за состоянием живых эритроцитов крови, подбирать дозу активаторов или блокаторов мембранных рецепторов с наименьшей повреждающей активностью. 3 з.п. ф-лы, 2 ил.
Способ определения реактивности эритроцитов крови при изменении состава среды относится к области физиологии и мембранологии и может быть использован в диагностике функциональной полноценности клеток.
Известны способы оценки функционального состояния биологических мембран, основанные на определении продуктов перекисного окисления липидов (ПОЛ) как одного из основных механизмов деструкции мембран. Увеличение ПОЛ при патологии приводит к инициации свободно-радикального окисления мембранных липидов и, как следствие, полимеризации мембранных белков, в результате образуется побочный продукт – малоновый диальдегид. Различные патологические процессы, интоксикация, дисфункция клеточного метаболизма, отражаются на морфофункциональных свойствах крови. Изменения формы эритроцитов крови не всегда четко выявляются обычными способами, например, такими как по степени выраженности анизоцитоза и пойкилоцитоза на мазках крови, биохимическими методами, характеризующими ПОЛ, хемилюминесцентными и поляризационными методами. Так как указанные методы имеют ряд недостатков, например, на мазках при фиксации в спиртах и сушке происходит сильная деформация, ретракция и изменение формы эритроцитов крови, в результате чего невозможно оценить первоначальную форму эритроцитов крови; хемилюминесцентный метод позволяет оценить только целостность липопротеидов мембран.
За прототип выбран биофизический способ оценки дестабилизации мембран эритроцитов крови, основанный на измерении параметров линейно поляризованных составляющих образца, возбуждаемого плоскополяризованным светом [1], включающий:
– отбор периферической крови и стабилизацию ее гепарином;
– отмывание эритроцитов трис-буфером;
– приготовление суспензии эритроцитарных мембран в изотоническом растворе хлорида натрия методом «гипоосмотического шока»;
– облучение приготовленного образца неполяризованным светом, причем поляризационную призму располагают за образцом суспензии мембран эритроцитов;
– определение степени поляризации образца по формуле
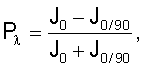
где Р – степень поляризации при длине волны – степень поляризации при длине волны  =493 нм; J0 – интенсивность излучения при длине волны =493 нм; J0 – интенсивность излучения при длине волны  =493 нм, когда оба поляризатора установлены на нулевом делении; J0/90 – интенсивность излучения при длине волны =493 нм, когда оба поляризатора установлены на нулевом делении; J0/90 – интенсивность излучения при длине волны  , когда поляризатор возбуждающего монохроматора установлен на нулевом делении, а эмиссионный монохроматор – на 90-м делении. , когда поляризатор возбуждающего монохроматора установлен на нулевом делении, а эмиссионный монохроматор – на 90-м делении.
– определение степени деполяризации образца по формуле
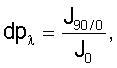
где dp – степень деполяризации при длине волны – степень деполяризации при длине волны  =493 нм; J0/90 – интенсивность излучения, когда поляризатор возбуждающего монохроматора установлен перед образцом на 90-м делении, а эмиссионный монохроматор – на нулевом делении; J0 – интенсивность излучения при длине волны =493 нм; J0/90 – интенсивность излучения, когда поляризатор возбуждающего монохроматора установлен перед образцом на 90-м делении, а эмиссионный монохроматор – на нулевом делении; J0 – интенсивность излучения при длине волны  =493 нм, когда оба поляризатора установлены на нулевом делении; =493 нм, когда оба поляризатора установлены на нулевом делении;
– пересчет полученных величин на 100 эритроцитов крови по формулам
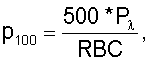
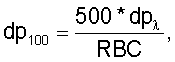
где RBC – количество эритроцитов крови, 1012 л-1;
– определение степени дестабилизации мембран в образце из соотношения p100/dp100.
Однако описанный способ дает достаточно субъективные данные, поскольку интенсивность поляризованного излучения зависит от правильно выбранной длины волны, причем исследователь должен выбрать длину волны, при которой наблюдается максимум интенсивности поляризационного излучения. Таким образом, для каждого исследуемого образца будет отсутствовать эталонная длина волны, что заметно отразится на уровне достоверности получаемых результатов. К тому же данный способ предъявляет высокий уровень требований к технике и оптике, что не всегда удается соблюсти в лабораторных условиях. В предлагаемом способе не установлен критерий, определяющий дестабилизацию мембран, а лишь указано, что величина р100/dp100 определена в условиях физиологической нормы у 10 доноров и варьирует в пределах 3,623±0,070 отн.ед. Существенным недостатком описанного способа является высокий уровень повреждения эритроцитарных мембран при подготовке материала к анализу, так как отмывка их с использованием трис-буфера может существенно повлиять на величину деполяризации мембраны.
Задачей изобретения является создание способа, позволяющего оценивать реактивность эритроцитов крови на изменения состава среды, позволяющего адекватно оценивать функциональное состояние эритроцитов крови даже в случае их визуальной морфологической целостности.
Для достижения указанного технического результата предлагается в способе, включающем:
– отбор периферической крови и стабилизацию ее гепарином;
– отмывание эритроцитов;
– приготовление суспензии эритроцитов,
внести следующие изменения:
– отмывание эритроцитов крови отобранной периферической крови производить трехкратно в растворе Хенкса путем центрифугирования;
– осуществлять изменение состава среды путем добавления к инкубационной среде фармакологического блокатора кальциевых каналов, например, 0,25% раствора верапамила; либо блокатора  -адренергических рецепторов, например пропранолола, также тормозящего поток кальция в клетку за счет блокирования фосфолирования G-белков цитоскелета, -адренергических рецепторов, например пропранолола, также тормозящего поток кальция в клетку за счет блокирования фосфолирования G-белков цитоскелета,
– осуществлять воздействие измененной средой на эритроциты крови опытной пробы в течение 15 минут на воздухе при комнатной температуре. Более 15 минут осуществлять воздействие невозможно, т.к. блокаторы теряют свои свойства, а за период менее 15 минут не успевают оказать полное воздействие на эритроциты крови;
– готовить из пробы разведения в соотношении кровь/инкубационная среда 1:50, причем первое разведение в 0,2% растворе хлорида натрия, а второе – в 0,65% растворе хлорида натрия;
– инкубацию готовых разведений осуществлять в течение часа;
– формировать однослойные препараты из каждого разведения,
– вычислять морфометрические индексы эритроцитов крови;
– определять количество функционально неполноценных эритроцитов, для которых коэффициент резервной поверхности (CRS) больше единицы, по формуле
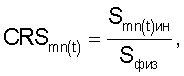
где CRS – коэффициент резервной поверхности эритроцитов;
Smn(t)ин – площадь поверхности эритроцитов при инкубации в 0,2% растворе хлорида натрия;
Sфиз – площадь поверхности эритроцитов при инкубации в 0,65% растворе хлорида натрия, определяют периодически с временным интервалом Тк=30 с (Тк – к-й временной интервал воздействия повреждающего фактора, где к – 1; 2; 3…n);
– определять временную функциональную зависимость реактивности эритроцитов крови 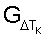 путем вычисления для каждого путем вычисления для каждого  Тк отношения Тк отношения 
где 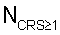 – количество функционально неполноценных клеток; – количество функционально неполноценных клеток;
N – общее количество эритроцитов в пробе; – общее количество эритроцитов в пробе;
– определять реактивность эритроцитов крови как величину временного интервала воздействия на нее средой с измененным составом, по истечении которого обеспечивается справедливость соотношения G Tк Tк 0,15. 0,15.
Отличительными признаками заявленного способа являются:
1. Отмывание эритроцитов крови путем центрифугирования в растворе Хенкса (состав: глюкоза 2 г, хлорид калия 0,4 г, хлорид натрия 8 г, гидрофосфат натрия 1,77 г, дигидрофосфат натрия 0,69 г, дистиллированная вода 1000 мл), что позволяет сохранить целостность клеток, жизнеспособность за счет наличия глюкозы в среде, не изменяя их нативной формы (конфигурации) при изъятии из организма;
2. Осуществление изменения состава среды путем добавления к суспензии эритроцитов фармакологического блокатора кальциевых каналов. Использование именно фармакологического блокатора кальциевых каналов необходимо для целей изобретения, т.к. за счет его воздействия исключается передача сигнала извне внутрь клетки посредством кальциевых ионных потоков, благодаря чему можно оценить истинную реактивность или жизнеспособность эритроцитов крови;
3. Использование коэффициента резервной поверхности эритроцитов для оценки их функциональной полноценности по формуле
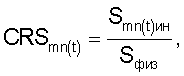
где CRS – коэффициент резервной поверхности эритроцитов;
Smn(t)ин – площадь поверхности эритроцитов крови при инкубации в 0,2% растворе хлорида натрия;
Sфиз – площадь поверхности эритроцитов крови при инкубации в 0,65% растворе хлорида натрия.
Коэффициент резервной поверхности эритроцитов (CRS) определяют периодически с временным интервалом Тк=30 с (Тк – к-й временной интервал воздействия повреждающего фактора, где к – 1; 2; 3…n), что позволяет выявить среди морфологически однородных эритроцитов крови функционально полноценные и неполноценные формы. Так как экспериментально установлено, что коэффициент резервной поверхности (CRS) для функционально полноценных эритроцитов крови при изменении условий среды имеет обратную функциональную зависимость по отношению к коэффициенту эксцентричности. При этом чем ближе форма эритроцита крови к узкоэллиптической, тем ниже значение коэффициента эксцентричности. Индикатором функциональных нарушений в мембране при максимальном набухании эритроцита является рост коэффициента резервной поверхности до значения выше единицы, т.е. при повышении площади поверхности эритроцита крови в 0,2% растворе хлорида натрия над площадью поверхности эритроцита крови в 0,65% растворе хлорида натрия.
4. Определение реактивности эритроцитов крови производят по величине временного интервала, в течение которого отношение количества функционально неполноценных эритроцитов крови 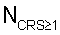 к общему количеству эритроцитов крови в пробе N к общему количеству эритроцитов крови в пробе N превышает 0,15, что обусловлено различной реакционной способностью эритроцитов крови разных возрастов [2, стр.65-66]. превышает 0,15, что обусловлено различной реакционной способностью эритроцитов крови разных возрастов [2, стр.65-66].
Таким образом, предложенный способ позволяет определить реактивность эритроцитов крови и оценить возрастную гетерогенность эритроцитарной популяции и может быть использован в качестве надежного маркера развивающихся динамических процессов в системе гемопоэза.
Предлагаемый способ осуществляют следующим образом:
– производят отбор периферической крови и стабилизируют ее гепарином, трижды отмывают эритроциты крови в растворе Хенкса путем центрифугирования;
– осуществляют изменение состава среды путем добавления к инкубационной среде фармакологического блокатора кальциевых каналов;
– осуществляют воздействие измененной средой на эритроциты крови опытной пробы в течение 15 минут на воздухе при комнатной температуре;
– готовят из пробы разведения в соотношении кровь/инкубационная среда 1:50, причем первое разведение в 0,2% растворе хлорида натрия, а второе – в 0,65% растворе хлорида натрия;
– инкубируют готовые разведения в течение часа;
– формируют однослойные препараты из каждого разведения,
– вычисляют морфометрические индексы эритроцитов, для чего на однослойных препаратах через каждые 30 с в течение 10 минут в каждой из двух ортогональных плоскостях регистрируют временную последовательность групп проекций изображений эритроцитов крови 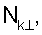 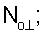 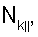 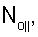 содержащих по содержащих по  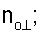 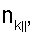 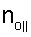 – изображений эритроцитов крови, а затем дополнительно через каждые 10 минут в течение одного часа регистрируют временную последовательность групп проекций изображений эритроцитов крови – изображений эритроцитов крови, а затем дополнительно через каждые 10 минут в течение одного часа регистрируют временную последовательность групп проекций изображений эритроцитов крови 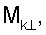 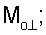 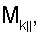 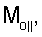 содержащих по содержащих по 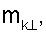 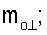 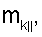 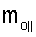 изображений эритроцитов крови; сохраняют полученные изображения временных последовательностей групп проекций изображений эритроцитов крови изображений эритроцитов крови; сохраняют полученные изображения временных последовательностей групп проекций изображений эритроцитов крови 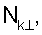 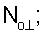 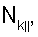 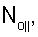 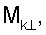 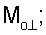 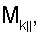 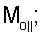 измеряют габаритные размеры всех эритроцитов крови Am – продольная ось эллипса, Bn – поперечная ось эллипса, содержащихся в сохраненных изображениях временных последовательностях групп проекций измеряют габаритные размеры всех эритроцитов крови Am – продольная ось эллипса, Bn – поперечная ось эллипса, содержащихся в сохраненных изображениях временных последовательностях групп проекций 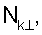 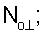 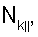 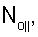 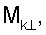 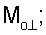 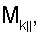 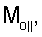 принимая клетку как модель эллипсоида вращения в общем случае не асимметричного; вычисляют по измеренным габаритным размерам эритроцитов крови соответствующих временных последовательностей значения морфометрических индексов для каждой из групп принимая клетку как модель эллипсоида вращения в общем случае не асимметричного; вычисляют по измеренным габаритным размерам эритроцитов крови соответствующих временных последовательностей значения морфометрических индексов для каждой из групп 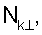 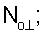 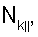 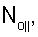 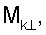 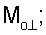 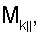 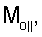 считая, что каждая из групп регистрировалась в соответствующие моменты времени tm, tn; по формулам считая, что каждая из групп регистрировалась в соответствующие моменты времени tm, tn; по формулам
а) коэффициент эксцентричности эритроцитов:
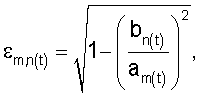
где  – коэффициент эксцентричности; – коэффициент эксцентричности;
am=Аm/2 – значение длинной полуоси эллипса,
bn=Bn/2 – значение короткой полуоси эллипса;
б) площадь поверхности эритроцитов:
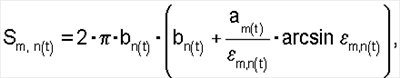
где S – площадь поверхности эритроцитов крови;
 – коэффициент эксцентричности эритроцитов. – коэффициент эксцентричности эритроцитов.
– Определяют коэффициент резервной поверхности эритроцитов по формуле
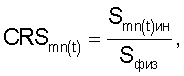 , ,
где CRS – коэффициент резервной поверхности эритроцитов,
Smn(t)ин – площадь поверхности эритроцитов крови при инкубации в 0,2% растворе хлорида натрия;
Sфиз – площадь поверхности эритроцитов крови при инкубации в 0,65% растворе хлорида натрия, определяют периодически с временным интервалом Тк=30 с (Тк – к-й временной интервал воздействия повреждающего фактора, где к – 1; 2; 3 n);
– определяют количество функционально неполноценных эритроцитов крови NCRS 1, для которых коэффициент резервной поверхности больше единицы; 1, для которых коэффициент резервной поверхности больше единицы;
– определяют временную функциональную зависимость степени воздействия измененной среды на эритроцитарную популяцию путем вычисления для каждого Тк отношения  где где 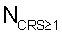 – количество функционально неполноценных эритроцитов; N – количество функционально неполноценных эритроцитов; N – общее количество эритроцитов крови в пробе; – общее количество эритроцитов крови в пробе;
– определяют реактивность эритроцитов крови как величину временного интервала воздействия на нее средой с измененным составом, по истечении которого обеспечивается справедливость соотношения G Tк Tк 0,15. 0,15.
Пример 1
Определение реактивности эритроцитов крови путем использования предложенного способа, в котором для изменения состава среды используют блокатор кальциевых каналов, например 0,25% верапамил in vitro.
Отбирают 1 мл периферической крови лягушки, которую стабилизируют гепарином в соотношении 0,1 часть антикоагулянта и 1 часть крови. Трижды проводят процедуру отмывания эритроцитов крови раствором Хенкса (состав: глюкоза 2 г, хлорид калия 0,4 г, хлорид натрия 8 г, гидрофосфат натрия 1,77 г, дигидрофосфат натрия 0,69 г, дистиллированная вода 1000 мл) путем центрифугирования. Готовят пробу крови в соотношении кровь/инкубационная среда 1:50, на которую в течение 15 мин оказывают воздействие фармакологическим блокатором кальциевых каналов, например 0,25% раствором верапамила. Через 15 минут воздействия верапамилом из пробы готовят по два разведения, первое – в 0,2% растворе хлорида натрия, второе – в 0,65% растворе хлорида натрия. Инкубируют в течение часа. Из полученных разведений готовят однослойные препараты, в которых через каждые 30 с в течение 10 минут, а затем дополнительно через 15, 30 минут и 1 час регистрируют изображения эритроцитов крови. На сохраненных изображениях измеряют соответствующие габаритные размеры эритроцитов крови, по которым рассчитывают морфометрические значения площади поверхности эритроцитов крови и коэффициента эксцентричности. Определяют коэффициент резервной поверхности эритроцитов крови по формуле
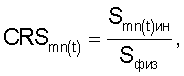
где CRS – коэффициент резервной поверхности эритроцитов крови;
Smn(t)ин – площадь поверхности эритроцитов крови при инкубации в 0,2% растворе хлорида натрия;
Sфиз – площадь поверхности эритроцитов крови при инкубации в 0,65% растворе хлорида натрия.
Определяют коэффициент резервной поверхности эритроцитов крови периодически с временным интервалом Тк=30 с (Тк – к-й временной интервал воздействия повреждающего фактора, где к – 1; 2; 3…n).
В каждый временной интервал воздействия инкубационной среды определяют количество функционально неполноценных эритроцитов крови 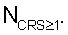 Определяют временную функциональную зависимость степени воздействия измененной среды на эритроцитарную популяцию путем вычисления для каждого Тк отношения Определяют временную функциональную зависимость степени воздействия измененной среды на эритроцитарную популяцию путем вычисления для каждого Тк отношения  а реактивность эритроцитарной популяции (эритроцитов крови) определяют как величину временного интервала воздействия на нее средой с измененным составом, по истечении которого обеспечивается справедливость соотношения G а реактивность эритроцитарной популяции (эритроцитов крови) определяют как величину временного интервала воздействия на нее средой с измененным составом, по истечении которого обеспечивается справедливость соотношения G Tк Tк 0,15. 0,15.
В результате проведенного эксперимента получена кривая реактивности эритроцитов крови в ответ на изменение состава среды при добавлении 0,25% раствора верапамила (фиг.1). Самая высокая реакционная способность характерна для эритроцитарной субпопуляции, с высокоподвижными внутриклеточными элементами цитоскелета, которые вовлекаются в ответ на изменение среды через 150 с от начала инкубации.
В следующие временные периоды инкубации со 180 по 900 с большая часть функционально полноценных эритроцитов крови с пониженной мембранной проницаемостью остается интактной и не вовлекается в ответную реакцию на измененную среду. В течение этого временного интервала происходило жесткое поддержание внутриклеточного гомеостаза за счет изменения интенсивности транспортных ионных потоков.
Заключительная волна реактивности наблюдается на 3600 с инкубации, когда в ответ на измененную среду включается функционально изношенная часть эритроцитарной субпопуляции. Видимо, эта волна также связана с развитием внутриклеточных механизмов регуляции. По литературным данным в присутствии антагонистов Са2+ (верапамила) начинается самопроизвольный ток ионов Na+ в клетки [3]. В эритроцитах крови лягушек R.Ridibunda Pall. установлено низкое содержание Na+ (12,2±0,8 ммоль/л клеток) и высокая концентрация К+ (90,1±1,9 ммоль/л клеток), при этом концентрация Na+ и K+ в эритроцитах крови лягушек достоверно не изменяется в разные сезоны года [4]. Таким образом, самопроизвольный ток Na+ по Са2+-каналам в присутствии кальциевого антагониста, снижающего сродство Са2+ и блокирующего его вход, будет приводить к развитию деполяризации мембраны и изменению ее заряда.
В поддержании объема эритроцитов основную роль отводят ионам К+, большая часть которых поступает в эритроцит крови через К-С1-котранспортер [4]. Наблюдаемые циклические процессы в динамике формы эритроцитов крови и их коэффициента резервной поверхности, а также появление пиков, связанных с появлением функционально неполноценных эритроцитов крови, являются показателем конкурентных потоков ионов в эритроциты крови и, как следствие, развития деполяризации их мембраны. Причем по скорости выраженности наблюдается различная динамика, возможно в связи с последовательным вовлечением в процесс различных каналов переноса. Первые 150 с инкубации, пока устанавливается связь в комплексе рецептор-верапамил, поток Na+ в эритроцитах крови зависит от диффузионной компоненты. В последующие 180 с Na+ поступает через Са2+-каналы и Na+/H+-обменник, в результате чего эритроциты крови сжимаются, что подтверждается снижением их коэффициента эксцентричности и коэффициента резервной поверхности. В следующие 120 с развивается активный внутриклеточный ответ, связанный с выкачиванием Na+ из эритроцитов крови посредством Na+-K+-насоса, и с участием Na+/H+-обменника (поскольку по литературным данным [4] он обеспечивает реверсивный ток ионов), в результате чего увеличивается коэффициент эксцентричности и коэффициент резервной поверхности эритроцитов крови клеток, которые пытаются восстановить свою форму.
Пример 2.
Определение реактивности эритроцитов крови путем использования предложенного способа, в котором для изменения состава среды используют неизбирательный блокатор  -адренорецепторов, например пропранолол в концентрации 0,27·10-3 ммоль/л. -адренорецепторов, например пропранолол в концентрации 0,27·10-3 ммоль/л.
Процедуру проводят in vitro так же, как и в примере 1.
При связывании пропранолола с  -адренорецепторами происходит стабилизация мембраны за счет изменения транспорта ионов через нее. В частности, пропранолол блокирует фосфорилирование G-белков цитоскелета, в результате чего поток кальция в клетку прекращается. Кроме того, учитывая, что кальциевые каналы эритроцитарных мембран являются рецептороуправляемыми [6, стр.35], под влиянием пропранолола не происходит активация инозитол-1,4,5-трифосфата и поток кальция в клетку тормозится. -адренорецепторами происходит стабилизация мембраны за счет изменения транспорта ионов через нее. В частности, пропранолол блокирует фосфорилирование G-белков цитоскелета, в результате чего поток кальция в клетку прекращается. Кроме того, учитывая, что кальциевые каналы эритроцитарных мембран являются рецептороуправляемыми [6, стр.35], под влиянием пропранолола не происходит активация инозитол-1,4,5-трифосфата и поток кальция в клетку тормозится.
В результате проведенного эксперимента получена кривая реактивности эритроцитов крови в ответ на изменение состава среды при добавлении 0,27·10-3 ммоль/л пропранолола, который является неизбирательным блокатором  -адренорецепторов, одновременно воздействуя на -адренорецепторов, одновременно воздействуя на  1- и 1- и  2-адренорецепторы (фиг.2). Первая реакция эритроцитов крови отмечается через 90 с инкубации, в которую вовлекаются эритроциты крови с высокопроницаемой мембраной. По данным литературы [4] показано ингибирование пропранололом транспорта K+ в эритроциты крови. При этом показано, что поток K+ в эритроцит крови лягушек вносит Cl-зависимый транспорт. K-Cl-котранспорт обеспечивает основную часть поступления K+ в эритроцит крови и участвует в регуляции внутриклеточного содержания ионов и объема клеток. Таким образом, наблюдаемая нами реакционная способность эритроцитов крови на 90 с, 150 и 210 с связаны с ингибированием K-Cl-котрнаспорта. Начиная с 270 с и по 450 с наблюдается следующая волна вовлечения эритроцитов крови в ответ на воздействие пропранолола. Это связано с химической природой этого вещества и способностью его хорошо растворяться в липидах биологических мембран [5, стр.117]. В течение этого временного интервала пропранолол массово проникает через биологические мембраны, изменяя вязко-эластические свойства липидного бислоя и блокируя деятельность 2-адренорецепторы (фиг.2). Первая реакция эритроцитов крови отмечается через 90 с инкубации, в которую вовлекаются эритроциты крови с высокопроницаемой мембраной. По данным литературы [4] показано ингибирование пропранололом транспорта K+ в эритроциты крови. При этом показано, что поток K+ в эритроцит крови лягушек вносит Cl-зависимый транспорт. K-Cl-котранспорт обеспечивает основную часть поступления K+ в эритроцит крови и участвует в регуляции внутриклеточного содержания ионов и объема клеток. Таким образом, наблюдаемая нами реакционная способность эритроцитов крови на 90 с, 150 и 210 с связаны с ингибированием K-Cl-котрнаспорта. Начиная с 270 с и по 450 с наблюдается следующая волна вовлечения эритроцитов крови в ответ на воздействие пропранолола. Это связано с химической природой этого вещества и способностью его хорошо растворяться в липидах биологических мембран [5, стр.117]. В течение этого временного интервала пропранолол массово проникает через биологические мембраны, изменяя вязко-эластические свойства липидного бислоя и блокируя деятельность  -адренорецепторов эритроцитов крови. Кроме того, в липидном бислое пропранолол не только блокирует работу -адренорецепторов эритроцитов крови. Кроме того, в липидном бислое пропранолол не только блокирует работу  -адренорецепторов и мембранноионный ток, но и образует дополнительные кластеры проницаемости. Заключительная волна реактивности эритроцитов крови наблюдается на 3600 с инкубации, когда в ответ на измененную среду включаются эритроциты крови с совершенными внутриклеточными механизмами регуляции. -адренорецепторов и мембранноионный ток, но и образует дополнительные кластеры проницаемости. Заключительная волна реактивности эритроцитов крови наблюдается на 3600 с инкубации, когда в ответ на измененную среду включаются эритроциты крови с совершенными внутриклеточными механизмами регуляции.
Предлагаемый способ технически прост, не требует применения специального оборудования, позволяет наблюдать за состоянием живых эритроцитов крови, а не мембран, полученных в результате гемолиза, и может быть применен как в клинической практике у лиц с наследственным элиптоцитозом, так и в гематологии низших позвоночных.
Так, предлагаемый способ может быть использован при определении функционального состояния эритроцитов крови. Например, у больных с эллиптоцитарным профилем крови при тестировании лекарственных препаратов возможно подбирать дозу активаторов или блокаторов мембранных рецепторов с наименьшей повреждающей активностью. В научный целях данный способ можно применять в гематологии низших позвоночных при изучении филогенеза мембранных механизмов регуляции клеточного гомеостаза.
Источники информации
2. Липунова Е.А., Скоркина М.Ю. Система красной крови: Сравнительная физиология. – Белгород: Изд-во БелГУ, 2004. – 216 с.
3. Авдонин В.П., Ткачук В.А. Рецепторы и внутриклеточный кальций. – М.: Наука, 1994. – 288 с.
4. Агалакова Н.И. Транспорт одновалентных катионов через мембрану эритроцитов лягушек Rana temporaria и Rana ridibunda. – Автореф. дис… к.б.н. – СПб, 1996. – 21 с.
5. Авакян О.М. Фармакологическая регуляция функций адренорецепторов. – М.: Медицина, 1988. – 256 с.
6. Сторожок С.А., Санников А.Г., Захаров Ю.М. Молекулярная структура мембран эритроцитов и их механические свойства. – Тюмень: Изд-во Тюменского университета, 1997. – 137 с.
Формула изобретения
1. Способ определения реактивности эритроцитов крови при изменении состава среды, включающий стабилизацию крови гепарином, отмывание эритроцитов, приготовление суспензии эритроцитов, отличающийся тем, что осуществляют воздействие на эритроциты крови измененной средой в виде фармакологического блокатора кальциевых каналов или блокатора  -адренергических рецепторов, тормозящего поток кальция в клетку крови в течение 15 мин на воздухе при комнатной температуре; затем готовят разведения в соотношении кровь/инкубационная среда 1:50, причем первое разведение в 0,2%-ном растворе хлорида натрия, а второе – в 0,65%-ном растворе хлорида натрия, инкубируют разведения в течение часа; определяют морфометрические индексы эритроцитов, по которым определяют коэффициент резервной поверхности эритроцитов крови для каждого временного интервала -адренергических рецепторов, тормозящего поток кальция в клетку крови в течение 15 мин на воздухе при комнатной температуре; затем готовят разведения в соотношении кровь/инкубационная среда 1:50, причем первое разведение в 0,2%-ном растворе хлорида натрия, а второе – в 0,65%-ном растворе хлорида натрия, инкубируют разведения в течение часа; определяют морфометрические индексы эритроцитов, по которым определяют коэффициент резервной поверхности эритроцитов крови для каждого временного интервала  ТK по формуле ТK по формуле
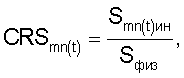
где CRS – коэффициент резервной поверхности эритроцитов,
Smn(t)ин – площадь поверхности эритроцитов при инкубации в 0,2%-ном растворе хлорида натрия;
Sфиз – площадь поверхности эритроцитов при инкубации в 0,65%-ном растворе хлорида натрия;
определяют количество функционально неполноценных эритроцитов, для которых коэффициент резервной поверхности больше единицы, строят временную функциональную зависимость реактивности эритроцитов крови путем вычисления для каждого  Тк отношения Тк отношения

где G Tк – временная функциональная зависимость реактивности эритроцитов крови; Tк – временная функциональная зависимость реактивности эритроцитов крови;
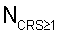 – количество функционально неполноценных эритроцитов; – количество функционально неполноценных эритроцитов;
N – общее количество эритроцитов в пробе, – общее количество эритроцитов в пробе,
а реактивность эритроцитов крови определяют как величину временного интервала воздействия на нее средой с измененным составом по истечении которого соотношение G Tк не менее 0,15. Tк не менее 0,15.
2. Способ по п.1, отличающийся тем, что в качестве фармакологического блокатора кальциевых каналов используют верапамил.
3. Способ по п.1, отличающийся тем, что в качестве фармакологического блокатора  -адренергических рецепторов, тормозящего поток кальция в клетку, используют пропранолол. -адренергических рецепторов, тормозящего поток кальция в клетку, используют пропранолол.
4. Способ по п.1, отличающийся тем, что для определения морфометрических индексов формируют однослойные препараты, в которых в течение 10 мин через каждые 30 с в каждой из двух ортогональных плоскостях регистрируют временную последовательность групп проекций изображений эритроцитов Nk , N0 , N0  ; Nk ; Nk , N0 , N0 , содержащих по nk , содержащих по nk , n0 , n0 ; nk ; nk , n0 , n0 – изображений эритроцитов, а затем дополнительно в течение одного часа через каждые 10 мин регистрируют временную последовательность групп проекций изображений эритроцитов Mk – изображений эритроцитов, а затем дополнительно в течение одного часа через каждые 10 мин регистрируют временную последовательность групп проекций изображений эритроцитов Mk , M0 , M0 ; Mk ; Mk , M0 , M0 , содержащих по mk , содержащих по mk , mо , mо ; mk ; mk , mo , mo изображений эритроцитов; сохраняют полученные изображения временных последовательностей групп проекций изображений эритроцитов Nk изображений эритроцитов; сохраняют полученные изображения временных последовательностей групп проекций изображений эритроцитов Nk , No , No ; Nk ; Nk , No , No ; Mk ; Mk , Mo , Mo ; Mk ; Mk , Mo , Mo , измеряют габаритные размеры всех эритроцитов Am – продольная ось эллипса, Bn – поперечная ось эллипса, содержащихся в сохраненных изображениях временных последовательностях групп проекций Nk , измеряют габаритные размеры всех эритроцитов Am – продольная ось эллипса, Bn – поперечная ось эллипса, содержащихся в сохраненных изображениях временных последовательностях групп проекций Nk  , No , No  ; Nk ; Nk , No , No ; Mk ; Mk  , Mo , Mo  ; Mk ; Mk , Mo , Mo , принимая клетку как модель эллипсоида вращения в общем случае не асимметричного; по измеренным габаритным размерам эритроцитов соответствующих временных последовательностей значения морфометрических индексов для каждой из групп Nk , принимая клетку как модель эллипсоида вращения в общем случае не асимметричного; по измеренным габаритным размерам эритроцитов соответствующих временных последовательностей значения морфометрических индексов для каждой из групп Nk , No , No ; Nk ; Nk , No , No ; Mk ; Mk  , Mo , Mo  ; Mkll, Moll, считая, что каждая из групп регистрировалась в соответствующие моменты времени tm; tn (где t1 – соответствует моменту времени первой регистрации равному 30 с отсчитываемых от момента времени начала инкубации после воздействия на опытную пробу измененной среды вычисляют ; Mkll, Moll, считая, что каждая из групп регистрировалась в соответствующие моменты времени tm; tn (где t1 – соответствует моменту времени первой регистрации равному 30 с отсчитываемых от момента времени начала инкубации после воздействия на опытную пробу измененной среды вычисляют
а) коэффициент эксцентричности по формуле
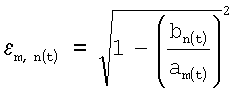 , ,
где  m, n(t) – коэффициент эксцентричности эритроцитов; m, n(t) – коэффициент эксцентричности эритроцитов;
bn (t) – значение поперечной полуоси эллипса;
аm(t) – значение продольной полуоси эллипса,
б) площадь поверхности эритроцитов по формуле
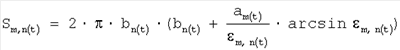 , ,
где Sm,n(t) – площадь поверхности эритроцитов;
 m,n(t) – коэффициент эксцентричности эритроцитов. m,n(t) – коэффициент эксцентричности эритроцитов.
РИСУНКИ
|