|
|
(21), (22) Заявка: 2005134357/28, 02.04.2004
(24) Дата начала отсчета срока действия патента:
02.04.2004
(30) Конвенционный приоритет:
08.04.2003 DK PA2003 00536
15.04.2003 US 60/462,949
26.01.2004 DK PA200400098
27.01.2004 US 60/539,875
(43) Дата публикации заявки: 27.08.2006
(46) Опубликовано: 27.03.2009
(56) Список документов, цитированных в отчете о
поиске:
JP 10221323 A, 21.08.1998. WO 1/27623 A, 19.04.2001. SU 1270689 A1, 15.11.1986. RU 2239827 C1, 10.11.2004. SU 1770898 A1, 23.10.1992.
(85) Дата перевода заявки PCT на национальную фазу:
08.11.2005
(86) Заявка PCT:
DK 2004/000234 (02.04.2004)
(87) Публикация PCT:
WO 2004/089504 (21.10.2004)
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
ЛАРСЕН Пер (DK),
СХАУ Оле (DK),
РАСМУССЕН Айгиль Шредер (DK)
(73) Патентообладатель(и):
НОВО НОРДИСК А/С (DK)
|
(54) РЕГЕНЕРАЦИЯ ХРОМАТОГРАФИЧЕСКОЙ СТАЦИОНАРНОЙ ФАЗЫ
(57) Реферат:
Настоящее изобретение относится к области хроматографической очистки. Предложен способ регенерации хроматографической стационарной фазы, в котором указанная хроматографическая стационарная фаза контактирует с регенерационным раствором, содержащим, по меньшей мере, одну органическую кислоту и менее чем 75% мас./мас. воды, где указанная органическая кислота представляет собой муравьиную кислоту. Также предложены: способ производства терапевтического полипептида, в котором проводят, по меньшей мере, одну хроматографическую стадию, на которой хроматографическая стационарная фаза регенерируется посредством способа регенерации, изложенного выше; применение способа регенерации хроматографической стационарной фазы согласно изобретению при производстве терапевтического полипептида и хроматографическая стационарная фаза, которая регенерирована посредством преложенного способа регенерации. Изобретение обеспечивает более эффективный способ регенерации хроматографических стационарных фаз для увеличения времени жизни дорогостоящих исходных материалов и предотвращения роста перепада давления на хроматографических колонках и, в частности, способ регенерации, который является пригодными для регенерации in-situ хроматографических стационарных фаз в производственных установках. 4 н. и 25 з.п. ф-лы, 3 ил., 12 табл. 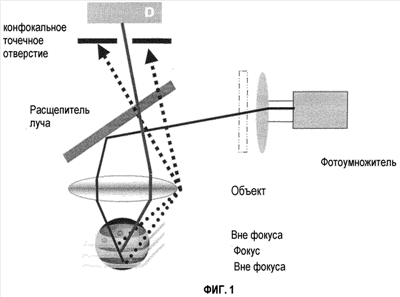
Область техники, к которой относится изобретение
Настоящее изобретение относится к области хроматографической очистки. Более конкретно, оно относится к способу регенерации хроматографической стационарной фазы.
Уровень техники
Полипептиды все в большей степени используются в качестве медикаментов для лечения заболеваний во всех главных областях терапии. Лечение диабета с помощью постоянного введения инсулина осуществляется в течение более чем 80 лет, и терапевтические применения полипептидов при расстройствах роста и раке также осуществляются в течение многих лет. Экономичные способы для крупномасштабного производства полипептидов с чистотой, достаточно высокой для терапевтических применений, являются критичными для дальнейшего развития терапии на основе полипептидов с целью выхода на массовый рынок и для того, чтобы существующая терапия стала использоваться более широко.
Очистка полипептида (выделение из смеси) представляет собой ряд стадий, которые, как правило, используются по несколько раз во время общего способа производства терапевтических полипептидов. Высокоэффективная жидкостная хроматография с обращенной фазой (ОФ-ВЭЖХ) является предпочтительным способом для промышленного выделения полипептидов с высоким разрешением, и способ, как показано, является пригодным для крупномасштабной очистки многих полипептидов.
Поскольку полипептиды для терапевтического использования должны быть очищены с высокой степенью чистоты, чтобы не вызывать вредных явлений при введении пациенту, является совершенно обычным использование нескольких хроматографических стадий очистки в способе производства. Стационарные фазы хроматографических колонок в производственных установках являются дорогостоящими, и они, таким образом, используются для нескольких хроматографических циклов. Однако со временем эффективность хроматографической стационарной фазы уменьшается, то есть перепад давления на колонке постепенно возрастает и коэффициент разделения уменьшается. Это приписывается постепенному отложению осадка. Проблему предлагается преодолевать с помощью способа регенерации, включающего в себя щелочные буферы (J. Chrom. 461, 1989, 45-61), например при pH 7,4, и высокую концентрацию органического модификатора.
Brange et al. (J. Pharm. Sci. 86 (1997) 517-525) описывает растворение фибрилл инсулина в кислоте и в основании.
В течение многих лет проблема облегчалась за счет регенерации хроматографической стационарной фазы щелочным раствором, например 0,1 молярным гидроксидом натрия (см. Liliedahl, “Twelve years of silica-based HPLC purification with focus on peptides”, at Tides 2000, 10 May 2000 in Las Vegas, USA). Этот способ регенерации может увеличить время жизни двуокиси кремния, используемой для очистки инсулина, до пределов между 100 и 600 циклами. Однако материалы двуокиси кремния не являются стабильными, когда подвергаются воздействию жестких щелочных условий, и, в частности, материалы на основе замещенной двуокиси кремния не могут быть пригодными для регенерации с помощью щелочных растворов. Экономически жизнеспособные способы очистки фармацевтических препаратов, таких как терапевтические полипептиды, должны включать в себя способ регенерации, который не разлагает хроматографическую стационарную фазу.
Общий и сложный способ регенерации материалов, содержащих частицы (глины, песка, двуокиси кремния и тому подобное) из разнообразных источников, описан в заявке на Международный патент WO 00/61493. Он представляет собой 5-стадийный способ, включающий в себя контактирование материала с a) экстрагентом органического материала, b) окисляющим агентом, а затем c) с раствором кислоты, d) нагревание материала и e) выделение материала. Способ является трудоемким и не пригодным для осуществления в установке для хроматографической очистки.
В данной области существует потребность в более эффективных способах регенерации хроматографических стационарных фаз с тем, чтобы увеличить время жизни этих дорогостоящих исходных материалов и предотвратить рост перепада давления на хроматографических колонках. Особенно требуются способы регенерации, которые являются пригодными для регенерации in-situ хроматографических стационарных фаз в производственных установках.
Сущность изобретения
Настоящее изобретение предусматривает способ регенерации хроматографической стационарной фазы, в котором указанная хроматографическая стационарная фаза контактирует с регенерационным раствором, содержащим, по меньшей мере, одну органическую кислоту и менее чем примерно 75% мас./мас. воды.
В другом аспекте настоящее изобретение предусматривает способ регенерации хроматографической стационарной фазы, в котором указанная хроматографическая стационарная фаза контактирует с регенерационным раствором, содержащим, по меньшей мере, одну органическую кислоту и менее чем примерно 1% масс./масс. воды.
В одном из вариантов осуществления настоящего изобретения органическая кислота представляет собой муравьиную кислоту. В другом варианте осуществления настоящего изобретения органическая кислота представляет собой уксусную кислоту. Еще в одном варианте осуществления регенерационный раствор содержит менее чем 0,5% воды, предпочтительно, менее чем 0,1% воды, более предпочтительно, менее чем 0,02% воды и наиболее предпочтительно, менее чем 0,001% воды.
В другом аспекте настоящее изобретение относится к способу регенерации хроматографической стационарной фазы, в котором указанная хроматографическая стационарная фаза контактирует с регенерационным раствором, содержащим, по меньшей мере, одну органическую кислоту, органический растворитель и менее чем примерно 1% мас./мас. воды.
В одном из вариантов осуществления настоящего изобретения органический растворитель представляет собой этанол. В другом варианте осуществления настоящего изобретения органический растворитель представляет собой 2-пропанол. В другом варианте осуществления настоящего изобретения органический растворитель представляет собой ацетонитрил. В другом варианте осуществления настоящего изобретения органический растворитель выбирается из группы, состоящей из метанола, 1-пропанола и гексиленгликоля.
В другом варианте осуществления регенерационный раствор содержит менее чем 0,5% воды, предпочтительно менее чем 0,1% воды, более предпочтительно менее чем 0,02% воды и наиболее предпочтительно менее чем 0,001% воды.
В другом аспекте настоящее изобретение относится к хроматографической стационарной фазе, которая регенерируется с помощью способов по настоящему изобретению.
В другом аспекте настоящее изобретение относится к продукту-полипептиду, получаемому с помощью способов по настоящему изобретению.
Еще в одном аспекте настоящее изобретение относится к продукту-полипептиду, производимому способом, включающим в себя регенерацию хроматографической стационарной фазы с помощью данных способов.
Еще в одном аспекте настоящее изобретение относится к автоматизированному хроматографическому оборудованию, содержащему трубопроводы и систему контроля для осуществления способа регенерации.
Еще в одном аспекте настоящее изобретение относится к фармацевтической композиции, получаемой путем очистки полипептида с использованием хроматографической стационарной фазы, которая регенерируется посредством данного способа.
Краткое описание чертежей
Далее настоящее изобретение иллюстрируется прилагаемыми чертежами, на которых:
Фигура 1 показывает принцип конфокального устройства.
Фигура 2 изображает двухмерную картину Source 30Q с фибриллами инсулина, окрашенными Thioflavin T.
Фигура 3 показывает принцип измерения площади фибрилл на Source 30Q. Более светлые участки показывают зеленый свет, исходящий от фибрилл инсулина на частицах Source 30Q.
Фигуры 4A-B показывают препаративные хроматограммы хроматографической очистки III (фиг.4A, верхняя фигура, перед регенерацией с помощью муравьиной кислоты, и фиг.4B (нижняя фигура) после регенерации с помощью муравьиной кислоты).
Определения
Следующее далее представляет собой подробное определение терминов, используемых в описании.
Термин “хроматографическая стационарная фаза”, как он здесь используется, означает твердую фазу, над которой проходит растворимая фаза, то есть хроматографическую матрицу. Хроматографическая стационарная фаза обычно помещается внутри хроматографической колонки. Примеры хроматографических стационарных фаз представляют собой замещенную двуокись кремния, такую как двуокись кремния C-4, двуокись кремния C-12 и двуокись кремния C-18, а также полимерные материалы, такие как полистирол, Source 30Q и Sepharose. Дополнительные примеры хроматографических стационарных фаз представляют собой мембраны, монолитные материалы и фильтры.
Термин “хроматографический элюент”, как он здесь используется, означает раствор, который используется для стадии элюирования, где очищенный полипептид обычно высвобождается из хроматографической стационарной фазы в элюент. В нормальном режиме хроматографии полный цикл включает в себя:
a) уравновешивание с помощью уравновешивающего буфера, чтобы привести колонку в состояние, где она является готовой для цикла,
b) нанесение образца, содержащего продукт,
c) необязательную стадию промывки, где хроматографическая стационарная фаза со связанным продуктом промывается,
d) элюирование, где сродство продукта по отношению к хроматографической стационарной фазе уменьшается и продукт покидает колонку в элюате хроматографической колонки,
e) необязательную регенерацию, где пытаются снять с хроматографической стационарной фазы оставшиеся примеси, используя регенерационный раствор.
Термин “уравновешивающий буфер” как он здесь используется, означает раствор, который используется для стадии уравновешивания, на которой хроматографическую колонку готовят для хроматографического цикла.
Термин “регенерационный раствор” как он здесь используется, означает раствор, который используют для регенерации хроматографической стационарной фазы. Целью регенерации является поддержание удовлетворительной эффективности хроматографического разделения в течение нескольких хроматографических циклов. Как правило, критические параметры, связанные с эффективностью, представляют собой перепад давления на хроматографической колонке и коэффициент разделения. Стадия регенерации может включать в себя контактирование хроматографической стационарной фазы либо с отдельным регенерационным раствором, либо более чем с одним регенерационным раствором. В последнем случае каждый из регенерационных растворов, а также получаемые из них смеси охватываются термином “регенерационный раствор”.
Термин “смесь”, как он здесь используется, означает композицию материала, содержащего, по меньшей мере, два ингредиента. Элюат хроматографической колонки представляет собой смесь, которая содержит химические реагенты в элюенте, вместе с продуктом, который снимается с колонки. Другой пример смеси представляет собой раствор химического реактива в растворителе, например солевой раствор. Еще один пример смеси представляет собой воду и смешивающийся с водой органический растворитель. Еще один пример смеси представляет собой раствор или суспензию полипептида в растворителе, таком как вода или органический растворитель.
Термин “выделение полипептида”, как он здесь используется, означает приведение полипептида в состояние, где он имеет более высокую концентрацию или более высокую чистоту, чем он имел до его выделения, то есть в исходном материале. Таким образом, примером выделения полипептида является осаждение или кристаллизация полипептида из раствора и отделение осадка или кристаллов от маточной жидкости.
Термин “органический растворитель”, как он здесь используется, означает растворитель, который содержит, по меньшей мере, один атом углерода и который находится в жидком состоянии в диапазоне температур от 0°C до 50°C. Неограничивающими примерами органических растворителей являются низшие спирты, такие как метанол и этанол, многоатомные спирты, ацетонитрил, гексан и ацетон.
Термин “смешивающийся с водой органический растворитель”, как он здесь используется, означает органический растворитель, который имеет растворимость в воде при 20°C, по меньшей мере, 1 г/л. Неограничивающими примерами органических растворителей, смешивающихся с водой, являются этанол, 1-пропанол, 2-пропанол, ацетонитрил и гексиленгликоль.
Термин “органическая кислота”, как он здесь используется, означает органическое соединение, которое имеет, по меньшей мере, одну функциональную группу с константой диссоциации, pKa менее чем 5,0. Примерами органических кислот являются муравьиная кислота, уксусная кислота, лимонная кислота и тому подобное.
Термин “низший спирт”, как он здесь используется, означает C1-6-спирт, который отличается тем, что имеет 1-6 атомов углерода и один гидроксильный остаток. Углеродный скелет в низшем спирте может быть прямым или разветвленным. Неограничивающими примерами низших спиртов являются этанол, н-пропанол, изопропанол и трет-бутанол.
Термин “многоатомный спирт” как он здесь используется, означает спирт, имеющий, по меньшей мере, два гидроксильных остатка. Неограничивающими примерами многоатомных спиртов являются гексиленгликоль (4-метил-2,4-пентандиол) и неопентиловый спирт (2,2-диметил-1,3-пропандиол).
Термин “наполнитель”, как он здесь используется, означает соединения, которые добавляют к фармацевтическим композициям для стабилизации и консервирования композиции. Типичными наполнителями являются буферы, консерванты и модификаторы тоничности.
Термин “фармацевтическая композиция”, как он здесь используется, означает продукт, содержащий активное соединение или его соль, вместе с фармацевтическими наполнителями, такими как буфер, консервант и модификатор тоничности, где указанная фармацевтическая композиция является пригодной для лечения заболевания или расстройства. Таким образом, фармацевтическая композиция также известна в данной области как фармацевтический препарат.
Термин “буфер”, как он здесь используется, относится к химическому соединению, которое используется в растворе для понижения тенденции pH раствора к изменению со временем, как произошло бы в другом случае из-за химических реакций. Буферы включают в себя такие реактивы, как фосфат натрия, TRIS, глицин и цитрат натрия.
Термин “модификатор тоничности”, как он здесь используется, относится к химическому соединению в фармацевтической композиции, которое служит для модификации осмотического давления фармацевтической композиции, с тем чтобы осмотическое давление стало ближе к давлению плазмы человека. Модификаторы тоничности включают в себя NaCl, глицерин, D-маннит и тому подобное.
Термин “фармацевтически приемлемый”, как он здесь используется, означает пригодный для обычных фармацевтических применений, то есть не оказывающий отрицательного воздействия на пациентов, и тому подобное.
Термин “инсулин человека” как он здесь используется, означает гормон человека, структура и свойства которого хорошо известны. Инсулин человека имеет две полипептидных цепи, которые соединены дисульфидными мостиками между цистеиновыми остатками, а именно, A-цепь и B-цепь. A-цепь представляет собой пептид из 21 аминокислоты, а B-цепь представляет собой пептид из 30 аминокислот, две цепи соединены посредством трех дисульфидных мостиков: один между цистеинами в положении 6 и 11 A-цепи, второй между цистеином в положении 7 A-цепи и цистеином в положении 7 B-цепи, а третий между цистеином в положении 20 A-цепи и цистеином в положении 19 B-цепи.
Термин “полипептид”, как он здесь используется, означает соединение, состоящее, по меньшей мере, из десяти составляющих аминокислот, соединенных посредством пептидных связей. Составляющие аминокислоты могут представлять собой группу аминокислот, кодируемых генетическим кодом, и они могут представлять собой природные аминокислоты, которые не кодируются генетическим кодом, а также синтетические аминокислоты. Природные аминокислоты, которые не кодируются генетическим кодом, представляют собой, например, гидроксипролин,  -карбоксиглутамат, орнитин, фосфосерин, D-аланин и D-глутамин. Синтетические аминокислоты включают в себя аминокислоты, полученные химическим синтезом, то есть D-изомеры аминокислот, кодируемых генетическим кодом, такие как D-аланин и D-лейцин, Aib ( -карбоксиглутамат, орнитин, фосфосерин, D-аланин и D-глутамин. Синтетические аминокислоты включают в себя аминокислоты, полученные химическим синтезом, то есть D-изомеры аминокислот, кодируемых генетическим кодом, такие как D-аланин и D-лейцин, Aib ( -аминоизомасляная кислота), Abu ( -аминоизомасляная кислота), Abu ( -аминомасляная кислота), Tle (трет-бутилглицин) и -аминомасляная кислота), Tle (трет-бутилглицин) и  -аланин. -аланин.
Термин “терапевтический полипептид”, как он здесь используется, означает полипептид, у которого наблюдается потенциальная пригодность в качестве терапевтического агента. Терапевтические полипептиды, как правило, имеют высокую степень чистоты, и они подвергаются клиническим исследованиям в качестве части процесса одобрения директивными органами. Примеры терапевтических полипептидов включают в себя инсулин человека, тромбопоэтин, эритропоэтин и гормон роста человека.
Термин “продукт-полипептид”, как он здесь используется, означает композицию, содержащую полипептид. Примерами продуктов-полипептидов являются кристаллизованный полипептид, осажденный полипептид и раствор полипептида.
Термин “аналог”, как он здесь используется, по отношению к исходному полипептиду означает модифицированный полипептид, где один или несколько аминокислотных остатков исходного полипептида замещены другими аминокислотными остатками и/или где один или несколько аминокислотных остатков удалены из исходного полипептида, и/или где один или несколько аминокислотных остатков удалены из исходного полипептида, и/или где один или несколько аминокислотных остатков добавлены к исходному полипептиду. Такое присоединение или удаление аминокислотных остатков может иметь место на N-конце полипептида, или на C-конце полипептида, или внутри полипептида. Примером аналога является Arg34-GLP-1(7-37), который представляет собой полипептид GLP-1(7-37), где Lys в положении 34 заменен Arg. Другими примерами являются свиной или бычий инсулин, которые оба являются аналогами инсулина человека.
Термин “предшественник”, как он здесь используется, по отношению к полипептиду означает модифицированную версию полипептида, который производится. Предшественники полипептидов, как правило, представляют собой расширенные аминокислотные версии полипептида или укороченные версии полипептида.
Эти предшественники могут служить для усиления клеточной экспрессии, содержать метки сродства для очистки, защищать определенные реакционноспособные группы производимого полипептида и тому подобное.
Термин “производное”, как он здесь используется, по отношению к исходному полипептиду означает химически модифицированный исходный полипептид или его аналог, где, по меньшей мере, один заместитель не присутствует в исходном полипептиде или его аналоге, то есть исходный полипептид, который является ковалентно модифицированным. Типичные модификации представляют собой амиды, углеводы, алкильные группы, ацильные группы, сложные эфиры, продукты PEG-илирования и тому подобное. Примерами производных инсулина человека являются треонинметиловый эфирB30 инсулина человека и N B29-тетрадеканоил-дез-(B30)-инсулин человека. B29-тетрадеканоил-дез-(B30)-инсулин человека.
Термин “липофильный заместитель”, как он здесь используется, означает заместитель, содержащий 4-40 атомов углерода и имеющий растворимость в воде при 20°C в пределах от примерно 0,1 мг/100 мл воды до примерно 250 мг/100 мл воды, например, в пределах от примерно 0,3 мг/100 мл воды до примерно 75 мг/100 мл воды. Например, октановая кислота (C8) имеет растворимость в воде при 20°C 68 мг/100 мл, декановая кислота (C10) имеет растворимость в воде при 20°C 15 мг/100 мл, и октадекановая кислота (C18) имеет растворимость в воде при 20°C 0,3 мг/100 мл.
Термин “трубопроводы и система контроля”, как он здесь используется, означает физические средства (трубы и контрольные клапаны) и программное обеспечение, контролирующее трубы и клапаны оборудования, применяемого в способе.
Описание изобретения
Настоящее изобретение относится к способу регенерации хроматографической стационарной фазы, в котором указанная хроматографическая стационарная фаза контактирует с регенерационным раствором, содержащим, по меньшей мере, одну органическую кислоту и менее чем примерно 75% мас./мас. воды. Настоящее изобретение также относится к способу регенерации хроматографической стационарной фазы, в котором указанная хроматографическая стационарная фаза контактирует с регенерационным раствором, содержащим, по меньшей мере, одну органическую кислоту и менее чем примерно 1% масс./масс. воды. Настоящее изобретение также относится к способу регенерации хроматографической стационарной фазы, в котором указанная хроматографическая стационарная фаза контактирует с регенерационным раствором, имеющим концентрацию органической кислоты, которая составляет, по меньшей мере, 25% мас./мас., в регенерационном растворе способа может использоваться ряд органических кислот. Предпочтительной органической кислотой является муравьиная кислота. Другой органической кислотой для регенерационного раствора является уксусная кислота. Другой регенерационный раствор содержит две органических кислоты, например муравьиную кислоту и уксусную кислоту.
Регенерационный раствор может, кроме того, содержать органический растворитель. Предпочтительно органический растворитель используется также в уравновешивающем буфере или хроматографическом элюенте. В одном из вариантов осуществления настоящего изобретения органический растворитель представляет собой этанол. В другом варианте осуществления органический растворитель представляет собой 2-пропанол. В другом варианте осуществления органический растворитель представляет собой ацетонитрил. В другом варианте осуществления органический растворитель выбирается из группы, состоящей из метанола, 1-пропанола и гексиленгликоля.
В другом варианте осуществления органическая кислота представляет собой муравьиную кислоту, а органический растворитель представляет собой этанол. В другом варианте осуществления органическая кислота представляет собой муравьиную кислоту, а органический растворитель представляет собой ацетонитрил. Еще в одном варианте осуществления органическая кислота представляет собой муравьиную кислоту, а органический растворитель представляет собой 2-пропанол. Еще в одном варианте осуществления органическая кислота представляет собой муравьиную кислоту, а органический растворитель представляет собой гексиленгликоль. В другом варианте осуществления органическая кислота представляет собой уксусную кислоту, а органический растворитель представляет собой этанол. В другом варианте осуществления органическая кислота представляет собой уксусную кислоту, а органический растворитель представляет собой ацетонитрил. Еще в одном варианте осуществления органическая кислота представляет собой уксусную кислоту, а органический растворитель представляет собой 2-пропанол. Еще в одном варианте осуществления органическая кислота представляет собой уксусную кислоту, а органический растворитель представляет собой гексиленгликоль.
В другом варианте осуществления настоящее изобретение относится к способу регенерации хроматографической стационарной фазы, где указанная хроматографическая стационарная фаза контактирует с регенерационным раствором, содержащим, по меньшей мере, одну органическую кислоту и менее чем 0,5% воды, предпочтительно менее чем 0,1% воды, более предпочтительно менее чем 0,02% воды и наиболее предпочтительно менее чем 0,001% воды.
Хроматографическая стационарная фаза предпочтительно контактирует с регенерационным раствором в хроматографической колонке. Таким образом, минимум производственной емкости теряется из-за времени простоя в связи со стадией регенерации. Таким образом, способ регенерации хроматографической стационарной фазы может осуществляться без повторной набивки колонки. В одном из вариантов осуществления хроматографическую стационарную фазу ожижают во время указанной регенерации. В другом варианте осуществления хроматографический элюент или уравновешивающий буфер вытесняют смешивающимся с водой органическим растворителем перед тем, как указанная хроматографическая стационарная фаза приводится в контакт с указанным регенерационным раствором. Предпочтительно указанный смешивающийся с водой органический растворитель присутствует также в хроматографическом элюенте или в уравновешивающем буфере. Предпочтительно указанный смешивающийся с водой органический растворитель также присутствует в регенерационном растворе.
В другом варианте осуществления хроматографическая стационарная фаза контактирует с указанным регенерационным раствором вне хроматографической колонки. Эта процедура является более трудоемкой, чем осуществление способа регенерации внутри колонки, но, тем не менее, она может быть полезной, если между частицами хроматографической стационарной фазы захватывается осажденный материал. В последнем случае осажденный материал может быть удален из хроматографической стационарной фазы без растворения указанного материала.
В одном из вариантов осуществления хроматографическая стационарная фаза представляет собой матрицу ОФ-ВЭЖХ. Хроматографическая стационарная фаза для ОФ-ВЭЖХ представляет собой механически очень жесткие материалы, которыми могут быть силикагель или замещенная двуокись кремния, такая как C4, C6, C8, C10, C12, C16, C18, C30 или фенилзамещенная двуокись кремния, или она может представлять собой стабильный при высоком давлении полимерный материал, который является замещенным или незамещенным. Хроматографическая стационарная фаза, представляет ли она собой матрицу на основе двуокиси кремния или полимерный материал, может также присутствовать в колонках в виде монолитных стержней с макропорами и мезопорами. Материал двуокиси кремния, пригодный для использования в качестве хроматографической стационарной фазы, представляет собой сферические частицы с узким распределением размеров пор и размерами частиц в пределах от 3 мкм до 100 мкм, например от 5 мкм до 100 мкм, например от 8 мкм до 30 мкм, например 10 мкм, 13 мкм, 15 мкм, 16 мкм, 18 мкм и 20 мкм. Обычно используются размеры пор в пределах от 60 Å до 300 Å, например, 100 Å, 120 Å, 150 Å, 175 Å, 200 Å или 300 Å. Для полимерных материалов, стабильных при высоком давлении, размер пор может составлять от 10 Å или даже выше, например, 50 Å, 100 Å, 400 Å, 600 Å, 1000 Å или 3000 Å. В одном из вариантов осуществления полимерный материал, стабильный при высоком давлении, представляет собой Source 30Q или XAD 1180. Хроматографическая колонка набивается стационарной фазой, и, после соответствующего испытания качества набивки, колонка уравновешивается с помощью буфера, используемого в режиме связывания. Промышленные хроматографические колонки, как правило, имеют диаметры от 15 до 100 см, и такие системы могут иметь динамическое аксиальное сжатие. Для производства малого объема полипептидов производственные колонки могут иметь диаметр, например, 15 см, 20 см или 25 см. Для производства большого объема полипептидов производственные колонки могут иметь диаметр, например, 40 см, 60 см, 80 см или более.
В другом варианте осуществления настоящего изобретения хроматографическая стационарная фаза, которую регенерируют, представляет собой мембрану, монолитные материалы, фильтры или тому подобное.
В одном из вариантов осуществления способа регенерации хроматографической стационарной фазы указанная хроматографическая стационарная фаза контактирует с указанным регенерационным раствором в течение, по меньшей мере, 1 секунды, предпочтительно в течение, по меньшей мере, 1 минуты, более предпочтительно в течение, по меньшей мере, 5 минут, например, от 1 минут до 24 час, от 1 минуты до 5 часов, от 1 минуты до 2 часов, от 10 минут до 60 минут.
В другом варианте осуществления способа регенерации хроматографической стационарной фазы указанная хроматографическая стационарная фаза контактирует с указанным регенерационным раствором до тех пор, пока перепад давления по длине хроматографической колонки при нормальной скорости потока не уменьшится, по меньшей мере, на 10%, предпочтительно по меньшей мере, на 25%, еще более предпочтительно, по меньшей мере, на 50%.
В другом варианте осуществления способа регенерации хроматографической стационарной фазы контактирование указанной хроматографической стационарной фазы с регенерационным раствором осуществляют при температуре в пределах от примерно 0°C до 70°C, от 5°C до 50°C, например, от 10°C до 40°C, например, от 15°C до 30°C или от 18°C до 25°C. В другом варианте осуществления способа регенерации хроматографической стационарной фазы время жизни указанной хроматографической стационарной фазы составляет, по меньшей мере, 500 хроматографических циклов, предпочтительно, по меньшей мере, 700 хроматографических циклов, более предпочтительно, по меньшей мере, 1000 хроматографических циклов, наиболее предпочтительно, по меньшей мере, 2000 хроматографических циклов.
В другом варианте осуществления способа регенерации хроматографической стационарной фазы указанный способ применяется к указанной хроматографической стационарной фазе в течение каждого хроматографического цикла, по меньшей мере, один раз на каждые 2 хроматографических цикла, по меньшей мере, один раз на каждые 5 хроматографических циклов, по меньшей мере, один раз на каждые 20 хроматографических циклов, по меньшей мере, один раз на каждые 50 хроматографических циклов или, по меньшей мере, один раз на каждые 100 хроматографических циклов.
В другом варианте осуществления настоящего изобретения количество процессов регенерации, осуществляемых на хроматографической стационарной фазе, составляет, по меньшей мере, 25, по меньшей мере, 50, по меньшей мере, 100, по меньшей мере, 200, по меньшей мере, 400 или, по меньшей мере, 1000.
В другом варианте осуществления способа регенерации хроматографической стационарной фазы указанный способ применяется к указанной хроматографической стационарной фазе каждый раз, когда перепад давления по длине хроматографической колонки превосходит пороговое значение.
Другой аспект настоящего изобретения представляет собой способ производства терапевтического полипептида или его предшественника, причем указанный способ включает в себя, по меньшей мере, одну хроматографическую стадию, на которой хроматографическая стационарная фаза регенерируется посредством способа регенерации, как описано выше. В одном из вариантов осуществления способа производства терапевтического полипептида или его предшественника указанный терапевтический полипептид представляет собой производное, содержащее липофильный заместитель. В другом варианте осуществления способа производства терапевтического полипептида или его предшественника указанный терапевтический полипептид представляет собой производное, содержащее липофильный заместитель, присоединенный к аминогруппе остатка лизина. В другом варианте осуществления способа производства терапевтического полипептида или его предшественника указанный терапевтический полипептид выбирается из группы, состоящей из глюкагона, глюкагоноподобного пептида 1, глюкагоноподобного пептида 2, exendin-4, пептидов TFF, инсулина человека, его аналогов и его производных. В другом варианте осуществления указанный полипептид выбирается из группы, состоящей из Lys26(N -( -( -Glu(N -Glu(N -гексадеканоил)))-GLP-1(7-37), Arg34-GLP-1(7-37), exendin-4, Lys17Arg30-GLP-2(1-33), Arg30Lys17N -гексадеканоил)))-GLP-1(7-37), Arg34-GLP-1(7-37), exendin-4, Lys17Arg30-GLP-2(1-33), Arg30Lys17N ( ( -Ala(N -Ala(N -гексадеканоил))GLP-2(1-33) и Gly2-GLP-2(1-33). В другом варианте осуществления указанный полипептид представляет собой exendin-4. В другом варианте осуществления указанный полипептид представляет собой полипептид слияния, содержащий сывороточный альбумин человека или его фрагмент. В другом варианте осуществления указанный полипептид представляет собой полипептид слияния GLP-1(7-37) или его аналога и фрагмента сывороточного альбумина человека или его аналога. В другом варианте осуществления указанный полипептид представляет собой полипептид слияния exendin-4(1-39) или его аналога и фрагмента сывороточного альбумина человека или его аналога. В другом варианте осуществления указанный полипептид представляет собой полипептид слияния, содержащий Fc-часть иммуноглобулина или ее фрагмент. В другом варианте осуществления указанный полипептид представляет собой полипептид слияния GLP-1(7-37) или его аналога и фрагмента Fc-части иммуноглобулина или его аналога. В другом варианте осуществления указанный полипептид представляет собой полипептид слияния exendin-4(1-39) или его аналога и фрагмента Fc-части иммуноглобулина или его аналога. -гексадеканоил))GLP-2(1-33) и Gly2-GLP-2(1-33). В другом варианте осуществления указанный полипептид представляет собой exendin-4. В другом варианте осуществления указанный полипептид представляет собой полипептид слияния, содержащий сывороточный альбумин человека или его фрагмент. В другом варианте осуществления указанный полипептид представляет собой полипептид слияния GLP-1(7-37) или его аналога и фрагмента сывороточного альбумина человека или его аналога. В другом варианте осуществления указанный полипептид представляет собой полипептид слияния exendin-4(1-39) или его аналога и фрагмента сывороточного альбумина человека или его аналога. В другом варианте осуществления указанный полипептид представляет собой полипептид слияния, содержащий Fc-часть иммуноглобулина или ее фрагмент. В другом варианте осуществления указанный полипептид представляет собой полипептид слияния GLP-1(7-37) или его аналога и фрагмента Fc-части иммуноглобулина или его аналога. В другом варианте осуществления указанный полипептид представляет собой полипептид слияния exendin-4(1-39) или его аналога и фрагмента Fc-части иммуноглобулина или его аналога.
В другом варианте осуществления указанный полипептид выбирается из группы, состоящей из инсулина человека, предшественника инсулина человека, аналога инсулина человека, предшественника аналога инсулина человека, аналога GLP-1(7-37), аналога exendin-4(1-39) и их производных. В другом варианте осуществления указанный полипептид выбирается из производного инсулина человека, содержащего, по меньшей мере, одну метокси- или этоксигруппу. В другом варианте осуществления указанный полипептид выбирается из группы, состоящей из
сложного треонинметилового эфираB30 инсулина человека,
сложного треонинэтилового эфираB30 инсулина человека,
AspB28 инсулина человека,
сложного треонинметилового эфираB30 AspB28 инсулина человека,
сложного треонинэтилового эфираB30 AspB28 инсулина человека,
LysB28ProB29 инсулина человека,
MetB-1ArgB0LysB28ProB29 проинсулина человека,
LysB3GluB29 инсулина человека,
GlyA21ArgB31ArgB32 инсулина человека,
дез-(B30)-инсулина человека,
N B29-тетрадеканоил-дез-(B30)-инсулина человека, B29-тетрадеканоил-дез-(B30)-инсулина человека,
N B29-литохолоил- B29-литохолоил- -глутамил-дез-(B30)-инсулина человека, -глутамил-дез-(B30)-инсулина человека,
N B29-октаноил-дез-(B30)-инсулина человека и B29-октаноил-дез-(B30)-инсулина человека и
N B29-октаноил-инсулина человека. B29-октаноил-инсулина человека.
Еще в одном варианте осуществления указанный полипептид выбирается из сывороточного альбумина человека, эритропоэтина, ФНО- , интерлейкина, IGF-1 (IGF-инсулиноподобный фактор роста), IGF-2, гормона роста человека, соматостатина, амилина человека и его аналогов. , интерлейкина, IGF-1 (IGF-инсулиноподобный фактор роста), IGF-2, гормона роста человека, соматостатина, амилина человека и его аналогов.
Полипептиды, очищаемые на хроматографических стационарных фазах, регенерируемых способом по настоящему изобретению, могут быть получены с помощью различных технологий, известных в области производства полипептидов. Полипептиды, большие чем 3000 Дальтон, обычно производят с помощью ферментации или культуры клеток, в то время как меньшие полипептиды могут производиться с помощью химического синтеза пептидов. Другие важные факторы, определяющие оптимальный способ производства, представляют собой также количество полипептида, которое должно производиться, и структуру полипептида, например дисульфидные связи и другие модификации. Полипептиды, полученные с помощью ферментации или культуры клеток, обычно производятся путем культивирования рекомбинантных клеток-хозяев, например бактерий, грибков, клеток млекопитающих, клеток насекомых или клеток растений, в соответствующих средах для культивирования. Среда для культивирования может представлять собой более или менее химически определенную среду, содержащую необходимые питательные вещества для роста и формирования продукта клеток-хозяев, например, сахар, источник азота, соли, витамины и другие факторы роста. После культивирования микроорганизмов или клеток в среде и их необязательного разрушения среда для культивирования содержит желаемый продукт в смеси с остальными компонентами среды, примесями, полученными из клеток-хозяев, и примесями, связанными с продуктом. Примеси, полученные из клеток-хозяев, в основном представляют собой полипептиды, нуклеиновые кислоты и остатки клеток. Продукт отделяют от этих ненужных примесей на стадиях извлечения или предварительной очистки. На стадиях конечной очистки (завершения), где примеси, тесно связанные с продуктом-полипептидом, отделяют от продукта-полипептида, широко используются хроматографические стадии.
Синтез полипептидов может быть также осуществлен с помощью твердофазного синтеза по химическому механизму типа Меррифилда, с помощью способов, использующих фазу раствора, или с помощью полусинтетических способов, известных в данной области. Одна или несколько стадий химического преобразования могут быть осуществлены между стадиями извлечения и конечной очистки. Такие химические модификации могут представлять собой гидролиз предшественника полипептида, при котором удлиняющий сегмент аминокислот на полипептиде отщепляется от полипептида. Такие удлиняющие сегменты аминокислот могут использоваться для увеличения экспрессии клеток-хозяев в случае полипептидов, полученных из культуры, или они могут использоваться для специфической очистки полипептида, например, с помощью аффинной хроматографии, например, IMAC-очистки полипептидов, меченых гистидином. Химическое преобразование также может представлять собой химическое модифицирование с получением полипептида, который представляет собой производное, например, путем ацилирования, PEG-илирования или эстерификации. Такие химические модификации хорошо известны в данной области (см., например, заявки на Международные патенты WO 98/08871, WO 99/43706, патент США №5424286, заявки на Международные патенты WO 00/09666, WO 00/66629, WO 01/04156 и WO 02/90388).
Другой аспект настоящего изобретения представляет собой использование указанных выше способов для регенерации хроматографической стационарной фазы с целью понижения перепада давления по длине хроматографической колонки.
Другой аспект настоящего изобретения представляет собой использование указанных выше способов регенерации хроматографической стационарной фазы с целью производства терапевтического полипептида.
Другой аспект настоящего изобретения представляет собой хроматографическую стационарную фазу, которая регенерируется путем контактирования указанной хроматографической стационарной фазы с регенерационным раствором, где указанный регенерационный раствор содержит, по меньшей мере, одну органическую кислоту и менее чем примерно 75% мас./мас. воды.
Другой аспект настоящего изобретения представляет собой хроматографическую стационарную фазу, которая регенерируется путем контактирования указанной хроматографической стационарной фазы с регенерационным раствором, причем указанный регенерационный раствор содержит, по меньшей мере, одну органическую кислоту и менее чем примерно 1% мас./мас. воды.
В одном из вариантов осуществления хроматографическую стационарную фазу регенерируют с помощью способа, как описано выше. В другом варианте осуществления хроматографическую стационарную фазу регенерируют с помощью способа, в котором указанный регенерационный раствор содержит менее чем 0,5% воды, предпочтительно менее чем 0,1% воды, более предпочтительно менее чем 0,02% воды и наиболее предпочтительно менее чем 0,001% воды. В другом варианте осуществления регенерируемая хроматографическая стационарная фаза представляет собой двуокись кремния или материал замещенной двуокиси кремния.
В другом аспекте настоящее изобретение относится к продукту-полипептиду, производимому с помощью способа, включающего в себя стадии
a) очистки полипептида или его предшественника с использованием хроматографической стационарной фазы, полученной способом регенерации по настоящему изобретению, и
b) выделения указанного полипептида или его предшественника с получением продукта-полипептида.
В другом аспекте настоящее изобретение относится к продукту-полипептиду, производимому с помощью способа, в котором используется хроматографическая стационарная фаза, регенерированная в соответствии со способом по настоящему изобретению.
В другом аспекте настоящее изобретение относится к автоматическому хроматографическому оборудованию, содержащему трубопроводы и систему контроля, для осуществления способа регенерации в соответствии с настоящим изобретением.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, полученной с помощью способа, включающего в себя стадии
a) сначала очистки полипептида или его предшественника с использованием хроматографической стационарной фазы, регенерированной способом в соответствии с настоящим изобретением,
b) затем сушки указанного полипептида и
c) наконец, смешивания с фармацевтически приемлемым наполнителем.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, полученной с помощью способа, включающего в себя стадии
a) сначала очистки полипептида или его предшественника с использованием хроматографической стационарной фазы, регенерированной способом, в котором указанная хроматографическая стационарная фаза контактирует с регенерационным раствором, содержащим, по меньшей мере, одну органическую кислоту и менее чем 0,5% воды, предпочтительно менее чем 0,1% воды, более предпочтительно менее чем 0,02% воды и наиболее предпочтительно менее чем 0,001% воды, и
b) затем сушки указанного полипептида и,
c) наконец, смешивания с фармацевтически приемлемым наполнителем.
ПРИМЕРЫ
Используются следующие сокращенные наименования для коммерчески доступных химических реагентов и материалов
HCOOH: муравьиная кислота
EtOH: этанол
AcOH: уксусная кислота
ODDMS: частицы октадецилдиметилзамещенной двуокиси кремния (двуокись кремния ODDMS)
Муравьиная кислота, используемая для примеров 1-68, 70-71, 73-74 и 76, имеет указанную чистоту 98-100% (согласно производителю), а муравьиная кислота, используемая для примера 72, имеет чистоту 99,9%.
Сокращение CV означает объемы колонок, как известно в области хроматографии.
Примеры 1-68
Общий набор экспериментов примеров 1-68 представляет собой следующее:
1. Определение противодавления и высоты впадины (точки минимума между пиками на кривой) для колонки, где нет проблем с давлением (новой неиспользуемой колонки).
2. Искусственное создание проблем с давлением и эффективностью.
3. Определение противодавления и высоты впадины между пиками для колонки, где есть проблемы с давлением.
4. Регенерация колонки.
5. Определение противодавления и высоты впадины между пиками для колонки после регенерации.
Определение противодавления и высоты впадины между пиками.
Один и тот же тип силикагеля используют для всех экспериментов, рассмотренных в этом разделе. Силикагель представляет собой 15 мкм силикагель ODDMS 200Å. По большей части используется одна и та же загрузка геля (№ загрузки 205144) (все колонки, начиная с 874-).
Силикагель набивают в стальные колонки 10 мм × 250 мм и исследуют в испытании на функциональность, используя дез-B30-инсулин в качестве исследуемого вещества и элюируя смесями вода-этанол, содержащими соли хлорида кальция и хлорида калия (см. таблицу 1). Противодавление при элюировании и высоту впадины между пиками дез-B30-инсулина и ближайшей примеси (перед пиком инсулина) используют в качестве параметров при исследовании того, насколько колонка восстановила свою эффективность.
Время элюирования дез-B30-инсулина может подвергаться некоторому экспериментальному разбросу из-за небольших изменений температуры и других экспериментальных параметров. Когда время элюирования дез-B30-инсулина является одинаковым в различных экспериментах, высота впадины между пиками представляет собой превосходный параметр сравнения эффективности разделения для колонок. Когда время элюирования дез-B30-инсулина изменяется от одного эксперимента к другому, высота впадины между пиками является менее хорошей мерой эффективности разделения колонки. При прочих равных условиях, чем больше время удерживания, тем меньше будет высота впадины между пиками.
Таблица 1
Растворы, используемые при исследовании функциональности |
| Вход |
Буфер |
Тип |
Содержание (мас./мас.) |
| A11 |
1 |
Уравновешивающий буфер |
20% этанола |
| A12 |
2 |
Элюирующий буфер A |
25% этанола, 1,5% KCl, 0,4% CaCl2 и 0,15% триэтаноламина (pH 7,4, с HCl) |
| B1 |
3 |
Элюирующий буфер B |
35% этанола, 1,5% KCl, 0,4% CaCl2 и 0,15% триэтаноламина (pH 7,4, с HCl) |
| A13 |
4 |
Регенерационный буфер |
70% этанола и 6,9% уксусной кислоты |
| A18 |
Нанесение |
Дез-B30-инсулин |
раствор Na2EDTA, pH 7,5, этанол |
Исследование функциональности осуществляют при 23±2°C на Äktaexplorer 100A с Unicorn 4,0 в качестве контрольного программного обеспечения и осуществляют следующий цикл колонки (см. таблицу 2):
Таблица 2
Цикл колонки при исследованиях функциональности (CV – объемы колонки) |
| Действие |
CV (кол.) |
Объем (мл) |
| Уравновешивание |
3 |
58,9 |
| Загрузка |
0,8 |
15 |
| Промывка 1 |
1 |
19,6 |
| Элюирование |
10 |
196,3 |
| Промывка 2 |
0,5 |
9,8 |
| Прополаскивание |
2 |
39,3 |
Исследуют колонку, набитую силикагелем (загрузка 205144), и измеряют противодавление 3,4±0,1 МПа. Аналогично, противодавление определяют для других колонок перед искусственным созданием проблем с давлением. Эксперименты показывают, что, если эти значения восстанавливаются после обработки, колонка восстанавливает свою эффективность.
Высоту впадины между пиками также определяют для индивидуальных колонок до и после создания проблем с давлением и эффективностью и после регенерации колонки.
Искусственное создание проблем с давлением и эффективностью:
Проблемы с давлением и эффективностью создают в 1 из 3 способов:
1. Колонку используют в исследованиях функциональности, но удаляют из системы после загрузки и выдерживают при 70°C в течение 1-16 час. После этого измеряют противодавление и высоту впадины между пиками, выполняя оставшуюся часть исследования функциональности.
2. Силикагель ODDMS (25 г) смешивают в химическом стакане с дез-B30-инсулином (0,14 г), 0,1M Tris буфером (22 мл) и этанолом (15 мл) при 50°C в течение 1 часа. После этого гель декантируют и набивают в стальную колонку (10 мм × 250 мм). Измеряют противодавление и высоту впадины между пиками, осуществляя исследования функциональности.
Этот способ может быть также осуществлен при более низких температурах, но это требует более длительного времени реакции.
3. Сочетание 1 и 2. Сначала гель обрабатывают как в 2, но после набивки колонку обрабатывают как в 1.
Способы, используемые для индивидуальных колонок, перечислены ниже в таблице 4.
Регенерация колонки (то есть устранение проблем с давлением и эффективностью):
Регенерацию колонки также осуществляют на Äktaexplorer 100A. Цикл колонки для этого способа можно увидеть ниже в таблице 3. После регенерации колонку вновь тестируют в исследовании функциональности и определяют противодавление.
Таблица 3
Цикл колонки при регенерации |
| Действие |
Растворитель |
CV (кол.) |
Объем (мл) |
| Промывка 1 |
EtOH |
3 |
58,9 |
| Регенерация |
См. таблицу 4 и 5 |
2 |
39,3 |
| Оставляют стоять |
– |
0 |
30 минут |
| Регенерация |
См. таблицу 4 и 5 |
2 |
39,3 |
| Промывка 2 |
EtOH |
3 |
58,9 |
Различные растворители исследуют при 22°C и 40°C (всю систему ВЭЖХ помещают в холодильник при заданной температуре ±1°C). Конкретные условия для индивидуальных колонок представлены в таблице 4, а результаты исследования функциональности представлены в таблице 5.
Конкретные экспериментальные условия для индивидуальных колонок
Таблица 4
Экспериментальные условия для индивидуальных колонок |
| Пример № |
Колонка № |
Искусственное создание проблем с помощью способа № |
Регенерационный растворитель |
Температура (°C) |
| 1 |
204377/1 |
1 |
HCOOH |
22 |
| 2 |
874-32/1 |
2 |
HCOOH |
22 |
| 3 |
874-32/2 |
3 |
HCOOH |
22 |
| 4 |
874-32/7 |
2 |
HCOOH |
22 |
| 5 |
874-33/9 |
2 |
HCOOH |
22 |
| 6 |
874-33/6 |
3 |
HCOOH |
22 |
| 7 |
874-24/22 |
2 |
HCOOH |
40 |
| 8 |
874-24/10 |
3 |
AcOH |
22 |
| 9 |
874-24/15 |
2 |
AcOH |
22 |
| 10 |
874-24/23 |
2 |
AcOH |
40 |
| 11 |
874-31/1 |
2 |
AcOH |
40 |
| 12 |
203635/5 |
1 |
HCOOH/AcOH 99:1 |
22 |
| 13 |
874-24/6 |
3 |
HCOOH/AcOH 99:1 |
22 |
| 14 |
205019/1 |
1 |
HCOOH/AcOH 99:1 |
40 |
| 15 |
204770/1 |
1 |
HCOOH/AcOH 3:1 |
22 |
| 16 |
874-24/26 |
2 |
HCOOH/AcOH 3:1 |
40 |
| 17 |
204888/1 |
1 |
HCOOH/AcOH 1:1 |
22 |
| 18 |
874-24/27 |
2 |
HCOOH/AcOH 1:1 |
40 |
| 19 |
204923/1 |
1 |
HCOOH/AcOH 1:3 |
22 |
| 20 |
874-24/28 |
2 |
HCOOH/AcOH 1:3 |
40 |
| 21 |
203251/3 |
1 |
HCOOH/EtOH 99:1 |
22 |
| 22 |
874-24/4 |
2 |
HCOOH/EtOH 99:1 |
22 |
| 23 |
204815/1 |
1 |
НСООН/EtOH 99:1 |
40 |
| 24 |
204815/1 |
1 |
HCOOH/EtOH 3:1 |
22 |
| 25 |
204888/1 |
1 |
HCOOH/EtOH 3:1 |
40 |
| 26 |
874-24/5 |
3 |
HCOOH/EtOH 1:1 |
22 |
| 27 |
874-24/16 |
2 |
HCOOH/EtOH 1:1 |
22 |
| 28 |
204923/1 |
1 |
HCOOH/EtOH 1:1 |
40 |
| 29 |
204550/1 |
1 |
HCOOH/EtOH 1:3 |
22 |
| 30 |
874-24/17 |
2 |
HCOOH/EtOH 1:3 |
22 |
| 31 |
204770/1 |
1 |
HCOOH/EtOH 1:3 |
40 |
| 32 |
203635/5 |
1 |
HCOOH/вода 99:1 |
22 |
| 33 |
874-24/24 |
2 |
HCOOH/вода 99:1 |
40 |
| 34 |
204377/1 |
1 |
HCOOH/вода 95:5 |
22 |
| 35 |
874-24/29 |
2 |
HCOOH/вода 95:5 |
40 |
| 36 |
202985/2 |
1 |
HCOOH/вода 4:1 |
22 |
| 37 |
874-24/30 |
2 |
HCOOH/вода 4:1 |
40 |
| 38 |
204550/1 |
1 |
HCOOH/вода 1:1 |
22 |
| 39 |
874-24/31 |
2 |
HCOOH/вода 1:1 |
40 |
| 40 |
874-33/5 |
3 |
HCOOH/вода 1:1 |
40 |
| 41 |
874-24/7 |
3 |
HCOOH/вода 1:3 |
22 |
| 42 |
874-24/18 |
2 |
HCOOH/вода 1:3 |
22 |
| 43 |
204770/1 |
1 |
HCOOH/вода 1:3 |
40 |
| 44 |
874-24/8 |
3 |
AcOH/вода 99:1 |
22 |
| 45 |
874-24/19 |
2 |
AcOH/вода 99:1 |
40 |
| 46 |
874-24/11 |
3 |
AcOH/вода 3:1 |
22 |
| 47 |
874-24/20 |
2 |
AcOH/вода 3:1 |
40 |
| 48 |
874-31/2 |
2 |
AcOH/вода 3:1 |
40 |
| 49 |
874-33/4 |
3 |
AcOH/вода 3:1 |
40 |
| 50 |
874-24/12 |
3 |
AcOH/вода 1:1 |
22 |
| 51 |
874-24/25 |
2 |
AcOH/вода 1:1 |
40 |
| 52 |
874-31/3 |
2 |
AcOH/вода 1:1 |
40 |
| 53 |
874-24/13 |
3 |
HCOOH/фенол/вода 1:1:1 |
22 |
| 54 |
874-24/21 |
2 |
HCOOH/фенол/вода 1:1:1 |
22 |
| 55 |
874-32/3 |
2 |
1500 ч./млн Na-гипохлорит |
22 |
| 56 |
874-33/11 |
3 |
1500 ч./млн Na-гипохлорит |
22 |
| 57 |
874-33/14 |
2 |
1500 ч./млн Na-гипохлорит |
22 |
| 58 |
874-32/4 |
2 |
Муравьиная кислота |
22 |
| 59 |
874-33/13 |
3 |
Муравьиная кислота |
22 |
| 60 |
874-33/18 |
2 |
Муравьиная кислота |
22 |
| 61 |
874-32/5 |
2 |
1,5M формальдегид |
22 |
| 62 |
874-33/12 |
3 |
1,5M формальдегид |
22 |
| 63 |
874-33/15 |
2 |
1,5M формальдегид |
22 |
| 64 |
874-32/6 |
2 |
6M гидрохлорид гуанидина |
22 |
| 65 |
874-33/10 |
3 |
6M гидрохлорид гуанидина |
22 |
| 66 |
874-33/17 |
2 |
6M гидрохлорид гуанидина |
22 |
| 67 |
874-33/19 |
2 |
EtOH(60% мас./мас.)/
0,1M NaOH |
22 |
| 68 |
874-33/20 |
3 |
EtOH(60% мас./мас.)/
0,1M NaOH |
22 |
Результаты исследования функциональности для индивидуальных колонок
Таблица 5
Противодавление и высота впадины между пиками, полученные при исследованиях функциональности, выполненных до и после искусственного создания проблем, и после регенерации колонок в соответствии с условиями, перечисленными в таблице 4.
RT представляет собой время удерживания для дез-B30-инсулина, и высота впадины между пиками (HV) приводится для дез-B30-инсулина и ближайшей примеси. |
| Пример № |
Противодавление (МПА) |
Эффективность |
| До проблем |
После проблем |
После регенерации |
До проблем |
После проблем |
После регенерации |
| RT мл |
HV
mAU |
RT мл |
HV
mAU |
RT мл |
HV
mAU |
| 1 |
3,8 |
6,2 |
3,8 |
140,2 |
38,4 |
|
|
144,3 |
36,1 |
| 2 |
3,4 |
5,8 |
3,6 |
141,2 |
39,6 |
146,6 |
62,0 |
138,6 |
44,5 |
| 3 |
3,4 |
>10 |
3,7 |
141,2 |
39,6 |
– |
– |
137,9 |
45,9 |
| 4 |
3,4 |
4,4 |
3,4 |
141,2 |
39,6 |
146,6 |
62,0 |
139,0 |
43,2 |
| 5 |
3,4 |
4,7 |
3,4 |
141,7 |
41,9 |
134,6 |
63,0 |
139,2 |
42,9 |
| 6 |
3,4 |
>10 |
3,6 |
141,7 |
41,9 |
– |
– |
140,1 |
45,8 |
| 7 |
3,4 |
4,7 |
3,4 |
134,5 |
54,3 |
136,5 |
47,8 |
137,2 |
48,6 |
| 8 |
3,4 |
>10 |
>10 |
134,5 |
54,3 |
– |
– |
– |
– |
| 9 |
3,4 |
4,7 |
4,4 |
134,5 |
54,3 |
136,5 |
47,8 |
135,9 |
48,4 |
| 10 |
3,4 |
4,7 |
3,9 |
134,5 |
54,3 |
136,5 |
47,8 |
135,0 |
50,1 |
| 11 |
3,4 |
4,2 |
4,2 |
134,5 |
54,3 |
|
|
149,5 |
44,7 |
| 12 |
3,0 |
3,7 |
2,8 |
136,1 |
42,7 |
|
|
130,3 |
51,9 |
| 13 |
3,4 |
>10 |
3,5 |
134,5 |
54,3 |
– |
– |
145,2 |
44,4 |
| 14 |
3,5 |
>10 |
3,5 |
139,9 |
44,1 |
– |
– |
135,9 |
44,8 |
| 15 |
3,5 |
>10 |
3,3 |
138,7 |
40,6 |
– |
– |
127,3 |
54,7 |
| 16 |
3,4 |
4,7 |
3,4 |
134,5 |
54,3 |
136,5 |
47,8 |
139,3 |
45,0 |
| 17 |
3,0 |
>10 |
2,9 |
139,2 |
30,4 |
– |
– |
130,2 |
36,2 |
| 18 |
3,4 |
4,7 |
3,4 |
134,5 |
54,3 |
136,5 |
47,8 |
137,1 |
47,0 |
| 19 |
3,1 |
>10 |
3,0 |
130,2 |
36,2 |
– |
– |
133,3 |
57,2 |
| 20 |
3,4 |
4,7 |
3,5 |
134,5 |
54,3 |
136,5 |
47,8 |
136,6 |
47,5 |
| 21 |
2,2 |
3,4 |
2,3 |
131,6 |
32,9 |
|
|
133,8 |
35,2 |
| 22 |
3,4 |
5,2 |
3,4 |
134,5 |
54,3 |
136,5 |
47,8 |
135,1 |
50,1 |
| 23 |
3,4 |
5,8 |
3,3 |
148,5 |
29,6 |
|
|
142,0 |
65,0 |
| 24 |
3,3 |
6,2 |
3,1 |
135,2 |
35,4 |
|
|
135,3 |
34,0 |
| 25 |
3,1 |
9 |
3,1 |
157,0 |
24,7 |
– |
– |
151,3 |
31,9 |
| 26 |
3,4 |
>10 |
>10 |
134,5 |
54,3 |
– |
– |
– |
– |
| 27 |
3,4 |
4,7 |
3,5 |
134,5 |
54,3 |
136,5 |
47,8 |
136,2 |
46,9 |
| 28 |
3,2 |
>10 |
3,5 |
139,7 |
44,7 |
– |
– |
148,0 |
35,7 |
| 29 |
2,8 |
>10 |
>10 |
142,4 |
23,2 |
– |
– |
– |
– |
| 30 |
3,4 |
4,7 |
4,1 |
134,5 |
54,3 |
136,5 |
47,8 |
137,6 |
44,2 |
| 31 |
3,6 |
>10 |
>10 |
147,4 |
38,7 |
– |
– |
– |
– |
| 32 |
3,1 |
6,9 |
3,1 |
143,8 |
34,7 |
|
|
136,3 |
41,4 |
| 33 |
3,4 |
4,7 |
3,3 |
134,5 |
54,3 |
136,5 |
47,8 |
132,1 |
55,8 |
| 34 |
3,7 |
>10 |
3,9 |
140,6 |
41,6 |
– |
– |
145,8 |
34,5 |
| 35 |
3,4 |
4,7 |
3,6 |
134,5 |
54,3 |
136,5 |
47,8 |
139,8 |
42,0 |
| 36 |
2,4 |
5,1 |
2,3 |
145,8 |
22,0 |
|
|
134,1 |
32,0 |
| 37 |
3,4 |
4,7 |
3,5 |
134,5 |
54,3 |
136,5 |
47,8 |
140,3 |
45,4 |
| 38 |
2,6 |
4,6 |
2,7 |
126,6 |
27,2 |
|
|
135,9 |
34,5 |
| 39 |
3,4 |
4,7 |
3,4 |
134,5 |
54,3 |
136,5 |
47,8 |
140,4 |
42,2 |
| 40 |
3,4 |
>10 |
4,1 |
141,7 |
41,9 |
– |
– |
141,8 |
64,0 |
| 41 |
3,4 |
>10 |
>10 |
134,5 |
54,3 |
– |
– |
– |
– |
| 42 |
3,4 |
4,7 |
3,3 |
134,5 |
54,3 |
136,5 |
47,8 |
137,0 |
45,6 |
| 43 |
3,4 |
5,8 |
3,8 |
131,9 |
47,0 |
|
|
145,0 |
40,8 |
| 44 |
3,4 |
>10 |
>10 |
134,5 |
54,3 |
– |
– |
– |
– |
| 45 |
3,4 |
4,7 |
4,3 |
134,5 |
54,3 |
136,5 |
47,8 |
135,2 |
42,9 |
| 46 |
3,4 |
>10 |
5,2 |
134,5 |
54,3 |
– |
– |
134,2 |
119,3 |
| 47 |
3,4 |
4,7 |
3,4 |
134,5 |
54,3 |
136,5 |
47,8 |
134,4 |
64,0 |
| 48 |
3,4 |
4,2 |
3,5 |
134,5 |
54,3 |
|
|
137,3 |
47,7 |
| 49 |
3,4 |
>10 |
5,6 |
141,7 |
41,9 |
– |
– |
141,9 |
73,4 |
| 50 |
3,4 |
>10 |
9 |
134,5 |
54,3 |
136,5 |
47,8 |
– |
– |
| 51 |
3,4 |
4,7 |
3,4 |
134,5 |
54,3 |
136,5 |
47,8 |
134,9 |
50,7 |
| 52 |
3,4 |
4,2 |
3,5 |
134,5 |
54,3 |
|
|
126,9 |
62,7 |
| 53 |
3,4 |
>10 |
4,1 |
134,5 |
54,3 |
– |
– |
137,7 |
46,1 |
| 54 |
3,4 |
4,7 |
3,4 |
134,5 |
54,3 |
136,5 |
47,8 |
138,6 |
45,0 |
| 55 |
3,4 |
4,4 |
3,8 |
141,2 |
39,6 |
146,6 |
62,0 |
138,0 |
46,2 |
| 56 |
3,4 |
>10 |
>10 |
141,7 |
41,9 |
– |
– |
– |
– |
| 57 |
3,4 |
4,7 |
4,1 |
141,7 |
41,9 |
134,6 |
63,0 |
149,8 |
39,3 |
| 58 |
3,4 |
4,4 |
3,6 |
141,2 |
39,6 |
146,6 |
62,0 |
138,2 |
46,1 |
| 59 |
3,4 |
>10 |
3,5 |
141,7 |
41,9 |
– |
– |
135,5 |
52,3 |
| 60 |
3,4 |
4,7 |
3,3 |
141,7 |
41,9 |
134,6 |
63,0 |
135,1 |
54,1 |
| 61 |
3,4 |
4,4 |
3,7 |
141,2 |
39,6 |
146,6 |
62,0 |
137,7 |
49,4 |
| 62 |
3,4 |
>10 |
>10 |
141,7 |
41,9 |
– |
– |
– |
– |
| 63 |
3,4 |
4,7 |
3,9 |
141,7 |
41,9 |
134,6 |
63,0 |
147,6 |
40,7 |
| 64 |
3,4 |
4,4 |
3,5 |
141,2 |
39,6 |
146,6 |
62,0 |
139,4 |
45,0 |
| 65 |
3,4 |
>10 |
>10 |
141,7 |
41,9 |
– |
– |
– |
– |
| 66 |
3,4 |
4,7 |
3,8 |
141,7 |
41,9 |
134,6 |
63,0 |
137,4 |
53,4 |
| 67 |
3,4 |
4,7 |
3,5 |
141,7 |
41,9 |
134,6 |
63,0 |
138,4 |
39,1 |
| 68 |
3,4 |
>10 |
3,9 |
141,7 |
41,9 |
134,6 |
– |
138,8 |
49,3 |
Пример 69
Время жизни колонки – хроматографические растворители/элюенты
Время жизни замещенных силикагелей может быть ограничено химическими разложениями геля растворами, наносимыми на хроматографическую колонку, например буферами и регенерационными растворами. Химическое разложение замещенных силикагелей может наблюдаться по появлению кремния на выходе из колонки или по понижению содержания углерода в геле, указывающему на потерю замещения. Следующие эксперименты демонстрируют появление кремния в эффлюенте колонки и уменьшение содержания углерода в гелях во время продолжительной промывки тремя хроматографическими растворами: 20% этанола в воде, элюентом 1 и элюентом 2. Композиция элюента 2 представляет собой 31% мас./мас. этанола, 1,5% мас./мас. KCl, 0,40% мас./мас. CaCl2, 0,15% мас./мас. триэтаноламина, и pH доводят до pH 7,4, используя HCl. Композиция элюента 1 представляет собой соль, буфер, этанол и pH 3,0.
Загрузку силикагеля ODDMS набивают в пять стальных колонок 4,0×250 мм с помощью стандартной процедуры для набивки хроматографических колонок. Затем колонки уравновешивают 3 CV этанола до начала непрерывной промывки хроматографическим элюентом. Затем пять колонок промывают хроматографическим элюентом (20% EtOH, элюентом 1 или элюентом 2) в течение 1, 3, 7, 12 и 16 дней, соответственно. После промывки в течение соответствующего времени каждую колонку затем уравновешивают с помощью 3 CV этанола, и силикагель удаляют из колонок. Образец использованного силикагеля анализируют на содержание углерода, а образец использованного регенерационного раствора анализируют на содержание кремния. Результаты для дня №0 представляют собой результат (содержание углерода) силикагеля, используемого для набивки колонок.
Таблица 6
Оценка времени жизни колонки во время продолжительной промывки типичными хроматографическими элюентами путем измерения оставшегося углерода и высвобождающегося кремния |
| |
№ колонки |
Хроматографический раствор |
Продолжительность
(дни) |
Измеренный С
(%) |
Измеренный Si (мг) |
Объем (мл) |
Относительное содержание С
(%) |
100 Å ODDMS
4,0*250 мм |
204614/15
204614/16
204614/17
204614/23 |
20% EtOH
20% EtOH
20% EtOH
20% EtOH |
0
1
3
7
12 |
19,40
19,14
19,16
19,26
19,28 |
0,00
0,05
0,13
0,31
0,25 |
0
136
425
1540
1270 |
100,00
98,66
98,76
99,28
99,38 |
| 204614/24 |
20% EtOH |
16 |
19,27 |
0,41 |
1360 |
99,33 |
| |
|
|
|
|
|
|
| |
204614/18
204614/20
204614/21
204614/19 |
Элюент 1
Элюент 1
Элюент 1
Элюент 1 |
0
1
3
7
12 |
19,40
18,67
18,85
18,76
18,64 |
0,00
0,15
0,36
0,87
1,33 |
0
147
360
870
1325 |
100,00
96,24
97,16
96,70
96,08 |
| 204614/22 |
Элюент 1 |
16 |
18,67 |
0,86 |
860 |
96,24 |
| |
| |
№ колонки |
20% EtOH
(% об./об.) |
Продолжительность
(дни) |
Измеренный С
(%) |
Измеренный Si (мг) |
Объем (мл) |
Относительное содержание С
(%) |
200 Å ODDMS
4,0*250 мм |
204630/14
204630/13
204630/15
204630/16 |
20% EtOH
20% EtOH
20% EtOH
20% EtOH |
0
1
3
7
12 |
9,80
9,61
9,66
9,72
9,69 |
0,00
0,03
0,09
0,09
0,18 |
0
160
430
425
610 |
100,00
98,06
98,57
99,18
98,88 |
| 204630/18 |
20% EtOH |
16 |
9,69 |
0,28 |
930 |
98,88 |
| |
|
|
|
|
|
|
| |
204630/19
204630/17
204630/20
204630/21 |
Элюент 2
Элюент 2
Элюент 2
Элюент 2 |
0
1
3
7
12 |
9,80
9,55
9,55
9,54
9,59 |
0,00
0,13
0,40
0,85
1,29 |
0
125
400
850
1290 |
100,00
97,45
97,45
97,35
97,86 |
| 204630/23 |
Элюент 2 |
16 |
9,49 |
0,70 |
700 |
96,84 |
Пример 70
Время жизни колонки – регенерационные растворы, содержащие муравьиную кислоту
Время жизни замещенных силикагелей может быть ограничено химическими разложениями геля растворами, наносимыми на хроматографическую колонку, например, буферами и регенерационными растворами. Химическое разложение замещенных силикагелей может наблюдаться по появлению кремния на выходе из колонки и по понижению содержания углерода в геле, указывающему на потерю замещения. Следующие эксперименты демонстрируют появление кремния в эффлюенте колонки и уменьшение содержания углерода в гелях во время продолжительной промывки регенерационными растворами, содержащими муравьиную кислоту. Таким образом, по сравнению с ситуацией с использованием хроматографических буферов или растворителей, регенерационные растворы, содержащие муравьиную кислоту, не являются больше воздействующими отрицательно на матрицу колонки.
Загрузку силикагеля ODDMS набивают в пять стальных колонок 4,0×250 мм с помощью стандартной процедуры для набивки хроматографических колонок. Затем колонки уравновешивают 3 CV этанола до начала непрерывной промывки муравьиной кислотой. Затем пять колонок промывают муравьиной кислотой (100% или 80%) в течение 1, 3, 7, 12 и 16 дней, соответственно. После промывки в течение соответствующего времени каждую колонку затем уравновешивают с помощью 3 CV этанола, и силикагель удаляют из колонки. Образец использованного силикагеля анализируют на содержание углерода, а образец использованного регенерационного раствора анализируют на содержание кремния. Результаты для дня № 0 представляют собой результат (содержание углерода) силикагеля, используемого для набивки колонок.
Таблица 7
Оценка времени жизни колонки во время продолжительной регенерации растворами, содержащими муравьиную кислоту, путем измерения оставшегося углерода и высвобождающегося кремния |
| Тип колонки |
Колонка № |
Муравьиная кислота
(%) |
Продолжительность
(дни) |
Измеренный С
(%) |
Измеренный Si (мг) |
Объем (мл) |
Относительное содержание С
(%) |
100 Å ODDMS
4,0*250 мм |
0
204614/7
204614/5
204614/6
204614/3
204614/2 |
–
100
100
100
100
100 |
0
1
3
7
12
12 |
19,40
19,00
18,90
19,26
18,97
18,94 |
0,00
0,82
1,46
1,95
5,63
3,92 |
0
124
510
620
1430
1100 |
100,00
97,94
97,42
99,28
97,78
97,63 |
| |
0
204614/8
204614/10
204614/9
204614/11
204614/12 |
–
80
80
80
80
80 |
0
1
3
7
12
16 |
19,40
19,08
19,08
18,93
17,04
18,61 |
0,00
1,67
2,62
4,55
6,07
6,86 |
0
177
410
970
1080
2090 |
100,00
98,35
98,35
97,58
N.D.
95,93 |
200 Å ODDMS
4,0*250 мм |
0
204630/8
204630/5
204630/6
204630/3
204630/2 |
–
100
100
100
100
100 |
0
1
3
7
12
12 |
9,80
9,56
9,50
9,41
9,67
9,63 |
0,00
0,62
1,77
1,02
1,31
1,22 |
0
85
510
800
1020
1655 |
100,00
97,55
96,94
96,02
98,67
98,27 |
| |
0
204630/7
204630/10
204630/9
204630/11
204630/12 |
–
80
80
80
80
80 |
0
1
3
7
12
16 |
9,80
9,64
9,42
9,43
8,67
9,18 |
0,00
0,56
0,77
1,10
1,40
1,46 |
0
141
440
920
1470
2000 |
100,00
98,37
96,12
96,22
N.D.
93,67 |
Пример 71
Использование конфокальной лазерной сканирующей микроскопии для детектирования фибрилл инсулина на ионообменнике Source 30Q
Цель
Целью использования конфокальной лазерной сканирующей микроскопии является визуальное определение того, насколько эффективными являются различные регенерированные растворители при удалении фибрилл инсулина с Source 30Q. Сложное программное обеспечение для обработки изображений дает возможность измерения площади фибрилл инсулина на каждой картине, что дает более точную оценку, вместо визуальной оценки каждой картины.
Конфокальный принцип
Принцип использования CLSM заключается в том, что образец окрашивают флуоресцентным красителем. Окрашенный образец помещают под микроскоп, и флуоресцентный краситель возбуждается с использованием лазера. Испускаемый свет, исходящий от флуоресцентного красителя, детектируется, и формируется изображение. Конфокальный лазерный сканирующей микроскоп является таким же, как и обычный конфокальный микроскоп, с использованием лазера в качестве источника света. Свет от лазера проходит через объектив микроскопа через дихроматический расщепитель луча. Дихроматический расщепитель луча представляет собой устройство, дающее возможность свету от лазера проходить через объектив вниз на образец, а испускаемому свету, исходящему от образца, проходить через дихроматический расщепитель луча и идти вверх в трубки фотоумножителей, где детектируется свет и формируется изображение. Между дихроматическим расщепителем луча и трубками фотоумножителей располагается конфокальное точечное отверстие. Конфокальное точечное отверстие работает как фильтр, останавливающий весь свет, исходящий не из фокальных областей, так что он не достигает трубок фотоумножителей. Это означает, что изображение, формируемое здесь, исходит от очень узкой фокальной плоскости. Посредством установки конфокального точечного отверстия возможно перемещение фокальной плоскости изображения вверх и вниз по образцу и получение ряда изображений вдоль оптической (z) оси микроскопа. Этот ряд изображений может быть собран в трехмерное изображение образца.
Source 30Q
Source 30Q представляет собой сильный анионообменник на основе монодисперсных шариков с размером частиц 30 микрон. Матрица состоит из полистирола/дивинилбензола. Source 30Q дает слабую собственную флуоресценцию в области длин волн выше 650 нм. Это означает, что частицы Source 30Q можно увидеть без какого-либо окрашивания.
Thioflavin T
Краситель, используемый для окрашивания фибрилл инсулина, представляет собой Thioflavin T, который используется для окрашивания амилоидных белков. Thioflavin T имеет широкий спектр испускания с максимумом испускания, находящимся в пределах от менее чем 490 нм до более чем 530 нм. Это означает, что можно обнаружить различия между светом, исходящим от фибрилл инсулина (зеленым), и светом собственной флуоресценции, исходящим от частиц (красным).
Способ окрашивания фибрилл инсулина на Source 30Q
0,0385 г сухого Source 30Q помещают в 25-30 мл стеклянный стакан.
500 мкл 96% этанола добавляют к Source 30Q
Добавляют 4,5 мл 0,05 M уксусной кислоты, доведенной до pH 3 с помощью NaOH.
Смесь перемешивают путем осторожного встряхивания стакана.
Добавляют 20 мкл 116,62 мм Thioflavin T в воде Milli-Q-water
Смесь осторожно встряхивают в течение 5 мин.
Теперь образец окрашен и готов к анализу под микроскопом.
Малую каплю смеси, приблизительно 40 мкл, помещают в лунку на предметном стекле и помещают под микроскоп.
Получают по 10 двухмерных картин каждого образца от различных участков лунки.
Оборудование
Условия микроскопа
Объектив: 40*; масло; NA?
Лазер: аргон, 488 нм
Интенсивность лазера: 100%
Конфокальное точечное отверстие: 20 мкм
Фильтр испускания (No 2): 515/30M от Chroma
Фильтр испускания (No 3): HQ650LP от Chroma
Микроскоп: Nikon TE300, снабженный конфокальной сканирующей головкой (фотоумножителем) PCM2000 от Nikon.
Программное обеспечение: Nikon EZ2000 Viewer 2.5.77
Программное обеспечение, используемое для обработки изображений: AnalySIS 3.00
Обработка изображений
Площади фибрилл инсулина измеряют на 10 двухмерных картинах от каждого образца. Для обеспечения того, что каждый образец обрабатывается одним и тем же образом, обработку изображений осуществляют автоматически, путем формирования макрокоманды. Макрокоманда показана ниже. Площадь каждой индивидуальной фибриллы от 10 картин каждого образца сводят вместе в рабочем листе Excel. Обобщенную площадь фибрилл от каждого образца собирают в столбиковую диаграмму для сравнения.
Макрокоманда для измерения площади фибрилл:
Op.Display=1;
docActivate(“picture name”);
DbLoadlmage();
MaximizeContrast();
ShadingCorrection(N*N average filter size;3; lower limit; 1900; upper limit; 2000);
BinarizeColorlmage(ColorThresholds:=NULL, Phase:=-1);
Invert();
EdgeEnhance(size; 5; percent; 70);
SetFrame(Left:=O, Top:=0, Right:=1023, Bottom =1023);
Detect();
ParticleResults();
Op.Display=6;
Option. BurnOverlay= TRUE;
SaveAs(FileName:);
docActivate(“Sheet*”);
SaveAs(FileName:);
Close(AskForSave:=TRUE);
Таблица 8
Измеренная площадь фибрилл на использованном геле Source 30Q до и после регенерации геля с использованием различных регенерационных растворов |
| Регенерационный раствор |
Площадь фибрилл (произвольные единицы) |
| Нет |
485 |
| Нет |
458 |
| NaOAc (0,25% мас./мас. NaOAc, 0,24% мас./мас. tris, 42,5% мас./мас. EtOH, pH 7,5 |
154 |
| NaOH (1M) |
101 |
| HCOOH:вода (50:50) |
68 |
| HCOOH(100%) |
0 |
| HCOOH:EtOH (50:50) |
0 |
Полное удаление фибрилл инсулина получают, используя чистую муравьиную кислоту или смесь муравьиной кислоты и этанола. Смесь муравьиная кислота:вода, 50:50, не полностью удаляет фибриллы, хотя эта смесь представляет собой более эффективный регенерационный раствор, чем гидроксид натрия (1M).
Пример 72
Стандартная процедура регенерации колонки ОФ-ВЭЖХ с помощью муравьиной кислоты в промышленном масштабе
Процедура, описанная ниже, применяется к двум типам колонок, используемых на четырех стадиях хроматографической очистки, при очистке инсулина человека в промышленном масштабе.
Колонка типа 1: Высота слоя 32,5 см.
1. Колонку промывают примерно 1,5 CV 20% мас./мас. этанола в воде со скоростью потока 4,6 CV/час для удаления буферных солей.
2. Направление потока в колонке изменяют на обратное.
3. Колонку промывают примерно 1,1 CV абсолютного этанола со скоростью потока 4,5 CV/час.
4. 1,1 CV чистой муравьиной кислоты закачивают в колонку со скоростью потока 2,1 CV/час.
5. Поток останавливают и колонке дают возможность постоять с муравьиной кислотой в течение 30 минут.
6. Колонку промывают примерно 1,1 CV абсолютного этанола со скоростью потока 4,5 CV/час.
7. Колонку промывают примерно 1,1 CV 20% мас./мас. этанола в воде со скоростью потока 4,5 CV/час.
8. Направление потока в колонке опять переключают на нормальное.
9. Колонку уравновешивают с помощью, минимум, 4 CV 20% мас./мас. этанола в воде со скоростью потока 4,6 CV/час.
Теперь колонка опять готова для использования.
Колонка типа 2: Высота слоя 37,5 см
1. Колонку промывают примерно 1,5 CV 20% мас./мас. этанола в воде со скоростью потока 4,6 CV/час для удаления буферных солей.
2. Направление потока в колонке изменяют на обратное.
3. Колонку промывают примерно 1,0 CV абсолютного этанола со скоростью потока 3,9 CV/час.
4. 0,92 CV чистой муравьиной кислоты закачивают в колонку со скоростью потока 1,9 CV/час.
5. Поток останавливают и колонке дают возможность постоять с муравьиной кислотой в течение 30 минут.
6. Колонку промывают примерно 1,0 CV абсолютного этанола со скоростью потока 3,9 CV/час.
7. Колонку промывают примерно 1,0 CV 20% мас./мас. этанола в воде со скоростью потока 3,9 CV/час.
8. Направление потока в колонке опять переключают на нормальное.
9. Колонку уравновешивают с помощью минимум 4,0 CV 20% мас./мас. этанола в воде со скоростью потока 4,6 CV/час.
Теперь колонка опять готова для использования.
На колонках типа 1 регенерация с помощью муравьиной кислоты осуществляется после каждого 16-го процесса, в качестве предупреждающего действия, для приостановки осаждения компонентов, увеличения противодавлений колонки и увеличения мертвых объемов. За счет применения процедуры регенерации с помощью муравьиной кислоты на первой стадии хроматографической очистки время жизни слоя колонки увеличивается до 2000 циклов.
На колонках типа 2 регенерация с помощью муравьиной кислоты осуществляется обычно после каждого 60-го процесса или, если наблюдается увеличение противодавлений, увеличение мертвых объемов и осаждение примесей. За счет применения процедуры регенерации с помощью муравьиной кислоты время жизни колонки увеличивается до 600 циклов на III стадии хроматографической очистки и до 900 циклов на IV стадии хроматографической очистки.
Матрица колонки, используемая на стадиях I, III и IV хроматографической очистки, состоит из частиц октадецилдиметилзамещенной двуокиси кремния (двуокись кремния ODDMS). Описываемая стандартная процедура применяется для всех типов матриц на основе замещенной двуокиси кремния, используемых в промышленном масштабе.
Процедура также используется в способах регенерации с помощью муравьиной кислоты матриц колонок на основе материала Source Q.
Примеры воздействия на хроматографическую очистку III и IV показаны ниже.
Таблица 9
Хроматографическая очистка III: Воздействие на мертвый объем и противодавление |
| Перед регенерацией с помощью муравьиной кислоты (100%) |
Мертвый объем
(масса) |
Противодавление
(максимальное давление на подающем насосе) |
| 208 кг |
27 бар |
| После регенерации с помощью муравьиной кислоты (100%) |
| Мертвый объем |
Противодавление
(максимальное давление на подающем насосе) |
| 165 кг |
17 бар |
Регенерация уменьшает мертвый объем на 21% и противодавление на 37%.
Фигуры 4A-B показывают воздействие регенерации на препаративную хроматограмму для хроматографической очистки III.
При применении регенерации с помощью муравьиной кислоты достигается улучшение разделения и формы пика инсулина человека (пик инсулина представляет собой большой пик, начинающийся в момент времени 8,20, на верхней фигуре, и в момент времени 14,02, на нижней фигуре).
Пример 73
Регенерация DEAE Sepharose
Загрузка DEAE Sepharose, которая использовалась в большом количестве циклов очистки в способе очистки гормона роста человека, регенерируется с помощью чистой муравьиной кислоты (100% HCOOH). Перед регенерацией Sepharose имеет коричневый цвет, указывающий на осаждение материала на геле. Регенерированная Sepharose гораздо светлее по цвету. Образцы регенерированной Sepharose сравнивают с Sepharose перед регенерацией, используя колориметр (Minolta CR-300), для количественного определения различий в цвете, см. результаты в таблице 10.
Таблица 10
Оценка регенерации DEAE Sepharose, когда она регенерируется в виде суспензии с помощью регенерационного раствора муравьиной кислоты |
| Анализируемый материал Sepharose |
Цветовые координаты |
| L (светлый) |
A (красный) |
b (желтый) |
| Использованный гель до регенерации |
66,81 |
2,37 |
17,22 |
| Использованный гель после 3 часов регенерации |
84,99 |
0,66 |
11,55 |
| Использованный гель после 24 часов регенерации |
87,94 |
0,35 |
7,64 |
| Использованный гель после 24 часов регенерации, когда свежий регенерационный раствор наносится на 12-м часу. |
85,85 |
0,69 |
8,81 |
| Неиспользованный гель, то есть гель, который никогда не использовался для хроматографии |
86,44 |
-0,06 |
2,01 |
Пример 74
Регенерация использованного силикагеля, содержащего агрегаты глюкагона
Глюкагон и глюкагоноподобные пептиды (GLP-1 и GLP-2) являются особенно восприимчивыми к агрегации, когда они образуют фибриллы, то есть агрегаты  -складчатых структур. В настоящем примере осуществляют модельный эксперимент, где глюкагон человека загружают на колонку с силикагелем (как описано в примерах 1-68). Раствору глюкагона дают возможность находиться в колонке в течение 3 дней при 30°C для искусственного создания проблем с давлением и эффективностью, повторяющих проблемы, встречающиеся во время промышленного производства глюкагона. Давление на колонке согласно измерениям равно 3,5 МПа, с использованием элюента 2, как описано в примере 69, со скоростью потока 9 мл/мин при 22°C. -складчатых структур. В настоящем примере осуществляют модельный эксперимент, где глюкагон человека загружают на колонку с силикагелем (как описано в примерах 1-68). Раствору глюкагона дают возможность находиться в колонке в течение 3 дней при 30°C для искусственного создания проблем с давлением и эффективностью, повторяющих проблемы, встречающиеся во время промышленного производства глюкагона. Давление на колонке согласно измерениям равно 3,5 МПа, с использованием элюента 2, как описано в примере 69, со скоростью потока 9 мл/мин при 22°C.
После цикла регенерации с использованием муравьиной кислоты (100%) давление на колонке уменьшилось до 2,67 МПа, иллюстрируя эффективность муравьиной кислоты в качестве регенерационного раствора.
Пример 75
Время жизни колонки – регенерационный раствор, содержащий 0,1M NaOH и 60% мас./мас. этанола в воде
Эксперимент осуществляют, как описано в примере 70, за исключением регенерационного раствора, который в этом эксперименте представляет собой щелочной этанол, как обычно принято при регенерации хроматографических стационарных фаз.
Поток регенерационного раствора составляет примерно 0,1 мл/мин, и эксперименты прекращают через 4 дня, поскольку давление на колонках было >10 МПа. Результаты перед отказом колонок показаны в таблице 11.
Таблица 11
Оценка времени жизни колонки во время продолжительной регенерации с помощью регенерационного раствора, содержащего 0,1M NaOH и 60% мас./мас. этанола в воде |
| Тип колонки |
Колонка № |
Продолжительность
(дни) |
Измеренный С
(%) |
Измеренный Si
(мг) |
Объем (мл) |
Относительное содержание С
(%) |
200 Å ODDMS
4,0*250 мм |
0
204630/26
204630/25
204630/24 |
0
1
2
4 |
9,80
9,80
9,77
9,59 |
0,0
16,2
27,0
31,9 |
0
116
180
228 |
100
100
99,7
97,9 |
Пример 76
Регенерация XAD 1180
Время жизни полимерной смолы обращенной фазы XAD 1180, используемой для концентрации предшественника инсулина из осветленного ферментационного бульона, является ограниченным из-за сильной аккумуляции гидрофобных загрязнений, таких как окрашенные соединения, пептиды и противовспенивающие добавки из ферментации. Обычный регенерационный цикл основан на промывке регенерационным раствором, содержащим 80% этанола в 0,1M лимонной кислоте, pH 3,0, с последующим нагреванием вместе с 5% раствором NaOH при 80°C. Этот способ регенерации не является эффективным при удалении аккумулируемых загрязнений.
Удаление связанной противовспенивающей добавки (Pluronic PE 6100 и P2000) из использованной смолы оценивают с помощью экспериментов с различной концентрацией и временем контакта этанола и изопропанола в статическом режиме и сравнивают с регенерацией муравьиной кислотой (таблица 12). Обработка муравьиной кислотой является превосходной при удалении адсорбированных загрязнений по сравнению со стандартными промышленными регенерационными растворителями.
Таблица 12
Эффективность различных регенерационных растворов при удалении адсорбированных загрязнений противовспенивающих добавок с использованной хроматографической стационарной фазы XAD 1180 |
| Регенерационный растворитель |
Конц. |
Время
(часы) |
Темпера-тура (°C) |
Концентрация противовспенивающей добавки на смоле (ч./млн) |
| Этанол |
84% |
2 |
25 |
20023 |
| Этанол |
92% |
2 |
25 |
13058 |
| Этанол |
99% |
2 |
25 |
8042 |
| Этанол |
84% |
6 |
25 |
25083 |
| Этанол |
84% |
2 |
50 |
14712 |
| Этанол |
99% |
6 |
50 |
9911 |
| Изопропанол |
70% |
2 |
25 |
15899 |
| Изопропанол |
99% |
2 |
25 |
3262 |
| Муравьиная кислота |
99% |
2 |
25 |
670 |
Формула изобретения
1. Способ регенерации хроматографической стационарной фазы, в котором указанная хроматографическая стационарная фаза контактирует с регенерационным раствором, содержащим, по меньшей мере, одну органическую кислоту и менее чем примерно 75% мас./мас. воды, где указанная органическая кислота представляет собой муравьиную кислоту.
2. Способ регенерации хроматографической стационарной фазы по п.1, в котором указанная хроматографическая стационарная фаза контактирует с регенерационным раствором, содержащим, по меньшей мере, одну органическую кислоту и менее чем примерно 1% мас./мас. воды.
3. Способ по п.1, в котором концентрация указанной органической кислоты составляет, по меньшей мере, примерно 25% мас./мас.
4. Способ по п.1, в котором указанный регенерационный раствор содержит органический растворитель.
5. Способ по п.4, в котором указанный органический растворитель выбран из группы, состоящей из этанола, 2-пропанола, ацетонитрила, метанола, 1-пропанола и гексиленгликоля.
6. Способ по п.1, в котором указанная хроматографическая стационарная фаза контактирует с указанным регенерационным раствором внутри хроматографической колонки.
7. Способ по п.6, в котором указанная хроматографическая стационарная фаза регенерируется без повторной набивки колонки.
8. Способ по п.6, в котором указанная хроматографическая стационарная фаза ожижается во время указанной регенерации.
9. Способ по п.6, в котором хроматографический элюент или уравновешивающий буфер вытесняется смешивающимся с водой органическим растворителем перед тем, как указанная хроматографическая стационарная фаза контактирует с указанным регенерационным раствором.
10. Способ по п.9, в котором указанный органический растворитель также присутствует в хроматографическом элюенте или уравновешивающем буфере.
11. Способ по п.9, в котором указанный смешивающийся с водой органический растворитель также присутствует в регенерационном растворе.
12. Способ по п.1, в котором указанная хроматографическая стационарная фаза контактирует с указанным регенерационным раствором вне хроматографической колонки.
13. Способ по п.1, в котором указанная хроматографическая стационарная фаза представляет собой матрицу для ОФ-ВЭЖХ.
14. Способ по п.1, в котором указанная хроматографическая стационарная фаза представляет собой материал типа двуокиси кремния или замещенной двуокиси кремния.
15. Способ по п.14, в котором указанная хроматографическая стационарная фаза представляет собой С4-, С8-, С16-, С18- или фенил-замещенную двуокись кремния.
16. Способ по п.14, в котором указанная хроматографическая стационарная фаза представляет собой полимерный материал.
17. Способ по п.1, в котором указанная хроматографическая стационарная фаза контактирует с указанным регенерационным раствором в течение, по меньшей мере, 1 с, предпочтительно в течение, по меньшей мере, 1 мин, более предпочтительно в течение, по меньшей мере, 5 мин, например от 1 мин до 24 ч, от 1 мин до 5 ч, от 1 мин до 2 ч, от 10 мин до 60 мин.
18. Способ по п.1, в котором указанная хроматографическая стационарная фаза контактирует с указанным регенерационным раствором до тех пор, пока перепад давления по длине хроматографической колонки при нормальной скорости потока не уменьшится, по меньшей мере, на 10%, предпочтительно, по меньшей мере, на 25%, наиболее предпочтительно, по меньшей мере, на 50%.
19. Способ по п.1, в котором контактирование указанной хроматографической стационарной фазы с указанным регенерационным раствором осуществляют при температуре в пределах примерно от 5 до 50°С, предпочтительно, от 10 до 40°С, более предпочтительно от 15 до 30°С, например от 18 до 25°С.
20. Способ по п.1, в котором время жизни указанной хроматографической стационарной фазы составляет, по меньшей мере, 500 хроматографических циклов, предпочтительно, по меньшей мере, 700 хроматографических циклов, более предпочтительно, по меньшей мере, 1000 хроматографических циклов, наиболее предпочтительно, по меньшей мере, 2000 хроматографических циклов.
21. Способ по п.1, в котором указанный способ применяется к указанной хроматографической стационарной фазе в течение каждого хроматографического цикла, по меньшей мере, один раз на каждые 2 хроматографических цикла, по меньшей мере, один раз на каждые 5 хроматографических циклов, по меньшей мере, один раз на каждые 20 хроматографических циклов, по меньшей мере, один раз на каждые 50 хроматографических циклов или, по меньшей мере, один раз на каждые 100 хроматографических циклов.
22. Способ производства терапевтического полипептида или его предшественника, включающий в себя, по меньшей мере, одну хроматографическую стадию, на которой хроматографическая стационарная фаза регенерируется посредством способа регенерации по п.1.
23. Способ по п.22, в котором указанный терапевтический полипептид представляет собой производное, содержащее липофильный заместитель.
24. Способ по п.22, в котором указанный терапевтический полипептид выбирается из группы, состоящей из глюкагона, глюкагоноподобного пептида 1, глюкагоноподобного пептида 2, exendin-4, пептидов TFF, инсулина человека, его аналогов и его производных.
25. Способ по п.22, в котором указанный полипептид или его предшественник выбирается из группы, состоящей из Lys26(N -( -( -Glu(N -Glu(N -гексадеканоил)))-GLP-1(7-37), Arg34-GLP-1(7-37), exendin-4, Lys17Arg30-GLP-2(1-33), Arg30Lys17N -гексадеканоил)))-GLP-1(7-37), Arg34-GLP-1(7-37), exendin-4, Lys17Arg30-GLP-2(1-33), Arg30Lys17N ( ( -Ala(N -Ala(N -гексадеканоил))GLP-2(1-33) и Gly2-GLP-2(1-33). -гексадеканоил))GLP-2(1-33) и Gly2-GLP-2(1-33).
26. Способ по п.22, в котором указанный полипептид или его предшественник выбран из группы, состоящей из
сложного треонинметилового эфира В30 инсулина человека,
сложного треонинэтилового эфира В30 инсулина человека,
AspВ28 инсулина человека,
сложного треонинметилового эфира В30 AspВ28 инсулина человека,
сложного треонинэтилового эфира В30 AspВ28 инсулина человека,
LysB28ProB29 инсулина человека,
MetB-1ArgB0LysB28ProB29 проинсулина человека,
LysB3GluB29 инсулина человека,
GlyA21ArgB31ArgB32 инсулина человека,
дез-(B30)-инсулина человека,
N B29-тетрадеканоил-дез-(B30)-инсулина человека, B29-тетрадеканоил-дез-(B30)-инсулина человека,
N B29-литохолоил- B29-литохолоил- -глутамил-дез-(B30)-инсулина человека, -глутамил-дез-(B30)-инсулина человека,
N B29-октаноил-дез-(B30)-инсулина человека и B29-октаноил-дез-(B30)-инсулина человека и
N B29-октаноил-инсулина человека. B29-октаноил-инсулина человека.
27. Применение способа по п.1 регенерации хроматографической стационарной фазы, используемой при производстве терапевтического полипептида.
28. Хроматографическая стационарная фаза, которая регенерирована посредством способа по п.1.
29. Хроматографическая стационарная фаза по п.28, в которой указанная хроматографическая стационарная фаза представляет собой материал типа двуокиси кремния или замещенной двуокиси кремния.
РИСУНКИ
|
|