Патент на изобретение №2350614
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ N-ЗАМЕЩЕННЫХ 3
(57) Реферат:
Изобретение относится к способу получения N-замещенных 3
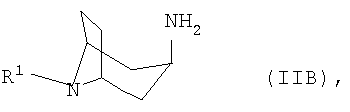
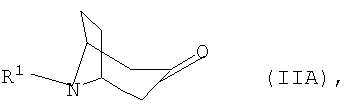
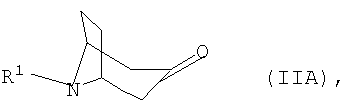
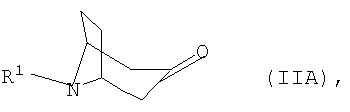
где R1 представляет собой необязательно замещенный остаток, выбранный из группы, включающей С1-С8алкил, С2-С8алкенил, С3-С8циклоалкил и С6-С10арил-С1-С8алкил, отличающийся тем, что либо а) соответствующий 3-оксонортропан формулы IIА
подвергают взаимодействию с арилметиламином формулы IIIA
в которой Ar обозначает необязательно замещенный фенильный остаток либо необязательно замещенный 5- или 6-членный гетероароматический остаток с по меньшей мере одним гетероатомом, выбранным из группы, включающей N, О и S, либо б) соответствующий 3
подвергают взаимодействию с арилальдегидом формулы IIIB
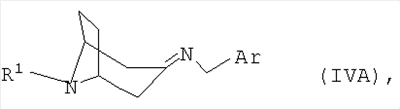
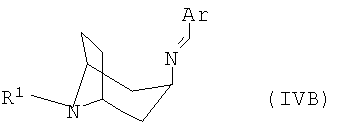
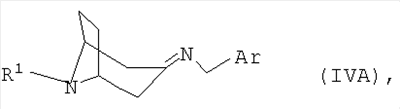
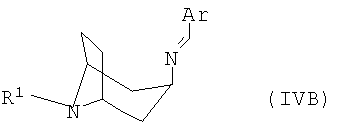
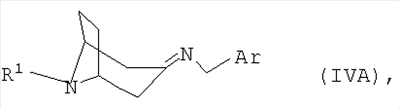
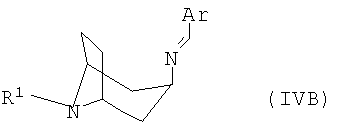
полученный в каждом случае имин формулы IVA или IVB
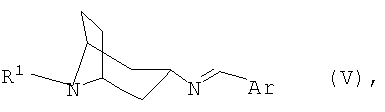
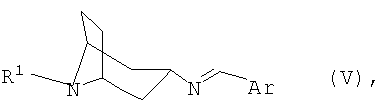
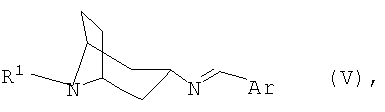
переводят в термодинамически стабильный таутомер, соответственно изомер формулы V
затем гидролизуют и при необходимости переводят в соответствующую кислотно-аддитивную соль. Полученные соединения формулы I являются ценными промежуточными продуктами в химическом синтезе различных фармацевтических действующих веществ или же сами они представляют собой фармацевтические действующие вещества, прежде всего в качестве модуляторов NMDA-рецептора. Технический результат – способ позволяет получать 3
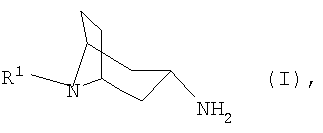
Предпосылки создания изобретения 1. Область техники, к которой относится изобретение Настоящее изобретение относится к способу получения N-замещенных 3
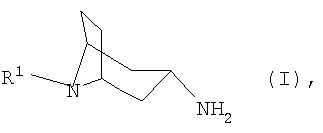
в которой R1 имеет указанные в формуле изобретения значения, из соответствующего 3-оксонортропана или соответствующего 3 2. Уровень техники Соединения формулы I являются ценными промежуточными продуктами в химическом синтезе различных фармацевтических действующих веществ (см., например, A.Nuhrich и др., Eur. Journ. Med. Chem. 31, 12, 1996, сс.957-964), или же сами они представляют собой фармацевтические действующие вещества, прежде всего в качестве модуляторов NMDA-рецептора (NMDA означает N-метил-D-аспартат) (см., например, А.Н.Lewin и др., Journ. Med. Chem, 41, 1998, сс.988-995). Гидрированием оксимов тропанона в присутствии платинового катализатора и разбавителя при повышенном давлении (см., например, S. Archer, Journ. Am. Chem. Soc. 80, 1958, с.4677) получают N-замещенные 3-аминонортропаны преимущественно в Взаимодействие оксимов тропанона с металлическим натрием в спирте (см., например, A. Nuhrich и др., в указанном выше источнике) приводит преимущественно к образованию Следует, однако, отметить, что реализация этого способа в промышленном масштабе по соображениям техники безопасности возможна лишь в ограниченной степени. С учетом вышеизложенного в основу настоящего изобретения была положена задача разработать способ получения N-замещенных 3 Указанную задачу удается решить согласно изобретению с помощью предлагаемого в нем способа, обеспечивающего получение 3 Предлагаемый в изобретении способ позволяет получать 3 Краткое изложение сущности изобретения Объектом изобретения является способ получения N-замещенных 3
где R1 представляет собой необязательно замещенный остаток, выбранный из группы, включающей С1-С8алкил, С2-С8алкенил, С3-С8циклоалкил и С6-С10арил-С1-С8алкил, при этом либо а) соответствующий 3-оксонортропан формулы IIА
подвергают взаимодействию с арилметиламином формулы IIIA
в которой Ar обозначает необязательно замещенный фенильный остаток либо необязательно замещенный 5- или 6-членный гетероароматический остаток с по меньшей мере одним гетероатомом, выбранным из группы, включающей N, О и S, либо б) соответствующий 3
подвергают взаимодействию с арилальдегидом формулы IIIB
полученный в каждом случае имин формулы IVA или IVB
переводят в термодинамически стабильный таутомер, соответственно, изомер формулы V
затем гидролизуют и при необходимости переводят в соответствующую кислотно-аддитивную соль. Изобретение относится далее к новым соединениям формулы V
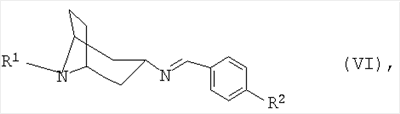
в которой R1 и Ar имеют указанные выше значения, а также к их таутомерам, соответственно, изомерам формул IVA и IVB. Подробное описание изобретения Под используемым выше и в последующем описании понятием “С1-С8алкил” индивидуально или в составе других групп либо остатков подразумевается прямоцепочечная или разветвленная алкильная группа с 1-8, предпочтительно 1-6, прежде всего 1-4, атомами углерода. В качестве примеров при этом можно назвать метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, неопентил и н-гексил. Наиболее предпочтительны метил и этил. Под используемым выше и в последующем описании понятием “С2-С8алкенил” подразумевается прямоцепочечная или разветвленная группа с 2-8, предпочтительно 2-6, прежде всего 2-4, атомами углерода. В качестве примеров при этом можно назвать винил, проп-1-енил, проп-2-енил (аллил), бут-1-енил и пент-1-енил. Наиболее предпочтительны винил и аллил. Под используемым выше и в последующем описании понятием “С3-С8циклоалкил” подразумевается циклоалкильная группа с 3-8, предпочтительно 3-6, прежде всего 5 или 6, атомами углерода. В качестве примеров при этом можно назвать циклопропил, циклобутил, цеклопентил и циклогексил. Под используемым выше и в последующем описании понятием “С6-С10арил” индивидуально или в составе других групп либо остатков подразумевается необязательно замещенная C1-С6алкилом, C1-С6алкоксигруппой, аминогруппой, C1-С6алкиламиногруппой, ди(С1-С6алкил)аминогруппой или галогеном фенильная либо нафтильная группа, предпочтительно незамещенный фенил либо фенил, замещенный 1-3 заместителями, выбранными из группы, включающей С1-С4алкил, С1-С4алкоксигруппу, аминогруппу, С1-С4алкиламиногруппу и ди(С1-С4алкил)аминогруппу. Под группой Ar подразумевается арильная группа с ее раскрытыми выше значениями или незамещенный либо замещенный C1-С6алкилом, C1-С6алкоксигруппой, аминогруппой, C1-С6алкиламиногруппой, ди(С1-С6алкил)аминогруппой или галогеном 5- или 6-членный гетероароматический остаток с по меньшей мере одним гетероатомом, выбранным из группы, включающей N, О и S. Предпочтительно гетероароматический остаток представляет собой пиррол, фуран, тиофен, имидазол, пиразол, тиазол, тиадиазол, тетразол, пиридин, пиримидин или пиразин. Предпочтительным является предлагаемый в изобретении способ, в котором используют соединение формулы I, где R1 представляет собой остаток, выбранный из группы, включающей C1-С6алкил, прежде всего метил или этил, и фенил-С1-С3алкил, прежде всего бензил. Предпочтительным является далее предлагаемый в изобретении способ, в котором используют соединение формулы I, где Ar обозначает фенильный остаток, одно- или двузамещенный C1-С6алкоксигруппой, прежде всего метокси-, этокси- либо изопропоксигруппой, и/или ди(С1-С6алкил)аминогруппой, прежде всего диметиламино- либо диэтиламиногруппой. Наиболее предпочтительно эти заместители находятся в пара-положении относительно метиламиногруппы (формулы IIIA) или карбальдегидной группы (формула IIIB). Каждую из отдельных стадий предлагаемого в изобретении способа предпочтительно проводить в инертном разбавителе, выбранном из группы, включающей необязательно галогенированные углеводороды, такие, например, как бензол, толуол, ксилол, метилциклогексан или дихлорметан, амиды, такие, например, как ацетамид или диметилацетамид, нитрилы, такие, например, как ацетонитрил или пропионитрил, сульфоксиды, такие, например, как диметилсульфоксид (ДМСО), простые эфиры, такие, например, как диэтиловый эфир, трет-бутилметиловый эфир (ТБМЭ) или тетрагидрофуран (ТГФ), и их смеси. Согласно одному из предпочтительных вариантов осуществления предлагаемого в изобретении способа реакцию между соединением формулы IIА и соединением формулы IIIA, соответственно, между соединением формулы IIB и соединением формулы IIIB проводят в способствующих дегидратации условиях. Как правило, в этой реакции используют 0,5-2,0 эквивалента, предпочтительно 0,8-1,2 эквивалента, соединения формулы IIА, соответственно, формулы IIB из расчета на один эквивалент соединения формулы IIIA, соответственно, формулы IIIB. При этом целесообразно использовать примерно эквимолярные количества соединений формулы IIА, соответственно, формулы IIB в пересчете на соответствующие количества соединений формулы IIIA, соответственно, формулы IIIB. В качестве реакций, протекающих в способствующих дегидратации условиях, можно назвать среди прочих таковые, которые проводят в присутствии связывающих воду (так называемых дегидратирующих) агентов, таких, например, как пентаоксид фосфора, тетрахлорид титана и молекулярное сито, или реакцию, которую проводят в присутствии неорганической либо органической кислоты при повышенной температуре и удалении образовавшейся воды путем азеотропной перегонки. Особенно предпочтительно удалять воду с помощью n-толуолсульфоновой кислоты (n-TsOH) в толуоле. Полученные имины формулы IVA или IVB предпочтительно переводить в таутомер формулы V в присутствии соответствующего основания. Особенно предпочтительными являются новые имины формулы VI в которой R1 имеет указанные для формулы I значения, a R2 представляет собой Н, C1-С6алкоксигруппу, прежде всего метоксигруппу, или ди(С1-С6алкил)аминогруппу, прежде всего диметиламиногруппу. Пригодными для использования в указанных целях основаниями являются сильные основания, прежде всего алкоголяты металлов, такие, например, как метанолят натрия, этанолят натрия, этанолят калия, трет-бутанолят натрия, трет-бутанолят калия, неопентанолят натрия, неопентанолят калия, прежде всего трет-бутанолят калия. Как правило, изомеризацию осуществляют в присутствии инертного разбавителя. Предпочтительны для применения в этих целях полярные, апротонные растворители, такие, например, как диметилсульфоксид, ацетонитрил, диметилацетамид, N,N-диметилэтиленмочевина (ДЭМ), N,N- диметилпропиленмочевина (ДПМ) или их смеси. Согласно одному из особенно предпочтительных вариантов реакцию с трет-бутанолятом калия проводят в присутствии ТГФ и ДМСО. Как правило, реакцию проводят при температуре в интервале от 0 до 120°С, предпочтительно от 25 до 100°С, прежде всего от 40 до 80°С. При соблюдении указанных условий изомеризация завершается через 1-15 ч. Гидролиз соединения формулы VI осуществляют, как правило, в присутствии соответствующей кислоты. Предпочтительны для применения в этих целях сильные неорганические или органические кислоты, такие, например, как серная кислота, соляная кислота, фосфорная кислота или трифторуксусная кислота. Особенно предпочтительно проводить гидролиз в двухфазной системе, состоящей из органического, плохо смешивающегося с водой растворителя, прежде всего толуола или дихлорметана, воды и соответствующей кислоты, прежде всего серной кислоты. Гидролиз проводят, как правило, при температуре в интервале от 0 до 100°С, предпочтительно от 10 до 60°С, прежде всего от 15 до 30°С. При соблюдении указанных условий гидролиз завершается через 15-360 мин. Согласно одному из особенно предпочтительных вариантов водную фазу полученного таким путем сырого продукта отделяют и с помощью соответствующего основания, предпочтительно гидроксида щелочного металла, прежде всего едкого натра, слегка подщелачивают, устанавливая значение рН на 7,5-9,5, прежде всего на примерно 8,0. Полученную таким путем водную фазу экстрагируют с помощью не смешивающегося с водой растворителя, предпочтительно алифатического либо ароматического углеводорода, прежде всего толуола. Полученная таким путем органическая фаза может использоваться для регенерации исходных материалов. Водную фазу отделяют и с помощью соответствующего основания, предпочтительно гидроксида щелочного металла, прежде всего едкого натра, сильно подщелачивают, устанавливая значение рН предпочтительно на 10,0-14,0, прежде всего на примерно 12,7. Полученную таким путем водную фазу экстрагируют с помощью не смешивающегося с водой растворителя, предпочтительно необязательно галогенированного, алифатического либо ароматического углеводорода, прежде всего толуола или дихлорметана. Полученные таким путем объединенные органические фазы концентрируют. В результате получают соединение формулы I в виде свободного основания. Это основание по известным методам путем обработки неорганической либо органической кислотой можно переводить в соответствующую кислотно-аддитивную соль. С этой целью свободное основание целесообразно сначала растворять в полярном растворителе, предпочтительно в спирте, таком, например, как метанол, этанол или изопропанол, воде либо в смеси таких растворителей, прежде всего в смеси этанола и воды, а затем с помощью соответствующей кислоты, предпочтительно неорганической кислоты, такой как соляная кислота или серная кислота, устанавливать значение рН на слабоосновное. Выпадающую при этом в осадок соль отделяют, промывают полярным растворителем и сушат. Таким путем получают продукт в чистой кристаллической форме, не требующей последующей очистки. К другим преимуществам предлагаемого в изобретении способа следует отнести высокий выход продукта с единицы объема в единицу времени, достигаемый при осуществлении данного процесса, а также высокий выход и высокую степень чистоты получаемых в каждом случае промежуточных продуктов, которые можно подвергать дальнейшей переработке без хроматографической очистки. Ниже способ получения соединений формулы I более подробно поясняется на примерах, которые лишь иллюстрируют некоторые возможные варианты осуществления изобретения, не ограничивая при этом его объем. Пример 1 Гемисульфат N-метил-3 Смесь из 17,0 г N-метил-3 Смесь из 36,2 г N-метил-3 После 45-минутнуго перемешивания при комнатной температуре фазы разделяют, значение рН водной фазы с помощью едкого натра устанавливают на 8,0 и промывают ее 100 мл толуола. Фазы разделяют, водную фазу смешивают со 150 мл дихлорметана и с помощью едкого натра ее значение рН устанавливают на 12,9, после чего фазы разделяют и водную фазу трижды экстрагируют 150 мл дихлорметана. Объединенные органические фазы концентрируют. В результате получают 8,8 г коричневого масла. Это масло растворяют в 150 мл этанола, с помощью полуконцентрированной серной кислоты значение рН устанавливают на 7,5-6,5 и в течение 1 ч перемешивают при комнатной температуре. Таким путем получают 14,45 г соли с температурой разложения 320°С. Пример 2 Гемисульфат N-метил-3 Смесь из 17,0 г N-метил-3 Смесь из 33,5 г N-метил-3 После 45-минутного перемешивания при комнатной температуре фазы разделяют, значение рН водной фазы с помощью едкого натра устанавливают на 8,0 и экстрагируют ее один раз 50 мл толуола и дважды дихлорметаном порциями по 50 мл. Затем водную фазу смешивают со 150 мл дихлорметана и с помощью едкого натра ее значение рН устанавливают на 12,9. Фазы разделяют и водную фазу 6 раз экстрагируют дихлорметаном порциями по 60 мл. Объединенные органические фазы сушат над сульфатом натрия, фильтруют и концентрируют. В результате получают 17,1 г масла золотисто-коричневого цвета. Это масло растворяют в 200 мл этанола, с помощью полуконцентрированной серной кислоты значение рН устанавливают на 7,0-6,5 и в течение 30 мин перемешивают при комнатной температуре. Таким путем получают 17,5 г соли с температурой разложения 320°С. Пример 3 Гемисульфат N-бензил-3 Смесь из 75,5 г гидрохлорида N-бензилнортропинона, 60 мл воды, 173 мл толуола и 22,5 мл едкого натра перемешивают при комнатной температуре. Затем фазы разделяют и водную фазу экстрагируют 87 мл толуола. Смесь толуольных фаз, 41,2 г 4-метоксибензиламина и 0,22 г n-TsOH кипятят в течение 5 ч на водоотделителе. Затем реакционную смесь концентрируют. В результате получают 95 г N-бензил-3-(4-метокси-бензилимино)тропана, который без последующей очистки подвергают дальнейшей переработке. Смесь из 95 г N-бензил-3-(4-метоксибензилимино)тропана, 240 мл ДМСО, 16,8 г 24%-ного раствора трет-бутанолята калия в ТГФ нагревают до 65-70°С с выдержкой при этой температуре в течение 5 ч. Затем реакционную смесь распределяют между 300 мл толуола и 900 мл воды и водную фазу дважды экстрагируют толуолом порциями по 300 мл. Объединенные толуольные фазы медленно примешивают к смеси из 960 мл воды и 21,7 мл концентрированной серной кислоты. После 60-минутного перемешивания при комнатной температуре фазы разделяют, значение рН водной фазы с помощью едкого натра устанавливают на 8,0, промывают ее 300 мл толуола и насыщают поваренной солью. Затем водную фазу смешивают со 150 мл дихлорметана и ее значение рН с помощью едкого натра устанавливают на 12,9. Фазы разделяют и водную фазу трижды экстрагируют 150 мл толуола. Объединенные органические фазы концентрируют. В результате получают 54,5 г продукта в виде коричневого масла. Это масло растворяют в смеси из 330 мл этанола и 6,67 мл воды и значение рН с помощью 35 мл 32%-ной серной кислоты устанавливают на 8,6. Образовавшийся осадок фильтруют и промывают 265 мл этанола. Полученное твердое вещество сушат при 50°С. Таким путем получают 53,8 г соли в виде белых кристаллов с температурой плавления 283,4-289,4°С. Пример 4 Гемисульфат N-бензил-3 Смесь из 89,5 г полугидрата дигидрохлорида N-бензил-3 Смесь из 104,2 г N-бензил-3 После 60-минутного перемешивания при комнатной температуре фазы разделяют, значение рН водной фазы с помощью едкого натра устанавливают на 8,0 и промывают ее 300 мл толуола. Далее фазы разделяют, водную фазу смешивают с 300 мл толуола и ее значение рН с помощью едкого натра устанавливают на 12,7. Органическую фазу отделяют, а водную фазу дважды экстрагируют 300 мл толуола. Объединенные органические фазы после экстракции при рН 12,7 концентрируют. В результате получают 58,77 г (90,6% от теории) продукта в виде масла желтоватого цвета. Это масло растворяют в смеси из 330 мл этанола и 6,67 мл воды и значение рН с помощью 35 мл 32%- ной серной кислоты устанавливают на 8,6. Образовавшийся остаток фильтруют и промывают 265 мл этанола. Полученное твердое вещество сушат при 50°С. Таким путем получают 66,65 г (83,7% от теории) соли в виде белых кристаллов с температурой плавления 283,4-284,9°С.
Формула изобретения
1. Способ получения N-замещенных 3
где R1 представляет собой необязательно замещенный остаток, выбранный из группы, включающей С1-С8алкил, С2-С8алкенил, С3-С8циклоалкил и С6-С10арил-С1-С8алкил, отличающийся тем, что либо а) соответствующий 3-оксонортропан формулы IIA
подвергают взаимодействию с арилметиламином формулы IIIA
в которой Ar обозначает необязательно замещенный фенильный остаток либо необязательно замещенный 5- или 6-членный гетероароматический остаток с по меньшей мере одним гетероатомом, выбранным из группы, включающей N, О и S, либо б) соответствующий 3
подвергают взаимодействию с арилальдегидом формулы IIIB
полученный в каждом случае имин формулы IVA или IVB
переводят в термодинамически стабильный таутомер, соответственно изомер, формулы V
затем гидролизуют и при необходимости переводят в соответствующую кислотно-аддитивную соль. 2. Способ по п.1, отличающийся тем, что R1 представляет собой остаток, выбранный из группы, включающей C1-С6алкил и фенил-С1-С3алкил. 3. Способ по п.1, отличающийся тем, что Ar обозначает фенильный остаток, одно- либо двузамещенный C1-С6алкоксигруппой и/или ди(С1-С6алкил)аминогрупой. 4. Способ по одному из пп.1-3, отличающийся тем, что реакцию между соединением формулы IIA и соединением формулы IIIA, соответственно между соединением формулы IIB и соединением формулы IIIB, проводят в способствующих дегидратации условиях. 5. Способ по одному из пп.1-3, отличающийся тем, что полученные имины формулы IVA или IVB переводят в присутствии соответствующего основания в таутомер, соответственно изомер формулы V. 6. Способ по одному из пп.1-3, отличающийся тем, что гидролиз соединения формулы V проводят в присутствии соответствующей кислоты. 7. Способ по одному из пп.1-3, отличающийся тем, что каждую из отдельных его стадий проводят в инертном разбавителе, выбранном из группы, включающей необязательно галогенированные углеводороды, амиды, нитрилы, сульфоксиды, простые эфиры и смеси этих соединений. 8. N-замещенный 3
в которой R1 представляет собой остаток, выбранный из группы, включающей С1 -С8алкил и С6-С10арил-С1-С8алкил, а Ar обозначает незамещенный фенил, либо фенильный остаток одно- или двузамещенный C1-С6алкоксигруппой, или его таутомер, соответственно изомер формулы IVA или IVB. 9. 3
|
||||||||||||||||||||||||||

 -АМИНОНОРТРОПАНОВ
-АМИНОНОРТРОПАНОВ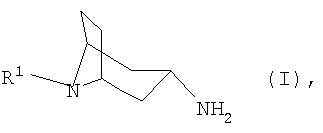
 ,
,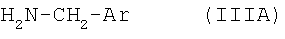 ,
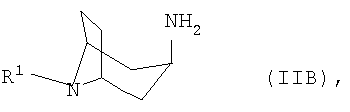
, -аминонортропан формулы IIB
-аминонортропан формулы IIB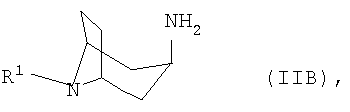
 ,
,
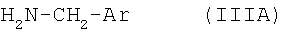 ,
,

 ,
,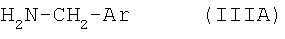 ,
,