Патент на изобретение №2349643
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ КОНЦЕНТРАЦИИ ВИРУСОВ ИЗ ЖИДКИХ СРЕД
(57) Реферат:
Изобретение относится к области биотехнологии и касается способа концентрации вирусов из жидких сред. Способ включает адсорбцию вируса на гидрогеле метакриловой кислоты в концентрации не менее 2,0 мг/мл, сорбции при рН 5,0 от 20 минут до 24 часов при температуре от 4°С до 22°С и далее комплекс вирус-сорбент центрифугируют и вирус элюируют. Преимущество изобретения заключается в сокращении числа стадий и уменьшении времени концентрирования. 1 з.п. ф-лы, 3 табл.
Изобретение относится к области медицины, а именно вирусологии и биотехнологии, и может быть использовано для концентрации вирусов из воды, водных растворов, биологических сред; для выявления вирусов в воде питьевой, сточной, воде открытых водоемов, которые используются как источники водоснабжения, водопроводной воде, воде подземных источников, питьевой воде бутылированной, воде морской и пресных водоемов, которые используются для рекреационных целей, воде плавательных бассейнов; для очистки вирусных суспензий, используемых для изготовления вирусных антигенов и вакцин, очистки вирусов, полученных из тканевых культур, от клеточного детрита.
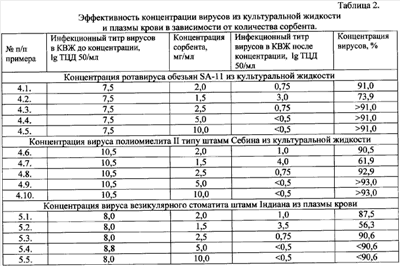
Известный способ включает помещение сорбента в пробу жидкой среды, выдерживание временного интервала с последующим центрифугированием исследуемой пробы, удаление надосадочной жидкости, получение комплекса вирус + сорбент и последующую элюцию вирусов. Недостатками способа являются продолжительность и трудоемкость приготовления геля бентонита, нестандартизированностъ сорбента, которая зависит от места его добычи. В основу изобретения поставлена задача усовершенствования способа концентрации вирусов из жидких сред, в котором применение гидрогеля метилкремниевой кислоты сокращает продолжительность и трудоемкость способа и повышает процент выявления вирусов при исследовании различных жидких сред. Поставленная задача решается тем, что в способе концентрации вирусов из жидких сред, который включает помещение сорбента в пробу жидкой среды, выдерживание временного интервала с последующим центрифугированием исследуемой пробы, удаление надосадочной жидкости, получение комплекса вирус + сорбент и последующую элюцию вирусов, согласно изобретению в качестве сорбента используют гидрогель метилкремниевой кислоты (ГГМКК), который обладает адсорбционными свойствами по отношению к биологическим объектам вирусной природы, временной интервал выдерживают от 20 минут до 24 часов при температуре от +4°С до +22°С, а получение комплекса вирус + сорбент осуществляют без проведения этапа обессоливания. Согласно изобретению ГГМКК, способный в концентрации не менее 30 мг/мл адсорбировать не менее 96% вирусных частиц из водных сред, помещают в пробу водной среды, при этом исследуемую пробу подкисляют раствором кислоты до рН=5,0. Согласно изобретению ГГМКК, который способен в концентрации не менее 2 мг/мл адсорбировать не менее 90% вирусных частиц из биологических сред, помещают в пробу биологической среды. Заявители изобретения являются изобретателями и заявителями способа получения сорбента на основе гидрогеля метилкремниевой кислоты (заявка № а 2006 10083), в котором, благодаря новому способу получения, указанный сорбент имеет объем пор не менее 0,8 см3/г и обладает высокой адсорбционной активностью в отношении веществ с большой молекулярной массой (5-900 кД) и различных биологических объектов, в том числе вирусной природы. Гидрогель метилкремниевой кислоты – это новый эффективный сорбент, который имеет глобулярную структуру пористой кремнийорганической матрицы. На ее поверхности присутствуют гидроксильные группы, благодаря чему поверхность глобул и пор активно сольватируется полярными молекулами воды, и метильные группы, обусловливающие гидрофобные свойства и сродство к тканям и биосубстратам организма. Сорбент ГГМКК безопасен, имеет высокую селективность, адсорбционная емкость по конго красному достигает 3,0-3,5 мг/г (или 4,5-5,0 мкмоль/г). Используется как сорбент в различных отраслях медицины и ветеринарии. Цель изобретения состоит в повышении эффективности концентрации вирусов из проб жидких сред, уменьшении стадий в процедуре выполнения, сокращении времени концентрации, создании возможности концентрации вирусов из минимальных объемов жидких сред, использовании для концентрации готового вещества (сорбента), состав и качество которого гарантируется соответствующими ФС и ТУ. Способ осуществляется следующим образом. ГГМКК, полученный способом, заявленным в № а 2006 10083, имеющий адсорбционные свойства относительно биологических объектов вирусной природы, помещают в пробу жидкой среды, выдерживают от 20 минут до 24 часов при температуре от +4°С до +22°С. ГГМКК, способный в концентрации 30 мг/мл адсорбировать не менее 96% вирусных частиц из водной среды, помещают в пробу водной среды, а также в пробу биологической среды, загрязненные вирусами. Проводят адсорбцию вирусов, после чего ГГМКК концентрируют центрифугированием и удаляют надосадочную жидкость. Затем осуществляют элюцию вирусов и отделяют ГГМКК от раствора центрифугированием. В надосадочной жидкости осуществляют индикацию и идентификацию вирусов. Пример 1. Концентрация вирусов из проб сточной воды. Способ осуществляется как описано в п.п.1.2, при этом пробу воды (500 мл предварительно осветленной сточной воды) подкисляют при помощи 1 М HCl до рН=5,0, в подкисленную пробу помещают сорбент ГГМКК в количестве 1 г и выдерживают 20 минут при температуре 20°С. После экспозиции пробу с сорбентом центрифугируют при 1000 об/мин. в течение 20 минут. Надосадочную жидкость удаляют и получают комплекс вирус + сорбент, процесс обессоливания отсутствует. Пример 2. Концентрация вирусов из проб питьевой воды. Способ осуществляется как описано в п.п.1.2, при этом пробу воды подкисляют при помощи 1 М HCl до рН=5,0, в подкисленную пробу (10 л питьевой воды) помещают сорбент ГГМКК в количестве 20 г и выдерживают до 20 часов при температуре 20°С, надосадок осторожно сливают через край, оставляя на дне стеклянного сосуда 200 мл неплотного белого осадка. Полученный осадок (осадок + небольшое количество надосадка) встряхивают и переносят в стаканы или флаконы для центрифугирования по 250 мл и центрифугируют при 1000 об/мин в течение 20 минут. Образовавшийся белый осадок также не плотный, поэтому надосадочную жидкость снова сливают через край, оставляя на дне флакона 20 мл. Этот осадок встряхивают, переносят в две пробирки для центрифугирования и повторно центрифугируют. После второго центрифугирования плотный осадок формируется на дне пробирок, надосадочную жидкость удаляют пастеровской пипеткой и получают комплекс вирус + сорбент, процесс обессоливания отсутствует. Пример 3. Концентрация вирусов из проб воды открытых водоемов и подземных источников. Способ осуществляется как описано в п.п.1.2, при этом пробу воды (2 л) подкисляют при помощи 1 М HCl до рН=5,0, в подкисленную пробу помещают сорбент ГГМКК в количестве 4 г и выдерживают до 20 минут при температуре 20°С. После экспозиции пробу с сорбентом центрифугируют при 1000 об/мин в течение 20 минут. Надосадочную жидкость удаляют и получают комплекс вирус + сорбент, процесс обессоливания отсутствует. Пример 4.1. Концентрация вирусов из проб культуральной жидкости. Способ осуществляется как описано в п.п.1.3, при этом в культуральную вирусосодержащую жидкость (КВЖ), содержащую ротавирус обезьян SA-11 с инфекционным титром 7,5 lg ТЦД50/мл, добавляют сорбент ГГМКК из расчета 2 мг на 1 мл жидкости. Формирование комплекса ротавирус + сорбент осуществляют при температуре 20°С в течение 10 часов, периодически перемешивая. Образовавшийся комплекс ротавирус + сорбент выделяют низкоскоростным центрифугированием. В надосадочной жидкости отсутствие вируса контролируют, определяя инфекционный титр ротавируса титрованием по ЦПД в чувствительной культуре клеток. Результаты осуществления способа представлены в таблице 2. Пример 4.2. Способ выполняют как в примере 4.1, но ГГМКК помещают в культуральную жидкость из расчета 1,5 мг/мл. Результаты выполнения способа представлены в таблице 2. Пример 4.3. Способ выполняют как в примере 4.1, но ГГМКК помещают в культуральную жидкость из расчета 2,5 мг/мл. Результаты выполнения способа представлены в таблице 2. Пример 4.4. Способ выполняют как в примере 4.1, но ГГМКК помещают в культуральную жидкость из расчета 5,0 мг/мл. Результаты выполнения способа представлены в таблице 2. Пример 4.5. Способ выполняют как в примере 4.1, но ГГМКК помещают в культуральную жидкость из расчета 10 мг/мл. Результаты выполнения способа представлены в таблице 2. Примеры 4.6-4.10. Способ выполняют как в примерах 4.1-4.5, но используют культуральную жидкость, которая содержит вирус полиомиелита II типа штамм Себина с инфекционным титром 10,5 lg ТЦД50/мл. Результаты выполнения способа представлены в таблице 2. Примеры 5.1-5.5. Концентрация вирусов из проб плазмы крови человека. Способ осуществляют как в п.3 и примерах 4.1.-4.5, но вместо вирусосодержащей жидкости используют плазму крови человека, которая содержит вирус везикулярного стоматита (ВВС), штамм Индиана. Результаты осуществления способа представлены в таблице 2. Пример 6. Способ концентрации вирусов-колифагов из проб питьевой воды. Способ осуществляется как описано в п.п.1.2 и в примере 2, только концентрируемые вирусы являются колифагами Т2 (бактериофаг эшерихии Т2), а ГГМКК вносят из расчета 50 мг/мл. После экспозиции пробу с сорбентом центрифугируют при 1000 об/мин в течение 20 минут, надосадочную жидкость удаляют и получают комплекс колифаг Т2 + сорбент, процесс обессоливания отсутствует. Примеры осуществления способа с элюцией вирусов. Пример 7.1. Способ осуществляют как в примере 4.1., но удаленный низкоскоростным центрифугированием комплекс «ротавирус SA-11 + сорбент» помещают в раствор 0,14 М фосфатно-солевого буфера (ФСБ) с рН=8,5, объем которого в 10 раз меньше объема КВЖ, из которой был адсорбирован ротавирус. Полученную суспензию интенсивно встряхивают в течение 10 минут при температуре 20°С и оставляют в тех же условиях для десорбции еще на 20 минут. Сорбент удаляют низкоскоростным центрифугированием. Супернатантную жидкость, содержащую ротавирус, отбирают в стерильную пробирку, доводят ее рН до 7,2-7,4 1 М раствором HCl, и деконтаминируют. Инфекционный титр ротавируса в полученном супернатанте определяют по ЦПД титрованием микрометодом в культуре клеток НЕР-2. Одновременно, в этих же условиях титруют и образцы КВЖ, из которой адсорбируют ротавирус. Титрование повторяют в трех параллельных опытах. Титрование каждого образца проводят в 4 рядах лунок 96-лункового культурального планшета. Инфекционный титр ротавируса в культуральной жидкости и в образцах элюата рассчитывают по методу Кербера. Результаты выполнения способа представлены в таблице 3. Пример 7.2. Способ осуществляют как в примере 7.1, но элюцию проводят при рН=8,0. Результат выполнения способа представлен в таблице 3. Пример 7.3. Способ осуществляют как в примере 7.1, но элюцию проводять при рН=9,0. Результат виполнения способа представлен в таблице 3. Пример 7.4. Способ осуществляют как в примере 7.1, но элюцию проводят при рН=9,3. Результат выполнения способа представлен в таблице 3. Пример 7.5. Способ осуществляют как в примере 7.1, но элюцию проводят в 0,05 М трис-буферном растворе при рН=8,5. Результаты выполнения способа представлены в таблице 3. Пример 7.6. Способ осуществляют как в примере 7.5, но элюцию проводят при рН=8,0. Результаты выполнения способа представлены в таблице 3. Пример 7.7. Способ осуществляют как в примере 7.5, но элюцию проводят при рН=9,0. Результаты выполнения способа представлены в таблице 3. Пример 7.8. Способ осуществляют как в примере 4.6, но выделенный низкоскоростным центрифугированием комплекс «вирус полиомиелита II типа штамм Себина + сорбент» помещают в раствор 0,14 М фосфатно-солевого буфера с рН=8,5, объем которого в 10 раз меньше объема КВЖ, из которой был адсорбирован полиовирус. Полученную суспензию интенсивно встряхивают в течение 10 минут при температуре 20°С и оставляют в тех же условиях для десорбции еще на 20 минут. Сорбент удаляют низкоскоростным центрифугированием. Супернатантную жидкость, содержащую полиовирус, отбирают в стерильную пробирку, доводят ее рН до 7,2-7,4 1 М раствором HCl и деконтаминируют. Инфекционный титр полиовируса в полученном супернатанте определяют по ЦПД титрованием микрометодом в культуре клеток НЕР-2. Одновременно, в тех же условиях титруют и образцы КВЖ, из которой адсорбировали полиовирус. Титрование повторяют в трех параллельных опытах. Титрование каждого образца виполняют в 4 рядах лунок 96-лункового культурального планшета. Инфекционный титр полиовируса в культуральной жидкости рассчитывают по методу Кербера. Результаты выполнения способа представлены в таблице 3. Пример 7.9. Способ виполняют как в примере 7.8, но элюцию проводят в 0,05 М трис-буферном растворе при рН=8,5. Результаты виполнения способа представлены в таблице 3. Пояснение. Элюцию вируса везикулярного стоматита из комплекса «вирус + сорбент» не проводили, поскольку цель состояла в максимальном очищении плазмы крови от вируса, а не в его концентрировании, в этом случае поиск условий десорбции ВВС не нужен. Предлагаемый способ обеспечивает сокращение стадий в процессе выполнения, уменьшение времени концентрирования, возможность концентрации вирусов из минимальных объемов жидких сред, благодаря чему увеличивается точность и повышается процент выявления вирусов при исследовании различных жидких сред.
Формула изобретения
1. Способ концентрации вирусов в жидких средах, включающий сорбцию вирусов из жидких сред на сорбенте в течение временного интервала с последующим отделением комплекса вирус + сорбент центрифугированием и элюцией вирусов, отличающийся тем, что в качестве сорбента используют гидрогель метилкремневой кислоты в концентрации не менее 2 мг/мл сорбента, сорбцию проводят при рН 5,0 от 20 мин до 24 ч при температуре от +4 до +22°С. 2. Способ концентрации вирусов по п.1, отличающийся тем, что используют гидрогель метилкремниевой кислоты, в концентрации не менее 30,0 мг/мл, который обладает способностью адсорбировать не менее 96% вирусных частиц из водных сред, при рН 5,0.
PC4A – Регистрация договора об уступке патента СССР или патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Договор № РД0052354 зарегистрирован 09.07.2009
Извещение опубликовано: 20.08.2009 БИ: 23/2009
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||