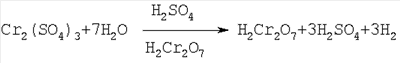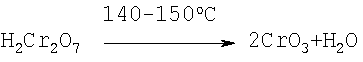Патент на изобретение №2349551
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ХРОМОВОГО АНГИДРИДА
(57) Реферат:
Изобретение может быть использовано при получении хромового ангидрида, используемого в химической, лакокрасочной, текстильной, металлургической и других отраслях промышленности. Способ получения хромового ангидрида включает выщелачивание хромитового концентрата при температуре 140-160°С смесью 60-62%-ной серной кислоты и катализатора – хромового ангидрида, центрифугирование суспензии, окисление методом электролиза сульфата хрома, полученного в результате выщелачивания, в хромовую кислоту, упаривание раствора электролита при температуре 140-150°С до концентрации серной кислоты в упаренном растворе 950-1100 г/л, отделение кристаллов хромового ангидрида от маточного раствора центрифугированием и сушку готового продукта. Предварительно перед сернокислотным выщелачиванием хромитовый концентрат обогащают методом гравитации. Количество катализатора при выщелачивании составляет 70-100% от содержания оксида двухвалентного железа в хромитовом концентрате. После отделения от маточного раствора кристаллы хромового ангидрида дополнительно отмывают в серной кислоте концентрации 60-62% при температуре 140-150°С. Изобретение позволяет получить хромовый ангидрид из бедных рудных смесей с повышением выхода продукта и снижением содержания примесей. 4 табл.
(56) (продолжение): CLASS=”b560m”Журнал прикладной химии, 1940, том XIII, №2, с.170-180. АВЕРБУХ Т.Д., ПАВЛОВ П.Г. Технология соединений хрома. – Л.: Химия, 1973, с.196-215.
Изобретение относится к химической технологии неорганических веществ, в частности к технологии получения хромового ангидрида – вещества, широко используемого во многих отраслях промышленности: химической, лакокрасочной, текстильной, металлургической и др. Так, например, значительные количества хромового ангидрида (оксида хрома VI) потребляет лакокрасочная промышленность для изготовления хромовых пигментов (например, «зеленая окись хрома», «изумрудно-зеленый гидрат окиси хрома» и др.) и лаков и красок на их основе, обладающих большой устойчивостью к действию высоких температур и коррозии. Кроме того, водный раствор хромового ангидрида используется для получения высокочистого металлического хрома – основы для выплавки жаро- и коррозионно-стойких легированных сплавов. Единственным сырьем для получения соединений хрома, в том числе хромового ангидрида, является хромитовая руда (хромит, хромпикотит) или обогащенная руда – хромитовый концентрат, который представляет собой твердый раствор ряда минералов (FeO Al2O3, MgO Fe2O3, MgO Al2O3 и других минералов) в хромите FeO Cr2О3, где хром находится в виде оксида трехвалентного хрома (Cr2О3) – при обычных условиях практически химически инертного к щелочам, кислотам и воде соединения. Поэтому для извлечения хрома из хромита его необходимо перевести из трехвалентного состояния в шестивалентное хорошо растворимое в воде соединение – CrO3. Это может быть достигнуто только в результате окисления оксида двухвалентного железа FeO (входящего в кристаллическую решетку хромита) в оксид трехвалентного железа – Fe2О3. При этом разрушается кристаллическая решетка солей, входящих в состав хромитового концентрата, и оксиды (Fe2О3, Al2О3, MgO, Cr2O3) вступают в химическое взаимодействие с различными реагентами: с кальцинированной содой или с серной кислотой. Известен способ получения хромового ангидрида из хромита, который включает в себя: – обогащение бедных хромитовых руд с получением концентратов; – высокотемпературное окислительное прокаливание шихты, состоящей из хромита, кальцинированной соды и доломита, при температуре 1150-1200°С; выщелачивание спека, фильтрацию шламовой суспензии с получением монохромата натрия – Na2CrO4; – очистку раствора монохромата натрия от алюминия с помощью серной кислоты при температуре 80°С и перевод монохромата натрия в бихромат натрия – Na2Cr2O7; выпуск товарного бихромата натрия в виде чешуйчатого или гранулированного продукта; – разложение бихромата натрия серной кислотой при температуре 200°С Образующиеся расплавленные жидкие хромовый ангидрид и бисульфат натрия мало растворимы друг в друге и легко разделяются декантацией благодаря разнице удельных весов. Расплав хромового ангидрида охлаждают, гранулируют и затаривают (Авербух, П.Г.Павлов. Технология соединений хрома. Л., 1967, стр.46, 156). Процесс получения хромового ангидрида по такой схеме имеет следующие недостатки: – соединения хроматов и бихроматов (натрия, калия и др.), а также их растворы очень токсичны; – процесс очень сложный и многостадийный, требует использования высоких температур при спекании хромитового концентрата с кальцинированной содой и доломитом; сопровождается большим количеством побочных процессов; – процесс требует сложную многоступенчатую очистку отходящих топочных газов и сточных вод. В качестве прототипа взят наиболее близкий по технической сущности и достигаемому результату способ получения хромового ангидрида выщелачиванием хромитового концентрата (содержащего 53,7% Cr2O3 и 13,54% FeO с размером частиц – 2,0+0,0 мм) при температуре 140-150°С смесью 60-62%-ной серной кислоты и катализатора – хромового ангидрида CrO3 (или хромовой кислоты – Н2Cr2O7), взятых в количестве 3,4 т Н2SO4 (или 3,78 м2 60%-ой H2SO4) и 0,01172 т CrO3 на 1,0 т хромитового концентрата с последующим анодным окислением фильтрата – раствора, содержащего сульфаты хрома, примесных металлов и серную кислоту (ЖПХ, 13, №2, 170 (1940); I. Soc. Chem Ind (London), 69, 275, 1950). В результате анодного окисления сульфат хрома переходит в хромовую и серную кислоты. Раствор упаривают при температуре 140-150°С до концентрации серной кислоты в растворе – 940-1100 г/л. При этом хромовая кислота дегидратирует и переходит в хромовый ангидрид. Суспензию фильтруют (центрифугируют) и отделяют кристаллы хромового ангидрида от раствора серной кислоты и сульфатов Fe3+, Al3+, Mg2+ др. Осадок – кристаллы CrO3 и часть неразложившегося хромита сушат при температуре 105-150°С и затаривают, а маточный раствор возвращают на выщелачивание хромитового концентрата. Было получено 482,5 кг хромового ангидрида, выход CrO3 – 68,3% от возможного – 706,6 кг. Недостатком указанного способа является: – малый выход основного вещества – хромового ангидрида (68,3%), что, очевидно, связано с низкой концентрацией в реакционной смеси катализатора – хромовой кислоты – 1,17% (или 8,64% от содержания FeO в хромитовом концентрате, что не способствует полному окислению оксида двухвалентного железа в трехвалентное. В результате этого не происходит полного разложения хромита, и часть Cr2О3 – в составе концентрата (31,7%) остается в нерастворимом остатке (см. стр.2 описания, прототип). – высокое содержание примесей в готовом продукте в виде сульфатов Al3+, Fe3+, Mg2+ и др. Технической задачей изобретения является разработка экономически эффективного способа получения хромового ангидрида из хромитового концентрата, обеспечивающего максимальный выход целевого продукта с минимальным содержанием примесей. Техническим результатом от использования изобретения является обеспечение более полного разложения хромитового концентрата, повышение выхода хромового ангидрида с минимальным содержанием примесей, а также расширение объема использования бедных рудных смесей при одновременном комплексном извлечении ценных компонентов сырья. Технический результат достигается за счет того, что в способе получения хромового ангидрида из хромитового концентрата, включающем выщелачивание при температуре 140-160°С смесью 60-62%-ной серной кислоты и катализатора – хромового ангидрида, центрифугирование суспензии, окисление методом электролиза сульфата хрома, полученного в результате выщелачивания, в хромовую кислоту, упаривание раствора электролита при температуре 140-150°С до концентрации серной кислоты в упаренном растворе 950-1100 г/л, отделение кристаллов хромового ангидрида от маточного раствора центрифугированием и сушку готового продукта, предварительно перед сернокислотным выщелачиванием хромитовый концентрат обогащают методом гравитации, количество катализатора при выщелачивании составляет 70-100% от содержания оксида двухвалентного железа (FeO) в хромитовом концентрате, а после отделения от маточного раствора кристаллы хромового ангидрида дополнительно отмывают в серной кислоте концентрации 60-62% при температуре 140-150°С. Хромитовый концентрат подвергают дополнительному обогащению методом гравитации. Обогащенный хромитовый концентрат направляется на выщелачивание серной кислотой концентрации 60-62% при температуре 140-160°С в присутствии хромового ангидрида в качестве катализатора. Содержание хромового ангидрида в реакционной смеси принимается равным 70-100% от содержания FeO в хромитовом концентрате, при этом т:ж=1:(3,75-4,0). Процесс выщелачивания минерала хромита, очевидно, протекает по схеме: После выщелачивания раствор, содержащий сульфаты Cr3+, Mg2+, Al3+, Fe3+, Ni2+, хромовый ангидрид (в виде хромовой кислоты Н2Cr2О7) и избыток серной кислоты центрифугируют, отделяя от части неразложившегося хромита, и подвергают электролизу при 30-50°С в ванне с диафрагмой и свинцовым анодом с целью окисления трехвалентного сульфата хрома и перевода его в шестивалентный хромовый ангидрид (или хромовую кислоту). Переход трехвалентного сульфата хрома в шестивалентный хромовый ангидрид (в результате электрохимической реакции) протекает по схеме: процесс у анода:
процесс у катода:
суммарная реакция: Неразложившийся хромит возвращают на выщелачивание. После электролиза раствор сульфата концентрируют упариванием при температуре 140-150°С, при этом хромовая кислота дегидратирует, превращается в хромовый ангидрид и выпадает в осадок
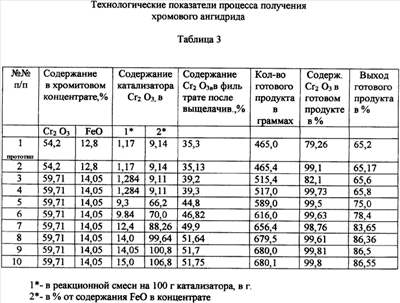
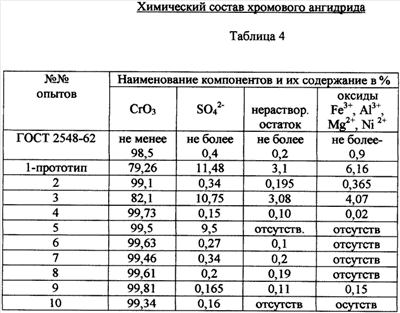
Степень упаривания контролируют по концентрации серной кислоты в суспензии, которая должна быть не ниже 950-1100 г/л H2SO4, поскольку при такой концентрации H2SO4 растворимость кристаллов CrO3 в растворе минимальна (0,49-1,01 мас.%) и они выпадают в осадок. Суспензию центрифугируют, маточный раствор, содержащий серную кислоту (950-1100 г/л H2SO4) и сульфаты Al3+, Mg2+, Fe3+, Ni2+ и др., возвращают на выщелачивание хромитового концентрата, а осадок – кристаллы CrO3 – направляют в реактор с серной кислотой (1100 г/л H2SO4), где при температуре 140-150°С отмывают от примесей Al3+, Mg2+, Fe3+, Ni2+ и др. Отмытые таким образом кристаллы хромового ангидрида центрифугируют, маточный раствор (серная кислота) возвращается на выщелачивание хромитового концентрата, а кристаллы CrO3 сушат при 150°С и затаривают. В табл.1 приведен минеральный состав хромитового концентрата до и после гравитационного обогащения. В табл.2 приведен химический состав хромитового концентрата до и после гравитационного обогащения В табл.3 приведены технологические показатели процесса получения хромового ангидрида В табл.4 приведен химический состав готового продукта – хромового ангидрида. Пример 1 Технология получения хромового ангидрида проведена по схеме прототипа. 1000 г хромитового концентрата, содержащего 54,2% Cr2О3 и 12,8% FeO с размером частиц 2,0+0,0 мм, обрабатывают раствором, состоящим из 3,7 л 60%-ной серной кислоты и 11,7 г хромового ангидрида, взятого в качестве катализатора. Выщелачивание проводят при температуре 140-150°С. Соотношение Т:Ж=1:3,7. Количество CrO3 в реакционной смеси, равное 11,7 г, соответствует 9,14% от содержания окислов двухвалентного железа в хромитовом концентрате. Количество Cr2O3, перешедшего в раствор в результате выщелачивания, – 35,3%. После выщелачивания суспензию центрифугируют, нерастворимый остаток массой 380 г, представляющий собой неразложившиеся минералы, направляют на дальнейшую переработку, а фильтрат (объемом 6,75 л), состоящий из смеси сульфатов Cr3+, Al3+, Mg2+, Fe3+ и др. и серной кислоты, направляют на электролиз с целью окисления трехвалентного хрома в шестивалентный и перевода сульфата хрома в хромовую кислоту. Электролиз ведут в специальных электролизерах с мембраной и со свинцовым анодом при температуре 30-50°С. Далее раствор направляют на упаривание при температуре 140-150°С до концентрации серной кислоты 1100 г/л с целью максимального извлечения CrO3. Упаренную суспензию центрифугируют, маточный раствор, содержащий серную кислоту и сульфаты, направляют на выщелачивание хромитового концентрата, а осадок (готовый продукт) сушат при температуре 150°С и затаривают. Выход готового продукта составил 465,0 г или 65.2% от возможного – 713 г. Пример 2 1000 г хромитового концентрата, содержащего 54,20% Cr2О3 (см. табл.2, ст.2), выщелачивают по схеме 1. Содержание CrO3 в реакционной смеси – 11,7 г. Количество Cr2O3, перешедшее в раствор после выщелачивания, – 35,13%. Суспензию центрифугируют, маточный раствор подвергают электролизу и упариванию (по схеме 1), упаренную суспензию центрифугируют, нерастворимый остаток отмывают в серной кислоте (1140 г/л) при температуре 140-150°С. Выпавшие кристаллы CrO3 сушат при температуре 150°С и затаривают. Выход готового продукта составил 465,4 г. Пример 3 1000 г хромитового концентрата, обогащенного методом гравитации и содержащего 59,71% Cr2О3 и 14,05% FeO (табл.2, ст.3), выщелачивают по схеме 1. Содержание CrO3 в реакционной смеси – 12,84 г. Количество Cr2О3, перешедшее в раствор после выщелачивания, равно 39,13%. Далее процесс ведут по схеме 1. Выход готового продукта составил 515,4 г. Пример 4 1000 г хромитового концентрата, обогащенного методом гравитации и содержащего 59,71% Cr2О3 и 14,05% FeO, выщелачивают по схеме 3. Содержание CrO3 в реакционной смеси – 12,84 г. Количество Cr2O3, перешедшее в раствор после выщелачивания, – 39,13%. Далее процессы электролиза, упаривания электролита, очистки нерастворимого осадка в серной кислоте и сушки кристаллов Cr2О3 ведут по схеме 2. Выход готового продукта составил 517,0 г. Пример 5 1000 г хромитового концентрата, обогащенного методом гравитации и содержащего 59,71% Cr2О3 и 14,05% FeO, выщелачивают раствором, состоящим из серной кислоты (62% H2SO4) и 93,0 г и 14,05% FeO (по схеме 3). Количество Cr2О3, перешедшее в раствор, – 44,8%. Далее процессы электролиза, упаривания электролита, очистки кристаллов CrO3 от примесей в серной кислоте и их сушку проводят по схеме 2. Выход готового продукта составил 589 г или 75% от возможного 785,3 г. Примеры 6-10 Получение кристаллического CrO3 проводят по схеме 5, изменяя концентрацию катализатора в процессе выщелачивания от 103 до 140 г, что составляет от 70,0 до 100% CrO3, от содержания FeO в хромитовом концентрате, равном 14,0%. Таким образом, из приведенных примеров видно, что максимальный выход готового продукта – кристаллов CrO3 – 86,5% самого высокого качества (содержание CrO3=99,81-99,85%) обеспечивается в процессах, которые включают в себя: – обогащение хромитового концентрата с методом гравитации; – сернокислотное выщелачивание хромитового концентрата в смеси с катализатором – хромовым ангидридом, в количестве, равном 70-100% от содержания FeO в хромитовом концентрате. Дальнейшее увеличение концентрации катализатора в реакционном растворе для выщелачивания экономически нецелесообразно, поскольку приводит к существенному повышению коррозионной активности реакционной массы; – электрохимическое окисление сульфата хрома в хромовую кислоту; – упаривание раствора, содержащего смесь хромовой и серной кислот при температуре 140-150°С до содержания H2SO4 в упаренном растворе 940-1100 г/л; – отмывку кристаллов CrO3 в серной кислоте концентрации 60-62% при температуре 140-150°С; – сушку кристаллов CrO3 при температуре 150°С.
Формула изобретения
Способ получения хромового ангидрида из хромитового концентрата, включающий выщелачивание при температуре 140-160°С смесью 60-62%-ной серной кислоты и катализатора – хромового ангидрида, центрифугирование суспензии, окисление методом электролиза сульфата хрома, полученного в результате выщелачивания, в хромовую кислоту, упаривание раствора электролита при температуре 140-150°С до концентрации серной кислоты в упаренном растворе 950-1100 г/л, отделение кристаллов хромового ангидрида от маточного раствора центрифугированием и сушку готового продукта, отличающийся тем, что предварительно перед серно-кислотным выщелачиванием хромитовый концентрат обогащают методом гравитации, количество катализатора при выщелачивании составляет 70-100% от содержания оксида двухвалентного железа в хромитовом концентрате, а после отделения от маточного раствора кристаллы хромового ангидрида дополнительно отмывают в серной кислоте концентрации 60-62% при температуре 140-150°С.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

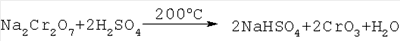
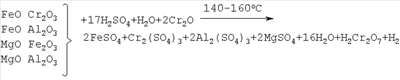
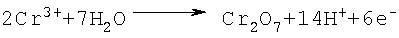
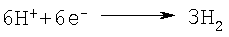 .
.