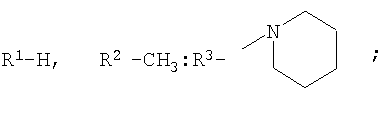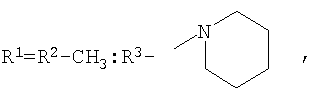Патент на изобретение №2348611
|
||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ N,N-ДИАЛКИЛЗАМЕЩЕННЫХ АМИДОВ АДАМАНТИЛАЛКИЛКАРБОНОВЫХ КИСЛОТ
(57) Реферат:
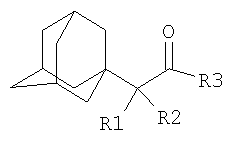
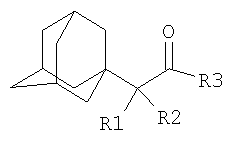
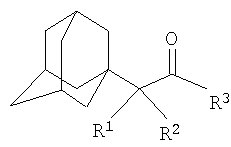
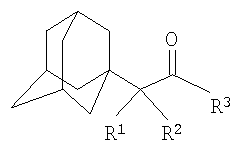
Изобретение относится к химии производных адамантана, а именно к новому способу получения N,N-диалкилзамещенных амидов адамантилалкилкарбоновых кислот общей формулы
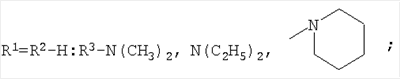
которые могут представлять интерес в качестве полупродуктов в синтезе некоторых биологически активных веществ, обладающих противовирусной активностью. Способ заключается во взаимодействии производного адамантана с диалкиламидами карбоновых кислот, в котором в качестве производного адамантана используют 1,3-дегидроадамантан, а в качестве диалкиламидов карбоновых кислот используют N,N-диметилацетамид, N,N-диэтилацетамид, N-ацетилпиперидин, N-пропионилпиперидин, N-(2-метил)пропионилпиперидин, и процесс протекает при мольных соотношениях реагентов, равных соответственно 1:2-3, в среде исходных диалкиламидов карбоновых кислот при температуре 120-130°С в течение 5-6 часов. Техническим результатом является разработка альтернативного метода получения соединений заявляемой структурной формулы и исключение стадии получения адамантилалкилкарбоновых кислот.
Изобретение относится к химии производных адамантана, а именно к новому способу получения N,N-диалкилзамещенных амидов адамантилалкилкарбоновых кислот общей формулы
которые могут представлять интерес в качестве полупродуктов в синтезе некоторых биологически активных веществ. Известна реакция 1,3-дегидроадамантана с карбоновыми кислотами [Pincock R.E., Torupka E.J. Tetracyclo[3.3.1.13.7.01.3 В данном способе используется катализатор, образуется смесь продуктов N и С-адамантилирования, кроме того, данным способом не получены соединения заявляемой структурной формулы. Наиболее близким к предполагаемому изобретению является способ получения соединений близкой структуры по реакции производного адамантана с аммиаком, анилином или N-алкиламинами (N-метиламином), причем в качестве производного адамантана выступает хлорангидрид адамантилуксусной кислоты [Sasaki Tadashi, Eguchi Shoji, Toru Takeshi. Synthesis of adamantane derivatives from adamantylacetic acid / Bull.Chem. Soc. Japan, 1968, 41, №1, p.233-240 (англ.); Пат.США №3352912, Кл. 260-563, опубл. 14.11.67]. Недостатком данного метода является то, что с его помощью можно получить ограниченное количество производных адамантана, так как используются кислоты ряда адамантана, ассортимент которых ограничен. Получение разветвленных адамантилалкилкарбоновых кислот многостадийно и затруднительно. Кроме этого, не описано получение таким методом большинства веществ заявляемой структурной формулы. Задачей предлагаемого изобретения является разработка технологичного малостадийного метода синтеза N,N-диалкилзамещенных амидов адамантилалкилкарбоновых кислот, протекающего с достаточно высоким выходом по исходному 1,3-дегидроадамантану в отсутствие катализатора. Техническим результатом является разработка нового метода получения соединений заявляемой структурной формулы и исключение стадии получения промежуточных адамантилалкилкарбоновых кислот. Поставленный технический результат достигается в новом способе получения N,N-диалкилзамещенных амидов адамантилалкилкарбоновых кислот общей формулы
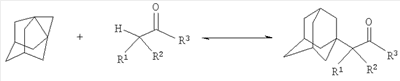
заключающемся во взаимодействии производного адамантана с диалкиламидами карбоновых кислот, причем в качестве производного адамантана используют 1,3-дегидроадамантан, а в качестве диалкиламидов карбоновых кислот используют N,N-диметилацетамид, N,N-диэтилацетамид, N-ацетилпиперидин, N-пропионилпиперидин, N-(2-метил)пропионилпиперидин и процесс протекает при мольных соотношениях реагентов, равном соответственно 1:2-3, в среде исходных диалкиламидов карбоновых кислот при температуре 120-130°С в течение 5-6 часов.
Сущностью метода является реакция получения N,N-диалкилзамещенных амидов адамантилалкилкарбоновых кислот по реакции присоединения к 1,3-дегидроадамантану диалкиламидов карбоновых кислот. Реакция основана на ранее неизвестном свойстве 1,3-дегидроадамантана алкилировать диалкиламиды карбоновых кислот. Протекание данного взаимодействия становится возможным благодаря присутствию незначительной СН-кислотности диалкиламидов карбоновых кислот. Данная реакция не является очевидной, так как в отличие от кетонов или нитрилов карбоновых кислот протон в Разработанный способ позволяет получать достаточно широкий ряд соединений различного строения. Ограничением в выборе исходных соединений является отсутствие в молекуле диалкиламидов карбоновых кислот заместителей, содержащих группы ОН, NH, СООН и им подобных, реакционноспособных по отношению к 1,3-дегидроадамантану и его гомологам. Способ осуществляется следующим образом. К 2-3-кратному мольному избытку соответствующего диалкиламида карбоновой кислоты приливают раствор 1,3-дегидроадамантана в легкокипящем инертном растворителе (диэтиловый эфир), который затем удаляется из реакционной смеси отгонкой. Смесь 1,3-дегидроадамантана и диалкиламида карбоновой кислоты нагревают в течение 5-6 часов при температуре 120-130°С, после чего избыток исходного диалкиламида карбоновой кислоты отгоняют в вакууме водоструйного насоса. Полученный N,N-диалкилзамещенный амид адамантилалкилкарбоновой кислоты очищают перегонкой в вакууме. Выходы продуктов заявляемой структурной формулы составляют 50-60%. Как показали проведенные исследования, оптимальным и технологичным условием проведения реакции присоединения 1,3-дегидроадамантана или его гомологов к диалкиламидам карбоновых кислот является ее осуществление в отсутствие растворителя, в среде избытка исходных диалкиламидов карбоновых кислот при мольном соотношении 1,3-дегидроадамантан : диалкиламид карбоновой кислоты=1:2-3. Меньший избыток приводил к некоторому снижению выхода целевых продуктов за счет гомополимеризации 1,3-дегидроадамантана или его гомологов, или его неполной конверсии. Обнаружено существенное влияние температуры на протекание реакции. Наиболее полное протекание взаимодействия происходит при 120-130°С. Превышение этой температуры приводит к снижению выхода целевых соединений за счет протекания побочной реакции полимеризации 1,3-дегидроадамантана. Снижение температуры приводит к уменьшению выхода целевых соединений за счет уменьшения скорости реакции. Установлено, что проведение реакции при продолжительности нагревания менее 5 часов сопровождается уменьшением конверсии 1,3-дегидроадамантана и снижением выхода целевых продуктов. Увеличение продолжительности взаимодействия выше 6 часов нецелесообразно, так как практически не влияет на выход целевых соединений. Строение синтезированных соединений подтверждено ЯМР 1H спектроскопией, а также элементным анализом. Изобретение иллюстрируется следующими примерами. Пример 1. N,N-Диметиламид 1-адамантилуксусной кислоты
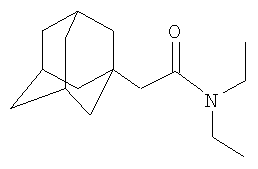
К 5.7 г (0.066 моль) N,N-диметилацетамида в атмосфере сухого азота при комнатной температуре прикапывают раствор 3 г (0.022 моль) свежевозогнанного 1,3-дегидроадамантана (соотношение 1,3-дегидроадамантан : N,N-диметилацетамид=1:3) в 20 мл абсолютного диэтилового эфира, после чего диэтиловый эфир отгоняют, реакционную смесь выдерживают при температуре 120°С в течение 5 часов, после чего избыток N,N-диметилацетамида удаляют перегонкой, продукт перегоняют, очищают перекристаллизацией из н-гексана и получают 2.86 г (0.013 моль, 59%) N,N-диметиламида 1-адамантилуксусной кислоты, Ткип=183-185°С/10 мм рт.ст. Спектр ЯМР 1H, Пример 2. N,N-Диэтиламид 1-адамантилуксусной кислоты
Аналогично к 7.6 г (0.066 моль) N,N-диэтилацетамида в атмосфере сухого азота при комнатной температуре прикапывают раствор 3 г (0.022 моль) свежевозогнанного 1,3-дегидроадамантана в 20 мл абсолютного диэтилового эфира (соотношение 1,3-дегидроадамантан : N,N-диэтилацетамид=1:3), после чего диэтиловый эфир отгоняют, реакционную смесь выдерживают при температуре 125°С в течение 6 часов, после чего избыток N,N-диэтилацетамида удаляют перегонкой, продукт очищают перегонкой в вакууме и получают 3.29 г (0.0132 моль, 60%) N,N-диэтиламида 1-адамантилуксусной кислоты, Ткип=207-209°С/11 мм рт.ст. Спектр ЯМР 1H, Пример 3. N-(1-Адамантил)ацетилпиперидин
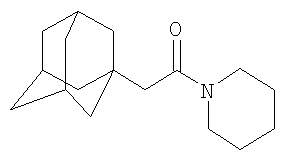
Аналогично к 7.0 г (0.055 моль) N-ацетилпиперидина в атмосфере сухого азота при комнатной температуре прикапывают раствор 3 г (0.022 моль) свежевозогнанного 1,3-дегидроадамантана в 20 мл абсолютного диэтилового эфира (соотношение 1,3-дегидроадамантан : N-ацетилпиперидин=1:2.5), после чего растворитель отгоняют, реакционную смесь выдерживают при температуре 130°С в течение 6 часов, после чего избыток N-ацетилпиперидина удаляют перегонкой, продукт очищают перегонкой в вакууме и получают 3.33 г (0.0128 моль, 58%) N-(1-адамантил)ацетилпиперидина, Ткип=247-249°С/8 мм рт.ст.Спектр ЯМР 1Н, Пример 4. N-2-(1-Адамантил)пропионилпиперидин
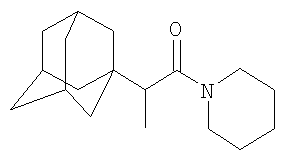
К 6.2 г (0.044 моль) N-пропионилпиперидина в атмосфере сухого азота при комнатной температуре прикапывают раствор 3 г (0.022 моль) свежевозогнанного 1,3-дегидроадамантана (соотношение 1,3-дегидроадамантан : N-пропионилпиперидин=1:2) в 10 мл абсолютного диэтилового эфира, после чего растворитель отгоняют, реакционную смесь выдерживают при температуре 125°С в течение 6 часов, после чего избыток N-пропионилпиперидина удаляют перегонкой, продукт очищают перегонкой в вакууме и получают 3.34 г (0.0121 моль, 55%) N-2-(1-адамантил)пропионилпиперидина, Ткип.=255-258°С/9 мм рт.ст. Спектр ЯМР 1H, Пример 5. N-(2-Метил-2-(1-адамантил))пропионилпиперидин
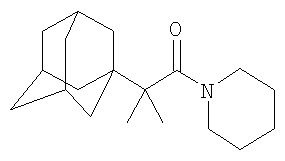
Аналогично к 6.8 г (0.044 моль) N-(2-метил)пропионилпиперидина в атмосфере сухого азота при комнатной температуре прикапывают раствор 3 г (0.022 моль) свежевозогнанного 1,3-дегидроадамантана в 15 мл абсолютного диэтилового эфира (соотношение 1,3-дегидроадамантан : N-(2-метил)пропионилпиперидин=1:2), после чего растворитель отгоняют, реакционную смесь выдерживают при температуре 130°С в течение 6 часов, после чего избыток N-(2-метил)пропионилпиперидина удаляют перегонкой, продукт очищают перегонкой в вакууме и получают 3.18 г (0.011 моль, 50%) N-(2-метил-2-(1-адамантил))пропионилпиперидина, Ткип=265-268°С/ 10 мм рт.ст. Спектр ЯМР1 H, Таким образом, вышеизложенные сведения свидетельствуют о выполнении при использовании заявленного изобретения следующей совокупности условий: – средство, воплощающее заявленное изобретение при его осуществлении, предназначено для применения в различных отраслях промышленности; – для заявленного изобретения в том виде, как оно охарактеризованно в независимом пункте нижеизложенной формулы изобретения, подтверждена возможность его осуществления с помощью вышеописанных в заявке или известных до даты приоритета средств и методов; – средство, воплощающее заявленное изобретение, при его осуществлении способно обеспечить достижение технического результата. Следовательно, заявленное изобретение соответствует требованию “промышленная применимость”. Выводы Разработан новый малостадийный способ получения N,N-диалкилзамещенных амидов адамантилалкилкарбоновых кислот, позволяющий получать соединения заявляемой структурной формулы с достаточно высокими выходами. Структура полученных соединений подтверждена ЯМР 1H-спектроскопией и элементным анализом.
Формула изобретения
Способ получения N,N-диалкилзамещенных амидов адамантилалкилкарбоновых кислот общей формулы
заключающийся во взаимодействии производного адамантана с диалкиламидами карбоновых кислот, отличающийся тем, что в качестве производного адамантана используют 1,3-дегидроадамантан, а в качестве диалкиламидов карбоновых кислот используют N,N-диметилацетамид, N,N-диэтилацетамид, N-ацетилпиперидин, N-пропионилпиперидин, N-(2-метил)пропионилпиперидин, и процесс протекает при мольных соотношениях реагентов, равных соответственно 1:2-3, в среде исходных диалкиламидов карбоновых кислот при температуре 120-130°С в течение 5-6 ч.
|
||||||||||||||||||||||||||


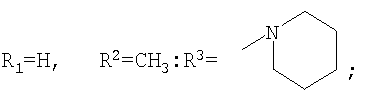
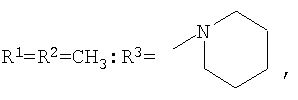
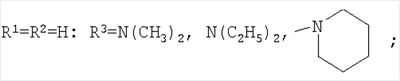
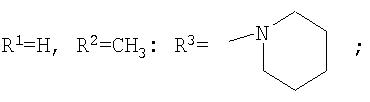
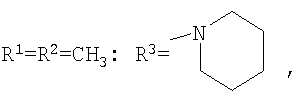
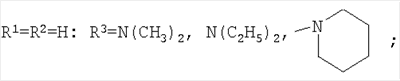
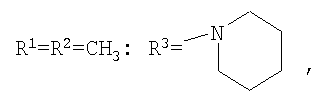
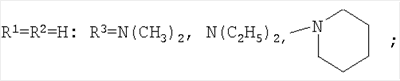
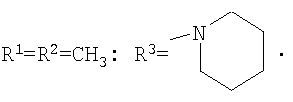
 -положении у карбонильной группы диалкиламидов карбоновых кислот малоподвижен и некаталитические реакции диалкиламидов как СН-кислот не характерны.
-положении у карбонильной группы диалкиламидов карбоновых кислот малоподвижен и некаталитические реакции диалкиламидов как СН-кислот не характерны.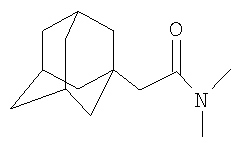
 , м.д.: 1.58 с (12Н, адамант-1-ил), 1.89 с (3Н, адамант-1-ил), 1.96 с (2Н, СН2С(O)), 2.79, 2.96 2 с (3+3Н, -N(CH3)2). Найдено, %: С 75.78, Н 10.93, N 6.38. C14H23NO. Вычислено, %: С 75.97, Н 10.47, N 6.33.
, м.д.: 1.58 с (12Н, адамант-1-ил), 1.89 с (3Н, адамант-1-ил), 1.96 с (2Н, СН2С(O)), 2.79, 2.96 2 с (3+3Н, -N(CH3)2). Найдено, %: С 75.78, Н 10.93, N 6.38. C14H23NO. Вычислено, %: С 75.97, Н 10.47, N 6.33.