Патент на изобретение №2348431
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ЛЕЧЕНИЯ СТЕРОИДОЗАВИСИМОЙ БРОНХИАЛЬНОЙ АСТМЫ
(57) Реферат:
Изобретение относится к медицине, а именно к пульмонологии, и может быть использовано для лечения стероидозависимой бронхиальной астмы. Способ осуществляется следующим образом. Наряду с базисной терапией вводят ронколейкин одновременно в виде ингаляций в дозе 250 тыс. ME, осуществляемых с помощью небулайзера, и инъекций. Введение осуществляют в два этапа, при этом на первом этапе инъекции ронколейкина выполняют внутривенно капельно в дозе 250 тыс. ME курсом 3 процедуры с интервалом 72 часа, а на втором этапе инъекции ронколейкина выполняют с интервалом 2 недели подкожно в наружную поверхность плеча в дозе 250 тыс. ME курсом 4-6 процедур. Изобретение позволяет нормализовать иммунные нарушения и снизить эндобронхиальное воспаление за счет нормализации ронколейкином функций Т-клеток и повышения количества рецепторов к глюкокортикостероидам на мононуклеарах. 2 табл.
(56) (продолжение): Изобретение относится к медицине, а именно к пульмонологии, и предназначено для лечения стероидозависимой бронхиальной астмы.
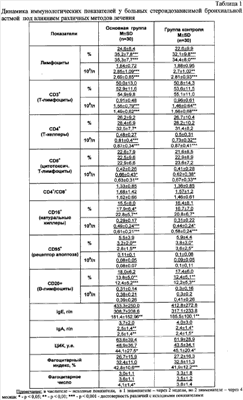
Заявляемое изобретение решает задачу повышения эффективности лечения стероидозависимой бронхиальной астмы. Техническим результатом является нормализация иммунных нарушений, снижение выраженности эндобронхиального воспаления. Это достигается тем, что в известном способе лечения стероидозависимой бронхиальной астмы, включающем базисную терапию с применением в качестве иммуномодулятора ронколейкина, вводимого в виде инъекций и ингаляций в дозе 250 тыс. ME, осуществляемых с помощью небулайзера, введение ронколейкина осуществляют в два этапа, при этом на первом этапе инъекции ронколейкина выполняют с интервалом 72 часа внутривенно капельно в дозе 250 тыс. ME курсом 3 процедуры, а на втором этапе инъекции ронколейкина выполняют с интервалом 2 недели подкожно в наружную поверхность плеча в дозе 250 тыс. ME курсом 4-6 процедур. В предложенном способе лечения сочетанием местного воздействия ронколейкина на иммунокомпетентные клетки трахеобронхиального дерева и системного воздействия препарата достигается нормализация иммунных нарушений, возникающих при стероидозависимой бронхиальной астме. Ронколейкин является лекарственной формой рекомбинантного интерлейкина-2 человека. Он представляет собой полный структурный и функциональный аналог эндогенного ИЛ-2 человека, обладающего иммунокорригирующим действием, направленным на усиление противобактериального, противовирусного, противогрибкового и противоопухолевого иммунитета. Рекомбинантый интерлейкин-2 человека восстанавливает функции Т-клеточного звена иммунной системы, устраняет субпопуляционный дисбаланс Тh1- и Тh2-лимфоцитов и способен повышать количество рецепторов к глюкокортикостероидам на мононуклеарах периферической крови человека. В предлагаемом способе использован ронколейкин для инъекций (Roncoleukin, ампулы 250 тыс. ME), изготовленный ООО «Биотех», Санкт-Петербург, Россия; регистрационное удостоверение №000122/012000, выдано Министерством здравоохранения РФ от 31.08.95 Пример 1. Больной И., 54 года, история болезни №406, с 21.02.05 по 4.03.05 находился на стационарном лечении в пульмонологическом отделении ГБ №4 по поводу обострения смешанной формы стероидозависимой бронхиальной астмы. Сухой кашель по утрам отмечает с детства. С 1996 года беспокоят приступы затрудненного дыхания, в 1999 году верифицирован диагноз бронхиальной астмы, назначено лечение ингаляционными глюкокортикостероидами. В связи с сохранением симптомов астмы на фоне постоянного приема 1800 мкг в сутки беклозона к лечению с 2001 года подключается 15 мг преднизолона перорально. На момент поступления предъявлял жалобы на учащение приступов удушья до 5-6 раз в сутки, из них 1-2 раза ночью, плохо купирующиеся бронхолитиками, приступообразный кашель с вязкой слизисто-гнойной мокротой и одышку при физической нагрузке. При аускультации в легких выслушивались рассеянные сухие свистящие хрипы на фоне жесткого дыхания. В гемограмме: лейкоциты 5,6 тыс. в мкл, СОЭ 18 мм/ч, эозинофилы 4%. Эндоскопически выявлен двусторонний диффузный гнойный эндобронхит, осадок бронхоальвеолярного смыва практически полностью состоял из нейтрофилов. Отмечалось резкое снижение ПСВ, разброс достигал 50%. Среди показателей иммунограммы обращало внимание уменьшение количества Т-лимфоцитов до 45%, Т-хелперов до 21%, повышение В-лимфоцитов до 26%, сниженная фагоцитарная активность нейтрофилов (ФИ-19%, ФЧ-1,5 у.е.). Проведено лечение с дополнительным назначением ронколейкина. Ронколейкин вводили ингаляционно с помощью компрессионного небулайзера в дозе 250 тыс. ME одновременно с внутривенным капельным введением препарата в дозе 250 тыс. ME трехкратно с интервалом в 72 часа. В процессе лечения мокрота приобрела слизистый характер, кашель уменьшился. При выписке дыхание в легких оставалось жестким, хрипы не выслушивались. Снизилась степень обструктивных нарушений: вырос ОФВ1 на 42%, ПОС на 48,2%, МОС25-75 на 15%, однако сохранялся большой разброс суточных колебаний ПСВ (41%). В общем анализе крови наблюдалось снижение СОЭ до 5 мм/ч. В эндоцитограмме смывов с бронхов количество нейтрофилов сохранялось повышенным (до лечения – 92%, к 15 дню терапии – 88%). Число Т-лимфоцитов увеличилось до 62%, Т-хелперов – до 34% на фоне снижения содержания В-лимфоцитов до 7%. Выросла фагоцитарная активность нейтрофилов (ФИ-29%, ФЧ-2,5). Госпитализация 13 дней. Через две недели после выписки из стационара дополнительно 4 раза получил лечение ронколейкином ингаляционно через небулайзер в дозе 250 тыс. ME и одновременно с подкожным введением в дозе 250 тыс. ME интервалом в 2 недели. К концу лечения купировались ночные симптомы астмы, дневные приступы удушья возникали только при значительной физической нагрузке, потребность в бронхолитиках снизилась до 0-2 раз в сутки. ПСВ увеличилось до 82% от должного; ОФВ1 достиг значений 93,4%, ПОС – 96,3%, МОС25-75 – 67%. При фибробронхоскопии описана картина катарального эндобронхита, степень воспаления I, содержание нейтрофилов в лаважной жидкости уменьшилось практически в 2 раза по сравнению с показателем до начала терапии (45,1%). Положительная клинико-функциональная динамика происходила на фоне снижения дозы системных глюкокортикостероидов, и к 4 месяцу наблюдения преднизолон был отменен. Пример 2. Больная П, 48 лет, история болезни №2694, поступила 23.11.06 в пульмонологическое отделение с жалобами на ежедневные дневные и ночные симптомы астмы, потребность в бронхолитиках до 10-15 раз в сутки, приступообразный сухой кашель и чихание при вдыхании резких запахов и холодного воздуха, по утрам кашель с отделением скудной слизисто-гнойной мокроты, затрудненное носовое дыхание, слабость, потливость. С 1990 года страдает аллергическим ринитом (сенсибилизация к пыльцевым аллергенам), с 1999 года возникают приступы удушья в летнее время, назначаются ингаляционные глюкокортикостероиды (альдецин 800 мкг/сутки), бронхолитики по потребности. Через 2-3 года начала отмечать учащение приступов удушья и появление кашля с отделением мокроты желто-зеленого цвета на фоне ОРВИ. С 2000 года непрерывно принимала беклозон в дозе 1600 мкг в сутки. В связи с сохранением частых симптомов астмы на фоне проводимой терапии с 2002 года к лечению подключаются системные глюкокортикостероиды (преднизолон в поддерживающей дозе 30 мг в сутки). По данным анамнеза, несмотря на получаемую базисную терапию, у пациентки сохраняются высокая гиперреактивность бронхов, которая подтверждалась 43% разбросом ПСВ и высокой потребностью в бронхолитиках. Ухудшение самочувствия около 3-4 дней после переохлаждения. При объективном осмотре выявлены жесткое дыхание с рассеянными свистящими хрипами, усиливающимися на форсированном выдохе. В общем анализе крови при поступлении – лейкоциты 18,2 тыс. в мкл, СОЭ 12 мм/ч, эозинофилы 14%, палочкоядерные нейтрофилы 4%. В общем анализе мокроты – лейкоциты сплошь, в цитограмме – преобладание нейтрофилов. При эндоскопическом исследовании диагностирован двусторонний диффузный гнойный эндобронхит, степень воспаления II, содержание нейтрофилов в лаважной жидкости – 32,4×104/л. При спирографии было обнаружено значительное нарушение функции внешнего дыхания по смешанному типу. По данным иммунологического обследования крови обнаружена депрессия Т-клеточного иммунного ответа и снижение фагоцитарной активности нейтрофилов. Была проведена стандартная терапия с подключением ронколейкина. Препарат вводили ингаляционно с помощью компрессионного небулайзера в дозе 250 тыс. ME одновременно с внутривенным капельным введением препарата в дозе 250 тыс. ME трехкратно с интервалом в 72 часа. После первой процедуры было отмечено повышение температуры до 37,2°С, в остальные дни температура была в пределах нормы. Лечение переносила хорошо. В динамике через 14 дней полностью отсутствовали дневные симптомы астмы; сократились число ночных приступов удушья, потребность в бронхолитиках, количество хрипов в легких. ПСВ достигла 63% от должного, однако разброс ПСВ в течение суток оставался значительным – 46%. Показатели спирограммы – увеличение ОФВ1 с 51,4% до 68,9%, ПОС с 39,4% до 60% и МОС25-75 с 27,2% до 48,5%. В общем анализе крови отмечалось нормализация содержания лейкоцитов и эозинофилов. Наблюдалась положительная динамика эндоскопической картины в виде перехода гнойного бронхита в катаральный, однако содержание нейтрофилов в лаважной жидкости сохранялось на прежнем уровне. К этому же времени улучшились показатели иммунограммы: число Т-лимфоцитов увеличилось с 25% до 48%, фагоцитарный индекс вырос с 18 до 44% (норма 52-69%). Длительность стационарного лечения составила 16 дней. Через две недели в амбулаторных условиях больная продолжила лечение ронколейкином ингаляционно через небулайзер в дозе 250 тыс. ME с одновременным подкожным введением в наружную поверхность плеча в дозе 250 тыс. ME курсом 6 процедур с интервалом в 2 недели. К концу лечения купировались ночные симптомы астмы, улучшилось носовое дыхание, потребность в бронхолитиках снизилась до 0-3 раз в сутки. Наряду с положительной клинической динамикой отмечалась положительная динамика показателей функции внешнего дыхания: ПСВ достигла 84% от должного, разброс ПСВ – 14%, ОФВ1 – 88,1%, ПОС до 82,7% и МОС25-75 до 63,8%. При фибробронхоскопии – катаральный эндобронхит, степень воспаления 0-1, нейтрофилы в лаваже уменьшились до 14,6×104/л. По данным иммунологического обследования выявлена нормализация показателей фагоцитарной активности нейтрофилов и Т-клеточного звена иммунитета, снижение ЦИК с 148 у.е. до 15 у.е., уменьшение содержания CD95+-клеток с 0,12×109/л до 0,06×109/л. Стойкая клинико-функциональная динамика позволила снизить поддерживающую дозу преднизолона до 10 мг в сутки. Пример 3 (без ингаляционного введения ронколейкина). Больная З., 42 года, история болезни 3459/290. Находилась на стационарном лечении в пульмонологическом отделении МУЗ ГБ №4 с 21.03.05 по 4.04.05. Страдает бронхиальной астмой 20 лет, с 1993 года постоянный прием 15 мг преднизолона в сутки. При поступлении предъявляла жалобы на постоянные приступы удушья, потребность в бронхолитиках до 10 раз в сутки, из них 3-4 раза ночью, кашель с трудноотделяемой мокротой желтого цвета, повышение температуры тела до 37,4°С, слабость, потливость. Аускультативно в легких выслушивалось жесткое дыхание с большим количеством жужжащих и свистящих хрипов. В общем анализе крови отмечалось повышение лейкоцитов до 15,1 тыс. в мкл с палочкоядерным сдвигом в лейкоформуле до 9%. При фибробронхоскопии бронхов определялся двусторонний диффузный гнойный эндобронхит, степень воспаления II, с большим содержанием бронхиального эпителия и нейтрофилов в смыве с бронхов (24,5×104/л). При спирографии зарегистрировано резкое снижение всех показателей. Исследование иммунного статуса выявило депрессию Т-клеточного звена в виде снижения количества Т-хелперов (8,5%), повышения числа CD95+-клеток (0,2,1×109/л) на фоне увеличения содержания В-лимфоцитов (21%) и уровня ЦИК (201 ед.). К стандартной терапии был подключен ронколейкин внутривенно капельно в дозе 500 тыс. ME трехкратно с интервалом в 72 часа. На фоне проводимой терапии наблюдалось уменьшение выраженности кашля, урежение дневных симптомов астмы с сохранением ночных приступов удушья, нормализация температуры тела, обострение купировалось к 18 дню. Аускультативно выслушивалось жесткое дыхание с единичными хрипами. ПСВ увеличилась с 47% до 64% от должного, однако сохранялся большой суточный разброс (49%). В гемограмме отмечалось снижение лейкоцитов до 9,8 тыс. в мкл, число палочкоядерных нейтрофилов уменьшилось незначительно – 8%. В иммунограмме отмечалось повышение Т-хелперов (до 18,4%), снижение В-лимфоцитов до 16%, уровень ЦИК и содержание CD95+-клеток сохранялось повышенным. Бронхоскопическая картина существенно не изменилась, лаважная жидкость характеризовалась повышенным содержанием нейтрофилов (21,5×109/л). Через две недели амбулаторно пациентке проведено 5-кратное с интервалом в 2 недели подкожное введение ронколейкина в дозе 500 тыс. ME. Несмотря на проведенную иммунокоррекцию сохранялись ночные симптомы удушья (до 3-4 раз в неделю), свистящие хрипы на форсированном выдохе, высокая вариабельность ПСВ (32%). Эндоскопически значимой динамики не выявлено. Больная продолжала принимать преднизолон в поддерживающей дозе 15 мг в сутки. Под наблюдением находилось 60 больных стероидозависимой бронхиальной астмой в стадии обострения, поступивших на стационарное лечение в пульмонологическое отделение многопрофильной Городской больницы №4 г.Чебоксары. В исследование включались пациенты в возрасте 38-80 лет со стероидозависимой бронхиальной астмой с их информированного согласия при выявлении нарушений в иммунном статусе. В предложенном нами способе у 30 пациентов стероидозависимой бронхиальной астмой дополнительно к стандартной общепринятой терапии назначался ронколейкин ингаляционно с помощью компрессионного небулайзера в дозе 250 тыс. ME с внутривенным капельным введением препарата в дозе 250 тыс. ME трехкратно с интервалом в 72 часа, а затем через 2 недели ингаляционно через небулайзер в дозе 250 тыс. ME в с подкожным введением в наружную поверхность плеча в дозе 250 тыс. ME курсом 4-6 процедур с интервалом в 2 недели. Группу контроля составили 30 больных стероидозависимой бронхиальной астмой, получавших на фоне базисной терапии ингаляционную терапию с 0,9% раствором хлорида натрия одновременно с внутривенным капельным введением – ронколейкина в дозе 500 тыс. ME трехкратно с интервалом в 72 часа, а затем через 2 недели 5 мл 0,9% раствора хлорида натрия ингаляционно через небулайзер в сочетании с подкожным введением ронколейкина в дозе 500 тыс. ME, курсом 4-6 процедур с интервалом в 2 недели. Обе группы были однородными по половому, возрастному составу, сопутствующей патологии. На период лечения ронколейкином не допускалось применение других препаратов или каких-либо процедур с иммунотропным эффектом. У всех пациентов проводили динамическое наблюдение основных клинико-лабораторных и функциональных показателей. Показатели иммунного статуса, эндобронхиального воспаления оценивали перед введением ронколейкина, через 2 недели и 4 месяца от начала терапии. Выбранные сроки позволяли оценить исходное состояние иммунореактивности пациентов и провести контроль изменения иммунного статуса и местного воспаления в процессе лечения. На основании полученных данных (таблица 1) установлено, что оба способа введения ронколейкина на фоне базисной терапии обеспечивают положительную динамику показателей общего иммунитета (CD3+, CD4+, CD16+, CD95+, CD20+ – лимфоцитов периферической крови, циркулирующих иммунных комплексов, сывороточных иммуноглобулинов) уже через 14 дней от начала терапии. Достоверных различий в динамике иммунологических показателей сравниваемых групп выявлено не было. В то же время достоверно более выраженное уменьшение активности эндобронхиального воспаления (таблица 2) отмечается при сочетанном введении препарата только к концу 4 месяца. Статистическая обработка полученных результатов проводилась с использованием статистических пакетов программы “STATISTICA 6.0 FOR”. Применялись методы вариационной статистики и непараметрического анализа. Таким образом, предлагаемый способ существенно повышает эффективность лечения стероидозависимой бронхиальной астмы: позволяет достичь значительного улучшения бронхоскопической картины в виде снижения выраженности эндобронхита и уменьшения содержания нейтрофилов к лаважной жидкости, сопровождается нормализацией показателей ФВД, ускоряет достижение ремиссии и позволяет сократить поддерживающую дозу системных глюкокортикостероидов.
Формула изобретения
Способ лечения стероидозависимой бронхиальной астмы, включающий базисную терапию с применением в качестве иммуномодулятора ронколейкина, вводимого одновременно в виде ингаляций в дозе 250 тыс.ME, осуществляемых с помощью небулайзера, и инъекций, отличающийся тем, что введение ронколейкина в виде инъекций и ингаляций осуществляют в два этапа, при этом на первом этапе инъекции ронколейкина выполняют внутривенно капельно в дозе 250 тыс. ME курсом 3 процедуры с интервалом 72 ч, а на втором этапе инъекции ронколейкина выполняют с интервалом 2 нед подкожно в наружную поверхность плеча в дозе 250 тыс.ME курсом 4-6 процедур.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||

 2
2