|
|
(21), (22) Заявка: 2007133340/14, 05.09.2007
(24) Дата начала отсчета срока действия патента:
05.09.2007
(46) Опубликовано: 27.02.2009
(56) Список документов, цитированных в отчете о
поиске:
Адрес для переписки:
675000, Амурская обл., г.Благовещенск, ул. Горького, 95, ГОУ ВПО АГМА Росздрава, ПИО
|
(72) Автор(ы):
Доровских Владимир Анатольевич (RU),
Симонова Наталья Владимировна (RU)
(73) Патентообладатель(и):
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ АМУРСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ Росздрава (RU)
|
(54) СПОСОБ И УСТРОЙСТВО ДЛЯ ЭКСПЕРИМЕНТАЛЬНОГО МОДЕЛИРОВАНИЯ АКТИВАЦИИ ПРОЦЕССОВ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ БИОЛОГИЧЕСКИХ МЕМБРАН
(57) Реферат:
Группа изобретений относится к экспериментальной медицине и может быть использовано для создания экспериментальной модели активации процессов перекисного окисления липидов биологических мембран у лабораторных крыс и мышей. Для этого лабораторных животных в условиях in vivo облучают с помощью ультрафиолетовой горелки ДРТ-240-1 ежедневно по 3 минуты в течение 7 дней. Для облучения животных помещают в не пропускающую ультрафиолетовые лучи стеклянную камеру. В поднимающуюся крышку стеклянной камеры встроена ультрафиолетовая горелка. В стенку стеклянной камеры встроен секундомер и вентилятор. Способ и устройство позволяет обеспечить создание экспериментальной модели активации процессов перекисного окисления липидов биологических мембран без применения фармакологических препаратов и при условии сохранения стандартного температурного режима, а также избежать частичного рассеивания ультрафиолетовых лучей в окружающем пространстве. 2 н.п. ф-лы, 1 ил., 4 табл.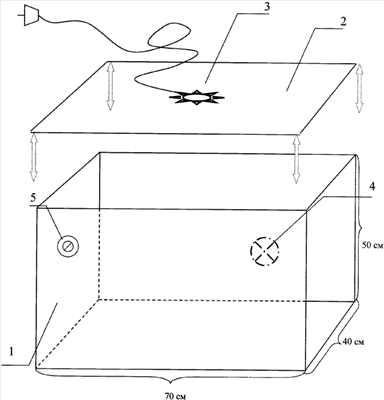
(56) (продолжение):
Изобретение относится к экспериментальной медицине и может быть использовано для создания экспериментальной модели активации процессов перекисного окисления липидов биологических мембран у мышей и крыс.
Известны способы экспериментального моделирования активации перекисного окисления липидов у крыс и мышей путем введения им четыреххлористого углерода [1], охлаждения в климатокамере «Fentron» при температурном режиме -15°С по 3 часа ежедневно в течение 15 дней [2].
Недостатками этих способов являются необходимость применения токсического препарата или необходимость длительного охлаждения животных.
Известны стенд для исследования биологических объектов, выполненный в виде стеклянной камеры, в стенке которой установлен вентилятор и ультрафиолетовые лампы [3] и устройство для содержания мелких лабораторных животных, выполненное в виде камеры с крышкой [4].
Технический результат: создание экспериментальной модели активации процессов перекисного окисления липидов биологических мембран и устройства для этой цели.
Предложен способ моделирования активации процессов перекисного окисления липидов биологических мембран у мышей и крыс путем облучения в условиях ультрафиолетовой камеры. Предлагаемая камера позволяет создать модель экспериментальной активации процессов перекисного окисления биологических мембран и изучить влияние ультрафиолетового облучения на интенсивность процессов пероксидации в теплокровном организме.
Способ заключается в том, что экспериментальных животных (крыс или мышей), находящихся в стандартных условиях вивария, ежедневно в течение 7 дней помещали в ультрафиолетовую камеру (время экспозиции – 3 минуты).
Предложена камера с встроенной ультрафиолетовой горелкой ДРТ-240-1, изготовленная из стекла, поскольку стекло не пропускает ультрафиолетовые лучи. В связи с этим вся область ультрафиолетового спектра сконцентрирована в пределах камеры и конечный эффект воздействия на теплокровный организм по своему масштабу будет полным. Камера предназначена для облучения крыс и мышей, которые являются основным объектом экспериментальных исследований в медицине.
На чертеже представлена ультрафиолетовая камера, которая представляет собой установку прямоугольной формы 1, выполненную из стекла. Крышка 2 плотно закрывает камеру. В нее встроена ультрафиолетовая горелка 3, подключающаяся к электрической сети. В камеру осуществляется подача воздуха с помощью встроенного на боковой поверхности вентилятора 4. Камера 1 снабжена секундомером 5, прикрепленным к боковой стенке. Электрическое питание осуществляется от стандартной электрической розетки (220 В).
Объект исследования (крысы в количестве 10 штук) помещаются в камеру 1, которая впоследствии плотно закрывается стеклянной крышкой 2. Включается горелка 3 и вентилятор 4 для подачи воздуха. Секундомером 5 засекается точное время экспозиции. По истечении времени экспозиции горелка 3 отключается от электрической сети.
Ультрафиолетовая камера позволяет осуществлять полное облучение экспериментальных животных в области всего спектра без частичного рассеивания ультрафиолетовых лучей в окружающем пространстве.
На 8й день эксперимента животные забивались путем декапитации.
Результаты учитывались по соотношению содержания продуктов ПОЛ (гидроперекисей липидов, диеновых коньюгатов, малонового диальдегида) в крови и внутренних органах в сравнении с животными контрольной группы, обработаны статистическими методами с использованием критерия Уилкоксона – Манна – Уитни.
Способ и устройство позволяет обеспечить создание экспериментальной модели активации процессов пероксидации у мышей и крыс без применения фармакологических препаратов и при условии сохранения стандартного температурного режима.
Исследовано содержание продуктов перекисного окисления липидов в крови и тканях печени, легкого, миокарда животных контрольной и экспериментальной групп (табл.1, 2, 3, 4).
Таблица 1
Соотношение содержания продуктов перекисного окисления липидов в крови контрольных и экспериментальных животных |
| Показатели |
Контрольная группа |
Экспериментальная группа |
| Гидроперекиси липидов (нмоль/мл) |
16,5±2,5 |
24,3±2,6 (Р<0,05) |
| Диеновые коньюгаты (нмоль/мл) |
70,8±6,8 |
96,2±6,0 (р<0,05) |
| Малоновый диальдегид (нмоль/мл) |
2,6±0,05 |
3,0±0,05 |
В результате проведенных исследований содержание гидроперекисей липидов в крови животных экспериментальной группы достоверно выше на 32,1% по отношению к контрольной группе животных, диеновых коньюгатов – на 26,5% (р<0,05), уровень малонового диальдегида выше лишь на 13,4%.
В печени экспериментальных животных содержание гидроперекисей липидов на 35,9% выше по отношению к контролю (р<0,01), диеновых коньюгатов – на 29% (р<0,01), малонового диальдегида – на 34,1% (р<0,05).
Таблица 2
Соотношение содержания продуктов перекисного окисления липидов в печени контрольных и экспериментальных животных |
| Показатели |
Контрольная группа |
Экспериментальная группа |
| Гидроперекиси липидов (нмоль/г) |
6,8±1,0 |
10,6±1,8 (р<0,01) |
| Диеновые коньюгаты (нмоль/г) |
52,2±3,9 |
73,5±5,1 (р<0,01) |
| Малоновый диальдегид (нмоль/г) |
6,0±0,5 |
9,1±0,4 (р<0,05) |
Таблица 3
Соотношение содержания продуктов перекисного окисления липидов в ткани легкого контрольных и экспериментальных животных |
| Показатели |
Контрольная группа |
Экспериментальная группа |
| Гидроперекиси липидов (нмоль/г) |
0,86±0,02 |
1,5±0,01 (р<0,001) |
| Диеновые коньюгаты (нмоль/г) |
35,3±4,4 |
61,6±4,8 (Р<0,001) |
| Малоновый диальдегид (нмоль/г) |
1,5±0,04 |
1,7±0,04 |
Уровень гидроперекисей липидов и диеновых коньюгатов в ткани легкого облучаемых крыс достоверно выше на 42,7% по сравнению с животными контрольной группы (р<0,001), содержание малонового диальдегида – на 11,8%.
Таблица 4
Соотношение содержания продуктов перекисного окисления липидов в ткани миокарда контрольных и экспериментальных животных |
| Показатели |
Контрольная группа |
Экспериментальная группа |
| Гидроперекиси липидов (нмоль/г) |
21,5±1,6 |
30,2±1,5 (Р<0,05) |
| Диеновые коньюгаты (нмоль/г) |
96,8±8,6 |
98,0±8,5 |
| Малоновый диальдегид (нмоль/г) |
2,7±0,06 |
2,6±0,08 |
В ткани миокарда животных экспериментальной группы достоверно выше по отношению к контролю содержание гидроперекисей липидов – на 28,9% (р<0,05), уровень диеновых коньюгатов и малонового диальдегида в облучаемой группе крыс практически не отличается от аналогичных показателей в контрольной группе животных.
ИНФОРМАЦИОННЫЕ ИСТОЧНИКИ
1. Арчаков А.И. Микросомальное окисление. – М.: Наука, 1975. – 324 с.
2. Доровских В.А. Фармакологическая регуляция холодового воздействия в эксперименте: Дис. д-ра мед. наук. – Ленинград, 1987. – 368 с.
3. SU 1673064 А1. Стенд для исследования биологических объектов. (Куйбышевский филиал Научно-производственного объединения «Гигиена и профпатология»), 16.08.1991.
4. SU 145084 А1. Устройство для содержания мелких лабораторных животных. (В.К.Суслов), 01.01.1962.
Формула изобретения
1. Способ экспериментального моделирования активации процессов перекисного окисления липидов биологических мембран у лабораторных животных в условиях in vivo, отличающийся тем, что с помощью ультрафиолетовой горелки ДРТ-240-1 экспериментальных животных подвергают воздействию ультрафиолетовых лучей ежедневно по 3 мин в течение 7 дней, помещая в стеклянную камеру, не пропускающую ультрафиолетовые лучи.
2. Устройство для осуществления способа экспериментального моделирования активации процессов перекисного окисления липидов биологических мембран по п.1, выполненное в виде стеклянной камеры, не пропускающей ультрафиолетовые лучи, в поднимающуюся крышку которой встроена ультрафиолетовая горелка ДРГ-240-1, а в стенку – секундомер и вентилятор.
РИСУНКИ
|
|