Патент на изобретение №2348041
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ДИАГНОСТИКИ АСПИРИНОРЕЗИСТЕНТНОСТИ У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА
(57) Реферат:
Изобретение относится к медицине, а именно к кардиологии. Для осуществления способа диагностики аспиринорезистентности у больных ишемической болезнью сердца до начала лечения аспирином в тромбоцитах периферической крови больных определяют активность реакций НАД- и НАДФ-зависимых дегидрогеназ (НАДФ-ГДГ, НАДФН-ГДГ, НАДН-ГДГ, НАД-ЛДГ). Затем рассчитывают коэффициент кофакторного обмена тромбоцитов (ККОТ) по формуле ККОТ=ИОР/ИВН, где ИОР – отношение уровней активности НАДФ- и НАДФН-зависимых реакций глутаматдегидрогеназы, а ИВН – отношение уровня активности НАДН-зависимой реакции глутаматдегидрогеназы к уровню активности НАД-зависимой реакции лактатдегидрогеназы. И при значении ККОТ выше 0,3 диагностируют аспиринорезистентность, а при значении ККОТ, равном или меньше 0,3, – чувствительность к аспирину. Способ позволяет проводить диагностику аспиринорезистентности больных до начала лечения аспирином и обеспечивает высокую точность прогноза. 2 табл.
(56) (продолжение): CLASS=”b560m”resistance., Indian J Physiol Pharmacol. 2007 Apr-Jun;51(2):109-17. PMID: 18175654 [PubMed – indexed for MEDLINE]. HIRMEROVA J et al Clinical importance of aspirin resistance, Vnitr Lek. 2004 Jun;50(6):462-9., PMID: 15346640 [PubMed – indexed for MEDLINE].
Изобретение относится к медицине, а именно к кардиологии. Может быть использовано при лечении больных ишемической болезнью сердца (ИБС). Известен способ определения аспиринорезистентности (АР) посредством агрегатометрии тромбоцитов, при котором АР выявляют через 2-3 дня и через 5 дней после начала приема аспирина [1]. В случае АР пациенту назначают другой препарат. Диагностическая ценность известного способа ограничена, так как метод не позволяет диагностировать АР до начала лечения препаратом. Задачей изобретения является разработка достоверного способа диагностики аспиринорезистентности у больных ИБС до начала лечения аспирином. Поставленная задача решается тем, что до начала терапии аспирином в тромбоцитах периферической крови больных ИБС определяют показатели активности реакций НАД- и НАДФ-зависимых дегидрогеназ, после чего вычисляют коэффициент кофакторного обмена тромбоцитов (ККОТ) по формуле ККОТ=ИОР/ИВН. ИОР представляет собой отношение уровней активности НАДФ- и НАДФН-зависимых реакций глутаматдегидрогеназы, т.е. ИОР=НАДФ-ГДГ/НАДФН-ГДГ. ИВН представляет собой отношение уровня активности НАДН-зависимой реакции глутаматдегидрогеназы к уровню активности НАД-зависимой реакции лактатдегидрогеназы, т.е. ИВН=НАДН-ГДГ/НАД-ЛДГ. При значении ККОТ выше 0,3 прогнозируют аспиринорезистентность, а при значении ККОТ, равном или меньше 0,3, – чувствительность больного к аспирину. Значение 0,3 получено на основании сопоставления значений ККОТ у больных ИБС до начала терапии аспирином с оценкой аспиринорезистентности этих больных. Известно, что у больных ИБС при исследовании показателей гемостаза выявляется гиперфункциональное состояние тромбоцитов и изменения плазменного звена. Данные нарушения значительно ухудшают прогноз заболевания и осложняют лечение. Ключевую роль в системе гемостаза играют тромбоциты. Именно эти клетки создают основу клеточного звена системы гемостаза, а также в тромбоцитах синтезируется ряд факторов плазменного звена гемостаза, в частности фибриноген. Функция тромбоцитов во многом определяется состоянием их внутриклеточной метаболической системы. Именно через метаболическую систему реализуется действие ряда веществ на тромбоциты, в том числе и воздействие аспирина. Активность дегидрогеназ наиболее объективно отражает состояние внутриклеточного обмена [2]. ЛДГ (КФ 1.1.1.27) – фермент гликолиза, обратимо катализирующий окисление лактата в пировиноградную кислоту с участием в качестве кофермента НАД. ЛДГ занимает ключевое положение в регуляции цитоплазматического уровня НАДН/НАД. В случае избытка НАДН в цитоплазме ЛДГ восстанавливает пируват до лактата, который затем удаляется из клетки (анаэробная реакция ЛДГ). В то же время, при активации аэробных процессов ЛДГ может окислять лактат до пирувата с образованием НАДН (аэробная реакция ЛДГ). Глутаматдегидрогеназы осуществляют окислительное дезаминирование Г-глутаминовой кислоты. Выделяют две глутаматдегидрогеназы, использующие в качестве кофакторов НАД (КФ 1.4.1.2) или НАДФ (КФ 1.4.1.4). Ферментативные реакции глутаматдегидрогеназ являются обратимыми, соответственно аммиак в присутствии НАД(Ф)Н и Способ выполняется следующим образом. Выделяют тромбоциты из 9 мл венозной крови по методу, предложенному Савченко Е.А. с соавт. [3]. Для этого венозную кровь смешивают с 3,8% раствором цитрата натрия в соотношении 9:1. Обогащенную тромбоцитами плазму получают путем центрифугирования стабилизированной крови при 140g в течение 10 минут. Из пробирки осторожно отбирают супернатант, переносят в чистую пробирку и доводят до 10 мл буфером №1 (90 мМ MaCl, 5 мМ KCl, 36 мМ цитрата натрия, 10 мМ ЭДТА, рН=7,2). Полученную смесь центрифугируют 15 мин при 400g. Осадок ресуспензируют в 10 мл буфера №1 и повторно центрифугируют 1 мин при 400g. Отбирают 9 мл супернатанта, который вновь центрифугируют при 400g в течение 15 мин. Супернатант аккуратно сливают, а к осадку добавляют 10 мл буфера №2 (0,13 М NaCl, 0,02 М Трис-HCl буфера, 0,03 М ЭДТА, 0,015 М глюкозы, рН=7,4) и центрифугируют в том же режиме. После чего осадок разводят в 400 мкл буфера №2 и центрифугируют 50 с при 140g. Для дальнейших исследований отбирают 250 мкл супернатанта. Для определения активности реакций НАД- и НАДФ-зависимых дегидрогеназ из забранного супернатанта с тромбоцитами отбирают объем, содержащий 107 клеток. Разрушают тромбоциты методом осмотического лизиса с доведением общего объема до 2,5 мл (конечная концентрация клеток составляет 4×106/мл). Активность реакций ЛДГ, НАДФ-ГДГ, НАДФН-ГДГ и НАДН-ГДГ определяют с помощью биолюминесцентного метода [4, 5]. Для этого в 150 мкл инкубационной смеси, содержащей соответствующий субстрат и кофактор, вносят 50 мкл суспензии разрушенных тромбоцитов. Конкретные значения концентраций субстратов и кофакторов, а также рН среды для определения активности ферментативных реакций представлены в таблице 1.
Для определения активности реакций НАДФН-ГДГ и НАДН-ГДГ в инкубационную смесь дополнительно вносят NH4CL в концентрации 5.0 мМ. После инкубации исследуемых проб при 37°С в течение 30 минут для реакций ЛДГ и НАДФ-ГДГ или в течение 5 минут для реакций НАДФН-ГДГ и НАДН-ГДГ к 200 мкл инкубационной смеси добавляют 50 мкл флавинмононуклеотида (ФМН) в концентрации 1,5×10-5 М, 50 мкл 0,0005% миристинового альдегида и 10 мкл ферментативной системы НАДН:ФМНоксидоредуктаза-люцифераза (все реактивы биолюминесцентной системы разводят в 0,1 М К+,Na+-фосфатном буфере с рН 7,0). После смешивания биолюминесцентных реактивов и инкубационной пробы измеряют свечение с помощью биохемилюминометра, например, марки “БЛМ-8803”. Учитывая, что в клетках имеется определенное количество субстратов для течения различных метаболических реакций, в том числе и катализируемых исследуемыми ферментами, определяют показатели, условно названные “субстратный фон ферментов”. Определение проводят в тех же условиях, что и для вышеперечисленных дегидрогеназ, но в инкубационную смесь вместо соответствующего субстрата вносят буфер. В результате измерения свечения на биохемилюминометре получают относительные значения активности исследуемых ферментов. Чтобы получить абсолютные значения активности, строят графики зависимости интенсивности биолюминесценции от концентрации НАДН и НАДФН (калибровочный график). Для этого 200 мкл стандартного раствора НАД(Ф)Н в диапазоне 10-9-10-4 М вносят в кюветы биолюминометра, содержащие ФМН, миристиновый альдегид и НАД(Ф)Н:ФМНоксидоредуктазу-люциферазу в концентрациях, указанных выше, после чего производят измерение интенсивности биолюминесценции. В связи с широким диапазоном рН буферов, используемых для определения активности реакций дегидрогеназ, а также рН-зависимостью биолюминесценции ферментативной системы из светящихся бактерий, калибровочные графики строят для каждого рН буфера. Активность реакций НАД- и НАДФ-зависимых дегидрогеназ рассчитывают по формуле:
где А – активность реакций дегидрогеназ, Е на 2×105 тромбоцитов (1Е=1 мкмоль/мин [2]);
V – объем пробы, мл; Т – время инкубации, мин. Затем рассчитывают индекс ИОР по соотношению уровней активности реакций НАДФ-ГДГ и НАДФН-ГДГ (ИОР=НАДФ-ГДГ/НАДФН-ГДГ). Индекс ИВН определяют по соотношению уровней активности реакций НАДН-ГДГ и НАД-ЛДГ (ИВН=НАДН-ГДГ/НАД-ЛДГ). Затем находят коэффициент ККОТ по соотношению индексов ИОР и ИВН (ККОТ=ИОР/ИВН). Величина ККОТ выше 0,3 свидетельствует об АР, а ККОТ, равный или меньший 0,3, свидетельствует о чувствительности тромбоцитов больных ИБС к аспирину. В таблице 2 представлены результаты обследований 38 больных ИБС, проведенных в кардиохирургическом отделении Красноярской краевой клинической больницы №1. До начала лечения аспирином (в дозе 75-150 мг/сутки) по предложенному способу в тромбоцитах крови больных определяли активность реакций НАД- и НАДФ-зависимых дегидрогеназ, рассчитывали ККОТ и в зависимости от его значения диагностировали АР или чувствительность тромбоцитов к аспирину. Через 5 суток после начала лечения аспирином у наблюдаемых больных определяли аспиринорезистентность по данным агрегатометрии: у 12 больных диагностировали АР, у 28 больных тромбоциты оказались чувствительными к действию аспирина. Данные, представленные в таблице, показывают, что у 36 из 38 больных отмечено совпадение прогноза по предложенному способу (94,7%).
Клинические примеры. Пример 1. Больной Н., 64 года (данные №11 в табл.2). История болезни №4984. Находился на стационарном лечении в кардиохирургическом отделении Краевой клинической больницы №1 с 02.03.2005 по 05.04.2005 с диагнозом ИБС, стенокардия 3 функционального класса, постинфарктный кардиосклероз. Проведено обследование по предложенному способу. В тромбоцитах периферической крови больного определены активности реакций дегидрогеназ: ЛДГ=947,15 мкЕ на 2×105 тромбоцитов; НАДФ-ГДГ=3,39 мкЕ на 2×105 тромбоцитов; НАДН-ГДГ=54,03 мкЕ на 2×105 тромбоцитов; НАДФН-ГДГ=46,94 мкЕ на 2×105 тромбоцитов. Рассчитаны значения ИОР, ИВН и ККОТ: ИОР=0,07; ИВН=0,06; ККОТ=0,07/0,06=1,17. Согласно изобретению ККОТ>0,3 свидетельствует об аспиринорезистентности больного. При поступлении больного в стационар проведено исследование агрегации тромбоцитов (лазерный агрегометр “Biola”, Москва) с АДФ (5 мкМ): светопропускание составило 40%. Через 5 суток после начала лечения аспирином проведена агрегатометрия тромбоцитов с АДФ: светопропускание составило 60%. Следовательно, на фоне лечения аспирином снижения агрегации тромбоцитов не произошло, что подтверждает аспиринорезистентность больного. Пример 2. Больной А., 54 года (данные №17 в табл.2). История болезни №8205. Находился на стационарном лечении в кардиохирургическом отделении Краевой клинической больницы №1 с 08.04.2005 по 12.05.2005 с диагнозом: ИБС, стенокардия 2 функционального класса, постинфарктный кардиосклероз. Проведено обследование по предложенному способу. В тромбоцитах периферической крови больного определены активности реакций дегидрогеназ: ЛДГ=14373,42 мкЕ на 2×105 тромбоцитов; НАДФ-ГДГ=0,00 мкЕ на 2×105 тромбоцитов; НАДН-ГДГ=170,48 мкЕ на 2×105 тромбоцитов; НАДФН-ГДГ=37,63 мкЕ на 2×105 тромбоцитов. Рассчитаны значения ИОР, ИВН и ККОТ: ИОР=0,00; ИВН=0,01; ККОТ=0,0. Согласно изобретению ККОТ<0,3 свидетельствует об аспириночувствительности больного. При поступлении больного в стационар проведено исследование агрегации тромбоцитов с АДФ (5 мкМ): светопропускание составило 41%. Через 5 суток после начала лечения аспирином проведена агрегатометрия тромбоцитов с АДФ: светопропускание составило 27%. Следовательно, на фоне лечения аспирином произошло снижение агрегации тромбоцитов, что подтверждает чувствительность больного к аспирину. Технический результат от реализации предложенного способа: – возможность диагностики у больных ИБС до начала лечения аспирином; – высокий уровень совпадения прогноза – 94,7%. Таким образом, предложенный способ позволяет достоверно диагностировать аспиринорезистентность больных ИБС до начала терапии и может быть рекомендован для применения в клинической практике. Источники информации 1. Момот А.П. Патология гемостаза. Принципы и алгоритмы клинико-лабораторной диагностики. – Спб.: ФормаТ, 2006. – С.95. 2. Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1998. – 704 с. Формула изобретения
Способ диагностики аспиринорезистентности у больных ишемической болезнью сердца, заключающийся в определении резистентности тромбоцитов к аспирину, отличающийся тем, что до начала терапии аспирином в тромбоцитах периферической крови больных определяют активность реакций НАД- и НАДФ-зависимых дегидрогеназ, после чего вычисляют коэффициент кофакторного обмена тромбоцитов (ККОТ) по формуле ККОТ=ИОР/ИВН, где ИОР представляет собой отношение уровней активности НАДФ- и НАДФН-зависимых реакций глутаматдегидрогеназы (т.е. ИОР=НАДФ-ГДГ/НАДФН-ГДГ), а ИВН представляет собой отношение уровня активности НАДН-зависимой реакции глутаматдегидрогеназы к уровню активности НАД-зависимой реакции лактатдегидрогеназы (т.е. ИВН=НАДН-ГДГ/НАД-ЛДГ), и при значении ККОТ выше 0,3 прогнозируют аспиринорезистентность, а при значении ККОТ, равном или меньше 0,3, – чувствительность к аспирину.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -кетоглутаровой кислоты может участвовать в синтезе глутамата. НАД- и НАДФ-зависимые глутаматдегидрогеназы являются регуляторными в системе аминокислотного обмена.
-кетоглутаровой кислоты может участвовать в синтезе глутамата. НАД- и НАДФ-зависимые глутаматдегидрогеназы являются регуляторными в системе аминокислотного обмена.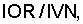
 [С] – разница концентраций НАД(Ф)Н в пробах “фермент” и “фон фермента”, мкмоль;
[С] – разница концентраций НАД(Ф)Н в пробах “фермент” и “фон фермента”, мкмоль;