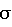Патент на изобретение №2348038
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ДИАГНОСТИКИ ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ НА ДОКЛИНИЧЕСКОЙ СТАДИИ
(57) Реферат:
Изобретение относится к медицине, в частности к нефрологии и эндокринологии. Способ диагностики доклинической стадии диабетической нефропатии у детей с инсулинозависимым сахарным диабетом при отсутствии белка при общеклиническом исследовании мочи характеризуется тем, что исследуют белковые фракции мочи, разделенные с помощью электрофореза в градиентном 8-25%-ном полиакриламидном геле с детергентом додецилсульфатом и при определении на уропротеинограмме единственной фракции альбумина молекулярной массой 67 кДа в количестве до 26 мг/л состояние пациента интерпретируют как норму; при обнаружении дополнительно к альбумину протеинов с молекулярной массой 58-156 кДа: трансферрина, гаптоглобина, IgG, постальбумина и преальбумина диагностируют клубочковую дисфункцию; при обнаружении протеинов с молекулярной массой от 10 до 58 кДа: рибонуклеазы, мономерного гемоглобина, ретинол-связывающего белка, легких цепей IgG,
Изобретение относится к медицине, в частности к нефрологии и эндокринологии. Способ обеспечивает диагностику нефропатии у больных сахарным диабетом на доклинической стадии, в период функциональных изменений, когда терапевтические мероприятия способствуют устранению этих изменений. Механизмы развития поражения почек при сахарном диабете (СД) до конца неясны. В патогенезе диабетической нефропатии (ДН) имеет значение сочетание многих факторов: генетических, метаболических, иммунологических, гемодинамических, действие которых взаимосвязано и взаимообусловлено [Дедов И.И., Шестакова М.В., Миленькая Т.М. Сахарный диабет: ретинопатия, нефропатия. М.: Медицина, 2001; 175; Ракова Н.Г. Патогенез и лабораторная диагностика диабетической нефропатии (обзор литературы). Клин. лаб. диагностика 1998; 5: 3-9.]. Частота поражения почек у больных сахарным диабетом составляет 40%-50%, и у 48% из них смерть от хронической почечной недостаточности (ХПН) возникает в возрасте до 20 лет [Viberti G.C., Mackintosh D., Bilous R.W. and al. Proteinuria in diabetes mellitus: role of spontaneous and experimental variation of glycemia. Kidney Int. 1982; 21: 714-720; Пермитина М.В., Воробьева В.А., Бабаш Г.Б., Плоткина В.А., Азова Е.А. Диагностика диабетической нефропатии у детей и подростков. Рос.педиатр. журнал 2005; 6: 44-47.]. В последние годы ДН становится одной из ведущих причин ХПН во многих странах Западной Европы, США, Японии [Rychlik I., Milenberger-Miltenyi G., Ritz E. The drama of the continuous increase in end-stage renal failure in patients with type II diabetes mellitus. Nephrol. Dial. Transplant. 1998; 13: 6-10]. Выявление ДН напрямую зависит от длительности заболевания. Считается, что в течение 5 лет от начала болезни ДН не развивается. Максимальный пик развития нефропатии приходится на 15-20 лет стажа диабета. Наиболее ранний клинический признак ДН – транзиторная и, затем, постоянная протеинурия – обнаруживается на IV стадии при уже необратимых изменениях в почках [Mogensen C.E., Christensen C.K., Vittinghus E. The stages in diabetic renal disease with emphasis on the stage of incipient diabetic nephropathy. Diabetes 1983; 32: 64-78]. Третья стадия (начинающаяся ДН) проявляется микроальбуминурией. Микроальбуминурия указывает уже на необратимый патологический процесс в почках. Хотя на ранней стадии развития, она может быть ликвидирована коррекцией гипергликемии. Рациональная инсулинотерапия в течение недели снижает почечный кровоток, клубочковую фильтрацию и ликвидирует микроальбуминурию. Однако обратному развитию гипертрофии почечной ткани способствует только длительная (более 3-х месяцев) адекватная инсулинотерапия [Mogensen C.E., Christensen C.K. Predicting diabetic nephropathy in insulin-dependent patients. N. Engl. J. Med. 1984; 311: 84-93; Mogensen C.E., Christensen C.K. Blood pressure change and renal function in incipient and overt diabetic nephropathy. Hypertension 1985; 7: 64-73; Mogensen C.E. Microalbuminuria as a predictor of clinical diabetic nephropathy. Kidney Int. 1987; 31: 673-689; Rudberg S., Ullman E., Oahlquist G. Relationship between early metabolic control and the development of microalbuminuria – a longitudinal study in children with type I (insulin-dependent) diabetes mellitus. Diabethol. 1993; 36: 1309-1314]. Четвертая стадия ДН характеризуется постоянной протеинурией и повышением артериального давления. Изучение отношений структуры – функции показали, что увеличение мезангиального матрикса, потеря зарядо- и размероселективности базальной мембраны клубочков строго соотносятся с клинической манифестацией ДН [Prete D.D., Anglani F., Ceol М. and al. Molecular biology of diabetic glomerulosclerosis. Nephrol. Dial. Transpl. 1998; 13: 20-25]. С появлением клинических признаков нефропатии прогноз для жизни больного ухудшается. Морфологически выявляется диабетический гломерулосклероз. Пятая стадия ДН проявляется ХПН, и через 2-5 лет при отсутствии рациональной терапии больной погибает. Обычно от начала ДН до смерти проходит от 5 до 15 лет [Дедов И.И., Шестакова М.В., Миленькая Т.М. Сахарный диабет: ретинопатия, нефропатия. – М.: Медицина, 2001; 175]. Существующие на сегодняшний день методы лабораторной диагностики в большинстве своем не дают возможности выявлять доклинические стадии диабетической нефропатии (ДН). До настоящего времени остается открытым вопрос о том, что первично при развитии ДН – изменения клубочков или канальцев. Однако недостатком данных способов является то, что они не позволяют диагностировать ДН на доклинической стадии, когда экскреция альбумина остается нормальной, так как именно в этот период функциональных изменений необходимо начинать лечебные мероприятия, способствующие снижению скорости прогрессирования нефропатии. Все это делает весьма актуальным разработку новых способов лабораторной диагностики поражения почек у больных инсулинозависимым сахарным диабетом (ИЗСД), тем более, что биопсия почек производится у этих больных крайне редко. Цель настоящего изобретения является диагностика доклинической стадии диабетической нефропатии у детей с инсулинозависимым сахарным диабетом. Технический результат достигается благодаря использованию метода автоматизированного электрофореза в градиентном полиакриламидном геле. На основании анализа уропротеинограмм были выделены клубочковый, канальцевый и смешанный типы протеинурии. К маркерам клубочковой протеинурии относят белки с молекулярной массой более 60 кДа (альбумин, пре- и постальбумины, трансферрин, гаптоглобин, димерный альбумин, IgG). Канальцевую протеинурию определяют низкомолекулярные белки (с молекулярной массой менее 58 кДа – рибонуклеаза, лизоцим, Достоверность технического результата подтверждается исследования 203-х пациентов с сахарным диабетом I типа (112 мальчиков и 91 девочка) в возрасте от 3 до 16 лет, наблюдавшихся в эндокринологическом отделении областной детской клинической больнице №1 г.Воронежа с 1995 по 2003 год. Всем пациентам проводилось клинико-лабораторное обследование по плану больных диабетологического и нефрологического профилей. Было выделено 2 группы: I группу составили 183 ребенка со стажем диабета 1-5 лет, не имевших эпизодов протеинурии в общеклинических анализах мочи в течение заболевания; II группу – группу сравнения – 48 детей со стажем сахарного диабета более 5 лет, имевших протеинурию (транзиторную (58,3%) или персистирующую (41,7%)) в общеклинических анализах мочи. У пациентов II группы была диагностирована ДН. В связи с длительностью наблюдения 28 больных вошли как в I, так и во II группы. Сравнительная характеристика детей приведена в таблице 1. Как видно из таблицы, группы больных СД были сопоставимы по полу, наследственной предрасположенности и стадии заболевания, но различались по возрасту, давности болезни, по показателям биохимического анализа крови, обще клинического анализа мочи, уровню артериального давления. Контрольную группу составили 20 здоровых детей от 3 до 16 лет, не имевших изменений в анализах крови и мочи, не болевших в течение месяца до исследования УПГ респираторно-вирусной инфекцией. При статистической обработке результатов исследования для определения достоверности различий показателей использовался критерий t Стьюдента. Различия считались статистически значимыми при р<0,05. Было проведено исследование 251 уропротеинограммы: у 20 здоровых детей (контрольная группа), 183 больных сахарным диабетом 1 группы и 48 пациентов – II группы. На основании анализа УПГ было идентифицировано 15 белковых фракций,табл.2. Уропротеинограммы всех обследованных в 100% случаев в своем составе имели альбумин. Альбумины, являясь основным компонентом белкового спектра плазмы крови, составляют основу и белков мочи. Уропротеинограммы здоровых детей (контрольной группы) были представлены единственной фракцией альбумина, концентрация альбумина в моче у здоровых детей не превышала 26 мг/л, в среднем 13,2±5,05 мг/л, что было определено как физиологический тип УПГ. В I группе больных СД (без ДН, с давностью болезни 1-5 лет) частота встречаемости идентифицированных белковых фракций, кроме альбумина, не превышала 42%. Наиболее часто определялись клубочковые протеины – трансферрин (42,1%), иммуноглобулин G (41,5%), постальбумин (39,9%) и преальбумин (26,3%). Из канальцевых белков чаще выявлялись легкие цепи IgG (38,8%). Во II группе больных (с ДН, со стажем диабета более 5 лет) все вышеперечисленные белковые фракции определялись практически у всех пациентов, достоверно чаще по сравнению с I группой (р<0,001). Обращает на себя внимание тот факт, что частота встречаемости клубочковых протеинов в обеих исследованных группах значительно превышала встречаемость канальцевых белков. У единичных детей как I, так и II группы определялись низкомолекулярные уропротеины ( В зависимости от качественно-количественного состава белковых фракций в уропротеинограмме было выделено 4 типа протеинурии: 1 – физиологический – на УПГ определялась единственная фракция альбумина (молекулярная масса 67 кДа) в количестве до 26 мг/л; 2 – клубочковый – на УПГ, кроме альбуминовой фракции, определялись протеины с молекулярной массой 58-160 кДа, относящиеся к маркерам поражения клубочков (трансферрин, гаптоглобин, IgG); 3 – канальцевый – на УПГ, кроме альбуминовой фракции, определялись белки с молекулярной массой 10-57,9 кДа, относящиеся к маркерам поражения канальцев (рибонуклеаза, лизоцим, 4 – смешанный – наличие на УПГ белков с молекулярной массой от 10 до 160 кДа (клубочковые и канальцевые протеины). Частота встречаемости различных типов протеинурии в исследованных группах детей представлена в таблице 3. У пациентов I группы (без ДН, со стажем диабета 1-5 лет, при отсутствии патологии в общеклинических анализах мочи) физиологическая протеинурия наблюдалась только у половины детей (47,5%), что было, тем не менее, достоверно чаще по сравнению с патологическими типами протеинурии (р<0,01-0,001). У трети больных определялась смешанная протеинурия (30,6%), у пятой части – изолированная клубочковая протеинурия (19,1%) и у единичных детей – канальцевая (2,7%). Анализ уропротеинограмм больных I группы показал, что экскреция альбумина у 100% обследованных не превышала 27 мг/л. В случаях, когда уропротеинограмма была представлена единственной фракцией альбумина (физиологический тип протеинурии), его экскреция составляла в среднем 12,1±2,5 мг/л. При сочетании альбумина с другими белковыми фракциями его концентрация в моче была в среднем 22,4±3,3 мг/л (р<0,001). У больных II группы (со стажем диабета более 5 лет и при наличии диабетической нефропатии) определялись 2 типа протеинурии: клубочковый и смешанный. В большинстве случаев наблюдался смешанный тип (85,4%), у седьмой части пациентов – клубочковый (14,6%), р<0,001. Между сравниваемыми группами больных с СД значимых различий не было только по отношению к клубочковому типу протеинурии, физиологический и изолированный канальцевый типы наблюдались достоверно чаще в I группе пациентов (соответственно р<0,001 и р<0,05), смешанный тип – во II группе (р<0,001). Некоторым больным исследование уропротеинограммы было проведено в динамике заболевания. Пример: Наташа Г., 11 лет. Истории болезни: №3349, 6838. Страдает ИЗСД с 1996 года, в 1998 году (в 11 лет) проходила очередное контрольное обследование в эндокринологическом отделении областной детской клинической больницы г. Воронежа. В анализе мочи по Каковскому-Аддису: белок – (-), лейкоциты – 0,3×106/л, эритроциты – (-); в пробе по Зимницкому – диурез 1370 мл, удельный вес – 1014; артериальное давление до 110/70 мм рт.ст. Уропротеинограмма была представлена клубочковыми (альбумин, постальбумин, трансферрин, иммуноглобулин G) и канальцевыми (легкие цепи иммуноглобулина G, На фоне отсутствия патологии со стороны общего и биохимического анализов крови, клинических анализов мочи, ультразвукового исследования почек, на уропротеинограмме определялся смешанный тип протеинурии, о чем свидетельствовала повышенная экскреция с мочой некоторых клубочковых и канальцевых протеинов. При очередном обследовании в 2002 году (давность болезни составила 6,5 лет) в клинических анализах мочи была выявлена протеинурия 0,66 г/л, диагностирована диабетическая нефропатия. При повторном исследовании уропротеинограммы вновь был определен смешанный тип протеинурии: были идентифицированы клубочковые (альбумин, пре- и постальбумины, трансферрин, гаптоглобин, иммуноглобулин G) и канальцевые (легкие цепи иммуноглобулина G, Данный пример показывает, что, несмотря на отсутствие признаков развивающейся диабетической нефропатии при стандартном обследовании пациентов ИЗСД, данные уропротеинограмм позволили диагностировать ДН на доклинической стадии уже через 2 года после дебюта заболевания. Исследование уропротеинограммы в динамике болезни позволило зафиксировать сохранение патологического качественного состава белка мочи, определяемого в доклинической стадии, и в развернутой стадии ДН. В последние годы повышенный интерес к изучению микроальбуминурии связан с тем, что новые методы исследования позволяют определять повышенные цифры экскреции альбумина с мочой при отсутствии белка в общеклинических анализах мочи. В течение длительного времени, и, прежде всего в диабетологии, под микроальбуминурией понимали экскрецию с мочой альбумина от 30 до 300 мг/сутки или 20-200 мг/мин [Deferrari G., Repetto M., Calvi С.et al. Diabetic nephropathy: from micro- to macroalbuminuria. Nephrol Dial Transplant 1998; 13: 11-15]. Дальнейшее изучение этого вопроса показало, что экскреция альбумина с мочой уже более 20 мг/сут часто предшествует сосудистым осложнениям у диабетиков [Ruilope L.M., Alcazar J.M., Hemander E. et al. Long-term influences of anti-hypertensive therapy on microalbuminuria in essential hypertension. Kidney Int 1994; 45: S171-173]. Подтвержденный клиническими исследованиями технический результат позволяет утверждать, что даже при нормальной экскреции альбумина у больных сахарным диабетом в половине случаев в конечной моче присутствуют маркеры поражения клубочков и/или канальцев. Поэтому более уместно в случае экскреции альбумина более 30 мг/л говорить о микропротеинурии. Учитывая тяжесть и быстрое прогрессирование уже возникших изменений почек, более важным и актуальным остается диагностика доклинических стадий ДН, когда экскреция альбумина остается нормальной, так как именно в этот период функциональных изменений необходимо начинать лечебные мероприятия, способствующие снижению скорости прогрессирования нефропатии. Метод автоматизированного электрофореза белка мочи в ПААГ, благодаря своей чувствительности, обладает высокой информативностью, позволяя диагностировать доклинические стадии развития ДН уже в первые годы болезни. Таким образом, положительный эффект изобретения заключается в своевременном выявлении патологии почек у больных ИЗСД на доклинической стадии ДН в период функциональных изменений нефрона, а также определение уровня дисфункции нефрона, что особенно важно для пациентов, у которых проведение биопсии затруднено. Библиография 1. Базарова А.В. Характеристика функций канальцев почек у больных с сахарным диабетом: Автореф. дис.(канд. мед. наук. – М., 1993. – 21 с. 2. Дедов И.И. Сахарный диабет: ретинопатия, нефропатия / И.И.Дедов, М.В.Шестакова, Т.М.Миленькая. – М.: Медицина, 2001. – 175 с.
Формула изобретения
Способ диагностики доклинической стадии диабетической нефропатии у детей с инсулинозависимым сахарным диабетом при отсутствии белка при общеклиническом исследовании мочи, характеризующийся тем, что исследуют белковые фракции мочи, разделенные с помощью электрофореза в градиентном 8-25%-ном полиакриламидном геле с детергентом додецилсульфатом, и при определении на уропротеинограмме единственной фракции альбумина молекулярной массой 67 кДа в количестве до 26 мг/л состояние пациента интерпретируют как норму; при обнаружении дополнительно к альбумину протеинов с молекулярной массой 58-156 кДа: трансферрина, гаптоглобина, IgG, постальбумина и преальбумина диагностируют клубочковую дисфункцию; при обнаружении протеинов с молекулярной массой от 10 до 58 кДа: рибонуклеазы, мономерного гемоглобина, ретинол-связывающего белка, легких цепей IgG,
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -микроглобулина,
-микроглобулина,  2-микроглобулин, ретинол-связывающий белок, легкие цепи IgG,
2-микроглобулин, ретинол-связывающий белок, легкие цепи IgG,  -следовой протеин,
-следовой протеин,