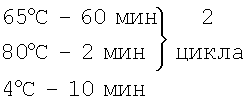Патент на изобретение №2346987
|
||||||||||||||||||||||||||
(54) СПОСОБ И НАБОР ДЛЯ УСКОРЕННОЙ ДИАГНОСТИКИ КОКЛЮША
(57) Реферат:
Изобретение относится к области медицинской микробиологии, в частности к лабораторной диагностике возбудителя коклюша. Способ предусматривает забор клинического материала из ротоглотки больного, выделение ДНК, проведение ПЦР и электрофореза, при этом обработку клинического материала осуществляют последовательно прогревом при 95°С в течение 30 мин, лизоцимом при 37°С±2°С в течение 30 мин и протеиназой К при 70°С в течение 2 часов. ДНК выделяют путем обработки лизирующим раствором и инкубации при 65°С в течение 5 мин, далее обрабатывают сорбентом при комнатной температуре в течение 7 мин, отмывочным раствором и элюируют ТЕ-буфером при 65°С в течение 5 мин. Постановку ПЦР осуществляют с использованием ПЦР реакционной смеси, включающей 10×ПЦР буфер с (NH4)2SO4, 2мМ смесь нуклеотидов (dNTPs), 25мМ MgCl2, 5% DMSO, три пары праймеров BP-F3 5
Изобретение относится к области медицинской микробиологии, в частности к лабораторной диагностике возбудителей инфекционных заболеваний. Существующая лабораторная диагностика коклюша основана на микробиологических и серологических методах исследования [1]. Однако данные методы являются недостаточно эффективными и возможны для ретроспективного анализа, что снижает качество диагностики. Бактериологическая диагностика коклюша от начала исследования до выдачи ответа занимает от 5 до 7 дней [1]. Результат выделения возбудителя у больных коклюшем (при условии правильного взятия материала в первые дни болезни и использовании хороших питательных сред) не превышает 40-50%. В клинической практике он, как правило, не превышает 10%, и в редких случаях доходит до 20%. Низкая высеваемость микроорганизмов рода Bordetella обусловлена их сниженной выживаемостью во внешней среде, поздним обследованием больных, низким качеством питательных сред, применением антибиотиков до начала бактериологического обследования, медленным ростом, контаминацией исследуемого материала другими микроорганизмами, недостаточной кратностью обследования, неправильным взятием исследуемого материала. Большие трудности имеют и серологические методы диагностики. Поэтому разработка высокочувствительных, специфичных, информативных и ускоренных методов обнаружения возбудителя коклюша является несомненно актуальным. Были предложены различные ПЦР-технологии – nested-ПЦР, ПЦР в режиме реального времени, позволяющие выявлять различные мишени в геноме B.pertussis [2, 3, 4, 5, 6]. Так, ПЦР, основанная на выявлении промоторной области коклюшного токсина, является высокоспецифичной для B.pertussis, но имеет низкую чувствительность [2, 3]. В отличие от нее IS481 ПЦР метод высокочувствителен, однако данный вариант ПЦР выявляет не только B.pertussis, но и B.holmesii [4, 5, 6]. Наиболее близким техническим решением является недавно предложенный способ выявления штаммов B.pertussis, предусматривающий забор клинического материала, выделение ДНК, постановку ПЦР, основанную на изотермальной амплификации (LAMP) с использованием в реакционной смеси от 4 до 6 пар праймеров, амплифицирующих специфичные мишени в геноме возбудителя, Bst полимеразу, а также проведение амплификации при изотермальных условиях – 63-65°С в течение 1 часа и детекции в агарозном геле [7]. Недостатками известного способа является то, что он был апробирован только на выделенных штаммах B.pertussis, а на первичном клиническом материале использован в ограниченном количестве и давал ложноположительные результаты, кроме того, способ предусматривал использование дорогостоящих реагентов и невозможность широкого применения в клинической диагностике в нашей стране. Задачей настоящего изобретения является разработка более дешевого, простого, ускоренного, высокочувствительного и специфичного способа и набора для ускоренной диагностики коклюша, позволяющего выявлять возбудителя заболевания непосредственно в клиническом материале от больного вне зависимости от стадии заболевания. В соответствии с поставленной задачей был разработан способ и набор для ускоренной диагностики коклюша. Способ предусматривает взятие клинического материала из ротоглотки больного, выделение ДНК, проведение ПЦР и электрофореза, отличается тем, что обработку клинического материала осуществляют сначала прогревом при 95°С в течение 30 мин, затем лизоцимом при 37°С±2°С в течение 30 мин и протеиназой К при 70°С в течение 2 часов, выделение ДНК проводят с помощью лизирующего раствора, сорбента, отмывочного раствора и ТЕ-буфера, при этом с лизирующим раствором проводят инкубацию при 65°С в течение 5 мин, далее обрабатывают сорбентом при комнатной температуре в течение 7 мин, после этого обрабатывают отмывочным раствором и элюируют с ТЕ-буфером при 65°С в течение 5 мин, а постановку ПЦР осуществляют с использованием ПЦР реакционной смеси, включающей 10×ПЦР буфер с (NH4)2SO4, 2мМ смесь нуклеотидов (dNTPs), 25мМ MgCl2, 5% DMSO, три пары праймеров BP-F3 5′-CCGCATACGTGTTGGCA-3′, ВР-В3 5′-TGCGTTTTGATGGTGCCT-3′, BP-FIP5′-TTGGATTGCAGTAGCGGGATGTGCATGCGTGCAGATTCGTC-3′, ВР-BIP5′-CGCAAAGTCGCGCGATGGTAACGGATCACACCATGGCA-3′ BP-LF 5′-ACGGAAGAATCGAGGGTTTTGTAC-3′, BP-LB 5′-GTCACCGTCCGGACCGTG-3′ и Bst полимеразу, при этом амплификацию проводят в циклическом режиме сначала при 65°С в течение 60 мин, затем при 80°С в течение 2 мин, далее цикл повторяют, после электрофореза продукты амплификации подвергают дифференциации путем сравнения электрофоретической подвижности полученных фрагментов ДНК с подвижностью контрольных образцов ДНК штаммов В.pertussis, при наличии специфического светящегося профиля, аналогичного контрольному образцу ДНК штамма В.pertussis, данный образец ДНК регистрируется как содержащий ДНК штамма В.pertussis. В данном изобретении для выделения ДНК может быть использован набор «ДНК-сорбАМ» (производства «Интерлабсервис», г.Москва). Апробация набора и клинические испытания способа ускоренной лабораторной диагностики коклюша проведены совместно с инфекционистами клинического отдела ФГУН МНИИЭМ им. Г.Н.Габричевского Роспотребнадзора на базе ИКБ №1 (г.Москва). Все больные одновременно обследованы разработанным способом и бактериологическим методом. В ИКБ №1 обследовано 56 пациентов, из них 30 больных с клиническим диагнозом: коклюш (разной степени тяжести), обследованных на различные сроки от начала заболевания. Возраст больных коклюшем колебался от 1 месяца до 12 лет, в том числе 22 (73,3%) были в возрасте до 1 года, 8 (26,7%) – старше 1 года. Тяжесть коклюша оценивалась согласно общепринятой классификации, в соответствии с которой у 10 (33,4%) детей коклюш протекал в тяжелой форме, у 19 (63,3%) – в среднетяжелой форме, легкая форма имела место лишь у 1 (3,3%) ребенка. Диагноз коклюша устанавливался на основании характерной клинической картины заболевания и оценки эпидемиологической ситуации в окружении больного. Среди 30 больных с клиническим диагнозом «коклюш» 23 пациента имели положительные результаты в ПЦР-диагностике, то есть процент совпадений клинического диагноза и разработанном способе составил 76,7%±7,7%. В то же время бактериологическое подтверждение диагноза было лишь в 4 случаях, что составило 13,3%±6,2% (p<0,001). У 7 (23,3%±7,7%) оставшихся больных получены отрицательные результаты как в разработанном способе ПЦР-диагностики, так и в бактериологическом методе. С целью определения специфичности данного способа было обследовано 26 детей с диагнозами «ОРВИ», «лакунарная ангина», «респираторный микоплазмоз» и др. Обследования этих детей на «коклюш» имели отрицательные результаты, что свидетельствует о высокой специфичности разработанного способа диагностики. Все больные были обследованы на различные сроки от начала заболевания – минимальный срок составил 6 дней, максимальный – 25 дней. Разработанный способ диагностики позволял выявлять возбудителя коклюша начиная с ранних сроков вплоть до 25 дня заболевания – в период обратного развития заболевания. В то время как бактериологическая диагностика была наиболее эффективна на 2 – начале 3-й неделях заболевания – в разгар спазматического периода, когда имеется выраженный кашлевой синдром. Примером высокой специфичности апробируемого способа диагностики коклюша может служить история болезни пациентки Г., 24 лет, у которой в клинической картине наблюдался коклюшеподобный кашель. При бактериологическом обследовании были выделены B.bronchiseptica, a результаты ПЦР-диагностики оказались отрицательными. Таким образом, проведенные исследования показали, что разработанный способ эффективен начиная с ранних сроков заболевания и вплоть до 24-25 дня заболевания; диагностическая эффективность предложенного способа составляет 76,7%±7,7% (p<0,001). Техническим результатом заявленного изобретения является простой, дешевый, ускоренный, высокочувствительный и высокоспецифичный способ и набор для лабораторной диагностики коклюша, позволяющий выявлять возбудителя заболевания в течение 9-10 часов от начала исследования непосредственно в материале от больного, что будет способствовать быстрой постановке диагноза, назначению своевременной и адекватной терапии, а также будет способствовать быстрому выявлению и изоляции больных коклюшем при проведении противоэпидемических мероприятий в очагах коклюшной инфекции. Пример. Подготовка проб и выделение ДНК. Разлить по 1 мл ТЕ буфера в 1,5 мл эппендорфы; суспендировать тампон от больного в ТЕ буфере в течение 2-3 мин, удалить тампон; цетрифугировать при 14000 об/мин – 4 мин; удалить супернатант, оставив 180 мкл в пробе; помешать на вортексе и инкубировать при 95°С 30 мин. К пробе добавить 8 мкл раствора лизоцима (100 мг/мл) и инкубировать при 37°С не менее 30 мин; добавить 25 мкл протеиназы К и продолжить инкубацию при 70°С – 2 часа. Добавить 300 мкл лизирующего раствора и 25 мкл сорбента, перемешать на вортексе и инкубировать при 65°С – 5 мин; далее перемешать на вортексе и оставить в штативе на 3 мин, еще раз перемешать и оставить на 5 мин; осадить на центрифуге в течение 30 сек; удалить полностью супернатант и добавить 1 мл отмывочного раствора, перемешать на вортексе и осадить в течение 30 сек; удалить супернатант; высушить при 65°С – 7 мин; добавить ТЕ буфер и инкубировать при 65°С в течение 5 минут; центрифугировать при 12000 об/мин в течение 1 мин. Постановка ПЦР. Приготовить реакционную ПЦР смесь. Состав реакционной смеси (на 1 пробу): 2,5 мкл 10×ПЦР буфер с (NH4)2SO4 2,5 мкл 2мМ dNTP 1,5 мкл 25мМ MgCl2 2,5 мкл 5% DMSO 0,8 мкл BP-F3 0,9 мкл ВР-В3 1,8 мкл BP-FIP 1,7 мкл ВР-BIP 0,6 мкл BP-LF 0,4 мкл ВР-LB перемешать на вортексе и раскапать по 15,2 мкл в каждую пробу; внести по 8,8 мкл ДНК пробы; добавить по 1 капле масла; слегка перемешать на вортексе; добавить по 1,0 мкл Bst полимеразы в каждую пробу под масло и слегка перемешать на вортексе. Режим амплификации:
Электрофорез в агарозном геле. Приготовить 2% агарозный гель; в штативе смешать 3 мкл 6х Mass Loading Dye Solution («Fermentas», Литва) и 20 мкл ампликонов; режим электрофореза – 160V 1 час. Далее гель окрашивали стандартным раствором этидия бромида и результат реакции выявляли с помощью УФ-трансиллюминатора и фотографировали. В качестве маркера молекулярных весов использовали DNA Ladder Mix («Fermentas», Литва). Так, если у исследуемого образца ДНК имеются специфические светящиеся профили, аналогичные контрольному профилю штамма В.pertussis, то данные образцы регистрируются как содержащие штамм В.pertussis. Литература 1. Инструкция по бактериологическому и серологическому исследованиям при коклюше и паракоклюше. Министерство здравоохранения СССР. Москва, 1983. 2. Grimprel E., P.Begue, I.Anjak. Comparison of polymerase chain reaction, culture, and Western immunoblot serology for diagnosis of Bordetella pertussis infection. J. of Clinical Microbiology. 1993, vol.31: 2745-2750. 3. Houard S., C.Hackel, A.Herzog at all. Specific identification of B.pertussis bypolymerase chain reaction. Res. Microbiology. 1989, 140: 477-487. 4. Anderson T.P., K.A.Beynon, D.R.Murdoch. Comparison of real-time PCR and conventional hemi-nested PCR for the detection of B.pertussis in nasopharyngeal samples. Clin. Microbiol. Infection. 2003, 9: 746-749. 5. Reischi U., N.Lehn, G.N.Sanden et all. Real-time PCR assay targeting IS481 of B.pertussis and molecular basis for detecting B.holmesii. J. Clin. Microbiology. 2001, 39: 1963-1966. 6. Farell D.J., G.Daggard, T.K.S.Mukkur. Nested duplex PCR to detect B.pertussis and B.parapertussis and its application in diagnosis of pertussis in nonmetropolitan southeast Queensland, Australia. J. Clin. Microbiology. 1999, 37:606-610. 7. K.Kamachi, H.Toyoizumi-Ajisaka, K.Toda et all. Development and evaluation of a loop-mediated isothermal amplification method for rapid diagnosis of B.pertussis infection. J. of Clinical Microbiology. 2006, 44: 1899-1902.
Формула изобретения
1. Способ ускоренной диагностики коклюша, предусматривающий забор клинического материала из ротоглотки больного, выделение ДНК, проведение ПЦР и электрофореза, отличающийся тем, что после забора клинический материал последовательно обрабатывают прогревом при 95°С в течение 30 мин, затем лизоцимом при 37°С±2°С в течение 30 мин и протеиназой К при 70°С в течение 2 часов, выделение ДНК проводят путем обработки клинического материала лизирующим раствором и инкубации при 65°С в течение 5 мин, обработкой сорбентом при комнатной температуре в течение 7 мин, а затем отмывочным раствором и элюцией с ТЕ-буфером при 65°С в течение 5 мин, проведение ПЦР осуществляют с использованием ПЦР реакционной смеси, включающей 10×ПЦР буфер с (NH4)2SO4, 2mM смесь нуклеотидов (dNTPs), 25mM MgCl2, 5% DMSO, три пары праймеров BP-F3 5 ВР-В3 5 BP-FIP5 BP-BIP5 BP-LF 5 BP-LB 5 2. Набор для ускоренной диагностики коклюша, содержащий раствор лизоцима и протеиназу К для обработки клинического материала, лизирующий раствор, сорбент, отмывочный раствор и ТЕ-буфер для выделения ДНК, для постановки ПЦР-ПНР реакционную смесь, включающую 10×ПЦР буфер с (NH4)2SO4 2mM смесь нуклеотидов (dNTPs), 25mM MgCl2, 5% DMSO, три пары праймеров BP-F3 5 ВР-В3 5 BP-FIP5 BP-BIP5 BP-LF 5 BP-LB 5
|
||||||||||||||||||||||||||

 -CCGCATACGTGTTGGCA-3
-CCGCATACGTGTTGGCA-3