|
(21), (22) Заявка: 2007107668/13, 01.03.2007
(24) Дата начала отсчета срока действия патента:
01.03.2007
(43) Дата публикации заявки: 10.09.2008
(46) Опубликовано: 20.02.2009
(56) Список документов, цитированных в отчете о
поиске:
KONG D., SHEN H., HUANG Y., MI H. PCR hot-start using duplex primers. – Biotechnol Lett. 2004 Feb; 26 (4): 277-80. US 5567583, 22.10.1996. RU 2241042 C1, 27.11.2004. THORESON A.C., BORRE M., ANDERSEN L.P., JØ RGENSEN F., KIILERICH S., SCHEIBEL J., RATH J., KROGFELT K.A. Helicobacter pylori detection in human biopsies: a competitive PCR
Адрес для переписки:
105082, Москва, а/я 111, ООО Юридическая фирма “Лабзин и партнеры”, С.М. Ломскому
|
(72) Автор(ы):
Абрамов Дмитрий Дмитриевич (RU),
Трофимов Дмитрий Юрьевич (RU),
Ребриков Денис Владимирович (RU)
(73) Патентообладатель(и):
Закрытое акционерное общество “Научно-производственная фирма ДНК-Технология” (RU)
|
(54) СПОСОБ ОПРЕДЕЛЕНИЯ НАЛИЧИЯ “ГОРЯЧЕГО СТАРТА” В ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ
(57) Реферат:
Изобретение относится к области молекулярной биологии и биотехнологии и может быть использовано для разработки систем анализа дезоксирибонуклеиновых кислот. Для выполнения способа определения наличия или отсутствия «горячего старта» в полимеразной цепной реакции определяют разницу между результатами ПЦР для двух реакционных смесей, включающих изучаемую систему обеспечения «горячего старта» и ДНК-матрицу. ПЦР в одной из указанных реакционных смесей проводят в присутствии олигонуклеотида, полностью комплементарного 3 -концевой части одноцепочечной ДНК-матрицы, и олигонуклеотида, идентичного 5 -концевой части одноцепочечной ДНК-матрицы, и олигонуклеотида, идентичного 5 -концевой части одноцепочечной ДНК матрицы. В другой реакционной смеси ПЦР проводят в присутствии олигонуклеотида, частично некомплементарного 3 -концевой части одноцепочечной ДНК матрицы. В другой реакционной смеси ПЦР проводят в присутствии олигонуклеотида, частично некомплементарного 3 -концевой части одноцепочечной ДНК-матрицы, и олигонуклеотида, идентичного 5 -концевой части одноцепочечной ДНК-матрицы, и олигонуклеотида, идентичного 5 -концевой части одноцепочечной ДНК-матрицы. Применение изобретения позволяет надежно оценить наличие или отсутствие «горячего страта», а также качество «горячего старта». 2 ил. -концевой части одноцепочечной ДНК-матрицы. Применение изобретения позволяет надежно оценить наличие или отсутствие «горячего страта», а также качество «горячего старта». 2 ил.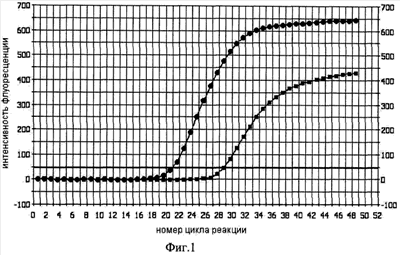
(56) (продолжение):
CLASS=”b560m”assay with internal control reveals false results. FEMS Immunol Med Microbiol. 1999 Jun; 24 (2): 201-8.
Область техники, к которой относится изобретение
Предложенный способ относится к области медицины, биологии и биотехнологии и может быть использован при разработке и характеристике методик обеспечения «горячего старта» полимеразной цепной реакции (ПЦР) и систем олигонуклеотидов для проведения ПЦР.
Полимеразная цепная реакция широко используется для амплификации нуклеиновых кислот и позволяет, в частности, выявить присутствие и определить количество нуклеиновой кислоты с определенной последовательностью нуклеотидов в ДНК- или РНК-образце.
Одним из подходов, повышающих специфичность и чувствительность используемой для проведения ПЦР системы олигонуклеотидов, является использование так называемого «горячего старта» – блокировки активности ДНК-полимеразы до достижения реакционной смесью температур, близких к температуре гибридизации праймеров на ДНК-матрицу. Хотя активность используемых при ПЦР полимераз оптимальна при 60-80 С, большинство из этих ферментов сохраняют существенную активность и при низких температурах (например, при комнатной температуре). Поскольку компоненты реакции смешивают на льду (при 4°С) или при комнатной температуре, праймеры могут неспецифически отжигаться на всегда присутствующую в образце ДНК одноцепочечную фракцию и удлиняться полимеразой еще до начала ПЦР. В результате могут образоваться неспецифичные фрагменты, эффективно амплифицируемые в ходе последующей ПЦР. Для предотвращения такой неспецифичной амплификации существует несколько принципиально разных подходов, фигурирующих в литературе под общим названием «горячий старт»:
1. один из компонентов, необходимый для проявления полимеразной активности, добавляется в реакционную смесь только после достижения реакционной смесью температуры 70-95°С. Этими компонентами могут быть: ДНК-полимераза, Mg2+, дезоксинуклеотидтрифосфаты, праймеры и другие необходимые для реакции компоненты.
2. один из необходимых для протекания реакции компонентов отделен от реакционной смеси барьером из парафина, который плавится при температуре 50-70°С, и все компоненты реакции смешаются. Реализуют барьер путем разделения смеси на 2 отсека парафиновой пробкой либо за счет помещения одного из компонентов в парафиновые шарики [1, 2].
3. для приготовления реакции используют ДНК-полимеразу, блокированную специфичными к ДНК-полимеразе антителами, в комплексе с которыми она неактивна. При нагревании реакционной пробирки в ходе первого цикла ПЦР антитела термически инактивируются, а полимераза активируется [3, 4].
4. для приготовления реакции используют ДНК-полимеразу, блокированную термолабильными химическими группами, присоединенными к некоторым аминокислотам полимеразы и инактивирующими фермент. При 95°С во время первого цикла ПЦР термолабильные группы удаляются, и фермент активируется. Для эффективной активации фермента необходима продолжительная инкубация при 95°С (10-20 мин) [5].
5. ДНК-полимеразу обратимо ингибируют аналогами субстрата (например, специальными олигонуклеотидами [6]), диссоциирующими от полимеразы при высоких температурах.
Независимо от используемого метода обеспечения «горячего старта» в ряде случаев перед исследователем стоит задача определения наличия или отсутствия «горячего старта» в используемой методике.
Наиболее близким к предложенному изобретению является способ, предусматривающий оценку наличия димеров праймеров при использовании «горячего старта» [7]. Однако этот способ не позволяет провести определение при использовании ПЦР «в реальном времени» (без постановки электрофоретического анализа результатов реакции). Кроме того, образование димеров праймеров является нестабильным процессом и не всегда дает воспроизводимые результаты.
Раскрытие изобретения
Задача, решаемая предложенным изобретением, заключается в устранении указанных недостатков.
Предложенный способ определения наличия «горячего старта» в полимеразной цепной реакции предусматривает:
1. Приготовление реакционной смеси №1 для ПЦР «в реальном времени» с использованием следующих олигонуклеотидов:
– одноцепочечной ДНК-матрицы (искусственно синтезированного одноцепочечного олигонуклеотида)
– праймера, соответствующего 5 -концевой части ДНК-матрицы -концевой части ДНК-матрицы
– флуоресцентно-меченой олигонуклеотидной пробы, соответствующей средней части ДНК-матрицы
– праймера, полностью комплементарного 3 -концу ДНК-матрицы (m0) -концу ДНК-матрицы (m0)
2. Приготовление реакционной смеси №2, в точности соответствующей по составу смеси №1, за исключением замены праймера m0 на праймер, аналогичный праймеру m0, но отличающийся тем, что он содержит некомплементарные матрице основания.
3. Проведение ПЦР «в реальном времени» с использованием детектирующего амплификатора одновременно для реакционных смесей №1 и №2. В качестве варианта осуществления изобретения возможно проведение реакции с использованием обычного (не детектирующего амплификатора). В этом случае о результатах реакции судят по электрофореграмме (по окончании реакции необходимо проводят гель-электрофорез).
4. Учет результатов ПЦР «в реальном времени». О наличии или отсутствии горячего старта судят по наличию или отсутствию продукта реакции в реакционной смеси №2. Продукт реакции в реакционной смеси №1 служит положительным контрольным образцом и образуется в любом случае. Кроме того, по разнице в пороговых циклах между реакционной смесью №1 и №2 можно судить о качестве обеспечения «горячего старта».
Таким образом, по результатам ПЦР «в реальном времени» можно судить о наличии или отсутствии «горячего старта» в используемой системе обеспечения «горячего старта», а также о качестве «горячего старта».
Технический результат, достигаемый при осуществлении предложенного изобретения, заключается в надежной оценке наличия или отсутствия «горячего старта» и его относительной оценке при использовании некоторой системы обеспечения «горячего старта».
Краткое описание чертежей
На фиг.1 приведен график изменения интенсивности флуоресценции в реакционных смесях №1 (маркировка линии кружками) и №2 (маркировка линии квадратиками) для одного эксперимента в отсутствие «горячего старта». На графиках по оси абсцисс показан номер цикла реакции, по оси ординат – интенсивность флуоресценции (в относительных единицах).
На фиг.2 приведен график изменения интенсивности флуоресценции в реакционных смесях №1 (маркировка линии кружками) и №2 (маркировка линии квадратиками) для одного эксперимента в условиях «горячего старта».
Осуществление изобретения
Для проведения ПЦР «в реальном времени» в условиях отсутствия «горячего старта», готовят реакционную смесь, содержащую 20 мМ Трис-HCl (рН 8.6 при 25°С), 30 мМ KCl, 2.5 мМ MgCl2, 0,2 мМ каждого дезоксирибонуклеотидтрифосфата, 0,1 мкМ флуоресцентно-меченой олигонуклеотидной пробы (FAM)-5 -TCAGCCCTCTGGCCCAGGCAG-3 -TCAGCCCTCTGGCCCAGGCAG-3 -(BHQ1), 2,5 ед. фермента Так-полимеразы, 100 тысяч штук молекул одноцепочечной ДНК-матрицы (CCGCTCGACCTGCACTAGACAACTGCCTGGGCCAGAGGGCTGAAGTTCAGATGTCACGGAGGCG), 0,4 мкМ праймера (CCGCTCGACCTGCACTAGACA), аналогичного 5 -(BHQ1), 2,5 ед. фермента Так-полимеразы, 100 тысяч штук молекул одноцепочечной ДНК-матрицы (CCGCTCGACCTGCACTAGACAACTGCCTGGGCCAGAGGGCTGAAGTTCAGATGTCACGGAGGCG), 0,4 мкМ праймера (CCGCTCGACCTGCACTAGACA), аналогичного 5 -концевому участку ДНК-матрицы, который может вступить в реакцию лишь в случае появления второй цепи ДНК. Кроме того, отдельно для реакционных смесей №1 и №2 используют два вида праймеров (0,4 мкМ), комплементарных 3 -концевому участку ДНК-матрицы, который может вступить в реакцию лишь в случае появления второй цепи ДНК. Кроме того, отдельно для реакционных смесей №1 и №2 используют два вида праймеров (0,4 мкМ), комплементарных 3 -концу ДНК-матрицы, однако отличающихся тем, что один из них являлся полностью комплементарным (m0; CGCCTCCGTGACATCTGAAC), а другой содержит в своей последовательности четыре однонуклеотидых замены (m4; CCCCTCCCTGACATGTGATC). Смесь выдерживают при 35°С в течение 15 мин, затем прогревают при 95°С в течение 4 мин, после чего проводят 50 циклов реакции со следующими условиями: 93°С – 15 с, 62°С – 30 с. По наличию или отсутствию продукта реакции в реакционной смеси №2 определяют наличие или отсутствие «горячего старта» в данных условиях реакции. -концу ДНК-матрицы, однако отличающихся тем, что один из них являлся полностью комплементарным (m0; CGCCTCCGTGACATCTGAAC), а другой содержит в своей последовательности четыре однонуклеотидых замены (m4; CCCCTCCCTGACATGTGATC). Смесь выдерживают при 35°С в течение 15 мин, затем прогревают при 95°С в течение 4 мин, после чего проводят 50 циклов реакции со следующими условиями: 93°С – 15 с, 62°С – 30 с. По наличию или отсутствию продукта реакции в реакционной смеси №2 определяют наличие или отсутствие «горячего старта» в данных условиях реакции.
Для проведения ПЦР «в реальном времени» в условиях наличия «горячего старта», готовят реакционную смесь, аналогичную ранее описанной, но отличающейся тем, что используют одну из систем обеспечения «горячего старта». Например, используют 2,5 ед. фермента Так-полимеразы в комплексе со специфичными к ферменту антителами, блокирующими активность фермента при температурах ниже 50°С, Смесь выдерживают при 35°С в течение 15 мин, затем прогревают при 95°С в течение 4 мин, после чего проводят 50 циклов реакции со следующими условиями: 93°С – 15 с, 62°С – 30 с. По наличию или отсутствию продукта реакции в реакционной смеси №2 определяют наличие или отсутствие «горячего старта» в данных условиях реакции.
Для указанных вариантов праймеров была предварительно определена примерная температура присоединения к ДНК-матрице (температура отжига), которая отражает степень их специфичности. Специфические праймеры (m0) отжигались при высокой температуре (60°С), а неспецифические (m4) – при более низкой (44°С).
Список использованной литературы
1. Chou, Q et al. (1992) NAR 20, 1717-1723.
2. Horton, R.M. et al. (1994) BioTechniques 16, 42-43.
3. Kellogg, D.E. et al. (1994) BioTechniques 16, 1134-1137.
4. Findley, J.B. et al. (1993) Clin. Chem. 39, 1927-1933.
5. Birch, D.E. (1996) Nature 381, 445-446.
6. Dang, C. And Jayasena, S.D. (1996) J. Mol. Biol. 264, 268-278.
7. Kong D, et. al (2004) Biotechnol Lett. 26, 277-80.
Формула изобретения
Способ определения наличия “горячего старта” в полимеразной цепной реакции (ПНР), предусматривающий определение разницы между результатами ПЦР для двух реакционных смесей, каждая из которых содержит одинаковые для обеих смесей одноцепочечную ДНК-матрицу и компоненты изучаемой системы обеспечения “горячего старта”, отличающийся тем, что
(а) одна реакционная смесь помимо одноцепочечной ДНК-матрицы и компонентов изучаемой системы обеспечения “горячего старта” содержит олигонуклеотид, полностью комплементарный 3 -концевой части одноцепочечной ДНК-матрицы, и олигонуклеотид, идентичный 5 -концевой части одноцепочечной ДНК-матрицы, и олигонуклеотид, идентичный 5 -концевой части одноцепочечной ДНК-матрицы -концевой части одноцепочечной ДНК-матрицы
(б) другая реакционная смесь помимо одноцепочечной ДНК-матрицы и компонентов изучаемой системы обеспечения “горячего старта” содержит олигонуклеотид, частично некомплементарный 3 -концевой части одноцепочечной ДНК-матрицы (содержащий некомплементарные матрице основания) и олигонуклеотид, идентичный 5 -концевой части одноцепочечной ДНК-матрицы (содержащий некомплементарные матрице основания) и олигонуклеотид, идентичный 5 -концевой части одноцепочечной ДНК-матрицы. -концевой части одноцепочечной ДНК-матрицы.
РИСУНКИ
|