|
|
(21), (22) Заявка: 2007119191/13, 24.05.2007
(24) Дата начала отсчета срока действия патента:
24.05.2007
(46) Опубликовано: 20.02.2009
(56) Список документов, цитированных в отчете о
поиске:
US 4752603, 21.06.1988. SU 1732516 А1, 20.08.1995. US 4317882, 02.03.1982. US 4245051, 13.01.1981. RU 2121362 CI, 10.11.1998. GUAN A.L., RETZIOS A.D., HENDERSON G.N., MARKLAND F.S. Jr. “Purification and characterization of a fibrinolytic enzyme from venom of the southern copperhead snake (Agkisrodon contortrix contortrix)”, Arch. Biochem. Biophys, 1991, 289, (2), 197-207.
Адрес для переписки:
117292, Москва, а/я 157, В.А.Исаеву
|
(72) Автор(ы):
Исаев Вячеслав Арташесович (RU),
Семенова Светлана Александровна (RU),
Лютова Людмила Васильевна (RU),
Руденская Галина Николаевна (RU),
Медведева Елена Александровна (RU)
(73) Патентообладатель(и):
Закрытое Акционерное Общество Научно-производственное предприятие “Тринита” (RU)
|
(54) СПОСОБ ПОЛУЧЕНИЯ АКТИВАТОРА ПЛАЗМИНОГЕНА
(57) Реферат:
Изобретение относится к получению высокоочищенных высокоактивных ферментных препаратов-активаторов плазминогена, которые могут быть использованы в биохимии и медицине. Способ предусматривает растворение ферментного препарата «Морикраза» в трис-хлоридном буфере с рН 7,2-7,5 до концентрации его в растворе не менее 2,5%. Полученный раствор фракционируют с помощью ионообменной хроматографии на сорбенте ДЭАЭ – Тойоперл. Проводят элюцию протеиназы в градиенте концентрации NaCl 0,1-1,5 М. Затем при помощи ультрафильтрации на мембране, пропускающей пептиды с молекулярной массой менее 10 кДа, осуществляют концентрирование и обессоливание полученного раствора активатора плазминогена. После чего осуществляют очистку активатора плазминогена гель-хроматографией на Сефадексе G 50 в 0,1 М аммоний-ацетатном буфере с рН 6,3-6,5, содержащем 1,0-1,2 М хлорида натрия. Изобретение позволяет упросить способ получения и сократить сроки проведения процесса. 3 ил., 1 табл.
Изобретение относится к биотехнологии, в частности к получению высокоочищенных высокоактивных ферментных препаратов, которые могут быть использованы в биохимии, медицине, для терапии тромбоэмболических заболеваний, а также для исследовательских целей.
В плазме крови присутствуют многочисленные протеиназы, которые участвуют в процессе свертывания крови. Главный действующий фермент при свертывании крови – тромбин, субстратом которого является фибриноген. При повреждении стенок кровеносных сосудов протромбин быстро превращается с помощью протеиназ-активаторов в тромбин, который, в свою очередь, превращает фибриноген в фибрин (тромбин отщепляет от молекулы фибриногена небольшие фрагменты; при этом образуются молекулы фибрин-мономера, которые полимеризуются, образуя фибрин). Фибрин имеет сетчатую структуру типа бинта, который закрывает повреждение, образуя сгусток. Плазмин – протеиназа, по действию противоположная тромбину. В плазме крови также находится в неактивном состоянии в виде плазминогена. Когда стенка кровеносного сосуда восстановилась, плазминоген превращается в активный плазмин и гидролизует остатки фибрина, т.е. растворяет ненужный сгусток с образованием небольших пептидов, безвредных для организма. Когда процесс заживления прошел, активные тромбин и плазмин ингибируются ингибиторами плазмы крови и разрушаются другими протеиназами. В здоровом организме эти процессы сбалансированы, у больных же наблюдается дисбаланс. При избытке протромбина и тромбина может быть склонность к тромбозам, при избытке плазминогена и плазмина – склонность к кровотечениям.
Плазминоген – профермент, широко распространенный в организме. Его концентрация в плазме крови достигает 0,2 г/л. Основная функция активаторов плазминогена – регуляция жидкого состояния крови (фибринолиза).
Широкое распространение заболеваний, связанных с тромбообразованием, отложениями фибриновых масс в суставах, гематомами и др. требует расширения арсенала средств, способных растворять образовавшиеся в организме тромбы.
В настоящее время выявлены основные критерии, которым должны отвечать тромболитические препараты:
– высокое активаторное действие на плазминоген – неактивный профермент из крови, превращающийся после введения активирующего фермента в плазмин, разрушающий тромбы;
– низкая протеолитическая активность по отношению к белкам плазмы крови;
– устойчивость фермента к действию ингибиторов плазмы крови. Терапия тромбозов развивается несколькими путями:
1. поиск активаторов плазминогена;
2. поиск фибринолитических препаратов, содержащих протеиназы, отличные от плазминогена, и способных гидролизовать фибриновые сгустки.
Первый путь более естественный и безопасный для организма. Второй путь иногда более эффективный, но чреват побочными явлениями.
Известные очищенные тромболитические препараты, применяемые в настоящее время в медицине, обладают рядом недостатков. Например, стрептокиназы («стрептаза», «кабикиназа», «авелизин») вызывают аллергические реакции, а при введении высоких доз приводят к гипотонии. Урокиназа из мочи человека («аббокиназа», «урокидан») не вызывает аллергических реакций, но быстро разрушается и выводится из организма. Стафилокиназа секретируется штаммом патогенного микроорганизма – золотистого стафилококка, поэтому фермент для использования в медицине получают в виде рекомбинантного белка. Все вышеуказанные препараты отличаются высокой стоимостью, поэтому поиск новых средств, регулирующих состояние крови, является актуальным.
Известно, что многие кровососущие организмы, например пиявки, некоторые летучие мыши и змеи после укуса вводят в кровь ингибиторы тромбина (гирудин пиявки) или активаторы плазминогена. Попадание больших количеств таких веществ в организм может привести к геморрагическому эффекту – кровь перестает свертываться, и жертва может погибнуть от кровотечения. У некоторых змей, наоборот, в состав яда входят как активаторы протромбина, так и активаторы плазминогена. Так, например, известен способ получения фибринолитического фермента из яда южной мокасиновой змеи, который подвергают ионообменной хроматографии на СМ-целюлозе, гель-фильтрации на Сефадексе G-100, аффинной хроматографии на п-аминобензамидин-сефарозе. Фермент относится к классу металлопротеиназ, способен гидролизовать сгустки крови in vitro в концентрации от 100 мкг/мл и выше.
К недостаткам способа относится труднодоступное сырье, дорогостоящий способ очистки. Более того, металлопротеиназа змеи не способна активировать плазминоген с образованием плазмина. При этом возможно вредное воздействие на систему гемостаза за счет образования токсичных продуктов гидролиза тромба или разрушения гемоглобина и других белков крови.
Guan A.L., Retzios A.D., Henderson G.N., Markland F.S., Jr., «Purification and characterization of a fibrinolytic enzyme from venom of the southern copperhead snake (Agkistrodon contortrix contortrix)». Arch.Biochem.Biophys., 1991, 289, (2), 197-207.
Известен способ получения вещества, обладающего антикоагулянтной активностью, из растений, произрастающих в Южной Африке (из Aspilia afrikana), а также произрастающих в средней полосе европейской части России – таволги вязолистой или коры корней пиона. Сырье измельчают и экстрагируют дистиллированной водой при соотношении сырье : экстракт 1:5, прогревают на кипящей водяной бане, после чего осадок удаляют центрифугированием при 1800-2000 об/мин, супернатант замораживают при (-10)-(-20)°С и лиофильно высушивают.
Способ имеет следующие недостатки:
– редкий ареал распространения вида растения,
– недостаточные антитромбоцитарные свойства продукта,
– имеются побочные эффекты от использования фракций продукта.
Более того, получаемые по данному способу препараты являются скорее БАД, а не лечебными средствами. Они вводятся перорально, активности компонентов системы фибринолиза повышаются всего в 1,4-2 раза, механизм действия неизвестен.
Патент RU, №2143270, А61К 35/78, 1999.12.27.
Известен способ получения активатора плазминогена из среды культивирования ряда линий монослойных культур клеток, в том числе из культуры клеток почки эмбриона свиньи в присутствии пептона. Способ заключается в выращивании культуры в течение длительного времени при температуре 36,6-37,0°С с последующим добавлением в среду культивирования дистиллированной воды и последующим центрифугированием при 7000-8000 об/мин в течение 15-20 мин и отделением супернатанта. Данный способ получения активатора плазминогена из культуры клеток приводит к получению неферментного активатора, структура которого не установлена.
Недостатком способа является также его длительность и получение целевого продукта лишь с узкой специфичностью активатора плазминогена. Авт свид. СССР №1732516, А61К 38/48, C12N 9/68, 1995.08.20.
Процессы получения активатора плазминогена в виде рекомбинантного белка обладают следующими недостатками: при получении рекомбинантных белков экспрессией генов в клетках E.coli белок может образовать нерастворимые тела включения. Экспрессия в клетках E.coli также непригодна для получения гликозилированных белков. Основной недостаток E.coli в качестве системы для экспрессии физиологически активных белков – наличие примесей эндотоксинов кишечной палочки в белковых препаратах. Удаление эндотоксинов – сложный процесс, требующий больших материальных затрат.
Клетки тканей животных растут значительно медленнее, чем бактериальные, и хуже поддаются генно-инженерным манипуляциям, направленным на улучшение технологических характеристик штаммов.
Известен способ получения активатора плазминогена из кровеносных сосудов человека. Способ представляет собой пятистадийный процесс и включает осаждение белка из экстракта сульфатом аммония, аффинную хроматографию на аргинин-сефарозе, гидрофобную хроматографию на фенил-сефарозе, гель-фильтрацию на Сефакриле G-200 и аффинную хроматографию на фибрин-сефарозе. Способ очень трудоемкий, осуществляется на дорогостоящих сорбентах, позволяет получить очищенный препарат активатора плазминогена с выходом 38%. Учитывая малодоступный источник фермента и сложность очистки, этот метод может быть использован только в лабораторных условиях.
ЕР №0 124 613 (JP), C12N 9/72, А61К 38/00, опубл. 1984.11.14.
Известен способ получения активатора плазминогена из тканей толстой кишки человека. Как и вышеуказанный способ, он представляет собой пятистадийный процесс, включающий лигандообменную хроматографию на Zn-сефарозе, аффинную хроматографию на конканавалин А-сефарозе с последующим диализом и лиофилизацией и рехроматографию на конканавалин А-сефарозе. В других примерах вместо рехроматографии на конканавалин-сефарозе используют аффинную хроматографию на фибрин-сефарозе или бензамидин-сефарозе. Этот способ также не является препаративным из-за использования труднодоступного в настоящее время исходного материала, трудоемкого и дорогостоящего процесса очистки.
ЕР №0 241 448, (US) C12N 9/64, C12N 9/72, опубл. 1987.10.14.
Интересен способ получения пролонгированных тромболитических средств, полученных химической модификацией фибринолитического фермента ацилированием по активному центру избытком 4-нитрофенилового эфира цис- или транс-изомеров 4-(N,N,N-триметиламино-)-коричной кислоты. Ацилирование проводят при температуре 0-25°С и рН 7,0-8,5 в течение 10-70 мин в отсутствие органического растворителя. Отделяют полученный ацилфермент гель-фильтрацией или ультрафильтрацией, белковые фракции лиофилизуют.
Полученные комплексы протеиназ-активаторов с обратимыми ингибиторами при введении в кровь начинают активироваться только при попадании на плазминоген, поскольку имеют к нему большее, чем модифицирующие ингибиторы, сродство. В результате химические реагенты освобождают активный центр активаторов в пользу природного субстрата плазминогена и происходит образование плазмина.
Тромболитические ферменты, которые в этом способе подвергают модификации, довольно дороги, а после обработки их стоимость увеличивается.
Патент RU №2121362, А61К 38/02,1998.11.10.
Наиболее близким к заявленному является способ получения активатора плазминогена из культуральной жидкости клеток меланомы человека, включающий отделение клеточного материала от культуральной жидкости центрифугированием при 7000 g, лигандообменную хроматографию культуральной жидкости на колонке с Zn-IDA-агарозой, аффинную хроматографию на конканавалин-А-агарозе и гель-фильтрацию на Сефадексе G150 Superfine. В результате получают с 46% выходом активатор плазминогена, очищенный в 263 раза. Чистоту полученного препарата подтверждают наличием одной полосы на электрофореграмме после SDS-ПААГ-электрофореза. К недостаткам способа следует отнести дорогостоящее сырье, потенциально содержащее онкогенные белки. Таким образом, возрастает возможность вредного действия препарата при попадании в кровь пациента. Необходимость поддержания культуры клеток, многостадийный метод очистки, включающий хроматографию на дорогостоящих аффинных сорбентах, использование буфера, содержащего тиоцианат калия (отнесен к категории ядов) в высокой концентрации (1,6 М -129 г/л), длительный процесс выделения также препятствуют получению активатора плазминогена в количествах, достаточных для применения в качестве тромболитического препарата в медицине.
Патент US №4752603, C12N 9/64, А61К 38/00, опубл.1988.06.21.
Задачей изобретения является повышение выхода активатора плазминогена, упрощение и удешевление способа его получения, расширение ассортимента активаторов плазминогена.
Поставленная задача достигается тем, что в способе получения активатора плазминогена из ферментсодержащего сырья, включающем фракционирование его с помощью ионообменной хроматографии, в качестве ферментсодержащего сырья используют коллагенолитический ферментный препарат «Морикраза», растворяют последний в трис-хлоридном буфере с рН 7,2-7,5 до концентрации его в растворе не менее 2,5%, с последующим фракционированием раствора на сорбенте ДЭАЭ-Тойоперл, элюцией протеиназы в градиенте концентрации NaCl 0,1 -1,5 М, концентрированием и обессоливанием полученного раствора активатора ультрафильтрацией на мембране, пропускающей пептиды с молекулярной массой менее 10 кДа, и очисткой активатора плазминогена гель-хроматографией на Сефадексе G50 в 0,1М аммоний-ацетатном буфере с рН 6,3-6,5, содержащем 1,0-1,2 М хлорида натрия.
Препарат коллагенолитических ферментов «Морикраза», разработанный НПО «Тринита» совместно с химическим факультетом МГУ им. М.В.Ломоносова, охарактеризован и выделен из гепатопанкреаса дальневосточного краба Paralithodes camtshatica (PC) по разработанной оригинальной методике.
Rudenskaya G.N., Isaev V.A., Shmoilov A.M., Karabasova M.A., Shvets S.V., Miroshnikov A.I., Brusov A.B. “Preparation of proteolytic enzymes from kamchatka crab Paralithodes camchatica hepatopancreas.” Appl.Biochem. Biotechnol., 88, 175-83, 2000.
«Морикраза» – это суммарный препарат протеиназ камчатского краба, содержащий коллагенолитическую сериновую протеиназу, трипсин, эластазу, металлопротеиназу, карбоксипептидазу и аминопептидазу. Благодаря совместному действию этих ферментов препарат легко гидролизует коллаген, фибрин, азоказеин и другие белки.
Интерес к этому источнику связан с утилизацией отходов краболовства. Немаловажным преимуществом является безвредность препаратов коллагеназ краба для человека. Морикраза нарабатывается в значительных количествах, относительно недорога, используется в мазевых композициях для лечения ожогов, язв, послеоперационных рубцов.
Как показали экспериментальные данные, Морикраза обладает тромболитической активностью, способна активировать плазминоген, однако непосредственное введение раствора Морикразы в кровяное русло опасно из-за его высокой коллагенолитической и протеолитической активности.
Выделенная согласно предлагаемому способу из Морикразы металлопротеиназа – фермент, который является эффективным активатором плазминогена, обладает незначительной общей протеолитической активностью и практически не способен гидролизовать коллаген. Тромболитическое действие такого фермента обусловлено активностью эндогенного плазмина, образующегося после активации плазминогена ферментом.
Сущность способа заключается в следующем.
В качестве источника ферментов используют раствор препарата Морикраза (концентрация его в растворе не менее 2,5% или 2,5 г/л), который фракционируют с помощью ионообменной хроматографии. Фракционирование проводят при комнатной температуре на сорбенте ДЭАЭ-тойоперл в трис-хлоридном буфере с рН 7,2-7,5. Протеиназы элюируют в градиенте концентрации хлорида натрия от 0,1 до 1-1,5 М.
Замену буфера, обессоливание и концентрирование препарата осуществляют ультрафильтрацией на мембране, задерживающей белки с молекулярной массой не менее 10 кДа.
Для полного удаления примеси трипсина дальнейшую очистку препарата металлопротеиназы от примеси сериновых протеиназ проводят гель-хроматографией на Сефадексе G50 в 0,1 М аммоний-ацетатном буфере с рН 6.3 – 6,5, содержащем 1,0 – 1,2 М хлорид натрия.
Пример.
На колонку 20×2 см с ДЭАЭ-Тойоперл, уравновешенную Tris-HCl буфером с рН 7,5, наносят 10 мл раствора Морикразы с концентрацией 25 мг/мл. После промывки колонки стартовым буфером проводят элюцию в градиенте концентрации NaCl 0,1 – 1,0 М.
Фракции, содержащие металлопротеиназу, объединяют, концентрируют ультрафильтрацией на ячейке с мембраной, пропускающей пептиды с молекулярной массой менее 10 кДа.
В результате получают очищенный препарат металлопротеиназы с содержанием активатора около 84% (активность препарата по азоказеину подавляется ингибитором металлопротеиназ ЭДТА на 84%), содержащий следовую примесь трипсиноподобной сериновой протеиназы (Фиг.1) Выход 50%, очистка 2.5 раза.
На фиг.1 представлены:
а) СДС-ПААГ электрофореграмма препарата «Морикраза». Справа – набор белков-маркеров (БСА 66,2 кДа, овальбумин 45 кДа, карбангидраза 31 кДа, соевый ингибитор трипсина 21,5 кДа, лизоцим 14,4 кДа);
б) Препарат металлопротеиназы камчатского краба после ионообменной хроматографии. Слева – набор белков-маркеров (целлюлаза 94 кДа, БСА 66,2 кДа, овальбумин 45 кДа, карбангидраза 31 кДа, соевый ингибитор трипсина 21,5 кДа, лизоцим 14,4 кДа).
Для дальнейшей очистки полученный препарат наносят на колонку с Сефадексом G50, уравновешенную 0,1 М аммоний-ацетатным буфером с рН 6,4, содержащим 1 М NaCl.
В результате получают препарат металлопротеиназы с содержанием активатора, близким к 100%, гомогенный по данным электрофореза в ПААГ (фиг.2), с выходом по активности 39% и степенью очистки 5,5 раза.
На фиг.2 представлен препарат металлопротеиназы камчатского краба после ионообменной хроматографии и гель-хроматографии. Слева – набор белков-маркеров (целлюлаза 94 кДа, БСА 66,2 кДа, овальбумин 45 кДа, карбангидраза 31 кДа, соевый ингибитор трипсина 21,5 кДа, лизоцим 14,4 кДа).
Фибринолитическую активность препарата и его способность активировать плазминоген определяют с использованием стандартных фибриновых пластин, приготовленных по следующей методике: «Методы исследования фибринолитической системы крови». Под ред. Г.В. Андреенко. М.:МГУ, 1981. С.43.
На поверхность фибриновой пластины наносят 30 мкл плазмы крови человека или физиологического раствора, а затем сверху наслаивают раствор препарата. Фибриновые пластины инкубируют при температуре 37°С. Площадь зоны лизиса определяют как произведение двух перпендикулярных диаметров.
Активацию плазминогена металлопротеиназой также исследуют in vitro путем инкубации раствора, содержащего плазминоген и металлопротеиназу, при температуре 37°С и рН 7,5 в течение 2 часов и более. Белки из раствора осаждают ТХУ в конечной концентрации 7 -10% (вес./об.), промывают осадок ацетоном и растворяют в буфере для нанесения образцов. Затем проводят электрофорез по Лэммли [Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970 Aug 15;227, (5259):680-685] и окрашивают гель «Кумасси бриллиантовым голубым» для визуализации белковых полос.
Способность препарата лизировать предобразованные сгустки плазмы крови человека определяют по следующей методике.
К 250 мкл плазмы крови человека добавляют 50 мкл раствора тромбина (2000 ед.акт. на 0,2 г сухого веса) с концентрацией 2 мг/мл и выдерживают в течение 5 минут на водяной бане при температуре 37°С.
К полученному сгустку добавляют 500 мкл раствора препарата фермента и выдерживают на водяной бане при температуре 37°С до полного лизиса сгустка. В контрольные пробирки добавляют физиологический раствор. Лизис сгустка регистрируют визуально.
На фиг.3 представлена электрофореграмма продуктов взаимодействия плазминогена с металлопротеиназой (время инкубации – 2 часа). 1 – плазминоген без металлопротеиназы, 2 – набор белков – маркеров (сбоку указаны их молекулярные массы в кДа), 3 – реакционная смесь (МП – металлопротеиназа).
В таблице приведены данные, характеризующие активаторную groupTop9754groupRight11179groupBottom15211fFlipH0fFlipV0dxWrapDistLeft24130dyWrapDistTop21590dxWrapDistRight24130dyWrapDistBottom0posrelh0posrelv2fLayoutInCell1fAllowOverlap1fLayoutInCell1активность полученного продукта.
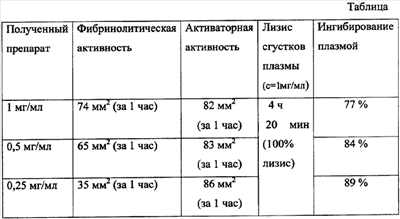
В случае использования активатора плазминогена, полученного по предлагаемому способу, полный лизис сгустков плазмы (который эквивалентен полному восстановлению проходимости кровеносного сосуда) происходит за 4 ч 20 мин под действием 500 мкг фермента. В случае использования активатора плазминогена, полученного по способу прототипа, добавление 20 мкг и более активатора плазминогена к сгустку плазмы приводит к неполному лизису тромба за 12 час, причем невозможно определить, произойдет ли при неполном лизисе тромба востановление проходимости сосуда (так как в прототипе степень лизиса оценивали с помощью радиометрического метода, который не позволяет установить, нарушена ли механическая целостность тромба – то есть, восстановилась ли проходимость сосудов).
Таким образом, при сопоставимой активаторной активности полученного нами фермента с активностью фермента, выделенного в прототипе, предложный способ позволяет:
1) использовать более доступное сырье (гепатопанкреас краба – побочный продукт пищевой промышленности, таким образом, наша методика позволяет более полно утилизировать природное сырье), при этом нет необходимости в культивировании клетки (тем более опухолевых),
2) уменьшить затраты на очистку препарата (менее дорогие сорбенты, меньшее число стадий),
3) использовать безопасные для организма препараты.
Таким образом, предлагаемый способ позволяет получить новый активатор плазминогена из доступного, дешевого и не содержащего онкогенных белков сырья, сократить время процесса и удешевить процесс получения препарата.
Формула изобретения
Способ получения активатора плазминогена из ферментсодержащего сырья, включающий фракционирование его с помощью ионообменной хроматографии, отличающийся тем, что в качестве ферментсодержащего сырья используют коллагенолитический ферментный препарат «Морикраза», растворяют последний в трис-хлоридном буфере с рН 7,2-7,5 до концентрации его в растворе не менее 2,5% с последующим фракционированием раствора на сорбенте ДЭАЭ-Тойоперл, элюцией протеиназы в градиенте концентрации NaCl 0,l-1,5 М, концентрированием и обессоливанием полученного раствора активатора плазминогена ультрафильтрацией на мембране, пропускающей пептиды с молекулярной массой менее 10 кДа, и очисткой активатора плазминогена гель-хроматографией на Сефадексе G50 в 0,1 М аммоний-ацетатном буфере с рН 6,3-6,5, содержащем 1,0-1,2 М хлорида натрия.
РИСУНКИ
|
|