|
|
(21), (22) Заявка: 2005104557/13, 17.07.2003
(24) Дата начала отсчета срока действия патента:
17.07.2003
(30) Конвенционный приоритет:
19.07.2002 US 60/396,629
(43) Дата публикации заявки: 10.09.2005
(46) Опубликовано: 20.02.2009
(56) Список документов, цитированных в отчете о
поиске:
US 5559022, 24.09.1996. YASUI О. et al. Isolation of oval cells from Long-Evans Cinnamon rats and their transformation into hepatocytes in vivo in the rat liver. – Hepatology, 1997, v.25, n.2, p.329-334. RU 2153344 Cl, 27.07.2000.
(85) Дата перевода заявки PCT на национальную фазу:
21.02.2005
(86) Заявка PCT:
US 03/22220 (17.07.2003)
(87) Публикация PCT:
WO 2004/009766 (29.01.2004)
Адрес для переписки:
103735, Москва, ул. Ильинка, 5/2, ООО “Союзпатент”, пат.пов. А.П.Агурееву
|
(72) Автор(ы):
ЛАДЛОУ Джон В. (US),
ФЁРТ Марк Э. (US),
БРЮС Эндрю Т. (US),
РЕЙД Лола М. (US),
СЬЮСИК Роберт Л. младший (US)
(73) Патентообладатель(и):
ВЕСТА ТЕРАПЬЮТИКС, ИНК. (US)
|
(54) СПОСОБ ПОЛУЧЕНИЯ ЖИЗНЕСПОСОБНЫХ КЛЕТОК ПЕЧЕНИ ЧЕЛОВЕКА, В ТОМ ЧИСЛЕ ПЕЧЕНОЧНЫХ СТВОЛОВЫХ КЛЕТОК/КЛЕТОК-ПРЕДШЕСТВЕННИКОВ
(57) Реферат:
Изобретение относится к области биотехнологии, конкретно, к получению клеток печени, и может быть использовано в медицине. Из целой печени или из ее резецированной части получают популяцию клеток, обогащенную жизнеспособными клетками печени человека, в том числе печеночными стволовыми клетками/клетками-предшественниками. В состав популяции клеток входят функционально активные гепатоциты и билиарные клетки, экспрессирующие цитокератин 19 (СК19) и не экспрессирующие альбумин, а также печеночные стволовые клетки/клетки-предшественники, имеющие диаметр в диапазоне от 9 до 13 мкм и экспрессирующие маркеры ЕР-CAM, CD 133. Полученную популяцию клеток используют для лечения пациентов, страдающих заболеваниями печени. Изобретение позволяет получить жизнеспособную популяцию клеток печени, достаточно эффективную для регенерации. 7 н. и 53 з.п. ф-лы, 16 ил., 2 табл.
Область техники, к которой относится изобретение
Данное изобретение относится к области трансплантации клеток печени или клеточной терапии и обеспечивает продукт для трансплантации печеночных клеток или клеточной терапии фармацевтического качества и способам получения популяций функциональных печеночных клеток с высокой жизнеспособностью, в том числе печеночных стволовых клеток/клеток-предшественников.
Уровень техники
Нормальная печень обладает способностью регенерировать посредством репарации или замены поврежденной ткани. Несмотря на эту защиту, как только критическая масса клеток печени погибает вследствие заболевания или повреждения, печень может перестать функционировать, что приводит к болезни или смерти. Печеночная недостаточность является серьезной проблемой здравоохранения. Каждый год имеют место регистрируемые 300000 госпитализаций и 30000 смертей в Соединенных Штатах вследствие хронических заболеваний печени. В настоящее время единственным лечением для многих из этих заболеваний печени является трансплантат печени. Однако только приблизительно 5000 донорских печеней становятся доступными каждый год в Соединенных Штатах. По данным на май 2002 г. 18000 пациентов находились в списке ожидания трансплантата печени; увеличение более чем на 100% в сравнении с последними четырьмя годами и с 1700 десять лет назад. Кроме того, приблизительно 100000 взрослых, которые в настоящее время страдают от тяжелого цирроза и других форм хронической печеночной недостаточности в Соединенных Штатах, могут стать кандидатами в отношении трансплантата.
Вследствие дефицита донорских органов потенциальные ожидающие трансплантата печени пациенты должны часто ожидать годами того момента, когда донорская печень будет доступной. В настоящее время процедуры трансплантации печени в виде целого органа требуют донора, который подвергся смерти головного мозга, но сердце которого все еще сокращается. Это происходит только приблизительно в одном-двух процентах смертей в больницах, что сильно ограничивает потенциальный пул доноров. Ясно, что огромное большинство пациентов с заболеваниями печени не могут полагаться на трансплантацию печени как на решение вопроса. Существует настоятельная необходимость в новых технологиях для поддержания пациентов с поврежденной печенью.
Регенеративная способность печени предполагает, что трансплантация клеток печени может предоставить ценную альтернативу ортотопической трансплантации целых печеней. Донорские печеночные клетки, инфузированные в пациента с заболеванием печени, могут быть способны колонизировать печень реципиента (и/или селезенку при инфузии в этот орган) и восстанавливать функцию. Однако потенциал выживания и увеличения количества в течение продолжительных периодов после трансплантации у зрелых гепатоцитов остается неопределенным.
Обычный здравый смысл позволяет считать, что все зрелые клетки печени взрослых (гепатоциты) способны делиться много раз, позволяя этому органу регенерировать после повреждения. Однако имеется растущее понимание в отношении диапазона регенеративного потенциала паренхимных клеток, полученных из печени. В исследованиях на гепатоцитах грызунов было показано, что зрелые гепатоциты из перицентральной зоны могут претерпевать ограниченное, если вообще могут претерпевать клеточное деление; перипортальные гепатоциты взрослых, иногда называемые “малыми гепатоцитами”, имеют более высокую регенеративную способность, но все еще проходят только через ограниченное число делений; и наибольшая регенеративная способность присутствует в небольшой популяции диплоидных паренхимных клеток со свойствами, подобными свойствам стволовых клеток или клеток-предшественников, которые могут размножаться очень интенсивно и могут давать увеличение числа зрелых гепатоцитов [Kubota H and Reid LM. 2000/ Clonogenic hepatoblasts, common precuesors for hepatocytic and biliary lineages, are lacking classical major histocompatibility complex class I antigen. Proceedings of the National Academy of Sciences (USA) 97: 12132-12137].
Печеночные стволовые клетки/клетки-предшественники являются популяцией незрелых клеток, которые коммитированы в направлении печеночной линии дифференцировки, но еще не проявляют большинства функций зрелых клеток печени.
Однако они могут интенсивно пролиферировать и приводить к появлению полностью дифференцированных дочерних клеток, которые действительно обеспечивают функцию печени. Исследования на моделях грызунов продемонстрировали существование стволовых клеток/клеток-предшественников в фетальной печени и печени взрослых, которые являются, по меньшей мере, бипотентными; т.е. их потомство включает в себя два типа клеток, а именно, гепатоциты и клетки желчных протоков [Kubota H and Reid LM. 2000/Clonogenic hepatoblasts, common precuesors for hepatocytic and biliary lineages, are lacking classical major histocompatibility complex class I antigen. Proceedings of the National Academy of Sciences (USA) 97:12132-12137]. Было показано, что в печени взрослых эти стволовые клетки/клетки-предшественники участвуют в регенерации печени и интенсивно заселяют повторно печени хозяев после определенных типов повреждения печени, в которых зрелые гепатоциты реципиента были разрушены или имеют нарушенную способность пролиферации.
На протяжении последних 30 лет был накоплен значительный объем научной литературы, демонстрирующей способность инфузированных гепатоцитов, выделенных из печеней взрослых, приживаться в ткани хозяина, пролиферировать, функционировать и участвовать в регенеративном процессе. Было показано, что трансплантация гепатоцитов в селезенку или печень корректировала наследственные дефекты метаболизма на многочисленных моделях, полностью повторно заселяла печень хозяина в условиях, в которых клетки печени были утрачены или имели уменьшенную продолжительность жизни (как в модели FAH-недостаточных мышей), обеспечивала функции печени во время острой печеночной недостаточности, индуцированной различными повреждениями, улучшала функции печени и пролонгировала выживание на CCl4-индуцированных моделях цирроза.
Исследования случаев заболеваний и историй болезни в литературе описывают введение гепатоцитов более чем 40 пациентам с различными острыми и хроническими, наследственными и приобретенными заболеваниями печени. [Strom SC, Chowdhury JR, and Fox IJ. 1999. Hepatocyte transplantation for the treatment of human disease (Review). Seminars in Liver Disease 19:39-48]. Данные из ряда этих сообщений предполагают, что эти клетки действительно приживались, выживали и функционировали в течение периода до нескольких месяцев. В одном исследовании синтетические способности печени показали улучшение в течение четырех-шести месяцев после трансплантации клеток, о чем свидетельствовали улучшенные уровни альбумина и протромбиновое время. Одно из самых лучших опубликованных сообщений, демонстрирующих приживление и функцию трансплантированных гепатоцитов, связано с 10-летней девочкой с синдромом Криглера-Найяра, наследственным заболеванием, при котором индивидуум имеет приводящую к тяжелой желтухе недостаточность фермента УДФ-глюкуронозилтрансферазы, который конъюгирует билирубин (Fox et al., I.J., “Treatment of the Crigler-Najjar Sundrome Type I with hepatocyte transplantation, “New England Journal of Medicine, (1998) 338:1422-1426). В течение 18 месяцев после трансплантации эта пациентка испытывала значительные увеличения в экскреции конъюгированного билирубина в ее желчи, увеличенную активность ферментов в биопсиях ее печени и уменьшенную потребность в отношении фототерапии УФ-светом. Однако эти прежние эксперименты с трансплантированными гепатоцитами привели только к временному улучшению. Ограниченная пролиферативная способность зрелых гепатоцитов неизбежно ограничивает эффективную продолжительность действия терапии одними гепатоцитами.
В настоящее время было обнаружено, что вышеупомянутые проблемы в предыдущих попытках лечения заболеваний печени преодолеваются использованием популяций клеток данного изобретения, которые обогащены жизнеспособными функциональными клетками печени. Высокая пролиферативная способность клеток данного изобретения поддерживает максимальную регенерацию ткани и снижает необходимую дозу клеток для успешной трансплантации. Присутствие стволовых клеток/клеток-предшественников также предоставляет увеличенную эффективную продолжительность действия терапии клетками печени вследствие их улучшенной способности, в сравнении со зрелыми гепатоцитами, выживать, пролиферировать, функционировать и участвовать в регенеративном процессе.
Если терапия клетками печени должна стать коммерческой реальностью и жизнеспособной терапевтической альтернативой для значительного количества пациентов, должно быть налажено достаточное обеспечение печеночной тканью. Было обнаружено, что клетки, полученные способами данного изобретения, могут быть получены из печеней определенных доноров органов, которые не подходят для получения трансплантата целого органа или, вследствие временных/транспортных ограничений, не могут быть использованы своевременно. Жизнеспособные, функциональные клетки печени могут быть выделены способом данного изобретения из печеней, которые, согласно общепринятым рекомендациям, не пригодны для ортотопической трансплантации или для получения больших количеств зрелых гепатоцитов для трансплантации клеток. Наиболее важным является то, что очистка популяций клеток печени человека, в том числе стволовых клеток/клеток-предшественников, способом данного изобретения обещает разительное увеличение пула доноров для терапии с использованием клеток печени. Кроме того, очевидно, вследствие относительной устойчивости стволовых клеток/клеток-предшественников к ишемическому повреждению, было обнаружено, что эти клетки могут быть получены по данному способу из многих асистолических (т.е. с не сокращающимся сердцем) доноров.
Способ выделения данного изобретения обеспечивает включение жизнеспособных, функциональных клетки печени, в том числе печеночных стволовых клеток/клеток-предшественников, из печени донора в криоконсервированную смесь клеток. Этот способ изолирует суспензию клеток с пропорционально более высокой жизнеспособностью из целых печеней людей-доноров или резецированных частей (в сравнении с грубыми препаратами печени) и элиминирует мертвые клетки и дебрис без чрезмерного истощения (если вообще с каким-либо истощением) популяции малых печеночных стволовых клеток/клеток-предшественников. Полученная клеточная популяция может содержать более чем 80% клеток, жизнеспособных перед криоконсервированием, более чем 70% клеток, жизнеспособных после оттаивания, и более чем 75% этих клеток, являющихся гепатоцитами.
В противоположность этому, известные способы выделения гепатоцитов используют низкоскоростное центрифугирование, во многих случаях через среду Перколл, для обогащения живых гепатоцитов (обнаруживаемых в осадке после центрифугирования). Хотя этот способ является очень эффективным при выделении больших жизнеспособных гепатоцитов, в частности более крупных гепатоцитов, он приводит к значительному истощению печеночных стволовых клеток/клеток предшественников и даже к значительной потере малых зрелых гепатоцитов.
Данное изобретение направлено на вышеупомянутые потребности и развивает состояние трансплантации клеток печени или клеточной терапии обеспечением продукта для трансплантации печеночных клеток или клеточной терапии фармацевтического качества и способов получения популяций функциональных печеночных клеток с высокой жизнеспособностью, в том числе печеночных стволовых клеток/клеток-предшественников, которые не могли быть получены ранее общепринятыми способами. Продукт для трансплантации печеночных клеток или клеточной терапии данного изобретения состоит из хорошо охарактеризованной смеси печеночных клеток, содержащих печеночные стволовые клетки/клетки-предшественники, а также другие типы клеток, обнаруживаемые в печени.
Раскрытие изобретения
Данное изобретение относится к способу получения популяции клеток, обогащенной жизнеспособными печеночными клетками человека, предусматривающему:
расщепление целой печени человека или ее резецированной части препаратом протеолитических ферментов для обеспечения расщепленной целой печени человека или ее резецированной части; диссоциацию расщепленной целой печени человека или ее резецированной части для обеспечения суспензии клеток; установление плотности среды, в которой суспендируют эти клетки, посредством чего после центрифугирования получают, по меньшей мере, две полосы клеток, разделенных барьером плотности, причем, по меньшей мере, одна полоса из этих, по меньшей мере, двух полос является полосой меньшей плотности, чем другая полоса из этих, по меньшей мере, двух полос; и сбор этой, по меньшей мере, одной полосы меньшей плотности для получения популяции клеток, обогащенной жизнеспособными клетками печени человека, в том числе печеночными стволовыми клетками/клетками-предшественниками.
В другом воплощении данного изобретения обеспечен способ получения популяции клеток, обогащенной жизнеспособными печеночными клетками человека, в том числе печеночными стволовыми клетками/клетками-предшественниками, предусматривающий: расщепление целой печени человека или ее резецированной части препаратом протеолитических ферментов для обеспечения расщепленной целой печени человека или ее резецированной части; диссоциацию расщепленной целой печени человека или ее резецированной части для обеспечения суспензии клеток; установление плотности среды, в которой суспендируют эти клетки, посредством чего после центрифугирования получают, по меньшей мере, одну полосу клеток, причем эта, по меньшей мере, одна полоса клеток является полосой меньшей плотности, чем осадок клеток или клеточный дебрис; и сбор этой, по меньшей мере, одной полосы более низкой плотности для получения популяции клеток, обогащенных жизнеспособными клетками печени человека, в том числе печеночными стволовыми клетками/клетками-предшественниками. Другие воплощения данного изобретения включают в себя, но не ограничиваются ими, популяции клеток, имеющие также функциональные гепатоциты, функциональные билиарные клетки, функциональные гемопоэтические клетки или их комбинации.
Следующее воплощение данного изобретения обеспечивает то, что печень или ее резецированная часть могут быть получены из имеющих сокращающееся сердце или асистолических неонатальных, педиатрических, ювенильных или взрослых доноров. В частности, клетки могут быть получены по способу данного изобретения из печени донора, которая была подвергнута тепловой ишемии или была получена из асистолического донора.
Кроме того, данное изобретение относится к композиции, содержащей популяцию печеночных клеток, обогащенную жизнеспособными, функциональными клетками печени, причем эта популяция клеток содержит функциональные гепатоциты и печеночные стволовые клетки/клетки-предшественники. В конкретном воплощении эта обогащенная популяция клеток обогащена печеночными стволовыми клетками/клетками-предшественниками, имеющими диаметр в диапазоне приблизительно 9-13 микрон, которые являются положительными в отношении экспрессии ЕР-САМ (также называемого GA733-2, С017-1А, EGP40, KS1-4, KSA), CD133 или обоих.
В следующем воплощении данное изобретение относится к композиции, содержащей популяцию печеночных клеток, обогащенную относительно грубой суспензией клеток, полученных из печени жизнеспособными, функциональными гепатоцитами и печеночными стволовыми клетками/клетками-предшественниками. Еще одно воплощение дополнительно содержит билиарные клетки. Было обнаружено, что билиарные клетки этих клеточных популяций данного изобретения являются положительными в отношении экспрессии цитокератина-19 (СК19) и являются отрицательными в отношении экспрессии альбумина.
Данное изобретение относится также к способу лечения заболевания печени, предусматривающему введение эффективного количества популяции клеток, обогащенной жизнеспособными, функциональными клетками печени, в том числе печеночными стволовьми клетками/клетками-предшественниками. Различные способы введения предусматриваются данным способом, в том числе, но не только, введение через селезеночную артерию или воротную вену непосредственно в пульпу печени под капсулу печени или непосредственно в селезенку.
В другом воплощении данное изобретение относится к фармацевтической композиции, содержащей популяцию клеток печени, обогащенную жизнеспособными, функциональными клетками печени, в том числе печеночными стволовыми клетками/клетками-предшественниками, и фармацевтически приемлемый носитель. В следующем воплощении фармацевтически приемлемый носитель может включать в себя криоконсервант, такой как HYPOTHERMOSOL . .
Еще в одном воплощении данное изобретение относится к способу проведения испытания токсичности in vitro, предусматривающему подвергание действию тест-агента популяции клеток печени, обогащенной жизнеспособными, функциональными клетками печени, в том числе печеночными стволовыми клетками/клетками-предшественниками, и наблюдение, по меньшей мере, одного действия, если оно имеется, тест-агента на эту популяцию клеток печени (например, на жизнеспособность клеток, функцию клеток или на обе). Данное изобретение предусматривает также способ проведения исследований метаболизма лекарственных средств in vitro, предусматривающий подвергание популяции клеток печени, обогащенной жизнеспособными, функциональными клетками печени, в том числе печеночными стволовыми клетками/клетками-предшественниками, действию тест-агента и наблюдение, по меньшей мере, одного изменения, если оно имеется, включающего тест-агент, после заданного тест-периода. Это, по меньшей мере, одно изменение может включать в себя, но не ограничивается ими, изменение в структуре, концентрации или и в структуре, и в концентрации этого тест-агента.
Другое воплощение данного изобретения относится к вспомогательному устройству для печени, содержащему корпус, вмещающий популяцию клеток печени, обогащенную жизнеспособными, функциональными клетками печени, в том числе печеночными стволовыми клетками/клетками-предшественниками. Эти клетки печени могут содержать клетки печени человека или клетки печени свиньи.
Данное изобретение относится также к способу лечения ошибок экспрессии генов, предусматривающему введение в популяцию клеток печени человека, включающую в себя жизнеспособные, функциональные печеночные стволовые клетки/клетки-предшественники, функциональной копии гена для обеспечения трансформированной популяции и введение в печень пациента, который нуждается в функциональной копии этого гена, по меньшей мере, части этой трансформированной популяции. Другим воплощением данного изобретения является композиция данного изобретения, применимая в вышеупомянутом способе.
Другие способы, обеспечиваемые данным изобретением, включают в себя способы усиления регенерации поврежденной или заболевшей печени, способы проведения тестирования на эффективные агенты для лечения инфекций печени, способы получения представляющего интерес белка и способы получения представляющей интерес вакцины.
В способе тестирования на эффективные агенты для лечения инфекций печени популяцию клеток печени человека инфицируют представляющим интерес инфекционным агентом. После этого эту инфицированную популяцию подвергают действию заданного количества тест-агента и определяют эффекты, если они имеются, этого воздействия на инфицированную популяцию. В способе получения представляющего интерес белка функциональный ген, кодирующий представляющий интерес белок, вводят в популяцию клеток печени, включающую в себя печеночные стволовые клетки/клетки-предшественники. Затем полученную популяцию инкубируют при условиях, эффективных для прохождения транскрипции, трансляции и при необходимости посттрансляционной модификации, и после этого собирают представляющий интерес белок. Предусматривается также способ получения вакцины, при котором рекомбинантные частицы вируса или вириона вводят в популяцию клеток данного изобретения, причем частица вируса или вириона способна инфицировать, по меньшей мере, некоторые члены этой популяции клеток, заставляя эти инфицированные члены экспрессировать антиген, так что индуцируется иммунная реакция в субъекте, который подлежит иммунизации против подвергания в будущем действию инфекционного агента, ассоциированного с этим антигеном, после введения инфицированных членов этой популяции в этого субъекта.
Применение на практике данного изобретения будет использовать, если не указано иначе, общепринятые способы биологии клеток, культуры клеток, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантных ДНК и иммунологии, которые находятся в рамках квалификации в данной области. Такие способы описаны в литературе. См., например. Molecular Cloning: A Laboratory Manual, Second Edition, ed. by Sambrook, Fritsch and Maniatis (Cold Spring Harbor Laboratory Press: 1989); DNA Cloning, Volumes I and II (D.N. Glover ed., 1985); Oligonucleotide Synthesis (M.J. Gait ed., 1984); Mullis et al. U.S. Pat. No: 4,683 195; Nucleic Acid Hybridization (B.D. Hames & S.J. Higgins eds. 1984); Transcription And Translation (B.D. Hames & S.J. Higgins eds. 1984); Culture Of Animal Cells (R.I. Freshney, Alan R. Liss, Inc., 1987); Immobilized Cells And Enzymes (IRL Press, 1986); В. Perbal, A Practical Guide To Molrcular Cloning (1984); многотомное издание Methods in Enzymology (Academic Press, Inc., N. Y.); Gene Transfer Vectors For Mammalian Cells (J.H. Miller and M.P. Calos eds., 1987, Cold Spring Harbor Laboratory); Methods in Enzymology, Vols. 154 and 155 (Wu et al. eds.), Immunochemical Methods in Cell And Molecular Biology (Mayer and Walker, eds.. Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (D.M. Weir and C.C. Blackwell, eds., 1986);
Manipulating the Mouse Embryo, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y., 1986); Applications and Products 2001: Density Gradient Media (Axis-Shield PoC AS, Oslo, Norway, 2001).
Другие признаки и преимущества данного изобретения станут очевидными из следующего подробного описания данного изобретения, рассматриваемого вместе с сопутствующими рисунками, которые иллюстрируют посредством примеров принципы данного изобретения.
Краткое описание чертежей
Фиг.1 показывает профиль размеров, определенный при помощи счетчика Коултера, для нового способа фракционирования OptiPrep, который выявляет 2 пика клеток: клеток, которые названы авторами изобретения “малыми” (обычно в диапазоне приблизительно 9-13 мкм), и относительно больших клеток (обычно в диапазоне приблизительно 18-22 мкм). Популяция “малых” клеток содержит стволовые клетки/клетки-предшественники, так как эти клетки имеют размер приблизительно 10 мкм.
Фиг.2 показывает профиль размеров, определенный при помощи счетчика Коултера, для стандартного (общепринятого) способа с Перколлом, показывающий, что относительная численность более крупных клеток (18-22 мкм) является более высокой в осадке Перколла (100 × g), чем в соответствующем супернатанте (300 × g).
Фиг.3 показывает результаты FACS-анализов после иммуноокрашивания антителом, специфичным к ЕР-САМ человека, показывающие, что осадок Перколла (100 × g) содержит в 6 раз меньше ЕР-САМ-положительно окрашивающихся клеток (левая панель, 0,12% популяции (+) в отношении ЕР-САМ), чем исходный материал (правая панель, 0,76% популяции (+) в отношении ЕР-САМ).
Фиг.4 показывает результаты FACS-анализов после иммуноокрашивания антителом, специфичным к ЕР-САМ человека, показывающие, что фракционирование OptiPrep, по-видимому, не влияет на общую численность ЕР-САМ-положительно окрашивающейся популяции (3,07% и 3,06% популяции, окрашивающейся положительно в отношении ЕР-САМ во фракционированных и нефракционированных пробах, соответственно).
Фиг.5 показывает графики, показывающие относительные популяции ЕР-САМ-положительных клеток, обнаруженных в клеточном выделении данного изобретения (левая панель) в сравнении с супернатантом стандартного способа (центральная панель) и осадком стандартного способа (правая панель).
Результаты получены на девятимесячном доноре.
Фиг.6 показывает графики, показывающие относительные популяции ЕР-САМ-положительных клеток, обнаруженных в клеточном выделении данного изобретения (левая панель) в сравнении с супернатантом стандартного способа (центральная панель) и осадком стандартного способа (правая панель).
Результаты получены на 3-летнем доноре.
Фиг.7 показывает графики, демонстрирующие обогащение в отношении ЕР-САМ-положительных клеток после иммуноселекции.
Фиг.8 показывает графики, демонстрирующие обогащение в отношении ЕР-САМ-положительных клеток после иммуноселекции.
Фиг.9 показывает микрофотографии колоний, выращенных из отдельной клетки, при различных условиях окрашивания, демонстрирующие, что клетки, выделенные по способу данного изобретения, являются печеночными стволовыми клетками/клетками-предшественниками.
Фиг.10 показывает микрофотографии колоний, выращенных из отдельной клетки, при различных условиях окрашивания, демонстрирующие, что клетки, выделенные по способу данного изобретения, являются печеночными стволовыми клетками/клетками-предшественниками.
Фиг.11 показывает микрофотографию гепатоцитов человека, полученных с использованием данного изобретения на гранулах-микроносителях в мышах NOD-SCID.
Фиг.12 показывает микрофотографию, сделанную при меньшей разрешающей способности, чем микрофотография фиг.11, для визуализации большого островка гепатоцитов, которые становятся васкуляризованными хозяином, о чем свидетельствуют эритроциты.
Фиг.13 приводит доказательство того, что печеночные стволовые клетки/клетки-предшественники данного изобретения способны развиваться в гепатоциты и проявляют зрелый фенотип, демонстрирующий положительное окрашивание на гликоген в их цитоплазме. Обратите внимание на явную организацию этих клеток в тяжи.
Фиг.14 показывает три гепатоцита, полученных с использованием данного изобретения, прикрепленных к микроносителю, инъецированному в хозяина. Черный прямоугольник нарисован вокруг поверхности раздела между двумя соседними клетками. Увеличенный фотоснимок этой зоны показывает структуры, микроворсинки, характерные для желчных канальцев, – другой маркер зрелых гепатоцитов.
Фиг.15 показывает микрофотографию, демонстрирующую приживление криоконсервированных клеток печени человека данного изобретения в печени мышей NOD-SCID. Два часа после трансплантации клетки человека ясно видны по гибридизации in situ в воротных венах и печеночных синусоидных капиллярах печени. Эти клетки еще не перешли из васкулярного пространства в печеночную паренхиму.
Фиг.16 показывает микрофотографию, демонстрирующую приживление криоконсервированных клеток печени человека данного изобретения в печени мышей NOD-SCID. На 40 день после трансплантации клетки человека не только остаются в печени, но приживляются в клеточную пластинку печени, становясь полностью интегрированными в печеночную паренхиму.
Осуществление изобретения
Данное изобретение относится, в частности, к способу получения популяции клеток, обогащенной жизнеспособными, функциональными гепатоцитами и печеночными стволовыми клетками/клетками-предшественниками. Другим, родственным, аспектом данного изобретения является идентификация печеночных стволовых клеток/клеток-предшественников. Описанные ниже воплощения данного изобретения приведут к важному прогрессу в идентификации и выделении печеночных стволовых клеток/клеток-предшественников из печени взрослых людей.
Идентифицированы несколько белков клеточной поверхности, которые экспрессируются печеночными стволовыми клетками/клетками-предшественниками, выделенными из фетальной печени человека. Обнаружено, что те же самые поверхностные антигены экспрессируются небольшим процентом клеток в неонатальных, педиатрических печенях и печенях взрослых людей. Способ магнитного сортинга клеток используется для значительного обогащения клетками, экспрессирующими один из этих поверхностных антигенов. Клетки, выделенные с использованием этого подхода, являются, в среднем, гораздо меньшими по размеру, чем зрелые гепатоциты, в отличие от предыдущих исследований печеночных стволовых клеток/клеток-предшественников грызунов, которые идентифицировали класс больших (больших, чем зрелые паренхимные клетки), ацидофильных печеночных клеток в качестве резервных клеток печени (патент США с номером 5559022). Кроме того, огромное большинство клеток также экспрессируют второй антиген, характерный для фетальных печеночных стволовых клеток/клеток-предшественников. При культивировании в условиях, которые строго отбирают на рост печеночных стволовых клеток/клеток-предшественников грызунов и ограничивают рост более зрелых печеночных клеток, отобранные сортингом клетки взрослых людей обнаруживают усиленный потенциал роста. Наиболее убедительным аргументом является то, что анализ колоний, выращенных из отдельных клеток в отобранной сортингом популяции, демонстрирует экспрессию белков, характерных для линий дифференцировки как гепатоцитов, так и желчных протоков, как это ожидалось для бипотентных печеночных стволовых клеток/клеток-предшественников.
Бросающимся в глаза в данном изобретении является то, что клетки, экспрессирующие характерные поверхностные антигены, остаются присутствующими в печенях (из доноров с остановившимся сердцем), которые страдали несколько часов от тяжелой кислородной депривации перед сбором. Фактически, печеночные стволовые клетки/клетки-предшественники являются, по-видимому, значительно более устойчивыми к ишемии, чем зрелые гепатоциты. Кроме того, хотя тотальные препараты клеток печени из асистолических доноров обычно содержат в значительной степени повышенные количества клеток, ассоциированных с повреждением ткани и воспалительными реакциями, все еще остается возможным сильное обогащение жизнеспособными, функциональными клетками печени, в том числе печеночными стволовыми клетками/клетками-предшественниками с использованием способов данного изобретения. В предпочтительных воплощениях данного изобретения используют способы иммуноселекции и магнитного сортинга для дополнительного выделения или удаления выбранных типов клеток, полученных из печени.
Способы данного изобретения, которые используются для обогащения жизнеспособными, функциональными клетками печени человека, могут быть применены непосредственно к тотальным препаратам клеток печени или к препаратам, полученным из резецированных частей печени. Эта процедура является быстрой, дает удовлетворительные выходы клеток и удовлетворительную жизнеспособность и может быть масштабирована для обработки десятков миллиардов клеток. Выделенные клетки легко криоконсервируются и сохраняют свою жизнеспособность при оттаивании.
Данное изобретение демонстрирует, что жизнеспособные клетки печени могут быть выделены post mortem из различных печеночных источников, включающих в себя печени доноров с небьющимся сердцем, печени которых не могут быть использованы для трансплантации целых органов. Поскольку популяции клеток печени данного изобретения могут быть получены из асистолических доноров, данное изобретение будет разительно расширять пул донорских органов, которые пригодны для использования в трансплантации клеток печени или клеточной терапии. Таблица 1 суммирует выходы из доноров с сокращающимся сердцем и асистолических доноров.

Клетки выделяли из целых донорских печеней или их резецированных частей перфузией ткани Liberase , очищенной формой коллагеназы, и сбором полученной суспензии клеток. Испытывали два способа отделения живых клеток от мертвых клеток. В новом способе данного изобретения аликвоту суспензии печеночных клеток смешивают с равным объемом раствора иодиксанола (OptiPrep , очищенной формой коллагеназы, и сбором полученной суспензии клеток. Испытывали два способа отделения живых клеток от мертвых клеток. В новом способе данного изобретения аликвоту суспензии печеночных клеток смешивают с равным объемом раствора иодиксанола (OptiPrep , 60% иодиксанол в воде, Axis-Shield, Norway) и центрифугируют при 2000 об/мин (приблизительно 500 × g) в промывателе для клеток Cobe 2991 , 60% иодиксанол в воде, Axis-Shield, Norway) и центрифугируют при 2000 об/мин (приблизительно 500 × g) в промывателе для клеток Cobe 2991 (доступном от Blood Component Technology, Lakewood, CO) в течение 15 минут при комнатной температуре следующим образом. (доступном от Blood Component Technology, Lakewood, CO) в течение 15 минут при комнатной температуре следующим образом.
В стерильный флакон на 500 мл добавляют 208,5 мл OptiPrep , 291,5 мл среды RPMI-1640 без фенолового красного. Это дает 25% раствор иодиксанола, имеющий плотность 1,12. , 291,5 мл среды RPMI-1640 без фенолового красного. Это дает 25% раствор иодиксанола, имеющий плотность 1,12.
После расчета объема клеток на основе массы добавляют достаточное количество среды RPMI-1640 без фенолового красного с доведением конечного объема до 250 мл с общим количеством клеток 10 × 109 (40 × 106 клеток/мл). Добавляют 250 мл 25% иодиксанола и осторожно перемешивают для хорошего смешивания. Подают полученный раствор клеток в иодиксаноле под действием силы тяжести в мешочек для обработки промывателя клеток Cobe 2991 . Наслаивают 100 мл среды RPMI-1640 без фенолового красного на поверхность раствора клеток в иодиксаноле с использованием перистальтического насоса при скорости 20 мл/мин во время центрифугирования мешочка. Центрифугируют при 2000 об/мин (приблизительно 500 × g) в течение 15 минут в целом. Полученную полосу печеночных клеток на поверхности раздела между раствором клеток в иодиксаноле и средой RPMI-1640 без фенолового красного извлекают отдельно от осажденного материала. . Наслаивают 100 мл среды RPMI-1640 без фенолового красного на поверхность раствора клеток в иодиксаноле с использованием перистальтического насоса при скорости 20 мл/мин во время центрифугирования мешочка. Центрифугируют при 2000 об/мин (приблизительно 500 × g) в течение 15 минут в целом. Полученную полосу печеночных клеток на поверхности раздела между раствором клеток в иодиксаноле и средой RPMI-1640 без фенолового красного извлекают отдельно от осажденного материала.
В отдельных экспериментах, приводящих к условиям, описанным выше, определяли плотности исходных материалов и материалов выбранных полос после центрифугирования, в том числе полосы, обозначенной как полоса “Umix”, полоса “gradient contents”, и осадка. Обнаружено, что представляющая интерес полоса, полоса “Umix”, имеет плотность 1,0607. Эта величина плотности меньше, чем величина, обнаруженная для исходного материала (1,0792), полосы “gradient contents” (1,0792) и осадка (1,1061). Затем определено, что 11,59% раствор иодиксанола необходим для обеспечения градиента, непосредственно на который будут осаждаться представляющие интерес клетки после центрифугирования.
В одном из стандартных способов получения препаратов клеток печени аликвоту суспензии клеток печени смешивают с изотоническим Перколлом (Sigma, МО) до конечной концентрации 22,5% Перколла. После центрифугирования при 100 × g в течение 5 минут при 4°С в центрифуге Sorvall RC3B извлекают осадок. Следует отметить, что в описаниях общепринятых способов супернатант отбрасывают вследствие общепринятой уверенности в том, что этот супернатант содержит клетки более низкой жизнеспособности и что он содержит обычно больше клеточного дебриса. Для сравнительных целей супернатант извлекают, разбавляют в 5 раз и центрифугируют при 300 × g в течение 5 минут при 4°С, и полученный осадок извлекают. Другим основным стандартным способом для получения препаратов клеток печени является выделение суспензии клеток печени ферментативным расщеплением этой печени и затем откручиванием этих клеток низкоскоростным центрифугированием, обычно при приблизительно 50 g. Осажденные клетки сохраняют, а клетки в супернатанте выбрасывают.
Исключения Трипанового синего выявляют, что осадок Перколла 100 × g обогащен жизнеспособными клетками (диапазон 70-90%) в сравнении с супернатантом Перколла (диапазон 40-60%). В отличие от этого для OptiPrep , градиента данного изобретения, самая верхняя полоса клеток обогащена жизнеспособными клетками (80-90%) в сравнении с осажденным материалом (обычно менее чем 20%). Анализы размеров с использованием счетчика Коултера выявили обогащение в отношении более крупных клеток (с диаметром 18-22 мкм) в осадке Перколла, в сравнении с супернатантом Перколла, который содержит большую популяцию клеток с диапазоном диаметров 9-13 мкм, чем осадок. Самая верхняя полоса из градиента OptiPrep , градиента данного изобретения, самая верхняя полоса клеток обогащена жизнеспособными клетками (80-90%) в сравнении с осажденным материалом (обычно менее чем 20%). Анализы размеров с использованием счетчика Коултера выявили обогащение в отношении более крупных клеток (с диаметром 18-22 мкм) в осадке Перколла, в сравнении с супернатантом Перколла, который содержит большую популяцию клеток с диапазоном диаметров 9-13 мкм, чем осадок. Самая верхняя полоса из градиента OptiPrep содержит клетки как с диаметром 18-22 мкм, так и с диаметром 91-13 мкм. Определение распределения размеров для осадка OptiPrep содержит клетки как с диаметром 18-22 мкм, так и с диаметром 91-13 мкм. Определение распределения размеров для осадка OptiPrep является проблематичным вследствие большого количества дебриса. Анализ методом активированного флуоресценцией сортинга клеток (FACS) после ЕР-САМ-иммуноокрашивания этих клеток показывает, что седиментация через Перколл приводит к истощению ЕР-САМ-положительных клеток; эти положительные клетки остаются позади в супернатанте Перколла. Самая верхняя полоса градиента OptiPrep является проблематичным вследствие большого количества дебриса. Анализ методом активированного флуоресценцией сортинга клеток (FACS) после ЕР-САМ-иммуноокрашивания этих клеток показывает, что седиментация через Перколл приводит к истощению ЕР-САМ-положительных клеток; эти положительные клетки остаются позади в супернатанте Перколла. Самая верхняя полоса градиента OptiPrep содержит популяцию ЕР-САМ-положительных клеток, сходную с таковой из супернатанта Перколла. Анализы образования колоний фактически не обнаруживают образования колоний для клеток, обнаруженных в осадке Перколла, тогда как супернатант Перколла имеет сравнимый уровень колониеобразующей способности с самой верхней полосой градиента OptiPrep содержит популяцию ЕР-САМ-положительных клеток, сходную с таковой из супернатанта Перколла. Анализы образования колоний фактически не обнаруживают образования колоний для клеток, обнаруженных в осадке Перколла, тогда как супернатант Перколла имеет сравнимый уровень колониеобразующей способности с самой верхней полосой градиента OptiPrep . Эта способность к образованию колоний коррелирует с ЕР-САМ-положительным окрашиванием, так как обогащение в отношении ЕР-САМ-положительных клеток также увеличивает способность к образованию колоний этой популяции клеток. . Эта способность к образованию колоний коррелирует с ЕР-САМ-положительным окрашиванием, так как обогащение в отношении ЕР-САМ-положительных клеток также увеличивает способность к образованию колоний этой популяции клеток.
Как показано на фиг.1, профиль распределения размеров, определенный при помощи счетчика Коултера, для нового способа фракционирования с использованием OptiPrep выявил 2 пика клеток: клетки, которые авторы назвали относительно малыми (обычно в диапазоне диаметров 9-13 мкм), и большие клетки (обычно в диапазоне диаметров 18-22 мкм). выявил 2 пика клеток: клетки, которые авторы назвали относительно малыми (обычно в диапазоне диаметров 9-13 мкм), и большие клетки (обычно в диапазоне диаметров 18-22 мкм).
Популяция малых клеток содержит стволовые клетки/клетки-предшественники, так как эти клетки имеют размер приблизительно 10 мкм. Относительная численность этих двух популяций варьирует в зависимости от донорской печени, как и средний размер в микронах популяции пика.
Фиг.2 показывает, что согласно стандартному способу с Перколлом относительная численность более крупных клеток (18-22 мкм в диаметре) является более высокой в осадке Перколла (100 × g), чем в соответствующем супернатанте (300 × g).
Фиг.3 показывает результаты FACS-анализов после иммуноокрашивания антителом, специфичным к ЕР-САМ человека, показывающие, что осадок Перколла (100 х g) содержит в 5 раз меньше ЕР-САМ-положительно окрашивающихся клеток (левая панель, 0,12% популяции (+) в отношении ЕР-САМ), чем исходный материал (правая панель, 0,76% популяции (+) в отношении ЕР-САМ).
В противоположность этому, как показано на фиг.4, фракционирование с OptiPrep , по-видимому, не влияет на общую численность ЕР-САМ-положительно окрашивающейся популяции (3,07% и 3,06% популяции, окрашивающейся положительно в отношении ЕР-САМ, во фракционированных и нефракционированных пробах, соответственно). , по-видимому, не влияет на общую численность ЕР-САМ-положительно окрашивающейся популяции (3,07% и 3,06% популяции, окрашивающейся положительно в отношении ЕР-САМ, во фракционированных и нефракционированных пробах, соответственно).
С использованием фракционированных с OptiPrep клеток (самой верхней полосы) в качестве исходного материала в экспериментах с использованием 2 разных донорских печеней авторы изобретения также показывают, что положительно окрашивающиеся на ЕР-САМ клетки остаются в супернатанте после стандартного способа с Перколлом. Как показано на фиг.5 и 6, популяция ЕР-САМ-положительных клеток сравнима для исходного материала фракционированных с OptiPrep клеток (самой верхней полосы) в качестве исходного материала в экспериментах с использованием 2 разных донорских печеней авторы изобретения также показывают, что положительно окрашивающиеся на ЕР-САМ клетки остаются в супернатанте после стандартного способа с Перколлом. Как показано на фиг.5 и 6, популяция ЕР-САМ-положительных клеток сравнима для исходного материала фракционированных с OptiPrep клеток и супернатанта Перколла, тогда как осадок Перколла имеет 2-5-кратное истощение в отношении этих положительных клеток. клеток и супернатанта Перколла, тогда как осадок Перколла имеет 2-5-кратное истощение в отношении этих положительных клеток.
В качестве биологического теста на присутствие стволовых клеток/клеток-предшественников в препаратах клеток после фракционирования в OptiPrep и центрифугирования в градиенте плотности Перколла 20000 живых клеток на лунку высевали на слои-фидеры STO, поддерживали в среде с определенным содержанием гормонов и оценивали в баллах на образование колоний после 2-недельного инкубирования. Для дополнительного подтверждения, что ЕР-САМ-иммунореактивность соответствует присутствию стволовых клеток/клеток-предшественников, авторы резонным образом полагали, что при увеличении популяции ЕР-САМ-клеток должно увеличиваться количество образующих колонии клеток в этой популяции. Для этой цели авторы изобретения проводили обогащение иммуноселекцией на эти клетки и включали их в анализ. Как показано на фиг.7 и 8, авторы получали обогащение в 40 раз (0,59% исходной популяции являются ЕР-САМ-положительными, но после иммуноселекции 24,7% этой популяции являются положительными в отношении этого маркера). и центрифугирования в градиенте плотности Перколла 20000 живых клеток на лунку высевали на слои-фидеры STO, поддерживали в среде с определенным содержанием гормонов и оценивали в баллах на образование колоний после 2-недельного инкубирования. Для дополнительного подтверждения, что ЕР-САМ-иммунореактивность соответствует присутствию стволовых клеток/клеток-предшественников, авторы резонным образом полагали, что при увеличении популяции ЕР-САМ-клеток должно увеличиваться количество образующих колонии клеток в этой популяции. Для этой цели авторы изобретения проводили обогащение иммуноселекцией на эти клетки и включали их в анализ. Как показано на фиг.7 и 8, авторы получали обогащение в 40 раз (0,59% исходной популяции являются ЕР-САМ-положительными, но после иммуноселекции 24,7% этой популяции являются положительными в отношении этого маркера).
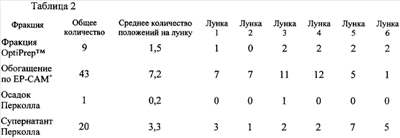
Таблица 2 показывает, что авторы действительно обогащают в отношении образования колоний при обогащении в отношении ЕР-САМ-положительных клеток. Кроме того, фракционированные с OptiPrep клетки и супернатант Перколла содержат колониеобразующие клетки, тогда как осадок Перколла не содержит таких клеток. клетки и супернатант Перколла содержат колониеобразующие клетки, тогда как осадок Перколла не содержит таких клеток.
Для гарантии того, что эти колонии возникают из единственной клетки, проводили лимитирующие разведения обогащенных по ЕР-САМ-положительным клетках, и лунки, содержащие в среднем 1 клетку, иммуноокрашивали антителом к альбумину человека, указывающим на паренхимные клетки, и СК19, которое взаимодействует с билиарными клетками. Как показано на фиг.9 и 10, присутствие обоих этих типов клеток в единой колонии подтверждает факт бипотентности клетки, дающей начало этой колонии. Такая бипотентность является функциональным определением стволовой клетки/клетки-предшественника.
Эти данные ясно показывают, что новый способ фракционирования с использованием OptiPrep данного изобретения отделяет живые клетки от мертвых клеток при сохранении жизнеспособных печеночных стволовых клеток/клеток-предшественников во фракции живых клеток. В противоположность этому стандартный способ в данной области, центрифугирование через градиент плотности Перколла, исключает эти клетки из осадка. Хотя имеются модификации в условиях, при которых центрифугируют градиенты плотности Перколла, все из этих модификаций включают в себя кратковременные центрифугирования (минуты) и низкую силу g (50, 70, 88 x g). Целью этого общепринятого способа, по-видимому, является обогащение жизнеспособными зрелыми гепатоцитами большего размера. Поскольку для последующих экспериментов используют осадок Перколла (супернатант отбрасывают), в этой области постоянно использовали препараты клеток, лишенные таких пролиферативных стволовых клеток/клеток-предшественников. Новый способ авторов данного изобретения наверняка изменит типы проводимых экспериментов, в которых признается решающим иметь трансплантируемые клетки с наивысшей пролиферативной способностью, чтобы иметь наибольшую вероятность восстановления функции печени. данного изобретения отделяет живые клетки от мертвых клеток при сохранении жизнеспособных печеночных стволовых клеток/клеток-предшественников во фракции живых клеток. В противоположность этому стандартный способ в данной области, центрифугирование через градиент плотности Перколла, исключает эти клетки из осадка. Хотя имеются модификации в условиях, при которых центрифугируют градиенты плотности Перколла, все из этих модификаций включают в себя кратковременные центрифугирования (минуты) и низкую силу g (50, 70, 88 x g). Целью этого общепринятого способа, по-видимому, является обогащение жизнеспособными зрелыми гепатоцитами большего размера. Поскольку для последующих экспериментов используют осадок Перколла (супернатант отбрасывают), в этой области постоянно использовали препараты клеток, лишенные таких пролиферативных стволовых клеток/клеток-предшественников. Новый способ авторов данного изобретения наверняка изменит типы проводимых экспериментов, в которых признается решающим иметь трансплантируемые клетки с наивысшей пролиферативной способностью, чтобы иметь наибольшую вероятность восстановления функции печени.
Иммуноселекция является лишь одним средством обогащения популяции печеночных стволовых клеток/клеток-предшественников данного изобретения. В частности, моноклональные антитела применимы для идентификации маркеров (поверхностных мембранных белков, например рецепторов), ассоциированных с конкретными линиями дифференцировки и/или стадиями дифференцировки. Процедуры для отделения рассматриваемых печеночных стволовых клеток/клеток-предшественников могут включать в себя магнитное разделение, использующее покрытые антителом магнитные гранулы, аффинную хроматографию и “пэннинг” с антителом, прикрепленным к твердому матриксу, например к планшету, или другие удобные способы. Способы, обеспечивающие точное разделение, включают в себя активируемый флуоресценцией сортинг клеток, который может иметь варьирующие степени сложности, например множество цветовых каналов, каналы детектирования рассеяния света под малым и тупым углом, каналы импеданса и т.д.
Можно также истощить нежелательные клеточные популяции из жизнеспособных клеток печени человека данного изобретения. Кроме гепатоцитов и их непосредственных предшественников печень содержит ряд дополнительных типов клеток, в том числе клетки желчных протоков, эндотелиальные клетки, тканевые макрофаги (клетки Купфера), звездчатые клетки и лимфоциты. Суспензии клеток, полученные из перфузированных печеней, также, вероятно, содержат некоторые остаточные клетки крови из кровообращения. В препаратах жизнеспособных клеток печени человека данного изобретения большинство клеток экспрессируют внутриклеточный альбумин и, следовательно, являются гепатоцитами или стволовыми клетками/клетками-предшественниками, которые образуют гепатоциты. Среди остальных клеток в этих препаратах, которые не экспрессируют внутриклеточный альбумин, большинство окрашиваются на поверхностный маркер CD45, общий антиген лейкоцитов, антиген, о котором известно, что он присутствует на большинстве или на всех клетках лимфоцитарной, моноцитарной/макрофагальной и гранулоцитарной линии дифференцировки, и на эритроидных предшественниках. Важные наборы клеток, являющихся резидентными в печени взрослых, которые, как можно было бы ожидать, экспрессируют CD45, включают в себя Т-лимфоциты, клетки Купфера (которые составляют приблизительно 80% тканевых макрофагов тела) и, возможно, гранулоциты.
Истощение CD45-положительных клеток из жизнеспособных клеток печени человека данного изобретения может быть достигнуто способами иммуноистощения, известными специалистам в данной области. Например, моноклональное антитело, специфичное к CD45, может быть связано с магнитными микросферами. Затем эти микросферы контактируют с жизнеспособными клетками печени человека. CD45-положительные клетки связываются с микросферами и могут быть удалены приложением магнитного поля. Одна система, подходящая для истощения CD45-положительных клеток, является доступной коммерчески от Miltenyi Biotec (MiltenyiBiotec GmbH, Friedrich-Ebert-Ska e 68, D-51429 Bergisch Gladbach, Germany). В системе Miltenyi CD45-микрогранулы используют вместе с магнитной колонкой (в таком устройстве, как AutoMACS или CliniMACS) для связывания и удаления CD45-положительных клеток. С использованием этой или эквивалентных систем, по меньшей мере, приблизительно 90-95% CD45-положительных клеток могут быть удалены за один раунд истощения. Истощенная по СП45-клеткам популяция сохраняет также, по существу, все клетки из препарата печени, которые способны прикрепляться и расти в культуре в условиях, благоприятствующих эпителиальным клеткам, в том числе гепатоцитам. Многие из этих клеток могут прикрепляться к покрытым коллагеном чашкам в бессывороточной среде, а некоторые проявляют морфологию гепатоцитов. В противоположность этому, полученная магнитным сортингом CD45-популяция, удаленная из препаратов жизнеспособных клеток печени данного изобретения с использованием иммуноистощения, содержит мало клеток, которые прикрепляются и проявляют морфологию паренхимных клеток печени.
Другие моноклональные антитела могут быть легко выбраны специалистами в данной области для специфического истощения конкретных нежелательных популяций клеток. Например, антитело к маркеру клеточной поверхности CD3 может быть использовано для удаления Т-лимфоцитов. Сходным образом, антитело к маркеру клеточной поверхности CD 14 может быть использовано для удаления клеток макрофагальной/моноцитарной линии дифференцировки, таких как клетки Купфера.
Удобным образом могут быть обеспечены антитела в конъюгированной форме для облегчения разделения клеток. Материалы для конъюгации включают в себя, но не ограничиваются ими: магнитные гранулы, которые делают возможным прямое отделение; биотин, который делает возможным опосредованное отделение посредством связывания с авидином или стрептавидином, присоединенным к носителю; флуорохромы, которые могут быть использованы с активируемым флуоресценцией сортером клеток. Может быть использован любой способ, который не является чрезмерно вредным для жизнеспособности клеток.
Клетки данного изобретения могут сохраняться криоконсервированием с использованием любого из нескольких способов криоконсервирования. Обычно изолированные клетки (как описано выше) разводят до желаемой концентрации в водной смеси Hypothermosol (Biolife Solutions, NY) и подвергают контролируемому замораживанию до желаемой температуры хранения. Замороженные клетки данного изобретения могут храниться в жидком азоте. (Biolife Solutions, NY) и подвергают контролируемому замораживанию до желаемой температуры хранения. Замороженные клетки данного изобретения могут храниться в жидком азоте.
Функциональность клеток данного изобретения
После выделения и криоконсервирования популяций клеток печени данного изобретения, включающих в себя печеночные стволовые клетки/клетки-предшественники, их характеризуют при помощи проточной цитометрии с использованием клеткоспецифических моноклональных или поликлональных антител и флуорохром-конъюгированных вторичных антител для количественного определения присутствующих типов клеток. Кроме того, функциональность этих криоконсервированных клеток оценивают по ряду in vitro и in vivo параметров.
Например, печеночные стволовые клетки/клетки-предшественники данного изобретения могут взаимодействовать на льду со 100 мкл мышиных моноклональных IgG-полиморфных антител к ЕР-САМ-антигенам человека, конъюгированным с флуоресцеинизотиоцианатом (FITC) (Serotec Inc, Великобритания). Контрольные клетки обрабатывают только мышиными IgG-FITC. Пробы анализируют с использованием проточного цитометра EPICS С (Coulter Electronics, Hialeah, Fla,), настроенного на длину волны 488 нм с коэффициентом усиления флуоресценции, установленным для исключения 98% контрольных клеток. Окна устанавливают вокруг различных популяций клеток с использованием двухпараметрической гистограммы “прямое рассеивание света (FLS) против бокового рассеивания (SS)” и определяют процент положительных флуоресцентных событий.
In vitro параметры включают в себя: метаболизм 7-этоксикумарина, который измеряет как зависимое от микросомного цитохрома Р-450 окисление фазы I, так и сопряженные реакции конъюгирования фазы II; образование мочевины для оценки способности клеток превращать аммиак в мочевину (важная функция, утрачиваемая при печеночной недостаточности); и пролиферативный потенциал.
In vivo авторы изобретения оценивают способность этих клеток: выживать на протяжении времени; устанавливать и поддерживать фенотип зрелых гепатоцитов и приживляться в паренхиме печени.
Следующие исследования используют мышей NOD-SCID, которые имеют тяжелое комбинированное иммунодефицитное состояние, предотвращающее отторжение трансплантированных клеток человека у этих животных. В одном исследовании клетки оттаивают и инкубируют in vitro с микроносителями, к которым они прикрепляются. Затем эти микроносители инъецируют в перитонеальную полость мышей. Спустя одну неделю конгломераты микроноситель-клетка собирают из перитонеальной полости, делают срезы и окрашивают для световой микроскопии. Выполняют также электронную микроскопию.
На фиг.11 микрофотографии гепатоцитов человека на гранулах микроносителя в мышах NOD-SCID можно ясно видеть гепатоциты, прикрепленные к микроносителям. Обратите внимание на их округлые ядра и большое количество прозрачной цитоплазмы. Правая стрелка указывает двухядерную клетку. Клетки в дальней правой части являются стромальными клетками хозяина, вероятно, являющимися фибробластями, из перитонеальной выстилки мыши-реципиента.
Фиг.12 показывает микрофотографию, сделанную при меньшей разрешающей способности для визуализации большого островка гепатоцитов, которые стали васкуляризованными хозяином, о чем свидетельствуют эритроциты. Особенно примечательной является видимая организация этих клеток в тяжи или ряды гепатоцитов – структурная организация, которую можно легко наблюдать на поперечных срезах ткани печени.
Доказательство того, что печеночные стволовые клетки/клетки-предшественники данного изобретения действительно могут созревать в гепатоциты и проявляют зрелый фенотип, приведено на фиг.13, демонстрирующей положительное окрашивание на гликоген в их цитоплазме. Опять обратите внимание на видимую организацию этих клеток в тяжи.
На электронно-микроскопическом уровне можно различить на фиг.14 три гепатоцита, прикрепленных к микроносителю. Черный прямоугольник нарисован вокруг поверхности раздела между двумя соседними клетками. Увеличенный фотоснимок этой зоны показывает структуры, микроворсинки, указывающие на желчные канальца, другой маркер зрелых гепатоцитов.
Две микрофотографии, приведенные на фиг.15 и 16, демонстрируют приживление криоконсервированных клеток печени человека данного изобретения в печени мышей NOD-SCID. В этом исследовании 1 миллион оттаявших клеток инъецируют в селезенки мыши. В различные моменты времени после трансплантации животных умерщвляют, и присутствие клеток человека определяют гибридизацией in situ с использованием ДНК-зондов к центромерам человека, а также ПЦР-анализа. Спустя два часа после трансплантации (фиг.15) клетки человека ясно видны по гибридизации in situ в воротных венах и печеночных синусоидных капиллярах. Однако эти клетки еще не перешли из васкулярного пространства в печеночную паренхиму.
Спустя 40 дней после трансплантации (фиг.16) клетки человека не только остаются в печени, но и приживляются в клеточную пластинку печени, становясь полностью интегрированными в паренхиму печени.
Трансплантация клеток печени
Популяцией-мишенью для лечения клетками и с использованием способа данного изобретения являются амбулаторные пациенты с циррозом и конечной стадией заболевания печени (ESLD), вызываемого различными факторами. Пациенты имеют предполагаемую продолжительность жизни без трансплантата печени большую, чем шесть месяцев, но меньшую, чем два года. Таким образом, большая часть таких пациентов рассматривалась для помещения в список ожидания ортотопической трансплантации печени (т.е. трансплантации интактного донорского органа). Эти пациенты испытывали одно или несколько осложнений заболевания, такие как абдоминальная жидкость (асциты), кровотечение, спутанное сознание (гепатическая энцефалопатия), инфекции и другие проблемы. Предполагается, что все эти рассматриваемые пациенты будут получать иммуносупрессорную терапию для предотвращения отторжения трансплантированных клеток печени, как это имело бы место при трансплантации интактных печеней. Задачей предполагаемой терапии является задержка или устранение необходимости трансплантации целой печени, уменьшение госпитализаций в связи с осложнениями заболевания печени и улучшение качества жизни пациента.
Оценки исходного уровня и при последующем врачебном наблюдении включают в себя рутинные лабораторные и клинические оценки функции печени, а также специфические количественные биохимические оценки способности поврежденной печени удалять токсины, метаболизировать лекарственные средства и синтезировать белки. Поскольку ожидается, что трансплантированные клетки печени заселяют как печень, так и селезенку, проводят периодически специфические в отношении клеток печени сканирования селезенки для мониторинга приживления и пролиферации трансплантированных клеток печени. Трансплантированные клетки выделяют растворимые антигены, которые являются специфическими для донорских клеток. Эти растворимые антигены, которые могут быть измерены в крови, подвергают мониторингу в качестве дополнительного доказательства жизнеспособности и функции трансплантированных клеток.
За две недели перед поступлением в больницу для трансплантации клеток пациенты принимаются исследователем в клинике. Исследователь получает информированное согласие и начинает оценки исходного уровня, в том числе АВО-типирование крови. Тип крови пациента должен быть совместимым с клетками крови донора при трансплантации цельной печени или клеток печени. За два дня перед поступлением в больницу начинают иммуносупрессорную терапию. Криоконсервированные клетки доставляют в больницу, где они остаются в замороженном виде до момента непосредственно перед трансплантацией.
Вечером перед трансплантацией пациент поступает в больницу. На следующее утро пациента переводят в отделение инвазивной рентгенологии, где он/она получают воздействующее на сознание седативное средство. В бедренную артерию пациента (в паховой области) помещают катетер и продвигают его в селезеночную артерию. Донорские клетки печени оттаивают, разбавляют и доставляют предпочтительно через шприц в катетер в селезеночной артерии. Время введения варьируют в зависимости от дозы от пяти до приблизительно 30 минут. Катетер удаляют и пациента переводят обратно в его/ее палату для последующего наблюдения. Пациента выписывают из больницы через восемь часов после процедуры.
Трансплантация гепатоцитов и печеночных стволовых клеток/клеток-предшественников данного изобретения может быть использована для выполнения замены функции печени инъекцией некоторого количества жизнеспособных клеток печени, включающих в себя гепатоциты и/или печеночные стволовые клетки/клетки-предшественники (содержащиеся в среде для трансплантации, такой как физиологический раствор), в подходящий анатомический сайт, где этим клеткам печени, в том числе гепатоцитам и/или печеночным стволовым клеткам/клеткам-предшественникам, дают имплантироваться в сайте-мишени, таком как паренхима печени и/или селезенки, и проявлять функции дифференцированной печени, в том числе функции гепатоцитов. В зависимости от количества клеток печени, в том числе гепатоцитов и/или печеночных стволовых клеток/клеток-предшественников, трансплантированных таким образом, различные степени недостаточности функции печени могут быть скорректированы заменой функции печени этими клеточными трансплантатами. Однако наиболее выгодной клеточная трансплантация гепатоцитов и/или печеночных стволовых клеток/клеток-предшественников является в лечении заболевания печени, обусловленного генетическими дефектами, приводящими к отсутствию или уменьшенной функции отдельного фермента или другого белкового продукта. Такие заболевания включают в себя, например, гиперлипидемии и недостаточность альфа-антитрипсина. Другие заболевания печени, которые могут лечиться с помощью данного изобретения, включают в себя гепатит, цирроз, врожденные ошибки метаболизма, острую печеночную недостаточность, острые инфекции печени, острую химическую токсичность, хроническую недостаточность печени, холангиоцит, билиарный цирроз, синдром Alagille, недостаточность альфа 1-антитрипсина, аутоиммунный гепатит, билиарную атрезию, рак печени, кистозное заболевание печени, жировую дистрофию печени, галактоземию, желчные конкременты, синдром Жильбера, гемохроматоз, гепатит А, гепатит В, гепатит С, порфирию, первичный склерозирующий холангит, синдром Рейе, саркоидоз, тирозинемию, гликогеновую болезнь типа 1 и болезнь Вильсона.
Для выполнения процедуры трансплантации выбирают место инъекции для трансплантации клеток печени в паренхиму печени. В одном способе выполнения этого местом инъекции является селезенка человека. После вычисления координат местоположения селезенки инжектор помещают для инъекции трансплантационной среды, содержащей клетки печени, в том числе гепатоциты и/или печеночные стволовые клетки/клетки-предшественники, в селезенку. Затем перенесенные клетки мигрируют через селезеночную вену в паренхиму печени [См. Gupta et al., Seminars in Liver Disease 12, 321 (1992)]. В другом способе получают изображения ответвлений воротной вены, например, сканированием живота при помощи компьютеризованной аксиальной томографии (CAT) после инъекции рентгеноконтрастной среды. Координаты местоположения ответвлений воротной вены, питающих отдельные доли печени, могут быть затем использованы для инъекции трансплантационной среды в ответвление воротной вены и, следовательно, инфузии конкретной доли печени клетками печени. Такая селективная инфузия делает возможным непрерывный воротный кровоток через другую печень.
Альтернативно, клетки печени, в том числе гепатоциты и/или печеночные стволовые клетки/клетки-предшественники данного изобретения, могут быть инъецированы или инфузированы непосредственно в пульпу печени через селезеночную вену или воротную вену, или под капсулу печени.
Подходящие способы введения клеток данного изобретения субъектам, в частности субъектам-людям, описаны здесь подробно, в том числе инъекция или имплантация клеток в сайты-мишени в субъектов, или клетки данного изобретения могут быть введены в устройство доставки, которое облегчает введение инъекцией или имплантацией этих клеток в субъекты. Такие устройства доставки включают в себя трубки, например, катетеры, для инъекции клеток и жидкостей в тело субъекта-реципиента. В предпочтительном варианте осуществления эти трубки имеют дополнительно иглу, например шприц, через который клетки данного изобретения могут вводиться в субъекта в желаемом местоположении. Клетки печени, в том числе гепатоциты и/или печеночные стволовые клетки/клетки-предшественники данного изобретения, могут быть введены в такое устройство доставки, например шприц, в различных формах. Например, эти клетки могут быть суспендированы в растворе или заключены в матрикс-носитель, когда они содержатся в таком устройстве доставки. В данном контексте термин “раствор” включает в себя фармацевтически приемлемый носитель или разбавитель, в котором клетки данного изобретения остаются жизнеспособными. Фармацевтически приемлемые носители и разбавители включают в себя физиологический раствор, водные буферные растворы, растворители и/или диспергирующие среды. Применение таких носителей и разбавителей хорошо известно в данной области. Этот раствор является предпочтительно стерильным и жидким до такой степени, которая обеспечивает легкость подачи посредством шприца. Предпочтительно, этот раствор является стабильным в условиях приготовления и хранения и предохраненным против загрязняющего действия микроорганизмов, таких как бактерии и грибы, на протяжении его использования, например, путем использования парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимерозала и т.п.Растворы данного изобретения могут быть приготовлены включением жизнеспособных, функциональных клеток печени, описанных здесь, в фармацевтически приемлемый носитель или разбавитель и, если требуется, другие перечисленные выше ингредиенты с последующей стерилизацией фильтрованием.
Матриксы-носители, в которые могут быть включены или заключены жизнеспособные, функциональные клетки, включают в себя матриксы, которые являются реципиент-совместимыми и которые разрушаются до продуктов, которые не являются вредными для реципиента. Природные и/или синтетические биодеградируемые матриксы являются примерами таких матриксов. Природные биодеградируемые матриксы включают в себя сгустки плазмы, например, полученные из млекопитающего, и коллагеновые матриксы. Синтетические биодеградируемые матриксы включают в себя синтетические полимеры, такие как полиангидриды, полиортоэфиры и полимолочная кислота. Другие примеры синтетических полимеров и способы включения или заключения клеток в эти матриксы также известны в данной области. См., например, патент США №4298002 и патент США №5308701. Эти матриксы обеспечивает опору и защиту для клеток печени in vivo и, следовательно, являются предпочтительной формой, в которой клетки печени вводят в субъектов-реципиентов.
Генотерапия данного изобретения
Результаты клинических испытаний генотерапии были обычно неутешительными как для врачей, так и для пациентов, часто вследствие невозможности получения стойкой экспрессии гена-мишени. Популяции клеток печени, такие как популяции данного изобретения, включающие в себя стволовые клетки/клетки-предшественники, вследствие их потенциала интенсивного размножения, представляют перспективную популяцию клеток, в которой можно получать и поддерживать эффективную экспрессию генов. Генотерапия данного изобретения в одном варианте осуществления будет достигаться встраиванием экзогенного гена в эти клетки и трансплантацией этих клеток в пациента. Рациональными нарушениями-мишенями являются заболевания, являющиеся результатом неспособности клеток печени пациента правильно производить важный белок, такой как отсутствующие рецепторы липопротеинов низкой плотности (LDL) при гиперхолестеринемии и факторы свертывания при гемофилии.
Главным препятствием в существующих попытках достижения стабильной интеграции чужеродных генов в эукариотические клетки-хозяева различных органов является неспособность большинства этих клеток пролиферировать in vitro. Это является особенно проблематичным для попыток встраивания чужеродных генов в клетки печени, так как зрелые гепатоциты не претерпевают полного клеточного деления in vitro или, в лучшем случае, подвергаются 1-2 делениям. Недавно были проведены исследования переноса генов с использованием гепатоцитов, выделенных из наследственно гиперлипидемических кроликов Watanabe, которые широко используются в качестве животной модели семейной гиперхолестеринемии человека. Подобно их человеческим аналогам клетки кроликов Watanabe содержат генетическую недостаточность в отношении рецептора липопротеинов низкой плотности (LDL), что приводит к высоким уровням холестерина в кровотоке и увеличенной частоте раннего заболевания коронарных артерий (Wilson et al., 1990, Proceedings National Academy of Sciences USA 87:8437). Гепатоциты кролика инфицировали рекомбинантными вирусами, несущими функциональный ген рецептора LDL, и было показано, что он вызывал временное ослабление гиперлипидемии в генетически дефектных кроликах после трансплантации. Авторы считают, что степень успеха этой формы терапии может быть дополнительно увеличена, если представляющий интерес ген может достигнуть более стабильной интеграции в популяцию клеток реципиента, которая способна к существенному клеточному делению. Поскольку печеночные стволовые клетки/клетки-предшественники данного изобретения пролиферируют in vitro, в частности, в течение более продолжительных периодов времени, в описанной здесь системе, в которой паренхимные клетки ко-культивируют с эмбриональными стромальными клетками, эти клетки могут быть идеальными кандидатами в качестве реципиентов для введения экзогенных генов в культуре.
Различные врожденные нарушения метаболизма обусловлены наследственной генетической недостаточностью клеток печени. Эти заболевания могут лечиться трансплантацией клеток печени данного изобретения, несущих функциональные копии правильных генов. Вкратце, эта процедура включает в себя выделение клеток печени, в том числе печеночных стволовых клеток/клеток-предшественников, данного изобретения из пациентов, пораженных конкретной недостаточностью, перенос функциональных генов в эти клетки для коррекции этого генетического дефекта общепринятыми технологиями переноса генов, подтверждение стабильной интеграции и экспрессии желаемых продуктов этих генов и трансплантацию этих клеток в печени того же самого или другого пациента для восстановления. Этот подход в особенности применим в ситуации, когда дефект единственного гена является ответственным за данное заболевание, и этот дефектный ген был идентифицирован и молекулярно клонирован; однако он не ограничивается только этими состояниями. В дополнение к генотерапии в аутологичных условиях печеночные стволовые клетки/клетки-предшественники данного изобретения, несущие функциональные гены, могут быть также трансплантированы в аллогенные HLA-совместимые индивидуумы. Примеры генов-мишеней и связанных с ними заболеваний печени, которые поддаются этой форме терапии, включают в себя, но не ограничиваются ими, ген рецептора LDL при семейной гиперхолестеринемии, гены фактора свертывания для факторов VIII и IX при гемофилии, ген альфа-1-антитрипсина при эмфиземе, ген фенилаланингидроксилазы при фенилкетонурии, ген орнитинтранскарбамилазы при гипераммониемии и гены белков комплемента при различных формах недостаточности комплемента.
Печень является центром продуцирования многих секреторных белков. Она анатомически связана с системой кровообращения таким образом, что возможным является эффективное высвобождение различных белков в кровоток. Таким образом, гены, кодирующие белки, которые имеют системные действия, могут быть встроены в клетки печени данного изобретения, в противоположность специфическим типам клеток, которые обычно продуцируют их, в частности, когда трудно интегрировать гены в эти клетки. Например, различные гены гормонов или гены специфических антител могут быть встроены в клетки печени данного изобретения для секреции их генных продуктов в кровоток.
Для применения на практике данного изобретения клетки печени данного изобретения, выделенные описанными выше процедурами, используют в качестве реципиентов в экспериментах по переносу генов. Эти клетки могут выращиваться в культуре до, во время или после введения экзогенного гена. Дифференцировка этих клеток может быть минимизирована добавлением цитокинов способом, сходным с применением фактора ингибирования лейкоза в культурах гемопоэтических стволовых клеток.
Для введения экзогенных генов в культивируемые клетки данного изобретения любой клонированный ген может быть перенесен с использованием общепринятых способов, в том числе, но не только, микроинъекции, трансфекции и трансдукции. Кроме того, если клетки печени экспрессируют рецепторы для асиалогликопротеина, плазмиды, содержащие представляющие интерес гены, могут быть конъюгированы с асиалогликопротеином и добавлены к клеткам для индукции поглощения и экспрессии (Wu et al., 1991, Journal of Biological Chemistry 266: 14338). Эта процедура является более мягкой на клетках-реципиентах.
Предпочтительный способ переноса генов использует рекомбинантные вирусы, такие как ретровирусы и аденовирусы. Например, при использовании аденовирусных экспрессионных векторов кодирующая последовательность может быть лигирована с регуляторным комплексом транскрипции/трансляции аденовируса, например, поздним промотором и состоящей из трех частей лидерной последовательностью. Затем этот химерный ген может быть встроен в геном аденовируса рекомбинацией in vitro или in vivo. Встраивание в несущественный район вирусного генома (например, район Е1 или Е3) будет приводить к рекомбинантному вирусу, который является жизнеспособным и способным экспрессировать генный продукт в инфицированных резервных клетках печени (например, см. Logan & Shenk, 1984, Proc. Natl. Acad. Sci. USA 81: 3655-3659). Альтернативно, может быть использован промотор 7,5К вируса осповакцины (например, см. Mackett et al., Proc. Natl. Acad. Sci. USA 79:7415-7419; Mackett et al., 1984, J. Virol. 49: 857-864; Panicali et al., Proc. Natl. Acad. Sci. USA 79:4927-4931). Особый интерес представляют векторы на основе бычьего папилломавируса, которые способны реплицироваться в виде внехромосомных элементов (Sarver, et al., 1981, Mol. Cell. Biol. 1:486). Вскоре после попадания этой ДНК в клетки эта плазмида реплицируется до приблизительно 100-200 копий на клетку. Транскрипция этой встроенной кДНК не требует интеграции этой плазмиды в хромосому хозяина, что приводит к высокому уровню экспрессии. Эти векторы могут быть использованы для стабильной экспрессии включением селектируемого маркера в эту плазмиду, такого как, например, ген пео. Альтернативно, ретровирусный геном может быть модифицирован для использования в качестве вектора, способного вводить и регулировать экспрессию любого представляющего интерес гена в печеночных стволовых клетках/клетках-предшественниках данного изобретения (Cone & Mulligan, 1984, Proc. Natl. Acad. Sci. USA 81:6349-6353). Экспрессия высокого уровня может быть также достигнута с использованием йндуцибельных промоторов, в том числе, но не только, промотора металлотионеина IIA и промоторов теплового шока.
Для долгосрочного, высокопроизводительного продуцирования рекомбинантных белков предпочтительной является стабильная экспрессия. Вместо того, чтобы использовать экспрессирующие векторы, которые содержат вирусные сайты инициации репликации, жизнеспособные, функциональные клетки печени, в том числе печеночные стволовые клетки/клетки-предшественники, данного изобретения могут быть трансформированы кДНК, контролируемой подходящими элементами регуляции экспрессии (например, промоторной, энхансерной последовательностями, терминатором транскрипции, сайтами полиаденилирования и т.д.) и селектируемым маркером. Селектируемый маркер в рекомбинантной плазмиде придает устойчивость к отбору и позволяет клеткам стабильно интегрировать эту плазмиду в их хромосомы и расти с образованием очагов, которые, в свою очередь, могут быть клонированы и размножены в клеточные линии. Например, после введения чужеродной ДНК сконструированные клетки печени могут быть оставлены расти в обогащенных средах и затем перенесены на селективные среды. Могут быть использованы ряд систем селекции, в том числе, но не только, ген тимидинкиназы вируса простого герпеса (Wigler, et al., 1977, Cell 11:223), ген гипоксантингуанинфосфорибозилтрансферазы (Szybalska & Szybalski, 1962, Proc. Natl. Acad. Sci. USA 48:2026) и ген аденинфосфорибозилтрансферазы (Lowy, et al., 1980, Cell 22:817). Устойчивость к антиметаболитам может быть также использована в качестве основы селекции на ген dhfr, который придает устойчивость к метотрексату (Wigler, et al., 1980, Proc. Natl. Acad. Sci. USA 77:3567; O’Hare, et al., 1981, Proc. Natl. Acad. Sci. USA 78:1527); ген gpt, который придает устойчивость к микофеноловой кислоте (Mulligan & Berg, 1981, Proc. Natl. Acad. Sci. USA 78:2072); ген пео, который придает устойчивость к аминогликозиду G-418 (Colberre-Garapin, et al., 1981, J. Mol. Biol. 150:1); и ген hygro, который придает устойчивость к гигромицину (Santene, et al., 1984, Gene 30: 147), Недавно были описаны дополнительные селектируемые гены, а именно, trpB, который позволяет клеткам использовать индол вместо триптофана; hisD, который позволяет клеткам использовать гистинол, вместо гистидина (Hartman & Mulligan, 1988, Proc. Natl. Acad. Sci. USA 85:8047) и ODC (орнитиндекарбоксилазы), который придает устойчивость к ингибитору орнитиндекарбоксилазы, 2-(дифторметил)-DL-орнитину, DFMO (McConlogue L., 1987, In: Current Communications in Molecular Biology, Cold Spring Harbor Labotatory ed.).
Клетки печени данного изобретения, которые интегрировали конкретный ген, как измерено по их экспрессии продукта этого гена такими способами, как Нозерн-блоттинг и ELISA, могут быть трансплантированы, как описано выше, в пациентов, из которых эти клетки были первоначально получены, или в HLA-совместимого индивидуума. Для HLA-совместимой аллогенной трансплантации резервные клетки печени могут необязательно требовать переноса гена перед трансплантацией. Например, резервные клетки печени, полученные из донора, который имеет функциональный ген, кодирующий фактор свертывания VIII, могут быть использованы непосредственно с использованием трансплантации в HLA-совместимого гемофильного пациента. Эти трансплантированные клетки будут предположительно размножаться и образовывать зрелые PC, выполняющие функции нормальной печени, в том числе продуцирование фактора свертывания VIII.
Кроме использования клеток печени данного изобретения для коррекции дефектов генов печени, эти клетки могут быть использованы для восполнения паренхимы печени в случае цирроза печени, как отмечалось выше, или они могут быть сконструированы против специфических инфекционных заболеваний печени. Например, неинфицированные печеночные стволовые клетки/клетки-предшественники могут быть получены из пациента с ранней стадией гепатита и использованы в качестве реципиентов для генов, кодирующих антисмысловую РНК, которая комплементарна критическим связанным с репликацией генетическим элементам вируса гепатита. Затем эти клетки могут быть трансплантированы в пациентов для борьбы с распространением вируса и восстановления нормальной функции печени.
Применение в геномике и исследованиях
Технология печеночных клеток данного изобретения имеет применение в качестве инструмента для идентификации новых лекарственных средств и в разработке и процессе испытания лекарственных средств. Печеночные стволовые клетки/клетки-предшественники можно заставить расти и дифференцироваться в зрелые клетки печени. Определение профилей экспрессии генов на различных стадиях линий дифференцировки печени обеспечивает геномную информацию для открытия лекарственных средств. Например, эта информация может быть использована для идентификации новых мишеней для программ обнаружения лекарственных средств или для идентификации белков, выполняющих биологические функции, которые могут иметь применение в терапии.
В качестве инструмента для процесса испытания и разработки лекарственных средств клетки печени и их потомство могли бы использоваться для оценки изменений в профилях экспрессии генов, вызываемых лекарственными средствами, рассматриваемыми для разработки. Изменения в профиле экспрессии генов, вызываемые потенциальными лекарственными средствами, могли бы сравниваться с изменениями, вызываемыми лекарственными средствами, о которых известно, что они действуют на печень. Это могло бы позволить фармацевтической компании проводить скрининг соединений на их действие на печень в более ранний период времени в процессе разработки, что позволит сберечь время и деньги. Полная линия дифференцировки клеток печени, от предшественников до зрелых клеток, также могла бы использоваться для испытания лекарственных средств на токсичность для печени и для исследования, каким образом данное лекарственное средство метаболизируется. В настоящее время фармацевтические компании испытывают трудность в получении постоянного запаса клеток печени для испытания токсичности. Способы данного изобретения удовлетворяют эту потребность.
Вспомогательное устройство для печени
Технология печеночных стволовых клеток/клеток-предшественников данного изобретения имеет применение в развитии вспомогательного устройства для печени (“LAD”). LAD предназначены для обеспечения лечения для пациентов с острой печеночной недостаточностью посредством обеспечения функции печени в течение короткого периода времени (7-30 дней), чтобы дать достаточное время для восстановления собственной печени пациента от недостаточности или для обеспечения мостика к трансплантату.
В попытках, предпринятых на клинически применимых LAD другими исследователями, использовали гепатоциты свиньи или слабо дифференцированные печеночные клетки из опухолей человека в биореакторах разнообразных типов. Эти устройства были многообещающими, но все использовали клетки с недостатками, которые клетки авторов данного изобретения должны преодолеть. Гепатоциты свиньи, хотя и легко получаемые, имели серьезные недостатки: например, иммунные реакции на секретируемые белки свиньи, ограниченное время существования и вирусы не человека. Клетки опухоли печени могут легко выращиваться, но сохраняют только часть функций клеток нормальной печени и вызывают опасения в отношении их безопасности. Функционирование клеток печени человека из донорских органов не были альтернативой вследствие недостатка донорских печеней. LAD с использованием клеток-предшественников печени человека данного изобретения будет преодолевать многие из проблем, которые встречались до настоящего времени. Белки, секретируемые этими клетками, будут иметь человеческое происхождение, так что иммунные реакции должны быть минимизированными. Клетки-предшественники могут интенсивно делиться в культуре, так что клетки из одной донорской печени смогут обеспечивать многочисленные LAD. Наиболее важным является то, что эти клетки должны проявлять широкий диапазон функций печени, необходимый для клинической применимости.
Пример LAD, подходящего для клеток данного изобретения, описан в международной публикации с регистрационным номером PCTUS00/15524.
Приготовление вакцин данного изобретения
Клетки печени данного изобретения могут быть также использованы для получения вакцин. Например, недостаточный по репликации вирус (например, лентивирус, см. Nadini et al. Science 272:263-267, 1996) может быть использован для инфицирования клеток печени человека, причем этот вирус был дополнительно модифицирован для того, чтобы нести гены, кодирующие один или несколько специфических белковых антигенов. Эти специфические белковые антигены выбирают в зависимости от типа желаемой иммунной реакции. В основном, клетки печени данного изобретения инфицируют рекомбинантным вирусом. Затем эти инфицированные клетки экспрессируют белковый антиген, против которого индуцируется иммунная реакция. Ожидается, что эта иммунная реакция (на основе антител или на основе клеток) направлена против инфекционного агента, такого как вирус гепатита С. Субъекты, подвергнутые действию этих инфицированных клеток, становятся затем защищенными против этого инфекционного агента. См. Blister et al., J.Gen.Virol. 83 (Pt. 2): 369-381,2002 в отношении описания применения рекомбинантного вируса лесов Семлики, кодирующего неструктурный белок вируса гепатита С, для индукции клеточной иммунной реакции.
Примеры
Краткое описание способа
Всю обработку печени выполняют в ламинарном боксе класса 100, расположенном в помещении класса 10000, в соответствии с асептическими способами и в согласии с процессами хорошего производства. Все компоненты, которые контактируют с печенью, покупали в стерильном виде или собирали и подвергали стерилизации газом или автоклавированием.
Первоначальная обработка
Печень получают погруженной в VIASPAN  применим в качестве гипотермического раствора для промывания и хранения органов). Печень перемещают в стерильное ведро и выдерживают погруженной в антибиотический промывной раствор (0,1 мг/мл гентамицина и 5 мг/мл цефазолина) в течение 5 минут.Печень переворачивают с верхней стороны на нижнюю во время этой процедуры для обеспечения того, чтобы обе стороны были погружены. применим в качестве гипотермического раствора для промывания и хранения органов). Печень перемещают в стерильное ведро и выдерживают погруженной в антибиотический промывной раствор (0,1 мг/мл гентамицина и 5 мг/мл цефазолина) в течение 5 минут.Печень переворачивают с верхней стороны на нижнюю во время этой процедуры для обеспечения того, чтобы обе стороны были погружены.
Печень вынимают и промывают два раза общим объемом 2 л стерильного нормального физиологического раствора над ведром. Затем печень переносят в другое стерильное ведро. Полую вену пережимают при помощи стерильных одноразовых пластиковых пуповинных зажимов, и воротную вену и/или печеночную артерию канюлируют предварительно стерилизованной канюлей, изготовленной из пластиковых переходных муфт/соединителей разных размеров. Берут небольшую биопсию (из переднего края доли) для гистологического исследования. Печень переносят в перфузионный резервуар и перфузируют теплым (<37°С) хелатирующим буфером в течение 15 минут при скорости, которая делает возможным максимальное раздувание печени (обычно 120-240 мл/мин). В конце перфузионного периода буфер сливают в сток через отверстие для стока, расположенное на дне перфузионного резервуара.
Перфузия и расщепление
Затем печень расщепляют (переваривают) перфузатом, содержащим LIBERASE CI (ферментным препаратом, содержащим коллагеназу и эластазу) в течение 30 минут при 28°С-37°С. В конце расщепления содержащий LIBERASE CI (ферментным препаратом, содержащим коллагеназу и эластазу) в течение 30 минут при 28°С-37°С. В конце расщепления содержащий LIBERASE буфер сливают, и печень перфузируют холодным, содержащим сыворотку буфером для сбора для остановки расщепления ферментом. После последней перфузии буфер сливают в контейнер для отходов, и резервуар пополняют новым, содержащим сыворотку, буфером для сбора. Капсулу печени разрезают при помощи стерильного хирургического скальпеля из нержавеющей стали и ткань массируют (в течение не более чем 20 минут) для облегчения диссоциации клеток. Когда все клетки из расщепленной ткани, по-видимому, являются диссоциированными в буфер, полученную суспензию клеток пропускают через предварительный фильтр и ряд 1000, 500, 250 и 150 мкм предварительно стерилизованных сит из нержавеющей стали и затем собирают в 4-литровый мешок для крови, охлажденный на льду. Из этой грубой клеточной суспензии отбирают пробы для испытания в ходе процесса жизнеспособности, концентрации, общего количества клеток, выхода на грамм ткани и стерильности. буфер сливают, и печень перфузируют холодным, содержащим сыворотку буфером для сбора для остановки расщепления ферментом. После последней перфузии буфер сливают в контейнер для отходов, и резервуар пополняют новым, содержащим сыворотку, буфером для сбора. Капсулу печени разрезают при помощи стерильного хирургического скальпеля из нержавеющей стали и ткань массируют (в течение не более чем 20 минут) для облегчения диссоциации клеток. Когда все клетки из расщепленной ткани, по-видимому, являются диссоциированными в буфер, полученную суспензию клеток пропускают через предварительный фильтр и ряд 1000, 500, 250 и 150 мкм предварительно стерилизованных сит из нержавеющей стали и затем собирают в 4-литровый мешок для крови, охлажденный на льду. Из этой грубой клеточной суспензии отбирают пробы для испытания в ходе процесса жизнеспособности, концентрации, общего количества клеток, выхода на грамм ткани и стерильности.
Последующая обработка
Грубую клеточную суспензию асептически переносят в подходящее количество мешков для крови на 600 мл и концентрируют центрифугированием при 800 × g. Концентрированную клеточную суспензию обогащают живыми клетками путем смешивания равных объемов этого концентрата клеток и раствора OPTIPREP (25% иодиксанола) с использованием промывателя для клеток СОВЕ 2991. После центрифугирования при 2000 об/мин в течение 15 минут нужная клеточная популяция перемещается вверх и образует полосу. Эти полосы асептически собирают и распределяют в подходящее количество мешков для крови на 600 мл в объеме, предпочтительно не превышающем 200 мл на мешок. Затем объем в мешке разбавляют до 500 мл средой RPMI 1640. Мешок центрифугируют при 800 × g в течение 10 минут и супернатант удаляют.Полученный осадок взвешивают, добавляют достаточное количество среды RPMI 1640 для получения конечного объема 500 мл и центрифугируют при 800 × g в течение 10 минут. После удаления супернатанта осадок после промывания взвешивают, берут пробы для определения числа клеток и жизнеспособности и ресуспендируют в HTS с получением концентрации 6х107 клеток/мл. Если проводят многократные прогоны с использованием СОВЕ из-за большого количества клеток, полосы, собранные из каждого прогона, объединяют. (25% иодиксанола) с использованием промывателя для клеток СОВЕ 2991. После центрифугирования при 2000 об/мин в течение 15 минут нужная клеточная популяция перемещается вверх и образует полосу. Эти полосы асептически собирают и распределяют в подходящее количество мешков для крови на 600 мл в объеме, предпочтительно не превышающем 200 мл на мешок. Затем объем в мешке разбавляют до 500 мл средой RPMI 1640. Мешок центрифугируют при 800 × g в течение 10 минут и супернатант удаляют.Полученный осадок взвешивают, добавляют достаточное количество среды RPMI 1640 для получения конечного объема 500 мл и центрифугируют при 800 × g в течение 10 минут. После удаления супернатанта осадок после промывания взвешивают, берут пробы для определения числа клеток и жизнеспособности и ресуспендируют в HTS с получением концентрации 6х107 клеток/мл. Если проводят многократные прогоны с использованием СОВЕ из-за большого количества клеток, полосы, собранные из каждого прогона, объединяют.
Заполнение и хранение
Затем эти клетки вручную помещают (при объеме наполнения 1,5 мл) в помеченные фторопластовые криомешки на 33 мл и затем смешивают с равным объемом криобуфера (HTS:ДМСО: сыворотка человека 60:20:20) с получением конечной концентрации 3х107 клеток/мл, 10% ДМСО и 10% сыворотки человека. Эти мешки замораживают с использованием программируемого морозильника Cryomed, и замороженные клетки хранят в морозильниках в парах жидкого азота. Спустя, по меньшей мере, 24 часа после замораживания пробы из морозильника объединяют и транспортируют в предназначенные испытательные учреждения для промышленного испытания.
Технологическая схема процесса
Технологическая схема, описывающая процесс изготовления, представлена ниже.
Введение в клинических условиях
Клинические запасы будут транспортироваться в клинические учреждения в сертифицированных контейнерах для перевозки в паровой фазе жидкого азота, которые поддерживают температуру при -120°С или при более низкой температуре. Криомешки, содержащие клеточную суспензию, будут оставаться в контейнере для перевозки, пока пациент не будет готов. Перед использованием продукт вынимают из контейнера для перевозки, быстро оттаивают при 37°С и помещают на лед. Затем удаляют верхнюю упаковку и, с использованием стандартных асептических больничных процедур, клеточную суспензию разбавляют в десять раз холодным Plasma-Lyte®; А в криомешке перед введением пациенту. Эта процедура устраняет необходимость промывания клеток перед инфузией и минимизирует риск нарушения стерильности. В одном воплощении данного изобретения, которое будет вводиться пациенту, содержится 3х106 клеток/мл и дополнительно содержится ДМСО (1%), сыворотка АВ человека (1%), HypoThermosol®;
(4%-8%) и RPMI без фенолового красного (0%-4%) в PLASMA-Lyte®.
Выделение клеток печени свиньи
Следуют процедуре фильтрования и сбора клеточной суспензии, как описано выше, для получения пробы свиной печени.
Пробу испытывают на жизнеспособность, плотность и выход. После проведения всех расчетов берут 10 миллиардов клеток. Если плотность ниже, чем 25 миллионов клеток на мл, эти клетки концентрируют с использованием центрифуги Sorval RC3B, Sorval centritech или клеточного процессора СОВЕ 2991. Осадок ресуспендируют в 250 мл среды RPMI 1640 без фенолового красного. Клеточную суспензию переносят в мешок для крови на 600 мл и добавляют 25% иодиксанол (OptiPrep
Клеточный процессор СОВЕ 2991 собирают с использованием одного комплекта для обработки. Суспензию клеток подают самотеком с использованием красной трубки комплекта. Как только тороидальная камера заполнится, начинают центрифугирование при 2000 об/мин в течение 15 минут.В начале центрифугирования 100 мл среды RPMI 1640 наслаивают на верхнюю часть градиента с использованием перистальтического насоса со скоростью 20 мл/мин для действия в качестве буфера для смешивающейся полосы. Спустя 15 минут этот верхний буфер “декантируют” со скоростью 100 мл/мин в мешок для отходов, и верхнюю полосу клеток собирают в мешок для сбора. Осадок также собирают, если желательно, для последующего анализа. Верхнюю полосу клеток помещают на лед и берут пробы на жизнеспособность и выход. Этот процесс повторяют, пока не обработают все нефракционированные свиные гепатоциты. После сбора всех полос и объединения их вместе эти объединенные собранные полосы клеток промывают разведением в буфере для сбора и центрифугированием при 3000 об/мин в течение 10 минут с использованием центрифуги Sorval RC3B. Полученный осадок ресуспендируют в буфере для криоконсервирования при плотности 30 миллионов клеток/мл. Аликвоты, если необходимо, помещают в мешки и/или флаконы. Конечные препараты свиных клеток хранят в регулируемом морозильнике над жидким азотом.
Данное изобретение не следует ограничивать объемом приведенных в качестве примеров воплощений, которые предназначены для иллюстрации отдельных аспектов данного изобретения. Действительно, различные модификации данного изобретения, в дополнение к показанным и описанным здесь, станут очевидными специалистам в данной области из предыдущего описания и сопутствующих чертежей. Предполагается, что такие модификации попадают в объем прилагаемой формулы изобретения.
Формула изобретения
1. Способ получения популяции клеток, обогащенной жизнеспособными клетками печени человека, в том числе печеночными стволовыми клетками/клетками-предшественниками, где указанная популяция клеток содержит функционально активные гепатоциты и билиарные клетки, экспрессирующие цитокератин 19 (СК19) и не экспрессирующие альбумин, а также печеночные стволовые клетки/клетки-предшественники, имеющие диаметр в диапазоне от 9 до 13 мкм и экспрессирующие маркеры ЕР-CAM, CD 133 или оба, предусматривающий:
(а) расщепление целой печени человека или ее резецированной части препаратом протеолитических ферментов для обеспечения расщепленной целой печени человека или ее резецированной части;
(б) механическую диссоциацию расщепленной целой печени человека или ее резецированной части для обеспечения клеточной суспензии;
(c) суспендирование суспензии клеток в растворе 25% (мас./об.) иодиксанола;
(d) центрифугирование смеси согласно (с) для получения по меньшей мере одной полосы, обогащенной жизнеспособными клетками печени человека; и
(е) сбор, по меньшей мере, одной полосы для получения популяции клеток, обогащенной жизнеспособными клетками печени человека, в том числе печеночными стволовыми клетками/клетками-предшественниками.
2. Способ по п.1, в котором популяция клеток, обогащенная жизнеспособными клетками печени человека, дополнительно включает в себя функциональные гепатоциты.
3. Способ по п.1, в котором популяция клеток, обогащенная жизнеспособными клетками печени человека, дополнительно включает в себя функциональные билиарные клетки.
4. Способ по п.1, в котором популяция клеток, обогащенная жизнеспособными клетками печени человека, дополнительно включает в себя функциональные гемопоэтические клетки.
5. Способ по п.1, в котором стадия (а) предусматривает, по меньшей мере, одно из следующего:
(е) перфузирование целой печени человека или ее полученной резекцией части хелатирующим буфером;
(f) расщепление целой печени человека или ее резецированной части препаратом ферментов, содержащим коллагеназу и, по меньшей мере, один другой протеолитический фермент, при приблизительно 37°С для обеспечения расщепленной печени; и
(g) перфузирование расщепленной печени буфером для сбора, имеющим температуру 4-15°С.
6. Способ по п.5, в котором препарат ферментов включает в себя, по меньшей мере, одну нейтральную протеазу.
7. Способ по п.5, в котором препарат ферментов включает в себя эластазу.
8. Способ по п.5, в котором препарат ферментов содержит LIBERASE . .
9. Способ по п.1, в котором указанная диссоциация включает в себя механическую диссоциацию посредством разрезания, шуровки, прочесывания и продавливания через сетку печени.
10. Способ по п.1, в котором стадия (с) предусматривает, по меньшей мере, одно из следующего:
(h) фильтрование клеточной суспензии для удаления дебриса и агрегатов клеток;
(i) сбор полученной отфильтрованной клеточной суспензии в первый мешок;
(j) при необходимости определение концентрации клеток в отфильтрованной клеточной суспензии;
(k) доведение, при необходимости, концентрации клеток для обеспечения исходной клеточной суспензии;
(1) смешивание аликвоты исходной клеточной суспензии с равным объемом 25% раствора иодиксанола в жидкой среде для обеспечения смеси; и
(m) подвергание, по меньшей мере, части этой смеси, на которую наслоен предварительно заданный объем жидкой среды, центрифугированию для получения, по меньшей мере, одной полосы, обогащенной жизнеспособными клетками печени человека.
11. Способ по п.1, в котором стадия (d) предусматривает, по меньшей мере, одно из следующего:
(n) сбор, по меньшей мере, одной полосы в контейнер на льду;
(о) определение жизнеспособности и концентрации клеток;
(р) промывание этих клеток центрифугированием и ресуспендированием в
буфере для криоконсервирования для получения конечной клеточной
суспензии;
(q) подвергание конечной клеточной суспензии замораживанию с регулируемой скоростью для обеспечения замороженной клеточной суспензии и
(r) хранение этой замороженной клеточной суспензии в морозильнике с жидким азотом.
12. Способ по п.5, в котором буфер для сбора содержит среду RPMI 1640 с 10% человеческой или бычьей сывороткой.
13. Способ по п.10, в котором указанная стадия фильтрования предусматривает пропускание указанной клеточной суспензии через фильтрующую кассету,
14. Способ по п.10, в котором указанная жидкая среда содержит среду RPMI 1640, не содержащую фенолового красного.
15. Способ по п.10, в котором указанное центрифугирование проводят в течение приблизительно 15 мин при приблизительно 500 × g.
16. Способ по п.11, в котором указанный контейнер включает в себя мешок для сбора.
17. Способ по п.11, в котором буфер для криоконсервирования содержит смесь, содержащую Na+, К+, Са2+Mg2+ CI–, H2PO4 –, HCO3 –, HEPES, лактобионат, сахарозу, маннит, глюкозу, декстран-40, аденозин, глутатион или их комбинации.
18. Способ по п.17, в котором буфер для криоконсервирования дополнительно содержит сыворотку и диметилсульфоксид.
19. Способ по п.18, в котором смесь, сыворотка и диметилсульфоксид присутствуют в соотношении приблизительно 80:10:10 об./об./об.
20. Способ по п.18, в котором сыворотка включает человеческую сыворотку, бычью сыворотку или их комбинацию.
21. Способ по п.1, в котором плотность среды устанавливают с использованием водного раствора иодиксанола.
22. Способ по п.21, в котором водный раствор иодиксанола содержит стерильный 60% (мас./об.) иодиксанол в воде.
23. Способ по п.1, в котором обогащенная популяция клеток включает в себя печеночные клетки-предшественники/стволовые клетки, имеющие диаметр в диапазоне 9-13 мкн, которые являются положительными в отношении экспрессии ЕР-CAM, CD 133 или обоих.
24. Способ получения обогащенной популяции жизнеспособных клеток печени человека, причем эта популяция клеток содержит функционально активные гепатоциты и билиарные клетки, экспрессирующие цитокератин 19 (СК19) и не экспрессирующие альбумин, а также печеночные стволовые клетки/клетки-предшественники, имеющие диаметр в диапазоне от 9 до 13
мкм и экспрессирующие маркеры ЕР-CAM, CD 133 или оба, предусматривающий
(a) обеспечение целой печени человека или ее резецированной части из неонатального, педиатрического, ювенильного, взрослого или трупного донора;
(b) перфузирование целой печени человека или ее резецированной части хелатирующим буфером;
(c) расщепление целой печени человека или ее резецированной части препаратом ферментов для обеспечения клеточной суспензии;
(d) при необходимости механическая диссоциация целой печени или ее резецированной части для обеспечения клеточной суспензии;
(e) при необходимости удаление дебриса и агрегатов клеток;
(f) смешивание клеточной суспензии с равным объемом раствора иодиксанола;
(g) подвергание полученной смеси, на которую наслоен предварительно заданный объем культуральной среды, центрифугированию для получения, по меньшей мере, двух полос клеток, разделенных барьером плотности, причем, по меньшей мере, одна полоса имеет более низкую плотность, чем другая полоса/другие полосы; и
(h) сбор, по меньшей мере, одной полосы более низкой плотности.
25. Способ по п.24, в котором обогащенная популяция клеток обогащена печеночными клетками-предшественниками/стволовыми клетками, имеющими диаметр в диапазоне 9-13 мкн, которые являются положительными в отношении экспрессии ЕР-CAM, CD 133 или обоих.
26. Композиция для лечения пациентов, страдающих заболеванием печени, содержащая популяцию клеток, обогащенную жизнеспособными, функциональными клетками печени, в том числе печеночными стволовьми клетками/клетками-предшественниками, где указанная популяция клеток содержит функционально активные гепатоциты и билиарные клетки, экспрессирующие цитокератин 19 (СК19) и не экспрессирующие
альбумин, а также печеночные стволовые клетки/клетки-предшественники, имеющие диаметр в диапазоне от 9 до 13 мкм и экспрессирующие маркеры ЕР-CAM, CD 133 или оба.
27. Композиция по п.26, в которой клетки печени являются клетками печени человека или клетками печени млекопитающего.
28. Композиция по п.27, которая дополнительно содержит гепатоциты, билиарные клетки, гемопоэтические клетки или их комбинации.
29. Композиция по п.26, в которой клетки печени содержат клетки, которые являются положительными в отношении экспрессии ЕР-САМ, CD 133 или обоих.
30. Композиция по п.26, в которой клетки печени содержат стволовые клетки/клетки-предшественники с диаметром приблизительно 9-13 мкн.
31. Композиция для лечения пациентов, страдающих заболеванием печени, содержащая популяцию клеток печени, обогащенную, относительно грубой суспензии клеток, полученной из печени, жизнеспособными, функциональными гепатоцитами и печеночными стволовыми клетками/клетками-предшественниками, где указанная популяция клеток содержит функционально активные гепатоциты и билиарные клетки, экспрессирующие цитокератин 19 (СК19) и не экспрессирующие альбумин, а также печеночные стволовые клетки/клетки-предшественники, имеющие диаметр в диапазоне от 9 до 13 мкм и экспрессирующие маркеры ЕР-САМ, CD 133 или оба.
32. Композиция по п.31, в которой клетки печени являются клетками печени человека.
33. Композиция по п.32, в которой популяция клеток печени дополнительно содержит билиарные клетки, которые являются положительными в отношении экспрессии цитокератина 19 (СК19) и отрицательными в отношении экспрессии альбумина.
34. Композиция по п.31, в которой стволовые клетки/клетки- предшественники являются положительными в отношении экспрессии ЕР-САМ, CD 133 или обоих.
35. Композиция по п.33, в которой эта популяция дополнительно содержит клетки моноцитарной/макрофагальной линии дифференцировки (например клетки Купфера), лимфоциты (например Т-лимфоциты), эндотелиальные клетки или их комбинации.
36. Композиция по п.31, в которой популяция клеток печени истощена в отношении клеток иммунной системы.
37. Композиция по п.36, в которой популяция клеток печени истощена в отношении клеток иммунной системы путем использования негативной иммуноселекции.
38. Композиция по п.37, в которой негативная селекция использует истощение по CD45, CD3, CD lIb или CD 14 или их комбинациям для удаления гемопоэтических клеток.
39. Композиция по п.36, в которой клетки иммунной системы, которые истощены, включают в себя клетки моноцитарной/макрофагальной линии дифференцировки (например клетки Купфера), лимфоциты (например Т-лимфоциты) или и те, и другие.
40. Композиция по п.31, в которой донорские клетки были подвергнуты периоду тепловой ишемии.
41. Композиция по п.31, в которой клетки печени получены из асистолического донора.
42. Композиция по п.31, в которой, по меньшей мере, 75% популяции клеток печени содержит гепатоциты и печеночные стволовые клетки/клетки-предшественники.
43. Композиция для лечения пациентов, страдающих заболеванием печени, содержащая популяцию клеток
печени, обогащенную жизнеспособными, функциональными билиарными клетками и печеночными стволовыми клетками/клетками-предшественниками, где указанная популяция клеток
содержит функционально активные гепатоциты и билиарные клетки, экспрессирующие цитокератин 19 (СК19) и не экспрессирующие альбумин, а также печеночные стволовые клетки/клетки-предшественники, имеющие диаметр в диапазоне от 9 до 13 мкм и экспрессирующие маркеры ЕР-САМ, CD 133 или оба.
44. Композиция по п.43, в которой клетки печени являются клетками печени человека, клетками печени свиньи или их смесями.
45. Композиция по п.43, в которой клетки печени получены из асистолического донора или были подвергнуты периоду тепловой ишемии.
46. Композиция по п.43, в которой билиарные клетки являются положительными в отношении экспрессии СК19 и отрицательными в отношении экспрессии альбумина.
47. Способ лечения заболевания печени, предусматривающий введение эффективного количества популяции клеток, обогащенных жизнеспособными, функциональными клетками печени, в том числе печеночными стволовыми клетками/клетками-предшественниками, где указанная популяция клеток содержит функционально активные гепатоциты и билиарные клетки, экспрессирующие цитокератин 19 (СК19) и не экспрессирующие альбумин, а также печеночные стволовые клетки/клетки-предшественники, имеющие диаметр в диапазоне от 9 до 13 мкм и экспрессирующие маркеры ЕР-САМ, CD 133 или оба.
48. Способ по п.47, в котором введение осуществляют введением через селезеночную артерию или воротную вену.
49. Способ по п.47, в котором введение осуществляют введением непосредственно в пульпу печени.
50. Способ по п.47, в котором введение осуществляют введением под капсулу печени.
51. Способ по п.47, в котором введение осуществляют введением непосредственно в селезенку.
52. Способ по п.47, в котором введение является инфузией или инъекцией.
53. Способ по п.47, в котором заболевание печени включает в себя гепатит, цирроз, врожденные нарушения метаболизма, острую печеночную недостаточность, острые инфекции печени, острую химическую токсичность, хроническую недостаточность печени, холангиоцит, билиарный цирроз, синдром Alagille, недостаточность альфа-1-антитрипсина, аутоиммунный гепатит, билиарную атрезию, рак печени, кистозное заболевание печени, жировую дистрофию печени, галактоземию, желчные конкременты, синдром Жильбера, гемохроматоз, гепатит А, гепатит В, гепатит С и инфекции других вирусов гепатита, порфирию, первичный склерозирующий холангит, синдром Рейе, саркоидоз, тирозинемию, гликогеновую болезнь типа 1 или болезнь Вильсона.
54. Фармацевтическая композиция для лечения пациентов, страдающих заболеванием печени, содержащая популяцию клеток печени, обогащенную жизнеспособными, функциональными клетками печени, в том числе печеночными стволовыми клетками/клетками-предшественниками, где указанная популяция клеток содержит функционально активные гепатоциты и билиарные клетки, экспрессирующие цитокератин 19 (СК19) и не экспрессирующие альбумин, а также печеночные стволовые клетки/клетки-предшественники, имеющие диаметр в диапазоне от 9 до 13 мкм и экспрессирующие маркеры ЕР-CAM, CD 133 или оба, и фармацевтически приемлемый носитель.
55. Композиция по п.54, в которой клетки печени являются клетками печени человека, клетками печени свиньи или их смесями.
56. Композиция по п.54, в которой клетки печени получены из асистолического донора или были подвергнуты периоду тепловой ишемии.
57. Композиция по п.54, в которой стволовые клетки/клетки-предшественники являются положительными в отношении экспрессии ЕР-САМ, CD 133 или обоих.
58. Композиция по п.54, в которой стволовые клетки/клетки- предшественники имеют диаметр приблизительно 9-13 мкн.
59. Композиция по п.54, в которой фармацевтически приемлемый носитель включает в себя HYPOTHERMOSOL . .
60. Композиция по п.54, в которой фармацевтически приемлемый носитель дополнительно включает в себя сыворотку человека и диметилсульфоксид.
РИСУНКИ
|
|