Патент на изобретение №2346940
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
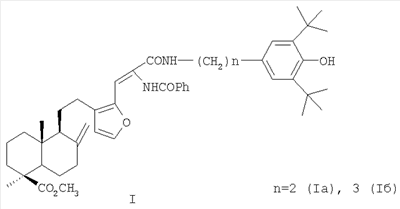
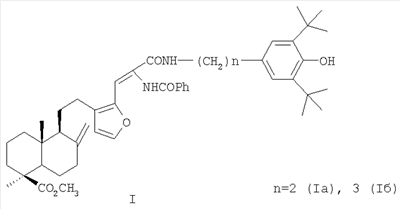
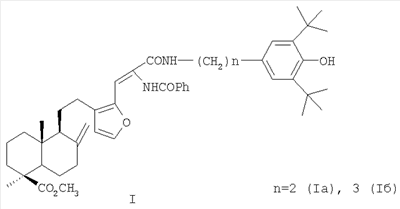
(54) 16-{2-БЕНЗОИЛАМИНО-2-[(3,5-ДИ-ТРЕТ-БУТИЛ-4-ГИДРОКСИФЕНИЛ)-АЛКИЛКАРБАМОИЛ]ВИНИЛ}-ЛАБДАТРИЕНЫ С АНТИОКСИДАНТНЫМИ, ГЕПАТОПРОТЕКТОРНЫМИ И ГЕМОСТИМУЛИРУЮЩИМИ СВОЙСТВАМИ
(57) Реферат:
Изобретение относится к новым соединениям, конкретно к 16-{2-бензоиламино-2-[(3,5-ди-трет-бутил-4-гидроксифенил)-алкилкарбамоил]винил}-лабдатриенам формулы (I) обладающим антиоксидантными, гепатопротекторными и гемостимулирующими свойствами, позволяющими использовать их при токсическом гепатите и для коррекции побочных эффектов цитостатических препаратов (например, циклофосфана). Соединения формулы I получают из растительного сырья – хвои или живицы кедра сибирского. 4 табл.
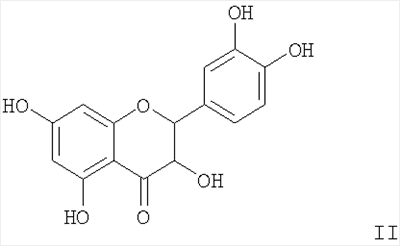
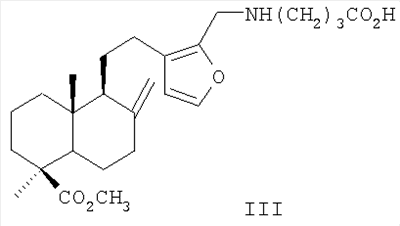
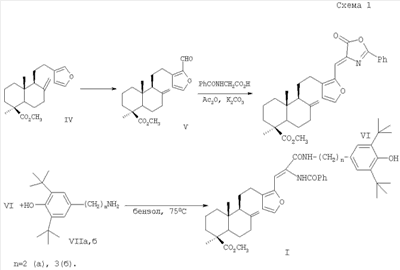
Изобретение относится к новым химическим соединениям, конкретно к 16-{2-бензоиламино-2-[(3,5-ди-трет-бутил-4-гидроксифенил)-алкилкарбамоил]винил}-лабдатриенам формулы (I) обладающим антиоксидантной, гепатопротекторной и гемостимулирующей активностью. Указанные свойства позволяют предполагать возможность использования соединений в медицине в качестве фармацевтических препаратов. В медицинской практике используются антиоксиданты группы экранированных фенолов. Например, препарат дибунол (2,6-ди-трет-бутил-4-метилфенол) применяется для лечения рака и папилломатоза мочевого пузыря, циститов, ожогов, трофических и лучевых язв [1]. Препарат пробукол [4,4′-(изопропилидендитио)-бис-(2,6-ди-трет-бутил)фенол] назначается как гиполипидемическое средство при гиперхолестеринемии с риском развития ишемической болезни сердца [2]. Таким образом, производные 2,6-ди-трет-бутилфенола могут служить лекарственными средствами различной направленности, что делает перспективным синтез и фармакологическое изучение веществ, включающих названный структурный фрагмент. Задачей, на решение которой направлено предлагаемое изобретение, является разработка антиоксидантов фенольного типа с дополнительными свойствами на основе доступного растительного лабданоида ламбертиановой кислоты. Важным элементом поставленной задачи служит получение антиоксиданта нового структурного типа, способного снижать побочные токсические эффекты цитостатических препаратов, к которым обычно относятся гемо- и миелодепрессия, иммунологические расстройства, функциональные и морфологические повреждения различных органов и т.д. Интерес к разработке таких агентов на основе растительного сырья значительно возрос в новом столетии в связи необходимостью их включения в комплексную химиотерапию опухолей. Ассортимент подобных препаратов-корректоров химиотерапевтических средств в настоящее время недостаточно широк. В основном применяются препараты в виде сложных смесей экстрактивных веществ [3], которые имеют определенные недостатки, связанные с индивидуальной непереносимостью и аллергическими эффектами. Анализ литературных данных показывает, что синтез новых соединений из растительного сырья с целью расширения ассортимента нетоксичных антиоксидантов с дополнительными (помимо антиоксидантной активности) протекторными свойствами, является актуальной задачей. Поставленная задача решается новыми химическими соединениями 16-{2-бензоиламино-2-[(3,5-ди-трет-бутил-4-гидроксифенил)-алкилкарбамоил] винил}-лабдатриенами формулы (I), а именно, (Z)-метил-16-{2-бензоиламино-2-[2-(3,5-ди-трет-бутил-4-гидроксифенил)-этилкарбамоил]-винил}-15,16-эпокси-8(17), 13 (16), 14-лабдатриен-18-оатом (Ia) или (Z)-метил-16-{2-бензоиламино-2-[3-(3,5-ди-трет-бутил-4-гидроксифенил)-пропилкарбамоил]-винил}-15,16-эпокси-8(17), 13(16), 14-лабдатриен-18-оатом (Iб), проявляющими выраженные антиоксидантные, гепатопротекторные и гемостимулирующие свойства и пригодными для коррекции токсических эффектов цитостатической полихимиотерапии. Аналогом по свойствам заявляемых соединений является дигидрокверцетин [(2R,3R)-3,5,7,3′,4′-пентагидроксифлаванон] формулы (II). Дигидрокверцетин является основным биофлавоноидом (90% и выше) препарата диквертин, производство которого из древесины лиственницы налажено в последние годы. Дигидрокверцетин обладает антирадикальной и антиоксидантной активностью, противовоспалительными, капилляропротективными, гастро- и гепатопротекторными свойствами [4]. Указанные эффекты обеспечивают этому соединению статус базовой субстанции для создания на ее основе средств, обладающих новыми фармакологическими свойствами. К основным недостаткам комплексных препаратов, в составе которых используется дигидрокверцетин, является развитие побочных эффектов в желудочно-кишечном тракте, например тошноты, изжоги [5]. Аналогом по структуре указанных соединений является 16-аминометилпроизводное ламбертиановой кислоты, формулы (III), обладающее ноотропной активностью [6]. Способ получения соединений (I), содержащих в структуре лабданоидный остов, соединенный с фрагментами пространственно затрудненных фенолов, реализуется по приведенной схеме 1. Формилирование метилового эфира ламбертиановой кислоты (IV) приводит к 16-формилпроизводному (V) [7], выделяемому кристаллизацией. Взаимодействие альдегида (V) с бензоилглицином (гиппуровой кислотой) приводит к образованию лабданоидного 5(4Н)-оксазолона (VI). Соединение (VI) образуется с выходом до 76% в виде индивидуального изомера с (Z)-конфигурацией двойной связи. Взаимодействие азлактона (VI) с 3,5-ди-третбутил-4-гидроксифенилэтил(пропил)-аминами (VIIa,б) гладко приводит к соответствующим 4-замещенным карбамоилвинилбензамидам (Iа, б) (выход 76-91%). Достоинством изобретения является способ получения соединений (Iа, б) путем химической модификации доступного растительного метаболита кедра сибирского Pinus sibirica R. Mayr. – метилового эфира ламбертиановой кислоты (IV). Последний легко выделяется из лесопромышленного продукта – кедровой живицы или из хвои кедра, являющейся многотоннажным отходом лесосеки [8]. Физико-химические константы новых, впервые полученных соединений, приведены в примерах 1, 2. Биологическая активность соединений (Iа, б) изучалась путем определения токсичности, гепатопротекторных свойств на модели токсического гепатита, антиоксидантной и гемостимулирующей активности – на модели токсического поражения крыс, вызванного циклофосфаном. В качестве препарата сравнения использовали антиоксидант дигидрокверцетин (II). Острую токсичность определяли на беспородных мышах массой 18-23 г при однократном внутрижелудочном способе введения. Параметры токсичности рассчитывали по методу Кербера. Установлено, что LD50 соединений (Iа, б) превышает максимально возможную для разового введения дозу 1000 мг/кг. Для исследования антиоксидантного и гепатопротекторного эффектов была использована стандартная экспериментальная модель токсического CCl4 гепатита у мышей. Модель воспроизводилась согласно методическим рекомендациям [9]. Раствор CCl4 в растительном масле (25%) вводился внутрижелудочно мышам самцам. Соединения (Iа, б) вводили в желудок в дозе 100 мг/кг в виде водно-твиновой взвеси за 1 час до гепатотоксина. Референсное соединение – дигидрокверцетин (ДКВ) – вводили аналогичным образом. Через сутки в сыворотке крови мышей определяли активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), щелочной фосфатазы (ЩФ) и концентрацию малонового диальдегида (МДА) общепринятыми методами [10]. Установлено, что соединения (Iа) и (Iб) при внутрижелудочном введении в дозе 100 мг/кг обладают гепатопротекторным действием, снижая выраженность цитолитических и холестатических процессов на фоне токсического гепатита. Агент (Iа) снижает активность трансаминаз в крови в 1,3, агент (Iб) – в 1,7-1,9 раз по сравнению с контролем. Оба агента не уступают дигидрокверцетину по влиянию на уровень АЛТ, при этом агент (Iб) превосходит референс-соединение в 1,7 раз по влиянию на активность ACT. По величине антихолестазного эффекта соединение (Iа) не уступает, а соединение (Iб) в 1,5 раза превосходит ДКВ. Изучение гепатопротекторного, антиоксидантного и гемостимулирующего действия соединений (Iа, б) в условиях поражения циклофосфаном (ЦФ) изучали на крысах самках Вистар. ЦФ вводился однократно внутрибрюшинно в дозе 125 мг/кг в растворе 0,9% NaCl всем животным. Соединения (Iа, б) вводились в виде водно-твиновой взвеси двум группам крыс (по 10 шт.) в желудок в дозе 50 мг/кг в течение трех дней после введения ЦФ. Референсное соединение – дигидрокверцетин (ДКВ) – вводили в той же дозе аналогичным образом отдельной группе крыс (10 шт.). Контрольной группе вводили только циклофосфан (10 шт.). В конце опыта определяли состав периферической крови и лейкоцитарную формулу. В сыворотке крови с помощью стандартных наборов реактивов исследовали активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), щелочной фосфатазы (ЩФ), концентрацию общего белка, глюкозы. Концентрацию малонового диальдегида (МДА) исследовали методом [10]. Результаты изучения биологической активности приведены в табл.2-4. Установлено, что на фоне интоксикации циклофосфаном антицитолитический эффект соединений (Iа) и (Iб) ниже, а антиоксидантный в 1,3-1,4 раза выше, чем у ДКВ. Показано, что соединение (Iб) на фоне гемодепрессии, вызванной введением циклофосфана, уменьшает лейкопению и превосходит ДКВ по стимулирующему влиянию на лейкоцитарный росток крови. Агент (Iа) в тех же условиях не проявляет значимого гемостимулирующего эффекта. Таким образом, предлагаемое изобретение обладает следующими преимуществами, а именно: – Высокая гепатопротекторная активность соединений (Iа) и (Iб) при токсическом гепатите. – Антиоксидантный и гемостимулирующий эффекты соединения (Iб) на фоне введения цитостатика циклофосфана. – Использование для синтеза соединений (Iа, б) исходного, получаемого из доступного растительного сырья – хвои или живицы кедра сибирского Pinus sibirica R. Mayr. Изобретение иллюстрируется следующими примерами. Пример 1. Получение (Z)-Метил-16-{2-бензоиламино-2-[2-(3,5-ди-трет-бутил-4-гидроксифенил)-этилкарбамоил]-винил}-15,16-эпокси-8 (17), 13(16), 14-лабдатриен-18-оата (Ia). К раствору 1.00 г (2.79 ммоль) 16-формилметилламбертианата (V) [7] в 15 мл уксусного ангидрида при перемешивании добавили 0.50 г (2.79 ммоль) гиппуровой кислоты и 0.38 г (2.79 ммоль) карбоната калия. Реакционную смесь перемешивали в течение 5 ч и оставили на ночь. Выпавший осадок отфильтровали, промыли водой, сушили под вакуумом и перекристаллизовывали из смеси петролейный эфир: серный эфир =2:1. Получили 1.06 г (выход 76%) Z-(1S,4aR,5S)-метил-1.4а-диметил-6-метилен-5-{2-[2-(5-оксо-2-фенил-4-оксазолилиденметил)-фур-3-ил1этил}-декагидронафталин-1-карбоксилата (VI). Тпл 112-115°С. К раствору 0.50 г (1.0 ммоль) азлактона (VI) в 7 мл бензола добавили 0.27 г (1.1 ммоль) 3,5-дитретбутил-4-гидроксифенилэтиламина, реакционную массу нагревали (70°С) в течение 6 ч. Растворитель удалили в вакууме, остаток хроматографировали на силикагеле (элюент: хлороформ). Кристаллизацией из диэтилового эфира выделили 0.57 г (выход 76%) соединения (Iа). Тпл 91-93°С. [ Пример 2. Получение (Z)-Метил-16-{2-бензоиламино-2-[3-(3,5-ди-трет-бутил-4-гидроксифенил)-пропилкарбамоил]-винил}-15,16-эпокси-8(17), 13(16), 14-лабдатриен-18-оата (Iб). К раствору 0.50 г (1.0 ммоль) азлактона (VI), полученного по примеру 1, в 7 мл бензола добавили 0.27 г (1.1 ммоль) 3,5-ди-трет-бутил-4-гидроксифенилпропиламина, реакционную массу нагревали (70°С) в течение 6 ч. Растворитель удалили в вакууме, остаток хроматографировали на силикагеле (элюент: хлороформ). Кристаллизацией из диэтилового эфира выделили 0.69 г (выход 91%) соединения (Iб). Тпл 85-87°С. [ Пример 3. Исследование гепатопротекторных свойств на модели острого токсического гепатита Острый токсический гепатит вызывали у беспородных мышей самцов путем однократного внутрижелудочного введения 25% раствора CCl4 в подсолнечном масле (по 0,1 мл на 10 г массы тела). Соединения (Iа) или (Iб) вводили внутрижелудочно мышам (по 9 шт. в каждой группе) в дозе 100 мг/кг в виде водно-твиновой взвеси за 1 час до воспроизведения гепатита. Контрольным животным (9 шт.) аналогично вводили водно-твиновую взвесь в эквивалентном объеме, группе сравнения (9 шт.) – дигидрокверцетин в дозе 100 мг/кг. Через сутки в сыворотке крови мышей определяли с помощью стандартных наборов реактивов («Biocon», «Ольвекс Диагностикум») активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT) и щелочной фосфатазы (ЩФ). Уровень малонового диальдегида (МДА) определяли методом [10]. Результаты обрабатывали статистически с помощью пакета программ «STATISTIKA 6». Результаты эксперимента представлены в таблице 1. Установлено, что соединения (Iа) и (Iб) проявляют достоверный антицитолитический эффект. Агент (Iа) снижает активность трансаминаз в крови в 1,3, агент (Iб) – в 1,7-1.9 раз по сравнению с контролем. Оба агента не уступают дигидрокверцетину по влиянию на уровень АЛТ (различия между группами не достоверны), а агент (Iб) превосходит референс-соединение в 1,7 раз по влиянию на активность ACT. Под действием соединений (Iа) и (Iб) достоверно уменьшается активность ЩФ, что свидетельствует о их антихолестазном действии. Агент (Iа) снижает активность ЩФ в крови в 1,5, а агент (Iб) – в 2 раза по сравнению с контролем. По выраженности антихолестазного эффекта соединение (Iа) не уступает, а соединение (Iб) достоверно превосходит ДКВ в 1,5 раза. Оба агента, так же как и референс соединение, в условиях данного опыта не оказали влияния на интенсивность процессов перекисного окисления: концентрация МДА в соответствующих группах не имела достоверных различий с контролем (табл.1).
Таким образом, показано, что соединения (Iа) и (Iб) при внутрижелудочном введении в дозе 100 мг/кг обладают гепатопротекторным действием, снижая выраженность цитолитических и холестатических процессов на фоне токсического гепатита. По величине эффекта соединение (Iа) не уступает, а соединений (Iб) превосходит ДКВ. Пример 4. Исследование гепатопротекторных и антиоксидантных свойств на фоне токсического поражения крыс циклофосфаном Эксперимент проводили на крысах самках Вистар, которым вводился однократно внутрибрюшинно циклофосфан в дозе 125 мг/кг (в растворе 0.9% NaCl). Соединения (Ia) и (Iб) вводилось в желудок крысам (по 10 шт. в группе) в виде водно-твиновой взвеси в дозе 50 мг/кг в течение трех дней после введения ЦФ. Референсное соединение – дигидрокверцетин (ДКВ) – вводили в той же дозе аналогичным образом отдельной группе крыс (10 шт.). Контролем являлись животные с введением только ЦФ (10 шт.). В конце опыта в сыворотке крови исследовали с помощью стандартных наборов реактивов («Biocon», «Ольвекс Диагностикум») активность аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), щелочной фосфатазы (ЩФ), концентрацию общего белка и глюкозы. Результаты представлены в табл.2. Установлено, что на фоне циклофосфана соединения (Iа) и (Iб) не проявили антицитолитического действия: активность обеих трансаминаз не имела статистических различий с контролем. Соответствующий эффект ДКВ проявился только в отношении ACT, активность которой в референс группе снизилась в 1,4 раза относительно контроля. Оба агента и ДКВ в данном опыте не оказали антихолестазного действия. Соединения (Iа) и (Iб) не повлияли заметно на концентрацию МДА в крови, в отличие от ДКВ, который достоверно усилил интенсивность перекисного окисления относительно контроля. Различия между ДКВ и соединениями (Iа) и (Iб) по концентрации МДА составили соответственно 1,3 и 1,4 раза. Значимой разницы между агентами и референс-соединением по влиянию на показатели общего обмена (белок, глюкозу) не обнаружено.
Таким образом, показано, что при внутрижелудочном введении в дозе 50 мг/кг на фоне интоксикации циклофосфаном антицитолитический эффект соединений (Iа) и (Iб) ниже, а антиоксидантный выше, чем у ДКВ. Пример 5. Исследование гемостимулирующего действия на фоне токсического поражения крыс циклофосфаном Эксперимент проводили на крысах самках Вистар, которым вводился однократно внутрибрюшинно циклофосфан в дозе 125 мг/кг (в растворе 0.9% NaCl). Соединение (I) вводилось в желудок 12 крысам в дозе 50 мг/кг в течение трех дней после введения ЦФ (в виде водно-твиновой взвеси). Референсное соединение – дигидрокверцетин (ДКВ) – вводили в той же дозе аналогичным образом отдельной группе крыс (10 шт.). Контролем являлись животные с введением только ЦФ (10 шт.). В конце опыта с помощью гемоанализатора MEDONIC определяли морфологический состав периферической крови. Лейкоцитарную формулу подсчитывали под микроскопом в мазках крови, окрашенных гематоксилин-эозином. Результаты представлены в табл.3. Установлено, что на фоне гемодепрессии, вызванной циклофосфаном, соединение (Iб) вызывает однонаправленные с ДКВ сдвиги в показателях периферической крови. Соединение (Iб) достоверно снижает лейкопению, повышая в 1,9 раза количество лейкоцитов в крови относительно контроля, что превышает аналогичный эффект ДКВ (1,6 раз). У агента (Iб) выявлено небольшое (в 1,2 раза) снижение количества эритроцитов по сравнению с контролем, которое коррелирует с таким же снижением гематокрита. Относительное уменьшение эритроцитарной массы у животных этой группы компенсируется небольшим достоверным повышением количественных показателей гемоглобина в эритроцитах (МСН, МСНС). Соединение (Iа) не вызвало достоверных сдвигов в показателях периферической крови и, таким образом, не проявило гемостимулирующего эффекта.
На фоне нейтропении, вызванной циклофосфаном, наблюдалась тенденция к увеличению количества гранулоцитарных клеток под действием соединений (Iа) и (Iб). В этих же группах в крови животных выявлен относительный моноцитоз. Отмеченная тенденция к стимуляции клеток лейкоцитарного ряда была более выраженной у соединения (Iб), чем у ДКВ (табл.4).
Таким образом, показано, что соединение (Iб) при внутрижелудочном введении в дозе 50 мг/кг на фоне гемодепрессии, вызванной введением циклофосфана, уменьшает лейкопению и превосходит ДКВ по стимулирующему влиянию на лейкоцитарный росток крови. Агент (Iа) в тех же условиях не проявляет значимого гемостимулирующего эффекта. Источники информации 1. М.Д.Машковский. Лекарственные средства, изд.15. М.: «Новая Волна», 2005, 471. 2. М.Д.Машковский. Лекарственные средства, изд.15. М.: «Новая Волна», 2005, 731. 3. Е.Г.Гольдберг, Зуева Е.П., Препараты из растений в комплексной терапии злокачественных новообразований. Томск. Изд-во Томского университета. 2000, 128 с. 4. М.Б.Плотников, Н.А.Тюкавкина, Т.М.Плотникова. Лекарственные препараты на основе диквертина. Томск. Изд-во Томского университета. 2005, 228 с. 5. Лекарственные препараты, разрешенные к применению в СССР./Под ред. М.А.Клюева, Э.А.Бабаяна. М., Медицина, 1979, с.61-65. 6. Т.Г.Толстикова, И.В.Сорокина, Т.В.Воевода, С.В.Чернов, Э.Э.Шульц, Г.А.Толстиков. Доклады академии наук. 2001. Т.376. №2. С.271-273. 7. Клок Д.А., Шакиров М.М., Гришко В.В., Ралдугин В.А. Известия АН. Серия химическая. 1995. №11. С.2514-2517. 8. Т.Г.Толстикова, И.В.Сорокина, М.П.Долгих., Ю.В.Харитонов, С.В.Чернов, Э.Э.Шульц, Г.А.Толстиков. Химико-фармацевтический журнал. 2004. Т. 38, №10. С.13-15. 9. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: Медицина, 2000, 832 с. 10. Камышников B.C. Справочник по клинико-химической лабораторной диагностике, Минск: Беларусь, 2000, Т.2, с.207.
Формула изобретения
16-{2-Бензоиламино-2-[(3,5-ди-трет-бутил-4-гидроксифенил)-алкилкарбамоил]винил}-лабдатриены формулы (I) обладающие антиоксидантными, гепатопротекторными и гемостимулирующими свойствами.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

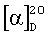 1.16 (с 7.68, CHCl3). ИК спектр, см-1: 702, 780, 883 (Ph); 883 (C=C); 983, 1551 (фуран); 1173, 1380, 1720 (СО2Ме); 1645, 1759, 1789 (азлактон). УФ спектр,
1.16 (с 7.68, CHCl3). ИК спектр, см-1: 702, 780, 883 (Ph); 883 (C=C); 983, 1551 (фуран); 1173, 1380, 1720 (СО2Ме); 1645, 1759, 1789 (азлактон). УФ спектр,  макс, нм (lg
макс, нм (lg  ) 232 (3.41), 266 (3.75), 392 (4.18), 409 (4.17). Спектр ЯМР 1H (
) 232 (3.41), 266 (3.75), 392 (4.18), 409 (4.17). Спектр ЯМР 1H ( , м.д., J, Гц): 0.43 с (3Н, С20,H3), 0.82 т.д. (1Н, Н1′, J 12, 3), 0.90 т.д. (1H, Н3‘, J 12, 3), 1.06 с (3Н, С19, Н3), 1.13 д.д. (1Н, Н5‘, J 11, 2.4), 1.38 д.м. (1Н, Н2‘, J 12), 1.48 д (1Н, Н9′, J 9), 1.60-1.80 м (6Н, н7′,2′,6′,11′,11′,1′), 1.89 д.м (1Н, Н6′ J 12), 2.05 д.м. (1Н, Н3′, J 11), 2.36 т.д. (1Н, Н7′, J 11, 3), 2.51 м (1Н, Н12′), 2.66 м (1Н, Н12′), 3.51 с (3Н, ОСН3), 4.53 с, 4.92 с (2Н, Н17′,17′), 6.40 д (1Н, Н14′, J 1.8), 6.92 с (1Н, Н6), 7.41 т (2Н, Н3″,5″, J 7), 7.48 т.т. (1Н, Н4″, J 7, 1), 7.68 д (1Н, Н15, J 1.8), 8.07 д.д. (2Н, Н2″,6″, J 7, 1). Спектр ЯМР С13 (CDCl3,
, м.д., J, Гц): 0.43 с (3Н, С20,H3), 0.82 т.д. (1Н, Н1′, J 12, 3), 0.90 т.д. (1H, Н3‘, J 12, 3), 1.06 с (3Н, С19, Н3), 1.13 д.д. (1Н, Н5‘, J 11, 2.4), 1.38 д.м. (1Н, Н2‘, J 12), 1.48 д (1Н, Н9′, J 9), 1.60-1.80 м (6Н, н7′,2′,6′,11′,11′,1′), 1.89 д.м (1Н, Н6′ J 12), 2.05 д.м. (1Н, Н3′, J 11), 2.36 т.д. (1Н, Н7′, J 11, 3), 2.51 м (1Н, Н12′), 2.66 м (1Н, Н12′), 3.51 с (3Н, ОСН3), 4.53 с, 4.92 с (2Н, Н17′,17′), 6.40 д (1Н, Н14′, J 1.8), 6.92 с (1Н, Н6), 7.41 т (2Н, Н3″,5″, J 7), 7.48 т.т. (1Н, Н4″, J 7, 1), 7.68 д (1Н, Н15, J 1.8), 8.07 д.д. (2Н, Н2″,6″, J 7, 1). Спектр ЯМР С13 (CDCl3,  ]580 9.40° (с 1.90, CHCl3). ИК спектр, см-1: 713, 750, 769 (Ph); 890 (фуран); 1122, 1188, 1722 (CO2Me); 1516, 1665 (CONH), 3426 (ОН). УФ спектр,
]580 9.40° (с 1.90, CHCl3). ИК спектр, см-1: 713, 750, 769 (Ph); 890 (фуран); 1122, 1188, 1722 (CO2Me); 1516, 1665 (CONH), 3426 (ОН). УФ спектр, 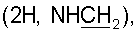 (2Н, NHCH2), 4.56 с, 4.91 с (2Н, H17,17), 5.07 с (1Н, ОН), 6.32 д (1Н, Н14, J 1.8), 6.54 т (1Н, CONH, J 6), 6.83 с (1Н, Н1′), 7.00 с (2Н, Н2″,6″), 7.34 д (1Н, Н15, J 1.8), 7.46 т (2Н, H7′,9′, J 7), 7.54 т (1Н, Н8′, J 7), 7.91 д (2Н, H6′,10′,J 8), 8.55 ш.с. (1Н, Н3′). Спектр ЯМР С13 (CDCl3,
(2Н, NHCH2), 4.56 с, 4.91 с (2Н, H17,17), 5.07 с (1Н, ОН), 6.32 д (1Н, Н14, J 1.8), 6.54 т (1Н, CONH, J 6), 6.83 с (1Н, Н1′), 7.00 с (2Н, Н2″,6″), 7.34 д (1Н, Н15, J 1.8), 7.46 т (2Н, H7′,9′, J 7), 7.54 т (1Н, Н8′, J 7), 7.91 д (2Н, H6′,10′,J 8), 8.55 ш.с. (1Н, Н3′). Спектр ЯМР С13 (CDCl3, 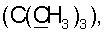 34.06 с
34.06 с 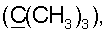 35.58 т
35.58 т 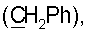 37.93 т (С3), 38.43 т (С7), 38.86 т (С1), 39.98 т (CH2N), 41.56 с (С4), 44.07 с (С10), 50.96 к (ОСН3), 54.70 д (С9), 55.90 д (С5), 106.48 т (С17), 110.72 д (С1′), 112.78 д (С14), 125.11 д (С2″,6″), 126.31 с (С2′), 127.32 д (С6′,10′), 128.58 д (С7′,9′), 129.33* с (С13), 129.81* с (С5′), 132.05 д (С8′), 133.19 с (С1″), 135.76 с (С3″,5″), 143.14 д (С15), 146.24 с (С16), 147.50 с (С8), 152.10 с (С4″), 164.80 с (CONH), 166.22 с (С4′), 177.58 с (С18). Найдено: С 74.61, N 3.68, Н 8.73. C47O6N2H62 Вычислено: С 75.20, N 3.73, Н 8.28.
37.93 т (С3), 38.43 т (С7), 38.86 т (С1), 39.98 т (CH2N), 41.56 с (С4), 44.07 с (С10), 50.96 к (ОСН3), 54.70 д (С9), 55.90 д (С5), 106.48 т (С17), 110.72 д (С1′), 112.78 д (С14), 125.11 д (С2″,6″), 126.31 с (С2′), 127.32 д (С6′,10′), 128.58 д (С7′,9′), 129.33* с (С13), 129.81* с (С5′), 132.05 д (С8′), 133.19 с (С1″), 135.76 с (С3″,5″), 143.14 д (С15), 146.24 с (С16), 147.50 с (С8), 152.10 с (С4″), 164.80 с (CONH), 166.22 с (С4′), 177.58 с (С18). Найдено: С 74.61, N 3.68, Н 8.73. C47O6N2H62 Вычислено: С 75.20, N 3.73, Н 8.28.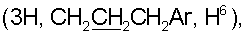 1.96 д.м. (1Н, Н6 J 12), 2.12 д.м. (1Н, Н3, J 11), 2.38 м (2Н, H12,7), 2.58 т (3Н, СН2Ar, Н12, J 6), 3.41 д.д.
1.96 д.м. (1Н, Н6 J 12), 2.12 д.м. (1Н, Н3, J 11), 2.38 м (2Н, H12,7), 2.58 т (3Н, СН2Ar, Н12, J 6), 3.41 д.д. 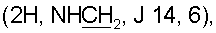 3.58 с (3Н, ОСН3), 4.56 с, 4.92 с (2Н, H17,17), 5.03 с (1Н, ОН), 6.33 д (1Н, Н14, J 1.8), 6.52 т (1Н, CONH, J 6), 6.81 с (1Н, H1′), 6.97 с (2Н, H2″,6″), 7.35 д (1Н, Н15, J 1.8), 7.47 т (2Н, Н7′,9′, J 7), 7.55 т (1Н, Н8′, J 7), 7.93 д (2Н, Н6′,10′; J 8), 8.59 ш.с. (1Н, H3′). Спектр ЯМР С13 (CDCl3,
3.58 с (3Н, ОСН3), 4.56 с, 4.92 с (2Н, H17,17), 5.03 с (1Н, ОН), 6.33 д (1Н, Н14, J 1.8), 6.52 т (1Н, CONH, J 6), 6.81 с (1Н, H1′), 6.97 с (2Н, H2″,6″), 7.35 д (1Н, Н15, J 1.8), 7.47 т (2Н, Н7′,9′, J 7), 7.55 т (1Н, Н8′, J 7), 7.93 д (2Н, Н6′,10′; J 8), 8.59 ш.с. (1Н, H3′). Спектр ЯМР С13 (CDCl3, 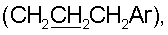 35.09 т
35.09 т 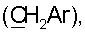 34.14 с
34.14 с 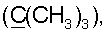 37.99 т (С3), 38.51 т (С7), 38.92 т (С1), 39.69 т (CH2N), 40.04 с (С4), 44.13 с (С10), 51.03 к (ОСН3), 54.74 д (С9), 55.95 д (С5), 106.55 т (С17), 110.60 д (С1′), 112.87 д (С14), 124.76 д (С2″,6″), 126.53 с (С2′), 127.38 д (С6′‘10′), 128.65 д (С7′,9′), 129.79 с (С13), 132.03 с (С5′), 132.14 д (С8′), 133.25 с (С1″), 135.62 с (С3″,5″), 143.17 д (С15), 146.36 с (С16), 147.57 с (С8), 151.74 с (С4“), 164.88 с (CONH), 166.22 с (С4′), 177.65 с (С18). Найдено: С 75.32, N 3.62, Н 8.63. C48O6N2H64 Вычислено: С 75.39, N 3.66, Н 8.38.
37.99 т (С3), 38.51 т (С7), 38.92 т (С1), 39.69 т (CH2N), 40.04 с (С4), 44.13 с (С10), 51.03 к (ОСН3), 54.74 д (С9), 55.95 д (С5), 106.55 т (С17), 110.60 д (С1′), 112.87 д (С14), 124.76 д (С2″,6″), 126.53 с (С2′), 127.38 д (С6′‘10′), 128.65 д (С7′,9′), 129.79 с (С13), 132.03 с (С5′), 132.14 д (С8′), 133.25 с (С1″), 135.62 с (С3″,5″), 143.17 д (С15), 146.36 с (С16), 147.57 с (С8), 151.74 с (С4“), 164.88 с (CONH), 166.22 с (С4′), 177.65 с (С18). Найдено: С 75.32, N 3.62, Н 8.63. C48O6N2H64 Вычислено: С 75.39, N 3.66, Н 8.38.