Патент на изобретение №2346926
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ ПРОСТЫХ ПОЛИФТОРАЛКИЛОВЫХ ЭФИРОВ
(57) Реферат:
Изобретение относится к способу получения простых полифторалкиловых эфиров формулы H(CF2)nCH2OR (n=2, 4, 6; R=н-Pr, н-Bu, изо-Bu, н-С5Н11, изо-С5Н11, н-С6Н13, С6Н11(циклогексил), RF (где RF=H(CF2)nCH2, n=2, 4, 6, 8), Ph, ArCH2 (где Ar=Ph, п-Cl-Ph, п-СН3О-Ph, м-NO2-Ph)) реакцией соответствующих спиртов или фенола с полифторалкилхлорсульфитами в присутствии растворителя при смешении реагентов при температуре -10 – -5°С. При этом спирты или фенол дозируют в раствор полифторалкилхлорсульфита в смеси с катализатором N,N-диметилформамидом при их мольном соотношении, равном 1:(1-1,1):(0,005-0,1) соответственно, реакцию ведут при 40-50°С в течение 4-6 ч, а выделяющиеся диоксид серы и хлористый водород отдувают инертным газом. Способ позволяет получить полифторалкиловые эфиры с высоким выходом и упростить процесс. 1 табл.
Изобретение относится к способу синтеза простых полифторалкиловых эфиров из спиртов и полифторалкилхлорсульфитов. Известно множество методов синтеза полифторированных простых эфиров. Наиболее распространенными являются два направления – это фторирование элементарным фтором, фтористым водородом и различными фторидами. Второе направление – это синтез эфиров на основе полифторированных спиртов или алкоголятов. Фторированные спирты типа RfCH2OH и (Rf)2 Недостатком этого способа является невысокий выход эфиров. Кроме того, исходные полифторалкоксиэтилхлориды необходимо предварительно получать реакцией соответствующих спиртов с тионилхлоридом, что значительно усложняет технологию. Известен способ получения диполифторированных эфиров [RU 2203881 C1, С07С 43/12, опубл. 2003.05.10] путем взаимодействия полифторированного спирта с тетрафторэтиленом в присутствии катализатора – гидроксида калия (1.2-2.0% от массы полифторированного спирта). Процесс ведут в присутствии 2-10 мас.% метанола, температура процесса 50-110°C, давление 9-16 кгс/см2. Недостатком этого способа является образование побочных продуктов – алкиловых эфиров 2,3,3,3-тетрафторпропионовой кислоты и продуктов замещения фтора на алкоксигруппу. Недостатком этого способа является невысокий выход, образование побочного продукта – трифторметилсульфокислоты или арилсульфокислоты и использование большого избытка спирта, который для повторного применения после выделения продуктов необходимо дополнительно очищать и осушать. Известен способ получения диполифторалкиловых эфиров из полифторированных спиртов и полифторалкилхлорсульфитов [Рахимов А.И., Налесная А.В., Вострикова О.В. Синтез ди(полифторалкиловых) эфиров/ЖПХ. 2004. Т.77. Вып.9. С.1573-1574]. Диполифторалкиловые эфиры получают двумя методами – каталитическим взаимодействием полифторалкилхлорсульфитов с полифторированными спиртами в присутствии N,N-диметилформамида (ДМФА) и некаталитическим взаимодействием полифторалкилхлорсульфитов с полифторированными спиртами в присутствии триэтиламина. По первому методу раствор хлорсульфита добавляют в смесь соответствующего спирта с ДМФА в мольном соотношении хлорсульфит: полифторированный спирт: ДМФА, равном 1:1:(0.005-0.01) при -10°С, затем выдерживают реакционную массу при 20°C два часа, отдувая выделяющиеся хлористый водород и диоксид серы осушенным воздухом, и еще 1 сутки при комнатной температуре. После отгонки растворителя (хлороформ, диэтиловый эфир) и перегонки продукта выход эфира составляет 59-98%. По второму методу раствор хлорсульфита дозировали в предварительно приготовленный комплекс спирта с триэтиламином при -10°C, затем выдерживали реакционную смесь сутки при комнатной температуре; растворитель – пентан или гексан. Образующийся хлорид триэтиламмония отфильтровывали, полученный эфир очищали перегонкой, выход 52-85%. Недостатком этого способа является большая продолжительность реакции (более суток), а также применение больших количеств триэтиламина (ТЭА) по второму методу. Недостатками этого способа являются недостаточно высокие выходы эфиров, а также применение в больших количествах триэтиламина и, как следствие, образование побочного продукта – хлорида триэтиламмония. Образование соли идет с выделением тепла, что способствует протеканию побочных реакций и снижению выхода эфира. Кроме того, хлорид триэтиламмония является нежелательным загрязнителем, от которого трудно избавиться. Техническим результатом предлагаемого изобретения является получение полифторалкиловых эфиров с высоким выходом (до 90.2%), без применения триэтиламина, что значительно упрощает способ получения заявляемых соединений. Технический результат достигается тем, что способ получения полифторалкиловых эфиров формулы H(CF2)nCH2OR (n=2, 4, 6; R=н-Pr, н-Bu, изо-Bu, н-С5Н11, изо-С5Н11, н-С6Н13, С6Н11(циклогексил), RF (где RF=H(CF2)nCH2, n=2, 4, 6, 8), Ph, ArCH2 (где Ar=Ph, п-Cl-Ph, п-СН3О-Ph, м-NO2-Ph)) реакцией соответствующих спиртов или фенола с полифторалкилхлорсульфитами в присутствии растворителя, заключается в смешении реагентов при температуре -10÷-5°C, причем спирты или фенол дозируют в раствор полифторалкилхлорсульфита в смеси с катализатором – N,N-диметилформамидом при их мольном соотношении, равном 1:(1-1.1):(0.005-0.1) соответственно, реакцию ведут при 40-50°C в течение 4-6 ч, выделяющиеся диоксид серы и хлористый водород отдувают инертным газом. Сущность предлагаемого способа заключается в том, что спирты и фенол, обладая кислотными свойствами, образуют с ДМФА, как со слабым основанием, донорно-акцепторный комплекс, что приводит к увеличению реакционной способности спирта (фенола) в специфическом взаимодействии с полифторалкилхлорсульфитом (ПФАХС), приводящем к образованию простого эфира. Каталитическое действие ДМФА подробно изучено в реакции полифторированных спиртов с тионилхлоридом [Налесная А.В. Каталитический синтез и реакции полифторалкилхлорсульфитов: Автореф.дисс. канд. хим. наук. 02.00.03 Органическая химия, – Волгоград, 2004, 20 с.], установлено, что молекула амидного катализатора, ассоциируясь карбонильной группой по гидроксилу спирта, участвует в поляризации исходных реагентов и промежуточных структур. Известно, что ассоциаты более устойчивы при низкой температуре, то есть для образования и устойчивости ассоциатов при смешении реагентов необходимо охлаждение до -10÷-5°С. ПФАХС, как наиболее реакционно-способный реагент, склонный к разложению (гидролизу), должен быть в избытке, поэтому необходимо брать на 1 моль спирта 1-1.1 моль ПФАХС и при этом раствор спирта дозировать в ПФАХС. Известно, что для получения диполифторалкиловых эфиров из полифторированных спиртов и полифторалкилхлорсульфитов [Рахимов А.И., Налесная А.В., Вострикова О.В. Синтез ди(полифторалкиловых) эфиров/ЖПХ. 2004. Т.77. Вып.9. С.1573-1574.] используют мольное соотношение спирт: ДМФА равное 1:(0.005-0.01). Нами установлено, что нефторированные спирты менее реакционно-способны при взаимодействии с ПФАХС, кроме того, увеличение молекулярной массы полифторированного спирта также снижает его реакционно-способность, что требует увеличения количества катализатора, поэтому мы увеличили количество ДМФА в этих случаях до (0.01-0.1) моль на 1 моль соответствующего спирта. Были установлены следующие оптимальные соотношения спирта (фенола) и ДМФА: – для полифторированных спиртов H(CF2)nСН2ОН
– для нефторированных спиртов 1:0.01; – для фенолов 1:(0.005-0.01). По прототипу реакцию спиртов с ПФАХС ведут 5-6 часов при комнатной температуре (20°C), при этом выход эфиров составляет 39-51%. Известно, что повышение температуры повышает скорость реакции, поэтому мы повысили температуру до 40-50°C (в зависимости от реакционной способности исходных спиртов и ПФАХС), при этом время реакции уменьшилось до 4-6 ч и выход эфиров повысился до 60.5-89.9%. Очевидно, при понижении температуры реакции необходимо увеличивать время реакции для получения эфиров с высоким выходом. Выделяющиеся в процессе реакции газы – хлористый водород и диоксид серы, необходимо удалять из реакционной смеси для предотвращения побочных реакций, а также, чтобы сдвинуть равновесие в сторону образования эфира. Для этого применяют продувку (барботирование) инертным газом, например азотом. Пример 1. Получение 1-(2,2,3,3,4,4,5,5-октафтор)пентоксипропана 1.4 г (0.023 моль) пропилового спирта смешали с 0.018 мл (0.00023 моль) ДМФА в 20 мл гексана, охладили до -5°C и при интенсивном перемешивании порциями добавляли в раствор 7.7 г (0.024 моль) 1, 1, 5-тригидроперфторпентилхлорсульфита в 15 мл гексана, поддерживая температуру -5°C. Мольное соотношение реагентов спирт: ПФАХС: ДМФА (далее просто мольное соотношение) при этом составляет 1:1.04:0.01. После смешения реагентов температуру реакционной смеси повышали до 45-50°C и выдерживали 6 часов при постоянной продувке инертным газом (азотом). Гексан отгоняли, продукт перегоняли в вакууме. Выход 1-(2,2,3,3,4,4,5,5-октафтор)пентоксипропана 5.54 г (87.9%), т.кип.104°C (13 мм рт. ст.), Пример 2. Получение 1-(2, 2, 3, 3-тетрафтор)пропоксибутана 1.6 г (0.022 моль) 1-бутанола смешали с 0.017 мл (0.00022 моль) ДМФА в 20 мл гексана, охладили до -10°C и при интенсивном перемешивании порциями добавляли в раствор 4.7 г (0.022 моль) 1,1,3-тригидроперфторпропилхлорсульфита в 10 мл гексана, поддерживая температуру -10°C. Мольное соотношение 1:1:0.01. После смешения реагентов температуру реакционной смеси повышали до 40-45°C и выдерживали 5 часов при постоянной продувке инертным газом (азотом). Гексан отгоняли, продукт перегоняли в вакууме. Выход 1-(2,2,3,3-тетрафтор)пропоксибутана 3.72 г (89.9%), т.кип.95°C (4 мм рт. ст.), Пример 3. Получение 1-(2,2,3,3,4,4,5,5-октафтор)пентоксибутана Получали аналогично примеру 1. Выход 85.0%, т.кип.102°С (4 мм рт. ст.), Пример 4. Получение 1-(2,2,3,3-тетрафтор) пропилоксипентана Получали аналогично примеру 2. Выход 80%, т.кип. 88°C (2 мм рт. ст.), Пример 5. Получение 1-(2,2,3,3-тетрафторпропокси)-2-метилпропана Получали аналогично примеру 2. Выход 60.0%, т.кип. 95 °С (3 мм рт. ст.), Пример 6. Получение 1-(2,2,3,3,4,4,5,5-октафторпентокси)-2- метилпропана Получали аналогично примеру 1. Выход 56.0%, т.кип.106°C (3 мм рт. ст.), Пример 7. Получение 1-(2,2,3,3-тетрафторпропокси)-3-метилбутана Получали аналогично примеру 2. Выход 70.0%, т.кип.100°C (3 мм рт. ст.), Пример 8. Получение 1-(2,2,3,3,4,4,5,5-октафторпентокси)-3-метилбутана Получали аналогично примеру 1. Выход 71.0%, т.кип. 113 °С (3 мм рт. ст.), Пример 9. Получение 1 – (2,2,3,3-тетрафтор) пропоксигексана Получали аналогично примеру 2. Выход 60.0%, т.кип. 100 °С (2 мм рт. ст.), Пример 10. Получение 1 – (2,2,3,3,4,4,5,5-октафтор) пентоксигексана Получали аналогично примеру 1. Выход 55.0%, т.кип. 120°C (2 мм рт. ст.), Пример 11. Получение 2, 2, 3, 3-тетрафторпропоксициклогексана Получали аналогично примеру 2. Выход 82.3%, т.кип. 95°C (3 мм рт. ст.), Пример 12. Получение 2,2,3,3,4,4,5,5-октафторпентоксициклогексана Получали аналогично примеру 1. Выход 75.5%, т.кип. 105 °С (3 мм рт. ст.), Пример 13. Получение 1, 1, 7-тригидроперфторгептилоксициклогексана Получали аналогично примеру 1. Выход 65.2%, т.кип.123 °С (3 мм рт. ст.), Пример 14. Получение 2,2,3,3-тетрафтор-1-(2,2,3,3,4,4,5,5-октафторпентокси) пропана 4.4 г (0.019 моль) 1, 1, 5-тригидроперфтор-1-пентанола смешали с 0.007 мл (0.0001 моль) ДМФА в 15 мл хлороформа, охладили до -10 °С и при интенсивном перемешивании дозировали в раствор 4.48 г (0.02 моль) 1,1,3-тригидроперфторпропилхлорсульфита в 10 мл хлороформа, поддерживая температуру -10°C. Мольное соотношение 1:1.05:0.005. Затем температуру реакционной смеси повысили до 40°C и выдерживали 4 ч при постоянной продувке инертным газом (азотом). Растворитель отогнали, продукт перегоняли в вакууме. Выход 5.56 г (84.6%), т.кип. 83°C (2 мм рт. ст.), Пример 15. Получение 2,2,3,3-тетрафтор-1-(1,1,7-тригидроперфторгептилокси) пропана Получали аналогично примеру 14, используя 1,1,7-тригидроперфтор-1-гептанол и 1,1,3-тригидроперфторпропилхлорсульфит. Выход 71.6%, т.кип. 95°C (1 мм рт. ст.), Пример 16. Получение 2,2,3,3,4,4,5,5-октафтор-1-(1,1,7-тригидроперфторгептилокси) пентана Получали аналогично примеру 14, используя 1,1,7-тригидроперфтор-1-гептанол и 1,1,5-тригидроперфторпентилхлорсульфит. Выход 61,5%, т.кип. 110 °С (1 мм рт. ст.), Пример 17. Получение 2,2,3,3-тетрафтор-1-(1,1,9-тригидроперфторнонилокси) пропана 3.96 г (0.0091 моль) 1,1,9-тригидроперфтор-1-нонанола смешали с 0.07 мл (0.0009 моль) ДМФА в 20 мл хлороформа, охладили до -5 °С и при интенсивном перемешивании дозировали в раствор 2.15 г (0.01 моль) 1, 1, 3-тригидроперфторпропилхлорсульфита в 10 мл хлороформа, поддерживая температуру -5 °С. Мольное соотношение 1:1.1:0.1. Затем температуру реакционной смеси повысили до 50 °С и выдерживали 6 ч при постоянной продувке инертным газом (азотом). Отогнали растворитель, непрореагировавшие спирт и хлорсульфит; неперегоняющийся в вакууме остаток перекристаллизовывали из хлороформа. Получили 1.72 г (34.5%) эфира, т.пл. 49°C. ИК-спектр, Пример 18. Получение 2,2,3,3,4,4,5,5-октафтор-1-(1,1,9-тригидроперфторнонилокси) пентана Получали аналогично примеру 17, используя 1,1,9-тригидроперфтор-1-нонанол и 1,1,5-тригидроперфторпропилхлорсульфит. Выход 32.1%, т. пл. 53°C. ПМР-спектр, Пример 19. Получение 1-фенокси-2,2,3,3-тетрафторпропана Получали аналогично примеру 2. Выход 61.5%, т.кип. 53°С (3 мм рт. ст.), Пример 20. Получение 1-фенокси-2,2,3,3,4,4,5,5-октафторпентана Получали аналогично примеру 1. Выход 81.3%, т.кип. 68 °С (3 мм рт. ст.), Пример 21. Получение [(2,2,3,3-тетрафторпропокси)метил] бензола 3.25 г (0.03 моль) бензилового спирта смешали с 0.02 мл (0.0003 моль) ДМФА в 20 мл бензола, охладили до -10°C и при интенсивном перемешивании дозировали в раствор 6.44 г (0.03 моль) 1, 1, 3-тригидроперфторпропилхлорсульфита в 10 мл бензола, поддерживая температуру -10°C. Мольное соотношение 1: 1: 0.01. Затем температуру реакционной смеси повысили до 45-50°C и выдерживали 6 ч при постоянной продувке инертным газом (азотом). После отгонки растворителя и перегонки в вакууме получили 5.69 г (85.4%) эфира, т.кип. 120°C (3 мм рт. ст.), Пример 22. Получение [(2,2,3,3,4,4,5,5-октафторпентокси)метил] бензола Получали аналогично примеру 21. Выход 83.1%, т.кип. 125°C (3 мм рт. ст.), Пример 23. Получение 1-хлор-4-[(2,2,3,3-тетрафторпропокси) метил] бензола Получали аналогично примеру 21. Выход 90.2%, т.кип. 130 °С (3 мм рт. ст.), Пример 24. Получение 1-хлор-4-[(2,2,3,3,4,4,5,5-октафторпентокси) метил] бензола Получали аналогично примеру 21. Выход 85.3%, т.кип. 135 °С (3 мм рт. ст.), Пример 25. Получение 1-метокси-4-[(2,2,3,3-тетрафторпропокси) метил] бензола Получали аналогично примеру 21. Выход 70.4%, т.кип.110 °С (3 мм рт. ст.), Пример 26. Получение 1-метокси-4-[(2,2,3,3,4,4,5,5-октафторпентокси) метил] бензола Получали аналогично примеру 21. Выход 63.7%, т.кип. 116°C (3 мм рт. ст.), Пример 27. Получение 1-нитро-3-[(2,2,3,3-тетрафторпропокси) метил] бензола Получали аналогично примеру 21. Выход 90.0%, т.кип. 130 °С (3 мм рт. ст.), Пример 28. Получение 1-нитро-3-[(2,2,3,3,4,4,5,5-октафторпентокси) метил] бензола Получали аналогично примеру 21. Выход 84.1%, т.кип. 140 °С (3 мм рт. ст.), Выход и свойства полученных эфиров представлены в таблице. Нами было установлено, чем больше молекулярная масса исходного полифторалкилхлорсульфита H(CF2)nCH2OS(O)Cl, тем он менее реакционно-способен, поэтому необходимо при переходе от n=2 к n=6 увеличивать температуру и время реакции (примеры 1 и 2). Увеличение молекулярной массы полифторированного спирта также снижает его реакционно-способность, что требует увеличения количества катализатора, температуры и времени реакции и снижает выход эфиров (примеры 17, 18).
Таким образом, предлагается способ получения полифторалкиловых эфиров из спиртов (фенола) и полифторалкилхлорсульфитов с использованием в качестве катализатора N, N-диметилформамида при соотношении реагентов спирт (фенол): полифторалкилхлорсульфит: ДМФА, равном 1:(1-1.1):(0.005-0.1) моль, позволяющий получать эфиры с выходом до 90.2%.
Формула изобретения
Способ получения простых полифторалкиловых эфиров формулы H(CF2)nCH2OR (n=2, 4, 6; R=н-Pr, н-Bu, изо-Bu, н-С5Н11, изо-С5Н11, н-С6Н13, С6Н11(циклогексил), RF (где RF=H(CF2)nCH2, n=2, 4, 6, 8), Ph, ArCH2 (где Ar=Ph, п-Cl-Ph, п-СН3О-Ph, м-NO2-Ph)) реакцией соответствующих спиртов или фенола с полифторалкилхлорсульфитами в присутствии растворителя, заключающийся в смешении реагентов при температуре -10 ÷ -5°С, отличающийся тем, что спирты или фенол дозируют в раствор полифторалкилхлорсульфита в смеси с катализатором N,N-диметилформамидом при их мольном соотношении, равном 1:(1-1,1):(0,005-0,1) соответственно, реакцию ведут при 40-50°С в течение 4-6 ч, выделяющиеся диоксид серы и хлористый водород отдувают инертным газом.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

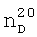 1.3705,
1.3705, 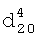 1.4234. ИК-спектр, v, см-1:1154 (С-О-С), 1180 (CF2), 2892 (CH2-O), 2980 (CH2, СН3).
1.4234. ИК-спектр, v, см-1:1154 (С-О-С), 1180 (CF2), 2892 (CH2-O), 2980 (CH2, СН3).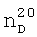 1.4180,
1.4180, 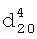 1.2770. ИК-спектр,
1.2770. ИК-спектр,  , см-1:1171 (С-О-С), 1206 (CF2), 2912 (O-CH2), 2963 (СН2), 2997 (СН3).
, см-1:1171 (С-О-С), 1206 (CF2), 2912 (O-CH2), 2963 (СН2), 2997 (СН3).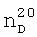 1.3700,
1.3700, 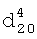 1.4165.
1.4165.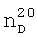 1.3996,
1.3996, 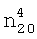 1.0371. ИК-спектр, v, см-1: 1137 (С-О-С), 1214 (CF2), 2885 (O-CH2), 2963 (CH2, СН3).
1.0371. ИК-спектр, v, см-1: 1137 (С-О-С), 1214 (CF2), 2885 (O-CH2), 2963 (CH2, СН3).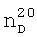 1.3450,
1.3450, 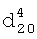 1.1020.
1.1020.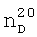 1.3520,
1.3520, 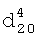 1.3040.
1.3040.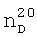 1.3550,
1.3550, 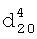 1.0990.
1.0990.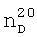 1.3600,
1.3600, 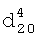 1.2990.
1.2990.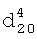 1.0870.
1.0870.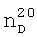 1.3480,
1.3480, 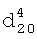 1.2130.
1.2130.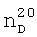 1,3798,
1,3798, 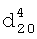 1,1005. ИК-спектр,
1,1005. ИК-спектр,  , м.д.: 5.95 т.т. (1Н, HCF2); 3.86 т (2Н, О-СН2-СР2), 2.85 с (CH кольца), 1.74 и 1.32 (мультиплет кольца).
, м.д.: 5.95 т.т. (1Н, HCF2); 3.86 т (2Н, О-СН2-СР2), 2.85 с (CH кольца), 1.74 и 1.32 (мультиплет кольца).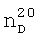 1,3865,
1,3865, 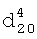 1,3733. ИК-спектр,
1,3733. ИК-спектр, 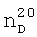 1.3891,
1.3891, 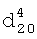 1.4067. ИК-спектр,
1.4067. ИК-спектр, 
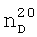 1.3500,
1.3500, 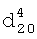 1.6790. ИК-спектр,
1.6790. ИК-спектр, 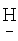 (CF2)4CH2OCH2(CF2)2H); 5.823 т.т. (1Н, H(CF2)4CH2OCH2(CF2)2
(CF2)4CH2OCH2(CF2)2H); 5.823 т.т. (1Н, H(CF2)4CH2OCH2(CF2)2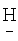 ); 4.321 д.кв. (4Н,-СН2-).
); 4.321 д.кв. (4Н,-СН2-).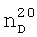 1.3450,
1.3450, 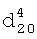 1.7310. ИК-спектр,
1.7310. ИК-спектр, 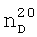 1.3380,
1.3380, 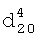 1.7647. ИК-спектр,
1.7647. ИК-спектр, 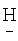 (CF2)8CH2OCH2(CF2)2
(CF2)8CH2OCH2(CF2)2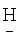 ); 4.358 д.т. (4Н,-СН2-).
); 4.358 д.т. (4Н,-СН2-).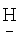 (CF2)8CH2OCH2(CF2)4
(CF2)8CH2OCH2(CF2)4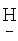 ); 4.354 д.т. (4Н,-СН2-).
); 4.354 д.т. (4Н,-СН2-).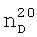 1.4508,
1.4508, 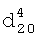 1.4378. ИК-спектр,
1.4378. ИК-спектр, 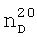 1.3980,
1.3980, 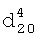 1.5760. ПМР-спектр,
1.5760. ПМР-спектр, 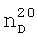 1.3580,
1.3580, 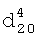 1.5065. ИК-спектр,
1.5065. ИК-спектр, 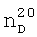 1.3730,
1.3730, 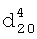 1.6382. ИК-спектр,
1.6382. ИК-спектр, 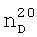 1.4580,
1.4580, 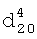 1.4025. ИК-спектр,
1.4025. ИК-спектр, 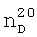 1.4100,
1.4100, 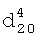 1.5002. ИК-спектр,
1.5002. ИК-спектр, 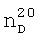 1.4440,
1.4440, 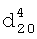 1.2856. ИК-спектр,
1.2856. ИК-спектр, 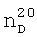 1.3995,
1.3995, 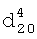 1.3643. ИК-спектр,
1.3643. ИК-спектр, 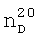 1.4760,
1.4760, 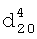 1.3570. ИК-спектр,
1.3570. ИК-спектр, 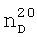 1.4310,
1.4310, 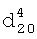 1.5002. ИК-спектр,
1.5002. ИК-спектр,