|
|
(21), (22) Заявка: 2005112731/13, 26.09.2003
(24) Дата начала отсчета срока действия патента:
26.09.2003
(30) Конвенционный приоритет:
27.09.2002 US 60/414,692
(43) Дата публикации заявки: 20.01.2006
(46) Опубликовано: 10.02.2009
(56) Список документов, цитированных в отчете о
поиске:
US 6,117,985 А, 12.09.2000. US 6,448,075 А, 10.09.2002. НОВИКОВ Д.К. и др. Клеточные методы иммунодиагностики. – Минск: Беларусь, 1979, с.20-23.
(85) Дата перевода заявки PCT на национальную фазу:
27.04.2005
(86) Заявка PCT:
US 03/30265 (26.09.2003)
(87) Публикация PCT:
WO 2004/029208 (08.04.2004)
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
КОЛЛИНЗ Дэниел П. (US),
ХЕЙПК Джоел Г. (US),
БУЧЕРТ Кэрол А. (US)
(73) Патентообладатель(и):
БайоИ, Инк. (US)
|
(54) КОМПОЗИЦИЯ (ВАРИАНТЫ), СПОСОБ И НАБОР ДЛЯ РАЗДЕЛЕНИЯ КЛЕТОК
(57) Реферат:
Изобретение касается вариантов композиций для разделения клеток, в частности клеток крови, содержащая декстран, антитело против гликофорина А, анти-CD 15 антитело, анти-CD 9 антитело, анти-CD 94 антитело, анти-CD 161 антитело и при необходимости другие анти-CD антитела и другие компоненты, необходимые для разделения клеток, в частности гепарин и двухвалентные катионы. Изобретение раскрывает набор и способ разделения клеток с его использованием. Композиции по изобретению и способ позволяют осуществлять агглютинацию клеток посредством распознавания их поверхности, и могут быть использованы для выделения даже редко встречающихся клеток с высоким выходом. 4 н. и 46 з.п. ф-лы, 4 ил., 19 табл.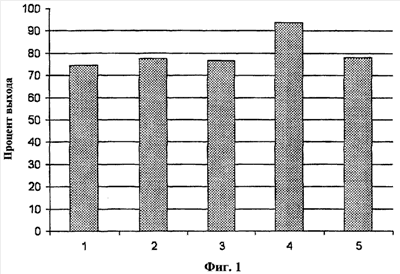
Область, к которой относится изобретение
Настоящее изобретение относится к композициям и способам разделения клеток.
Предшествующий уровень техники
Многие стандартные процедуры выделения клеток крови предусматривают предварительное выделение эритроцитных и гранулоцитных компонентов из общей массы клеток путем седиментации в градиенте плотности. Разделение в градиенте плотности основано на небольшом различии в плотности клеток различных типов, приводящем к их сегрегации на различных уровнях в жидкой среде различной плотности. Различия в плотности клеток различных типов могут быть небольшими, и клетки отдельных типов могут быть гетерогенными по размеру и плотности. Следовательно, клетки конкретных типов могут распределяться по всей среде в градиенте плотности, а не сегрегироваться в каком-либо дискретном участке в плотной среде. Этот феномен может приводить к низкому выходу нужных клеток и/или к их контаминации клетками нежелательных типов. В процедурах с обогащением клетками крови редко встречающихся типов, такими как гемопоэтические клетки-предшественники, применение методов седиментации в градиенте плотности дает низкие выходы. Так, например, считается, что применение стандартных методов седиментации в градиенте плотности для выделения клеток-предшественников (например, гемопоэтических стволовых CD34+-клеток) из крови пупочного канатика приводит к значительной потере нужных стволовых клеток. См. например, Wagner J.E. Am. J. Ped. Hematol Oncol. 15:169 (1993). Другим примером может служить тот факт, что применение стандартных методов седиментации в градиенте плотности для выделения лимфоцитов приводит, как сообщалось, к селективной потере конкретных субпопуляций лимфоцитов. См., например, Collins, D.P., J.Immunol. Methods 243:125 (2000).
Увеличение выхода клеток редких типов из донорной ткани резко повышает шансы на успех терапии методом трансплантации и иммунотерапии (например, трансплантации костного мозга, генотерапии с использованием стволовых клеток и терапии с использованием клеток иммунной системы), где этот успех, как очевидно, зависит от фактического числа клеток, используемых в терапии.
Сущность изобретения
Настоящее изобретение относится к композициям и способам разделения клеток. Описанные композиции и способы могут быть использованы, например, для эффективного получения клеток для культивирования тканей, для иммунофенотипической характеризации, для других диагностических тестов и для дополнительной очистки и терапевтического введения.
Способы настоящего изобретения предусматривают контактирование образца, содержащего клетки крови (например, пробы периферической крови, образца пупочного канатика и образца костного мозга), с композицией для разделения клеток. Не претендуя на какую-либо конкретную теорию, можно лишь отметить, что композиции настоящего изобретения могут обеспечивать селективную агглютинацию клеток посредством их взаимодействия с антигенами клеточной поверхности и/или посредством стимуляции межклеточной адгезии (например, за счет увеличения уровня экспрессии клеточно-поверхностных факторов адгезии). Агглютинированные клетки отделяются от неагглютинированных клеток, которые остаются в растворе. Клетки могут быть выделены либо из агглютината, либо из супернатантной фазы, либо из того и другого.
Описанные композиции и способы могут быть использованы для выделения клеток различных типов и обогащения этими клетками, включая, например, Т-лимфоциты, хелперные Т-клетки, супрессорные Т-клетки, В-клетки, гемопоэтические стволовые клетки, фетальные клетки, циркулирующие в материнском кровотоке, и циркулирующие метастатические опухолевые клетки. Описанные композиции и методы могут быть использованы при аллогенной и аутологичной трансплантации. Что касается аутологичной трансплантации, то описанные композиции и способы могут быть использованы, например, для удаления нежелательных клеток, таких как метастатические раковые клетки, из крови или из костного мозга пациента. Нужные клетки (например, гемопоэтические стволовые клетки), полностью очищенные, или, в основном, очищенные от опасных для жизни опухолевых клеток, могут быть затем возвращены назад пациенту. Описанные композиции и способы могут быть применены к клеткам любого млекопитающего, включая человека, других приматов, грызунов, свиней, коров и лошадей.
Композиции для разделения клеток могут содержать декстран, антитело против гликофорина А, а также одно или несколько антител против антигенов клеточной поверхности, таких как CD9, CD15, CD2, CD3, CD4, CD8, CD72, CD16, CD41a, HLA класса I, HLA-DR, CD29, CD11a, CD11b, CD11c, CD19, CD20, CD23, CD39, CD40, CD43, CD44, CDw49d, CD53, CD54, CD62L, CD63, CD66, CD67, CD81, CD82, CD94, CD99, CD100, CD161, Leu-13, TPA-1 или поверхностный Ig и их комбинации.
Так, например, композиция может содержать декстран, антитело против гликофорина А, анти-CD15 антитело, анти-CD9 антитело, анти-CD94 антитело и анти-CD161 антитело. В некоторых вариантах осуществления изобретения такая композиция, кроме того, может содержать анти-CD72 антитело или анти-CD2 антитело. В других вариантах осуществления изобретения такая композиция может также содержать анти-CD4 антитело, анти-CD16 антитело и анти-CD19 антитело, или анти-CD8 антитело, анти-CD16 антитело и анти-CD19 антитело.
Композиции для разделения клеток могут содержать антитела против поверхностных антигенов клеток других типов (например, белки клеточной поверхности опухолевых клеток).
Антитела против антигенов клеточной поверхности могут присутствовать в композиции для разделения клеток либо в растворимой форме, либо в связанной с субстратом форме, либо в той и другой формах. Антитела могут быть связаны с субстратами, такими как латексные микрочастицы, протравленные кислотой стеклянные частицы, агрегированные полипептиды, полисахариды, частицы авидина или биотинилированные частицы агарозного геля. Антитела в композициях для разделения клеток могут быть моноклональными антителами и могут быть антителами типа IgM или IgG. В некоторых вариантах осуществления изобретения композиция для разделения клеток содержит античеловеческое антитело. Концентрация растворимого антитела в композиции для разделения клеток может составлять примерно от 0,01 мг/л до 15 мг/л. Связанные с субстратом антитела могут присутствовать в композиции для разделения клеток в концентрации примерно от 0,1 до 50,0×109 частиц/л.
Композиции для разделения клеток могут также содержать гепарин, двухвалентные катионы (например, Ca2+, Mg2+) и забуференный фосфатом физиологический раствор. В некоторых вариантах осуществления изобретения композиции имеют рН 6,8-7,8 (например, от 7,2 до 7,4).
Настоящее изобретение также относится к наборам, содержащим компоненты композиции для разделения клеток и упаковочный материал. Эти наборы могут включать сосуд для сбора крови, такой как мешок для сбора крови или вакуумная пробирка.
Если это не определено особо, все технические и научные термины имеют общепринятые значения, известные специалистам в области техники, к которой относится настоящее изобретение. Хотя для осуществления настоящего изобретения могут быть использованы все методы и материалы, аналогичные или эквивалентные методам и материалам, описанным в настоящей заявке, однако, предпочтительные методы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие цитируемые здесь материалы во всей своей полноте вводятся в настоящее описание посредством ссылки. В случае возникновения противоречий, они могут быть урегулированы в соответствии с представленным описанием, включая определения. Кроме того, материалы, методы и примеры приводятся в иллюстративных целях и не должны рассматриваться как ограничение изобретения.
Другие отличительные признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания и формулы изобретения.
Описание графического материала
На Фиг.1 представлен график процента выхода CD4-Т-клеток из проб крови.
На Фиг.2 представлен график процента чистоты CD4-Т-клеток, выделенных из проб крови.
На Фиг.3 представлен график процента выхода CD8-Т-клеток из проб крови.
На Фиг.4 представлен график процента чистоты CD8-Т-клеток, выделенных из проб крови.
Подробное описание изобретения
Настоящее изобретение относится к композициям и способам для разделения клеток. Композиции настоящего изобретения могут быть использованы для селективной агглютинации клеток из проб крови, содержащих эти клетки. Не претендуя на объяснение какого-либо конкретного механизма, можно лишь отметить, что композиции настоящего изобретения могут вызывать агглютинации клеток посредством взаимодействия с антигенами клеточной поверхности и/или посредством стимуляции экспрессии факторов адгезии клеточной поверхности, таких как LFA-1 (ассоциированный с лимфоцитарной функцией антиген-1, CD11а/CD18) и ICAM-1 (межклеточная адгезивная молекула-1, CD54). Агглютинированные клетки отделяются от неагглютинированных клеток, которые остаются в растворе. Клетки могут быть выделены из супернатанта или из агглютината.
Композиции для разделения клеток
Композиция для разделения клеток настоящего изобретения может содержать декстран и одно или несколько антител против антигена клеточной поверхности (то есть антител, обладающих аффинностью специфического связывания с этим антигеном).
Декстран представляет собой полисахарид, состоящий из глюкозных звеньев, связанных преимущественно через альфа-связь (1-6). Декстран может вызывать слипание эритроцитов (то есть образование агрегатов типа “монетных столбиков”), и, тем самым, способствует удалению эритроидных клеток из раствора. Обычно концентрация декстрана в композиции для разделения клеток составляет 10-20 г/л (например, 20 г/л). Антитела против антигенов клеточной поверхности могут способствовать удалению клеток крови из раствора путем гомотипической агглютинации (то есть агглютинации клеток одного и того же типа) и/или гетеротипической агглютинации (то есть агглютинации клеток различных типов).
Композиции для разделения клеток могут содержать антитела против поверхностных антигенов клеток крови, включая, например, гликофорин А, CD15, CD9, CD2, CD3, CD4, CD8, CD72, CD16, CD41a, HLA класса I, HLA-DR, CD29, CD11a, CD11b, CD11c, CD19, CD20, CD23, CD39, CD40, CD43, CD44, CDw49d, CD53, CD54, CD62L, CD63, CD66, CD67, CD81, CD82, CD94, CD99, CD100, CD161, Leu-13, TPA-1, поверхностный Ig и их комбинации. Таким образом, композиции для разделения клеток могут быть получены в целях селективной агглютинации клеток крови конкретных типов.
В некоторых вариантах осуществления изобретения композиция для разделения клеток включает антитела против гликофорина А. Обычно концентрация антител против гликофорина А в композиции для разделения клеток составляет от 0,1 до 15 мг/л (например, 0,1-10 мг/л, 1-5 мг/л или 1 мг/л). Антитела против гликофорина А могут способствовать удалению эритроцитов из раствора, по крайней мере, по двум механизмам. Антитела против гликофорина А могут вызывать гомотипическую агглютинацию эритроцитов, поскольку гликофорин А является основным поверхностным гликопротеином на эритроцитах. Кроме того, антитела против гликофорина А могут также стабилизировать опосредованное декстраном образование “монетных столбиков”. Примерами моноклональных антител против гликофорина А являются, но не ограничиваются ими, 107FMN (мышиный изотип IgG1), YTH89.1 (крысиный изотип IgG2b) и Е4 (мышиный изотип IgM). См. например, M. Vanderlaan et al., Molecular Immunology 20:1353 (1983); Telen M.J. & Bolk, T.A., Transfusion 27:309 (1987); и Outram S. et al., Leukocyte Research 12:651 (1988).
В некоторых вариантах осуществления изобретения композиция для разделения клеток включает антитела против CD15. Концентрация анти-CD15 антител в композиции для разделения клеток может варьироваться в пределах от 0,1 до 15 мг/л (например, 0,1-10, 1-5 или 1 мг/л). Анти-CD15 антитела могут вызывать гомотипическую агглютинацию гранулоцитов посредством сшивающих молекул CD15, присутствующих на поверхности гранулоцитов. Анти-CD15 антитела также могут вызывать гомотипическую и гетеротипическую агглютинацию гранулоцитов с моноцитами, NK-клетками и с В-клетками путем стимуляции экспрессии адгезивных молекул (например, L-селектина и интегрина бета-2) на поверхности гранулоцитов, которые взаимодействуют с адгезивными молекулами на моноцитах, NK-клетках и В-клетках. Гетеротипическая агглютинация клеток таких типов может способствовать удалению этих клеток из раствора вместе с эритроцитными компонентами. Примерами моноклональных анти-CD15 антител являются, но не ограничиваются ими, AHN1.1 (мышиный изотип IgM), FMC-10 (мышиный изотип IgM), BU-28 (мышиный изотип IgM), MEM-157 (мышиный изотип IgM), MEM-158 (мышиный изотип IgM), MEM-167 (мышиный изотип IgM). См. например, Leukocyte typing IV (1989), Leukocyte typing II (1984); Leukocyte typing VI (1995); Solter D. et al., Proc. Natl. Acad. Sci. USA 75:5565 (1978); Kannagi R. et al., J. Biol. Chem. 257:14865 (1982); Magnani J.L. et al., Archives of Biochemistry and Biophysics 233:501 (1984); Eggens I. et al., J. Biol. Chem. 264:9476 (1989).
В некоторых вариантах осуществления изобретения композиция для разделения клеток включает антитела против CD9 (например, в концентрации от 0,1 до 15, от 0,1 до 10, от 1 до 5 или 1 мг/л). Анти-CD9 антитела могут вызывать гомотипическую агглютинацию тромбоцитов. Анти-CD9 антитела также могут вызывать гомотипическую агглютинацию гранулоцитов и моноцитов с помощью тромбоцитов, которые могут прилипать к поверхности гранулоцитов и моноцитов. Анти-CD9 антитела могут стимулировать экспрессию тромбоцитарного L-селектина, которая приводит к связыванию тромбоцитов с клеточными поверхностями лейкоцитов. Таким образом, анти-CD9 антитела могут стимулировать образование множества межклеточных связей, и тем самым способствовать агглютинации и удалению клеток из раствора. Примерами моноклональных анти-CD9 антител являются, но не ограничиваются ими, МЕМ-61 (мышиный изотип IgG1), МЕМ-62 (мышиный изотип IgG1), МЕМ-192 (мышиный изотип IgM), FMC-8 (мышиный изотип IgG2a), SN4 (мышиный изотип IgG1), BU-16 (мышиный изотип IgG2a). См. например, Leukocyte typing VI (1995), Leukocyte typing II (1984); Von dem Bourne A.E.G.Kr. & Moderman P.N. (1989) Leukocyte typing IV (ed. W.Knapp et al.), pp.989-92. Oxford University Press, Oxford; Jennings L.K. et al., Leukocyte typing V, ed.S.F. Schlossman et al., pp.1249-51. Oxford University Press, Oxford (1995); Lanza F. et al., J.Biol.Chem. 266:10638 (1991); Wright et al., Immunology Today 15:588 (1994); Rubinstein E. et al., Seminars in Thrombosis and Hemostasis 21:10 (1995).
В некоторых вариантах осуществления изобретения композиция для разделения клеток содержит антитела против CD41, которые могут селективно агглютинировать тромбоциты. В некоторых вариантах осуществления изобретения композиция для разделения клеток содержит антитела против CD3, которые могут селективно агглютинировать Т-клетки. В некоторых вариантах осуществления изобретения композиция для разделения клеток содержит антитела против CD2, которые могут селективно агглютинировать Т-клетки и NK-клетки. В некоторых вариантах осуществления изобретения композиция для разделения клеток содержит антитела против CD72, которые могут селективно агглютинировать В-клетки. В некоторых вариантах осуществления изобретения композиция для разделения клеток содержит антитела против CD16, которые могут селективно агглютинировать NK-клетки и нейтрофильные гранулоциты. Концентрация каждого из этих антител может варьироваться от 0,01 до 15 мг/л.
В других вариантах осуществления изобретения композиция для разделения клеток содержит антитела против CD94 и CD161, которые могут селективно агглютинировать субпопуляции NK-клеток. Примером подходящего анти-CD94 антитела является клон НР-3D9. Примером подходящего анти-CD161 антитела является клон В199.2. Особенно подходящими являются моноклональные анти-CD94 и анти-CD161 антитела. Обычно концентрация каждого из этих антител составляет от 0,01 мг/л до 10 мг/л (например, от 0,1 до 5, от 0,1 до 2,5, от 0,1 до 1,5 мг/л). Так, например, концентрация анти-CD94 антитела может составлять от 0,125 до 0,25 мг/л. Концентрация анти-CD161 антитела может составлять от 0,25 до 1 мг/л.
Как было упомянуто выше, композиции для разделения клеток могут быть получены в целях селективной агглютинации конкретных клеток крови. Так, например, композиция для разделения клеток, содержащая декстран и антитела против гликофорина А, CD15 и CD9, может стимулировать агглютинацию эритроцитов, гранулоцитов, NK-клеток, В-клеток и тромбоцитов. Затем Т-клетки, NK-клетки и редкие клетки-предшественники могут быть удалены из раствора. Если композиция также содержит антитело против CD3, то Т-клетки могут быть также агглютинированы, а NK-клетки и редкие клетки-предшественники могут быть удалены из раствора. В других вариантах осуществления изобретения композиция для разделения клеток содержит декстран и антитела против гликофорина А, CD15, CD9, CD94 и CD161, в результате чего эритроциты, гранулоциты, NK-клетки, В-клетки и тромбоциты агглютинируются, и Т-клетки и редкие клетки-предшественники могут быть удалены из раствора. Для получения очищенных популяций CD4-Т-клеток в композицию могут быть включены анти-CD8 антитела, анти-CD16 антитела и анти-CD19 антитела. Для получения очищенных популяций CD8-Т-клеток в композицию могут быть включены анти-CD4 антитела, анти-CD16 антитела и анти-CD19 антитела. Неограничивающими примерами подходящих анти-CD4 антител являются клоны QS4120, RPA-Т4, S3.5, М-Т441, RFT-4 и 13В8.2. Неограничивающими примерами подходящих анти-CD8 антител являются клоны HIT8a, UCHT4 и RPA-Т8. Примером подходящего анти-CD16 антитела является клон 3G8. Неограничивающими примерами подходящих анти-CD19 антител являются клоны HIB19 и BU12.
Композиции для разделения клеток могут содержать антитела против поверхностных антигенов клеток других типов (например, белков клеточной поверхности опухолевых клеток). Каждый специалист с помощью рутинных методов может получить антитела против антигенов поверхности клеток крови и других клеток человека и других млекопитающих, включая, например, клетки других приматов, грызунов (например, мышей, крыс, хомячков, кроликов и морских свинок), свиней, коров и лошадей.
Обычно антитела, используемые в данной композиции, представляют собой моноклональные антитела, которые являются гомогенными популяциями антител против конкретного эпитопа, содержащегося в антигене. Подходящие моноклональные антитела являются коммерчески доступными, либо они могут быть получены с помощью стандартной гибридомной технологии. В частности моноклональные антитела могут быть получены методами, позволяющими продуцировать молекулы антител с использованием стабильных клеточных линий в культуре, включая методы, описанные Kohler G. et al., Nature, 1975, 256:495, методы продуцирования человеческих В-клеточных гибридом (Kosbor et al., Immunology Today 4:72(1983); Cole et al., Proc. Natl. Acad. Sci. USA 80:2026 (1983)), и методы продуцирования EBV-гибридом (Cole et al., “Monoclonal Antibodies and Cancer Therapy”, Alan R. Liss, Inc., pp.77-96 (1983)).
Антитела могут принадлежать к любому классу иммуноглобулинов, включая IgG, IgM, IgE, IgA, IgD и любые их подклассы. В композициях настоящего изобретения для разделения клеток особенно подходящими являются антитела изотипов IgG и IgM. Пентамерные антитела IgM содержат большее число антиген-связывающих сайтов, чем антитела IgG, и, в некоторых случаях (например, в случае антител против гликофорина А и CD15), они могут быть особенно подходящими для использования в реагентах для разделения клеток. В других случаях (например, в случае анти-CD9 антител), антитела изотипа IgG являются особенно подходящими для стимуляции гомотипической и/или гетеротипической агглютинации.
Антитела против антигенов клеточной поверхности могут быть получены в жидкой фазе (т.е. растворимые), либо они могут быть получены в ассоциации с твердой фазой (т.е. связаны с субстратом). Антитела в жидкой фазе обычно присутствуют в композиции для разделения клеток в концентрации примерно от 0,01 до 15 мг/л (например, от 0,25 до 10, от 0,25 до 1, от 0,5 до 2, от 1 до 2, от 4 до 8, от 5 до 10 мг/л). Связанные с субстратом антитела обычно присутствуют в композиции для разделения клеток в концентрации примерно от 0,1 до 50,0×109 частиц/л (например, от 0,25 до 10,0×109, от 1 до 20,0×109, от 2 до 10,0×109, от 0,5 до 2×109, от 2 до 5×109, от 5 до 10×109 и от 10 до 30×109 частиц/л), где термин “частицы” означает твердофазные частицы, связанные с антителами.
Антитела против различных антигенов клеточной поверхности могут быть ковалентно связаны с твердой фазой, стимулируя, тем самым, сшивание молекул клеточной поверхности и активацию адгезивных молекул клеточной поверхности. Использование связанных с субстратом антител может стимулировать разделение клеток (например, благодаря массе, которую придают эти частицы агглютинировнным клеткам, или благодаря свойствам, используемым для очистки).
В некоторых вариантах осуществления изобретения твердая фаза, с которой ассоциируется связанное с субстратом антитело, является макрочастицей. В некоторых вариантах осуществления изобретения, антитело связывают с латексной микрочастицей, такой как парамагнитная сфера (например, посредством биотин-авидиновой связи, ковалентной связи с группами СОО на полистироловых сферах или ковалентной связи с группами NH2 на модифицированных сферах). В некоторых вариантах осуществления изобретения антитело связывают со стеклянной частицей, протравленной кислотой (например, посредством биотин-авидиновой связи). В некоторых вариантах осуществления изобретения, антитело связывают с агрегированным полипептидом, таким как агрегированный альбумин бычьей сыворотки (например, посредством биотин-авидиновой связи или ковалентной связи с полипептидными группами СОО или NH2). В некоторых вариантах осуществления изобретения антитело ковалентно связывают с полисахаридом, таким как высокомолекулярный сульфат декстрана (например, >1000000 Mr). В некоторых вариантах осуществления изобретения биотинилированные антитела связывают с авидиновыми частицами, в результате чего образуются тетрамерные комплексы, имеющие четыре молекулы антитела на одну молекулу авидина. В некоторых вариантах осуществления изобретения антитела связывают с биотинилированными частицам агарозного геля (One Cell Systems, Cambridge, MA, USA) посредством связей “биотин-авидин-биотинилированное антитело”. Такие частицы обычно имеют размер примерно 300-500 микрон и могут быть получены в водяной бане с ультразвуком или в водяной бане с быстрым перемешиванием.
Частицы “клетка-субстрат” (то есть частицы, включающие клетки и связанные с субстратом антитела) могут осаждаться из раствора в виде агглютината. Частицы “клетка-субстрат” могут быть также удалены из раствора, например, путем приложения магнитного поля, если указанной частицей является парамагнитная сфера.
Композиции для разделения клеток могут также содержать двухвалентные катионы (например, Ca2+ и Mg2+). Двухвалентные катионы могут быть получены, например, в сбалансированном растворе соли (например, в сбалансированном солевом растворе Хенкса). Ионы Ca2+ могут играть важную роль в опосредованной селектином и интегрином межклеточной адгезии.
Композиции для разделения клеток настоящего изобретения могут также содержать антикоагулянт, такой как гепарин. Гепарин может предотвращать свертывание крови и неспецифическую потерю клеток, ассоциированную со свертыванием крови в среде с высоким содержанием кальция. Гепарин также стимулирует агрегацию тромбоцитов. Агрегированные тромбоциты могут прилипать к гранулоцитам и к моноцитам и, тем самым, усиливать гетеротипическую агглютинацию в гораздо большей степени, чем отдельно взятые тромбоциты. Гепарин может поставляться в виде его соли (например, натриевой, литиевой или калиевой соли гепарина).
Способы разделения клеток
Описанные композиции могут быть использованы, например, в целях эффективного продуцирования клеток для культивирования тканей, иммунофенотипической характеризации, диагностических тестов, последующей очистки и терапевтического введения. Не претендуя на конкретную теорию, можно лишь отметить, что композиции настоящего изобретения могут селективно агглютинировать клетки посредством взаимодействия с антигенами клеточной поверхности и/или посредством стимуляции межклеточной адгезии (например, посредством повышения уровня экспрессии клеточно-поверхностных факторов адгезии). Агглютинированные клетки отделяются от неагглютинированных клеток, которые остаются в растворе.
После агглютинации неагглютинированные клетки могут быть выделены из жидкой фазы (то есть супернатанта). В вариантах изобретения, в которых используются одно или несколько биотинилированных антител, супернатант может быть подвергнут контакту с композицией, содержащей покрытые авидином или стрептавидином частицы (например, магнитные сферы) для дополнительного удаления нежелательных клеток из супернатанта. После смешивания этого супернатанта и композиции, сферы могут быть отделены от супернатанта (например, с помощью магнита), и клетки могут быть удалены из супернатанта.
Клетки могут быть также выделены из агглютината. Агглютинированные клетки могут быть диссоциированы, например, путем переноса клеток в буферы, содержащие агенты, образующие хелатные комплексы с двухвалентными катионами, такие как EDTA или EGTA. Клетки, выделенные из агглютината, могут быть затем разделены с использованием антител против антигенов клеточной поверхности. Клетки могут быть выделены из агглютината, содержащего гелевую микрочастицу-антитело-клетку, путем нагревания этого агглютината до температуры, чуть превышающей температуру плавления.
Описанные композиции могут быть использованы для выделения клеток из различных образцов, содержащих клетки крови, включая клетки периферической крови (например, полученные путем венопункции), клетки крови пупочного канатика (например, взятые у женщин после родов) и клетки костного мозга (например, полученные путем аспирации). Пробы, содержащие клетки крови, могут быть подвергнуты контактированию с композицией для разделения клеток в целях агглютинации клеток конкретных типов. Так, например, эритроциты и дифференцированные миелоидные компоненты крови могут быть селективно агглютинированы с использованием композиций для разделения клеток, содержащих антитела против поверхностных антигенов этих клеток. Описанные композиции и способы могут быть использованы для выделения клеток и обогащения клетками различных типов, включая, например, Т-лимфоциты, хелперные Т-клетки, супрессорные Т-клетки, В-клетки, гемопоэтические стволовые клетки, фетальные клетки, циркулирующие в материнском кровотоке, и циркулирующие метастатические опухолевые клетки. Описанные композиции могут быть использованы для агглютинации любых клеток млекопитающих, включая человека, других приматов, грызунов, свиней, коров и лошадей.
Описанные композиции и методы могут быть использованы при аллогенной и аутологичной трансплантации. Что касается аутологичной трансплантации, то описанные композиции и способы могут быть использованы, например, для удаления нежелательных клеток, таких как метастатические раковые клетки, из крови пациента или из костного мозга. Нужные клетки (например, гемопоэтические стволовые клетки), полностью очищенные, или, в основном, очищенные от опасных для жизни опухолевых клеток, могут быть затем возвращены назад пациенту.
Композиции для разделения клеток, содержащие антитела против поверхностных белков опухолевых клеток могут быть использованы для очистки крови или костного мозга пациентов от опухолевых клеток. Такие композиции могут быть также использованы в диагностических анализах, например, для получения и детекции опухолевых клеток в агглютинате, где они присутствуют в высоких концентрациях, а поэтому они могут легче детектироваться, чем в кровотоке или костном мозге. Композиция для разделения клеток, содержащая антитела против рецептора эпителиального фактора роста, может быть использована для агглютинации опухолевых клеток, происходящих от эпителиальных опухолей (например, опухолей головы и шеи). Композиция для разделения клеток, содержащая антитела против эстрогенных рецепторов, может быть использована для агглютинации опухолевых клеток, происходящих от опухолей молочной железы и яичника. Композиция для разделения клеток, содержащая антитела против поверхностных иммуноглобулинов, может быть использована для агглютинации опухолевых клеток, ассоциированных с хроническим лимфоцитарным лейкозом, плазмацитомой и множественной миеломой. Клетки карциномы молочной железы экспрессируют на своей поверхности CD15 и могут быть удалены из костного мозга с использованием композиций для разделения клеток, которые содержат антитела против CD15. Другие композиции могут быть приготовлены на основе клеточных белков и белков клеточной поверхности в целях получения или удаления метастатических опухолевых клеток, происходящих от других карцином (например, эритролейкоза, эндотелиальной карциномы или карциномы желудочно-кишечного тракта), взятых из крови или костного мозга пациента.
Наборы для разделения клеток
Композиция для разделения клеток может быть помещена в упаковочный материал и может поставляться в продажу в виде набора. Компоненты композиции для разделения клеток могут быть упакованы по отдельности или в комбинации друг с другом. В некоторых вариантах осуществления изобретения упаковочный материал включает сосуд для сбора крови (например, мешок для сбора крови или вакуумную пробирку). Упаковочный материал, включенный в набор, обычно содержит инструкции или этикетки, на которых содержится информация по использованию данной композиции для разделения клеток в целях агглютинации клеток конкретных типов. Компоненты и методы приготовления таких наборов хорошо известны специалистам.
Настоящее изобретение, кроме того, описано в нижеследующих примерах, которые не ограничивают объема изобретения, определенного в формуле изобретения.
Примеры
Пример 1: Разделение клеток крови
В этом примере описан общий метод разделения клеток с использованием реагентов для разделения клеток, описанных ниже. Объем реагента для разделения клеток (то есть 25 мл) объединяли с равным объемом (то есть, 25 мл) пробы гепаринизованной периферической крови, подвергнутой антикоагуляции этилендиаминтетрауксусной кислотой (EDTA), в конической пробирке емкостью 50 мл. Образцы, содержащие число лейкоцитов более 20×106 клеток/мл, объединяли с реагентом для разделения клеток в соотношении одна часть крови: две части реагента. Содержимое пробирок слегка перемешивали на платформе-качалке в течение 20-45 минут при комнатной температуре. Пробирки устанавливали на стенде в вертикальном положении на 30-50 минут для отделения агглютинированных клеток от неагглютинированных клеток, которые оставались в растворе. Не нарушая агглютината, неагглютинированные клетки удаляли из супернатанта с помощью пипетки. Выделенные клетки промывали в 25 мл PBS и центрифугировали при 500×g в течение 7 минут. Клеточный осадок ресуспендировали в 4 мл PBS.
В вариантах осуществления изобретения, в которых одно или несколько антител являются биотинилированными, к супернатанту добавляли покрытые авидином магнитные сферы (1 мл сфер/мл исходного образца). Сферы и супернатант смешивали на платформе-качалке в течение 20 минут. Сферы, а также сферы, связанные с нежелательными клетками, удаляли путем помещения пробирки, содержащей указанную смесь, в PrepaMagТМ на 5 минут. Сферы, а также сферы, связанные с нежелательными клетками, направляли в боковые отделы пробирок. Для взятия жидкости из центра и со дна каждой пробирки использовали пипетку, не трогая при этом сферы и клетки, находящиеся в боковых отделах пробирок.
Клетки также были выделены из агглютината с использованием гипотонического раствора для лизиса, содержащего EDTA и этиленгликоль-бис(2-аминоэтиловый эфир)-N,N,N’N’-тетрауксусную кислоту (EGTA). Агглютинированные клетки обрабатывали 25 миллилитрами VitaLyseTM (BioErgonomics, St.Paul, MN) и встряхивали. Через 10 минут клетки либо экспонировали путем приложения магнитного поля для выделения клеток, ассоциированных с антителами, связанными с парамагнитными сферами, либо центрифугировали при 500×g в течение 7 минут, и супернатант удаляли. В каждом случае, клетки ресуспендировали в 4 мл PBS.
Выходы эритроцитов, лейкоцитов, лимфоцитов, моноцитов, гранулоцитов, Т-клеток, В-клеток и NK-клеток определяли с помощью проточной цитометрии и иммунофенотипирования. Перед проведением проточной цитометрии выход лейкоцитов (например, число лейкоцитов) определяли с использованием анализатора Coulter Onyx Hematology Analyzer, и образцы разводили PBS до концентрации 1×107 клеток/мл. 100 мкл аликвот образца со скорректированным объемом окрашивали при комнатной температуре в темноте в течение 15-30 минут ФИТЦ-меченными анти-CD3 антителами (реагирующими с Т-клетками), либо ФЭ-меченными анти-CD19 антителами (реагирующими с В-клетками), либо ФЭ-меченными анти-CD16 антителами (реагирующими с NK-клетками). К каждому образцу добавляли 2 мл PBS, а затем образец встряхивали и центрифугировали для осаждения клеток. Супернатанты отбрасывали и клеточный осадок встряхивали и ресуспендировали в 0,5 мл PBS. Окрашенные и неокрашенные клетки анализировали с помощью проточной цитометрии на проточном цитометре Coulter XL. Эритроциты, лейкоциты, лимфоциты, моноциты, гранулоциты и тромбоциты идентифицировали по их диагностическим свойствам исходя из прямого и бокового рассеяния. В-клетки, Т-клетки и NK-клетки идентифицировали по их способности к рассеянию света и окрашиванию меченными антителами.
Пример 2: Агглютинация эритроцитов
Реагент, описанный в Таблице 1, использовали для разделения клеток способом, описанным в примере 1.
| Таблица 1 |
| Декстран (средняя молекулярная масса 413000) |
20 г/л |
| Модифицированный по Дульбекко и забуференный фосфатом физиологический раствор (10 х) |
100 мл/л |
| Натриевая соль гепарина (10000 единиц/мл) |
1 мл/л |
| Сбалансированный солевой раствор Хенкса (рН 7,2-7,4) |
50 мл/л |
| Антитело против человеческого гликофорина А (мышиное моноклональное антитело IgM, клон Е4) |
1,0 мг/л |
Результаты разделения представлены в Таблице 2. Обеднение эритроцитов в супернатанте составляло 99,7%. В данном супернатанте число лимфоцитов (Т-клеток, В-клеток и NK-клеток) превышало число моноцитов и гранулоцитов.
| Таблица 2 |
| |
До разделения |
После разделения |
| Эритроциты на мл |
4,41×109 |
0,015×109 |
| Лейкоциты на мл |
5,9×106 |
5,3×106 |
| Лимфоциты (%) |
28,7 |
41,9 |
| Моноциты (%) |
8,69 |
4,78 |
| Гранулоциты (%) |
62,5 |
52,6 |
| Т-клетки (CD3+) |
19,7 |
31,8 |
| В-клетки (CD19+) |
4,46 |
5,42 |
| NK-клетки (CD16+) |
3,15 |
5,9 |
Пример 3: Агглютинация эритроцитов и CD2+-клеток
Реагент, описанный в Таблице 3, использовали для разделения клеток способом, описанным в примере 1.
| Таблица 3 |
| Декстран (средняя молекулярная масса 413000) |
20 г/л |
| Модифицированный по Дульбекко и забуференный фосфатом физиологический раствор (10 х) |
100 мл/л |
| Натриевая соль гепарина (10000 единиц/мл) |
1 мл/л |
| Сбалансированный солевой раствор Хенкса (рН 7,2-7,4) |
50 мл/л |
| Антитело против человеческого гликофорина А (мышиное моноклональное антитело IgM, клон Е4) |
1,0 мг/л |
| Парамагнитные агглютинирующие частицы с антителом против человеческого CD2 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD2, клон d118.10.1) |
14,02×109 частиц/л |
Результаты разделения представлены в Таблице 4. В данном супернатанте, обеднение эритроцитов составляло 99,7%, обеднение Т-клеток составляло 95,1%, а обеднение NK-клеток составляло 69,1%. В данном супернатанте, число В-клеток превышало число других клеток.
| Таблица 4 |
| |
До разделения |
После разделения |
| Эритроциты на мл |
4,41х109 |
0,014×109 |
| Лейкоциты на мл |
5,9х106 |
2,63×106 |
| Лимфоциты (%) |
28,7 |
16,0 |
| Моноциты (%) |
8,69 |
6,04 |
| Гранулоциты (%) |
62,5 |
75,6 |
| Т-клетки (CD3+) |
19,7 |
3,3 |
| В-клетки (CD19+) |
4,46 |
9,63 |
| NK-клетки (CD16+) |
3,15 |
4,32 |
Пример 4: Агглютинация эритроцитов и CD72+-клеток
Реагент, описанный в Таблице 5, использовали для разделения клеток способом, описанным в примере 1.
| Таблица 5 |
| Декстран (средняя молекулярная масса 413000) |
20 г/л |
| Модифицированный по Дульбекко и забуференный фосфатом физиологический раствор (10 х) |
100 мл/л |
| Натриевая соль гепарина (10000 единиц/мл) |
1 мл/л |
| Сбалансированный солевой раствор Хенкса (рН 7,2-7,4) |
50 мл/л |
| Антитело против человеческого гликофорина А (мышиное моноклональное антитело IgM, клон Е4) |
1,0 мг/л |
| Парамагнитные агглютинирующие частицы с антителом против человеческого CD72 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD72, клон BU40) |
2,63×106 частиц/мл |
Результаты разделения представлены в Таблице 6. В данном супернатанте, обеднение эритроцитов составляло 99,5%, а обеднение В-клеток составляло 81,6%.
| Таблица 6 |
| |
До разделения |
После разделения |
| Эритроциты на мл |
4,41×109 |
0,021×109 |
| Лейкоциты на мл |
5,9×106 |
3,2×106 |
| Лимфоциты (%) |
28,7 |
47,0 |
| Моноциты (%) |
8,69 |
4,78 |
| Гранулоциты (%) |
62,5 |
47,7 |
| Т-клетки (CD3+) |
19,7 |
41,3 |
| В-клетки (CD19+) |
4,46 |
2,75 |
| NK-клетки (CD16+) |
3,15 |
4,77 |
Пример 5: Агглютинация эритроцитов, CD15+-клеток и CD9+-клеток
Реагент, описанный в Таблице 7, использовали для разделения клеток способом, описанным в примере 1.
| Таблица 7 |
| Декстран (средняя молекулярная масса 413000) |
20 г/л |
| Модифицированный по Дульбекко и забуференный фосфатом физиологический раствор (10 х) |
100 мл/л |
| Натриевая соль гепарина (10000 единиц/мл) |
1 мл/л |
| Сбалансированный солевой раствор Хенкса (рН 7,2-7,4) |
50 мл/л |
| Антитело против человеческого гликофорина А (мышиное моноклональное антитело IgM, клон Е4) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Анти-CD15 антитело (мышиное моноклональное антитело IgM, клон МЕМ-158) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Анти-CD9 антитело (мышиное моноклональное антитело IgG, клон МЕМ-61) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
Результаты разделения представлены в Таблице 8. В данном супернатанте обеднение эритроцитов составляло 99,9%, обеднение моноцитов и гранулоцитов составляло 99,8%, обеднение В-клеток составляло 74%, а обеднение NK-клеток составляло 64,9%. Кроме того, количество тромбоцитов в супернатанте, которое до разделения составляло 226х106/мл, после разделения составляло 1,4х106/мл, что соответствовало обеднению на 99,4%.
| Таблица 8 |
| |
До разделения |
После разделения |
| Эритроциты на мл |
4,41×109 |
0,006×109 |
| Лейкоциты на мл |
5,9×106 |
1,53×106 |
| Лимфоциты (%) |
28,7 |
99,0 |
| Моноциты (%) |
8,69 |
0,12 |
| Гранулоциты (%) |
62,5 |
0,083 |
| Т-клетки (CD3+) |
19,7 |
83,2 |
| В-клетки (CD19+) |
4,46 |
8,10 |
| NK-клетки (CD16+) |
3,15 |
8,43 |
Пример 6: Агглютинация эритроцитов, CD15+-клеток, CD9+-клеток и CD2+-клеток
Реагент, описанный в Таблице 9, использовали для разделения клеток способом, описанным в примере 1.
| Таблица 9 |
| Декстран (средняя молекулярная масса 413000) |
20 г/л |
| Модифицированный по Дульбекко и забуференный фосфатом физиологический раствор (10 х) |
100 мл/л |
| Натриевая соль гепарина (10000 единиц/мл) |
1 мл/л |
| Сбалансированный солевой раствор Хенкса (рН 7,2-7,4) |
50 мл/л |
| Антитело против человеческого гликофорина А (мышиное моноклональное антитело IgM, клон Е4) |
1 мг/л |
| Анти-CD15 антитело (мышиное моноклональное антитело IgM, клон МЕМ-158) |
1 мг/л |
| Анти-CD9 антитело (мышиное моноклональное антитело IgG, клон МЕМ-61) |
1 мг/л |
| Парамагнитные агглютинирующие частицы с антителом против человеческого CD2 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD2, клон d118.10.1) |
14,02×109 частиц/л |
Результаты разделения представлены в Таблице 10. В данном супернатанте обеднение эритроцитов составляло 99,9%, обеднение моноцитов и гранулоцитов составляло 99,9%, обеднение В-клеток составляло 16,8%, обеднение NK-клеток составляло 29%, а обеднение Т-клеток составляло 91,5%. Кроме того, количество тромбоцитов в супернатанте, которое до разделения составляло 226×106/мл, после разделения составляло 0,3×106/мл, что соответствовало обеднению на 99,9%.
| Таблица 10 |
| |
До разделения |
После разделения |
| Эритроциты на мл |
4,41×109 |
0,005×109 |
| Лейкоциты на мл |
5,9×106 |
1,26×106 |
| Лимфоциты (%) |
28,7 |
99,8 |
| Моноциты (%) |
8,69 |
0,06 |
| Гранулоциты (%) |
62,5 |
0,09 |
| Т-клетки (CD3+) |
19,7 |
6,78 |
| В-клетки (CD19+) |
4,46 |
69,5 |
| NK-клетки (CD16+) |
3,15 |
20,7 |
Пример 7: Агглютинация эритроцитов, CD15+-клеток, CD9+-клеток и CD72+-клеток
Реагент, описанный в Таблице 11, использовали для разделения клеток способом, описанным в примере 1.
| Таблица 11 |
| Декстран (средняя молекулярная масса 413000) |
20 г/л |
| Модифицированный по Дульбекко и забуференный фосфатом физиологический раствор (10 х) |
100 мл/л |
| Натриевая соль гепарина (10000 единиц/мл) |
1 мл/л |
| Сбалансированный солевой раствор Хенкса (рН 7,2-7,4) |
50 мл/л |
| Антитело против человеческого гликофорина А (мышиное моноклональное антитело IgM, клон Е4) |
1 мг/л |
| Анти-CD15 антитело (мышиное моноклональное антитело IgM, клон МЕМ-158) |
1 мг/л |
| Анти-CD9 антитело (мышиное моноклональное антитело IgG, клон МЕМ-61) |
1 мг/л |
| Парамагнитные агглютинирующие частицы с антителом против человеческого CD72 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD72, клон BU40) |
2,63×109 частиц/л |
Результаты разделения представлены в Таблице 12. В данном супернатанте, обеднение эритроцитов составляло 99,9%, обеднение моноцитов было ниже обнаружимого уровня, обеднение гранулоцитов составляло 99,97%, обеднение В-клеток составляло 97,2%, а обеднение NK-клеток составляло 54,9%. Кроме того, количество тромбоцитов в супернатанте, которое до разделения составляло 226×106/мл, после разделения составляло 0,1×106/мл, что соответствовало обеднению на 99,96%.
| Таблица 12 |
| |
До разделения |
После разделения |
| Эритроциты на мл |
4,41×109 |
0,006×109 |
| Лейкоциты на мл |
5,9×106 |
2,3×106 |
| Лимфоциты (%) |
28,7 |
99,9 |
| Моноциты (%) |
8,69 |
0 |
| Гранулоциты (%) |
62,5 |
0,1 |
| Т-клетки (CD3+) |
19,7 |
92,4 |
| В-клетки (CD19+) |
4,46 |
0,59 |
| NK-клетки (CD16+) |
3,15 |
7,02 |
Пример 8: Агглютинация эритроцитов, CD15+-клеток, CD9+-клеток, CD19+-клеток и CD16+-клеток
Реагент, описанный в Таблице 13, использовали для разделения клеток способом, описанным в примере 1. Т-клетки и CD3+-клетки выделяли из супернатанта. В-клетки и гранулоциты выделяли из агглютината.
| Таблица 13 |
| Декстран (средняя молекулярная масса 413000) |
20 г/л |
| Модифицированный по Дульбекко и забуференный фосфатом физиологический раствор (10 х) |
100 мл/л |
| Сбалансированный солевой раствор Хенкса (рН 7,2-7,4) |
50 мл/л |
| Натриевая соль гепарина (10000 единиц/мл) |
1 мл/л |
| Антитело против человеческого гликофорина А (мышиное моноклональное антитело IgM, клон Е4) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Антитело против человеческого CD15 (мышиное моноклональное антитело IgM, клон МЕМ-158) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Антитело против человеческого CD9 (мышиное моноклональное антитело IgM, клон МЕМ-61) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Парамагнитные агглютинирующие частицы с анти-CD19 антителом (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD19, клон HIB19) |
0,1-30,0×109 частиц/л (предпочтительно, примерно 19,8×109 частиц/л) |
| Парамагнитные агглютинирующие частицы с анти-CD16 антителом (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD16, клон 3G8) |
5,5×1011 частиц/л |
Пример 9: Агглютинация эритроцитов, CD15+-клеток, CD9+-клеток, CD19+-клеток, CD16+-клеток и CD4+-клеток
Реагент, описанный в Таблице 14, использовали для разделения клеток способом, описанным в примере 1. CD8+-клетки выделяли из супернатанта.
| Таблица 14 |
| Декстран (средняя молекулярная масса 413000) |
20 г/л |
| Модифицированный по Дульбекко и забуференный фосфатом физиологический раствор (10 х) |
100 мл/л |
| Натриевая соль гепарина (10000 единиц/мл) |
1 мл/л |
| Сбалансированный солевой раствор Хенкса (рН 7,2-7,4) |
50 мл/л |
| Антитело против человеческого гликофорина А (мышиное моноклональное антитело IgM, клон Е4) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Антитело против человеческого CD15 (мышиное моноклональное антитело IgM, клон МЕМ-158) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Антитело против человеческого CD9 (мышиное моноклональное антитело IgM, клон МЕМ-61) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Парамагнитные агглютинирующие частицы с антителом против CD19 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD19, клон HIB19) |
0,1-30,0×109 частиц/л (предпоч-тительно, примерно 19,8×109 частиц/л) |
| Парамагнитные агглютинирующие частицы с антителом против CD16 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD16, клон 3G8) |
5,5×1011
частиц/л |
Парамагнитные агглютинирующие частицы с антителом против CD4 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD4, клон RFT4- или клон QS4120) или клон QS4120) |
1,2×1010
частиц/л |
Пример 10: Агглютинация эритроцитов, CD15+-клеток, CD9+-клеток, CD19+-клеток, CD16+-клеток и CD8+-клеток
Реагент, описанный в Таблице 15, использовали для разделения клеток способом, описанным в примере 1. CD8+-клетки выделяли из супернатанта.
| Таблица 15 |
| Декстран (средняя молекулярная масса 413000) |
20 г/л |
| Модифицированный по Дульбекко и забуференный фосфатом физиологический раствор (10 х) |
100 мл/л |
| Натриевая соль гепарина (10000 единиц/мл) |
1 мл/л |
| Сбалансированный солевой раствор Хенкса (рН 7,2-7,4) |
50 мл/л |
| Антитело против человеческого гликофорина А (мышиное моноклональное антитело IgM, клон Е4) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Антитело против человеческого CD15 (мышиное моноклональное антитело IgM, клон МЕМ-158) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Антитело против человеческого CD9 (мышиное моноклональное антитело IgM, клон МЕМ-61) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Парамагнитные агглютинирующие частицы с антителом против CD19 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD19, клон HIB19) |
0,1-30,0×109 частиц/л (предпочтительно, примерно 19,8×109 частиц/л) |
| Парамагнитные агглютинирующие частицы с антителом против CD16 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD16, клон 3G8) |
5,5×1011 частиц/л |
| Парамагнитные агглютинирующие частицы с антителом против CD8 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD8, клон HIT8а) |
7,92×109 частиц/л |
Пример 11: Агглютинация эритроцитов, CD15+-клеток, CD9+-клеток, CD19+-клеток и CD2+-клеток
Реагент, описанный в Таблице 16, использовали для разделения клеток способом, описанным в примере 1. CD34+-клетки выделяли из супернатанта с чистотой >50% и с выходом >80%.
| Таблица 16 |
| Декстран (средняя молекулярная масса 413000) |
20 г/л |
| Модифицированный по Дульбекко и забуференный фосфатом физиологический раствор (10 х) |
100 мл/л |
| Натриевая соль гепарина (10000 единиц/мл) |
1 мл/л |
| Сбалансированный солевой раствор Хенкса (рН 7,2-7,4) |
50 мл/л |
| Антитело против человеческого гликофорина А (мышиное моноклональное антитело IgM, клон Е4) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Антитело против человеческого CD15 (мышиное моноклональное антитело IgM, клон МЕМ-158) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Антитело против человеческого CD9 (мышиное моноклональное антитело IgM, клон МЕМ-61) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Парамагнитные агглютинирующие частицы с антителом против CD19 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD19, клон HIB19) |
0,1-30,0×109 частиц/л (предпочтительно, примерно 19,8×109 частиц/л) |
| Парамагнитные агглютинирующие частицы с антителом против CD2 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD2, клон d118.10.1) |
0,1-30,0×109 частиц/л (предпочтительно, примерно 3,0×1010 частиц/л) |
Пример 12: Агглютинация эритроцитов, CD15+-клеток, CD9+-клеток, CD2+-клеток и CD16+-клеток
Реагент, описанный в Таблице 17, использовали для разделения клеток способом, описанным в примере 1. В-клетки выделяли из супернатанта.
| Таблица 17 |
| Декстран (средняя молекулярная масса 413000) |
20 г/л |
| Модифицированный по Дульбекко и забуференный фосфатом физиологический раствор (10 х) |
100 мл/л |
| Натриевая соль гепарина (10000 единиц/мл) |
1 мл/л |
| Сбалансированный солевой раствор Хенкса (рН 7,2-7,4) |
50 мл/л |
| Антитело против человеческого гликофорина А (мышиное моноклональное антитело IgM, клон Е4) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Антитело против человеческого CD15 (мышиное моноклональное антитело IgM, клон МЕМ-158) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Антитело против человеческого CD9 (мышиное моноклональное антитело IgM, клон МЕМ-61) |
0,1-15 мг/л (предпочтительно, примерно 1,0 мг/л) |
| Парамагнитные агглютинирующие частицы с антителом против CD2 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD2, клон d118.10.1) |
0,1-30,0х109 частиц/л (предпочтительно, примерно 3,0х1010 частиц/л) |
| Парамагнитные агглютинирующие частицы с антителом против CD16 (покрытые авидином парамагнитные полистироловые частицы диаметром 4,3 микрон, меченные насыщающими дозами меченного биотином мышиного антитела против человеческого CD16, клон 3G8) |
5,5х1011 частиц/л |
Пример 13: Агглютинация эритроцитов, зрелых миелоидных клеток, NK-клеток и В-клеток
Реагент, описанный в Таблице 18, использовали для разделения клеток способом, описанным в примере 1. Для коррекции рН до 7,2-7,4 использовали соляную кислоту (4н) или гидроксид натрия (4н). Антитела против CD8, CD16, CD19, CD94 и CD161 биотинилировали. Клеточную суспензию, обогащенную CD4-Т-клетками, получали из супернатанта. Приблизительно 75-94% CD4-клеток выделяли из каждого образца цельной крови (на Фиг.1 представлены репрезентативные данные для пяти доноров). Для сравнения, в других коммерчески доступных продуктах, используемых для разделения в градиенте плотности, выход клеток составлял 50% или менее. В среднем чистота CD4-клеток составляла 96,1% (см. Фиг.2, репрезентативные данные для 12 доноров), тогда как средняя чистота CD4-клеток, очищенных с использованием других коммерчески доступных продуктов, которые были использованы для разделения в градиенте плотности, составляла 86,7%.
| Таблица 18 |
| Декстран (средняя молекулярная масса 413000) |
2% |
| Натриевая соль гепарина (10000 единиц/мл) |
1 ед/л |
| Сбалансированный солевой раствор Хенкса (рН 7,2-7,4) |
до конечного объема |
| Антитело против человеческого гликофорина А (мышиное моноклональное антитело IgM, клон Е4) |
разведение 1:40 |
| Антитело против человеческого CD15 (мышиное моноклональное антитело IgM, клон МЕМ-158) |
1 мг/л |
| Антитело против человеческого CD9 (мышиное моноклональное антитело IgM, клон МЕМ-61) |
1 мг/л |
| Антитело против человеческого CD8 (клон HIT8a) |
1 мг/л |
| Антитело против человеческого CD16 (клон 3G8) |
1 мг/л |
| Антитело против человеческого CD19 (клон HIB19) |
1 мг/л |
| Антитело против человеческого CD94 (клон HP-3D9) |
0,125 мг/мл |
| Антитело против человеческого CD161 (клон В199.2) |
0,25 мг/мл |
Пример 14: Агглютинация эритроцитов, зрелых миелоидных клеток, NK-клеток и В-клеток
Реагент, описанный в Таблице 19, использовали для разделения клеток способом, описанным в примере 1. Для коррекции рН до 7,2-7,4 использовали соляную кислоту (4н.) или гидроксид натрия (4н.). Антитела против CD4, CD16, CD19, CD94 и CD161 биотинилировали. Клеточную суспензию, обогащенную CD8-Т-клетками, получали из супернатанта. Приблизительно 53-81% CD8-клеток выделяли из каждой пробы цельной крови (на Фиг.3 представлены репрезентативные данные для пяти доноров). Для сравнения, при использовании других коммерчески доступных продуктов, необходимых для разделения в градиенте плотности, выход клеток составлял менее 52%, а обычно выход клеток составлял менее 35%. В среднем чистота CD8-клеток составляла 93,9% (см. Фиг.4, репрезентативные данные для 12 доноров), тогда как средняя чистота CD8-клеток, очищенных с использованием других коммерчески доступных продуктов, составляла 84,2%.
| Таблица 19 |
| Декстран (средняя молекулярная масса 413000) |
2% |
| Натриевая соль гепарина (10000 единиц/мл) |
1 ед/л |
| Сбалансированный солевой раствор Хенкса (рН 7,2-7,4) |
до конечного объема |
| Антитело против человеческого гликофорина А (мышиное моноклональное антитело IgM, клон Е4) |
разведение 1:40 |
| Антитело против человеческого CD15 (мышиное моноклональное антитело IgM, клон МЕМ-158) |
1 мг/л |
| Антитело против человеческого CD9 (мышиное моноклональное антитело IgM, клон МЕМ-61) |
1 мг/л |
| Антитело против человеческого CD4 (клон QS4120) |
1 мг/л |
| Антитело против человеческого CD16 (клон 3G8) |
1 мг/л |
| Антитело против человеческого CD19 (клон HIB19) |
1 мг/л |
| Антитело против человеческого CD94 (клон HP-3D9) |
0,25 мг/мл |
| Антитело против человеческого CD161 (клон В199.2) |
1 мг/мл |
Другие варианты осуществления изобретения
Хотя настоящее изобретение подробно изложено в представленном выше описании и в примерах, однако эти примеры и описание приводятся лишь в иллюстративных целях и не должны рассматриваться как ограничение объема изобретения, определенного в прилагаемой формуле изобретения. Другие аспекты, преимущества и модификации входят в объем формулы изобретения.
Формула изобретения
1. Композиция для разделения клеток, содержащая:
a) декстран;
b) антитело против гликофорина А;
c) анти-CD15 антитело;
d) анти-CD9 антитело;
e) анти-СD94 антитело;
f) анти-CD161 антитело.
2. Композиция по п.1, где указанная композиция дополнительно содержит анти-CD72 антитело.
3. Композиция по п.1, где указанная композиция дополнительно содержит анти-CD4 антитело, анти-CD16 антитело и анти-CD19 антитело.
4. Композиция по п.1, где указанная композиция дополнительно содержит анти-CD8 антитело, анти-CD16 антитело и анти-CD19 антитело.
5. Композиция по п.1, где указанная композиция дополнительно содержит анти-CD2 антитело.
6. Композиция по п.1, где указанная композиция дополнительно содержит гепарин.
7. Композиция по п.1, где указанная композиция дополнительно содержит двухвалентные катионы.
8. Композиция по п.7, где указанными двухвалентными катионами являются Са2+.
9. Композиция по п.7, где указанными двухвалентными катионами являются Mg2+.
10. Композиция по п.1, где указанная композиция дополнительно содержит забуференный фосфатом физиологический раствор.
11. Композиция по п.1, где рН указанной композиции составляет 6,8-7,8.
12. Композиция по п.1, где рН указанной композиции составляет 7,2-7,4.
13. Композиция по п.1, где указанное антитело против гликофорина А является моноклональным.
14. Композиция по п.1, где указанное антитело против гликофорина А представляет собой антитело IgM или антитело IgG.
15. Композиция по п.1, где указанным антителом против гликофорина А является антитело против человеческого гликофорина А.
16. Композиция по п.1, где концентрация указанного антитела против гликофорина А составляет примерно от 0,1 до 15 мг/л.
17. Композиция по п.1, где указанным анти-CD15 антителом является моноклональное антитело.
18. Композиция по п.1, где указанным анти-CD15 антителом является антитело IgM или антитело IgG.
19. Композиция по п.1, где указанным анти-СD15 антителом является антитело против человеческого CD15.
20. Композиция по п.1, где концентрация указанного анти-CD15 антитела составляет примерно от 0,1 до 15 мг/л.
21. Композиция по п.1, где указанным анти-СD9 антителом является моноклональное антитело.
22. Композиция по п.1, где указанным анти-CD9 антителом является антитело IgM или антитело IgG.
23. Композиция по п.1, где указанным анти-СD9 антителом является антитело против человеческого CD9.
24. Композиция по п.1, где концентрация указанного анти-CD9 антитела составляет примерно от 0,1 до 15 мг/л.
25. Композиция по п.1, где концентрация указанного анти-CD94 антитела составляет от 0,01 до 10 мг/л.
26. Композиция по п.1, где концентрация указанного анти-CD161 антитела составляет от 0,01 до 10 мг/л.
27. Композиция по п.1, где указанным анти-CD94 антителом является антитело IgM или IgG.
28. Композиция по п.1, где указанным анти-CD161 антителом является антитело IgM или IgG.
29. Композиция по п.1, где указанным анти-CD94 антителом является антитело против человеческого CD94.
30. Композиция по п.1, где указанным анти-CD161 антителом является антитело против человеческого CD161.
31. Композиция для разделения клеток, содержащая:
a) декстран;
b) антитело против гликофорина А;
c) анти-CD15 антитело;
d) анти-CD9 антитело;
e) анти-CD4 антитело или анти-CD8 антитело;
f) анти-CD16 антитело;
g) анти-CD19 антитело;
h) анти-CD94 антитело;
i) анти-CD161 антитело;
j) гепарин; и
k) двухвалентные катионы.
32. Композиция по п.31, где указанная композиция содержит анти-CD4 антитело.
33. Композиция по п.31, где указанная композиция содержит анти-CD8 антитело.
34. Композиция по п.31, где, по крайней мере, одно из указанных антител является биотинилированным.
35. Композиция по п.34, где указанное анти-CD16 антитело, указанное анти-CD19 антитело, указанное анти-СD94 антитело и указанное анти-CD161 антитело являются биотинилированными.
36. Набор для разделения клеток, содержащий сосуд для сбора крови и композицию для разделения клеток по п.31.
37. Набор по п.36, где указанным сосудом для сбора крови является мешок для сбора крови.
38. Набор по п.36, где указанным сосудом для сбора крови является вакуумная пробирка.
39. Способ разделения клеток, предусматривающий:
a) контактирование образца, содержащего клетки крови, с композицией, содержащей:
i) декстран,
ii) антитело против гликофорина А,
iii) анти-CD15 антитело,
iv) анти-CD9 антитело,
v) анти-CD94 антитело,
vi) анти-CD161 антитело;
b) разделение указанного образца на фазы агглютината и супернатанта;
c) выделение указанных клеток.
40. Способ по п.39, где указанная композиция дополнительно содержит анти-CD4 антитело, анти-CD16 антитело и анти-CD19 антитело.
41. Способ по п.39, где указанная композиция дополнительно содержит анти-CD8 антитело, анти-CD16 антитело и анти-CD19 антитело.
42. Способ по п.39, где указанный образец взят у человека.
43. Способ по п.42, где указанным образцом является проба периферической крови.
44. Способ по п.42, где указанным образцом является образец пупочного канатика.
45. Способ по п.42, где указанным образцом является образец костного мозга.
46. Способ по п.42, где указанными клетками являются метастатические опухолевые клетки.
47. Способ по п.42, где указанные клетки выделяют из указанной фазы супернатанта.
48. Способ по п.47, где указанными клетками являются стволовые клетки.
49. Способ по п.39, где указанное анти-CD94 антитело и указанное анти-CD161 антитело являются биотинилированными.
50. Способ по п.49, где выделение указанных клеток предусматривает: контактирование указанной фазы супернатанта с композицией, содержащей покрытые авидином частицы; разделение указанной фазы супернатанта и указанной композиции; и выделение клеток из указанной фазы супернатанта.
РИСУНКИ
|
|