|
|
(21), (22) Заявка: 2003122076/13, 18.07.2003
(24) Дата начала отсчета срока действия патента:
18.07.2003
(30) Конвенционный приоритет:
19.07.2002 DE 10232930.3
(43) Дата публикации заявки: 27.02.2005
(46) Опубликовано: 10.02.2009
(56) Список документов, цитированных в отчете о
поиске:
ЕР 0885962, 23.12.1998. WO 9715673, 01.05.1997. DASSLER T et.al. Identification of major facilitator protein from Escherichia coli involved in efflux of metabolites of the cysteine pathway. Mol.Microbiol. 2000 Jun, 36(5), 1101-12. RU 2154671 C1, 20.08.2000.
Адрес для переписки:
101000, Москва, М.Златоустинский пер., д.10, кв.15, “ЕВРОМАРКПАТ”, пат.пов. И.А.Веселицкой, рег.№ 0011
|
(72) Автор(ы):
МАЙЕР Томас (DE)
(73) Патентообладатель(и):
Ваккер Хеми АГ (DE)
|
(54) СПОСОБ ФЕРМЕНТАТИВНОГО ПОЛУЧЕНИЯ АМИНОКИСЛОТ И ПРОИЗВОДНЫХ АМИНОКИСЛОТ ИЗ СЕМЕЙСТВА ФОСФОГЛИЦЕРАТОВ
(57) Реферат:
Изобретение относится к биотехнологии и представляет собой способ получения аминокислот из семейства фосфоглицератов с использованием клеток Escherichia coli, пригодных для ферментативного получения аминокислот и имеющих повышенную активность продукта гена yfiK. Клетки Escherichia coli получают путем трансформации исходных клеток плазмидой, которая содержит ген yfiK и промотор. Изобретение позволяет получать аминокислоты из семейства фосфоглицератов с высокой степенью эффективности. 2 н. и 12 з.п. ф-лы, 1 ил., 3 табл.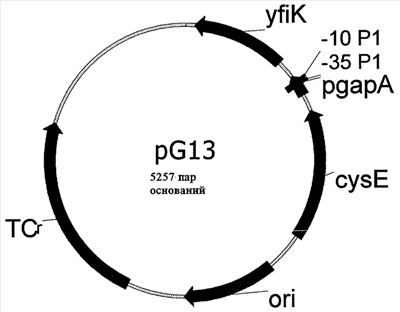
Настоящее изобретение относится к способу получения аминокислот и производных аминокислот из семейства фосфоглицератов, таких, например, как О-ацетил-L-серин, N-ацетил-L-серин, L-цистеин, LL-цистин и производные L-цистеина, путем ферментации.
В настоящее время двадцать встречающихся в естественных условиях протеиногенных аминокислот получают преимущественно путем ферментации с использованием микроорганизмов. При этом используется способность микроорганизмов к биосинтезу встречающихся в естественных условиях аминокислот.
Однако у штаммов дикого типа подобные процессы биосинтеза находятся под строгим контролем, обеспечивающим продуцирование аминокислот лишь в таких количествах, которые необходимы для удовлетворения собственных потребностей клетки в таких аминокислотах. Поэтому для эффективного получения аминокислот в промышленном масштабе важно располагать соответствующими микроорганизмами, которые в отличие от микроорганизмов дикого типа способны в результате их жизнедеятельности продуцировать требуемую аминокислоту в существенно больших количествах.
Подобные микроорганизмы, способные к сверхпродуцированию аминокислот, можно создавать классическими методами мутации/отбора и/или современными методами целенаправленной рекомбинации (“метаболическое конструирование”). В последнем случае сначала идентифицируют гены или аллели, которые в результате их изменения, активации или инактивации вызывают сверхпродуцирование аминокислот. Затем такие гены, соответственно аллели вводят методами молекулярной биологии в штамм микроорганизма или инактивируют таким образом, чтобы обеспечить оптимальное сверхпродуцирование аминокислот. Однако действительно эффективного продуцирования микроорганизмами аминокислот часто удается достичь лишь за счет использования нескольких различных мер в их сочетании.
Характерная особенность аминокислот из семейства фосфоглицератов состоит в том, что они в процессе их биосинтеза образуются исходя из 3-фосфоглицериновой кислоты. При этом в ходе естественного метаболизма сначала через образование промежуточных 3-фосфогидроксипирувата и 3-фосфо-L-серина образуется L-серин. В последующем этот L-серин может превращаться в глицин, соответственно через образование промежуточного O-ацетил-L-серина – в L-цистеин.
Из уровня техники уже известны некоторые, описанные ниже гены, соответственно аллели, которые могут использоваться для ферментативного получения аминокислот из семейства фосфоглицератов, прежде всего L-серина и L-цистеина, и применение которых приводит к сверхпродуцированию аминокислот:
– аллели serA, которые описаны в ЕР 0620853 В1 или в ЕР 0931833 А2 и которые кодируют 3-фосфоглицерат-дигидрогеназы, для которых характерно пониженное ингибирование обратной связи L-серином, вследствие чего образование 3-гидроксипирувата оказывается практически не связанным с уровнем серина в клетке;
– аллели cysE, которые описаны в заявке WO 97/15673 (которая включена в настоящее описание в качестве ссылки), в статье Nakamori S. и др., Appl. Env.Microbiol. 64, 1998, cc.1607-1611 (которая включена в настоящее описание в качестве ссылки), или у Takagi Н. и др., FEBS Lett. 452, 1999, cc.323-327, и которые встраивали в штамм микроорганизма, при этом такие аллели cysE кодируют серин-O-ацетилтрансферазы, для которых характерно пониженное ингибирование обратной связи L-цистеином, вследствие чего образование O-ацетил-L-серина, соответственно L-цистеина оказывается практически не связанным с уровнем цистеина в клетке;
– гены оттока, которые описаны в ЕР 0885962 А1, при этом описанный в указанной публикации ген orf предположительно кодирует систему оттока, которая пригодна для выведения из организма антибиотиков и других токсических веществ и которая обусловливает сверхпродуцирование L-цистеина, L-цистина, N-ацетилсерина и/или производных тиазолидина;
– ген cysB, который описан в DE 19949579 С1 и который кодирует центральный генный регулятор пути метаболизма серы и тем самым играет решающую роль в обеспечении процесса биосинтеза цистеина сульфидом.
Из уровня техники известно далее, что описанными выше методами можно также получать производные цистеина. Так, в частности, путем ферментации можно получать LL-цистин в качестве продукта окисления L-цистеина или 2-метилтиазолидин-2,4-дикарбоновую кислоту в качестве продукта конденсации L-цистеина и пирувата. Поскольку L-цистеин является основным источником серы для клетки, описанные методы могут служить отправной точкой для получения самых разнообразных серосодержащих метаболитов (например, L-метионина, (+)-биотина, тиамина и т.д.), которые в контексте настоящего описания обозначаются обобщающим понятием “производные L-цистеина”.
Из литературных источников известно далее, что при соответствующем подходе при ферментации в качестве основного ее продукта могут образовываться также такие аминокислоты, как N-ацетил-L-серин (ЕР 0885962 А1), соответственно О-ацетил-L-серин (DE 10107002 А). В свою очередь из содержащего N-ацетил-L-серин ферментационного бульона можно сравнительно просто получить L-серин, как это описано в DE 10219851 А.
В основу настоящего изобретения была положена задача создать рекомбинантный штамм микроорганизма, который обладал бы способностью сверхпродуцировать аминокислоты или производные аминокислот из семейства фосфоглицератов. Еще одна задача изобретения состояла в разработке способа ферментативного получения аминокислот или производных аминокислот из семейства фосфоглицератов с использованием таких рекомбинантных штаммов микроорганизмов.
Первая из указанных выше задач решается согласно изобретению с помощью штамма микроорганизма, пригодного для ферментативного получения аминокислот из семейства фосфоглицератов или их производных и создаваемого из исходного штамма, при этом такой штамм отличается тем, что он по сравнению с исходным штаммом характеризуется повышенной активностью продукта гена yfiK или генного продукта гомолога гена yfiK.
Согласно настоящему изобретению повышение активности продукта гена yfiK имеет место в том случае, когда в результате увеличения количества генного продукта в клетке повышается общая активность в клетке и тем самым, несмотря на практически неизменную удельную активность продукта гена yfiK, активность такого продукта из расчета на одну клетку возрастает.
Ген yfiK Escherichia coli, который был идентифицирован при секвенировании генома (Blattner и др., Science 277, 1997, cc.1453-1462) в виде открытой рамки считывания, кодирует протеин, состоящий из 195 аминокислот. До настоящего времени с геном yfiK не удавалось соотнести какой-либо физиологической функции. Поиск протеинов с гомологией последовательностей в банке данных (с использованием алгоритма FASTA из пакета программ GCG Wisconsin Package, разработанного фирмой Genetics Computer Group (GLG), Мэдисон, шт.Висконсин) также не дал практически никаких результатов, поскольку было выявлено сходство лишь с теми протеинами, функции которых также неизвестны. Единственной отправной точкой для выявления возможной активности продукта гена yfiK является информация, которую можно найти в работе Aleshin и др. (Trends in Biol. Sci., 24, 1999, cc.133-135). В этой работе постулируется существование структурного мотива, наличие которого должно быть характерно для семейства протеинов, способствующих оттоку аминокислот. Поскольку подобный слабый консенсусный мотив встречается также в протеине YfiK, такой протеин YfiK предположительно может представлять собой систему оттока аминокислот. Однако для специалиста в данной области на основе таких сведений абсолютно невозможно сделать вывод о конкретном аминокислотном субстрате протеина YfiK. Тот факт, что продукт гена yfiK оказывает положительное влияние на продуцирование аминокислот из семейства фосфоглицератов, является неожиданным прежде всего постольку, поскольку в Escherichia coli в качестве генного продукта YdeD уже был охарактеризован протеин, способствующий оттоку аминокислот из семейства фосфоглицератов (DaBler и др., Mol. Microbiol., 36, 2000, cc.1101-1112), а существование второй системы является полностью неожиданным. Интерес представляет также отсутствие структурного сходства между продуктами генов yfiK и ydeD.
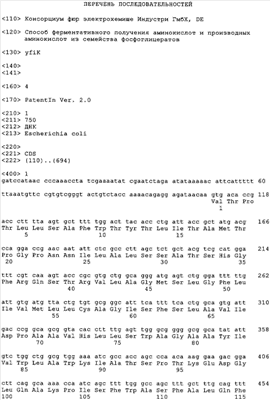
Ген yfiK и генный продукт YfiK (протеин YfiK) характеризуются последовательностями SEQ ID No.1, соответственно SEQ ID No.2. В контексте настоящего изобретения к гомологам гена yfiK относят те гены, идентичность последовательностей которых по данным анализа с использованием алгоритма BESTFIT (пакет программ GCG Wisconsin Package фирмы Genetics Computer Group (GLG), Мэдисон, шт.Висконсин) превышает 30%. Наиболее предпочтительной является идентичность последовательностей, превышающая 70%.
Равным образом к гомологам протеина YfiK следует отнести те протеины, идентичность последовательностей которых по данным анализа с использованием алгоритма BESTFIT (пакет программ GCG Wisconsin Package фирмы Genetics Computer Group (GLG), Мэдисон, штат Висконсин) превышает 30%. Наиболее предпочтительной является идентичность последовательностей, превышающая 70%.
В соответствии с этим под гомологами гена yfiK подразумеваются также аллельные варианты гена yfiK и прежде всего те функционально активные варианты, которые можно получить из представленной в SEQ ID No.1 последовательности путем делеции, инсерции или замены нуклеотидов, при этом, однако, соответствующий генный продукт должен сохранять ферментативную активность.
Предлагаемые в изобретении микроорганизмы, которые обладают повышенной по сравнению с исходным штаммом активностью продукта гена yfiK, можно получать стандартными методами молекулярной биологии.
В качестве исходного штамма в принципе можно использовать все организмы, которые способны к биосинтезу аминокислот из семейства фосфоглицератов и которые допускают возможность применения к ним методов рекомбинации и их культивирования путем ферментации. Такими микроорганизмами могут служить грибы, дрожжи или бактерии. Предпочтительны при этом бактерии, относящиеся к филогенетической группе Eubacteria, наиболее предпочтительны микроорганизмы из семейства Enterobacteriaceae и прежде всего вида Escherichia coli.
Повышение активности продукта гена yfiK в предлагаемом в изобретении микроорганизме достигается, например, за счет усиления экспрессии гена yfiK. При этом можно увеличивать количество копий гена yfiK в микроорганизме и/или повышать экспрессию гена yfiK с помощью соответствующих промоторов. Под усиленной экспрессией при этом преимущественно подразумевается экспрессия гена yfiK, которая по меньшей мере в два раза превышает экспрессию, характерную для исходного штамма.
Увеличивать количество копий гена yfiK в микроорганизме можно с помощью известных специалисту методов. Так, например, ген yfiK можно клонировать в плазмидных векторах, способных многократно увеличивать количество копий на одну клетку (например, в плазмидных векторах pUC19, pBR322, pACYC184 для Escherichia coli), и затем встраивать в микроорганизм. В другом варианте ген yfiK можно многократно интегрировать в хромосому микроорганизма. Для такой интеграции можно использовать известные системы с темперированными бактериофагами или интеграционные плазмиды либо осуществлять интеграцию с помощью гомологичной рекомбинации (см., например, Hamilton и др., J.Bacteriol., 171, 1989, cc.4617-4622).
Увеличивать количество копий гена yfiK предпочтительно путем его клонирования в плазмидных векторах под контролем промотора. Наиболее предпочтительным является увеличение количества копий в Escherichia coli путем клонирования гена yfiK в плазмиде, являющейся производной плазмиды pACYC, такой, например, как плазмида pACYC184-LH (которая в соответствии с Будапештским договором была депонирована 18.08.95 в Немецкой коллекции микроорганизмов и клеточных культур, Брауншвейг, под регистрационным номером DSM 10172).
В качестве контролирующей области для экспрессии кодируемого плазмидой гена yfiK могут служить встречающиеся в естественных условиях промоторная и операторная области гена.
Однако усиленной экспрессии гена yfiK можно прежде всего достичь также с помощью других промоторов. Соответствующие промоторные системы, которыми, например, для Escherichia coli являются конститутивный GAPDH-промотор гена gapA или индуцибельные lac-, tac-, trc-, lambda-, ara- или tet-промоторы, хорошо известны в данной области (Makrides S.C., Microbiol. Rev., 60, 1996, cc.512-538). Подобные конструкции можно по известным методам использовать в составе плазмид или встраивать в хромосому.
Помимо этого усиленная экспрессия может достигаться при наличии в соответствующей конструкции расположенных в оптимальной последовательности сигналов инициации трансляции, таких, например, как сайт связывания рибосомы или инициирующий кодон гена, либо в результате замены редко встречающихся кодонов на основе данных о “наиболее часто встречающихся кодонах” на более часто встречающиеся кодоны.
Штаммы микроорганизмов, имеющие указанные модификации, являются предпочтительными объектами настоящего изобретения.
Клонировать ген yfiK в плазмидных векторах можно, например, путем специфической амплификации с помощью полимеразной цепной реакции с использованием специфических праймеров, действие которых распространяется на весь ген yfiK, и последующего лигирования с фрагментами векторной ДНК.
Предпочтительными векторами, используемыми для клонирования гена yfiK, являются плазмиды, которые уже содержат промоторы, обеспечивающие усиленную экспрессию, например, содержат конститутивный GAPDH-промотор гена gapA Escherichia coli.
В соответствии с этим изобретение относится также к плазмиде, которая отличается тем, что она содержит ген yfiK совместно с промотором.
Особо предпочтительны далее векторы, которые уже содержат ген/аллель, использование которого приводит к сверхпродуцированию аминокислот из семейства фосфоглицератов, например, содержат ген cysEX (WO 97/15673). Подобные векторы позволяют создавать предлагаемые в изобретении штаммы микроорганизмов, обладающие высокой способностью к сверхпродуцированию аминокислот, непосредственно из любого штамма микроорганизма, поскольку такая плазмида уменьшает ингибирование обратной связи пути метаболизма цистеина в микроорганизме.
В соответствии с этим изобретение относится также к плазмиде, которая отличается тем, что она содержит генетический элемент, обусловливающий нарушение регуляции пути метаболизма цистеина, а также ген yfiK совместно с промотором.
Содержащие ген yfiK плазмиды можно встраивать в микроорганизмы традиционными методами трансформации (например, электропорации) и осуществлять отбор несущих плазмиду клонов, например, по признаку устойчивости к антибиотикам.
В соответствии с этим изобретение относится также к способу создания предлагаемых в нем штаммов микроорганизмов, который отличается тем, что в исходный штамм встраивают предлагаемую в изобретении плазмиду.
Аминокислоты из семейства фосфоглицератов получают с использованием предлагаемых в изобретении штаммов микроорганизмов в ферментере по хорошо известным методам.
В соответствии с этим изобретение относится также к способу получения аминокислот из семейства фосфоглицератов, который отличается тем, что для ферментации используют предлагаемый в изобретении штамм микроорганизма и образовавшуюся аминокислоту выделяют из сбраживаемой среды.
Выращивать штамм микроорганизма в ферментере можно путем непрерывного культивирования, периодического культивирования или предпочтительно периодического культивирования с подпиткой. В процессе ферментации наиболее предпочтительно непрерывно добавлять источник углерода.
В качестве источника углерода предпочтительно использовать сахара, сахароспирты или органические кислоты. При осуществлении предлагаемого в изобретении способа в качестве источников углерода наиболее предпочтительно использовать глюкозу, лактозу или глицерин.
Источник углерода предпочтительно добавлять в такой форме, чтобы его содержание в ферментере в процессе ферментации составляло от 0,1 до 50 г/л. Наиболее предпочтительное содержание источника углерода в ферментере составляет от 0,5 до 10 г/л.
В качестве источника азота при осуществлении предлагаемого в изобретении способа предпочтительно использовать аммиак, аммонийные соли или протеиновые гидролизаты. При использовании аммиака в качестве корректирующего средства для стабилизации значения рН такой источник азота следует регулярно добавлять в процессе ферментации.
В качестве других добавок к культуральной среде можно добавлять соли таких элементов, как фосфор, хлор, натрий, магний, азот, калий, кальций и железо, а также в следовых количествах (т.е. в микромолярных концентрациях) соли таких элементов, как молибден, бор, кобальт, марганец, цинк и никель.
Помимо этого к культуральной среде можно добавлять органические кислоты (например, в виде ацетата, цитрата), аминокислоты (например, изолейцин) и витамины (например, B1, B6).
В качестве комплексных источников питательных веществ можно использовать, например, дрожжевой экстракт, жидкость, образующуюся после замачивания зерен кукурузы до набухания, соевую муку или солодовый экстракт.
Температура инкубации для мезофильных микроорганизмов составляет предпочтительно от 15 до 45°С, наиболее предпочтительно от 30 до 37°С.
Процесс ферментации предпочтительно проводить в аэробных условиях роста микроорганизмов. Вводить кислород в культуральную среду, содержащуюся в ферментере, можно подачей в него сжатого воздуха или чистого кислорода.
Значение рН сбраживаемой среды в процессе ферментации составляет предпочтительно от 5,0 до 8,5, наиболее предпочтительно 7,0. При необходимости получения предлагаемым в изобретении способом О-ацетил-L-серина значение рН сбраживаемой среды наиболее предпочтительно поддерживать в пределах от 5,5 до 6,5.
Для получения L-цистеина и его производных в процессе ферментации необходимо добавлять источник серы. В этом случае предпочтительно использовать сульфаты или тиосульфаты.
Микроорганизмы, с использованием которых проводят ферментацию в соответствии с описанным выше способом, в периодическом процессе или в периодическом процессе с подпиткой после фазы роста в течение 10-150 ч с высокой эффективностью выделяют в культуральную среду аминокислоты из семейства фосфоглицератов.
Ниже изобретение более подробно рассмотрено на примерах.
Пример 1: Клонирование гена yfiK
Ген yfiK из штамма Escherichia coli W3110 амплифицировали с помощью полимеразной цепной реакции. При этом в качестве специфических праймеров использовали следующие олигонуклеотиды:
yfiK-fw (SEQ. ID. NO:3):
5′-GGA ATT CAT TAA TGA ТСС АТА АСС ССА ААС СТА ТС-3′ и
yfiK-rev (SEQ. ID. NO:4):
5′-GCC TTA ATT AAG TAG CAA GTT ACT AAG CGG AAG-3′.
Полученный в результате фрагмент ДНК расщепляли рестриктазами Asnl и PaCl, очищали с помощью электрофореза на агарозном геле и выделяли (набор для гель-экстракции Qiaquick Gel Extraction Kit фирмы Qiagen, Гильден, Германия). Клонирование осуществляли путем лигирования с расщепленным рестриктазами NdeI/PacI вектором pACYC184-cysEX-GAPDH, который подробно описан в ЕР 0885962 А1. Этот вектор содержит ген cysEX, который кодирует серинацетилтрансферазу с пониженным ингибированием обратной связи L-цистеином и расположенный на 3′-конце этого гена cysEX конститутивный GAPDH-промотор гена gapA. Описанный подход позволяет поместить ген yfiK за GAPDH-промотором таким образом, чтобы транскрипция могла инициироваться из этого положения. Полученный вектор, который обозначили как pG13, схематично изображен на прилагаемом к описанию чертеже. После проверки правильности конструкции ею трансформировали штамм Escherichia coli W3110 и осуществляли отбор соответствующих трансформантов с использованием тетрациклина. Штамм бактерии Escherichia coli W3110/pG13, который в соответствии с Будапештским договором был депонирован в Немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung fur Mikroorganismen und Zellkulturen GmbH (DSMZ), D-38142, Брауншвейг) под регистрационным номером DSM 15095, использовали в приведенных ниже примерах в качестве штамма-продуцента для получения аминокислот из семейства фосфоглицератов. В качестве сравнительного штамма, сравнение с которым позволяет продемонстрировать эффект от повышенной экспрессии гена yfiK, был выбран штамм W3110/pACYC184-cysEX, который подробно также описан в ЕР 0885962 А1, но который в отличие от pG13 не содержит последовательности GAPDH-промотор-yfiK.
Пример 2: Получение предварительной культуры штамма-продуцента
Для получения предварительной культуры для ферментации в 20 мл среды LB (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl), которая дополнительно содержала 15 мг/л тетрациклина, вносили штамм W3110/pG13, соответственно штамм W3110/pACYC184-cysEX и инкубировали в шюттель-аппарате при 30°С и 150 об/мин. Через 7 ч всю смесь переносили в 100 мл среды SM1 (12 г/л K2HPO4, 3 г/л KH2PO4, 5 г/л (NH4)2SO4, 0,3 г/л MgSO4×7H2O, 0,015 г/л CaCl2×2H2O, 0,002 г/л FeSO4×7H2O, 1 г/л Na3-цитрата×2Н2O, 0,1 г/л NaCl, 1 мл/л раствора микроэлементов, содержащего 0,15 г/л Na2MoO4×2H2O, 2,5 г/л Na3ВО3, 0,7 г/л CoCl2×6H2O, 0,25 г/л CuSO4×5H2O, 1,6 г/л MnCl2×4Н2O, 0,3 г/л ZnSO4×7H2O), дополненную 5 г/л глюкозы, 0,5 мг/л витамина B1 и 15 мг/л тетрациклина. Дальнейшую инкубацию проводили в течение 17 ч при 30°С и 150 об/мин.
Пример 3: Ферментативное получение О-ацетил-L-серина
В качестве ферментера использовали аппарат Biostat М фирмы Braun Biotech (Мельзунген, Германия) с максимальной вместимостью для культуральной среды, равной 2 л. В ферментер загружали 900 мл среды SM1, дополненной 15 г/л глюкозы, 0,1 г/л триптона, 0,05 г/л дрожжевого экстракта, 0,5 мг/л витамина B1 и 15 мг/л тетрациклина, и в эту среду вносили описанную в примере 2 предварительную культуру (с оптической плотностью при 600 нм, равной примерно 3). В процессе ферментации температуру регулированием устанавливали на 32°С и значение рН поддерживали на постоянном уровне в 6,0 добавлением 25%-ного раствора аммиака. Культуру барботировали обеззараженным (стерилизованным) сжатым воздухом с расходом 1,5 единицы объема на единицу объема среды в минуту и перемешивали мешалкой, вращавшейся с частотой 200 об/мин. После снижения степени насыщения среды кислородом до 50% частоту вращения мешалки повышали с помощью регулятора до 1200 об/мин для поддержания степени насыщения среды кислородом на этом 50%-ном уровне (степень насыщения кислородом измеряли с помощью pO2-зонда, откалиброванного на 100%-ное насыщение при 900 об/мин). После снижения концентрации глюкозы в ферментере с первоначальных 15 г/л до примерно 5-10 г/л добавляли 56%-ный раствор глюкозы. При этом глюкозу добавляли с расходом 6-12 мл/ч, поддерживая ее концентрацию на постоянном уровне в пределах от 0,5 до 10 г/л. Концентрацию глюкозы определяли с помощью анализатора глюкозы фирмы YSI (Йеллоуспрингс, шт.Огайо, США). Продолжительность ферментации составляла 28 ч. По истечении этого времени брали пробы культуральной среды и клетки отделяли от нее центрифугированием. Образовавшуюся в результате центрифугирования надосадочную жидкость культуры анализировали с помощью ЖХВР с обращенной фазой на колонке типа LUNA 5  С18(2) (фирма Phenomenex, Ашаффенбург, Германия) при скорости потока 0,5 мл/мин. В качестве элюента использовали разбавленную фосфорную кислоту (0,1 мл концентрированной фосфорной кислоты на л). В таблице 1 представлены данные о содержании основных метаболитов в надосадочной жидкости культуры. Этими метаболитами являются О-ацетил-L-серин и N-ацетил-L-серин, который в условиях, варьирующихся от нейтральных до щелочных, образуется в возрастающих по мере перехода от нейтральных к щелочным значениям рН количествах из О-ацетил-L-серина в результате изомеризации. С18(2) (фирма Phenomenex, Ашаффенбург, Германия) при скорости потока 0,5 мл/мин. В качестве элюента использовали разбавленную фосфорную кислоту (0,1 мл концентрированной фосфорной кислоты на л). В таблице 1 представлены данные о содержании основных метаболитов в надосадочной жидкости культуры. Этими метаболитами являются О-ацетил-L-серин и N-ацетил-L-серин, который в условиях, варьирующихся от нейтральных до щелочных, образуется в возрастающих по мере перехода от нейтральных к щелочным значениям рН количествах из О-ацетил-L-серина в результате изомеризации.
| Таблица 1 |
| Штамм |
Содержание аминокислоты [г/л] |
| О-ацетил-L-серин |
N-ацетил-L-серин |
| W3110/pACYC 184-cysEX |
1,8 |
1,5 |
| W3110/pG13 (cysEX-yfiK) |
7,4 |
3,0 |
Пример 4: Ферментативное получение N-ацетил-L-серина
N-ацетил-L-серин получали аналогично примерам 2 и 3. Единственное отличие состояло в том, что значение рН в процессе ферментации поддерживали на уровне 7,0. Соблюдение этого условия способствует изомеризации O-ацетил-L-серина в N-ацетил-L-серин, который в этом случае являлся основным продуктом. Ферментацию проводили в течение 48 ч.
| Таблица 2 |
| Штамм |
Содержание аминокислоты [г/л] |
| N-ацетил-L-серин |
| W3110/pACYC 184-cysEX |
5,8 |
| W3110/pG 13 (cysEX-yfiK) |
9,2 |
Пример 5: Ферментативное получение L-цистеина и его производных
L-цистеин получали аналогично примерам 2 и 3. Единственное отличие состояло в том, что значение рН в процессе ферментации поддерживали на уровне 7,0 и культуральную среду подпитывали тиосульфатом. При этом через 2 ч добавляли 30%-ный раствор Na-тиосульфата с расходом 3 мл/ч. Продолжительность ферментации составляла 48 ч. Процесс образования L-цистеина контролировали колориметрически в соответствии с тестом, описанным у Gaitonde (Gaitonde M.K., Biochem. J., 104, 1967, cc.627-633). При этом следует учитывать, что такой тест не позволяет проводить различий между L-цистеином и описанным в ЕР 0885962 А1 продуктом конденсации L-цистеина и пирувата (представляющим собой 2-метилтиазолидин-2,4-дикарбоновую кислоту). Присутствие LL-цистина, который образуется в результате окисления из L-цистеина, равно как и присутствие самого этого L-цистеина можно обнаружить в этом тесте путем восстановления дитиотреитолом (ДТТ) в разбавленном растворе при рН 8,0.
| Таблица 3 |
| Штамм |
Содержание аминокислоты [г/л] |
| L-цистеин+его производные |
| W3110/pACYC 184-cysEX |
4,6 |
| W3110/pG 13 (cysEX-yfiK) |
7,5 |


Формула изобретения
1. Клетка Escherichia coli, пригодная для ферментативного получения аминокислот из семейства фосфоглицератов, полученная в результате трансформации исходных клеток плазмидой, которая содержит ген yfiK и промотор, и характеризующаяся по сравнению с исходной клеткой повышенной активностью продукта гена yfiK.
2. Клетка по п.1, отличающаяся увеличенным количеством копий гена yfiK или повышенной экспрессией продукта гена yfiK за счет использования соответствующих промоторов или сигналов трансляции.
3. Клетка по п.2, отличающаяся тем, что промотор выбран из группы, включающей конститутивный GAPDH-прмотор гена gapA и индуцибельные lac-, tac-, trc-, lambda-, ara- и tet-промоторы.
4. Клетка по любому из пп.1-3, отличающаяся тем, что она представляет собой клетку, у которой повышенная активность продукта гена yfiK обусловлена увеличением количества копий гена yfiK в плазмиде, представляющей собой производную плазмиды pACYC.
5. Плазмида, обеспечивающая повышенную экспрессию белка YfiK в Escherichia coli и отличающаяся тем, что она содержит ген yfiK совместно с промотором.
6. Плазмида по п.5, отличающаяся тем, что она дополнительно содержит генетический элемент, обусловливающий нарушение регуляции пути метаболизма цистеина.
7. Способ создания клеток Escherichia coli по любому из пп.1-4, отличающийся тем, что в исходный штамм встраивают плазмиду по п.5 или 6.
8. Способ получения аминокислоты из семейства фосфоглицератов, отличающийся тем, что для ферментации используют клетки Escherichia coli по любому из пп.1-4 и образовавшуюся аминокислоту выделяют из сбраживаемой среды.
9. Способ по п.8, отличающийся тем, что клетки Escherichia coli выращивают в ферментере путем непрерывного культивирования, периодического культивирования или предпочтительно периодического культивирования с подпиткой.
10. Способ по п.8 или 9, отличающийся тем, что в процессе ферментации непрерывно добавляют источник углерода.
11. Способ по любому из пп.8-10, отличающийся тем, что в качестве источника углерода используют сахара, сахароспирты или органические кислоты.
12. Способ по любому из пп.8-11, отличающийся тем, что источник углерода добавляют в такой форме, чтобы его содержание в ферментере в процессе ферментации составляло от 0,1 до 50 г/л, наиболее предпочтительно от 0,5 до 10 г/л.
13. Способ по любому из пп.8-12, отличающийся тем, что в качестве источника азота используют аммиак, аммонийные соли или протеиновые гидролизаты.
14. Способ по любому из пп.8-13, отличающийся тем, что ферментацию проводят в аэробных условиях роста клеток микроорганизма.
РИСУНКИ
|
|