|
|
(21), (22) Заявка: 2006101986/04, 24.06.2004
(24) Дата начала отсчета срока действия патента:
24.06.2004
(30) Конвенционный приоритет:
25.06.2003 JP 2003-181908
(43) Дата публикации заявки: 27.07.2006
(46) Опубликовано: 10.02.2009
(56) Список документов, цитированных в отчете о
поиске:
СА 2432148 А1, 19.06.2003. WO 02/053565, 11.07.2002, пример 2 (78). ЕР 0795555 А1, 17.09.1997. RU 2124016 C1, 27.12.1998.
(85) Дата перевода заявки PCT на национальную фазу:
25.01.2006
(86) Заявка PCT:
JP 2004/009263 (24.06.2004)
(87) Публикация PCT:
WO 2004/113344 (29.12.2004)
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной
|
(72) Автор(ы):
ХАСЕГАВА Томоюки (JP),
МАЦУИ Тосиаки (JP),
АРАКИ Хироси (JP),
САИТО Тецудзи (JP),
ОБИЦУ Тецуо (JP),
ОКАМОТО Масаки (JP),
ДЖЕМБА Юити (JP),
МИКАМИ Ютака (JP)
(73) Патентообладатель(и):
ОНО ФАРМАСЬЮТИКАЛ КО., ЛТД. (JP)
|
(54) СОЛЬ МЕТАНСУЛЬФОНОВОЙ КИСЛОТЫ ПИРАЗОЛПИРИМИДИНОВОГО СОЕДИНЕНИЯ, ЕГО КРИСТАЛЛ И СПОСОБ ЕГО ПОЛУЧЕНИЯ
(57) Реферат:
Настоящее изобретение относится к метансульфонату 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-а]пиримидина, его кристаллу, способу их получения. Метансульфонат 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-а]пиримидина является превосходным соединением в отношении термической устойчивости. Кроме того, объектами изобретения являются фармацевтические композиции на основе вышеописанной соли или ее кристалла, представллящие собой антагонист CRF, которые могут быть использованы для лечения нейропсихиатрических расстройств или заболеваний пищеварительной системы. Изобретение также относится к новому способу получения промежуточного соединения 1-циано-1-(2-хлор-4-метоксифенил)пропан-2-она из 1-бром-2-хлор-4-метоксибензола с эффективным высоким выходом. 10 н. и 6 з.п. ф-лы, 6 ил.
Область техники, к которой относится изобретение
Настоящее изобретение относится к метансульфонату 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина, его кристаллу, способу их получения или способу получения его промежуточного соединения.
Предшествующий уровень техники
Кортикотропин-релизинг фактор (CRF) представлял собой пептид, включающий 41 аминокислотный остаток и выделенный из овечьего гипоталамуса в 1981 г. Предполагалось, что CRF высвобождается из гипоталамуса и регулирует секрецию адренокортикотропного гормона (АСТН) из гипофиза [Science, 218, 377-379 (1982)].
АСТН (адренокортикотропный гормон), который высвобождается стимуляцией CRF, стимулирует секрецию кортизола из коры надпочечников и относится к системному действию для репродукции, роста, желудочно-кишечной функции, воспаления, иммунной системы, нервной системы и т.д. Следовательно, считают, что CRF играет роль в качестве регулятора этих функций. В связи с этим большое внимание привлекла связь между CRF и заболеваниями центральной нервной системы или нейропсихиатрическими расстройствами.
В описании заявки WO 02/053565 было описано соединение формулы (А)
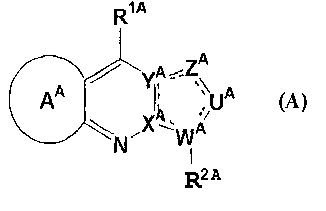
где ХА и YA, каждый независимо, представляет собой углерод или азот, и они оба не являются азотом в одно и то же время; WA представляет собой углерод или азот; UA и ZA, каждый независимо, представляет собой CR2A, NR13A, азот, кислород, серу, С=О или C=S;
R2A представляет собой (i) водород, (ii) С1-8 алкил, (iii) С2-8 алкенил, (iv) С2-8 алкинил, (v) атом галогена, (vi) CF3, (vii) циано, (viii) нитро, (ix) NR9AR10A, (x) OR11A, (xi) SH, (xii) S(O)nAR12A, (xiii) COR11A, (xiv) COOR11A, (xv) CONR9AR10A, (xvi) С3-10 моно- или бикарбоциклическое кольцо, (xvii) 3-10-членное моно- или бигетероциклическое кольцо, содержащее 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы или (xviii) замещенный С1-4 алкил;
 представляет собой одинарную связь или двойную связь; представляет собой одинарную связь или двойную связь;
 представляет собой С4-6 карбоциклическое кольцо или 4-6-членное гетероциклическое кольцо, содержащее, по меньшей мере, один из атома азота, кислорода и серы, и эти кольца являются незамещенными или замещенными 1-3 заместителями, выбранными из С1-4 алкила, С1-4 алкокси, атома галогена и CF3; представляет собой С4-6 карбоциклическое кольцо или 4-6-членное гетероциклическое кольцо, содержащее, по меньшей мере, один из атома азота, кислорода и серы, и эти кольца являются незамещенными или замещенными 1-3 заместителями, выбранными из С1-4 алкила, С1-4 алкокси, атома галогена и CF3;
R1A представляет собой (i) незамещенный или замещенный С1-8 алкил, (ii) незамещенный или замещенный С2-8 алкенил, (iii) незамещенный или замещенный С2-8 алкинил, (iv) NR4AR5A, (v) OR6A, (vi) SH, (vii) S(O)nR7A, (viii) CORRA, (ix) COOR6A, (x) CONR4AR5A, (xi) NR8ACOR6aA, (xii) NR8ACOOR6A, (xiii) NR8ACONR4AR5A, (xiv) незамещенное или замещенное С3-15 моно- или бикарбоциклическое кольцо, (xv) незамещенное или замещенное 3-15-членное моно- или бигетероциклическое кольцо, содержащее 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы,
в качестве антагониста рецепторов CRF.
Кроме того, в указанном документе был описан гидрохлорид 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина.
С другой стороны, в качестве промежуточного соединения формулы (А) было описано соединение формулы (В)
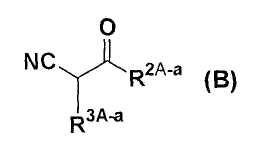
где R2A-а представляет собой (i) водород, (ii) С1-8 алкил, (iii) С2-8 алкенил, (iv) С2-8 алкинил, (v) атом галогена, (vi) трифторметил, (vii) циано, (viii) нитро, (ix) NR9AR10A, (x) OR11A, (xi) SH, (xii) S(O)nR12A, (xiii) COR11A, (xiv) COOR11A, (xv) CONR9AR10A, (xvi) С3-10 моно- или бикарбоциклическое кольцо, (xvii) 3-10-членное моно- или бигетероциклическое кольцо, содержащее 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы, или (xviii) замещенный С1-4 алкил; при условии, что R2A-а не представляет собой ОН, циано, =N-OR11A или группу, содержащую ОН, циано или =N-OR11A,
R3A-а представляет собой (i) замещенное С5-10 моно- или бикарбоциклическое кольцо или (ii) замещенное 5-10-членное моно- или бигетероциклическое кольцо, содержащее 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы, при условии, что эти указанные выше группы не представляют собой группу ОН, циано, =N-OR11A или группу, содержащую ОН, циано или =N-OR11A.
В соединении формулы (В) 1-циано-1-(2-метил-4-метоксифенил)пропан-2-он (соединение В-1) и 1-циано-1-(2-хлор-4-метоксифенил)пропан-2-он (соединение В-2) были описаны в качестве «Референсного примера», и было показано, что эти соединения можно получить способом, описанным в схемах А и В.
Схема А
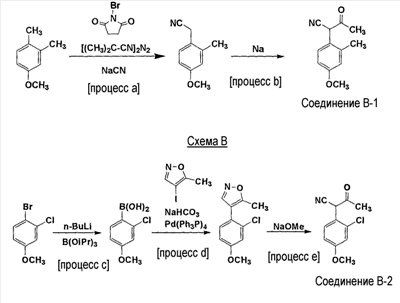
[Процесс а] проводят взаимодействием 1,2-диметил-4-метоксибензола с N-бромсукцинимидом и 2,2′-азобисизобутилнитрилом и затем проводят взаимодействием полученного соединения и цианида натрия.
[Процесс b] проводят взаимодействием соединения, полученного в [процессе А], и металлического натрия в этилацетате.
[Процесс с] проводят взаимодействием 3-хлор-4-броманизола и триизопропилбората в тетрагидрофуране в присутствии н-бутиллития.
[Процесс d] проводят взаимодействием соединения, полученного в [процессе с], и 4-йод-5-метилизоксазола в смеси диметоксиэтана/воды в присутствии карбоната натрия и тетракис(трифенилфосфин)палладия.
[Процесс е] проводят взаимодействием соединения, полученного в [процессе d], и метоксида натрия в метаноле.
В описании WO 02/053565 в качестве конкретного соединения был описан гидрохлорид 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина. Термостойкость этого соединения была низкая, и, что касается этого соединения, оно отделялось и имела место утечка хлористоводородной кислоты при температуре, превышающей определенный уровень. Кроме того, кристалличность этого соединения была низкой и выход кристаллов был очень низким.
Как описано выше, было трудно обеспечить устойчивость обрабатываемого гидрохлоридного соединения, обладающего низкой термической устойчивостью и низким выходом кристалла. Кроме того, может возникнуть проблема, если процесс нагревания необходим в способе получения, и поэтому гидрохлоридное соединение было нежелательно в качестве вещества для фармацевтического препарата.
С другой стороны, в способе получения промежуточного соединения формулы (В), описанного в указанной выше ссылке, взаимодействие [процесса b] с использованием металлического натрия в схеме А требовало специализированного оборудования для осуществления в сильно щелочных условиях, и, таким образом, он был неприемлемым для промышленного получения. Кроме того, общий выход соединения В-1 в двух способах [способе а] и [способе b] был низким, конкретнее, составил 59%.
В реакции схемы В 4-йод-5-метилизоксазол, используемый в [способе d], был неприемлемым для промышленного получения, потому что было трудно обеспечить метилизоксазол, который представляет собой материал 4-йод-5-метилизоксазола. Кроме того, 3 процесса требовались для получения соединения В-2, и общий выход был низким, конкретнее, составил 27%.
Как описано выше, способ получения, описанный в указанной выше ссылки, создавал некоторые проблемы, например, большое количество процессов, низкий выход целевого соединения и низкая промышленная производительность.
Заявители провели обширные исследования для решения указанных выше проблем и в результате обнаружили, что цель достигается новым соединением метансульфонатом 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина и его новым кристаллом.
Кроме того, заявители обнаружили способ получения соединения формулы (I)
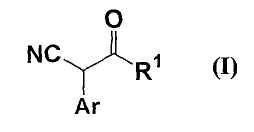
где все обозначения представляют собой, как определено ниже в настоящем описании;
которое можно получить взаимодействием соединения формулы (II)
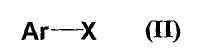
где все обозначения представляют собой, как определено ниже в настоящем описании;
и соединения формулы (III)
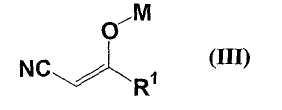
где все обозначения представляют собой, как определено ниже в настоящем описании;
в условиях действия гомогенного катализатора,
соединение формулы (I) было промежуточным соединением метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина, которое можно использовать для фармацевтических средств, и способ состоял из одной стадии и был эффективным, и целевое соединение можно было получать с высоким выходом.
Краткое описание чертежей
На фиг.1 показан график дифференциальной сканирующей калориметрии метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина.
На фиг.2 показан график дифференциальной сканирующей калориметрии гидрохлорида 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина.
На фиг.3 показан график спектра дифракции рентгеновских лучей порошка кристалла метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина.
На фиг.4 показан график спектра инфракрасного резонансного излучения (IR) кристалла метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина.
На фиг.5 показан рентгеновский структурный анализ монокристалла соединения I.
На фиг.6 показан рентгеновский структурный анализ монокристалла соединения I.
Описание изобретения
Настоящее изобретение относится к
1. метансульфонату 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина,
2. кристаллу метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина,
3. кристаллу по указанному выше п.2, который имеет спектр дифракции рентгеновских лучей порошка, показанный на фиг.3.
4. кристаллу по указанному выше п.2, который имеет угол дифракции 2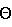 при 8,96, 12,70, 13,69, 14,98, 15,74, 16,38, 17,63, 18,98, 19,71, 20,49, 21,37, 22,26, 22,88, 23,76, 24,70, 25,79 и 26,57 на спектре дифракции рентгеновских лучей порошка, при 8,96, 12,70, 13,69, 14,98, 15,74, 16,38, 17,63, 18,98, 19,71, 20,49, 21,37, 22,26, 22,88, 23,76, 24,70, 25,79 и 26,57 на спектре дифракции рентгеновских лучей порошка,
5. кристаллу по указанному выше п.2, который имеет инфракрасный резонансный спектр, показанный на фиг.4,
6. кристаллу по указанному выше п.2, который имеет поглощение в инфракрасном резонансном спектре при 1652, 1595, 1549, 1220, 1168, 1141, 1115, 1034, 790, 766, 548, 533 и 522 см-1,
7. способу получения метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина, который включает взаимодействие 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина с метансульфоновой кислотой,
8. фармацевтической композиции, включающей соединение, описанное в указанном выше п.1, в качестве активного ингредиента,
9. фармацевтической композиции, включающей 1% или более кристалла в качестве активного ингредиента, описанного в любом из указанных выше пп.2-6,
10. фармацевтической композиции по указанному выше п.8, которая представляет собой антагонист CRF,
11. фармацевтической композиции по указанному выше п.8, которая представляет собой средство для предотвращения и/или лечения заболевания, опосредованного CRF,
12. фармацевтической композиции по указанному выше п.11, где заболевание, опосредованное CRF, представляет собой нейропсихиатрическое расстройство или заболевание пищеварительной системы,
13. фармацевтической композиции по указанному выше п.12, где нейропсихиатрическое расстройство представляет собой расстройство поведения, тревожное расстройство, расстройство, связанное со стрессом, расстройство, связанное с потреблением пищи, симптом, вызванный применением психомиметического препарата или зависимостью от него, органическое психическое расстройство, шизофрению или расстройство с дефицитом внимания и гиперактивностью,
14. фармацевтической композиции по указанному выше п.12, где заболевание пищеварительной системы представляет собой желудочно-кишечное расстройство, вызванное стрессом,
15. фармацевтической композиции по указанному выше п.13, где расстройство настроения представляет собой депрессию, одиночный эпизод депрессии, рецидивирующую депрессию, послеродовую депрессию, депрессию, вызванную жестоким обращением с детьми, биполярное аффективное расстройство или предменструальное дисфорическое расстройство,
16. лекарственному средству, которое включает метансульфонат 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина и одно или несколько лекарственных средств, выбранных из трициклических антидепрессантов, тетрациклических антидепрессантов, ингибиторов моноаминоксидазы, ингибиторов обратного захвата серотонина-норадреналина, селективных ингибиторов обратного захвата серотонина, ингибиторов обратного захвата серотонина, психоаналептиков, средств против тревоги, антипсихотических средств, лигандов бензодиазепиновых рецепторов митохондрий, антагонистов NK1, средств, стимулирующих моторику желудочно-кишечного тракта, антагонистов 5-НТ3, антагонистов 5-НТ4, антихолинергических средств, препаратов против диареи, слабительных средств и модуляторов вегетативных нервов,
17. антагонисту CRF, включающему метансульфонат 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина в качестве активного ингредиента,
18. препарату для инъекций, включающему метансульфонат 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина,
19. препарату для инъекций по указанному выше п.18, который включает солюбилизирующий агент и/или регулятор рН,
20. способу антагонизации CRF, который включает введение млекопитающим эффективного количества метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина,
21. применению метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина для получения антагониста CRF,
22. способу получения соединения формулы (I)
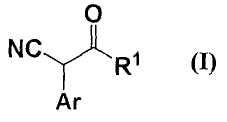
где все обозначения представляют собой, как определено ниже в настоящем описании;
которое можно получить взаимодействием соединения формулы (II)
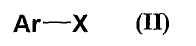
где Ar представляет собой бензол, нафталин, пиридин, 1,3-диоксаиндан или бензотиадиазол, кольца которых могут быть замещены заместителями, Х представляет собой атом галогена,
с соединением формулы (III)
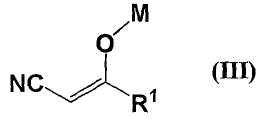
где R1 представляет собой (i) С1-8 алкил, (ii) С2-8 алкенил, (iii) С2-8 алкинил, (iv) трифторметил, (v) С3-10 моно- или бикарбоциклическое кольцо, (vi) 3-10-членное кольцо, содержащее 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы, (vii) С1-4 алкил, замещенный 1-2 членами, выбранными из трифторметила, NR3R4, в котором R3 и R4, каждый независимо, представляет собой (i) водород, (ii) С1-4 алкил, (iii) С3-10 моно- или бикарбоциклическое кольцо, (iv) 3-10-членное моно- или бигетероциклическое кольцо, содержащее 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы, или (v) С1-4 алкил, замещенный С3-10 моно- или бикарбоциклическим кольцом, или 3-10-членным моно- или бигетероциклическим кольцом, содержащим 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы; OR5, в котором R5 представляет собой (i) водород, (ii) С1-4 алкил, (iii) C5-6 карбоциклическое кольцо, (iv) 5- или 6-членное гетероциклическое кольцо, содержащее 1-2 атома азота, 1 атом кислорода и/или 1 атом серы, или (v) С1-4 алкил, замещенный C5-6 карбоциклическим кольцом, или 5- или 6-членным гетероциклическим кольцом, содержащим 1-2 атома азота, 1 атом кислорода и/или 1 атом серы; S(O)nR6, в котором n=0, 1 или 2, R6 представляет собой (i) C1-4 алкил, (ii) C5-6 карбоциклическое кольцо, (iii) 5- или 6-членное гетероциклическое кольцо, содержащее 1-2 атома азота, 1 атом кислорода и/или 1 атом серы или (iv) С1-4 алкил, замещенный C5-6 карбоциклическим кольцом или C5- или 6-членным гетероциклическим кольцом, содержащим 1-2 атома азота, 1 атом кислорода и/или 1 атом серы; COR5, COOR5, CONR3R4, C3-10 моно- или бикарбоциклическое кольцо и 3-10-членное моно- или бигетероциклическое кольцо, содержащее 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы; М представляет собой атом металла,
в условиях действия гомогенного катализатора, и
23. способу получения в соответствии с указанным выше п.22, где гомогенный катализатор представляет собой соединение палладиевой группы.
Метансульфонат 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина (далее называемый соединением (I)) настоящего изобретения представляет собой новое соединение.
Еще удивительнее то, что соединение (I) представляло собой значительно лучше соединение в отношении термической устойчивости, что становится понятно по графику DSC, показанному на фиг.1, на котором имеется пик поглощения при 196,1°С.
С другой стороны, график DSC гидрохлорида 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина, описанного в WO 02/053565, показан на фиг.2. Стабильная кривая DSC, подобная фиг.1, не была показана на фиг.2, и кривая однажды значительно изменилась примерно около 40°С и затем постепенно изменялась после температуры более 50°С.
На основании этих результатов было продемонстрировано, что гидрохлоридное соединение представляло собой неустойчивое к теплу соединение, а соединение метансульфоната настоящего изобретения представляло собой соединение с более высокой тепловой устойчивостью. Было очень удивительно, что различие в соли в значительной степени влияло на тепловую устойчивость, и это трудно было предвидеть.
Кроме того, соединение по настоящему изобретению также имеет превосходную растворимость и распределение. И выход соединения по настоящему изобретению был очень высоким, поскольку оно было получено с высоким выходом, 98%, в примере следующего описания, и соединение по настоящему изобретению было подходящим для промышленного производства вещества для фармацевтического препарата.
Соединение (I) по настоящему изобретению, которое имеет такую превосходную характеристику, может устойчиво поставляться, подходит для промышленного производства и имеет преимущество при доставлении лекарственного продукта.
Токсичность
Токсичность соединений (I) очень низкая, и поэтому соединения можно считать безопасными для фармацевтического применения.
Промышленная применимость
Применение для фармацевтических препаратов
Соединение (1) можно использовать для связывания рецептора CRF и проявления антагонистической активности в отношении рецептора CRF, для предотвращения и/или лечения заболеваний, ассоциированных с CRF, например, нейропсихиатрических расстройств, заболеваний пищеварительной системы, респираторных заболеваний, эндокринных заболеваний, метаболических заболеваний, заболеваний системы кровообращения, заболеваний кожи, мочеполовых заболеваний, заболеваний костно-мышечной системы.
Конкретно, в качестве нейропсихиатрических расстройств приводятся, например, расстройства настроения, такие как депрессия, одиночный эпизод депрессии, рецидивирующая депрессия, послеродовая депрессия, депрессия, вызванная жестоким обращением с детьми, биполярные расстройства, предменструальное дисфорическое расстройство; тревожные расстройства, такие как расстройства, связанные с тревогой, паническое расстройство, навязчиво-компульсивное расстройство, фобические расстройства, например, акрофобия, клаустрофобия, агорафобия, социальная фобия; расстройства, связанные со стрессом, такие как посттравматическое стрессовое расстройство (PTSD), вызванное стрессом подавление иммунитета, вызванная стрессом головная боль, вызванная стрессом лихорадка, вызванная стрессом боль, стресс, вызванный хирургической вмешательством, желудочно-кишечное расстройство, вызванное хирургическим вмешательством, синдром раздраженного кишечника; расстройства, связанные с потреблением пищи, такие как невротическая анорексия, булимия, невротическая рвота; симптомы, вызванные применением психомиметических препаратов и зависимостью от них, такие как абстинентный симптом, алкоголизм, лекарственная интоксикация, лекарственная зависимость; органические психические расстройства, такие как деменция типа Альцгеймера, деменция вследствие множественного инфаркта мозга; шизофрения, расстройство в виде дефицита внимания с гиперактивностью, нейродегенеративное заболевание, например, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боковой амиотрофический склероз; боль, судорожные расстройства, такие как судороги, мышечный спазм; припадочное расстройство, такое как эпилепсия, приступ, мигрень; или расстройство сна, такое как неорганическое расстройство сна, расстройство сна, вызванное фибромиалгией.
В качестве заболеваний пищеварительной системы приводятся, например, язвенная болезнь, воспалительное кишечное заболевание, например, язвенный колит, болезнь Крона; синдром раздраженного кишечника, желудочно-кишечное расстройство, вызванное стрессом, диарея и запор.
В качестве респираторных заболеваний приводятся, например, астма, бронхиальная инфекция, хроническое обструктивное легочное заболевание и аллергический ринит.
В качестве эндокринных заболеваний приводятся, например, синдром дисфункции щитовидной железы, болезнь Кушинга и синдром неадекватной секреции антидиуретического гормона.
В качестве метаболических расстройств приводится, например, гипогликемия.
В качестве заболеваний системы кровообращения приводятся, например, гипертензия, ишемическая болезнь сердца, тахикардия, застойная сердечная недостаточность и цереброваскулярное заболевание.
В качестве кожных заболеваний приводятся атопический дерматит, например, аллергический контактный дерматит и псориаз.
В качестве мочеполовых заболеваний приводятся, например, расстройство мочеиспускания, поллакиурия и недержание мочи.
В качестве глазных заболеваний приводится, например, увеит.
В качестве заболеваний костно-мышечной системы приводятся, например, хронический ревматоидный артрит, остеоартрит и остеопороз.
Комбинированное средство, полученное объединением соединения (1) с другими лекарственными средствами можно вводить для достижения следующих целей:
1) для дополнения и/или усиления профилактического и/или терапевтического эффекта соединения по настоящему изобретению;
2) для улучшения кинетики и/или всасывания и уменьшения дозы настоящего соединения и/или
3) для устранения побочных эффектов соединения по настоящему изобретению.
Комбинацию соединения (1) и других лекарственных средств можно вводить в виде композиций, содержащих эти компоненты, в виде одного препарата, или их можно ввести отдельными препаратами. В случае, когда эти лекарственные средства вводятся отдельными препаратами, их можно вводить одновременно или в различное время. В последнем случае соединение (1) можно вводить перед другими лекарственными средствами. Альтернативно, другие лекарственные средства можно ввести перед соединением (1). Способы введения этих лекарственных средств такие же или другие.
Заболевания, на которых указанные выше комбинированные препараты оказывают профилактическое и/или терапевтическое воздействие, конкретно не ограничены, но они могут представлять собой те, по поводу которых профилактическое и/или терапевтическое воздействие соединения (1) дополняется и/или усиливается.
Примеры других лекарственных средств для дополнения и/или усиления профилактического и/или терапевтического воздействия соединения (1) на расстройства поведения включают антидепрессант, такой как трициклический антидепрессант, тетрациклический антидепрессант, ингибитор моноаминоксидазы (МАО), ингибитор обратного захвата серотонина-норадреналина (SSRI), ингибитор обратного захвата серотонина, психоаналептик, средство против тревоги, антипсихотическое средство, лиганд бензодиазепиновых рецепторов митохондрий (MBR), антагонист NK1 и им подобный.
Примеры других лекарственных средств для дополнения и/или усиления профилактического и/или терапевтического воздействия соединения (1) на тревожные расстройства включают средство против тревоги, такое как бензодиазепиновый анксиолитик, тиенодиазепиновый анксиолитик, не бензодиазепиновый анксиолитик, лиганд MBR и им подобные.
Примеры других лекарственных средств для дополнения и/или усиления профилактического и/или терапевтического воздействия соединения (1) на синдром раздраженного кишечника включают регулятор перистальтики желудочно-кишечного тракта, антагонист 5-НТ3, антагонист 5-НТ4, антихолинергическое средство, препарат против диареи, слабительное средство, модулятор вегетативных нервов, антидепрессант, средство против тревоги и им подобные.
В качестве антидепрессантов приводятся, например, трициклический антидепрессант, такой как гидрохлорид амитриптилина, гидрохлорид имипрамина, гидрохлорид кломипрапина, гидрохлорид досулепина, гидрохлорид нортриптилина, гидрохлорид лофепрамина, малеат тримипрамина, амоксапин; тетрациклический антидепрессант, такой как гидрохлорид мапротилина, гидрохлорид миансерина, малеат сетиптилина; ингибитор МАО, такой как гидрохлорид сафразина; SNRI, такой как гидрохлорид милнаципрана, гидрохлорид венлафаксина; SSRI, такой как малеат флувоксамина, гидрохлорид пароксетина, гидрохлорид флуоксетина, гидрохлорид циталопрама; ингибитор обратного захвата серотонина, такой как гидрохлорид тразодона.
В качестве средства против тревоги приводится, например, бензодиазепиновый анксиолитик, такой как алпразолам, оксазепам, оксазолам, клоксазолам, дикалий клоразепат, хлордиазепоксид, диазепам, тофизопам, тризолам, празепам, флудиазепам, флутазолам, флутопразепам, бромазепам, мексазолам, медазепам, этиллофлазепат, лоразепам; тиенодиазепиновый анксиолитик, такой как этизолам, клотиазепам; не бензодиазепиновый анксиолитик, такой как цитрат тандоспирона и гидрохлорид гидроксилзина.
В качестве психоаналептика приводится, например, гидрохлорид метилфенидата и пемолин.
В качестве антипсихотического средства приводится, например, сулпирид, гидрохлорид тразодона, антагонист серотонина-допамина, такой как рисперидон, гидрохлоридгидрат пероспирона, фумарат кветиапина и оланзапин.
В качестве регулятора желудочно-кишечного тракта приводятся, например, малеат тримебутина и кальций поликарбофил.
В качестве антагониста 5-НТ3 приводится, например, алосетрон.
В качестве агониста 5-НТ4 приводятся, например, тегасерод, цисаприд и мосаприд.
Соотношение массы соединения (1) и других лекарственных средств конкретно не ограничено.
Можно вводить любую комбинацию двух или более лекарственных средств.
Кроме того, другие лекарственные средства для дополнения и/или усиления профилактического и/или терапевтического эффекта соединения (1) включают не только лекарственные средства, обнаруженные к настоящему времени, но также те, которые будут обнаружены на основании указанного выше механизма.
В качестве формы препарата приводятся, например, твердые препараты для приема внутрь и жидкие препараты для приема внутрь для перорального введения, инъекций, наружных препаратов и суппозиторий для парентерального введения.
Примеры твердых препаратов для внутреннего применения для перорального введения включают таблетки, пилюли, капсулы, порошки, гранулы и им подобные. Капсулы включают твердые капсулы и мягкие капсулы.
Такой твердый препарат для приема внутрь получают обычно используемым способом составления композиций, применением активных веществ без модификации или смеси активного вещества с эксципиентом (лактозой, маннитом, глюкозой, микрокристаллической целлюлозой, крахмалом и т.д.), связывающим веществом (гидроксипропилцеллюлозой, поливинилпирролидоном, метасиликаталюминатом магния и т.д.), дезинтегрантом (гликолятцеллюлозой кальция и т.д.), лубрикантом (стеаратом магния и т.д.), стабилизатором (например, антиоксидантом, таким как сульфит, пиросульфит натрия, аскорбиновая кислота), солюбилизирующим агентом (глутаминовой кислотой, аспарагиновой кислотой, серией полисорбата, такого как полисорбат 20, полисорбат 60, полисорбат 65, полисорбат 80; серией макрогола, такого как макрогол 200, макрогол 400, макрогол 1000, макрогол 1500, макрогол 4000, макрогол 6000, макрогол 20000; этанолом, глицерином, карбоксиметилцеллюлозой и т.д.). При необходимости он может быть покрыт покрывающим агентом (сахарозой, желатином, гидроксипропилцеллюлозой, фталатом гидроксипропилметилцеллюлозы и т.д.). Он может быть покрыт двумя или более слоями. Более того, капсулы, изготовленные из всасываемого материала, такого как желатин, включены в объем изобретения.
Жидкие препараты для приема внутрь для перорального введения включают фармацевтически приемлемые водные растворы, суспензии, эмульсии, сиропы, эликсиры и им подобные. Такой жидкий препарат получают растворением, суспендированием или эмульгированием активного вещества в обычно используемом разбавителе (очищенной воде, этаноле или их смесях и т.д.). Такие жидкие формы могут, кроме того, включать некоторые добавки, такие как увлажнители, суспендирующие агенты, эмульгирующие агенты, подслащивающие вещества, флаворанты, ароматизаторы, консерванты, буферы и им подобные.
Инъекционные препараты для парентерального введения включают растворы, суспензии, эмульсии и твердые инъекционные препараты, которые следует растворить или суспендировать перед использованием. Такой инъекционный препарат используется растворением, суспендированием или эмульгированием активного вещества в растворителе. Растворитель включает, например, дистиллированную воду для инъекций, физиологический солевой раствор, растительные масла, спирты, такие как пропиленгликоль, полиэтиленгликоль и этанол и их смеси. Инъекционный препарат может, кроме того, включать стабилизатор (например, антиоксидант, такой как сульфит, пиросульфит натрия, аскорбиновую кислоту), солюбилизирующее вещество (например, глутаминовую кислоту, аспарагиновую кислоту, серию полисорбата, такой как полисорбат 20, полисорбат 60, полисорбат 65, полисорбат 80; серию макрогола, такой как макрогол 200, макрогол 400, макрогол 1000, макрогол 1500, макрогол 4000, макрогол 6000, макрогол 20000; этанол, глицерин, карбоксиметилцеллюлозу и т.д.), модификатор рН (например, хлористоводородную кислоту, лимонную кислоту, цитрат натрия, уксусную кислоту, винную кислоту, янтарную кислоту, аргинин, моноэтаноламин, диэтаноламин, триэтаноламин, меглумин, гидроокись натрия, гидроокись калия, бикарбонат натрия, карбонат натрия), суспендирующие агенты, эмульгирующие агенты, смягчающие агенты (например, хлорбутанол, креатинин, инозитол), буферный агент (например, фосфорную кислоту, тринатрийфосфат, гидрофосфат натрия, дикалийфосфат, фосфат, дигидрофосфат калия, дигидрофосфат натрия), консервант (например, парагидроксибензоат метила, парагидроксибензоат этила, парагидроксибензоат пропила, парагидроксибензоат бутила) и им подобные. Такой инъекционный препарат можно получить стерилизацией на конечной стадии или используя асептический способ. Альтернативно, возможно также получение асептического твердого продукта, такого как лиофилизированный продукт, и его стерилизация или растворение в асептической дистиллированной воде для инъекций или другом растворителе, таком как физиологический солевой раствор, 5% раствор глюкозы перед использованием.
Наружные препараты для парентерального введения включают мази, гели, кремы, пенообразующие препараты, накладки, линименты, аэрозольные средства, ингаляционные препараты, средства для распыления, глазные капли и носовые капли и им подобные. Такой препарат содержит активное вещество и получается хорошо известным способом или обычно используемым составлением композиции.
Другие композиции для парентерального введения включают суппозитории и пессарии для влагалищного введения, которые содержат одно или несколько активных веществ, и их получают в соответствии с обычными способами составления композиций.
Соединение (1) настоящего изобретения представляет собой новый кристалл, характеризуемый следующими данными.
Другими словами, кристалл характеризуется спектром дифракции рентгеновских лучей порошка, который был получен с помощью излучения Cu-K , показанным на фиг.3; и данные угла дифракции 2 , показанным на фиг.3; и данные угла дифракции 2 и относительной интенсивности показаны в следующей таблице 1. и относительной интенсивности показаны в следующей таблице 1.
| Таблица 1 |
Угол дифракции 2 |
Относительная интенсивность |
| 8,96 |
44 |
| 12,70 |
13 |
| 13,69 |
21 |
| 14,98 |
10 |
| 15,74 |
20 |
| 16,38 |
13 |
| 17,63 |
44 |
| 18,98 |
19 |
| 19,71 |
45 |
| 20,49 |
32 |
| 21,37 |
99 |
| 22,26 |
32 |
| 22,88 |
31 |
| 23,76 |
40 |
| 24,70 |
27 |
| 25,79 |
100 |
| 26,57 |
22 |
Кроме того, кристалл характеризуется поглощением в инфракрасном резонансном спектре (ИК) при 1652, 1595, 1549, 1220, 1168, 1141, 1115, 1034, 790, 766, 548, 533, 522 см-1, и ИК спектр, измеренный способом ATR, показан на фиг.4.
Кроме того, кристалл также характеризуется пиком поглощения при 196,1°С и график DSC (дифференциальной сканирующей калориметрии) показан на фиг.1.
Кристалл соединения (1) характеризуется физико-химическими свойствами, описанными в настоящем описании, но данные каждого анализа не следует понимать буквально, потому что их характер несколько меняется.
Например, при признании идентичности кристалла по характеру спектра дифракции рентгеновских лучей порошка важны угол дифракции 2 и общие рентгенограммы, а относительная интенсивность может несколько изменяться в зависимости от направления роста кристалла, размера частиц и условий измерения. В ИК спектре для признания идентичности кристалла важен общий характер характеристики, и он может несколько изменяться в зависимости от условия измерения. В данных DSC для признания идентичности кристалла важен общий характер спектра, и он может несколько изменяться в зависимости от условия измерения. и общие рентгенограммы, а относительная интенсивность может несколько изменяться в зависимости от направления роста кристалла, размера частиц и условий измерения. В ИК спектре для признания идентичности кристалла важен общий характер характеристики, и он может несколько изменяться в зависимости от условия измерения. В данных DSC для признания идентичности кристалла важен общий характер спектра, и он может несколько изменяться в зависимости от условия измерения.
Поэтому те кристаллы, которые имеют аналогичные данные и картины спектра дифракции рентгеновских лучей, ИК спектра и DSC кристалла соединения (1), включены в кристалл соединения (1) по настоящему изобретению.
В качестве кристалла соединения (1) по настоящему изобретению предпочтителен тип кристалла, имеющий спектр дифракции рентгеновских лучей порошка, показанный на фиг.3, и/или ИК спектр, показанный на фиг.4, но он может также представлять собой смешанное соединение с другим типом кристалла, который будет обнаружен в будущем, и может представлять собой смешанное соединение с некристаллическим материалом соединения (1).
Кристалл соединения (1) по настоящему изобретению, кроме тепла, устойчив к влажности и свету.
С другой стороны, соединение формулы (1) является важным в качестве промежуточного соединения в способе получения метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина.
Способ получения соединения формулы (I) по настоящему изобретению представляет собой способ изготовления, в котором целевое соединение можно получить с эффективным высоким выходом, при котором решается проблема, присущая уровню техники. Способ изготовления по настоящему изобретению показан на следующей схеме 1.
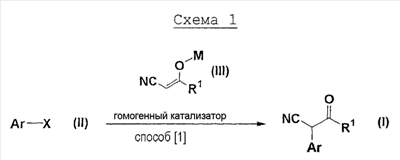
На схеме 1 все обозначения такие же, как определено выше в настоящем описании.
Соединение формулы (1) можно получить способом изготовления по настоящему изобретению из соединения формулы (II) одним процессом.
Процесс [1] проводится в органическом растворителе, например, 1,2-диметоксиэтане, диглиме, толуоле, ксилоле, диметилформамиде, простом циклопентилметиловом эфире, тергидрофуране, диоксане, в присутствии основания, например, трет-бутоксида натрия, трет-бутоксида калия, трет-бутоксида лития, гидрида натрия, карбоната натрия, карбоната калия, карбоната лития, фосфата калия, фосфата натрия; в присутствии или в отсутствие йодида, используя гомогенный катализатор при 70-120°С.
Способ получения по настоящему изобретению представляет собой превосходный способ с промышленной производительностью, потому что каждый реагент можно легко получить, реакция проводится в один процесс, и целевое соединение можно получить с высоким выходом.
Предпочтительными гомогенными катализаторами в настоящем изобретении являются соединения палладиевой группы гомогенных катализаторов. Например, приводятся тетракис(трифенилфосфин)палладий, ацетат палладия, трис(дибензилиденацетон)палладий и хлорид палладия. Потребленное количество представляет собой количество катализатора, предпочтительно количество составляет 0,1-20 мол.% для материала, более предпочтительно количество составляет 0,25-10 мол.% и, в частности, предпочтительно 0,25-5 мол.%.
Кроме того, гомогенные катализаторы в настоящем изобретении представляют собой только гомогенный катализатор или комбинацию гомогенного катализатора и лиганда. В качестве лиганда приводятся трифенилфосфин, 2,2′-бис(дифенилфосфин)-1,1′-бинафтил, 9,9′-диметил-4,5-бис(дифенилфосфин)ксантен, 1,1′-бис(дифенилфосфин)ферроцен, 1,2-бис(дифенилфосфин)этан, 1,3-бис(дифенилфосфин)пропан, 1,4-бис(дифенилфосфин)бутан, три-2-м-трифосфин, три-п-толилфосфин, три-о-толилфосфин, трис(2-метоксифенил)фосфин, трис(3-метоксифенил)фосфин, трис(4-метоксифенил)фосфин, 1,2-бис(дифенилфосфин)бензол, триметилсилилфосфин, трис(4-фторфенил)фосфин, трис(пентафторфенил)фосфин, циклогексилдифенилфосфин, дициклогексилдифенилфосфин, тригидрохлорид трис(3-сульфофенил)фосфина, простой бис(2-дифенилфосфинфенил)эфир, цис-1,2-бис(дифенилфосфин)этилен, дифенилпентафторфенилфосфин, 2-(ди-трет-бутилфосфин)бифенил, 2-(дициклогексилфосфин)бифенил, 2-дициклогексилфосфин-2′-N,N-диметиламино)бифенил. Предпочтительными лигандами являются 1,2-бис(дифенилфосфин)этан, три-2-м-толилфосфин, три-п-толилфосфин и 2,2′-бис(дифенилфосфин)-1,1′-бинафтил.
В настоящем изобретении в качестве гомогенного катализатора или комбинации гомогенного катализатора и лиганда предпочтительными являются один тетракис(трифенилфосфин)палладий, ацетат палладия и 1,2-бис(дифенилфосфин)этан, ацетат палладия и три-2-м-толилфосфин, ацетат палладия и три-п-толилфосфин, ацетат палладия и 2,2′-бис(дифенилфосфин)-1,1′-бинафтил, трис(дибензилиденацетон)дипалладий и 1,2-бис(дифенилфосфин)этан, трис(дибензилиденацетон)дипалладий и три-2-м-толилфосфин, трис(дибензилиденацетон)дипалладий и три-п-толилфосфин, трис(дибензилиденацетон)дипалладий и 2,2′-бис(дифенилфосфин)-1,1′-бинафтил.
В настоящем изобретении йодид означает соединение, которое может продуцировать ион йодида в реакционном растворе. Например, приводятся йодид натрия, йодид калия, йодид лития, йодид рубидия, йодид цезия, йодид магния, йодид марганца, йодид железа, йодид кобальта, йодид никеля, йодид меди, йодид цинка, йодид серебра, йодид четвертичного аммония (например, йодид тетра-н-бутиламмония), йод. Количество йодида, потребляемого при реакции, составляет 0,3-2,0 эквивалента для соединения формулы (II). Предпочтительно оно составляет 0,3-1,0 эквивалент.
В настоящем изобретении, когда целевое соединение имеет гидроксильную, карбоксильную, SH или аминогруппу в качестве заместителей, реакцию можно проводить с использованием соединения, имеющего гидроксильную, карбоксильную, SH или аминогруппу, защищенную предпочтительной защитной группой, а затем можно выбрать реакцию снятия защиты для соответствия защитным группам.
Например, метил, этил, аллил, трет-бутил, трихлорэтил, бензил (Bn), фенацил, п-метоксибензил, тритил, 2-хлортритил или твердофазный носитель, с которым была связана группа, можно использовать в качестве защитных групп для карбоксила.
Например, в качестве защитных групп для гидроксила можно использовать метил, тритил, метоксиметил (МОМ), 1-этоксиэтил (ЕЕ), метоксиэтоксиметил (МЕМ), 2-тетрагидропиранил (ТНР), триметилсилил (TMS), триэтилсилил (TES), трет-бутилдиметилсилил (TBDMS), трет-бутилдифенилсилил (TBDPS), ацетил (Ас), пивалоил, бензоил, бензил (Bn), п-метоксибензил, аллилоксикарбонил (Alloc) и 2,2,2-трихлорэтоксикарбонил (Troc).
Например, в качестве защитных групп для амино- и амидиногруппы можно использовать бензилоксикарбонил, трет-бутоксикарбонил, аллилоксикарбонил (Alloc), 1-метил-1-(4-бифенил)этоксикарбонил (Bpoc), трифторацетил, 9-фторенилметоксикарбонил, бензил (Bn), п-метоксибензил, бензилоксиметил (ВОМ) и 2-(триметилсилил)этоксиметил (SEM).
Бензил, метоксибензил, метоксиметил (МОМ), 2-тетрагидропиранил (ТНР), дифенилметил и ацетил (Ас) могут использоваться в качестве защитных групп для тиола.
В качестве защитных групп для карбоксильной, гидроксильной или аминогруппы также предпочтительны другие группы, которые можно легко и избирательно удалить, отличные от указанных выше защитных групп. Например, можно использовать группы, описанные в публикации T.W. Greene, Protective Groups in Organic Synthesis, Wiley, New York, 1999.
В настоящем изобретении «заместители» «бензола, нафталина, пиридина, 1,3-диоксаиндана или бензотиадиазола, кольца которых могут быть замещены заместителями», означают (а) С1-8 алкил, (b) С2-8 алкенил, (с) С2-8 алкинил, (d) атом галогена, (е) трифторметил, (f) трифторметокси, (g) циано, (h) нитро, (j) NR3R4, (k) OR5, (l) SH, (m) S(O)nR6, (n) COR5, (o) COOR5, (p) CONR3R4, (q) NR7COR5, (r) NR7COOR5, (s) NR3CONR3R4, (t) С3-10 моно- или бикарбоциклическое кольцо, (u) 3-10-членное моно- или бигетероциклическое кольцо, содержащее 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы, или (v) С1-4 алкил, замещенный 1-2 заместителями, выбранными из атома галогена, трифторметила, трифторметокси, циано, нитро, NR3R4, OR5, =N-OR5, SH, S(O)nR6, COR5, COOR5, CONR3R4, С3-10 моно- или бикарбоциклического кольца, и 3-10-членного моно- или бигетероциклического кольца, содержащего 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы.
R3, R4, R5, R6 и n является такими, как определено выше в настоящем описании.
R7 представляет собой (i) водород, (ii) С1-8 алкил, (iii) С2-8 алкенил, (iv) С2-8 алкинил, (v) С3-10 моно- или бикарбоциклическое кольцо, (vi) 3-10-членное моно- или бигетероциклическое кольцо, содержащее 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы, или (vii) С1-4 алкил, замещенный 1-2 заместителями, выбранными из атома галогена, трифторметила, OCF3, циано, нитро, NR3R4, OR5, =N-OR5, SH, S(O)nR6, COR5, COOR5, CONR3R4, С3-10 моно- или бикарбоциклического кольца, и 3-10-членного моно- или бигетероциклического кольца, содержащего 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы.
В настоящем изобретении заместители «бензола, нафталина, пиридина, 1,3-диоксаиндана или бензотиадиазола, кольца которых могут быть замещены заместителями», представляют собой С1-8 алкил, атом галогена, трифторметил, трифторметокси, циано, NR3аR4а, в которой R3а и R4а, каждый независимо, представляет собой водород или С1-4 алкил; OR5а, в которой R5а представляет собой водород или С1-4 алкил; S(O)nR6а, в которой R6а представляет собой С1-4 алкил; CHO, COOR5, CONR3aR4a, С3-7 циклоалкил, фенил, нафтил, фурил, тиенил, пирролил, пиридил или С1-4 алкил, замещенный 1-2 заместителями, выбранными из атома галогена, трифторметила, трифторметокси, циано, NR3аR4а, OR5а, CHO, COOR5a, CONR3aR4a, С3-7 циклоалкил, фенил, нафтил, фурил, тиенил, пирролил и пиридил.
В настоящем изобретении предпочтительная группа Ar представляет собой бензол, пиридин или бензотиадиазол, который может быть замещен указанными выше заместителями.
В настоящем изобретении атом галогена, представленный Х, представляет собой хлорид, бромид, фторид или йодид, и предпочтительными являются хлорид и бромид.
В настоящем изобретении атом металла, представленный М, представляет собой натрий, калий или литий, а предпочтителен натрий.
В настоящем изобретении предпочтительный радикал R1 представляет собой (i) С1-8 алкил, (ii) С2-8 алкенил, (iii) С2-8 алкинил или (iv) С1-4 алкил, замещенный 1-2 заместителями, выбранными из трифторметила, NR3R4, OR5, S(O)nR6, COR5, COOR5, CONR3R4, С3-10 моно- или бикарбоциклическое кольцо и 3-10-членное моно- или бигетероциклическое кольцо, содержащее 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы.
Особенно предпочтительным R1 является -CH2-R2. И предпочтительный R2 представляет собой (i) С1-7 алкил, (ii) С2-7 алкенил, (iii) С2-7 алкинил или (iv) трифторметил, NR3аR4а, OR5а, S(O)nR6а, COR5а, COOR5а, CONR3аR4а, 3-10-членное моно- или бикарбоциклическое кольцо или 3-10-членное моно- или бигетероциклическое кольцо, содержащее 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы, или метилен, замещенный ими. Особенно предпочтительный R2 представляет собой (i) С1-7 алкил или (ii) трифторметил, OR5а, S(O)nR6а, С3-7 циклоалкил, фенил, фурил, тиенил, пирролил, или пиридил, или метилен, замещенный ими, в которых R3а, R4а, R5а и R6а представляют собой, как определено выше в настоящем описании.
В описании С1-4 алкил включает метил, этил, пропил, бутил и их изомерные группы.
В описании С1-8 алкил включает метил, этил, пропил, бутил, пентил, гексил, гептил, октил и их изомерные группы.
В описании С2-8 алкенил включает этил, пропил, бутил, пентил, гексил, гептил, октил, имеющий 1-3 двойные связи и их изомерные группы. Например, приводятся винил, пропенил, бутенил, пентенил, гексенил, гексадиенил, гептенил, гептадиенил, октенил и октадиенил.
В описании С2-8 алкинил включает этил, пропил, бутил, пентил, гексил, гептил, октил, имеющие 1-3 тройных связи, и их изомерные группы. Например, приводятся этинил, пропинил, бутинил, пентинил, гексинил, гексадиинил, гептинил, гептадиинил, октинил и октадиинил.
В описании атом галогена включает фтор, хлор, бром и йод.
В описании С5-6 карбоциклическое кольцо представляет собой С5-6 карбоциклический арил или его частично или полностью насыщенную форму. Например, приводятся циклопентан, циклогексан, циклопентен, циклогексен, циклопентадиен, циклогексадиен и бензол.
В описании С3-7 циклоалкил представляет собой циклопропан, циклобутан, циклопентан, циклогексан или циклогептан.
В описании С3-10 моно- или бициклическое кольцо представляет собой С3-10 моно- или бициклический арил или его частично или полностью насыщенную форму. Например, приводятся циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклопентен, циклогексен, циклопентадиен, циклогексадиен, бензол, пентален, инден, нафталин, азулен, пергидропентален, индан, пергидроинден, тетрагидронафталин, пергидронафталин и пергидроазулен.
В описании 5- или 6-членное гетероциклическое кольцо, содержащее 1-2 атома азота, 1 атом кислорода и/или 1 атом серы, представляет собой 5- или 6-членный гетероциклический арил, содержащий 1-2 атома азота, 1 атом кислорода и/или 1 атом серы, или его частично или полностью насыщенную форму. Например, приводятся пиррол, имидазол, пиразол, пиридин, пиразин, пиримидин, пиридазин, фуран, пиран, тиофен, тиаин (тиопиран), оксазол, изоксазол, тиазол, изотиазол, пирролин, пирролидин, пиперидин, имидазолин, имидазолидин, пиразолин, пиразолидин, пиперазин, пергидропиримидин, пергидропиридазин, дигидрофуран, тетрагидрофуран, тетрагидропиран, дигидротиофен, тетрагидротиофен, тетрагидротиаин, морфолин и тиоморфолин.
В описании 3-10-членное моно- или бигетероциклическое кольцо, содержащее 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атом серы, представляет собой 3-10-членный моно- или бигетероциклический арил, содержащий 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы, или его частично или полностью насыщенную форму.
Указанный выше 3-10-членный моно- или бигетероциклический арил, содержащий 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы, представляет собой, например, пиррол, имидазол, пиразол, триазол, тетразол, пиридин, пиразин, пиримидин, пиридазин, азепин, диазепин, фуран, пиран, оксепин, тиофен, тиаин (тиопиран), тиепин, оксазол, изоксазол, оксадиазол, оксазин, оксадиазин, оксазепин, оксадиазепин, тиазол, изотиазол, тиадиазол, тиазин, тиадиазин, тиазепин, тиадиазепин, индол, изоиндол, индолизин, бензофуран, изобензофуран, бензотиофен, изобензотиофен, индазол, хинолин, изохинолин, хинолизин, фталазин, нафтиридин, хиноксалин, хиназолин, циннолин, бензоксазол, бензоксадиазол, бензотиазол, бензимидазол, бензофуразан, бензотиадиазол или бензотриазол.
Указанный выше частично или полностью насыщенный 3-10-членный моно- или бигетероциклический арил, содержащий 1-4 атома азота, 1-2 атома кислорода и/или 1-2 атома серы, представляет собой, например, азиридин, азетин, азетидин, пиролин, пирролидин, имидазолин, имидазолидин, пиразолин, пиразолидин, триазолин, триазолидин, тетразолин, тетразолидин, пиперидин, пиперазин, дигидропиридин, тетрагидропиридин, дигидропиразин, тетрагидропиразин, дигидропиримидин, тетрагидропиримидин, пергидропиримидин, дигидропиридазин, тетрагидропиридазин, пергидропиридазин, дигидроазепин, тетрагидроазепин, пергидроазепин, дигидродиазепин, тетрагидродиазепин, пергидродиазепин, оксиран, оксетан, дигидрофуран, тетрагидрофуран, дигидропиран, тетрагидропиран, дигидрооксепин, тетрагидрооксепин, пергидрооксепин, трииран, тиетан, дигидротиофен, тетрагидротиофен, дигидротиаин (дигидротиопиран), тетрагидротиаин (тетрагидротиопиран), дигидротиепин, тетрагидротиепин, пергидротиепин, оксазолин (дигидрооксазол), оксазолидин (тетрагидрооксазол), дигидроизоксазол, тетрагидроизоксазол, оксадиазолин (дигидрооксадиазол), оксадиазолидин (тетрагидрооксадиазол), тиазолин (дигидротиазол), тиазолидин (тетрагидротиазол), дигидроизотиазол, тетрагидроизотиазол, морфолин, тиоморфолин, индолин, изоиндолин, дигидробензофуран, пергидробензофуран, дигидроизобензофуран, пергидроизобензофуран, дигидробензотиофен, пергидробензотиофен, дигидроизобензотиофен, пергидроизобензотиофен, дигидроиндазол, пергидроиндазол, дигидрохинолин, тетрагидрохинолин, пергидрохинолин, дигидроизохинолин, тетрагидроизохинолин, пергидроизохинолин, дигидрофталазин, тетрагидрофталазин, пергидрофталазин, дигидронафтиридин, тетрагидронафтиридин, пергидронафтиридин, дигидрохиноксалин, тетрагидрохиноксалин, пергидрохиноксалин, дигидрохиназолин, тетрагидрохиназолин, пергидрохиназолин, дигидроциннолин, тетрагидроциннолин, пергидроциннолин, дигидробензоксазол, пергидробензоксазол, дигидробензоксазол, пергидробензотиазол, дигидробензимидазол, пергидробензимидазол, диоксолан, диоксан, диоксазин, диоксаиндан, хроман или изохроман.
В настоящем изобретении превосходные соли в отношении термической устойчивости 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина, отличные от метансульфоната, представляют собой тозилат, бензолсульфонат и камфорсульфонат (D, L или DL).
Получение соединения настоящего изобретения
Соединение (1) по настоящему изобретению можно получить взаимодействием 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина и метансульфоновой кислоты.
Детальнее, 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидин растворяют в органическом растворителе (например, этилацетате, метаноле, тетрагидрофуране, 1,2-диметоксиэтане, изопропиловом спирте, ацетонитриле), и затем к смеси при 20-60°С добавляют метансульфоновую кислоту. Осажденный кристалл собирают фильтрацией и сушат для получения целевого соединения.
С другой стороны, 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидин как материал можно получить способом, описанным в схеме 2.
Схема 2
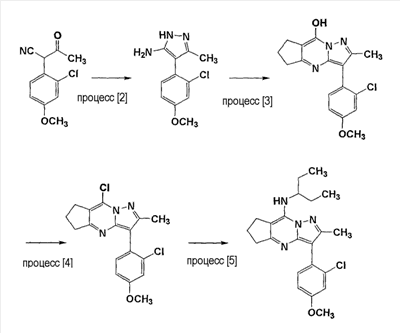
Процесс [2] проводят в органическом растворителе (например, толуоле, метаноле, изопропиловом спирте, этилацетате, изопропилацетате, тетрагидрофуране, ацетонитриле, диметилформамиде, диметилсульфоксиде) в присутствии кислоты (например, уксусной кислоты, пропионовой кислоты, п-толуолсульфоновой кислоты, метансульфоновой кислоты) с использованием гидразина, моногидрата гидразина или 60-80 мас.% водного раствора гидразина или моногидрата гидразина при 10-60°С или при кипячении с обратным холодильником.
Процесс [3] проводят, используя кислоту (например, уксусную кислоту, серную кислоту, метансульфоновую кислоту) в качестве растворителя при 50-100°С или при кипячении с обратным холодильником, или в органическом растворителе (например, метаноле, этаноле, толуоле, диметилформамиде, 1-пропаноле, 2-пропаноле, ацетонитриле) в присутствии кислоты (например, уксусной кислоты, серной кислоты, метансульфоновой кислоты, тозиловой кислоты) при 50-100°С или при кипячении с обратным холодильником.
В указанной выше реакции с использованием органического растворителя количество используемой кислоты было меньше, чем количество кислоты, используемой в качестве растворителя. Поэтому ее легко удалить, и можно обеспечить безопасность проведения реакции.
Процесс [4] проводят в органическом растворителе (например, толуоле, 1,2-диметоксиэтане, ацетонитриле, тетрагидрофуране) в присутствии основания (например, пиридина, триэтиламина, диметиланилина, диметиламинопиридина, диизопропилэтиламина, 2,6-лутидина, 2-пиколина, N-метилморфолина, N-этилморфолина, три-н-пропиламина, три-н-бутиламина) с использованием фосфорилхлорида при 70-120°С.
Процесс [5] проводят в органическом растворителе (например, толуоле, ксилоле, 1,2-диметоксиэтане, диметилформамиде, диметиламине, диметилсульфоксиде, 2-пропане, ацетонитриле) или без растворителя в присутствии или в отсутствие основания (например, триэтиламина, триметиламина, диизопропилэтиламина, N-метилморфолина, N-этилморфолина, три-н-пропиламина, три-н-бутиламина) при 80-150°С.
В случае использования метансульфоновой кислоты в настоящем изобретении можно использовать только ее, или ее можно растворить в органическом растворителе (например, этилацетате, метаноле, тетрагидрофуране, 1,2-диметоксиэтане, изопропиловом спирте, ацетонитриле, н-гептане) и добавлять по каплям для обеспечения безопасности. Метансульфоновая кислота характеризуется высокой едкостью и требует осторожности при манипуляциях.
Количество расходуемой метансульфоновой кислоты составляет от 0,5 до 2,2 эквивалентов, предпочтительно от 0,95 до 1,2 эквивалента относительно 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина.
Кроме того, после добавления метансульфоновой кислоты можно добавить органический растворитель (например, этилацетат, н-гептан) и перемешать для получения указанного выше кристалла.
Соединение (1) по настоящему изобретению можно очистить перекристаллизацией с использованием, по меньшей мере, одного из растворителей в виде низших спиртов, которые могут содержать воду и растворители на основе сложных эфиров; или смешанного растворителя из одного или нескольких растворителей и, по меньшей мере, одного из прямоцепочечных растворителей на основе алкана, которые могут содержать воду, растворители на основе сложных эфиров, растворители на основе цепочечных простых эфиров и растворители на основе кетонов.
В настоящем описании растворители в виде низших спиртов означают С1-4 алкановые растворители, имеющие гидроксил в структуре. Конкретно приводятся метанол, этанол и 2-пропанол.
В настоящем описании растворители на основе сложных эфиров означают растворители, имеющие сложноэфирную связь в структуре. Конкретно приводится этилацетат.
В настоящем описании растворители на основе прямоцепочечных алканов означают растворители, имеющие в структуре прямоцепочечный алкан. Конкретно приводятся н-пентан, н-гексан и н-гептан.
В настоящем описании растворители на основе цепочечных, простых эфиров означают растворители, имеющие в структуре связь простого эфира, а структура представляет собой цепь. Углеродный заместитель связи простого эфира может представлять собой цепь или кольцевую структуру. Конкретно приводятся 1,2-диметоксиэтан, простой циклопентилметиловый эфир, простой диэтиловый эфир, простой изопропиловый эфир и простой метил-трет-бутиловый эфир.
В настоящем описании растворители на основе кетонов означают растворители, имеющие в структуре кетоновую группу. Конкретно приводится ацетон и т.д.
Предпочтительное количество растворителей, расходуемых при перекристаллизации, составляет примерно от 1 до 100 мл, предпочтительнее примерно от 2 до 50 мл и особенно предпочтительно примерно от 5 до 20 мл на 1 г соединения (1).
Растворители, используемые для перекристаллизации, могут содержать воду. Содержание воды зависит от каждого растворителя, например, оно составляет от нуля до насыщенного количества каждого растворителя. Конкретно, в случае этилацетата, содержание воды составляет от 0 до 3,3%.
Кристалл можно высушить при нормальной температуре подогреванием или нагреванием, в соответствии с потребностью, под пониженным давлением или при нормальном давлении.
На каждой стадии в настоящем описании реакцию с нагреванием можно проводить, используя водяную баню, масляную баню, песочную баню или микроволны, что понятно специалисту в данной области.
При каждой реакции в настоящем описании продукты реакции можно очистить обычным способом очистки, например, дистилляцией при нормальном или пониженном давлении, высокоэффективной жидкостной хроматографией с использованием силикагеля или силиката магния, тонкослойной хроматографии, ионообменной смолы, акцепторной смолы, колоночной хроматографии, промывания или перекристаллизации. Очистку можно выполнять после каждой реакции или после нескольких реакций.
Лучший способ осуществления изобретения
Следующие примеры иллюстрируют, но не ограничивают настоящее изобретение.
Пример 1
1-циано-1-(2-хлор-4-метоксифенил)пропан-2-он
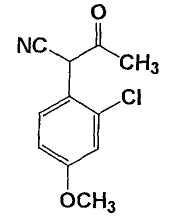
В атмосфере газа аргона к суспензии 1-бром-2-хлор-4-метоксибензола (54 г), цианоацетона натрия (28,2 г) и трет-бутоксида натрия (51,5 г) 1,2-диметоксиэтана (243 мл) добавляют тетракис(трифенилфосфин)палладий (7,04 г). Смесь нагревают при кипячении с обратным холодильником в течение 10,5 ч. Реакционную смесь охлаждают до 25°С и добавляют толуол (21,6 мл). Смесь перемешивают в течение 1 ч при внутренней температуре 20-30°С. Реакционную смесь фильтруют и полученное твердое вещество промывают толуолом. Полученное твердое вещество растворяют в 2 моль/л смешанного растворителя гидроксихлорида/толуола и смесь отделяют. Количество указанного в заголовке соединения в органическом слое (300,7 г) определяют, используя способ внутреннего эталона для ВЭЖХ.
Количественная оценка: 71%.
Выход: 38,7 г;
ТСХ: Rf 0,29 (н-гексан:этилацетат=3:1);
ЯМР (300 МГц, CDCl3):  7,38 (д, J=8,4 Гц, 1H), 7,01 (д, J=2,7 Гц, 1H), 6,90 (дд, J=8,4, 2,7 Гц, 1H), 5,12 (с, 1H), 3,83 (с, 3H), 2,29 (с, 3H). 7,38 (д, J=8,4 Гц, 1H), 7,01 (д, J=2,7 Гц, 1H), 6,90 (дд, J=8,4, 2,7 Гц, 1H), 5,12 (с, 1H), 3,83 (с, 3H), 2,29 (с, 3H).
Пример 2
1-циано-1-(2-хлор-4-метоксифенил)пропан-2-он
В атмосфере газа аргона к раствору 1-бром-2-хлор-4-метоксибензола (120 г) в смеси простого диэтиленгликольдиметилового эфира (230 мл) и 1,2-диметоксиэтана (90 мл) добавляют цианоацетон натрия (62,6 г), трет-бутоксид натрия (114,6 г) и йодид натрия (81,2 г) при перемешивании при комнатной температуре для получения суспензии. Использованием другого процесса в атмосфере газа аргона смесь простого диэтиленгликольдиметилового эфира (40 мл), ацетата палладия (426 мг) и трифенилфосфина (1,99 г) перемешивают в течение примерно 30 мин при 110°С для растворения. Этот раствор по каплям добавляют в указанную выше суспензию. Смесь нагревают до внутренней температуры 110-115°С и перемешивают в течение 7 ч. Реакционную смесь охлаждают, разбавляют этилацетатом (480 мл) и промывают водным раствором серной кислоты (101 г концентрированной серной кислоты на 660 мл воды). Органический слой дважды промывают 10% насыщенным водным раствором хлорида натрия (360 мл). К органическому слою добавляют активированный уголь (3,6 г). Смесь перемешивают в течение 1 ч и фильтруют. Фильтрат промывают этилацетатом (240 мл) для получения раствора 1-циано-1-(2-хлор-4-метоксифенил)пропан-2-она (971,7 г).
Выход указанного в заголовке соединения, определяемый с использованием способа внутреннего эталона для ВЭЖХ, описанного в примере 1, составляет 101,7 г.
Пример 3
5-амино-3-метил-4-(2-хлор-4-метоксифенил)пиразол
В атмосфере газа аргона к раствору соединения, полученного в примере 1 (38,7 г) в толуоле, последовательно добавляют уксусную кислоту (14,5 мл) и 60% водный раствор гидрата гидразина (17,7 мл) при внутренней температуре 10-30°С. Смесь перемешивают в течение 7 ч при внутренней температуре 45-55°С. К реакционному раствору, охлажденному до внутренней температуры 10-30°С, добавляют 2 моль/л хлористоводородной кислоты и затем смесь отделяют. Водный слой доводят до рН 6,5-7,5 добавлением 25 мас.% гидроксида натрия. К доведенному водному слою добавляют ацетат изопропила (216 мл). Отделенный органический слой концентрируют под пониженным давлением. Остаток нагревают и добавляют н-гептан. Раствор охлаждают при внутренней температуре 10-30°С. После осаждения кристалла раствор перемешивают в течение 30 мин. Кроме того, к раствору добавляют н-гептан и смесь перемешивают в течение 1 ч. Осажденный кристалл собирают фильтрацией, сушат под пониженным давлением в течение 14 ч или более примерно при 50°С с получением указанного в заголовке соединения, имеющего следующие физические данные (35,5 г (94,8% площади); количественная величина: 61% (2 процесса)).
ТСХ: Rf 0,34 (хлороформ:метанол=10:1).
ЯМР (300 МГц, CDCl3):  7,19 (д, J=8,1 Гц, 1H), 7,04 (д, J=2,7 Гц, 1H), 6,86 (дд, J=8,1, 2,7 Гц, 1H), 3,83 (с, 3H), 2,14 (с, 3H). 7,19 (д, J=8,1 Гц, 1H), 7,04 (д, J=2,7 Гц, 1H), 6,86 (дд, J=8,1, 2,7 Гц, 1H), 3,83 (с, 3H), 2,14 (с, 3H).
Пример 4
8-гидрокси-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидин
В атмосфере газа аргона к раствору соединения, полученного в примере 3 (26,0 г) в этаноле (109 мл), добавляют сложный этиловый эфир 2-оксоциклопентанкарбоновой кислоты (17,3 мл) при внутренней температуре 10-30°С и добавляют уксусную кислоту (18,7 мл). Смесь нагревают при кипячении с обратным холодильником в течение 7 ч при внутренней температуре 80-90°С. После охлаждения реакционной смеси до внутренней температуры 55-65°С добавляют толуол (109 мл). Разбавленный раствор перемешивают в течение 30 мин или более при внутренней температуре 40-65°С и затем раствор охлаждают до 10-30°С. Осажденный кристалл собирают фильтрацией, сушат под пониженным давлением в течение 14 ч или более примерно при 50°С с получением указанного в заголовке соединения, имеющего следующие физические данные (33,3 г (98,6% площади); количественная величина: 92,8%).
ТСХ:Rf 0,59 (хлороформ:метанол:уксусная кислота:вода = 50:10:1:1).
ЯМР (300 МГц, ДМСО-d6): 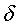 12,04 (с, 1H), 7,31 (д, J=8,4 Гц, 1H), 7,18 (д, J=2,4 Гц, 1H), 7,00 (дд, J=8,4, 2,4 Гц, 1H), 3,81 (с, 3H), 2,82 (т, J=7,5 Гц, 2H), 2,66 (т, J=6,9 Гц, 2H), 2,11 (с, 3H), 2,03 (м, 2H). 12,04 (с, 1H), 7,31 (д, J=8,4 Гц, 1H), 7,18 (д, J=2,4 Гц, 1H), 7,00 (дд, J=8,4, 2,4 Гц, 1H), 3,81 (с, 3H), 2,82 (т, J=7,5 Гц, 2H), 2,66 (т, J=6,9 Гц, 2H), 2,11 (с, 3H), 2,03 (м, 2H).
Пример 5
8-хлор-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидин
В атмосфере газа аргона к суспензии соединения, полученного в примере 4 (300 г) в толуоле (910 мл), добавляют N,N-диизопропилэтиламин (141 г) и затем по каплям добавляют фосфорилхлорид (419 г). Смесь перемешивают в течение 9 ч при внутренней температуре 80-95°С. Реакционный раствор, охлажденный до внутренней температуры до 20-30°С, выливают в смешанный растворитель этилацетата и воды и смесь перемешивают в течение 15 мин. Органический слой промывают насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, затем добавляют активированный уголь (30 г) с последующим перемешиванием в течение 1 ч и смесь фильтруют. К фильтрату добавляют N,N-диметилацетамид (600 мл). Смесь концентрируют под пониженным давлением. Раствор указанного в заголовке соединения (316,9 г; превращение 100%), имеющего следующие физические данные, в N,N-диметилацетамиде используют на следующей стадии без очистки.
ТСХ: Rf 0,42 (н-гексан:этилацетат=2:1).
ЯМР (300 МГц, CDCl3): 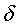 7,28 (д, J=8,7 Гц, 1H), 7,07 (д, J=2,4 Гц, 1H), 6,90 (дд, J=8,7, 2,4 Гц, 1H), 3,84 (с, 3H), 3,06 (м, 4H), 2,43 (с, 3H), 2,23 (м, 2H). 7,28 (д, J=8,7 Гц, 1H), 7,07 (д, J=2,4 Гц, 1H), 6,90 (дд, J=8,7, 2,4 Гц, 1H), 3,84 (с, 3H), 3,06 (м, 4H), 2,43 (с, 3H), 2,23 (м, 2H).
Пример 6
8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидин
В атмосфере газа аргона смесь раствора соединения, полученного в примере 5 (177,6 г) в N,N-диметилацетамиде (355 мл), и раствора триэтиламина (103,2 г) и 3-аминопентана (88,9 г) в изопропиловом спирте (178 мл) перемешивают в течение 4 ч при внутренней температуре 95-105°С. Воду выливают в реакционный раствор, который был охлажден до внутренней температуры 70-80°С. Разбавленный раствор охлаждают до внутренней температуры 50-60°С и затем после осаждения кристалла раствор перемешивают в течение 30 мин. Кроме того, воду выливают в раствор и разбавленный раствор перемешивают в течение 1 ч при внутренней температуре 20-30°С. Осажденный кристалл собирают фильтрацией и полученный кристалл сушат под пониженным давлением в течение 14 ч или более при примерно 50°С с получением неочищенного кристалла указанного в заголовке соединения (174 г (97,4% площади), количественная величина: 85% (2 процесса)).
Раствор полученного неочищенного кристалла (1,0 г) в этаноле/воде (3/1; 2 мл) нагревают при кипячении с обратным холодильником в масляной бане. Кроме того, добавляют этанол/воду (3/1; 5 мл). Масляную баню удаляют и раствору дают возможность постоять в течение ночи. Осажденный кристалл собирают фильтрацией, промывают этанолом/водой (3/1) и сушат под пониженным давлением в течение 14 ч или более примерно при 50°С с получением указанного в заголовке соединения (920 мг), имеющего следующие физические данные.
ТСХ:Rf 0,45 (н-гексан:этилацетат=2:1).
ЯМР (300 МГц, CDCl3): 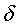 7,31 (д, J=8,4 Гц, 1H), 7,05 (д, J=2,7 Гц, 1H), 6,88 (дд, J=8,4, 2,7 Гц, 1H), 6,22 (ушир.д, J=10,5 Гц, 1H), 3,82 (с, 3H), 3,80 (м, 1H), 3,08 (т, J=7,2 Гц, 2H), 2,90 (т, J=7,5 Гц, 2H), 2,34 (с, 3H), 2,14 (м, 2H), 1,52-1,82 (м, 4H), 1,01 (т, J=7,5 Гц, 3H). 7,31 (д, J=8,4 Гц, 1H), 7,05 (д, J=2,7 Гц, 1H), 6,88 (дд, J=8,4, 2,7 Гц, 1H), 6,22 (ушир.д, J=10,5 Гц, 1H), 3,82 (с, 3H), 3,80 (м, 1H), 3,08 (т, J=7,2 Гц, 2H), 2,90 (т, J=7,5 Гц, 2H), 2,34 (с, 3H), 2,14 (м, 2H), 1,52-1,82 (м, 4H), 1,01 (т, J=7,5 Гц, 3H).
Пример 7
Метансульфонат 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина
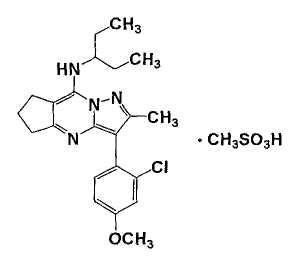
Неочищенный кристалл, полученный в примере 6 (71,6 г), растворяют в этилацетате (250 мл) при нагревании. После охлаждения раствора до внутренней температуры 50°С в раствор по каплям добавляют 99,3%-ную метансульфоновую кислоту (17,3 г). К смешанному раствору, охлажденному до внутренней температуры 30°С, добавляют н-гептан и затем смесь перемешивают в течение 30 мин при 25°С. Полученный кристалл охлаждают фильтрацией и сушат под пониженным давлением в течение 14 ч или более примерно при 50°С до получения указанного в заголовке соединения (87,1 г (97,4% площади); количественная величина: 98%) в виде порошкообразного кристалла.
ТСХ: Rf 0,17 (н-гексан:этилацетат=2:1);
точка плавления: 196-197°С (без коррекции, нагретый блок металла);
ЯМР (300 МГц, CDCl3): 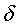 7,36 (д, J=8,4 Гц, 1H), 7,23 (д, J=10,5 Гц, 1H), 7,08 (д, J=2,4 Гц, 1H), 6,97 (дд, J=8,4, 2,4 Гц, 1H), 4,03-3,90 (м, 1H), 3,85 (с, 3H), 3,63-3,35 (м, 2H), 3,13 (т, J=7,2 Гц, 2H), 2,42 (с, 3H), 2,35-2,25 (м) и 2,34 (с) всего 5H, 1,90-1,50 (м, 4H), 1,06 (т, J=7,5 Гц) и 1,05 (т, J=7,5 Гц) всего 6H. 7,36 (д, J=8,4 Гц, 1H), 7,23 (д, J=10,5 Гц, 1H), 7,08 (д, J=2,4 Гц, 1H), 6,97 (дд, J=8,4, 2,4 Гц, 1H), 4,03-3,90 (м, 1H), 3,85 (с, 3H), 3,63-3,35 (м, 2H), 3,13 (т, J=7,2 Гц, 2H), 2,42 (с, 3H), 2,35-2,25 (м) и 2,34 (с) всего 5H, 1,90-1,50 (м, 4H), 1,06 (т, J=7,5 Гц) и 1,05 (т, J=7,5 Гц) всего 6H.
Данные физических свойств кристалла
Спектр дифракции рентгеновских лучей порошка, ИК спектр и график DSC соединения, полученного в примере 7, измеренные в указанные ниже сроки и при указанных условиях, показаны на фиг.3, 4 и 1.
(1) Спектр дифракции рентгеновских лучей порошка
| Прибор: |
BRUKER DISCOVER c GADD(C2), изготавливаемый BRUKER |
| Мишень: |
Cu |
| Фильтр: |
Нет |
| Напряжение: |
40 кВ |
| Электрический ток: |
40 мА |
| Время воздействия: |
5 мин |
(2) Спектр резонанса инфракрасного излучения (IR)
| Прибор: |
FTIR-660Plus, изготовленный JASCO Corporation/DURASCOPE, изготовленный SENSIR |
| Способ измерения: |
Кристалл измеряют методом ATR |
| Выполнение растворения: |
4 см-1 |
| Количество сеансов сканирования: |
16 раз |
| (3) Дифференциальный сканирующий калориметр (DSC) |
|
| Прибор: |
SEIKO INSTRUMENT DSC6200 |
| Количество образца: |
6,35 мг |
| Ячейка образца: |
Открытая алюминиевая ячейка |
| Поток газообразного азота: |
20 мл/мин |
| Скорость нагревания: |
5°С/мин |
Пример 7(1)
Соединение, полученное в примере 7 (500 мг), помещают в завинчивающуюся трубку (диаметром 18 мм, длиной 40 мм) и затем добавляют метанол (0,5 мл) и этилацетат (0,5 мл). После закрытия крышки завинчивающуюся трубку нагревают в масляной бане. После растворения твердого вещества смеси дают возможность охладиться в условиях защиты от света и при комнатной температуре и получают монокристалл метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина.
Данные рентгеноструктурного анализа монокристалла соединения (1) показаны в виде фиг.5 и 6.
Условия измерения
| Прибор: |
Устройство для рентгеноструктурного анализа монокристалла R-AXIS RAPID, изготовленный Rigaku Co. |
| Программное обеспечение анализа: |
“Crystal Structure”, изготовленная Rigaku Co. |
| Температура измерения: |
Комнатная температура |
| Мишень: |
CuK ( ( =1,54187Å) =1,54187Å) |
| R=0,059. |
|
Получены следующие кристаллографические данные:
| Константа решетки: |
a=8,165(2)Å, b=38,140(8)Å, c=7,947(2)Å,
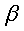 =94,32(2)° =94,32(2)° |
| Пространственная группа: |
P21/c |
Пример 8
Тозилат 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина
Неочищенный кристалл, полученный в примере 6 (100 мг), растворяют в тетрагидрофуране (0,5 мл) при нагревании. Смесь охлаждают до 60°С и к смеси добавляют тозиловую кислоту (47,7 мг). Смесь охлаждают до 25°С и добавляют простой метил-трет-бутиловый эфир (2,5 мл). Осажденный кристалл собирают фильтрацией. Полученный кристалл сушат в течение 14 ч или более под пониженным давлением при 50°С с получением указанного в заголовке соединения (105 мг, (97,6% площади); количественная величина: 71,1%), имеющего следующие физические данные как кристалл порошка.
ТСХ: Rf 0,38 (н-гексан:этилацетат=2:1);
ЯМР (300 МГц, CDCl3): 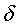 7,51 (д, J=8,4 Гц, 2H), 7,31 (д, J=8,6 Гц, 1H), 7,30-7,20 (м, 1H), 7,09 (д, J=8,4 Гц, 2H), 6,93 (д, J=2,6 Гц, 1H), 6,69 (дд, J=8,6, 2,6 Гц, 1H), 4,10-3,90 (м, 1H), 3,80-3,35 (м) и 3,72 (с) всего 5H, 3,14 (т, J=7,2 Гц, 2H), 2,40-2,20 (м, 2H), 2,35 (с, 3H), 2,33 (с, 3H), 1,90-1,60 (м, 4H), 1,06 (т, J=7,5 Гц) и 1,05 (т, J=7,5 Гц) всего 6H. 7,51 (д, J=8,4 Гц, 2H), 7,31 (д, J=8,6 Гц, 1H), 7,30-7,20 (м, 1H), 7,09 (д, J=8,4 Гц, 2H), 6,93 (д, J=2,6 Гц, 1H), 6,69 (дд, J=8,6, 2,6 Гц, 1H), 4,10-3,90 (м, 1H), 3,80-3,35 (м) и 3,72 (с) всего 5H, 3,14 (т, J=7,2 Гц, 2H), 2,40-2,20 (м, 2H), 2,35 (с, 3H), 2,33 (с, 3H), 1,90-1,60 (м, 4H), 1,06 (т, J=7,5 Гц) и 1,05 (т, J=7,5 Гц) всего 6H.
Фармакологическая активность
Следующими экспериментами было подтверждено, что соединение (1) обладает антагонистической активностью в отношении рецепторов CRF.
Эксперимент 1
Анализ связывания
Препарат клеточной мембраны
После того как клеточную линию, экспрессирующую человеческий рецептор CRF1 (экспрессированные клетки клеточной линии СНО-К1), культивировали для достижения слияния, клетки собирали скребком. Собранные клетки промывали дважды PBS (солевым раствором с фосфатным буфером) перед суспендированием в буфере для анализа связывания (Tris-HCl (50 мМ, рН 7,0), EDTA (2 мМ, рН 8,0) и MgCl2 (10 мМ)), охлажденном льдом. Суспендированные клетки гомогенизировали гомогенизатором типа Downs и подвергали центрифугированию при 10000g для сбора мембранной фракции. Собранную фракцию клеточных мембран ресуспендировали небольшим количеством буфера для анализа связывания и дополнительно разбавляли указанным буфером до 1 мг/мл. Полученную таким образом мембранную фракцию использовали для анализа связывания.
Анализ связывания
50 мкл [125I] человеческих рецепторов CRF, доведенные до 0,5 нМ буфером для анализа связывания, добавляли в силиконизированные пробирки емкостью 1,5 мл. В пробирки добавляли по 1 мкл каждого из соединений, разведенных соответствующее число раз, DMSO (для использования при общем связывании) и раствором человеческих рецепторов CRF (100 мкМ для использования при неспецифическом связывании). Образцы препарата фракции мембран, по 50 мкл каждый, добавляли в пробирки для инициации реакции (конечная концентрация [125I] человеческих рецепторов CRF 0,25 нМ), затем смеси инкубировали в течение 2 ч при комнатной температуре. После окончания реакции пробирки подвергали центрифугированию при 20000g для сбора мембранной фракции. Надосадочную жидкость удаляли и осадок в пробирке после центрифугирования промывали дважды охлажденным PBS (-), содержащим 0,01% Triton X-100. Величины радиоактивности соответствующих пробирок измеряли с помощью  -счетчика. -счетчика.
Специфическое связывание получали вычитанием величины неспецифического связывания из каждой величины связывания.
Результаты указали на то, что соединение (1) проявляло мощный аффинитет к рецептору CRF1 (IC50:<1 мкМ).
Эксперимент 2
Антагонистическая активность в отношении рецепторов (анализ циклического АМФ (аденозинмонофосфата)
Линию клеток, экспрессирующую человеческий рецептор CFR1, культивировали, используя 10% сыворотку телячьего эмбриона и 1% питательную смесь F-12, содержащую антибиотики и противогрибковое средство, в условиях температуры 37°С, содержания 5% СО2 и 95% воздуха. В день перед измерением циклического АМФ клетки высевали в 96-луночную планшету для доведения их концентрации до 1·104 клеток/лунку. В день измерения клетки промывали дважды питательной смесью F-12 и в каждую лунку добавляли питательную смесь F-12/1 мМ 3-изобутил-1-метилксантин (аналитическая среда) (178 мкл). После инкубации в течение 10 мин при 37°С к группе CRF и к контрольной группе добавляли каждый из различных концентрированных растворов испытуемого соединения (2 мкл) или добавляли DMSO (2 мкл). После инкубации в течение 15 мин при 37°С к группе испытуемого соединения и к группе CRF добавляли 10 нМ аналитической среды, содержащей человеческий/крысиный CRF (20 мкл). К контрольной группе добавляли аналитическую среду, содержащую 0,00001% уксусную кислоту (20 мкл). Кроме того, их инкубировали в течение 15 мин при 37°С. Надосадочную жидкость удаляли и реакцию останавливали охлаждением, используя лед. Все реакции также проводили в 3 лунках. Кумулятивную дозу внутриклеточного циклического АМФ измеряли системой ферментного иммуноанализа Biotrak (Amersham Biosciences). Кумулятивную дозу циклического АМФ получали вычитанием средней величины по 3 лункам контрольной группы из средней величины по 3 лункам. Величины IC50 рассчитывали нелинейным регрессионным анализом логарифма концентрата соединения в виде автономной переменной величины, а кумулятивную дозу АМФ – в виде индуцированной переменной величины.
Результаты указали на то, что соединение (1) проявляло мощную антагонистическую активность в отношении рецептора CRF (IC50<1 мкМ).
Пример 1 составления композиции
Следующие компоненты смешивали обычным способом и прессовали для получения 1000000 таблеток, содержащих по 10 мг активного ингредиента каждая.
| Метансульфонат 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина |
10 кг |
| Карбоксиметилцеллюлоза кальция (разрыхлитель) |
2 кг |
| Стеарат магния (смазывающее вещество) |
1 кг |
| Микрокристаллическая целлюлоза |
87 кг |
Пример 2 составления композиции
Следующие компоненты смешивали обычным способом. Раствор стерилизовали обычным путем, порции по 5 мл помещали в ампулы и лиофилизировали для получения 1000000 ампул, каждая из которых содержала 20 мг активного ингредиента.
| Метансульфонат 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-a]пиримидина |
20 кг |
| Маннит |
200 кг |
| Дистиллированная вода |
5 кг |
| 1н хлористоводородная кислота |
От 20 до 30 мл |
Формула изобретения
1. Метансульфонат 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-а]пиримидина.
2. Кристалл метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигадро-5Н-циклопента[d]пиразол[1,5-а]пиримидина, который имеет угол дифракции 20 при 8,96, 12,70, 13,69, 14,98, 15,74, 16,38, 17,63, 18,98, 19,71, 20,49, 21,37, 22,26, 22,88, 23,76, 24,70, 25,79 и 26,57 на спектре дифракции рентгеновских лучей порошка и/или поглощение в инфракрасном резонансном спектре при 1652, 1595, 1549, 1220, 1168, 1141, 1115, 1034, 790, 766, 548, 533 и 522 см-1.
3. Способ получения кристалла метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол [1,5-а]пиримидина по п.2, который включает взаимодействие 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-а]пиримидина с метансульфоновой кислотой.
4. Фармацевтическая композиция, представляющая собой антагонист CRF, включающая соединение по п.1 в качестве активного ингредиента.
5. Фармацевтическая композиция, представляющая собой антагонист CRF, включающая 1% или более кристалла по п.2 в качестве активного ингредиента.
6. Фармацевтическая композиция по п.4, которая представляет собой средство для предотвращения и/или лечения заболевания, опосредованного CRF.
7. Фармацевтическая композиция по п.6, где заболевание, опосредованное CRF, представляет собой нейропсихиатрическое расстройство или заболевание пищеварительной системы.
8. Фармацевтическая композиция по п.7, где нейропсихиатрическое расстройство представляет собой расстройство поведения, тревожное расстройство, расстройство, связанное со стрессом, расстройство, связанное с потреблением пищи, симптом, вызванный применением психомиметического препарата или зависимостью от него, органическое психическое расстройство, шизофрению или расстройство с дефицитом внимания и гиперактивностью.
9. Фармацевтическая композиция по п.7, где заболевание пищеварительной системы представляет собой желудочно-кишечное расстройство, вызванное стрессом.
10. Фармацевтическая композиция по п.8, где расстройство настроения представляет собой депрессию, одиночный эпизод депрессии, рецидивирующую депрессию, послеродовую депрессию, депрессию, вызванную жестоким обращением с детьми, биполярное аффективное расстройство или предменструальное дисфорическое расстройство.
11. Антагонист CRF, включающий метансульфонат 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-а]пиримидина по п.1 в качестве активного ингредиента.
12. Препарат для инъекций, включающий метансульфонат 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-а]пиримидина по п.1.
13. Препарат для инъекций по п.12, который включает солюбилизирующий агент и/или регулятор рН.
14. Способ антагонизации CRF, который включает введение млекопитающим эффективного количества метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-а]пиримидина по п.1.
15. Применение метансульфоната 8-(3-пентиламино)-2-метил-3-(2-хлор-4-метоксифенил)-6,7-дигидро-5Н-циклопента[d]пиразол[1,5-а]пиримидина по п.1 для получения антагониста CRF.
16. Способ получения 1-циано-1-(2-хлор-4-метоксифенил)пропан-2-она из 1-бром-2-хлор-4-метоксибензола, отличающийся тем, что 1-бром-2-хлор-4-метоксибензол подвергают взаимодействию с цианоацетоном натрия в присутствии гомогенного катализатора на основе соединения палладиевой группы.
РИСУНКИ
|
|