Патент на изобретение №2345984
|
||||||||||||||||||||||||||
(54) СИНТЕЗ 4-АМИНО-2-БУТЕНОИЛХЛОРИДОВ И ИХ ИСПОЛЬЗОВАНИЕ ПРИ ПОЛУЧЕНИИ 3-ЦИАНОХИНОЛИНОВ
(57) Реферат:
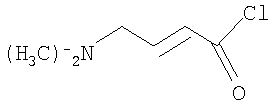
Изобретение относится к способу получения соединения формулы
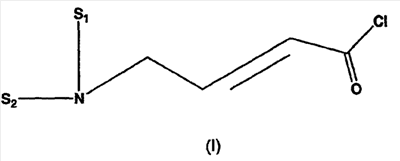
включающему взаимодействие бут-2-еновой кислоты с хлортриметилсиланом, бромирование полученного триметилсилилкротоната N-бромсукцинимидом, взаимодействие полученного триметилсилил-4-бромкротоната либо метил или этил 4-бромкротоната с диметиламином для получения 4-диметиламинокротоновой кислоты, вьщеление его в виде хлористоводородной соли и хлорирование оксалилхлоридом. Способ позволяет получить 4-диметиламино-2-бутеноилхлорид, пригодный для применения в качестве промежуточных соединений в синтезе фармацевтически активных ингибиторов протеинкиназ.
(56) (продолжение): CLASS=”b560m”efficient route to some
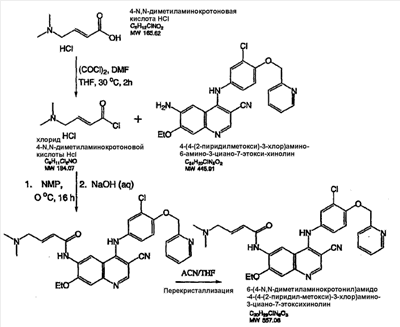
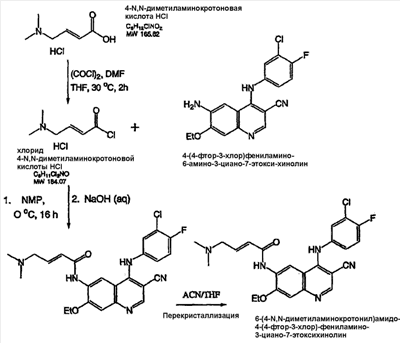
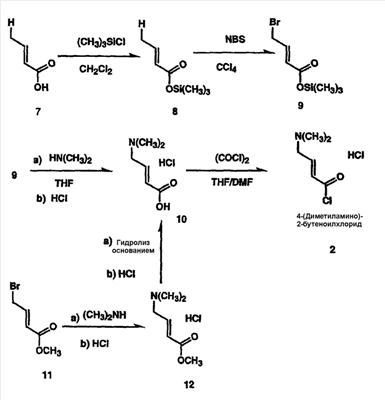
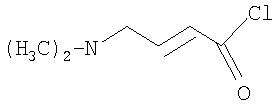
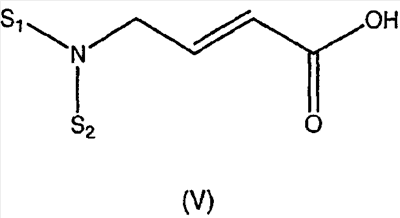
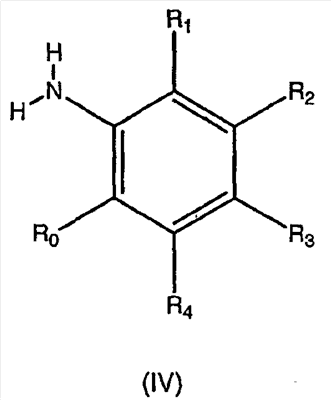
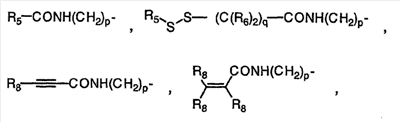
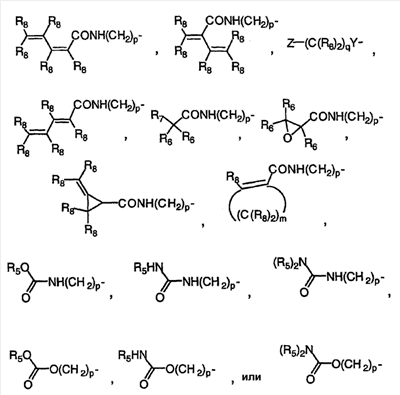
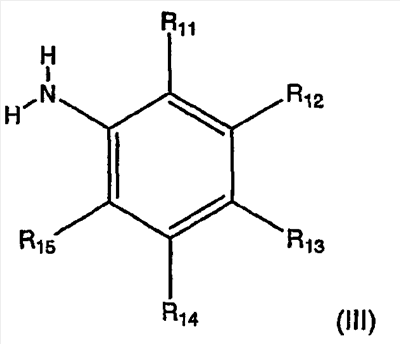
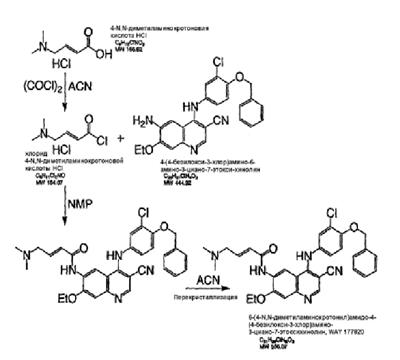
Изобретение касается ряда новых 4-амино-2-бутеноилхлоридов, способов их получения и их применения в качестве промежуточных соединений в синтезе фармацевтически активных ингибиторов протеинкиназ. Протеинкиназы представляют собой ферменты, переносящие фосфатную группу из АТФ в остаток аминокислоты, такой как тирозин, серин, треонин или гистидин на молекуле белка. Регулирование упомянутых протеинкиназ является существенным для контроля большого количества происходящих клеточных процессов, включая пролиферацию и миграцию. Конкретные протеинкиназы причастны к неблагоприятным состояниям, включая рак [Traxler, P.M., Exp. Opin. Ther. Patents, 8, 1599 (1998); Bridges, A.J., Emerging Drugs, 3, 279 (1998)], рестеноз [Mattsson, E., Trends Cardiovas. Med. 5, 200 (1995); Shaw, Trends Pharmacol. Sci. 16, 401 (1995)], атеросклероз [Raines, E.W., Bioessays, 18, 271 (1996)], ангиогенез [Shawver, L.K., Drug Discovery Today, 2, 50 (1997); Folkman, J., Nature Medicine, 1, 27 (1995)] и остепороз [Boyce, J. Clin. Invest., 90, 1622 (1992)]. B WO9843960 (US 6002008) описан синтез в лабораторном масштабе производных 3-цианохинолина, включающих [4-(3-хлор-4-фтор-фениламино)-3-циано-7-этокси-хинолин-6-ил]амид 4-диметил-амино-бут-2-еновой кислоты, ингибиторов протеинтирозинкиназ, используемых при лечении рака. Настоящее изобретение предлагает способы, подходящие для получения упомянутых соединений в широком (промышленном) масштабе. Кроме того, согласно данному изобретению могут быть получены промежуточные соединения, применимые в упомянутых способах. Согласно данному изобретению разработана методика синтеза, применимая в опытно-промышленном масштабе для получения соединений формулы (II): включающая охлаждение суспензии фармацевтически приемлемой соли соединения формулы (I); добавление к суспензии хлорирующего агента; нагревание и перемешивание суспензии до полного расходования хлорирующего агента; охлаждение суспензии; добавление по каплям анилина к суспензии до тех пор, пока концентрация анилина не достигнет уровня менее приблизительно 5%; добавление водного основания к суспензии для получения осадка; фильтрование, промывку и сушку осадка для получения соединения формулы (II). Согласно одному из вариантов осуществления данного изобретения соединение формулы (II) включает [4-(3-хлор-4-фтор-фениламино)-3-циано-7-этокси-хинолин-6-ил]амид 4-диметиламино-бут-2-еновой кислоты. Согласно другому варианту осуществления данного изобретения соединение формулы (II) включает 6-(4-N,N-диметиламинокротонил)амидо-4-(4-(2-пиридилметокси)-3-хлор)амино-3-циано-7-этоксихинолин. Согласно следующему варианту осуществления данного изобретения соединение формулы (II) включает 6-(4-N,N-диметиламинокротонил)амидо-4-(4-бензилокси)-3-хлор)амино-3-циано-7-этоксихинолин. Согласно данному изобретению также разработан способ получения соединения формулы (I), включающий взаимодействие 4-бромкротоната с S1,S2-N-R, в котором R представляет собой Н, триалкилсилил, щелочной металл, а каждый из S1 и S2 независимо представляет собой водород, алкил, алкенил, алкинил, аралкил, замещенный или незамещенный арил, циклоалкил, циклоалкенил, либо S1 и S2 вместе с атомом азота, к которому они присоединены, образуют азотсодержащий гетероарил; или его фармацевтически приемлемой соли для получения 4-S1,S2-аминокротоната; гидролиз 4-S1,S2-аминокротоната в присутствии основания; добавление к полученному соединению HCl; и хлорирование данного соединения хлорирующим агентом для получения соединения формулы (I). Согласно одному из вариантов осуществления настоящего изобретения S1 и S2 представляют собой СН3, а способ получения данного соединения включает взаимодействие бут-2-еновой кислоты с хлортриметилсиланом для получения триметилсилилкротоната; бромирование триметилсилилкротоната бромирующим агентом для получения триметилсилил-4-бромкротоната; взаимодействие триметилсилил-4-бромкротоната с диметиламином для получения 4-диметиламинокротоновой кислоты; хлорирование гидрохлорида 4-диметиламинокротоновой кислоты хлорирующим агентом для получения (Е)-4-(диметиламино)-2-бутеноилхлорида. Согласно первому аспекту данного изобретения предложено соединение формулы (I): в котором каждый из S1 и S2 независимо представляет собой водород, циклоалкил, циклоалкенил, алкил, алкенил, алкинил, аралкил, замещенный или незамещенный арил или гетероарил, либо S1 и S2 вместе с атомом азота, к которому они присоединены, образуют азотсодержащий гетероарил или циклогетероалкил; или его кислотно-аддитивная соль. Согласно второму аспекту данного изобретения разработан способ получения соединения в соответствии с настоящим изобретением, включающий: (а) взаимодействие 4-бромкротоната с S1,S2-N-R, в котором R представляет собой Н, триалкилсилил или щелочной металл, а S1 и S2 имеют указанные выше значения, или его кислотно-аддитивной солью для получения соответствующего 4-S1,S2-аминокротоната; (b) гидролиз 4-S1,S2-аминокротоната, полученного на стадии (а), в присутствии основания; и выделение соответствующей хлористоводородной соли; и (с) хлорирование соединения, полученного на стадии (b), хлорирующим агентом для получения соединения в соответствии с данным изобретением. Согласно третьему аспекту настоящее изобретение относится к способу получения соединения в соответствии с данным изобретением, в котором S1 и S2 представляют собой СН3, или его кислотно-аддитивной соли, включающему: (а) взаимодействие бут-2-еновой кислоты с хлортриметил-силаном для получения триметилсилилкротоната; (b) бромирование триметилсилилкротоната, полученного на стадии (а), бромирующим агентом для получения триметилсилил-4-бромкротоната; (с) взаимодействие триметилсилил-4-бромкротоната, полученного на стадии (b), либо метил или этил 4-бромкротоната с диметиламином для получения 4-диметиламинокротоновой кислоты; и (d) выделение соединения, полученного на стадии (с), в виде гидрохлорида и его хлорирование хлорирующим агентом для получения соединения в соответствии с данным изобретением, в котором S1 и S2 представляют собой СН3. Согласно четвертому аспекту настоящего изобретения разработан способ получения соединения формулы (II): в котором R1, R2, R3, R4 и R0 независимо выбраны из группы, включающей -Н, -CN, алкил, алкокси, винил, алкенил, формил, -CF3, -CCl3, галоид, -С6Н5, амид, ацил, сложный эфир, амино, тиоалкокси, фосфино, а также их сочетания; либо, R1 и R2, R2 и R3, R3 и R4 или R4 и R0, взятые вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенный гетероарил или циклогетероалкил; и S1 и S2 независимо выбраны из группы, включающей водород, алкил, алкенил, алкинил, аралкил, замещенный или незамещенный арил, либо S1 и S2 вместе с атомом азота, к которому они присоединены, образуют азотсодержащий гетероарил, включающий: (а) охлаждение суспензии кислотно-аддитивной соли соединения формулы (V): в которой S1 и S2 имеют указанные выше значения; (b) добавление хлорирующего агента к суспензии, полученной на стадии (а); (с) нагревание и перемешивание суспензии, полученной на стадии (b), до полного расходования хлорирующего агента; (d) охлаждение суспензии, полученной на стадии (с); (е) добавление по каплям анилина формулы (IV) к суспензии, полученной на стадии (d), до тех пор, пока концентрация анилина составит менее приблизительно 5%; где R1, R2, R3, R4 и R0 имеют вышеуказанные значения; (f) добавление водного основания к суспензии, полученной на стадии (е), для получения осадка; и (g) фильтрование, промывку и сушку осадка, полученного на стадии (f), для получения соединения формулы (II). Согласно данному изобретению гетероарил включает гетероциклическую кольцевую систему, содержащую от одного до трех конденсированных колец, в которой по меньшей мере одно кольцо может иметь ароматический характер и содержит от 1 до 4 одинаковых или различных гетероатомов, выбранных из группы, включающей S, N и О. Остальные кольца циклической системы могут быть полностью ненасыщенными, частично насыщенными или полностью насыщенными. Каждое кольцо включает от трех до десяти членов. Предпочтительными гетероарилруппами являются тиофен, тиантрен, фуран, пиран, изобензофуран, хромен, ксантен, феноксатиин, пиррол, имидазол, пиразол, изотиазол, изоксазол, пиридин, пиразин, пиримидин, пиридазин, индолизин, изоиндол, индол, индазол, пурин, хинолизин, изохинолин, хинолин, фталазин, нафтиридин, хиноксалин, хиназолин, птеридин, карбазол, фенантридин, акридин, перимидин, фенантролин, феназин, фенотиазин, фуразан, феноксазин и пирролидин. Гетероарил может быть независимо замещен в одной или нескольких позициях. Предпочтительными заместителями являются галоген, алкил, аралкил, алкенил, алкинил, циклоалкил, гидроксил, амино, нитро, сульфгидрил, имино, амидо, фосфонат, фосфинат, карбонил, карбоксил, силил, простой эфир, алкилтио, сульфонил, ацил, альдегид, сложный эфир, циклогетероалкил, ароматический или гетероароматический остаток, -CN или Y. Термин “циклогетероалкил” в данном описании означает 5-9-членное, насыщенное или ненасыщенное, моно- или бициклическое кольцо, содержащее 1 или 2 гетероатома, выбранных из N, N(С1-С6 алкила), S или О. Предпочтительными циклогетероалкилгруппами являются оксолан, тиолан, оксазол, пиперидин, пиперазин и морфолин. Циклогетероалкил может быть независимо замещен в одной или нескольких позициях. Предпочтительными заместителями являются галоген, алкил, аралкил, алкенил, алкинил, циклоалкил, гидроксил, амино, нитро, сульфгидрил, имино, амидо, фосфонат, фосфинат, карбонил, карбоксил, силил, простой эфир, алкилтио, сульфонил, кетон, альдегид, сложный эфир, циклогетероалкил, ароматический или гетероароматический остаток, и -CN. Если гетероарил замещен Y, когда Y представляет собой -NH, -O-, -S- или NR-, в котором R представляет собой алкил, имеющий 1-6 атомов углерода, в одной из позиций кольца имеется дополнительное замещение на -NH, -O-, -S- или NR- группой (СН2)n-Х’. В данном изобретении n равно 0-1, а “Х” представляет собой циклоалкил, содержащий от 3 до 7 атомов углерода, который может быть необязательно замещен одним или более алкилами, содержащими от 1 до 6 атомов углерода; либо представляет собой кольцо пиридинила, пиримидинила или фенила; при этом кольцо пиридинила, пиримидинила или фенила может быть необязательно моно-, ди- или три- замещено заместителями независимо выбранными из группы, включающей галоген, алкил, содержащий 1-6 атомов углерода, алкенил, содержащий 2-6 атомов углерода, алкинил, содержащий 2-6 атомов углерода, азидо, гидроксиалкил, содержащий 1-6 атомов углерода, галометил, алкоксиметил, содержащий 2-7 атомов углерода, алканоилоксиметил, содержащий 2-7 атомов углерода, алкокси, содержащий 1-6 атомов углерода, алкилтио, содержащий 1-6 атомов углерода, гидрокси, трифторметил, циано, нитро, карбокси, карбоалкокси, содержащий 2-7 атомов углерода, карбоалкил, содержащий 2-7 атомов углерода, фенокси, фенил, тиофенокси, бензоил, бензил, амино, алкиламино, содержащий 1-6 атомов углерода, диалкиламино, содержащий 2-12 атомов углерода, фениламино, бензиламино, алканоиламино, содержащий 1-6 атомов углерода, алкеноиламино, содержащий 3-8 атомов углерода, алкиноиламино, содержащего 3-8 атомов углерода, бензоиламино и -Q-(CH2)mAr, в котором Q выбран из О, NH, N(С1-С6 алкила) или S, m равно 0, 1 или 2, а Ar представляет собой фенил или пиридил, необязательно замещенный одним-тремя остатками, независимо выбранными из галогена, алкила, содержащего 1-6 атомов углерода, алкенила, содержащего 2-6 атомов углерода, алкинила, содержащего 2-6 атомов углерода, азидо, гидроксиалкила, содержащего 1-6 атомов углерода, галометила, алкоксиметила, содержащего 2-7 атомов углерода, алканоилоксиметила, содержащего 2-7 атомов углерода, алкокси, содержащего 1-6 атомов углерода, алкилтио, содержащего 1-6 атомов углерода, гидрокси, трифторметила, циано, нитро, карбокси, карбоалкокси, содержащего 2-7 атомов углерода, карбоалкила, содержащего 2-7 атомов углерода, фенокси, фенила, тиофенокси, бензоила, бензила, амино, алкиламино, содержащего 1-6 атомов углерода, диалкиламино, содержащего 2-12 атомов углерода, фениламино, бензиламино, алканоиламино, содержащего 1-6 атомов углерода, алкеноиламино, содержащего 3-8 атомов углерода, алкиноиламино, содержащего 3-8 атомов углерода и бензоиламино. Алкильная часть алкил, алкокси, алканоилокси, алкоксиметил, алканоилоксиметил, алкисульфинил, алкилсульфонил, алкилсульфонамидо, карбоалкокси, карбоалкил, алканоиламино-аминоалкил, алкиламиноалкил, N,N-дициклоалкиламиноалкил, гидроксиалкил и алкоксиалкилзаместителей включает как прямые цепи, так и разветвленные углеродные цепи. Циклоалкильные части N-циклоалкил-N-алкиламиноалкил и N,N-дициклоалкиламиноалкил заместителей включают как простые карбоциклы, так и карбоциклы, содержащие алкильные заместители. Алкенильная часть алкенил, алкеноилоксиметил, алкенилокси, алкенилсульфонамидозаместителей включает как прямые цепи, так и разветвленные углеродные цепи и один или более сайтов незамещения. Алкинильная часть алкинил, алкиноилоксиметил, алкинилсульфонамидо, алкинилоксизаместителей включает как прямые цепи, так и разветвленные углеродные цепи и один или более сайтов незамещения. В данном изобретении термин “три-алкилсилил” относится к алкильным (значение которых указано выше) производным силилгруппы, R3Si, в которой каждый из R может быть одинаковым или различным. Три-алкилсилил предпочтительно представляет собой триметилсилил. Карбокси означает радикал -СО2Н. Карбоалкокси, содержащий 2-7 атомов углерода, означает радикал -СО2R”, в котором R” представляет собой радикал алкила, содержащий 1-6 атомов углерода. Карбоалкил означает радикал -COR”, в котором R” представляет собой радикал алкила, содержащий 1-6 атомов углерода. Алканоилокси означает радикал -OCOR”, в котором R” представляет собой радикал алкила, содержащий 1-6 атомов углерода. Алканоилоксиметил означает радикал R”СО2СН2, в котором R” представляет собой радикал алкила, содержащий 1-6 атомов углерода. Алкоксиметил означает радикал R”ОСН2, в котором R” представляет собой радикал алкила, содержащий 1-6 атомов углерода. Термин “винил” означает СН2=СН и его производные, получаемые замещением. “Ацил” представляет собой радикал формулы -(С=О), алкил или -(С=О) перфторалкил, в котором радикал алкила или радикал перфторалкила содержит от 1 до 7 атомов углерода; предпочтительные примеры включают, но не ограничиваются ими, ацетил, пропионил, бутирил, трифторацетил. Алкилсульфинил означает радикал R”SO, в котором R” представляет собой радикал алкила, содержащий 1-6 атомов углерода. Алкилсульфонил означает радикал R”SO2, в котором R” представляет собой радикал алкила, содержащий 1-6 атомов углерода. Алкилсульфонамидо, алкенилсульфонамидо, алкинилсульфонамидо означают радикал R”‘SO2NH, в котором R”‘ представляет собой радикал алкила, содержащий 1-6 атомов углерода, радикал алкенила, содержащий 2-6 атомов углерода, радикал алкинила, содержащий 2-6 атомов углерода. N-алкилкарбамоил означает радикал R”NHCO, в котором R” представляет собой радикал алкила, содержащий 1-6 атомов углерода. N,N-диалкилкарбамоил означает радикал R”R’NCO, в котором R” представляет собой радикал алкила, содержащий 1-6 атомов углерода, R’ представляет собой радикал алкила, содержащий 1-6 атомов углерода, при этом R’ и R” могут быть одинаковыми или различными. Если Х замещен, то он предпочтительно является моно-, ди- или три-замещенным, при этом наиболее предпочтительным является монозамещение. Предпочтительно, чтобы из заместителей R1, R2, R3, R4 и R0 по меньшей мере один представлял собой водород, наиболее предпочтительно, чтобы два или три из них представляли собой водород. В данном изобретении каждый из R1, R2, R3, R4 и R0 независимо представляет собой водород, галоген, алкил, содержащий 1-6 атомов углерода, алкенил, содержащий 2-6 атомов углерода, алкинил, содержащий 2-6 атомов углерода, алкенилокси, содержащий 2-6 атомов углерода, алкинилокси, содержащий 2-6 атомов углерода, гидроксиметил, галометил, алканоилокси, содержащий 1-6 атомов углерода, алкеноилокси, содержащий 3-8 атомов углерода, алкиноилокси, содержащий 3-8 атомов углерода, алканоилоксиметил, содержащий 2-7 атомов углерода, алкеноилоксиметил, содержащий 4-9 атомов углерода, алкиноилоксиметил, содержащий 4-9 атомов углерода, алкоксиметил, содержащий 2-7 атомов углерода, алкокси, содержащий 1-6 атомов углерода, алкилтио, содержащий 1-6 атомов углерода, алкилсульфинил, содержащий 1-6 атомов углерода, алкилсульфонил, содержащий 1-6 атомов углерода, алкилсульфонамидо, содержащий 1-6 атомов углерода, алкенилсульфонамидо, содержащий 2-6 атомов углерода, алкинилсульфонамидо, содержащий 2-6 атомов углерода, гидрокси, трифторметил, циано, нитро, карбокси, карбоалкокси, содержащий 2-7 атомов углерода, карбоалкил, содержащий 2-7 атомов углерода, фенокси, фенил, тиофенокси, бензил, амино, гидроксиамино, алкоксиамино, содержащий 1-4 атома углерода, алкиламино, содержащий 1-6 атомов углерода, диалкиламино, содержащий от 2 до 12 атомов углерода, аминоалкил, содержащий 1-4 атома углерода, N-алкиламиноалкил, содержащий 2-7 атомов углерода, N,N-диалкиламиноалкил, содержащий 3-14 атомов углерода, фениламино, бензиламино, R5 представляет собой алкил, содержащий 1-6 атомов углерода, алкил, необязательно замещенный одним или более атомами галогена, фенил, либо фенил, необязательно замещенный одним или более атомами галогена, алкокси, содержащий 1-6 атомов углерода, трифторметил, амино, нитро, циано или алкил, содержащий 1-6 групп атомов углерода; R6 представляет собой водород, алкил, содержащий 1-6 атомов углерода, или алкенил, содержащий 2-6 атомов углерода; R7 представляет собой хлор или бром; R8 представляет собой водород, алкил, содержащий 1-6 атомов углерода, или аминоалкил, содержащий 1-6 атомов углерода, N-алкиламиноалкил, содержащий 2-9 атомов углерода, N,N-диалкиламиноалкил, содержащий 3-12 атомов углерода, N-циклоалкиламиноалкил, содержащий 4-12 атомов углерода, N-циклоалкил-N-алкиламиноалкил, содержащий 5-18 атомов углерода, N,N-дициклоалкиламиноалкил, содержащий 7-18 атомов углерода, морфолино-N-алкил, в котором алкилгруппа содержит 1-6 атомов углерода, пиперидино-N-алкил, в котором алкилгруппа содержит 1-6 атомов углерода, N-алкил-пиперидино-N-алкил, в котором любая алкилгруппа содержит 1-6 атомов углерода, азациклоалкил-N-алкил, содержащий 3-11 атомов углерода, гидроксиалкил, содержащий 1-6 атомов углерода, алкоксиалкил, содержащий 2-8 атомов углерода, карбокси, карбоалкокси, содержащий 1-6 атомов углерода, фенил, карбоалкил, содержащий 2-7 атомов углерода, хлор, фтор или бром; Z представляет собой амино, гидрокси, алкокси, содержащий 1-6 атомов углерода, алкиламино, в котором остаток алкила содержит 1-6 атомов углерода, диалкиламино, в котором каждый из остатков алкила содержит 1-6 атомов углерода, морфолино, пиперазино, N-алкилпиперазино, в котором остаток алкила содержит 1-6 атомов углерода, или пирролидино; m = 1-4, q = 1-3, а р = 0-3; любые из заместителей R1, R2, R3, R4 или R0, расположенных на смежных атомах углерода, могут вместе представлять собой двухвалентный радикал -О-С(R8)2-О-. R1, R2, R3, R4 и R0 предпочтительно независимо выбраны из группы, включающей -Н, -CN, алкил, алкокси, винил, алкенил, формил, -CF3, -CCl3, галоид, -С6Н5, амид, ацил, сложный эфир, амино, тиоалкокси, фосфино и их сочетания. В данном изобретении заместитель азациклоалкил-N-алкил означает моноциклический гетероцикл, содержащий атом азота, на котором замещен радикал алкила с прямой или разветвленной цепью. Заместитель морфолино-N-алкил представляет собой морфолиновое кольцо, замещенное на атоме азота радикалом алкила с прямой или разветвленной цепью. Заместитель пиперидино-N-алкил представляет собой пиперидиновое кольцо, замещенное на одном из атомов азота радикалом алкила с прямой или разветвленной цепью. Заместитель N-алкил-пиперидино-N-алкил представляет собой пиперидиновое кольцо, замещенное на одном из атомов азота алкилгруппой с прямой или разветвленной цепью, а на другом атоме азота – радикалом алкила с прямой или разветвленной цепью. В данном изобретении термин “алкил” означает радикал насыщенных алифатических групп, включая алкилгруппы с прямой цепью, алкилгруппы с разветвленной цепью, циклоалкил (алициклические) группы, замещенные алкилом циклоалкилгруппы и замещенные циклоалкилом алкилгруппы. Согласно предпочтительным вариантам алкил с прямой или разветвленной цепью содержит 30 или менее атомов углерода в своей главной цепи. Более предпочтительные алкилгруппы имеют прямую или разветвленную цепь, содержащую от 1 до 10 атомов углерода. Подобным образом предпочтительные циклоалкилы содержат от 30 до 10 атомов углерода в своей кольцевой структуре. Более того, термин “алкил”, используемый в данном описании и формуле изобретения, относится как к “незамещенным алкилам”, так и “замещенным алкилам”, последние из которых относятся к алкильным остаткам, имеющим заместители, замещающие водород на одном или более атомов углерода главной углеводородной цепи. Такие заместители могут включать, например, галоген, гидроксил, карбонил (такой как карбоксил, сложный эфир, формил или кетон), тиокарбонил (такой как сложный тиоэфир, тиоацетат или тиоформиат), алкоксил, фосфорил, фосфонат, фосфинат, амино, амидо, амидин, имин, циано, нитро, азидо, сульфгидрил, алкилтио, сульфат, сульфонат, сульфамоил, сульфонамидо, сульфонил, гетероциклил, аралкил либо ароматический или гетероароматический остаток. Специалистам в данной области техники понятно, что остатки, замещенные на углеводородной цепи, при необходимости сами могут быть замещены. Например, заместители замещенного алкила могут включать замещенные и незамещенные формы амино, азидо, имино, амидо, фосфорила (включая фосфонат и фосфинат), сульфонила (включая сульфат, сульфонамидо, сульфамоил и сульфонат) и силилгрупп, а также простых эфиров, алкилтио, карбонилов (включая кетоны, альдегиды, карбоксилаты и сложные эфиры), -CF, -CN и т.п. Незамещенными предпочтительно являются алкилгруппы. В данном изобретении термин “алкинил” означает ненасыщенные алифатические группы, аналогичные по длине и возможному расположению описанным выше алкилам, но содержащие по меньшей мере одну тройную связь и включающие как прямую, так и разветвленную углеродную цепь, содержащую 2-6 атомов углерода. В данном изобретении термин “алкенил” означает алифатический углеводород, включающий по меньшей мере одну двойную связь углерод-углерод и как прямые, так и разветвленные углеродные цепи, содержащие 2-6 атомов углерода во всех возможных конфигурационных изомерах, например, цис и транс, а также включающий этенил, 3-гексен-1-ил и т.п. Иллюстративные замещенные алкилы описаны ниже. Термин “аралкил” в данном описании означает алкилгруппу, замещенную арилгруппой (например, ароматическая или гетероароматическая группа). Циклоалкенил в данном описании означает неароматический карбоцикл, содержащий от 3 до 10 атомов углерода по меньшей мере с одной двойной связью углерод-углерод в кольце. В данном изобретении термин “арил” означает ароматический карбоциклический остаток, который может быть замещенным или незамещенным. Предпочтительные арилгруппы содержат от 6 до 14 атомов углерода. Особенно предпочтительными арилгруппами являются фенил и нафтил. Ароматическое кольцо может быть необязательно и независимо моно-, ди-, три- или тетра-замещенным. Предпочтительные заместители выбраны из группы, включающей галоген, азид, алкил, аралкил, алкенил, алкинил, циклоалкил, гидроксил, амино, нитро, сульфгидрил, имино, амидо, фосфонат, фосфинат, карбонил, карбоксил, силил, простой эфир, алкилтио, сульфонил, сульфонамидо, кетон, альдегид, сложный эфир, гетероциклил, ароматические или гетероароматические остатки и -CN. Термин “арил” также относится к полициклическим кольцевым системам, включающим два или более колец, в которых два или более атомов углерода являются общими для двух сочлененных колец (кольца являются “конденсированными”), при этом по меньшей мере одно из карбоциклических колец является ароматическим, например, другие кольца могут представлять собой циклоалкилы, циклоалкенилы, циклоалкинилы и/или арилы. Аралкил в данном описании означает остаток -алкил-арил, в котором арил и алкил имеют приведенные выше значения. Бензил представляет собой предпочтительную аралкилгруппу. Сложный эфир в данном описании означает группу -ОС(О)(С1-С6 алкил). Согласно одному из вариантов данного изобретения алкил, алкенил и алкинилгруппы могут быть замещены такими заместителями как фенил, замещенный фенил, гидрокси, галоген, алкокси, тиоалкил, карбокси, алкоксикарбонил и ацил. Соединения в соответствии с настоящим изобретением могут включать “двухвалентную группу”, определяемую в данном описании как соединяющая группа, например, СН2СН2. Соединения в соответствии с настоящим изобретением могут включать один или более асимметричных атомов углерода и таким образом образовывать стереоизомеры, такие как энантиомеры и диастереомеры. Несмотря на то, что соединения в соответствии с настоящим изобретением описаны без ссылок на их стереохимию, они включают все возможные отдельные стереоизомеры, а также рацемические и другие смеси R и S стереоизомеров (скалемические (scalemic) смеси, представляющие собой смеси неравных количеств энантиомеров) и их фармацевтически приемлемые соли. Следует отметить, что стереоизомеры согласно данному изобретению, имеющие одинаковую относительную конфигурацию в хиральном центре, могут, тем не менее, иметь различные R и S обозначения в зависимости от замещения на указанном хиральном центре. Некоторые из соединений согласно данному изобретению могут содержать одну или несколько двойных связей; в таких случаях соединения согласно данному изобретению включают каждый из возможных конфигурационных изомеров, а также смеси этих изомеров. Соли соединений согласно данному изобретению и промежуточные соединения могут быть получены из органических и неорганических оснований. Например, соли щелочных металлов: соли натрия, лития или калия и соли N-тетраалкиламмония, такие как соли N-тетра-бутиламмония. Если соединение согласно данному изобретению или промежуточное соединение содержит основный остаток, кислотно-аддитивные соли могут быть получены из органических и неорганических кислот. Например, соли могут быть получены из уксусной, пропионовой, молочной, лимонной, винной, янтарной, фумаровой, малеиновой, малоновой, миндальной, яблочной, фталевой, хлористоводородной, бромистоводородной, фосфорной, азотной, серной, метансульфоновой, нафталинсульфоновой, бензолсульфоновой, толуолсульфоновой, камфарсульфоновой и подобных известных протонных кислот. Согласно предпочтительному варианту осуществления данного изобретения кислотно-аддитивная соль представляет собой хлористоводородную соль. Термин “гетероатом” в данном описании означает атом любого элемента, отличного от углерода или водорода. Предпочтительными гетероатомами являются азот, кислород, сера и фосфор. В данном описании термин “нитро” означает -NO2; термин “галоген” означает -F, -Cl, Br- или J; термин “сульфгидрил” означает -SH; термин “гидроксил” означает -ОН; а термин сульфонил означает -SO-. Термины “амин”, “амино” и “амид” являются признанными в данной области техники и относятся как к незамещенным, так и замещенным аминам. Термин “алкилтио” означает вышеописанную алкилгруппу, содержащую присоединенный к ней радикал серы. В предпочтительных вариантах остаток “алкилтио” представлен одним из -S-алкила, -S-алкенила, -S-алкинила и -S-. Характерные алкилтиогруппы включают метилтио, этилтио и т.п. Термин “алкоксил” или “алкокси” в данном описании означают вышеописанную алкилгруппу, содержащую присоединенный к ней радикал кислорода. Характерные алкоксилгруппы включают метокси, этокси, пропиолокси, трет-бутокси и т.п. Термин “тиоалкокси” означает вышеописанную алкоксилгруппу, содержащую присоединенный к ней радикал серы. Замещениям могут быть подвергнуты алкенил и алкинилгруппы для получения, например, аминоалкенилов, аминоалкинилов, амидоалкенилов, амидоалкинилов, иминоалкенилов, иминоалкинилов, тиоалкенилов, тиоалкинилов, карбонил-замещенных алкенилов или алкинилов. Сокращения Ме, Et, Ph, Tf, Nf, Ts, Ms и dba означают метил, этил, фенил, трифторметансульфонил, нонафторбутансульфонил, п-толуолсульфонил, метансульфонил и дибензилиденацетон, соответственно. Более полный перечень сокращений, используемый рядовыми специалистами органической химии, приведен в первом номере каждого тома Journal of Organic Chemistry; этот перечень обычно представлен в виде таблицы, озаглавленной Standard List of Abbreviations (Стандартный перечень сокращений). Сокращения, содержащиеся в указанном перечне, и все сокращения, используемые рядовыми специалистами органической химии, приведены здесь в качестве ссылки. Следует отметить, что под термином “замещение” или “замещенный” подразумевается тот факт, что замещение осуществляется в соответствии с разрешенной валентностью замещенного атома и заместителя и что оно приводит к получению стойкого соединения, нелегко подвергающегося трансформации, такой как перегруппировка, циклизация, отщепление и т.д. Если не оговорено особо, под термином “замещенный” подразумеваются все допустимые заместители органических соединений. В широком аспекте допустимые заместители включают ациклические и циклические, разветвленные и неразветвленные, карбоциклические и гетероциклические, ароматические и неароматические заместители органических соединений. Иллюстративные заместители включают, например, описанные выше заместители. Допустимые заместители могут представлять собой один или более заместителей, а также одинаковые или различные заместители для соответствующих органических соединений. В данном изобретении гетероатомы, такие как азот, могут иметь водородные заместители и/или любые описанные здесь допустимые заместители органических соединений, удовлетворяющие валентностям гетероатомов. Предполагается, что данное изобретение никоим образом не ограничивается допустимыми заместителями органических соединений. Согласно одному из вариантов осуществления данного изобретения охлаждение суспензии осуществляют при температуре приблизительно от -10°С до 25°С. Согласно предпочтительному варианту охлаждение осуществляют при температуре приблизительно от 0°С до 10°С. Согласно варианту осуществления данного изобретения нагревание суспензии осуществляют при температуре 20-30°С. Согласно данному изобретению водное основание или основание может представлять собой, например, карбонат, бикарбонат натрия, гидроксид натрия, бикарбонат и карбонат калия или т.п. Термин “анилин” в данном описании означает остаток арила или гетероарила, несущий аминогруппу на кольцевом атоме. Аминогруппа предпочтительно представляет собой первичный (NH2). Согласно предпочтительному варианту данного изобретения анилин представляет собой: где R11, R12, R13, R14, R15 выбраны из группы, включающей Н, CN, алкил, алкокси, винил, алкенил, формил, CF3, CCl3, галоид, С6Н5, амид, ацил, сложный эфир, алкокси, амино, тиоалкокси, фосфино и их сочетания; и где, когда R11, R12, R13 или R14, представляют собой О, N или S, при этом представляет собой О, N или S вместе с атомом углерода, к которому они присоединены, и смежным атомом углерода образуют замещенный или незамещенный гетероарил. Согласно предпочтительному варианту, анилин представляет собой 4-[бензилокси-3-хлор]амино-6-амино-3-циано-7-этокси-хинолин. Согласно другому варианту осуществления данного изобретения анилин представляет собой 4-(4-(2-пиридилметокси)-3-хлор)амино-3-циано-7-этоксихинолин. Согласно следующему варианту осуществления данного изобретения анилин представляет собой 4-(3-хлор-4-фторфениламино)-3-циано-7-этоксихинолин. Следующие экспериментальные подробности приведены с целью облегчения понимания данного изобретения; они не предназначены для его ограничения и не должны рассматриваться как каким-либо образом ограничивающие изобретение, заявляемое в прилагаемой формуле изобретения. Подробное описание изобретения Получение соединений формулы (II) представлено на схеме I, на которой: Соединение А подвергают взаимодействию с 4-(диметиламино)-2-бутеноилхлоридом (гидрохлорид) (I) при температуре приблизительно от 0°С до 24°С в полярном апротонном растворителе, получая соединение формулы (II). Соединение формулы (II) собирают в виде твердого вещества после добавления водного бикарбоната натрия. В результате одной перекристаллизации указанного твердого вещества из тетрагидрофурана (ТГФ)-ацетонитрила (СН3CN) получают соединение формулы (II) с чистотой >95% и выходом 85%. В результате второй перекристаллизации из тетрагидрофурана (ТГФ)-ацетонитрила (СН3CN) получают соединение формулы 3 с чистотой >98% и выделением 85%. Пример 1 реакционной схемы: Схема 1 Суспензию гидрохлорида 4-N,N-диметиламинокротоновой кислоты в ацетонитриле и каталитическое количество ДМФ охлаждают до 0-10°С. По каплям добавляют оксалилхлорид (0,95 экв.), смесь нагревают до 25-30°С и перемешивают до тех пор, пока хлорирующий агент не израсходуется полностью. При помощи ЖХВД проверяют, чтобы оксалилхлорид в светло-желтом растворе был полностью израсходован, а затем нагревают раствор до 0-10°С. По каплям добавляют охлажденный раствор (0-10°С) 4-[4-бензилокси-3-хлор]амино-6-амино-3-циано-7-этоксихинолина в NMP (N-метил-пирролидон) и смесь перемешивают до тех пор, пока не останется Пример 2 реакционной схемы: Раствор гидрохлорида 4-N,N-диметиламинокротоновой кислоты в тетрагидрофуране (ТГФ) и каталитическое количество диметилформамида (ДМФ) охлаждают до 0-5°С. По каплям добавляют оксалилхлорид (0,95 экв.), смесь нагревают до 25-30°С и перемешивают до тех пор, пока хлорирующий агент не израсходуется полностью. При помощи жидкостной хроматографии высокого давления (ЖХВД) проверяют, чтобы оксалилхлорид в светло-желтом растворе был полностью израсходован, а затем нагревают раствор до 0-5°С. По каплям добавляют раствор 4-[4-(2-пиридилметокси)-3-хлор]амино-6-амино-3-циано-7-этоксихинолина и смесь перемешивают до тех пор, пока не останется Пример 3 реакционной схемы: [4-(3-Хлор-4-фторфениламино)-3-циано-7-этоксихинолин-6-ил]амид 4-диметиламино-бут-2-еновой кислоты А. Гидрохлорид 4-(диметиламино)-2-бутеноилхлорида В литровую колбу с несколькими горлышками, оборудованную мешалкой, термометром, наливной воронкой и защитной атмосферой азота, загружают ацетонитрил (0,67 кг, 0,85 л), а затем добавляют диметилформамид (0,00086 кг, 0,91 мл, d=0,944 г/мл). При температуре окружающей среды добавляют гидрохлорид 4-диметиламинокротоновой кислоты (0,0709 кг) и смесь перемешивают до гомогенного состояния. Реакционную смесь охлаждают до 0-10°С и по каплям в течение 20 минут к ней добавляют оксалилхлорид (0,0473 кг, 0,0325 л, d = 1,45 г/мл) при температуре 0-10°С, а затем промывают ацетонитрилом (0,02 кг, 0,03 л). Температуру 0-10°С поддерживают в течение 20 минут. В течение 20 минут температуру реакционной смеси доводят до 22-26°С и поддерживают в течение 2 часов. Температуру реакционной смеси доводят до 40-45°С и поддерживают в течение приблизительно 5 минут. Легкую суспензию охлаждают до температуры около 20-25°С и проверяют завершение реакции при помощи жидкостной хроматографии высокого давления (ЖХВД). Реакция завершена при наличии В. [4-(3-Хлор-4-фторфениламино)-3-циано-7-этоксихинолин-6-ил]амид 4-диметиламино-бут-2-еновой кислоты (сырой) В 3-литровую колбу с несколькими горлышками, оборудованную мешалкой, термометром, погружной трубкой и защитной атмосферой азота, загружают N-метилпирролидинон (0,77 кг, 0,75 л, d=1,033 г/мл). При температуре окружающей среды добавляют 4-[3-хлор-4-фторфенил]амино-6-амино-3-циано-7-этоксихинолин (0,0748 кг). Реакционную смесь нагревают до температуры 40-45°С и выдерживают при этой температуре в течение приблизительно 15 минут. Реакционную смесь охлаждают до 0-10°С и через погружную трубку при положительном давлении азота в течение 30-45 минут добавляют легкую суспензию гидрохлорида 4-(диметиламино)-2-бутеноилхлорида в СН3CN, поддерживая температуру на уровне 0-10°С в течение по меньшей мере 2 часов. Завершение реакции контролируют при помощи ЖХВД. Реакция завершена при наличии [4-(3-Хлор-4-фторфениламино)-3-циано-7-этоксихинолин-6-ил]амид 4-диметиламино-бут-2-еновой кислоты (очищен в небольшой степени) Первый сбор: В 6-литровую колбу с несколькими горлышками, оборудованную мешалкой, конденсатором, датчиком температуры и защитой из атмосферы азота, загружают ацетонитрил (3,14 кг, 4,00 л), а затем добавляют [4-(3-хлор-4-фторфениламино)-3-циано-7-этоксихинолин-6-ил]амид 4-диметиламино-бут-2-еновой кислоты (0,16 кг, 0,167 мол). Нагревают смесь до температуры 75-80°С и выдерживают при этой температуре в течение часа. Охлаждают смесь до 70-75°С и фильтруют через слой из диатомовой земли, удаляя неорганические соли. Слой промывают ацетонитрилом (2×0,24 кг, 2×0,30 л) и подвергают предварительному нагреванию до 70-75°С. Концентрируют фильтрат при давлении 20-30 мм рт.ст. и максимальной температуре 40-45°С до объема 1,2 л. К концентрату (суспензия) добавляют предварительно профильтрованный тетрагидрофуран (0,53 кг, 0,60 л). Нагревают до 65-70°С, получая полноценный раствор. Охлаждают смесь до 40-45°С в течение 0,3 часа. Добавляют затравочные кристаллы и продолжают охлаждение до 20-25°С в течение часа. Выдерживают при температуре 20-25°С в течение как минимум 18 часов. Собирают твердое вещество в воронке Бюхнера и промывают собранное твердое вещество предварительно профильтрованной и охлажденной до 0-5°С смесью ацетонитрила/тетрагидрофурана (2/1 объемн.) (2×0,6 кг, 2×0,08 л). Сушат продукт в вакуумной печи при 50°С и 10 мм рт.ст. в течение 48 часов до потерь при сушке (LOD) менее 0,5%. Все промывные воды и концентраты (маточные растворы) сохраняют для последующей очистки. Второй сбор: В 3-литровую колбу с несколькими горлышками, оборудованную мешалкой, температурным датчиком и защитой из атмосферы азота, загружают маточные растворы и промывные воды, полученные на предыдущей стадии. Концентрируют дистилляцией при давлении 20-30 мм рт.ст. и максимальной температуре 40-45°С до объема 0,50 л. Собирают твердое вещество в воронке Бюхнера и промывают его предварительно профильтрованным ацетонитрилом (0,04 кг, 0,05 л). Сушат продукт в вакуумной печи при 50°С и 10 мм рт.ст. в течение 18 часов. В литровую колбу с несколькими горлышками, оборудованную мешалкой, конденсатором, температурным датчиком и защитой из слоя азота, загружают предварительно профильтрованный ацетонитрил (0,47 кг, 0,60 л) и собранное твердое вещество в виде суспензии нагревают до температуры 70-75°С в течение 0,5 часа. К суспензии добавляют предварительно профильтрованный тетрагидрофуран (0,03 кг, 0,03 л), поддерживая температуру на уровне 70-75°С. Охлаждают раствор до 40-45°С и добавляют затравочные кристаллы. Продолжают охлаждение до 20-25°С в течение часа и выдерживают в течение 2 часов. Собирают полученное твердое вещество в воронке Бюхнера и промывают собранное твердое вещество предварительно профильтрованной и охлажденной до 5°С смесью ацетонитрила/ тетрагидрофурана (20/1 объемн.) (2×0,02 кг, 2×0,03 л). Сушат собранное твердое вещество в вакуумной печи при 50°С и 10 мм рт.ст. в течение 24 часов до LOD менее 0,5%. Общий выход составляет 27,5 г + 30,5 г (73%), при этом концентрация по данным жидкостной хроматографии высокого давления (ЖХВД) составляет 96,2-98,4%, а общее содержание загрязняющих примесей – 1,5-1,7%. [4-(3-Хлор-4-фторфениламино)-3-циано-7-этоксихинолин-6-ил]амид 4-диметиламино-бут-2-еновой кислоты (очищен в большей степени) Ацетонитрил, применяемый на практике (34,0 кг), и [4-(3-хлор-4-фторфениламино)-3-циано-7-этоксихинолин-6-ил]амид 4-диметиламино-бут-2-еновой кислоты (2,69 кг сырой, 1,53 кг с концентрацией 100%) загружают в продуваемый (100 л) реактор. Применяемый на практике ацетонитрил (2,0 кг) используют как ополаскиватель для стенок воронки и емкости. Коричневую суспензию нагревают при температуре от 70 до 76°С, при этом температура кожуха не превышает 85°С, а затем выдерживают при указанной температуре как минимум 45 минут, но не более 60 минут. Полученную суспензию затем фильтруют через фильтр Aurora 14” с нагретым кожухом (70-76°С), поддерживая температуру партии на уровне от 70 до 76°С. Фильтраты собирают насосом в продуваемый (100 л) сборник, поддерживая их температуру на уровне ниже 50°С. Затем слой с диатомовой землей промывают горячим (от 70 до 76°С) ацетонитрилом, используемым на практике (3×2,5 кг). Фильтраты и промывные воды в 100-литровом сборнике охлаждают до температуры от 20 до 26°С, а затем переносят в барабан из нержавеющей стали. Применяемый на практике ацетонитрил (2,0 кг) используют в качестве ополаскивателя. После очистки и продувания обеих емкостей содержимое барабана из нержавеющей стали переносят в 100-литровый сборник. Применяемый на практике ацетонитрил (2,0 кг) используют в качестве ополаскивателя. Партию нагревают при температуре от 70 до 76°С, при этом температура кожуха не превышает 85°С. Партию фильтруют при помощи насоса через один 1,0-микронный фильтр со сменным фильтрующим элементом, поддерживая ее температуру на уровне от 70 до 76°С. В качестве ополаскивателя для емкости, фильтров, насоса и линий используют горячий (70-76°С) ацетонитрил, применяемый на практике (4,0 кг). Фильтрат и промывные воды собирают и поддерживают при температуре на уровне ниже 50°С. Партию доводят до температуры от 10 до 16°С, затем концентрируют вакуумной дистилляцией до объема от 28 до 33 л: ожидаемая температура дистилляции составляет от 20 до 30°С, объем дистиллята – от 32 до 37 л. Суспензию нагревают до температуры от 64 до 70°С, при этом температура кожуха не превышает 85°С. Полученный раствор охлаждают до температуры от 40 до 46°С, а затем вводят затравку кристаллами, применяя очищенный [4-(3-хлор-4-фторфениламино)-3-циано-7-этоксихинолин-6-ил]амид 4-диметил-амино-бут-2-еновой кислоты (0,5 г). Смесь нагревают до температуры от 20 до 26°С в течение часа, а затем выдерживают при указанной температуре как минимум в течение 2 часов. Затем суспензию охлаждают при температуре от -3 до 3°С в течение часа, после чего выдерживают как минимум в течение часа. Твердый продукт собирают в 16” воронке Бюхнера, а затем промывают холодной (0-5°С) смесью ацетонитрила-тетрагидрофурана (20-6 об./об.) (2×2,5 кг). Собранное твердое влажное вещество еще раз подвергают перекристаллизации из ацетонитрила-тетрагидрофурана (20-6 об./об.) до желаемой чистоты. Материал сушат в вакуумной печи вначале при температуре от 35 до 45°С (требуется 40°С) в течение 4 часов, применяя жидкостной кольцевой насос, а затем при температуре от 45 до 55°С (требуется 50°С) в течение 4 часов. Затем при указанной температуре применяют глубокий вакуум до получения LOD <0,5% (90°C, в течение 2 часов, полный вакуум), при этом LOD каждого из ацетонитрила, тетрагидрофурана и 1-метил-2-пирролидинона составляет менее 0,2%. Очищенный лекарственный препарат подвергают размалыванию (Comil), а затем перемешиванию. Выход составляет 1,10 кг (70,1% с поправкой на исходный материал). Концентрация материала составляет 98,3%, а общее содержание загрязняющих примесей – 1,27%. Получение 4-(диметиламино)-2-бутеноилхлорида (гидрохлорид) (I) представлено на схеме (II), согласно которой бутен-2-еновую кислоту 7 подвергают взаимодействию с хлортриметилсиланом в пиридине, получая триметилсиликротонат 8, подвергаемый бромированию бромирующим агентом, предпочтительно, N-бромсукцинимидом, в свободных радикальных условиях в присутствии света и пероксида в метиленхлориде, ацетонитриле, 1,2-дихлорэтане, тетрахлориде углерода или этилацетате для получения триметилсилил-4-бромкротоната 9. В результате взаимодействия триметилсилил-4-бромкротоната 9 с диметиламином в тетрагидрофуране при температуре около 0-5°С получают 4-диметиламинокротоновую кислоту 10, выделяемую в виде хлористоводородной соли. Альтернативно, 4-диметиламинокротоновая кислота 10 может быть получена взаимодействием метил или этил 4-бромкротоната 11 с диметиламином при температуре от 0 до 10°С в тетрагидрофуране с получением метил или этил 4-диметиламинокротоната 12, гидролизуемого водным основанием, включающим гидроксид натрия в метаноле в качестве совместного растворителя при температуре около 40-45°С для получения 4-диметиламинокротоновой кислоты 10, выделяемой до 4-диметиламинокротоновой кислоты (гидрохлорид) 10 раствором хлористого водорода в изопропиловом спирте, а затем хлорируемого хлорирующим агентом, предпочтительно, но не ограничивающимся им, оксалилхлоридом в метиленхлориде, тетрагидрофуране (ТГФ) или ацетонитриле в присутствии каталитического количества N,N-диметилформамида для получения гидрохлорида 4-(диметиламино)-2-бутеноилхлорида 2. Схема II: Триметилсилилкротонат Пиридин (138 г, 1,74 мол) при комнатной температуре по каплям добавляют к перемешиваемому раствору кротоновой кислоты (125 г, 1,45 мол) и хлортриметилсилана (189 г, 1,74 мол) в простом эфире (1,51 л). Реакционной смеси позволяют перемешиваться при комнатной температуре в течение ночи, а полученный осадок удаляют фильтрацией. Фильтрат концентрируют, а остаток перегоняют при пониженном давлении. Фракцию продукта собирают при температуре 58-70°С (25 мм рт.ст.), получая 180 г указанного в заголовке соединения (79%). Чистота GC-MS составляет 93,4%, 1H ЯМР соответствует структуре. Триметилсилил-4-бромкротонат Перемешанную смесь триметилсилилкротоната (131 г, 0,828 мол), N-бромсукцинимида (206 г, 1,16 мол), бензоилпероксида (3,41 г, 0,141 мол) и четыреххлористого углерода (1 л) нагревают до дефлегмации (77°С) при видимом свете в течение 5 часов. Смесь охлаждают до комнатной температуры, а выпавший твердый осадок удаляют фильтрацией. Фильтрат концентрируют до остатка, который подвергают дистилляции при пониженном давлении. Фракцию продукта собирают при температуре 93-106°С (9-15 мм рт.ст.), получая 127 г указанного в заголовке соединения (65%). Чистота GC-MS составляет 83-89%, 1H ЯМР находится в соответствии с ожидаемой структурой. 4-Диметиламинокротоновая кислота Раствор 211 мл диметиламина (2М в тетрагидрофуране, 0,422 мол) по каплям добавляют к раствору 50 г триметилсилил-4-бромкротоната (0,211 мол, чистота, установленная при помощи GC-MS, составляет 75,9%) в 250 мл тетрагидрофурана при температуре 0-5°С в атмосфере N2. Реакционную смесь перемешивают при комнатной температуре в течение 30 минут. Белый твердый побочный продукт удаляют фильтрацией и к фильтрату добавляют 2 мл воды с последующей затравкой. Полученные кристаллы фильтруют и промывают простым эфиром, получая 18,3 г (с двух посевов) желаемого продукта в виде не совсем белого твердого вещества. Выход составляет 67,2% (чистота, установленная с помощью GC-MS, составляет 98%, ЯМР соответствуют ожидаемой структуре). Гидрохлорид 4-диметиламинокротоновой кислоты Раствор гидроксида натрия (3,35 г, 0,0838 мол) в воде (24 мл) добавляют к перемешиваемому раствору метил 4-диметиламинокротоната (12 г, 0,0838 мол) в метаноле (100 мл). Реакционную смесь нагревают до температуры 40-45°С в течение часа, а затем охлаждают до комнатной температуры. Добавляют хлористоводородную кислоту (5н), доводя рН реакционной смеси до 1-2. Реакционную смесь концентрируют при пониженном давлении до густого масла. Добавляют этанол (безводный, 100 мл), а твердое вещество (хлорид натрия) удаляют фильтрацией. Фильтрат концентрируют при пониженном давлении и вызывают выпадение продукта в осадок, добавляя 2-пропанол (50 мл) с целью образования твердого вещества, которое собирают получая желаемый продукт (7,0 г, 50%). Чистота GC-MS составляет 86%. 1H ЯМР соответствует ожидаемой структуре. Метил 4-диметиламинокротонат Раствор 120 мл диметиламина (2М в тетрагидрофуране, 0,24 мол) добавляют по каплям к раствору 20 г метил 4-бромкротоната (чистота 85%, 0,095 мол) в 150 мл тетрагидрофурана при температуре 0-5°С в атмосфере N2. Реакционную смесь перемешивают в течение 15 минут при комнатной температуре. Тонкослойная хроматография (ТСХ) (9:1 CH2Cl2:MeOH c несколькими каплями триэтиламина) показывает наличие остаточного метил 4-бромкротоната. Реакционную смесь нагревают до температуры 40-45°С в течение 15 минут. Белое побочное твердое вещество удаляют фильтрацией, а фильтрат упаривают, получая желтое масло (14 г). Желтое масло растворяют в 100 мл CH2Cl2 и дважды промывают H2О. Водный слой вновь экстрагируют 100 мл CH2Cl2. Слои CH2Cl2 объединяют, сушат над MgSO4 и фильтруют. Фильтрат упаривают, получая желаемый продукт в виде масла. Выход составляет 88%. ЯМР показывает желаемый продукт со следами метил 4-бромкротоната. Гидрохлорид метил 4-диметиламинокротоната В 3-литровую колбу с несколькими горлышками, оборудованную мешалкой, термометром, наливной воронкой и защитой из слоя азота, помещают тетрагидрофуран (0,71 кг, 0,80 л). К перемешиваемой смеси добавляют метил 4-бромкротонат (0,20 кг, 0,13 мл, d=1,522 г/мл) и ополаскиватель из тетрагидрофурана (0,18 кг, 0,20 л). Реакционную смесь перемешивают и раствор охлаждают до 0-10°С. В течение 1 часа 15 минут добавляют 2,0 М раствор диметиламина в тетрагидрофуране с последующим выдерживанием при температуре 0-10°С в течение по меньшей мере 30 минут. Завершение реакции проверяют при помощи ТСХ, при этом реакция считается завершенной при наличии Гидрохлорид 4-диметиламинокротоновой кислоты (небольшой масштаб) Раствор гидроксида натрия (3,35 г в 25 мл воды, 0,084 мол) добавляют по каплям при комнатной температуре к раствору 12 г метил 4-диметиламинокротоната (0,084 мол) в 100 мл метилового спирта. Реакционную смесь нагревают до 40-45°С в течение часа, а затем охлаждают до комнатной температуры. рН доводят приблизительно до 12 5н HCl. Смесь концентрируют до густого масла, которое растирают в обезвоженном спирте, получая твердое вещество. Твердый побочный продукт фильтруют, а фильтрат упаривают до масла, которое растирают в изопропиловом спирте, получая 7,0 г твердого белого продукта. Выход составляет 50%, а чистота – 86,3% по данным GC-MS. Гидрохлорид 4-диметиламинокротоновой кислоты (больший масштаб) В 2-литровую колбу с несколькими горлышками, оборудованную мешалкой, термометром, наливной воронкой и защитой из слоя азота, помещают этанол (0,39 кг, 0,50 л), а затем добавляют гидрохлорид метил 4-диметиламинокротоната (0,125 кг) с окончательным ополаскивателем из этанола (0,10 кг, 0,125 л). Перемешиваемую суспензию охлаждают до 0-10°С и, поддерживая данную температуру в течение 20 минут, добавляют гидроксид натрия (50%) (0,11 кг, 0,072 л, d = 1,53 г/мл). Наблюдается небольшой экзотермический эффект с повышением температуры, при этом смесь становится желтой. Температуру поддерживают в течение по меньшей мере 15 минут, а затем нагревают смесь до 18-22°С и поддерживают эту температуру в течение по меньшей мере 4 часов. Ход реакции отслеживают при помощи тонкослойной хроматографии (ТСХ). Реакция завершена при наличии Гидрохлорид 4-(диметиламино)-2-бутеноилхлорида Хорошо перемешанную суспензию гидрохлорида 4-диметиламинокротоновой кислоты (5,0 г, 30 ммол) в холодном (0°С) ТГФ (40 мл) и ДМФ (2 капли из пипетки) обрабатывают оксалилхлоридом (3,15 мл, 36 ммол). После перемешивания при 20-25°С в течение 3 часов суспензию охлаждают до 0°С и выдерживают в течение 30 минут. Твердые вещества собирают в воронке Бюхнера (в атмосфере азота) и лепешку промывают холодным (0°С) ТГФ (3×5 мл). Твердые вещества сушат в вакууме (1 торр) при температуре 40-50°С в течение 3 часов, получая 4,0 г гидрохлорида 4-диметиламинокротоноилхлорида. После обработки твердого вещества метанолом полученный продукт может быть охарактеризован как его сложный метиловый эфир. Альтернативно, гидрохлорид 4-(диметиламино)-2-бутеноилхлорида может быть получен в ацетонитриле и использован в виде суспензии в ацетонитриле для следующей реакции.
Формула изобретения
Способ получения соединения формулы
включающий: (a) взаимодействие бут-2-еновой кислоты с хлортриметилсиланом для получения триметилсилилкротоната; (b) бромирование триметилсилилкротоната, полученного на стадии (а), бромирующим агентом представляющим собой N-бромсукцинимид, для получения триметилсилил-4-бромкротоната; (c) взаимодействие триметилсилил-4-бромкротоната, полученного на стадии (b), либо метил или этил 4-бромкротоната с диметиламином для получения 4-диметиламинокротоновой кислоты; и (d) выделение соединения, полученного на стадии (с), в виде хлористоводородной соли и хлорирование хлорирующим агентом, представляющим собой оксалилхлорид.
|
||||||||||||||||||||||||||

 -functionalized acrylates.”, Synthetic Communications, 1995, 25(5), p.641-650. RU 2195456 C1, 27.12.2002.
-functionalized acrylates.”, Synthetic Communications, 1995, 25(5), p.641-650. RU 2195456 C1, 27.12.2002.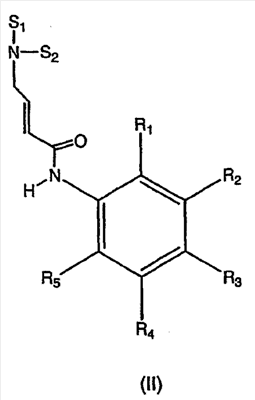
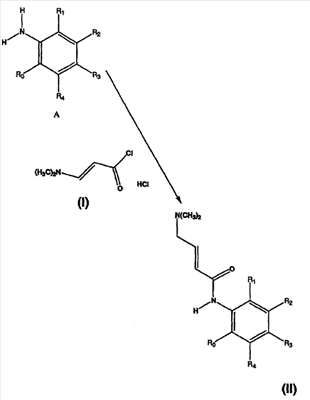
 2% исходного анилина. Смесь добавляют к насыщенному водному бикарбонату натрия, а желтый осадок фильтруют и промывают водой. Влажный твердый продукт нагревают до темнературы дефлегмации в ацетонитриле и осветляют в горячем виде, удаляя нерастворимые вещества. Раствор охлаждают, а выпавший в осадок продукт фильтруют и промывают холодным ацетонитрилом. Продукт сушат (40-50°С, 10 мм рт.ст., 24 часа), получая готовый продукт.
2% исходного анилина. Смесь добавляют к насыщенному водному бикарбонату натрия, а желтый осадок фильтруют и промывают водой. Влажный твердый продукт нагревают до темнературы дефлегмации в ацетонитриле и осветляют в горячем виде, удаляя нерастворимые вещества. Раствор охлаждают, а выпавший в осадок продукт фильтруют и промывают холодным ацетонитрилом. Продукт сушат (40-50°С, 10 мм рт.ст., 24 часа), получая готовый продукт.