Патент на изобретение №2345983
|
||||||||||||||||||||||||||
(54) ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ПРИМЕНЕНИЯ
(57) Реферат:
Изобретение относится к новым соединениям формулы I
где L означает радикал
в котором R1 означает Н, С1-4алкил; n означает 0 или 1 или L означает радикал
в котором R1 означает Н, С1-4алкил; m является 1; R означает Н, галоген, С1-С4алкил или С1-С4-алкокси; Z означает связь, -C(O)NH-, О или S; р означает целое число от 1 до 5; Q означает связь при условии, что Z не является связью, когда р равно 1; или означает О, S или -C(O)NR6-, где R6 означает Н, С1-4алкил или С3-6циклоалкил; или W и R6 вместе с атомом азота, к которому они присоединены, образуют или Q означает -NR6-, или при условии, что р не является 1; W означает
Соединения I обладают агонистической активностью в отношении рецепторов PPAR, что позволяет использовать их в фармацевтических композициях и способах лечений состояний, опосредованных этими рецепторами. 5 н. и 7 з.п. ф-лы.
Настоящее изобретение относится к гетероциклическим соединениям, к содержащим их фармацевтическим композициям и к способам лечения состояний, связанных с ретиноидным Х-рецептором (RXR) и с семействами пероксисомных активированных пролиферацией рецепторов (PPAR), включающими три подтипа PPAR В одном из аспектов настоящее изобретение обеспечивает соединения формулы
где L означает радикал
в котором R1 означает водород, необязательно замещенный алкил, арил, гетероарил, аралкил или циклоалкил; R2 означает водород, гидроксил, необязательно замещенный алкил, арил, аралкил, алкоксигруппу, арилоксигруппу, аралоксигруппу, алкилтиогруппу, арилтиогруппу или аралкилтиогруппу; R3 означает водород или арил или R2 и R3 объединенные представляют алкилен, который вместе с углеродными атомами, к которым они присоединены, образует 5- – 7-членное кольцо; n означает ноль или целое число от 1 до 2; Y означает водород или Y и R2 вместе с атомами углерода, к которым они присоединены, образуют связь при условии, что n означает 1; R4 означает водород или R4 и Y вместе с углеродными атомами, с которыми они связаны, образуют связь при условии, что n означает 1, и R2 и R3 вместе с атомами углерода, к которым они присоединены, образуют связь; или L означает радикал
в котором R1 означает водород, необязательно замещенный алкил, арил, гетероарил, аралкил или циклоалкил; R” означает водород, необязательно замещенный алкил, алкоксигруппу или галоген; m означает целое число от 1 до 2; Y означает водород; R4 и Y вместе с атомами углерода, с которыми они связаны, образуют связь при условии, что m означает 1; R и R’ означают независимо водород, галоген, необязательно замещенный алкил, алкоксигруппу, аралкил или гетероаралкил или R и R’, соединенные вместе, образуют метилендиоксигруппу при условии, что R и R’ присоединены к смежным атомам углерода, или R и R’ объединенные вместе с атомами углерода, к которым они присоединены, образуют необязательно замещенное 5- – 6-членное ароматическое или гетероароматическое кольцо при условии, что R и R’ присоединены к смежным атомам углерода, или R-C и R’-C могут быть независимо заменены азотом; Х означает -Z-(CH2)p-Q-W, где Z означает связь, О, S, S(O), S(O)2, -С(O)-или -C(O)NR5-, где R5 означает водород, алкил или аралкил; р означает целое число от 1 до 8; Q означает связь при условии, что Z не является связью, когда р означает 1, или Q означает -O(СН2)r– или -S(CH2)r-, где r означает ноль или целое число от 1 до 8, или Q означает -O(CH2)1-8O-, -S(CH2)1-8O-, -S(CH2)1-8S-, -C(O)- или -C(O)NR6-, где R6 означает водород, необязательно замещенный алкил, циклоалкил, арил, гетероарил, аралкил или гетероаралкил, или Q означает -NR6-, -NR5C(O)-, -NR5C(O)NH- или -NR5C(O)O- при условии, что р не является 1; W означает циклоалкил, арил, гетероциклил, аралкил или гетероаралкил или W и R6 вместе с атомом азота, к которому они присоединены, образуют 8-12-членную бициклическую кольцевую систему, которая может быть необязательно замещена или может содержать другой гетероатом, выбранный из кислорода, азота и серы, или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Согласно другому аспекту настоящее изобретение обеспечивает способы лечения состояний млекопитающих, опосредствованных активностью рецепторов PPAR. Такие состояния включают дислипидемию, гиперлипидемию, гиперхолестеринемию, атеросклероз, гипертриглицеридемию, сердечную недостаточность, инфаркт миокарда, сосудистые заболевания, сердечно-сосудистые заболевания, гипертензию, ожирение, воспаление, артрит, рак, болезнь Альцгеймера, кожные заболевания, респираторные заболевания, заболевания глаз, IBD (заболевание, связанное с раздражением кишечника), язвенный колит и болезнь Крона. Соединения по изобретению особенно полезны млекопитающим в качестве гипогликемических средств для лечения и предупреждения состояний, в которые вовлечены нарушенная толерантность к глюкозе, гипергликемия и резистентность к инсулину, как, например, диабет типа-1 и типа-2 и синдром X. Предпочтительны соединения по изобретению, которые являются двойными агонистами рецепторов PPAR Настоящее изобретение относится к гетероциклическим соединениям, к содержащим их фармацевтическим композициям, к способам получения соединений и к способам лечения состояний, опосредствованных семействами рецепторов RXR и PPAR, включая активацию рецепторов PPAR при использовании таких соединений. Соединения по изобретению могут также применяться в комбинации с лигандами для других нуклеарных рецепторов, которые, как известно, образуют гетеродимерные комплексы с рецепторами RXR. Далее настоящее изобретение относится к фармацевтическим композициям, содержащим гетероциклические соединения по изобретению, для лечения состояний, указанных выше. Ниже приводятся определения различных терминов, применяемых для описания соединений непосредственно данного изобретения. Эти определения применяют к терминам, используемым в спецификации или в пунктах формулы изобретения, если они не ограничиваются иным образом в конкретных примерах или по отдельности, или как часть более крупной группы, например, там, где место присоединения определенной группы ограничивают конкретным, входящим в эту группу атомом, место присоединения обозначают стрелкой при конкретном атоме. Термин “необязательно замещенный алкил” относится к незамещенным или замещенным углеводородным группам с прямой или разветвленной цепью, содержащим от 1 до 20 углеродных атомов, предпочтительно от 1 до 7 углеродных атомов. Примеры незамещенных алкильных групп включают метил, этил, пропил, изопропил, н-бутил, трет-бутил, изобутил, пентил, гексил, изогексил, гептил, 4,4-диметилпентил, октил и им подобные. Замещенные алкильные группы включают, но не ограничиваются этим, алкильные группы, замещенные одной или несколькими из следующих групп: галоид, гидроксил, циклоалкил, алканоил, алкоксигруппа, алкилоксиалкоксигруппа, алканоилоксигруппа, амино-, алкиламино-, диалкиламино-, алканоиламиногруппа, тиольная группа, алкилтиогруппа, алкилтионогруппа, алкилсульфонил, арилсульфонил, гетероарилсульфонил, сульфамидогруппа, нитрогруппа, циангруппа, карбоксильная группа, алкоксикарбонил, арил, алкенил, алкинил, аралкоксигруппа, гуанидиногруппа, гетероциклил, включая индолил, имидазолил, фурил, тиенил, тиазолил, пирролидил, пиридил, пиримидил, пиперидил, морфолинил и им подобные группы. Термин “низший алкил” относится к алкильным группам, описанным выше, которые содержат от 1 до 7, предпочтительно от 1 до 4, атомов углерода. Термин “галоген” или “галоид” относится к фтору, хлору, брому и иоду. Термин “алкенил” относится к любой из приведенных выше алкильных групп, содержащих, как минимум, два углеродных атома и, кроме того, содержащих двойную углерод-углеродную связь в месте присоединения. Предпочтительны группы, содержащие от двух до четырех углеродных атомов. Термин “алкинил” относится к любой из упомянутых выше алкильных групп, содержащих, как минимум, два атома углерода и, кроме того, содержащих тройную углерод-углеродную связь в месте присоединения. Предпочтительны группы, содержащие от двух до четырех атомов углерода. Термин “алкилен” относится к мостику с прямой цепью с 1-6 углеродными атомами, связанными простыми связями (например, -(СН2)х-, где х означает число от 1 до 6), который может быть замещен 1-3 низшими алкилами или алкоксигруппами. Термин “циклоалкил” относится к необязательно замещенным моноциклическим, бициклическим или трициклическим углеводородным группам из 3-12 углеродных атомов, каждая из которых может необязательно быть замещена одним или несколькими заместителями, как, например, алкил, галоид, оксогруппа, гидроксил, алкоксигруппа, алканоил, амино-, алкиламино-, диалкиламиногруппа, тиольная группа, алкилтиогруппа, нитрогруппа, циангруппа, карбоксил, карбоксиалкил, алкоксикарбонил, алкил- и арилсульфонил, сульфамидогруппа, гетероциклил и им подобные заместители. Примеры моноциклических углеводородных групп включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил и циклогексенил и им подобные группы. Примеры бициклических углеводородных групп включают борнил, индил, гексагидроиндил, тетрагидронафтил, декагидронафтил, бицикло[2.1.1]гексил, бицикло[2.2.1]гептил, бицикло[2.2.1]гептенил, 6,6-диметилбицикло[3.1.1]гептил, 2,6,6-триметилбицикло[3.1.1]гептил, бицикло[2.2.2]октил и им подобные группы. Примеры трициклических углеводородных групп включают адамантил и ему подобные. Термин “алкокси” относится к алкил-O-. Термин “ацил” относится к алканоилу, ароилу, гетероароилу, арилалканоилу или гетероарилалканоилу. Термин “алканоил” относится к алкил-С-(О)-. Термин “алканоилокси” относится к алкил-С(O)-O-. Термины “алкиламино” и “диалкиламино” относятся к алкил-NH- и к (алкил)2N- соответственно. Термин “алканоиламино” относится к алкил-С(O)-NH-. Термин “алкилтио” относится к алкил-S-. Термин “алкиламинотиокарбонил” относится к алкил-NHC(S)-. Термин “триалкилсилил” относится к (алкил)3Si-. Термин “триалкилсилилокси” относится к (алкил)3SiO-. Термин “алкилтионо” относится к -S(O)-. Термин “алкилсульфонил” относится к алкил-S(O)2-. Термин “алкоксикарбонил” относится к алкил-О-С(О)-. Термин “алкоксикарбонилокси” относится к алкил-O-С(O)O-. Термин “карбамоил” относится к алкил-NHC(О)-, (алкил)2NC(O)-, арил-NHC(O)-, алкил(арил)-NC(O)-, гетероарил-NHC(О)-, алкил(гетероарил)-NC(O)-, аралкил-NHC(О)- и алкил(аралкил)-NC(O)-. Термин “арил” относится к моноциклическим или бициклическим ароматическим углеводородным группам, содержащим от 6 до 12 углеродных атомов в кольце, как, например, фенильные, нафтильные, тетрагидронафтильные, бифенильные и дифенильные группы, каждая из которых может необязательно быть замещена 1-4 заместителями, как, например, алкил, галоид, гидроксил, алкоксигруппа, алканоил, алканоилоксигруппа, необязательно замещенная аминогруппа, тиольная группа, алкилтиогруппа, нитрогруппа, циангруппа, карбоксил, карбоксиалкил, алкоксикарбонил, алкилтионогруппа, алкил- и арилсульфонил, сульфамидогруппа, гетероциклоил и им подобные заместители. Термин “моноциклический арил” относится к необязательно замещенному фенилу, как описано для арила. Термин “аралкил” относится к арильной группе, связанной непосредственно через алкильную группу, как, например, бензил. Термин “аралкилтио” относится к аралкил-S-. Термин “аралкокси” относится к арильной группе, связанной непосредственно через алкоксигруппу. Термин “арилсульфонил” относится к арил-S(O)2-. Термин “арилтио” относится к арил-S-. Термин “ароил” относится к арил-С(О)-. Термин “ароиламино” относится к арил-С(O)-NH-. Термин “арилоксикарбонил” относится к арил-О-С(О)-. Термин “гетероциклил” или “гетероцикло” относится к необязательно замещенной, полностью насыщенной или ненасыщенной, ароматической или неароматической циклической группе, например, которая является 4-7-членной моноциклической, 7-12-членной бициклической или 10-15-членной трициклической кольцевой системой, которая содержит, как минимум, один гетероатом в, как минимум, одном содержащем углеродные атомы кольце. Каждое кольцо гетероциклической группы, содержащее гетероатом, может иметь 1, 2 или 3 гетероатома, выбранных из атомов азота, атомов кислорода и атомов серы, где гетероатомы азота и серы могут также быть необязательно окисленными. Гетероциклическая группа может быть присоединена по гетероатому или углеродному атому. Примеры моноциклических гетероциклических групп включают пирролидинил, пирролил, пиразолил, оксетанил, пиразолинил, имидазолил, имидазолинил, имидазолидинил, оксазолил, оксазолидинил, изоксазолинил, изоксазолил, тиазолил, тиадиазолил, тиазолидинил, изотиазолил, изотиазолидинил, фурил, тетрагидрофурил, тиенил, оксадиазолил, пиперидинил, пиперазинил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 2-оксоазепинил, азепинил, 4-пиперидонил, пиридил, пиразинил, пиримидинил, пиридазинил, тетрагидропиранил, морфолинил, тиаморфолинил, сульфоксид тиаморфолинила, сульфон тиаморфолинила, 1,3-диоксолан и тетрагидро-1,1-диоксотиенил, и им подобные группы. Примеры бициклических гетероциклических групп включают индолил, дигидроиндолил, бензотиазолил, бензоксазинил, бензоксазолил, бензотиенил, бензотиазинил, хинуклидинил, хинолинил, тетрагидрохинолинил, декагидрохинолинил, изохинолинил, тетрагидроизохинолинил, декагидроизохинолинил, бензимидазолил, бензопиранил, индолизинил, бензофурил, хромонил, кумаринил, циннолинил, хиноксалинил, индазолил, пирролопиридил, фуропиридинил (как, например, фуро[2,3-с]пиридинил, фуро[3,2-b]пиридинил или фуро[2,3-b]пиридинил), дигидроизоиндолил, дигидрохиназолинил (как, например, 3,4-дигидро-4-оксохиназолинил), фталазинил и им подобные группы. Примеры трициклических гетероциклических групп включают карбазолил, дибензоазепинил, дитиеноазепинил, бензиндолил, фенантролинил, акридинил, фенантридинил, феноксазинил, фенотиазинил, ксантенил, карболинил и им подобные группы. Термин “гетероциклил” включает замещенные гетероциклические группы. Замещенные гетероциклические группы относятся к гетероциклическим группам, замещенным 1, 2 или 3 из следующих групп: (а) алкил; (б) гидроксил (или защищенный гидроксил); (в) галоген; (г) оксо (т.е. =O); (д) необязательно замещенная амино-, алкиламино- или диалкиламиногруппа; (е) алкоксигруппа; (е) циклоалкил; (ж) карбоксил; (з) гетероциклооксигруппа; (и) алкоксикарбонил, как, например, незамещенный (низш.)алкоксикарбонил; (к) меркаптогруппа; (л) нитрогруппа; (м) циангруппа; (н) сульфамидогруппа, сульфамидоалкил, сульфамидоарил или сульфамидодиалкил; (о) арил; (п) алкилкарбонилоксигруппа; (р) арилкарбонилоксигруппа; (с) арилтиогруппа; (т) арилоксигруппа; (у) алкилтиогруппа; (ф) формил; (х) карбамоил; (ц) аралкил или (ч) арил, замещенный алкилом, циклоалкилом, алкоксигруппой, гидроксилом, амино-, алкиламино-, диалкиламиногруппой или галогеном. Термин “гетероциклоокси” означает гетероциклическую группу, присоединенную через кислородный мостик. Термин “гетероарил” относится к ароматическому гетероциклу, например к моноциклическому или бициклическому арилу, как, например, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, фурил, тиенил, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, бензотиазолил, бензоксазолил, бензотиенил, хинолинил, изохинолинил, бензимидазолил, бензофурил и им подобные группы, необязательно замещенные, например, низшим алкилом, (низш.)алкоксигруппой или галоидом. Термин “гетероарилсульфонил” относится к гетероарил-S(O)2-. Термин “гетероароил” относится к гетероарил-С(О)-. Термин “гетероаралкил” относится к гетероарильной группе, соединенной через алкильную группу. Изобретением охватываются пролекарственные производные, например любые фармацевтически приемлемые пролекарственные сложноэфирные производные карбоновых кислот по изобретению, которые способны превращаться при сольволизе или в физиологических условиях в свободные карбоновые кислоты. Примерами таких сложных эфиров карбоновых кислот являются предпочтительно сложные (низш.)алкиловые эфиры, сложные циклоалкиловые эфиры, сложные (низш.)алкениловые эфиры, сложные бензиловые эфиры, сложные моно- или дизамещенные (низш.)алкиловые эфиры, например сложные Соединения по изобретению в зависимости от природы заместителей могут обладать одним или несколькими асимметрическими центрами. Полученные в результате диастереоизомеры, оптические изомеры, т.е. энантиомеры, и геометрические изомеры охватываются непосредственно настоящим изобретением. Предпочтительны соединения формулы I, где Х означает -Z-(CH2)p-Q-W, где Z означает связь, О, S, -С(O)- или -C(O)NR5-, где R5 означает водород, алкил или аралкил; р означает целое число от 1 до 8; Q означает связь при условии, что Z не является связью, когда р означает 1, или Q означает -O(СН2)r– или -S(CH2)r-, где r означает ноль или целое число от 1 до 8, или Q означает -O(CH2)1-8O-, -S(CH2)1-8O-, -S(CH2)1-8S-, -C(O)- или -C(O)NR6-, где R6 означает водород, необязательно замещенный алкил, циклоалкил, арил, гетероарил, аралкил или гетероаралкил, или Q означает -NR6-, -NR5C(O)-, -NR5C(O)NH- или -NR5C(O)O- при условии, что р не является 1; W означает циклоалкил, арил, гетероциклил, аралкил или гетероаралкил или W и R6 вместе с атомом азота, к которому они присоединены, образуют 8-12-членную бициклическую кольцевую систему, которая может быть необязательно замещена или может содержать другой гетероатом, выбранный из кислорода, азота и серы, или их фармацевтически приемлемые соли, или их оптические изомеры или смесь их оптических изомеров. Далее предпочтительны соединения формулы
где L означает радикал
в котором R1 означает водород или необязательно замещенный алкил; R2 и R3 означают водород или R2 и R3 объединенные представляют алкилен, который вместе с углеродными атомами, к которым они присоединены, образует 6-членное кольцо; n означает ноль или целое число от 1 до 2; Y означает водород; R4 означает водород или L означает радикал
в котором R1 означает водород или необязательно замещенный алкил; R” означает водород, необязательно замещенный алкил, алкоксигруппу или галоген; m означает целое число от 1 до 2; Y означает водород; R4 означает водород; R и R’ означают независимо водород, галоген, необязательно замещенный (С1-С6)алкил или (С1-С6)алкоксигруппу или R и R’, объединенные вместе, образуют метилендиоксигруппу при условии, что R и R’ присоединены к смежным атомам углерода; Z означает связь, О, S или -C(O)NR5-, где R5 означает водород, алкил или аралкил; р означает целое число от 1 до 5; Q означает связь при условии, что Z не является связью, когда р означает 1, или Q означает -O(СН2)r– или -S(CH2)r-, где r означает ноль, или Q означает -С(O)- или -C(O)NR6-, где R6 означает водород, необязательно замещенный алкил, циклоалкил, арил, гетероарил, аралкил или гетероаралкил, или Q означает -NR6-, -NR5C(O)-, -NR5C(O)NH- или -NR5C(O)O- при условии, что р не является 1; W означает циклоалкил, арил или гетероциклил или W и R6 вместе с атомом азота, к которому они присоединены, образуют 9-10-членную бициклическую кольцевую систему, которая может быть необязательно замещена или может содержать другой гетероатом, выбранный из кислорода, азота и серы, или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Более предпочтительны соединения формулы IA, где L означает радикал
в котором R1 означает водород или необязательно замещенный алкил; R2 и R3 означают водород; n означает 0 или целое число от 1 до 2 или L означает радикал
в котором R1 означает водород или необязательно замещенный алкил; R” означает водород; m означает целое число от 1 до 2; R означает водород, галоген, необязательно замещенный (С1-С6)алкил или (С1-С6)-алкоксигруппу; R’ означает водород; Z означает связь, О или S; р означает целое число от 1 до 5; Q означает связь при условии, что Z не является связью, когда р означает 1, или Q означает О, S или -C(O)NR6-, где R6 означает водород, необязательно замещенный алкил или циклоалкил, или Q означает -NR6-, -NR5C(O)NH- или -NR5C(O)O-, где R5 означает водород, алкил или аралкил при условии, что р не является 1; W означает циклоалкил, арил или гетероциклил или W и R6 вместе с атомом азота, к которому они присоединены, образуют 9-10-членную бициклическую кольцевую систему, которая может быть необязательно замещена или может содержать другой гетероатом, выбранный из кислорода, азота и серы, или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Наиболее предпочтительны соединения формулы
где L означает радикал
в котором R1 означает водород или необязательно замещенный алкил; n означает ноль или 1 или L означает радикал
в котором R1 означает водород или необязательно замещенный алкил; m является 1; R означает водород, галоген, необязательно замещенный (С1-С6)алкил или (С1-С6)-алкоксигруппу; Z означает связь, О или S; р означает целое число от 1 до 5; Q означает связь при условии, что Z не является связью, когда р равно 1, или Q означает О, S или -C(O)NR6-, где R6 означает водород, необязательно замещенный алкил или циклоалкил, или Q означает -NR6-, -NR5C(O)NH- или -NR5C(O)O-, где R5 означает водород, алкил или аралкил при условии, что р не является 1; W означает циклоалкил, арил или гетероциклил или W и R6 вместе с атомом азота, к которому они присоединены, образуют 9-10-членную бициклическую кольцевую систему, которая может быть необязательно замещена или может содержать другой гетероатом, выбранный из кислорода, азота и серы; или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Далее предпочтительны соединения формулы IB, где L означает радикал
в котором R1 означает водород и n означает 0 или 1; R означает водород, галоген, необязательно замещенный (С1-С6)алкил или (С1-С6)-алкоксигруппу; Z означает связь, О или S; р означает целое число от 1 до 4; Q означает связь при условии, что Z не является связью, когда р означает 1, или Q означает О или S; W означает арил или гетероциклил, или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Затем предпочтительны также соединения формулы IB, где L означает радикал
в котором R1 означает водород; R означает водород, галоген, необязательно замещенный (С1-С6)алкил или (С1-С6)-алкоксил; Z означает связь, О или S; р означает целое число от 1 до 4; Q означает связь при условии, что Z не является связью, когда р означает 1, или Q означает О или S; W означает арил или гетероциклил, или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Далее предпочтительны также соединения формулы IB, где асимметрический центр в радикале L имеет (R)-конфигурацию, или их фармацевтически приемлемые соли. Кроме того, предпочтительны также соединения формулы IB, обозначаемые как группа А, где R1 означает водород или необязательно замещенный алкил; R означает водород, галоген, необязательно замещенный (С1-С6)алкил или (С1-С6)-алкоксигруппу; Z означает О или S; р означает 2; Q означает -NR6-, где R6 означает низший алкил; Q означает О или S; W означает арил или гетероциклил, или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Предпочтительны соединения в группе А, где R означает водород, хлор, н-пропил или метоксигруппу, или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Далее предпочтительны также соединения формулы IB, обозначаемые как группа В, где R1 означает водород или необязательно замещенный алкил; R означает водород, галоген, необязательно замещенный (С1-С6)алкил или (С1-С6)-алкоксигруппу; Z означает связь; р означает 2; Q означает -C(O)NR6-, где R6 означает необязательно замещенный алкил; W означает арил или гетероциклил или W и R6 вместе с атомом азота, к которому они присоединены, образуют 9-10-членную бициклическую кольцевую систему, которая может быть необязательно замещена или может содержать другой гетероатом, выбранный из кислорода, азота и серы, или их фармацевтически приемлемая соль, или их оптический изомер, или смесь их оптических изомеров. Предпочтительны соединения группы В, где R означает водород, хлор, н-пропил или метоксигруппу, или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Далее предпочтительны также соединения формулы IB, обозначаемые как группа С, где R1 означает водород или необязательно замещенный алкил; R означает водород, галоген, необязательно замещенный (С1-С6)алкил или (С1-С6)-алкоксигруппу; Z означает связь, О или S; р означает целое число от 2 до 3; Q означает О или S; W означает арил или гетероциклил, или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Предпочтительны соединения группы С, где R означает водород, хлор, н-пропил или метоксигруппу, или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Другой предпочтительной группой соединений в группе С являются соединения, где W выбирают из группы, состоящей из
или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Далее предпочтительны также соединения формулы IB, обозначаемые как группа D, где R1 означает водород или необязательно замещенный алкил; R означает водород, галоген, необязательно замещенный (С1-С6)алкил или (С1-С6)-алкоксигруппу; Z означает О или S; р означает целое число от 1 до 2; Q означает связь; W означает арил или гетероциклил, или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Предпочтительны соединения в группе D, где R означает водород, хлор, н-пропил или метоксигруппу, или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Другой предпочтительной группой соединений в группе D являются соединения, где W выбирают из группы, состоящей из
или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Еще одной предпочтительной группой соединений в группе D являются также соединения, где R1 означает водород или необязательно замещенный алкил; R означает водород, галоген, необязательно замещенный (С1-С6)алкил или (С1-С6)-алкоксигруппу; Z означает О или S; р означает 2; Q означает связь; W выбирают из группы, состоящей из
или их фармацевтически приемлемые соли, или их оптические изомеры, или смесь их оптических изомеров. Специфическими примерами осуществления изобретения являются следующие: (R)-1-{4-[4-(4-фенокси-2-пропилфенокси)бутокси]бензолсульфонил}азетидин-2-карбоновая кислота; (R)-1-{4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}азетидин-2-карбоновая кислота; (R)-1-[4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонил]азетидин-2-карбоновая кислота; (R)-1-{4-[2-(4-фторфенил)-5-метилоксазол-4-илметокси]бензолсульфонил}азетидин-2-карбоновая кислота; (R)-1-{4-[5-метил-2-(4-(трифторметилфенил)оксазол-4-илметокси] бензолсульфонил}азетидин-2-карбоновая кислота; (R)-1-{4-[2-(3,5-бис(трифторметилфенил)-5-метилоксазол-4-илметокси]бензолсульфонил}азетидин-2-карбоновая кислота; (R)-1-{4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]бензолсульфонил}азетидин-2-карбоновая кислота; (R)-1-{4-[4-(4-фенокси-2-пропилфенокси)бутокси]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-(4-{3-[2-пропил-4-(4-(трифторметил)фенокси)фенокси]пропокси}бензолсульфонил)пирролидин-2-карбоновая кислота; (R)-1-{4-[2-(4-фенокси-2-пропилфенокси)этокси]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-(4-{2-[2-пропил-4-(4-(трифторметил)фенокси)фенокси]этокси}бензолсульфонил)пирролидин-2-карбоновая кислота; (R)-1-{3-метокси-4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{3-хлор-4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{4-[3-(4-фенокси-2-пропилфенокси)пропокси]-3-пропилбензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{4-[3-(4-фенокси-2-пропилфенокси)пропилсульфанил]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{4-[2-(4-фенокси-2-пропилфенокси)этилсульфанил]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{4-[3-(4-фенокси-2-пропилфенокси)пропил]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-[4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонил]пирролидин-2-карбоновая кислота; (R)-1-{4-[2-(4-фторфенил)-5-метилоксазол-4-илметокси]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{4-[5-метил-2-(4-(трифторметилфенил)оксазол-4-илметокси]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{4-[2-(3,5-бис(трифторметилфенил)-5-метилоксазол-4-илметокси]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-[4-(2-бифенил-4-ил-5-метилоксазол-4-илметокси)бензолсульфонил]пирролидин-2-карбоновая кислота; (R)-1-[3-метокси-4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонил]пирролидин-2-карбоновая кислота; (R)-1-[3-хлор-4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонил]пирролидин-2-карбоновая кислота; (R)-1-[4-(5-метил-2-фенилоксазол-4-илметокси)-3-пропилбензолсульфонил]пирролидин-2-карбоновая кислота; (R)-1-[4-(5-метил-2-фенилоксазол-4-илметилсульфанил)бензолсульфонил]пирролидин-2-карбоновая кислота; (R)-1-{4-[2-(4-фторфенил)-5-метилоксазол-4-илметилсульфанил]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{4-[5-метил-2-(4-(трифторметил)фенил)оксазол-4-илметилсульфанил]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-(4-[2-(3,5-бис(трифторметилфенил)-5-метилоксазол-4-илметилсульфанил]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{3-метокси-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{3-хлор-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-(4-{2-[5-метил-2-(4-(трифторметилфенил)оксазол-4-ил]этокси}бензолсульфонил)пирролидин-2-карбоновая кислота; (R)-1-{4-[2-(5-метил-2-фенилоксазол-4-ил)этилсульфанил]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{4-[4-(4-фенокси-2-пропилфенокси)бутокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-{4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-{4-[2-(4-фенокси-2-пропилфенокси)этокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-{3-метокси-4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-{3-хлор-4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-[4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-{4-[2-(4-фторфенил)-5-метилоксазол-4-илметокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-{4-[5-метил-2-(4-(трифторметилфенил)оксазол-4-илметокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-{4-[2-(3,5-бис(трифторметилфенил)-5-метилоксазол-4-илметокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-[3-метокси-4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-[3-хлор-4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-[4-(5-метил-2-фенилоксазол-4-илметокси)-3-пропилбензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-[4-(5-метил-2-фенилоксазол-4-илметилсульфанил)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-{4-[2-(4-фторфенил)-5-метилоксазол-4-илметилсульфанил]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-{4-[5-метил-2-(4-(трифторметилфенил)оксазол-4-илметилсульфанил]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-{4-[2-(3,5-бис(трифторметилфенил)-5-метилоксазол-4-илметилсульфанил]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-{4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-{3-хлор-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота; (R)-1-{4-[5-метил-2-(4-(трифторметилфенил)оксазол-4-илметилсульфанил]бензолсульфонил}пирролидин-2-карбоновая кислота; (R)-1-{4-[5-метил-2-(4-(трифторметилфенил)оксазол-4-илметилсульфанил]-бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота, или их фармацевтически приемлемые соли, или их энантиомеры, или смесь их энантиомеров. Фармацевтически приемлемыми солями любых кислотных соединений по изобретению являются соли, образованные с основаниями, а именно соли катионов, как, например, соли щелочных и щелочноземельных металлов, как, например, натрий, литий, калий, кальций, магний, а также аммонийные соли, как, например, соли аммония, триметиламмония, диэтиламмония и трис(гидроксиметил)метиламмония. Подобным же образом кислотно-аддитивные соли, как, например, соли минеральных кислот, органических карбоновых кислот и органических сульфокислот, например соляной кислоты, метансульфокислоты, малеиновой кислоты, возможны при условии, что основная группа, как, например, пиридил, составляет часть структуры. Соединения формулы I могут быть получены, исходя из аналогов сульфокислот формулы
где R и R’ имеют приведенные здесь значения, X’ представляет X, как здесь определено, или X’ является группой, превращаемой в X. Соединения формулы II могут быть сначала обработаны хлорирующим средством, как, например, тионилхлорид или оксалилхлорид, для получения сульфонилхлоридов формулы
где R, R’ и X’ имеют значения, приведенные выше, применяя описанные здесь условия реакции или условия, хорошо известные в данной области. Сульфонилхлориды формулы III, где R, R’ и X’ имеют приведенные выше значения, могут затем быть подвергнуты реакции с аминами формулы
где R1, R2, R3, R4, n, Y, R” и m имеют приведенные здесь значения, в присутствии основания, как, например, триэтиламин, диизопропилэтиламин или N-метилморфолин, в инертном растворителе, как, например, дихлорметан, N,N-диметилформамид или тетрагидрофуран, для получения соединений формулы
где R, R’ и X’ имеют приведенные выше значения и L представляет радикал где R1, R2, R3, R4, n, Y, R” и m имеют приведенные выше значения. Амины формул IV и V могут быть получены с помощью описанных здесь способов или их модификаций, или с помощью способов, известных в данной области. Соединения формулы I’, где X’ представляет X, как здесь определено, могут быть получены из соединений формулы I’, где X’ является группой, превращаемой в Х с применением описанных здесь способов или их модификаций, или с применением способов, хорошо известных в данной области. Например, соединения формулы I’, в которых X’ является бензилоксигруппой, могут быть сначала превращены в соединения формулы
где R, R’ и L имеют приведенные выше значения, например, путем восстановления водородом в присутствии катализатора, как, например, палладий на угле, в полярном органическом растворителе, как, например, этилацетат или этанол. Полученные в результате фенолы формулы VI могут затем быть обработаны алкилирующим агентом формулы
где р, Q и W имеют приведенные выше значения и Lg является уходящей группой, как, например, бромид, хлорид или трифторметансульфонат, в присутствии основания, как, например, карбонат калия или гидрид натрия, в инертном растворителе, как, например, N,N-диметилформамид или тетрагидрофуран, для получения соединений формулы I’, в которых X’ означает -O-(CH2)p-Q-W и р, Q и W имеют приведенные здесь значения. Альтернативно соединения формулы I’, где X’ означает -O-(CH2)p-Q-W и р, Q и W имеют приведенные здесь значения, могут быть получены из аналогов сульфокислот формулы II’, где X’ является гидроксилом и R и R’ имеют приведенные здесь значения, путем превращения соединения формулы II в его соль, включающую два атома щелочного металла, например динатриевую соль, используя водное основание, например водную гидроокись натрия, в полярном растворителе, как, например, 1,4-диоксан, с последующей обработкой алкилирующим агентом формулы VII, где р, Q и W имеют приведенные здесь значения и Lg является уходящей группой, как, например, бромид, хлорид или трифторметансульфонат, для получения соединений формулы
где R, R’, р, Q и W имеют приведенные здесь значения. Соединения формулы VIII, где R, R’, р, Q и W имеют приведенные здесь значения, могут быть обработаны хлорирующим агентом, как, например, тионилхлорид или оксалилхлорид, для получения сульфонилхлоридов формулы
где R, R’, р, Q и W имеют приведенные здесь значения. Сульфонилхлориды формулы IX могут быть подвергнуты реакции с аминами формул IV или V или с их кислотно-аддитивными солями, где R1 означает водород и R2, R3, n, Y, R” и m имеют приведенные здесь значения, в присутствии основания, как, например, водная гидроокись натрия, в полярном растворителе, как, например, 1,4-диоксан, для получения соединений формулы I’, где X’ означает -O-(CH2)p-Q-W и р, Q и W имеют приведенные здесь значения. Подобным образом соединения формулы I’, где R, R’ и L имеют приведенные выше значения и X’ является тиолом, могут быть превращены в соединения формулы I’, в которых X’ означает -S-(CH2)p-Q-W. Например, тиолы формулы
где R и R’ имеют приведенные здесь значения, могут быть подвергнуты димеризации с помощью способов, известных в данной области, с образованием дисульфидов формулы где R и R’ имеют приведенные здесь значения. Соединения формулы XI, где R и R’ имеют приведенные здесь значения, могут быть превращены в аналоги сульфонилхлоридов формулы где R и R’ имеют приведенные здесь значения, путем обработки хлорсульфокислотой в инертном растворителе, как, например, дихлорметан, с последующим щелочным гидролизом, например, с помощью водной гидроокиси натрия. Полученные в результате бис-натриевые соли могут затем быть обработаны хлорирующим агентом, как, например, тионилхлорид или оксалилхлорид, для получения сульфонилхлоридов формулы XII. Сульфонилхлориды формулы XII, где R и R’ имеют приведенные здесь значения, могут взаимодействовать с аминами формулы в которых R1, R2, R3, R4, n, Y, R” и m имеют приведенные здесь значения, в присутствии основания, как, например, триэтиламин, диизопропилэтиламин или N-метилморфолин, в инертном растворителе, как, например, дихлорметан, N,N-диметилформамид или тетрагидрофуран, для получения дисульфидов формулы где R и R’ имеют приведенные выше значения и L представляет радикал где R1, R2, R3, R4, n, Y, R” и m имеют приведенные выше значения. Дисульфиды формулы XIII, где R, R’ и L имеют приведенные здесь значения, могут быть восстановлены в тиолы формулы
где R, R’ и L имеют приведенные выше значения, при обработке восстанавливающим агентом, как, например, борогидрид натрия или трифенилфосфин, в полярном растворителе, как, например, этанол или тетрагидрофуран соответственно. Тиолы формулы XIV могут затем быть обработаны алкилирующим агентом формулы
где р, Q и W имеют приведенные здесь значения и Lg является уходящей группой, как, например, бромид, хлорид или трифторметансульфонат, в присутствии основания, как, например, карбонат калия или гидрид натрия, в инертном растворителе, как, например, N,N-диметилформамид или тетрагидрофуран, для получения соединений формулы I Предпочтительно алкилирующий агент формулы VII выбирают из группы, где р является целым числом от 2 до 5, Q означает кислород, Lg означает хлорид или бромид и W означает
или алкилирующий агент формулы VII выбирают из группы, где р означает 1-2, Q означает связь, Lg означает хлорид или бромид и W означает
или алкилирующий агент формулы VII выбирают из группы, где р означает 2, Q означает связь, Lg означает хлорид или бромид и W означает
Алкилирующие агенты формулы VII могут быть получены с применением описанных здесь способов или их модификаций, или с применением способов, известных в данной области, например, 4-хлорметил-5-метил-2-фенилоксазол и 4-хлорметил-5-метил-2-[4-(трифторметил)фенил]оксазол могут быть получены с применением способов, описанных в международной заявке на патент РСТ WO 00/64888, или согласно J. Med. Chem., том 43, стр. 995-1010 (2000). 1-(3-Бромпропокси)-4-фенокси-2-пропилбензол может быть получен, как описано в международной заявке на патент РСТ WO 00/78312. Предпочтительно алкилирующие агенты формулы VII, имеющие формулу где Ra и Rb означают независимо водород, галоген, алкил, алкоксил, трифторметил или арил, могут быть получены при обработке соединения формулы где Ra и Rb имеют значения, приведенные для формулы VIIa, хлорирующим агентом, как, например, хлорокись фосфора (POCl3), в ацетонитриле. Существенно, что реакция проводится в ацетонитриле для того, чтобы получить алкилирующие агенты формулы VIIa с высоким химическим выходом и высокой чистотой, т.е. алкилирующие агенты формулы VIIa получают согласно настоящему способу с высокой региоселективностью, предпочтительно с селективностью, большей чем 99%. Хлорирование предпочтительно проводят при температуре окружающей среды, например при комнатной температуре. Соединения формулы VIIb могут быть получены при конденсации альдегида формулы где Ra и Rb имеют значения, приведенные для формулы VIIb, с монооксимом 2,3-бутадиона формулы в присутствии кислотного катализатора, как, например, HCl-газ, и органического растворителя, как, например, этилацетат или уксусная кислота, предпочтительно ледяная уксусная кислота, приводящей к соединениям формулы VIIb, где Ra и Rb имеют значения, приведенные выше. В предпочтительном варианте осуществления изобретения алкилирующим агентом формулы VIIa является 4-хлорметил-5-метил-2-[4-(трифторметил)фенил]оксазол. Альтернативно фенолы формулы VI и тиолы формулы XIV могут также реагировать со спиртами формулы
где р, Q и W имеют приведенные здесь значения, в условиях реакции Мицунобу, например, в присутствии трифенилфосфина и диэтилового эфира азодикарбоновой кислоты в органическом растворителе, как, например, тетрагидрофуран, для получения соединений формулы I’, где X’ означает -O-(CH2)p-Q-W или -S-(CH2)p-Q-W соответственно и р, Q и W имеют приведенные здесь значения. Спирты формулы VII” могут быть получены с помощью описанных здесь способов или их модификаций, или с помощью способов, хорошо известных в данной области. Соединения формулы I’, где X’ означает -(CH2)p-Q-W и р и W имеют приведенные здесь значения, и Q означает О или S, могут быть получены при реакции соединений формулы
где R, R’ и р имеют приведенные выше значения и Pg представляет защитную группу, как, например, ацил, например ацетил, или (низш.)алкоксикарбонил, с хлорсульфокислотой в инертном растворителе, как, например, дихлорметан, с последующей обработкой хлорирующим агентом, как, например, тионилхлорид или оксалилхлорид, что приводит к сульфонилхлоридам формулы
где R, R’, р и Pg имеют приведенные выше значения. Сульфонилхлориды формулы XVI могут соединяться с аминами формулы VI или V, как описано выше, с образованием соединений формулы
где R, R’, р, Pg и L имеют приведенные здесь значения. Последующее удаление защитной группы с использованием основания, например водной гидроокиси натрия, в полярном растворителе, как, например, метанол, тетрагидрофуран или 1,4-диоксан, в особенности, когда Pg означает ацетил, приводит к спиртам формулы
где R, R’, р и L имеют приведенные здесь значения. Спирты формулы XVIII могут соединяться с фенолами формулы W-OH или тиолами формулы W-SH, например, в условиях реакции Мицунобу с образованием соединений формулы I’, где R, R’ и L имеют приведенные здесь значения и X’ представляет -(CH2)p-Q-W, где р и W имеют приведенные здесь значения, и Q означает кислород или серу соответственно. Альтернативно спирты формулы XVIII могут быть превращены в соединения формулы
где R, R’, р и L имеют приведенные здесь значения и Lg представляет уходящую группу, как, например, хлорид, бромид или трифторсульфонат, с применением описанных здесь способов или их модификаций или с применением хорошо известных в данной области способов. Последующая реакция с фенолами формулы W-OH или тиолами формулы W-SH в присутствии основания, как, например, карбонат калия, или гидрида натрия, в инертном растворителе, как, например, N,N-диметилформамид или тетрагидрофуран, приводит к соединениям формулы I’, где R, R’ и L имеют приведенные здесь значения и X’ представляет -(CH2)p-Q-W, где р и W имеют приведенные здесь значения и Q означает кислород или серу соответственно. Соединения формулы I’, где R, R’ и L имеют приведенные здесь значения и X’ представляет -C(O)NR5-(CH2)p-Q-W, и R5, р, Q и W имеют приведенные здесь значения, могут быть получены при реакции активированного производного карбоновой кислоты формулы
где R, R’ и L имеют приведенные здесь значения и R1 означает необязательно замещенный алкил, арил, гетероарил, аралкил или циклоалкил, с аминами или их кислотно-аддитивными солями формулы
где R5, р, Q и W имеют приведенные здесь значения. Карбоновые кислоты формулы XX и амины формулы XXI могут быть получены с применением описанных здесь способов или их модификаций, или с применением известных в данной области способов. Подобным же образом соединения формулы I’, где R, R’и L имеют приведенные здесь значения и X’ представляет -Z-(CH2)p-C(O)NR6-W, и Z, p, R6 и W имеют приведенные здесь значения, могут быть получены при реакции активированного производного карбоновой кислоты формулы
где R, R’, L, Z и р имеют приведенные здесь значения и R1 является необязательно замещенным алкилом, арилом, гетероарилом, аралкилом или циклоалкилом, с аминами или их кислотно-аддитивными солями формулы
где R6 и W имеют приведенные здесь значения. Карбоновые кислоты формулы XXII и амины формулы XXIII могут быть получены с применением описанных здесь способов или их модификаций, или с применением известных в данной области способов. В цитированных выше способах активированные производные карбоновых кислот, например, формул XX и XXII, включают хлорангидриды, бромангидриды и фторангидриды, смешанные ангидриды, сложные (низш.)алкиловые эфиры и их активированные сложные эфиры, и аддукты, образованные с сочетающими агентами, как, например, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, тетрафторборат O-(1,2-дигидро-2-оксо-1-пиридил)-N,N,N’,N’-тетраметилурония и им подобные соединения. Смешанными ангидридами являются предпочтительно такие из триметилуксусной кислоты или сложных (низш.)алкиловых полуэфиров карбоновых кислот, как, например, этиловые или изобутиловые аналоги. Активированные сложные эфиры включают, например, сложные сукцинимидоэфиры, фталимидоэфиры или 4-нитрофениловые эфиры. Реакция активированного производного карбоновой кислоты, например, соединений формул XXI или XXIII соответственно, может быть проведена в присутствии основания, как, например, триэтиламин, диизопропилэтиламин или N-метилморфолин, в инертном растворителе, как, например, дихлорметан, N,N-диметилформамид или тетрагидрофуран. Карбоновые кислоты формул XX и XXII могут быть превращены в их активированные производные, применяя способы, описанные здесь или известные в данной области. Соединения формулы I’, где R, R’ и L имеют приведенные здесь значения и X’ представляет -Z-(CH2)p-NR5C(O)-W, -Z-(CH2)p-NR5C(O)NH-W или -Z-(CH2)p-NR5C(O)-O-W, и Z, р, R5 и W имеют приведенные здесь значения, могут быть получены при реакции аминов формулы
где R, R’, Z, р, R5 и L имеют приведенные здесь значения и R1 является необязательно замещенным алкилом, арилом, гетероарилом, аралкилом или циклоалкилом, с реагентом для получения производных по аминогруппе, как, например, производное активированной карбоновой кислоты, изоцианат или эфир хлормуравьиной кислоты соответственно, в присутствии основания, как, например, триэтиламин, диизопропилэтиламин или N-метилморфолин, в инертном растворителе, как, например, дихлорметан, N,N-диметилформамид или тетрагидрофуран. Амины формулы XXIV могут быть получены с применением описанных здесь способов или их модификаций, или с применением известных в данной области способов. Соединения формулы I’, в которых R, R’, L и X’ имеют приведенные здесь значения и R1 означает необязательно замещенный алкил, арил, гетероарил, аралкил или циклоалкил, могут быть превращены в соединения формулы I’, в которых R1 означает водород, используя описанные здесь условия реакции или их модификации, или используя известные в данной области способы, например, соединения формулы I’, в которых R1 означает низший алкил, например метил или этил, могут быть обработаны водным основанием, как, например, гидроокись натрия или калия, в полярном растворителе, как, например, метанол, этанол, 1,4-диоксан или тетрагидрофуран, в результате получают соединения формулы I’, в которых R, R’, L и X’ имеют приведенные здесь значения и R1 означает водород. В исходных веществах и промежуточных соединениях, которые превращают в соединения по изобретению описанным здесь способом, присутствующие функциональные группы, как, например, аминогруппа, тиольная, карбоксильная и гидроксильная группы, необязательно защищены обычными защитными группами, которые являются общепринятыми в препаративной органической химии. Защищенными аминогруппой, тиольной, карбоксильной и гидроксильной группами являются такие группы, которые могут быть превращены в мягких условиях в свободные аминогруппу, тиольную, карбоксильную и гидроксильные группы без разрушения структуры молекулы или протекания других нежелательных побочных реакций. Целью введения защитных групп является защита функциональных групп от нежелательных реакций с компонентами реакции в условиях, используемых для осуществления желаемого химического превращения. Необходимость в защитных группах и выбор защитных групп для определенной реакции известны специалистам в данной области и зависят от природы функциональной группы, которую следует защитить (гидроксильная группа, аминогруппа и т.д.), структуры и устойчивости молекулы, заместитель которой является ее частью, и условий реакции. Хорошо известные защитные группы, удовлетворяющие этим условиям, и их введение и удаление описываются, например, в книге McOmie, “Protective Groups in Organic Chemistry”, изд. Plenum Press, Лондон, Нью-Йорк (1973), и в книге Greene и Wuts, “Protective Groups in Organic Synthesis”, изд. John Wiley and Sons, Inc., Нью-Йорк (1999). Упомянутые выше реакции проводят согласно стандартным способам в присутствии или в отсутствие растворителей, таких, которые инертны по отношению к реагентам и являются их растворителями, или катализаторов, конденсирующих упомянутые другие агенты соответственно и/или в инертной атмосфере, при низких температурах, комнатной температуре или повышенных температурах (предпочтительно при температуре кипения или близкой к точке кипения используемых растворителей), и при атмосферном давлении или давлении выше атмосферного. Предпочтительные растворители, катализаторы и условия реакций представлены в приведенных иллюстративных примерах. Изобретение далее включает любой вариант представленных способов, по которому промежуточный продукт, получаемый на любой его стадии, применяется в качестве исходного вещества при проведении остальных стадий, или по которому исходные вещества образуются in situ в условиях реакции, или по которому компоненты реакции используются в виде их солей или оптически чистых антиподов. Соединения по изобретению и промежуточные соединения могут также быть превращены друг в друга согласно способам, обычно по сути известным. Изобретение также относится к любым новым исходным веществам и способам их получения. В зависимости от выбора исходных веществ и способов соединения могут быть в виде одного из возможных изомеров или их смесей, например, в виде в значительной степени чистых геометрических (цис- или транс-) изомеров, оптических изомеров (антиподов), рацематов или их смесей. Вышеупомянутые возможные изомеры или их смеси находятся в рамках сферы действия данного изобретения. Любые полученные в результате смеси изомеров могут быть разделены на основании физико-химических различий их составляющих на чистые геометрические или оптические изомеры, диастереоизомеры, рацематы, например, с помощью хроматографии и/или фракционной кристаллизации. Любые полученные в результате рацематы конечных продуктов или промежуточных соединений могут быть разделены на оптические антиподы известными способами, например путем разделения их диастереоизомерных солей, полученных с помощью оптически активной кислоты или основания, и выделения оптически активного кислотного или основного соединения. Промежуточные соединения в виде карбоновых кислот могут таким образом быть разделены на их оптические антиподы, например, путем фракционной кристаллизации D- или L-солей с Наконец, соединения по изобретению получают либо в свободной форме, либо в виде их соли, если присутствуют солеобразующие группы. Кислотные соединения по изобретению могут быть превращены в соли с помощью фармацевтически приемлемых оснований, например водной гидроокиси щелочного металла, предпочтительно в присутствии растворителя в виде простого эфирного или спиртового растворителя, как, например, (низш.)алканол. Из растворов в последнем соли могут осаждаться с применением простых эфиров, например диэтилового эфира. Полученные в результате соли могут быть превращены в свободные соединения при обработке кислотами. Эти или другие соли могут быть также использованы для очистки полученных соединений. Соединения по изобретению, имеющие основные группы, могут быть превращены в кислотно-аддитивные соли, особенно фармацевтически приемлемые соли. Эти соли образуются, например, с неорганическими кислотами, как, например, минеральные кислоты, например серная кислота, фосфорная или галоидводородная кислота, или с органическими карбоновыми кислотами, как, например, (С1-С4)алканкарбоновые кислоты, которые, например, не замещены или замещены галогеном, например уксусная кислота, такие, как насыщенные или ненасыщенные дикарбоновые кислоты, например щавелевая, янтарная, малеиновая или фумаровая кислоты, такие, как гидроксикарбоновые кислоты, например гликолевая, молочная, яблочная, винная или лимонная кислоты, такие, как аминокислоты, например аспарагиновая или глутаминовая кислоты, или с органическими сульфокислотами, как, например, (С1-С4)-алкилсульфокислоты, например метансульфокислота, или с арилсульфокислотами, которые не замещены или замещены, например, галогеном. Предпочтительны соли, образованные с соляной кислотой, метансульфокислотой или малеиновой кислотой. Принимая во внимание близкое родство между свободными соединениями и соединениями в виде их солей, всякий раз, когда на соединение ссылаются в данном контексте, также подразумевается соответствующая соль при условии, что такая соль возможна или уместна в данных обстоятельствах. Соединения, включая их соли, также могут быть получены в виде их гидратов или включают другие растворители, примененные для их кристаллизации. Фармацевтическими композициями согласно изобретению являются такие, которые подходят для введения через тонкий кишечник, как, например, пероральное или ректальное, для чрескожного и парентерального введения млекопитающим, включая человека, для лечения состояний, опосредствованных рецепторами PPAR, в особенности PPAR Фармакологически активные соединения по изобретению могут быть использованы при приготовлении фармацевтических композиций, включающих их эффективные количества в сочетании или в смеси с наполнителями или носителями, подходящими и для применения через тонкий кишечник и для парентерального применения. Указанные композиции могут быть стерилизованы и/или содержать адъюванты, как, например, консервирующие, стабилизирующие, смачивающие или эмульгирующие агенты, стимуляторы растворения, соли для регулирования осмотического давления и/или буферы. Кроме того, они могут также содержать другие терапевтически ценные вещества. Упомянутые композиции готовят согласно общепринятым способам смешения, гранулирования или нанесения покрытия соответственно и они содержат примерно 0,1-75%, предпочтительно примерно 1-50% активного ингредиента. Подходящие готовые лекарственные формы для чрескожного применения включают терапевтически эффективное количество соединения по изобретению вместе с носителем. Предпочтительные носители включают абсорбируемые фармакологически приемлемые растворители для способствования проникновению через кожу организма-хозяина. Обычно приспособления для чрескожного проникновения существуют в виде бандажа, включающего заднюю спинку, резервуар, содержащий соединение необязательно с носителями, необязательно с регулирующей скорость перегородкой для доставки соединения с кожи организма-хозяина с регулируемой и предварительно определенной скоростью в течение продолжительного периода времени, и средства для прикрепления приспособления к коже. Фармацевтические готовые формы содержат терапевтически эффективное количество соединения по изобретению, как определено выше, либо одного, либо в комбинации с другим терапевтическим средством, например, каждое в эффективной терапевтической дозе, как установлено в данной области. Такие терапевтические средства включают инсулин, инсулиновые производные и миметики; средства, усиливающие секрецию инсулина, как, например, сульфонилмочевины, например, глипизид и амарил; лиганды рецептора инсулинотропной сульфонилмочевины, как, например, меглитиниды, например натеглиниды и репаглиниды; инсулин-сенсибилизаторы, как, например, ингибиторы (белок-тирозин)-фосфатазы-1В (РТР-1В), ингибиторы GSK3 (гликогенсинтазы-киназы-3) или лиганды RXR; бигуаниды, как, например, метформин; ингибиторы Стандартная доза для млекопитающего массой 50-70 кг может содержать примерно между 1 и 1000 мг, предпочтительно примерно 5-500 мг активного ингредиента. Терапевтически эффективная доза активного соединения зависит от вида теплокровного животного (млекопитающего), массы тела, возраста и индивидуального состояния, от формы введения и от привлеченного к участию соединения. Соединения по настоящему изобретению связываются с рецепторами PPAR и поэтому могут быть применены для лечения состояний, опосредствованных рецепторами PPAR, в частности PPAR Приведенные выше свойства продемонстрированы in vitro и in vivo исследованиями преимущественно на млекопитающих, например, на мышах, крысах, собаках, обезьянах, или при использовании изолированных органов, тканей и их препаратов. Упомянутые соединения могут быть применены in vitro в виде растворов, например, предпочтительно водных растворов, и in vivo и через тонкий кишечник, и парентерально, преимущественно внутривенно, например, в виде суспензии или в водном растворе. Дозировка in vitro может колебаться в пределах между примерно 10-5 и 10-10 молярными концентрациями. Терапевтически эффективное количество in vivo может в зависимости от способа введения находиться в пределах примерно между 1 и 500 мг/кг, предпочтительно примерно между 5 и 100 мг/кг. Соединения по изобретению связываются с рецепторами PPAR Активность соединения по изобретению может быть оценена с помощью следующих способов или способов, подробно описанных в данной области. In vitro функциональное связывание с рецепторами PPAR Анализы функционального связывания для рецепторов PPAR Уменьшающая глюкозу и инсулин активность in vivo может быть оценена следующим образом. Взрослых самцов мышей линии C57BL (Jackson Lab, Бар Харбор, Средний Восток), полученных скрещиванием особей мышей с ожирением (ob/ob мыши), в возрасте 11 недель помещают по шесть особей в клетку в помещение с обратным световым циклом (свет от 6:00 после полудня до 6:00 до полудня) и мышам дают на выбор казуарину хвощевидную для грызунов Purina и воду. В день 1 берут образцы крови из хвоста в 8:00 до полудня и определяют уровни глюкозы в плазме. Животных методом слепого отбора относят к контрольной группе и к группе для исследования соединений. Согласовывали средние значения уровней глюкозы в группах. Животным затем вводили перорально носитель (0,5% карбоксиметилцеллюлоза с 0,2% твином-80) или соединения (в дозе 30 мг/кг) в носителе. Мышам это вводят ежедневно в общей сложности в течение 3 дней. В день 4 берут базальные образцы крови. В образцах плазмы определяют концентрации глюкозы, используя Двуканальный анализатор для Биохимических исследований YSI2700 (Yellow Springs Instrument Co., Yellow Springs, ОН), и концентрации инсулина, применяя ферментный иммуносорбентный анализ (ELISA). Иллюстрируя изобретение, соединение из примера 1 показывает ЕС50 примерно 27 нМ в анализе связывания рецептора PPAR Имеется в виду, что следующие примеры иллюстрируют изобретение и не рассматриваются как ограничивающие его. Температуры приводятся в градусах по шкале Цельсия. Если не указывается иначе, все операции упаривания проводятся при пониженном давлении, предпочтительно между примерно 15 и 100 мм рт.ст. (20-133 мбар). Структура конечных продуктов, промежуточных соединений и исходных веществ подтверждается с помощью стандартных аналитических способов, например с помощью микроанализа, и спектральных характеристик, например с помощью масс-спектрометрии (МС), инфракрасной спектрометрии (ИК) и ядерного магнитного резонанса (ЯМР). Используемые сокращения являются общепринятыми в данной области. Пример 1 (R)-1-{4-[3-(4-Фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота А. (R)-1-(4-Бензилоксибензолсульфонил)-2,3-дигидро-1Н-индол-2-карбоновая кислота К раствору (R)-2,3-дигидро-1Н-индол-2-карбоновой кислоты (2,89 г, 14,5 ммоля) и 1 н. гидроокиси натрия (37,7 мл, 37,7 ммоля) в воде (79 мл), перемешиваемому при комнатной температуре, прибавляют по каплям хлористый 4-бензилоксибензолсульфонил (4,1 г, 14,5 ммоля) в диоксане (104 мл). По завершении прибавления регулируют рН реакционной смеси и поддерживают между 7 и 8 путем медленного прибавления 1 н. водной гидроокиси натрия в течение последующих 2 часов. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Раствор выливают в измельченный лед и полученную в результате смесь подкисляют до рН 2-3 с помощью 1 н. водной соляной кислоты (15 мл). Продукт экстрагируют дихлорметаном (2×150 мл). Экстракт промывают водой (150 мл), соляным раствором (150 мл), сушат над безводным сульфатом магния (MgSO4), фильтруют и концентрируют, получают 5,5 г (R)-l-(4-бензилоксибензолсульфонил)-2,3-дигидро-1Н-индол-2-карбоновой кислоты в виде масла; [M+1]+=410,32, [М-1]–=408,24. Б. Метиловый эфир (R)-1-(4-бензилоксибензолсульфонил)-2,3-дигидро-1Н-индол-2-карбоновой кислоты Раствор полученной на стадии А (R)-1-(4-бензилоксибензолсульфонил)-2,3-дигидро-1Н-индол-2-карбоновой кислоты (5,55 г, 13, 6 ммоля) и моногидрата п-толуолсульфокислоты (0,52 г, 2,7 ммоля) в метаноле (260 мл) кипятят с обратным холодильником в атмосфере азота в течение 4 часов. Раствор выдерживают в течение ночи при комнатной температуре, что приводит к образованию твердого кристаллического вещества. Кристаллы собирают путем фильтрации под вакуумом и сушат в высоком вакууме. Вторую порцию кристаллов получают из маточного раствора, их выделяют и сушат в высоком вакууме. Всего получают 3,84 г метилового эфира (R)-1-(4-бензилоксибензолсульфонил)-2,3-дигидро-1Н-индол-2-карбоновой кислоты в виде чистого кристаллического продукта; [М+1]+=424,27. В. Метиловый эфир (R)-1-(4-гидроксибензолсульфонил)-2,3-дигидро-1Н-индол-2-карбоновой кислоты К суспензии полученного на стадии Б метилового эфира (R)-1-(4-бензилокси-бензолсульфонил)-2,3-дигидро-1Н-индол-2-карбоновой кислоты (3,00 г, 7,1 ммоля) в этаноле (200 мл) в атмосфере азота прибавляют 10% палладий на угле (0,3 г). Полученную в результате смесь гидрируют при давлении 3,234 кг/см2 в течение 18,5 часов при комнатной температуре. Смесь фильтруют через цеолит под вакуумом. Фильтрат концентрируют в вакууме, получают 1,31 г метилового эфира (R)-1-(4-гидроксибензолсульфонил)-2,3-дигидро-1H-индол-2-карбоновой кислоты, который используют без дальнейшей очистки; [M+1]+=334,22, [М-1]–=332,16. Г. Метиловый эфир (R)-1-(4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты К раствору полученного на стадии В метилового эфира (R)-1-(4-гидроксибензолсульфонил)-2,3-дигидро-1Н-индол-2-карбоновой кислоты (1,31 г, 3,9 ммоля) в N,N-диметилформамиде (50 мл) при комнатной температуре прибавляют в один прием безводный карбонат калия (2,16 г, 15,6 ммоля). Через 15 минут прибавляют при комнатной температуре раствор 3-(4-фенокси-2-пропилфенокси)пропан-1-бромида (1,37 г, 3,9 ммоля) в N,N-диметилформамиде (10 мл). Реакционную смесь перемешивают 64 часа при комнатной температуре. Реакционную смесь фильтруют, фильтрат разбавляют водой (150 мл) и полученную в результате смесь экстрагируют диэтиловым эфиром (2×150 мл). Органический экстракт промывают водой (3×100 мл) и соляным раствором (100 мл), сушат над безводным сульфатом магния, фильтруют и концентрируют в вакууме, получают 2,32 г технического метилового эфира (R)-1-{4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты. Очистка технического продукта с помощью хроматографии (SiO2: 100 г; элюент 30% Д. (R)-1-{4-[3-(4-Фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновая кислота К смеси полученного на стадии Г метилового эфира (R)-1-{4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты (1,47 г, 2,44 ммоля) в метаноле (50 мл) в атмосфере азота при комнатной температуре прибавляют по каплям 1 н. водную гидроокись натрия (4,9 мл, 4,9 ммоля). По окончании прибавления смесь перемешивают при комнатной температуре 45 минут, в это время прибавляют 5 мл тетрагидрофурана для облегчения растворения исходного вещества. Смесь перемешивают в течение ночи. Реакционную смесь концентрируют в вакууме, остаток распределяют между водой (50 мл) и диэтиловым эфиром (50 мл). Водный слой отделяют и подкисляют 1 н. водной соляной кислотой. Продукт экстрагируют дихлорметаном. Экстракт промывают соляным раствором, сушат над безводным сульфатом натрия (Na2SO4), фильтруют и концентрируют, получают 1,02 г (R)-1-{4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты в виде твердого пенообразного вещества белого цвета. Твердое вещество обрабатывают этанолом (1 мл), что приводит к растворению твердого вещества, и после выдержки начинают образовываться кристаллы. Кристаллы отделяют и сушат в высоком вакууме при 40°С, получают 0,85 г очищенной (R)-1-{4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты; [М+1]+=588,46; [М-1]–=586,41. Пример 2 (R)-1-[4-(5-Метил-2-фенилоксазол-4-илметокси)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновая кислота А. Динатриевая соль 4-гидроксибензолсульфокислоты Раствор дигидрата натриевой соли 4-гидроксибензолсульфокислоты (20 г, 86 ммолей) в 1 н. водной гидроокиси натрия (86 мл, 86 ммолей) перемешивают и нагревают при 50-60°С в течение 1 часа. Раствор концентрируют в вакууме при 50°С и получают твердое вещество. Твердое вещество суспендируют в безводном толуоле и концентрируют в вакууме. Эту обработку повторяют дважды. Твердое вещество сушат при 50°С в высоком вакууме в течение 18 часов, получают 21,34 г динатриевой соли 4-гидроксибензолсульфокислоты. Б. Натриевая соль 4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфокислоты Смесь полученной на стадии А динатриевой соли 4-гидроксибензолсульфокислоты (3,50 г, 16,1 ммоля) и 4-хлорметил-5-метил-2-фенилоксазола (4,00 г, 19,3 ммоля) в 20 мл N,N-диметилформамида перемешивают и нагревают в атмосфере азота при 110°С в течение 18 часов. Охлажденную реакционную смесь фильтруют и полученное твердое вещество тщательно промывают дихлорметаном. Твердое вещество сушат в течение ночи, получают 1,42 г натриевой соли 4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфокислоты; [М+1]+=346,05, [М-1]–=344,02. В. Хлористый 4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонил К раствору тионилхлорида (8,0 мл) и 2 капель N,N-диметилформамида при перемешивании под азотом при 0°С прибавляют в один прием полученную на стадии Б натриевую соль 4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфокислоты (1,42 г, 3,8 ммоля). Полученную в результате суспензию перемешивают при 0°С в течение 10 минут. Баню со льдом удаляют и суспензию перемешивают при комнатной температуре 1,5 часа. Прибавляют еще три капли N,N-диметилформамида, после чего получают в результате после перемешивания дополнительно в течение часа прозрачный раствор. Раствор концентрируют в вакууме до получения твердого остатка. Остаток распределяют между водой (20 мл) и этилацетатом (20 мл). Органический слой отделяют и промывают последовательно водой (3×20 мл), 0,1 н. водной гидроокисью натрия (3×20 мл) и соляным раствором (20 мл). Органический слой сушат над безводным сульфатом магния, фильтруют и концентрируют в вакууме, получают маслянистое вещество, которое медленно затвердевает с образованием 0,48 г хлористого 4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонила; [М+1]+=363,99. Г. (R)-1-[4-(5-Метил-2-фенилоксазол-4-илметокси)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновая кислота К раствору гидрохлорида (R)-2,3-дигидро-1Н-индол-2-карбоновой кислоты (0,92 г, 4,6 ммоля), 1 н. водной гидроокиси натрия (12,0 мл, 12 ммолей) и воды (25 мл) при комнатной температуре прибавляют по каплям раствор полученного на стадии В хлористого 4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонила (1,65 г, 4,6 ммоля) в диоксане (33 мл). После окончания прибавления рН реакционной смеси контролируют и поддерживают между 7 и 8 путем медленного прибавления 1 н. водной гидроокиси натрия в течение следующих 2 часов. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Раствор выливают в измельченный лед и полученную в результате смесь подкисляют до рН 2-3 с помощью 1 н. водной соляной кислоты (11 мл). Выпавший осадок собирают, промывают водой и сушат в высоком вакууме в течение ночи, получают 1,5 г (R)-1-[4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновой кислоты; [М+1]+=491,2, [М-1]–=489,1. Пример 3 (R)-1-[4-(5-Метил-2-фенилоксазол-4-илметилсульфанил)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновая кислота А. 4,4′-Дитиобисбензолсульфокислота К раствору фенилдисульфида (4,36 г, 20 ммолей) в дихлорметане (40 мл) при 0°С прибавляют по каплям раствор хлорсульфоновой кислоты (4,64 г, 2,95 мл, 40 ммолей) в дихлорметане (60 мл). Смесь перемешивают при 0°С в течение 1 часа, а затем 1,5 часа при комнатной температуре. Реакционную смесь концентрируют досуха в вакууме и остаток распределяют между диэтиловым эфиром и водой. Водную фазу отделяют, подщелачивают с помощью 2 н. водной гидроокиси натрия и концентрируют в вакууме до половины объема. Полученный в результате раствор выдерживают в холодильнике в течение ночи. Образовавшийся в течение ночи осадок отбрасывают, фильтрат далее концентрируют в вакууме до начала появления твердого вещества. Смесь помещают в холодильник на 2 часа. Смесь обрабатывают этанолом, образовавшееся твердое вещество отфильтровывают, промывают дважды этанолом и сушат в высоком вакууме в течение ночи при комнатной температуре, получают 6,0 г 4,4′-дитиобисбензолсульфокислоты в виде твердого вещества белого цвета; [М-1]–=398,8. Б. 4,4′-Дитиобисбензолсульфохлорид К тионилхлориду (70 мл) при 0°С прибавляют порциями полученную на стадии А 4,4′-дитиобисбензолсульфокислоту (5,9 г, 14 ммолей), а затем N,N-диметилформамид (1,4 мл). Полученную в результате смесь перемешивают при комнатной температуре 5 часов. Реакционную смесь концентрируют досуха в вакууме и обрабатывают этилацетатом, затем льдом и водой. Органическую фазу отделяют, промывают водой, насыщенным раствором бикарбоната натрия и соляным раствором, сушат над сульфатом натрия и концентрируют в вакууме, получают 4,0 г 4,4′-дитиобисбензолсульфохлорида в виде твердого вещества желтовато-коричневого цвета. В. 4,4′-Дитио-бис-[(R)-1-бензолсульфонил-2,3-дигидро-1Н-индол-2-карбоновая кислота] К раствору гидрохлорида (R)-2,3-дигидро-1Н-индол-2-карбоновой кислоты (4,35 г, 21,7 ммоля), 1 н. водной гидроокиси натрия (43,5 мл, 43,5 ммоля) и воды (20 мл) при 0°С прибавляют по каплям раствор полученного на стадии Б 4,4′-дитиобисбензолсульфохлорида (3,0 г, 7,24 ммоля) в диоксане (60 мл). По окончании прибавления контролируют рН реакционной смеси и поддерживают его между 7 и 8 путем медленного прибавления 1 н. водной гидроокиси натрия в течение следующих двух часов. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь фильтруют, фильтрат выливают в измельченный лед и полученную в результате смесь подкисляют до рН 2-3 с помощью 1 н. водной соляной кислоты. Смесь экстрагируют этилацетатом, органическую фазу промывают 1 н. водной соляной кислотой, водой, соляным раствором и сушат над сульфатом натрия, концентрируют в вакууме, получают 4,0 г 4,4′-дитио-бис-(1-бензолсульфонил-2,3-дигидро-1Н-индол-2-карбоновой кислоты) в виде твердого пенообразного вещества; [М-1]–=667,25. Г. (R)-1-(4-Меркаптобензолсульфонил)-2,3-дигидро-1Н-индол-2-карбоновая кислота К раствору борогидрида натрия (0,185 г, 4,86 ммоля) в этаноле (60 мл) при 0°С прибавляют порциями полученную на стадии В 4,4′-дитио-бис-(1-бензолсульфонил-2,3-дигидро-1Н-индол-2-карбоновую кислоту) (0,65 г, 0,973 ммоля). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Смесь обрабатывают льдом/водой, подкисляют 2 н. водной соляной кислотой и экстрагируют этилацетатом. Объединенные органические экстракты промывают водой и соляным раствором, сушат над сульфатом натрия и концентрируют в вакууме, получают 0,63 г (R)-1-(4-меркаптобензолсульфонил)-2,3-дигидро-1Н-индол-2-карбоновой кислоты в виде смолообразного вещества; [М-1]–=333,9. Д. (R)-1-[4-(5-Метил-2-фенилоксазол-4-илметилсульфанил)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновая кислота К раствору полученной на стадии Г (R)-1-(4-меркаптобензолсульфонил)-2,3-дигидро-1Н-индол-2-карбоновой кислоты (0,56 г, 1,67 ммоля) в диоксане (8 мл) прибавляют при комнатной температуре 1 н. водную гидроокись натрия (3,4 мл) и воду (2 мл). Полученный в результате раствор обрабатывают по каплям раствором 4-хлорметил-5-метил-2-фенилоксазола (0,423 г, 2,04 ммоля) в диоксане (4 мл). После перемешивания в течение 1,5 часов реакционную смесь концентрируют почти досуха в вакууме. Остаток обрабатывают водой, водную фазу промывают диэтиловым эфиром, подкисляют 2 н. водной соляной кислотой и экстрагируют этилацетатом. Объединенные органические фазы промывают водой, соляным раствором и сушат над сульфатом натрия. Органическую фазу концентрируют в вакууме и сушат в течение ночи в высоком вакууме, получают 0,68 г (R)-1-[4-(5-метил-2-фенилоксазол-4-илметилсульфанил)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновой кислоты в виде смолообразного вещества; [М-1]–=504,9. Пример 4 Следующие соединения получают аналогично примеру 1 при обработке полученного на стадии В примера 1 соединения подходящим алкилирующим агентом или следуя протоколу, описанному в примерах 2 или 3: Пример 7 4-Хлорметил-5-метил-2-[4-(трифторметил)фенил]оксазол
А. Хлористоводородная соль 3-окиси 4,5-диметил-2-[4-(трифторметил)фенил]оксазола В раствор 4-(трифторметил)бензальдегида (400,0 г, 2,3 ммоля) и монооксима 2,3-бутандиона (212 г, 2,055 моля) в 800 мл ледяной уксусной кислоты при 2-5°С пропускают путем медленного барботирования в течение 1,5 часов HCl-газ (250 г). Смесь перемешивают при этой же температуре еще 1 час. Прибавляют 3,75 л простого (трет-бутил)метилового эфира, поддерживая температуру между 5-25°С (при прибавлении первых 400 мл выделяется тепло). Полученную в результате суспензию перемешивают 30 минут, затем охлаждают до 10°С и твердый осадок отфильтровывают. Осадок на фильтре промывают 500 мл простого (трет-бутил)метилового эфира и сушат при 55-60°С (20 мбар) в течение 18 часов, получают 550 г (91%) хлористоводородной соли 3-окиси 4,5-диметил-2-[4-(трифторметил)фенил]оксазола; tпл 182-184°С (разл.). Б. 4-Хлорметил-5-метил-2-[4-(трифторметил)фенил]оксазол Суспензию полученного на стадии А гидрохлорида 3-окиси 4,5-диметил-2-[4-(трифторметил)фенил]оксазола (500 г, 1,70 моля) в 4,06 л ацетонитрила перемешивают 15 минут при комнатной температуре, затем охлаждают до 10°С. Прибавляют 491 г (3,17 моля) хлорокиси фосфора при 15°С в течение 30 минут. Суспензию перемешивают при комнатной температуре 16 часов, смесь охлаждают до 10°С и медленно прибавляют в реакционную смесь 6 л воды (прибавление первых 400 мл воды сопровождается очень сильным выделением тепла). Суспензию затем перемешивают при комнатной температуре еще 6 часов и твердое вещество собирают путем фильтрации, промывают 2 л воды и сушат до постоянной массы при 50°С (20 мбар), получают 4-хлорметил-5-метил-2-[4-(трифторметил)фенил]оксазол в виде твердого вещества белого цвета (400 г, выход 85%); tпл 97-98°C.
Формула изобретения
1. Соединение формулы
где L означает радикал n означает ноль или 1; или L означает радикал m является 1; R означает водород, галоген, С1-С4алкил или С1-С4алкоксигруппу; Z означает связь, -C(О)NH-, О или S; р означает целое число от 1 до 5; Q означает связь при условии, что Z не является связью, когда р равно 1; или Q означает О, S или -C(О)NR6-, где R6 означает водород, С1-4алкил или С3–6циклоалкил; или W и R6 вместе с атомом азота, к которому они присоединены, образуют
или Q означает -NR6-, при условии, что р не является 1; W означает
или его фармацевтически приемлемая соль, или его оптический изомер, или смесь его оптических изомеров. 2. Соединение по п.1, где L означает радикал R означает водород, галоген, С1-С4алкил или С1-С4-алкоксигруппу; Z означает связь, О или S; р означает целое число от 1 до 4; Q означает связь при условии, что Z не является связью, когда р означает 1; или Q означает О или S; или его фармацевтически приемлемая соль, или его оптический изомер, или смесь его оптических изомеров. 3. Соединение по п.1, где L означает радикал R означает водород, галоген, С1-С4алкил или С1-С4алкоксигруппу; Z означает связь, О или S; р означает целое число от 1 до 4; Q означает связь при условии, что Z не является связью, когда р означает 1; или Q означает О или S; или его фармацевтически приемлемая соль, или его оптический изомер, или смесь его оптических изомеров. 4. Соединение по п.1, где асимметрический центр в радикале L имеет (R)-конфигурацию; или его фармацевтически приемлемая соль. 5. Соединение по п.1, где R означает водород, хлор, н-пропил или метоксигруппу; или его фармацевтически приемлемая соль, или его оптический изомер, или смесь его оптических изомеров. 6. Соединение по п.1, которое выбирается из группы, состоящей из: (R)-1-{4-[4-(4-Фенокси-2-пропилфенокси)бутокси]бензолсульфонил}азетидин-2-карбоновой кислоты; (R)-1-{4-[3-(4-Фенокси-2-пропилфенокси)пропокси]бензолсульфонил}азетидин-2-карбоновой кислоты; (R)-1-[4-(5-Метил-2-фенилоксазол-4-илметокси)бензолсульфонил]азетидин-2-карбоновой кислоты; (R)-1-{4-[2-(4-Фторфенил)-5-метилоксазол-4-илметокси]бензолсульфонил}-азетидин-2-карбоновой кислоты; (R)-1-{4-[5-Метил-2-(4-(трифторметил-фенил)оксазол-4-илметокси]бензолсульфонил}азетидин-2-карбоновой кислоты; (R)-1-{4-[2-(3,5-Бистрифторметил-фенил)-5-метилоксазол-4-илметокси]бензолсульфонил}азетидин-2-карбоновой кислоты; (R)-1-{4-[2-(5-Метил-2-фенилоксазол-4-ил)этокси]бензолсульфонил} азетидин-2-карбоновой кислоты; (R)-1-{4-[4-(4-Фенокси-2-пропилфенокси)бутокси]бензолсульфонил} -пирролидин-2-карбоновой кислоты; (R)-1-{4-[3-(4-Фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-пирролидин-2-карбоновой кислоты; (R)-1-(4-{3-[2-Пропил-4-(4-(трифторметил)фенокси)фенокси]пропокси}-бензолсульфонил)пирролидин-2-карбоновой кислоты; (R)-1-{4-[2-(4-Метокси-2-пропилфенокси)этокси]бензолсульфонил}пирролидин-2-карбоновой кислоты; (R)-1-(4-{2-[2-Пропил-4-(4-(трифторметил)фенокси)фенокси]этокси}бензолсульфонил)пирролидин-2-карбоновой кислоты; (R)-1-{3-Метокси-4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}пирролидин-2-карбоновой кислоты; (R)-1-{3-Хлор-4-[3-(4-фенокси-2-пропил фенокси)пропокси]бензолсульфонил}-пирролидин-2-карбоновой кислоты; (R)-1-{4-[3-(4-Фенокси-2-пропилфенокси)пропокси]-3-пропилбензол-сульфонил}пирролидин-2-карбоновой кислоты; (R)-1-{4-[3-(4-Фенокси-2-пропилфенокси)пропилсульфанил]бензолсульфонил}-пирролидин-2-карбоновой кислоты; (R)-1-{4-[2-(4-Фенокси-2-пропилфенокси)этилсульфанил]бензолсульфонил}-пирролидин-2-карбоновой кислоты; (R)-1-{4-[3-(4-Фенокси-2-пропилфенокси)пропил]бензолсульфонил}-пирролидин-2-карбоновой кислоты; (R)-1-[4-(5-Метил-2-фенилоксазол-4-илметокси)бензолсульфонил]пирролидин-2-карбоновой кислоты; (R)-1-{4-[2-(4-Фторфенил)-5-метилоксазол-4-илметокси]бензолсульфонил}-пирролидин-2-карбоновой кислоты; (R)-1-{4-[5-Метил-2-(4-(трифторметил-фенил)оксазол-4-илметокси]бензолсульфонил}пирролидин-2-карбоновой кислоты; (R)-1-{4-[2-(3,5-Бистрифторметил-фенил)-5-метилоксазол-4-илметокси]-бензолсульфонил}пирролидин-2-карбоновой кислоты; (R)-1-[4-(2-Бифенил-4-ил-5-метилоксазол-4-илметокси)бензолсульфонил]-пирролидин-2-карбоновой кислоты; (R)-1-[3-Метокси-4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонил]-пирролидин-2-карбоновой кислоты; (R)-1-[3-Хлор-4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонил]-пирролидин-2-карбоновой кислоты; (R)-1-[4-(5-Метил-2-фенилоксазол-4-илметокси)-3-пропилбензолсульфонил]-пирролидин-2-карбоновой кислоты; (R)-1-[4-(5-Метил-2-фенилоксазол-4-илметилсульфанил)бензолсульфонил]-пирролидин-2-карбоновой кислоты; (R)-1-{4-[2-(4-Фторфенил)-5-метилоксазол-4-илметилсульфанил]бензолсульфонил}пирролидин-2-карбоновой кислоты; (R)-1-{4-[5-Метил-2-(4-(трифторметил-фенил)оксазол-4-илметилсульфанил]-бензолсульфонил}пирролидин-2-карбоновой кислоты; (R)-1-{4-[2-(3,5-Бистрифторметил-фенил)-5-метилоксазол-4-илметил-сульфанил]бензолсульфонил}пирролидин-2-карбоновой кислоты; (R)-1-{4-[2-(5-Метил-2-фенилоксазол-4-ил)этокси]бензолсульфонил}-пирролидин-2-карбоновой кислоты; (R)-1-{3-Метокси-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]бензолсульфонил}-пирролидин-2-карбоновой кислоты; (R)-1-{3-Хлор-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]бензолсульфонил}-пирролидин-2-карбоновой кислоты; (R)-1-(4-{2-[5-Метил-2-(4-(трифторметил-фенил)оксазол-4-ил]этокси}бензолсульфонил)пирролидин-2-карбоновой кислоты; (R)-1-{4-[2-(5-Метил-2-фенилоксазол-4-ил)этилсульфанил]бензолсульфонил}-пирролидин-2-карбоновой кислоты; (R)-1-{4-[4-(4-Фенокси-2-пропилфенокси)бутокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-{4-[3-(4-Фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-{4-[2-(4-Фенокси-2-пропилфенокси)этокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-{3-Метокси-4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензол-сульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-{3-Хлор-4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-[4-(5-Метил-2-фенилоксазол-4-илметокси)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-{4-[2-(4-Фторфенил)-5-метилоксазол-4-илметокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-{4-[5-Метил-2-(4-(трифторметил-фенил)оксазол-4-илметокси]бензолсульфонил}-2,3-Дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-{4-[2-(3,5-Бис(трифторметил-фенил)-5-метилоксазол-4-илметокси]бензолсульфонил}-2,3-Дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-[3-Метокси-4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-[3-Хлор-4-(5-метил-2-фенилоксазол-4-илметокси)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-[4-(5-Метил-2-фенилоксазол-4-илметокси)-3-пропилбензолсульфонил]-2,3-Дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-[4-(5-Метил-2-фенилоксазол-4-илметилсульфанил)бензолсульфонил]-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-{4-[2-(4-Фторфенил)-5-метилоксазол-4-илметилсульфанил]бензолусульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-{4-[5-Метил-2-(4-(трифторметил-фенил)оксазол-4-илметилсульфанил]-бензолсульфонил}-2,3-Дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-{4-[2-(3,5-Бистрифторметил-фенил)-5-метилоксазол-4-илметил-сульфанил]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-{4-[2-(5-Метил-2-фенилоксазол-4-ил)этокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-{3-Хлор-4-[2-(5-метил-2-фенилоксазол-4-ил)этокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты; (R)-1-{4-[5-Метил-2-(4-трифторметил-фенил)оксазол-4-илметилсульфанил]-бензолсульфонил}пирролидин-2-карбоновой кислоты; (R)-1-{4-[5-Метил-2-(4-трифторметил-фенил)оксазол-4-илметилсульфанил]-бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты; или его фармацевтически приемлемая соль, или его энантиомер, или смесь его энантиомеров. 7. Способ активации пероксисомных активированных пролиферацией рецепторов (PPAR), включающий введение млекопитающему в случае необходимости терапевтически эффективного количества соединения по п.1. 8. Применение соединения по п.1 для приготовления лекарственного средства для лечения состояний, опосредствованных рецепторами PPAR. 9. Применение по п.8, которое включает введение упомянутого соединения в комбинации с терапевтически эффективным количеством ингибитора DPPIV или ингибитора HMG-CoA-редуктазы. 10. Способ лечения состояний, опосредствованных рецепторами PPAR, выбранных из дислипидемии, гиперлипидемии, гиперхолестеринемии, атеросклероза, гипертриглицеридемии, сердечной недостаточности, инфаркта миокарда, сосудистых заболеваний, сердечно-сосудистых заболеваний, гипертензии, ожирения, синдрома-Х, воспаления, артрита, воспалительных заболеваний кишечника, язвенного колита и болезни Крона, диабета типа-1 и типа-2, который включает введение млекопитающему при необходимости терапевтически эффективного количества соединения по п.1. 11. Фармацевтическая композиция, обладающая агонистической активностью в отношении рецепторов PPAR, включающая терапевтически эффективное количество соединения по п.1 в комбинации с одним или несколькими фармацевтически приемлемыми носителями. 12. Фармацевтическая композиция по п.11 для лечения дислипидемии, гиперлипидемии, гиперхолестеринемии, атеросклероза, гипертриглицеридемии, сердечной недостаточности, инфаркта миокарда, сосудистых заболеваний, сердечно-сосудистых заболеваний, гипертензии, ожирения, синдрома-Х, воспаления, артрита, воспалительных заболеваний кишечника, язвенного колита и болезни Крона, сниженной толерантности к глюкозе, гипергликемии, резистентности к инсулину, диабета типа-1 и типа-2.
|
||||||||||||||||||||||||||

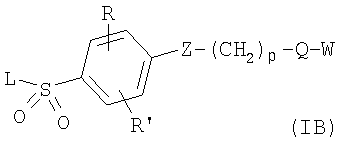
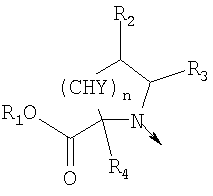
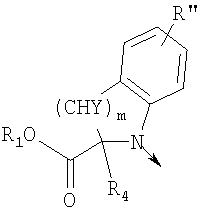
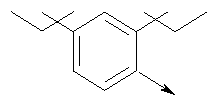 ,
, 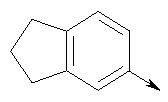 ,
, 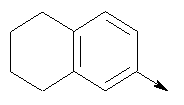 ,
, 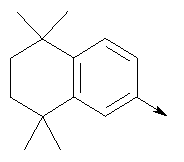 ,
, 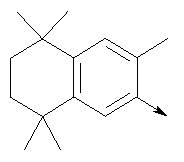 ,
,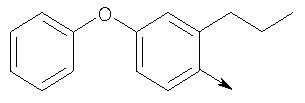 ,
, 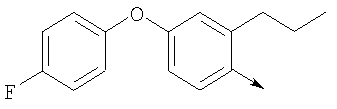 ,
, 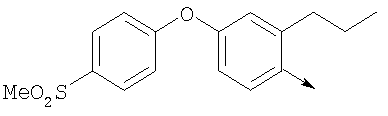 ,
, ,
,  ,
,  ,
, ,
, 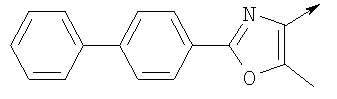 ,
, 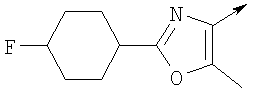 ,
, 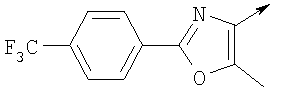 ,
,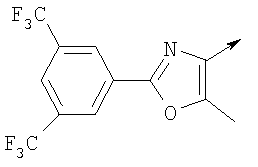 ,
, 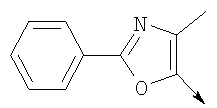 ,
, 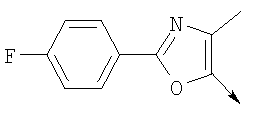 ,
, 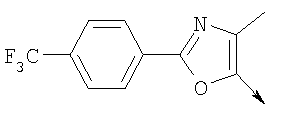 ,
,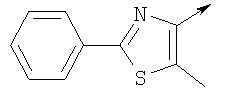 ,
, 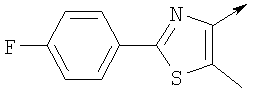 ,
, 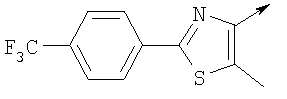 ,
, 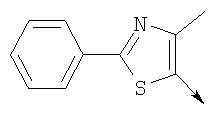 ,
,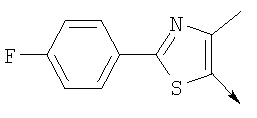 ,
, 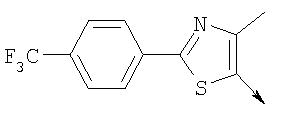 ,
, 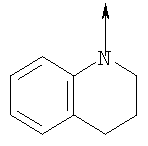 ,
, 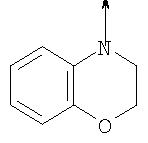 ,
, 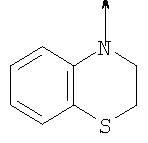 ,
,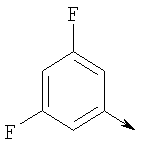 ,
, 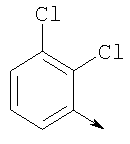 ,
, 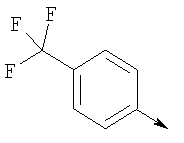 ,
, 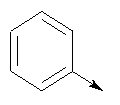 ,
,  и
и 
 , PPAR
, PPAR и PPAR
и PPAR .
.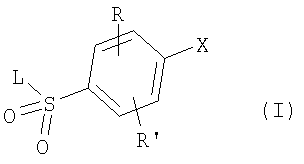
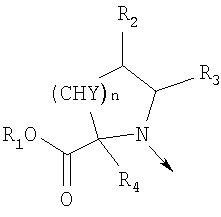
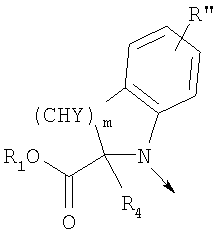
 -(амино-, моно- или ди-(низш.)алкиламино-, карбокси-, (низш.)алкоксикарбонил)-(низш.)алкиловые эфиры, сложные
-(амино-, моно- или ди-(низш.)алкиламино-, карбокси-, (низш.)алкоксикарбонил)-(низш.)алкиловые эфиры, сложные 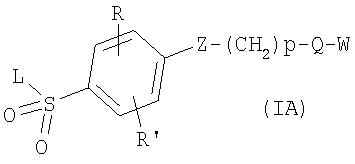
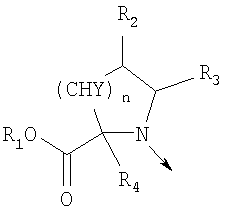
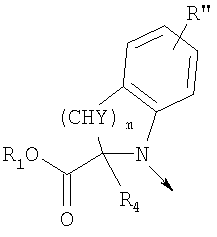
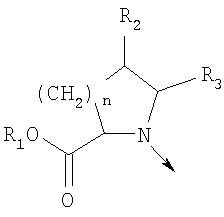
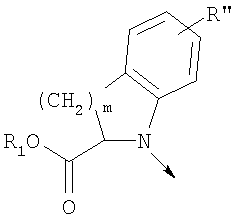
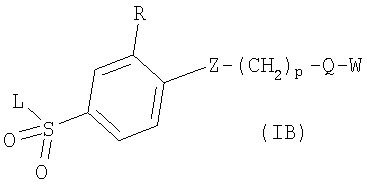
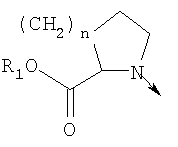
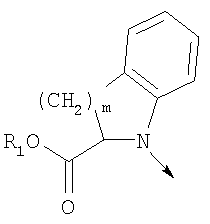
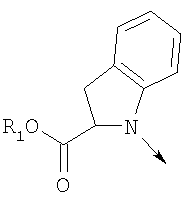
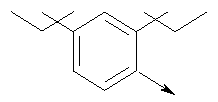 ,
, 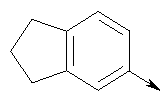 ,
, 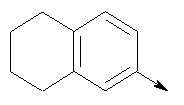 ,
, 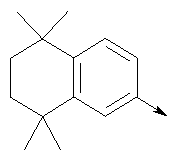 ,
, 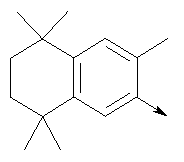 ,
,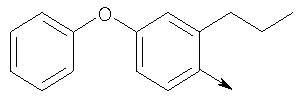 ,
, 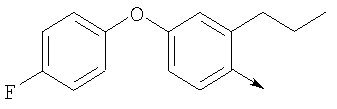 ,
, 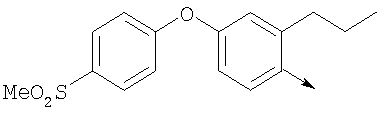 ,
,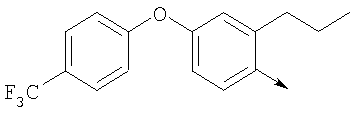 ,
, 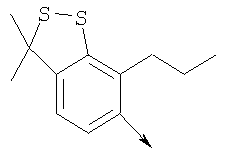 ,
,  ,
, 
 ,
,  и
и 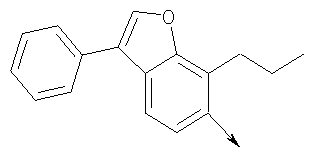 ,
,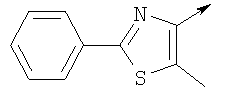 ,
, 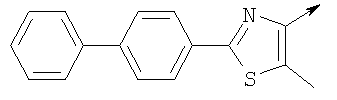 ,
, 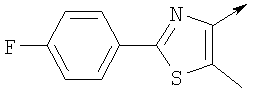 ,
, 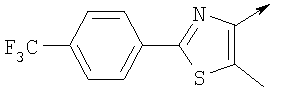 ,
,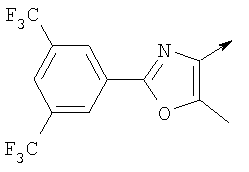 ,
, 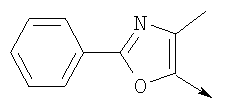 ,
, 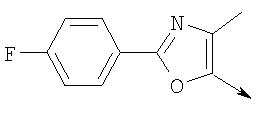 ,
, 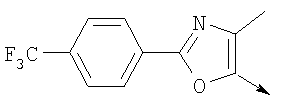 ,
,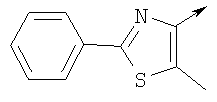 ,
, 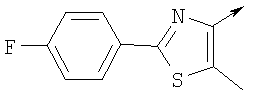 ,
, 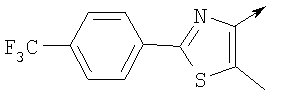 ,
, 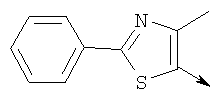 ,
,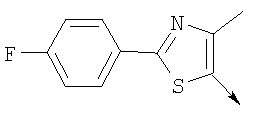 ,
, 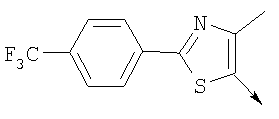 ,
, 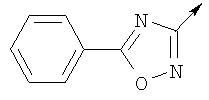 ,
, 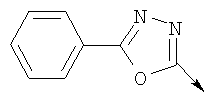 ,
,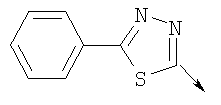 ,
, 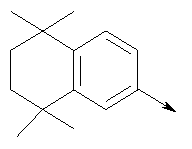 ,
,  ,
, 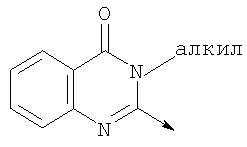 ,
, 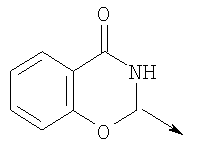 ,
,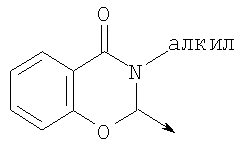 ,
, 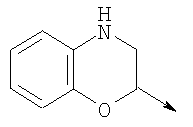 ,
, 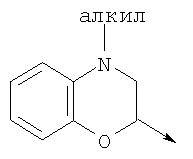 ,
, 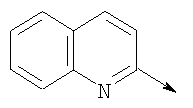 ,
, 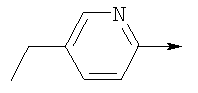 ,
,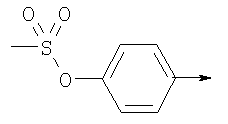 ,
, 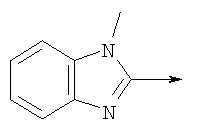 ,
, 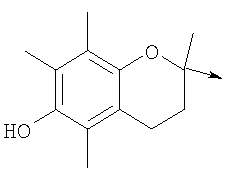 и
и 
 ,
, 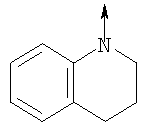 ,
, 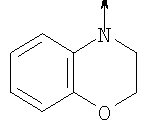 ,
, 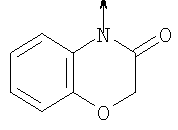 ,
, 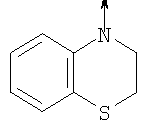 ,
, 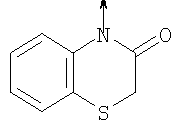 ,
,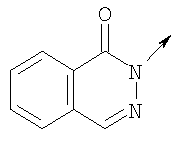 ,
, 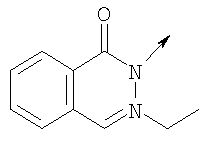 ,
, 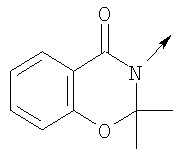 ,
, 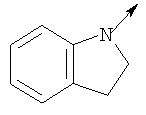 ,
, 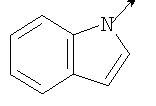 ,
, 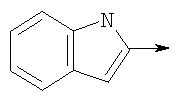 ,
,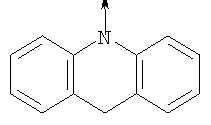 ,
,  ,
,  ,
,  ,
,  ,
,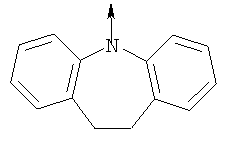 ,
, 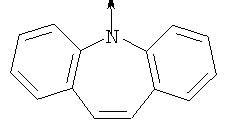 ,
, 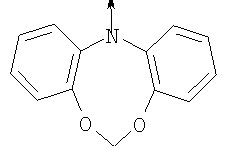 ,
, 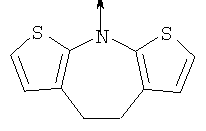 ,
, 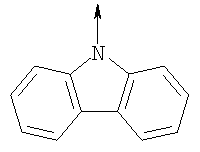 и
и 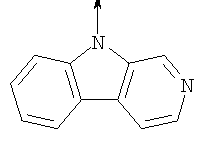 ,
,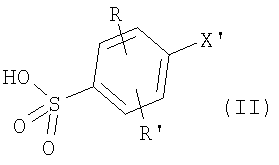
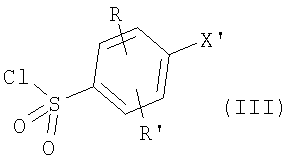
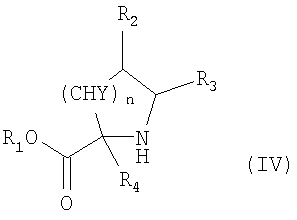 или
или 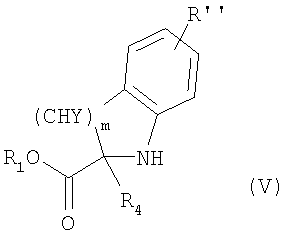
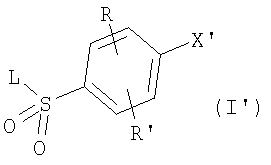
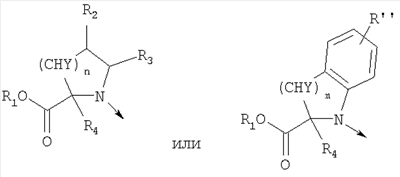
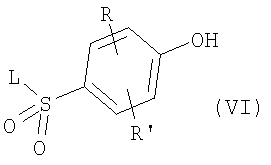
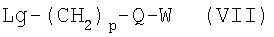 ,
,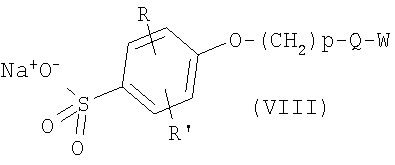
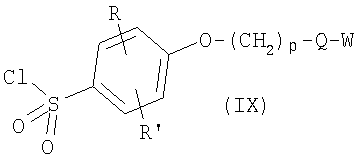
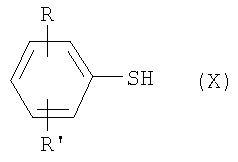
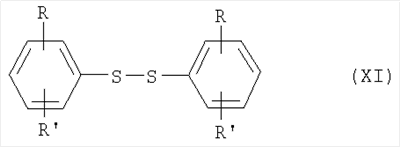
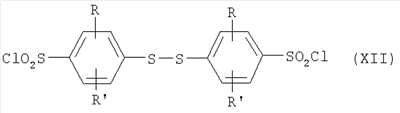
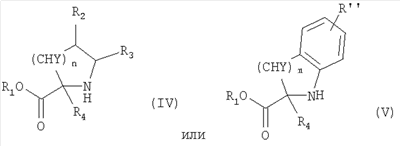
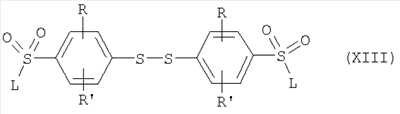
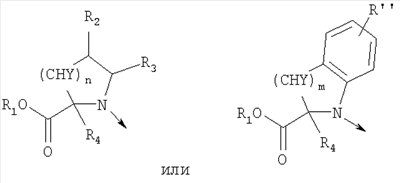
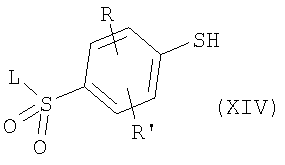
 , в которых X’ означает -S-(CH2)p-Q-W и р, Q и W имеют приведенные здесь значения.
, в которых X’ означает -S-(CH2)p-Q-W и р, Q и W имеют приведенные здесь значения. ,
, 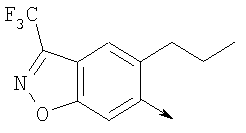 ,
, 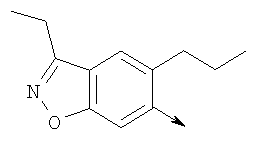
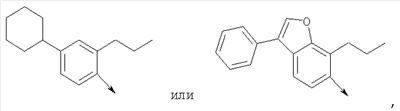
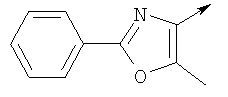 ,
, 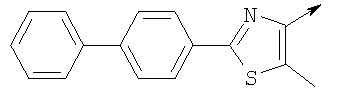 ,
, 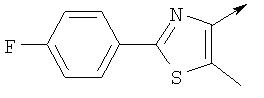 ,
, 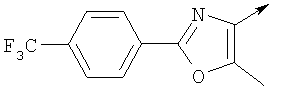 ,
,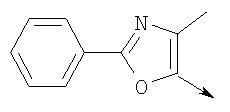 ,
, 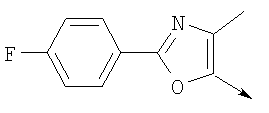 ,
, 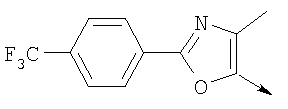 ,
,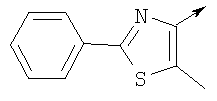 ,
, 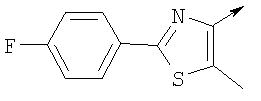 ,
, 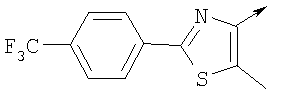 ,
, 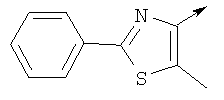 ,
,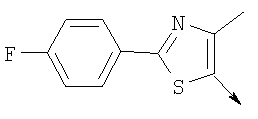 ,
, 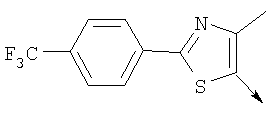 ,
, 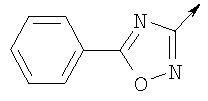 ,
, 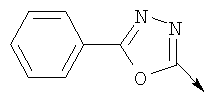 ,
,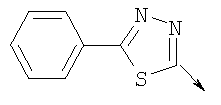 ,
, 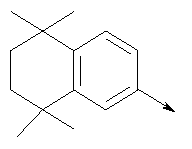 ,
, 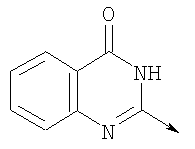 ,
, 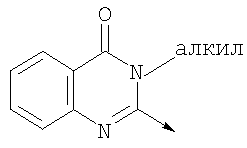 ,
, 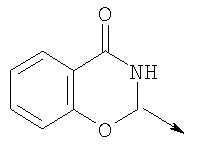 ,
,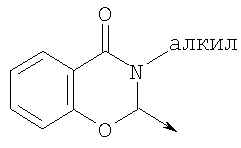 ,
, 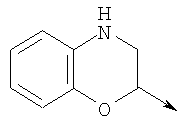 ,
, 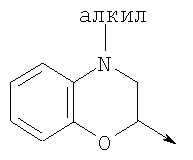 ,
,  ,
,  ,
,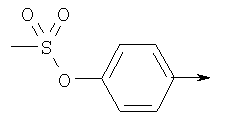 ,
,  ,
,  или
или  ,
, 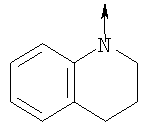 ,
, 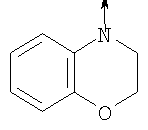 ,
, 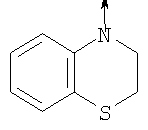 ,
, 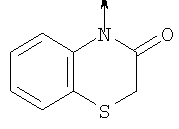 ,
,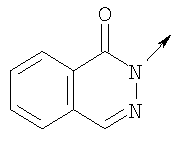 ,
, 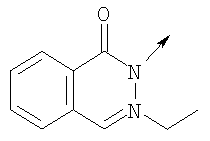 ,
, 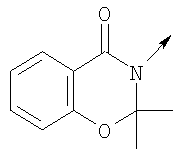 ,
,  ,
, 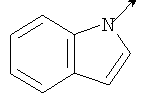 ,
, 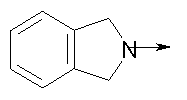 ,
, ,
,  ,
,  ,
,  ,
,  ,
, ,
, 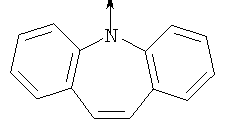 ,
, 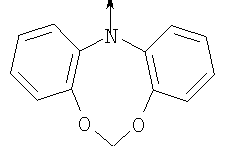 ,
, 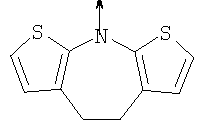 ,
, 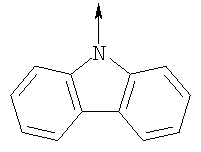 или
или 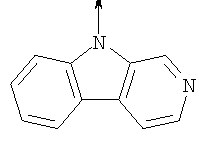 ;
;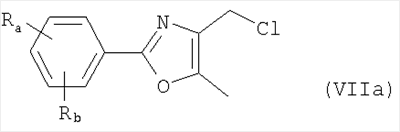
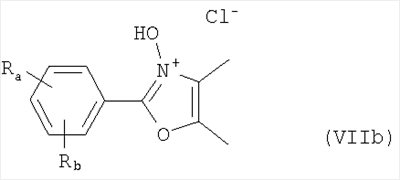
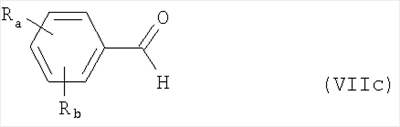

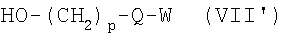 ,
,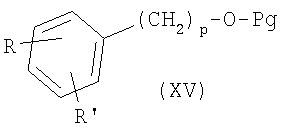
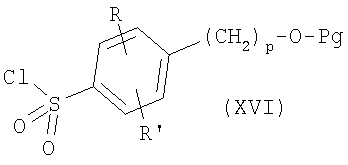
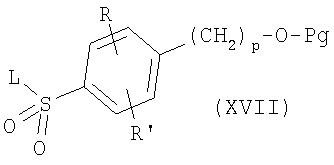
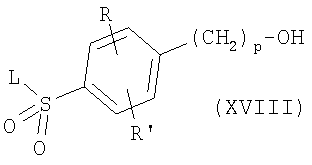
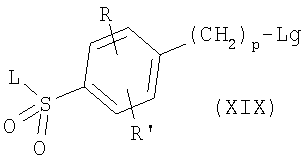
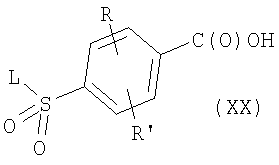
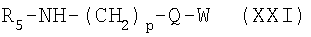 ,
,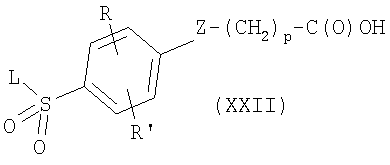
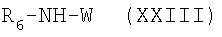 ,
,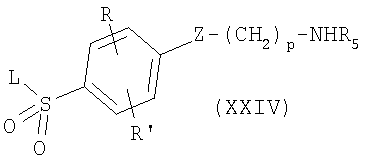
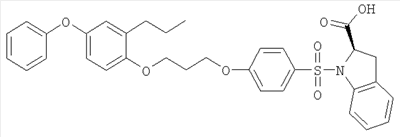
 50% этилацетат в гексане) приводит к 1,47 г очищенного метилового эфира (R)-1-{4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты в виде бесцветного смолистого вещества; [М+1]+=602,49.
50% этилацетат в гексане) приводит к 1,47 г очищенного метилового эфира (R)-1-{4-[3-(4-фенокси-2-пропилфенокси)пропокси]бензолсульфонил}-2,3-дигидро-1Н-индол-2-карбоновой кислоты в виде бесцветного смолистого вещества; [М+1]+=602,49.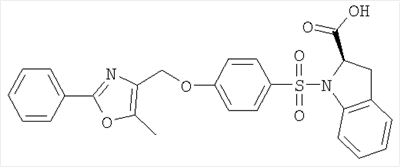
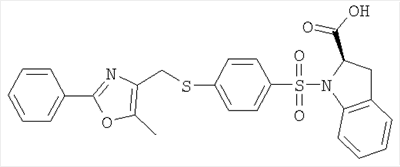
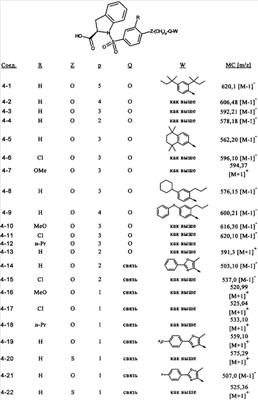
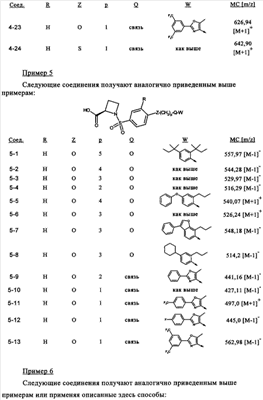
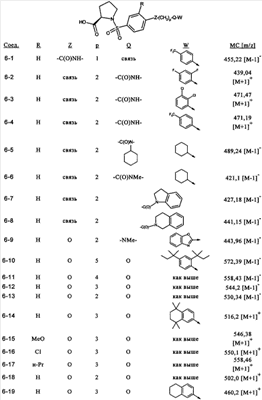
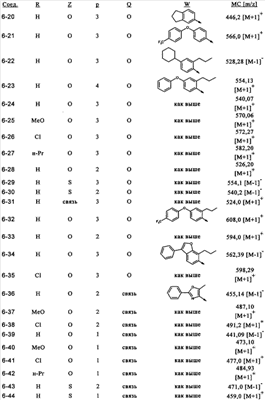
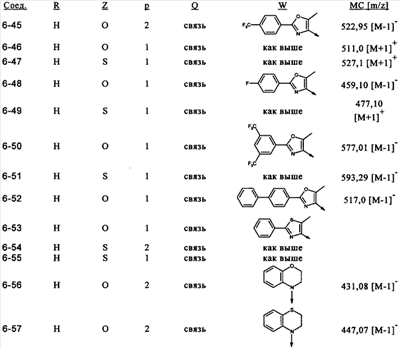
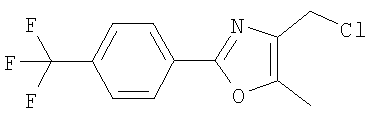
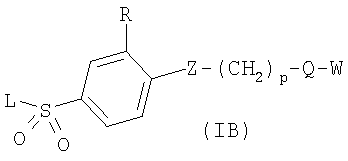 ,
,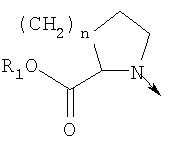 , в котором R1 означает водород или С1-4алкил;
, в котором R1 означает водород или С1-4алкил;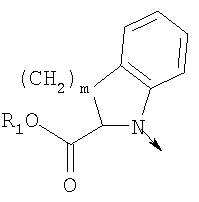 , в котором R1 означает водород или С1-4алкил;
, в котором R1 означает водород или С1-4алкил; или
или 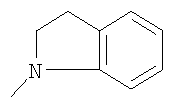
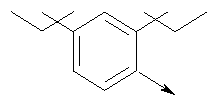 ,
, 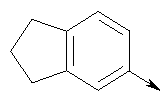 ,
, 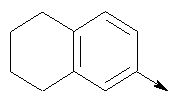 ,
,  ,
,  ,
, ,
,  ,
,  ,
, ,
,  ,
,  ,
,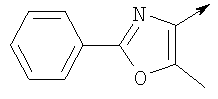 ,
, 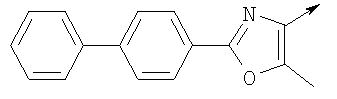 ,
, 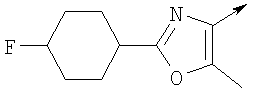 ,
, 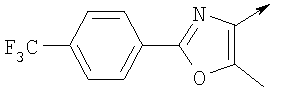 ,
,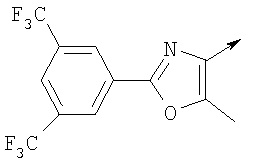 ,
, 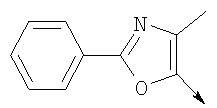 ,
, 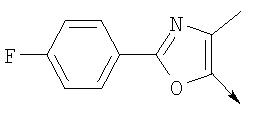 ,
, 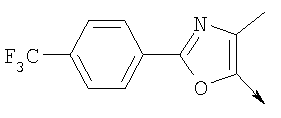 ,
,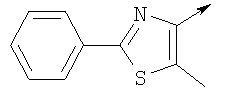 ,
, 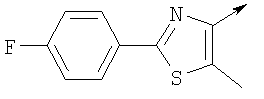 ,
, 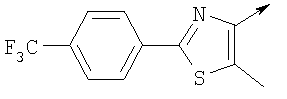 ,
, 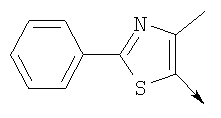 ,
,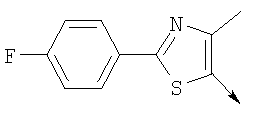 ,
, 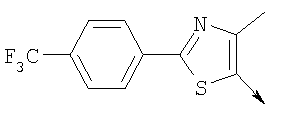 ,
, 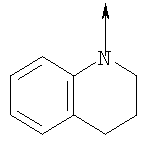 ,
, 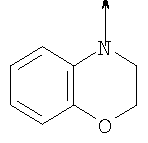 ,
, 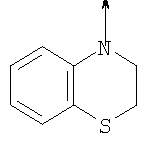 ,
, ,
,  ,
,  ,
, 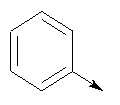 ,
, 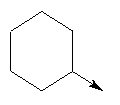 , и
, и 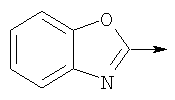
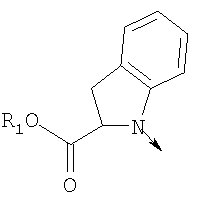 , в котором R1 означает водород;
, в котором R1 означает водород;