Патент на изобретение №2345950
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ КРЕМНИЯ ИЛИ СИЛИЦИДА ЦИНКА ИЗ ДИОКСИДА КРЕМНИЯ
(57) Реферат:
Изобретение может быть использовано в химической промышленности. Диоксид кремния восстанавливают цинком с получением кремния или силицида цинка, силикатов натрия и паров хлорида цинка. Реакция проводится в трехкомпонентном расплавленном шлаке, включающем хлорид натрия, диоксид кремния и цинк. Реакцию осуществляют при температуре выше температуры испарения образующегося хлорида цинка, но ниже температуры испарения цинка. Предложенное изобретение позволяет получить кремний без прямого контакта с углеродом. При этом процесс реализуется при температурах, значительно меньших температуры прямого восстановления диоксида кремния углеродом. 2 з.п. ф-лы, 4 табл.
Изобретение относится к области химии металлургических процессов. Кремний – один из наиболее распространенных в природе химических элементов после кислорода. Исключительно велика роль кремния в научно-техническом прогрессе. Поэтому проблема поиска новых способов получения кремния с целью повышения эффективности его производства и улучшения качества, актуальна. Одним из наиболее распространенных способов получения кремния является использование хлоридно-гидридной технологии с последующей вертикальной зонной плавкой по методу “плавающей зоны”. [Свойства элементов. Справочник под редакцией М.Е.Дрица. – М.: Металлургия, 1985 г., 409 с.] Данный способ является экологически опасным и технологически трудоемким. Исходные и конечные продукты сильно ядовиты. Наиболее близким к заявленному техническому решению является получение кремния из его диоксида. Кремний может быть восстановлен углеродом при температуре выше 1600°С. [Г.Г.Грибов, К.В.Зиновьев. Получение высокочистого кремния для солнечных элементов. Неорганические материалы. 2003 г., т.39, №7] [В.В.Стендер. Прикладная электрохимия. – Харьков: Изд. Харьковского университета, 1961 г.]. В результате получается кремний технической чистоты. В микроэлектронике требуется кремний высокочистый и в виде монокристаллов. Процесс может быть осуществлен в дуговых электропечах в относительно малых объемах. Техническая задача, решаемая изобретением, состоит в создании экологически безопасного и энергосберегающего способа получения достаточно чистого кремния и как промежуточного или самостоятельного продукта – силицида цинка. Для решения поставленной технической задачи получения кремния из диоксида кремния путем самопроизвольной реакции в среде расплавленного шлака, согласно предложению, расплавленный шлак представляет собой трехкомпонентную электролитическую среду, включающую хлорид натрия, диоксид кремния и цинк, а самопроизвольную реакцию осуществляют при температуре выше, чем температура испарения образующегося хлорида цинка, но ниже температуры испарения цинка с образованием кремния, силикатов натрия и паров хлорида цинка, при этом осуществляют дальнейшую реакцию в расплаве хлорида цинка с образовавшимся силикатом натрия и последующее восстановление цинка из образовавшегося силиката цинка с помощью углерода. Дополнительно осуществляют восстановление кремния из его диоксида с помощью углерода при температуре, не выше температуры испарения цинка. Экспериментально доказана возможность получения Si из SiO2 в расплаве соли NaCl (ж) с помощью Zn – восстановителя при температуре, выше температуры испарения ZnCl2 (733°C), по реакции: Для термодинамического расчета реакции (1) нами использовались известные термодинамические потенциалы веществ, участвующих в этой реакции [М.Х.Карапетьянц, М.Л.Карапетьянц. Основные термодинамические константы неорганических и органических веществ. – М.: Химия, 1968. 469 с.], и предполагаемые значения потенциалов пара ZnCl2(г) (исходя из аналогии ZnCl2(г) с MgCl2(г) (табл.1). Исходя из приведенных в табл.1 термодинамических потенциалов веществ получаем следующие величины термодинамических потенциалов реакции (I):
Отсюда следует, что минимальная температура реакции (1) в приближении температурной зависимости
Отсутствие термодинамического запрета на восстановление кремния из его диоксида с помощью цинкового восстановителя обусловлено образованием химически “прочного” силиката натрия с малой величиной ДС и парообразного ZnCl2(г) с большой величиной энтропии. В лабораторных опытах для нейтрализации пара ZnCl2(г) и его регистрации использовался порошок СаО (или СаСО3) в большом корундовом тигле, в котором размещалась емкость с исходной шихтой – смесью NaCl, SiO2 и Zn – гранул. Над ней располагался колпак для образования клапана на известковой засыпке. На практике в качестве поглотителя ZnCl2(г) можно использовать также расплав стекла: При термодинамическом расчете реакции (2) исходили из следующих величин термодинамических потенциалов веществ:
Отсюда, для термодинамических потенциалов реакции (2) получаем: Реакция (2) с участием парообразного ZnCl2(г) при температуре выше 733°С является термодинамически запрещенной из-за положительной величины
Реакция (2) с участием жидкого ZnCl2(ж) термодинамически разрешена, так как ее термодинамические потенциалы равны:
При Т<733°С расплав стекла не является жидкотекучим. Поэтому взвесь диспергированного стекла в расплаве соли NaCl(ж) может быть исходным поглотителем ZnCl2(ж). Так как в расплаве соли NaCl растворяются пары ZnCl2(г), то реакция (2) фактически может существовать и при Т>733°С как реакция расплавленного раствора ZnCl2 в NaCl(ж) с Na2SiO3. Образующийся при этом силикат цинка ZnSiO3 является одним из основных природных минералов, используемых в производстве цинка. Он может быть восстановлен по традиционной технологии: Приведем термодинамический расчет известной реакции (3) для подтверждения используемого приближения линейной температурной зависимости
Отсюда для термодинамических потенциалов реакции (3) получаем: Таким образом, рассчитанная температура оказалась близкой к реальной температуре, при которой осуществляется реакция (3) на практике. Известно, что для разделения Zn(г) и СО, образующихся в реакции (3), используется быстрое охлаждение паров Zn(г): Материальный баланс предлагаемого нами процесса получения кремния с участием реакций 1-4 формально совпадает с материальным балансом процесса прямого восстановления диоксида кремния углеродом в электропечах по известной реакции: Расход углерода по реакции (5) равен 0,860 кг на 1 кг кремния. Оценим энергетический баланс процесса получения Si из SiO2 по реакциям (1)-(4):
Отсюда удельный расход энергии -23·103 кДж/1 кг Si или 6,4·103 кВт·ч/1т Si. Для сравнения расход электроэнергии на 1т электролизного алюминия равен (16-17)·103 кВт·ч/1т Al, т.е. в 2,6 раза больше удельного расхода энергии в рассматриваемом процессе с участием реакций (1)-(4). Для реализации последнего нет необходимости в использовании электроэнергии. Расход тепловой энергии на получение кремния при учете 40% к.п.д. тепловых машин в 6 раз меньше расхода тепловой энергии, затрачиваемой ТЭЦ на выработку электроэнергии для производства такого же количества алюминия в существующем электролизном производстве. Для проверки справедливости используемого приближения линейной температурной зависимости
Из данных табл.4 получаем следующие значения термодинамических потенциалов химической реакции прямого восстановления диоксида кремния углеродом:
Заметим, что в соответствии с известным законом Гесса, получено близкое совпадение ЛИ для реакции прямого восстановления и АН процесса (1) – (4). Из
Таким образом, при температурах предлагаемого процесса реакция (5) является запрещенной. В производстве кремния она реализуется при Т Одним из основных преимуществ предложенного в настоящей работе процесса с участием реакций (1)-(4) – более низкие (на 500-600°С) температуры его реализации по сравнению с прямым восстановлением SiO2 углеродом в электропечах. Другое исключительно важное преимущество для получения чистого кремния преимущество – отсутствие прямого контакта с углеродом. Основные реакции проходят без его участия. Применение углерода связано только с получением Zn из ZnSiO3, являются сырьем. В нашем случае ZnSiO3 является промежуточным продуктом процесса, который может быть использован для получения израсходованного цинка. В связи с использованием цинка в качестве восстановителя диоксида кремния в расплаве NaCl важно рассмотреть вопрос о химическом взаимодействии кремния с цинком. По данным работы [Диаграммы состояния двойных металлических систем. Справочник в 3-х томах, Т.3, Кн.2, под редакцией академика РАН Н.П.Лякишева, – М.: Машиностроение, 2001. 448 с.] оно отсутствует. Однако при изучении реакции (1) нами был обнаружен ряд химических соединений цинка с кремнием – силицидов цинка ZnmSin.
Формула изобретения
1. Способ получения кремния или силицида цинка из диоксида кремния путем осуществления самопроизвольной реакции в среде расплавленного шлака, отличающийся тем, что расплавленный шлак представляет собой трехкомпонентную электролитную среду, включающую хлорид натрия, диоксид кремния и цинк, а самопроизвольную реакцию осуществляют при температуре выше, чем температура испарения образующегося хлорида цинка, но ниже температуры испарения цинка с образованием кремния, силикатов натрия и паров хлорида цинка. 2. Способ по п.1, отличающийся тем, что осуществляют дальнейшую реакцию в расплаве хлорида цинка с образовавшимся силикатом натрия и последующее восстановление цинка из образовавшегося силиката цинка с помощью углерода. 3. Способ по п.2, отличающийся тем, что дополнительно осуществляют восстановление кремния из его диоксида с помощью углерода при температуре не выше температуры испарения цинка.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

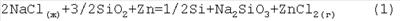
 G(20°C)
G(20°C) +170,53 кДж/моль;
+170,53 кДж/моль; 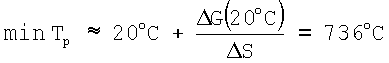
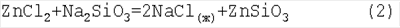
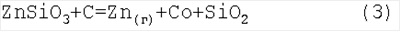


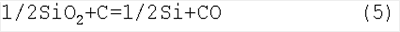
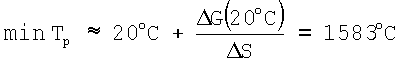
 1600°С.
1600°С.