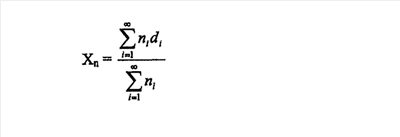Патент на изобретение №2344833
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) КОНТРАСТНОЕ СРЕДСТВО ДЛЯ УЛЬТРАЗВУКОВОЙ ВИЗУАЛИЗАЦИИ
(57) Реферат:
Изобретение относится к области ультразвуковой диагностики. Проведены клинические исследования и разработаны специфические препаративные формы с использованием полимерных микросфер, содержащих введенный в них перфторуглерод. Препаративные формы содержат микросферы, образованные биологически совместимым полимером, предпочтительно содержащие включенные в полимер липиды и содержащие перфторуглерод, который при температуре тела представляет собой газ. Микросферы вводят пациенту в количестве, эффективном для улучшения ультразвуковой визуализации в камерах желудочков в течение более чем 5 мин или в миокарде в течение более чем 1 мин, в дозе варьирующей от 0,025 до 8,0 мг микросфер/кг массы тела. Предпочтительно доза варьирует от 0,05 до 4,0 мг микросфер/кг массы тела. Препаративная форма обычно содержится в ампуле. Препарат в форме сухого порошка, который перед использованием восстанавливают стерильной водой, добавляя воду в ампулу или шприц с сухим порошком и встряхивая до получения изоосмотической или изотонической суспензии микросфер. Изобретение обеспечивает получение улучшенного изображения при ультразвуковой визуализации сердечно-сосудистой области в течение продолжительного времени. 6 н. 27 з.п. ф-лы, 5 табл.
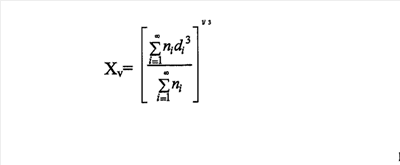
Предпосылки изобретения Настоящее изобретение относится к области средств для диагностической визуализации и особенно относится к специфическим средствам для ультразвуковой диагностики, обеспечивающим улучшенные изображения и продолжительные изображения. При использовании ультразвука с целью получения изображения внутренних органов и структур человека или животного ультразвуковые колебания, колебания звуковых волн по частоте выше тех, которые воспринимает человеческое ухо, отражаются, так как они проходят через тело. Различные типы тканей организма отражают ультразвуковые колебания по-разному, и отражения, которые вызываются ультразвуковыми колебаниями, отраженными от различных внутренних структур, выявляют и автоматически преобразуют в видимое изображение. При некоторых медицинских показаниях получение нужного изображения органа или представляющей интерес структуры особенно трудно, поскольку детали структуры не являются достаточно отличимыми от окружающей ткани на ультразвуковом изображении, полученном отражением ультразвуковых колебаний в отсутствие увеличивающего контраст вещества. Выявление и наблюдение некоторых физиологических и патологических состояний можно значительно усовершенствовать, повышая контраст ультразвукового изображения введением в орган или другую представляющую интерес структуру контрастного средства для ультразвука. В остальных случаях особенно важным является выявление движения ультразвукового контрастного вещества. Например, определенная модель кровотока, которая, как известно, является результатом только специфических сердечно-сосудистых нарушений, может быть более видимой при введении контрастного средства для ультразвука в кровоток и дальнейшем наблюдении за кровотоком или за объемом крови. Вещества, которые эффективны в качестве контрастных средств для ультразвука, действуют посредством влияния на ультразвуковые колебания по мере того, как они проходят через тело и отражаются, образуя изображение, по которому ставят медицинский диагноз. Различные типы веществ влияют на ультразвуковые колебания различным образом и в различной степени. Кроме того, некоторые из эффектов, вызываемые усиливающими контрастность средствами, более легко оценить и наблюдать, чем другие. Представленное вещество в подобранном идеальном составе контрастного средства для ультразвука, вероятно, обладает наиболее сильным действием на ультразвуковые колебания, так как проникает через тело. Также действие на ультразвуковое колебание должно быть легко измеримо. Газы являются предпочтительной средой для использования в качестве контрастного средства для ультразвука. Перед применением в виде сурфактант-стабилизированных пузырьков или посредством инкапсулирования в липосомах или микрочастицах газ нужно стабилизировать. Существуют три основных усиливающих контраст эффекта, которые можно наблюдать при ультразвуковом изображении: обратное рассеяние, ослабление пучка и разница скорости звука. Для инкапсуляции контрастных средств для ультразвуковой визуализации использовали различные природные и синтетические полимеры, такие как воздух, при нагнетании, чтобы получить контрастное средство для ультразвука, которое служит дольше после введения. В Schneider et al., Invest. Radiol., Vol. 27, pp. 134-139 (1992) описаны трехмикронные наполненные воздухом синтетические полимерные частицы. Как сообщали, эти частицы являются устойчивыми в плазме и под внешним давлением. Однако при 2,5 МГц их эхогенность была сниженной. Другой тип суспензии микропузырьков получали из альбумина, подвергнутого воздействию ультразвука. Feinstein et al., J. Am. Coll. Cardiol., Vol. 11, pp. 59-65 (1988). Feinstein описывает получение микропузырьков, с соответствующими для транспульмонального прохождения размерами при превосходной устойчивости in vitro. Однако эти микропузырьки являются короткоживущими in vivo, обладая временем полужизни порядка нескольких секунд (которое приближенно равно одному кругообороту) вследствие их неустойчивости под давлением. Gottlieb, S. et al., J. Am. Soc. Echo., Vol. 3, pp. 328 (1990), Abstract; и Shapiro, J. R. et al., J. Am. Coll. Cardiol. Vol. 16, pp. 1603-1607 (1990). Заключенные в желатин микропузырьки также были описаны Rasor Associates, Inc. в WO 80/02365. Они образованы в результате “слипания” желатина. Заключенные внутри оболочки из фторсодержащего материала газовые микропузырьки описаны Molecular Biosystems, Inc. в WO 96/04018. Кроме того, о микропузырьках, стабилизированных микрокристаллами галактозы (SHU 454 и SHU 508), сообщали Fritzch et al. Fritzsch, T. et al., Invest. Radiol. Vol. 23 (Suppl 1), pp. 302-305 (1988); и Fritzsch, T. et al., Invest. Radiol., Vol. 25 (Suppl 1), 160-161 (1990). Микропузырьки сохраняются вплоть до 15 мин in vitro, но менее чем 20 сек in vivo. Rovai, D. et al., J. Am. Coll. Cardiol., Vol. 10, pp. 125-134 (1987); и Smith, M. et al., J. Am. Coll. Cardiol., Vol. 13, pp. 1622-1628 (1989). В патенте EP 398935 Schering Aktiengesellschaft показали получение и использование микроинкапсулированного газа или летучих жидкостей для ультразвукового изображения, в которых микрокапсулы образованы синтетическими полимерами или полисахаридами. В европейском патенте 458745 Sintetica показали воздушные или газовые микрошарики, окруженные пограничной нанесенной полимерной мембраной, которые можно рассеивать в водном носителе для введения в животное-хозяина или для перорального, ректального или уретрального введения, для терапевтических или диагностических целей. В WO 92/18164 Delta Biotechnology Limited описано получение микрочастиц посредством сушки распылением водного белкового раствора до образования полых сферических оболочек, содержащих внутри газ, для использования в получении изображений. В WO 93/25242 описан синтез микрочастиц для ультразвуковой визуализации, состоящих из газа, который содержится внутри оболочки из полицианоакрилата или полиэфира. В WO 92/21382 показано производство микрочастиц контрастных средств, которые включают ковалентно связанную основу, содержащую газ, в котором основа представляет собой углевод. В патентах США 5334381, 5123414 и 5352435 Unger описаны липосомы для применения в качестве контрастных средств для ультразвука, которые включают газы, газовые предшественники, такие как активированные pH или светом газообразные предшественники, а также другие жидкие или твердые улучшающие контраст средства. Наблюдали действие заключенного в капсулу газа и предложили применение фторсодержащего газа для улучшения изображения по сравнению с воздухом. В патенте США 5393524 Quay показано применение средств, включающих перфторуглероды, для улучшения контраста при ультразвуковой визуализации. Состоящие из маленьких пузырьков или микропузырьков средства из подобранных газов, которые демонстрируют длительную жизнеспособность, заполняют раствор и являются довольно маленькими для проникновения через легкие, облегчая свое использование при ультразвуковой визуализации сердечно-сосудистой системы и других критических органов. В европейском патенте 554213 Bracco показано применение газов фторированных углеводородов для предотвращения коллапса микровезикул после оказания давления на сосудистое русло. В WO 95/23615 Nycomed показаны микрокапсулы для визуализации, которые образованы комплексами донорно-акцепторного типа из раствора, например, белкового раствора, содержащего перфторуглерод. В WO 95/03357 Massachusetts Institute of Technology показаны микрочастицы, образованные блок-сополимером полиэтиленгликоль – сополимеры лактида с гликолидом, содержащие инкапсулированные радиоактивные препараты, включащие газы, такие как воздух и перфторуглероды. Как описано в WO 94/16739 Sonus Pharmaceuticals, Inc., несмотря на то, что твердые и жидкие вещества отражают сигнал в одинаковой степени, известно, что газы являются более эффективными и предпочтительными средами для использования в качестве контрастных средств для ультразвука. Действительно, как показано в WO 94/16739 в примере 12, белковые микрокапсулы были отвергнуты как повышающий опасность фактор (а также вследствие проблем с эффективностью) при введении карликовым свиньям. В патентах США 6132699 и 5611344 описаны способы усиления контраста с использованием перфторуглерода в синтетических полимерных оболочках. В патенте США 5837221 описан способ получения проницаемой полимерной микрочастицы, содержащей гидрофобное вещество, объединенное в полимер для усиления эхогенности. Некоторые контрастные средства для ультразвука были утверждены в США или Европе для сильно ограниченных сердечных применений. OPTISON® (Amersham, Mallinkrodt) состоит из микрокапсул альбумина человека, денатурированного нагреванием, которые содержат газ октафторпропан. Каждый миллилитр суспензии микросфер содержит 5-8·108 микросфер со средним диаметром в интервале 2-4,5 микрон и 220 мкг октафторпропана. Эти микросферы не были утверждены для оценки коронарного кровотока, а утверждены исключительно для выделения контуров камеры желудочка. В высоких ударных дозах (5 мл суспензии или 1100 мкг октафторпропана) выделение контуров камеры желудочка продолжается вплоть до 5 мин. DEFINITY® (Bristol Myers Medical Imaging) состоит из октафторпропана, содержащего липидные микросферы, в которых липидная оболочка состоит из фосфолипидов DPPA, DPPC и mPEG-DPPE. Каждый мл суспензии содержит 1,2·1010 микрочастиц, имеющих средний диаметр в интервале 1,1-3,3 микрон и 1100 мкг октафторпропана. Средство апробировано исключительно для выделения контуров камеры желудочка, а не для оценки коронарного кровотока. В ударной дозе 700 мкл (на 70 кг веса человека) или 5133 мкг газа средство увеличивало время работы в камерах желудочка до приблизительно 3,4 мин. IMAGENT® (Photogen Inc.) состоит из липидных микросфер, содержащих перфторгексан, липидная оболочка которого состоит из фосфолипида DMPC. Каждый мл суспензии содержит 1,4·109 микрочастиц, имеющих средний диаметр меньше, чем 3 микрона, и 92 мкг перфторгексана. Средство апробировано исключительно для выделения контуров камеры желудочка, а не для оценки коронарного кровотока. В ударной дозе 0,43 мл (на 70 кг веса человека) или 40 мкг газа вещество имеет среднее увеличение времени работы в камерах желудочка приблизительно до 2,6 мин. Во всех случаях эти коммерческие средства имеют ограниченное применение и не утверждены для применения, кроме выделения контуров камеры желудочка и обеспечения средней продолжительности улучшения качества изображения в камерах желудочка, продолжающихся в течение 5 мин или меньше. Существует недостаток коммерческих контрастных средств для ультразвука, которые длительно обеспечивают усиленные изображения сердечно-сосудистой системы, особенно миокарда и камер желудочка. Описанные в известном уровне техники средства при введении в виде ударной дозы или короткой инфузии дают в результате изображения миокарда, которое продолжается в течение значительно меньшего времени, чем суммарно необходимое время для проведения полного исследования сердца. Обычно средства известного уровня техники обеспечивают изображения, которые длятся значительно меньше 1 мин для миокарда. Средство, которое может обеспечить продолжительности усиленного изображения, превосходящие 1 мин в миокарде и/или выше, чем 5 мин в камерах желудочка, предпочтительно. Поэтому цель изобретения состоит в создании препаративной формы, содержащей микрочастицы, которые позволяют получить усиленные изображения и долговременные изображения, в особенности для сердечных применений. Другая цель изобретения состоит в обеспечении набора для введения препаративной формы, содержащей микрочастицы для использования при способах ультразвуковой визуализации. Сущность изобретения Были проведены клинические исследования и были разработаны специфические дозированные препаративные формы с использованием полимерных микрочастиц, содержащих внутри газ перфторуглерод, которые обеспечивают долговременное значительное усиление изображения. Препаративная форма обычно включает одну, две или до пяти доз, наиболее предпочтительно – одна или две дозы микрочастиц, образованных биосовместимыми полимерами, предпочтительно включающих введенные внутрь липиды, и содержащих перфторуглерод, который при температуре тела представляет собой газ. Микрочастицы вводятся пациенту в дозе, эффективной для усиления ультразвуковой визуализации камер желудочка более чем на 5 мин и/или миокарда более чем на минуту, и в пределах дозы от 0,025 до 8,0 мг микрочастиц/кг веса тела. Предпочтительно вводимая доза для пациента варьировала от 0,05 до 4,0 мг микрочастиц/кг веса тела. В предпочтительном варианте осуществления ультразвуковое изображение усиливается в камерах желудочка в течение 9 мин и/или в миокарде в течение 2 мин. Препаративная форма обычно находится в ампуле или в шприце. Стандартная препаративная форма имеет форму сухого порошка, который перед использованием восстанавливают стерильной водой посредством добавления воды в ампулу или шприц с сухим порошком и встряхиванием до образования изоосмотической или изотонической суспензии микрочастиц. В предпочтительном варианте осуществления этой препаративной формы суспензия содержит 1,0-3,5·109 микрочастиц/мл суспензии или 25-50 мг микрочастиц/мл суспензии с наиболее предпочтительной концентрацией полученной суспензии, содержащей 1,5-2,8·109 микрочастиц/мл суспензии или 30-45 мг микрочастиц/мл суспензии. В предпочтительном варианте осуществления микрочастицы имеют средний размер частиц меньше, чем 8 микрон, наиболее предпочтителен средний размер частиц 1,8-3,0 микрон. В наиболее предпочтительном варианте осуществления газ представляет собой CF4, C2F4, C2F6, C3F6, C3F8, C4F8, C4F10, или SF6. В предпочтительном варианте осуществления газ представляет собой н-перфторбутан (C4F10), приготовленный в количестве 75-500 мкг/мл введенного объема суспензии микрочастиц; предпочтительно н-перфторбутан приготавливается в количестве 100-400 мкг/мл введенного объема суспензии микрочастиц и наиболее предпочтительно 150-350 мкг/мл введенного объема суспензии микрочастиц; или газ представляет собой н-октафторпропан, приготовленный в количестве 75-375 мкг/мл введенного объема суспензии микрочастиц, наиболее предпочтительно 120-300 мкг/мл введенного объема суспензии микрочастиц. В наиболее предпочтительном варианте осуществления микрочастица образована синтетическим полимером, таким как полиоксикислоты, который включает полимолочную кислоту, полигликолевую кислоту и сополимер молочной кислоты и гликолевой кислоты, полигликолиды, полилактиды и сополимер лактида с гликолидом, полиангидриды, полиортоэфиры, полиамиды, поликарбонаты, полиалкилены, такие как полиэтилен и полипропилен, полиалкиленгликоли, такие как полиэтиленгликоль, полиалкиленоксиды, такие как полиэтиленоксид поливиниловых спиртов, поливалериановая кислота, и сополимер лактида с капролактоном, производные вещества, сополимеры и их смеси и включают гидрофобное соединение, введенные в состав полимера в отношении от 0,01 до 30 мас.% гидрофобного соединения к массе полимера, наиболее предпочтительно введенный в состав полимера липид в отношении от 0,01 до 30% (масса липида/масса полимера). В особенно предпочтительном варианте осуществления липид представлен диолеоилфосфатидилхолином (DOPC), димиристоилфосфатидилхолином (DMPC), дипентадеканоилфосфатидилхолином (DPDPC), дилауроилфосфатидилхолином (DLPC), дипальмитоилфосфатидилхолином (DPPC), дистеароилфосфатидилхолином (DSPC), диарахидоилфосфатидилхолином (DAPC), дибехеноилфосфатидилхолином (DBPC), дитрикозаноилфосфатидилхолином (DTPC), дилигноцероилфатидилхолином (DLGPC); или фосфатидилэтаноламином. Наиболее предпочтительный синтетический полимер в микрочастицах представляет собой сополимер лактида с гликолидом с соотношением лактида к гликолиду 50:50 (т.е. 1:1) и средневесовая молекулярная масса в интервале 20000-40000 Дальтон, и гидрофобное соединение в микрочастицах является DAPC, в отношении от 5 до 6,6% (масса DAPC/масса полимера). Препаративная дозированная форма может находиться в виде сухого порошка в ампуле или в шприце, содержащего микрочастицы, или в комплекте, включающем в себя раствор для ресуспендирования микрочастиц. Обычно сухой порошок в ампуле или шприце содержит также носители, такие как сахар и соль, чтобы сделать раствор изоосмотическим или изотоническим после восстановления. Эта препаративная дозированная форма вводится пациенту, чтобы визуализироваться инъекцией, или как болюс или инъекция за период времени вплоть до 30 мин. Микрочастицы применяют в различных процедурах диагностической визуализации, включающих ультразвуковую визуализацию, магнитно-резонансную томографию, рентгеноскопическое исследование, рентгеновское исследование и компьютерную томографию. Микрочастицы были исследованы в клинических испытаниях для применения в кардиологии, таких как оценка коронарного кровотока и выделение контуров камер желудочка. Подробное описание изобретения Описаны усовершенствованные способы, микрочастицы, наборы и препаративные формы для ультразвуковой визуализации. Микрочастицы применяют в различных областях диагностической ультразвуковой визуализации, в особенности в ультразвуковых способах, таких как визуализация кровеносных сосудов и ультразвуковая кардиография, такая как оценка коронарного кровотока, оценка объема крови в миокарде и выделение контуров камер желудочка. I. Определения Как правило, в рамках настоящей заявки термин “микрочастица” включает в себя “микросферы” и “микрокапсулы”, а также другие микрочастицы, за исключением особо указанных случаев. Микрочастицы могут или не могут быть сферическими по форме. “Микрокапсулы” определены здесь как микрочастицы, имеющие внешнюю полимерную оболочку, окружающую ядро из газа. “Микросферы”, как определено здесь, могут представлять собой твердые полимерные сферы или пористые сферы с ячеистой структурой или губкоподобной структурой, образованной порами во всей толще полимера, которые заполнены газом. Некоторые микросферы могут содержать внешнюю полимерную оболочку с ячеистой структурой или губкоподобной структурой, образованной порами во всей толще оболочки полимера, и поры заполнены газом. Для этого типа микросфер эта внешняя полимерная оболочка окружает ядро из газа. Как правило, в рамках настоящей заявки термины “дозировка” и “доза” используется как синонимы для ссылки на количество вещества, которое дается одновременно, или количество вещества, которое необходимо, чтобы вызвать желательное диагностическое или контрастное действие. В рамках настоящей заявки термин “препаративная форма” относится к ампуле или другой стандартной таре, такой как шприц, содержащим одну или более дозы вещества, необходимых, чтобы вызвать желательное диагностическое или контрастное действие. Как правило, в рамках настоящей заявки “область пациента” относится к тому или иному участку или органу пациента. В ряде случаев “область пациента” относится целиком ко всему организму пациента. Примерами таких областей являются область легких, желудочно-кишечная область, сердечно-сосудистая область (включающая в себя миокардиальную ткань и миокард (т.е. сердечную мышцу), камеры желудочка, камеры предсердия, функцию клапана), почечная область, а также другие области тела, ткани, органы и т.п., включая сосудистую сеть и систему кровообращения, а также больную ткань, включая злокачественные ткани. Например, в “область пациента” включают участки для проведения диагностической визуализации. “Область пациента” является преимущественно внутренней, хотя она может быть и внешней. Как правило, в рамках настоящей заявки “сосудистая сеть” означает кровеносные сосуды (включающие в себя артерии, вены, капилляры и т.п.). Как правило, в рамках настоящей заявки “желудочно-кишечная область” включает в себя область, определенную пищеводом, желудком, тонким и толстым кишечником и прямой кишкой. Как правило, в рамках настоящей заявки “почечная область” относится к области, определенной почкой и сосудистой сетью, которая непосредственно приводит к и от почки, и включает в себя брюшную аорту. Как правило, в рамках настоящей заявки “область нацеливания” и “орган-мишень” применяют взаимозаменяемо для ссылки на участок в организме пациента, к которому желательна доставка средства. Как правило, в рамках настоящей заявки “область визуализации” и “визуализация области” применяется взаимозаменяемо для ссылки на область пациента, в которой желательна визуализация. Как правило, в рамках настоящей заявки “желудочковый кровоток или выделения контуров камеры желудочка” относятся к кровотоку через желудочки сердца в одном или более сердечных циклах. Как правило, в рамках настоящей заявки “предсердный кровоток” относится к кровотоку в предсердие сердца в одном или более сердечных циклах. Как правило, в рамках настоящей заявки “миокардиальный кровоток” относится к кровотоку в сосудистой сети сердечной мышцы или миокарда, включая кровеносные сосуды сердца в одном или более сердечных циклах. Как правило, в рамках настоящей заявки “объем крови миокарда” относится к объему крови в сосудистой сети сердечной мышцы или миокарда. Как правило, в рамках настоящей заявки “сердечный цикл” относится к осуществлению периода сокращения сердца и включает в себя и диастолический, и систолический периоды. Как правило, в рамках настоящей заявки “увеличенная яркость” относится к усилению яркости изображения по сравнению с изображением, полученным без контрастного средства для ультразвука. Как правило, в рамках настоящей заявки “улучшенное изображение” относится к изображению с повышенной яркостью в сравнении с изображением, получаемым в отсутствие контрастного средства для ультразвука. Как правило, в рамках настоящей заявки “продолжительность” относится к общему времени, в котором могло быть определено происходящее увеличение яркости изображения. Как правило, в рамках настоящей заявки “коронарный вазодилятатор” относится к биоактивному средству, такому как дипиридамол или аденозин, который при введении пациенту вызывает сужение сосудов в сердечно-сосудистой области. II. Микрочастицы. В предпочтительном варианте осуществления микрочастицы содержат полимер, липид и газ перфторуглерод. Микрочастицы могут состоять как из микросфер, так и микрокапсул, или только микросфер, или микрокапсул. Полимеры В предпочтительном варианте осуществления микрочастицы образуются из синтетических полимеров. Из синтетических полимеров производят микрочастицы, которые являются биологически совместимыми и не загрязняют биоматериалы. Кроме того, синтетические полимеры предпочтительны вследствие их более репродуктивного синтеза и деградации и in vitro, и in vivo. Полимер подбирают с учетом необходимого времени для устойчивости in vivo, т.е. это необходимое время для распределения в участке, в котором необходима визуализация, и необходимое время для визуализации. Синтетические полимеры могут быть изменены для производства микрочастиц с различными свойствами (например, изменение молекулярного веса и/или функциональных групп). Характерные синтетические полимеры представляют собой полигидроксикислоты, такие как полимолочная кислота, полигликолевая кислота и сополимер молочной кислоты и гликолевой кислоты, полигликолиды, полилактиды, сополимер лактида с гликолидом и их смеси, полиангидриды, полиортоэфиры, полиамиды, поликарбонаты, полиалкилены, такие как полиэтилен и полипропилен, полиалкиленгликоли, такие как полиэтиленгликоль, полиалкиленоксиды, такие как полиэтиленоксид поливиниловых спиртов, поливалериановая кислота, и сополимер лактида с капролактоном, производные вещества, сополимеры и их смеси. В рамках настоящей заявки в “производные” включают полимеры, содержащие замены, присоединения химических групп, например, алифатический радикал, алкилен, гидроксилирование, окисление и другие модификации, как принято делать у специалистов в данной области. Примеры предпочтительных биологически разлагаемых полимеров включают в себя полимеры из гидроксикислот, такие как молочная кислота и гликолевая кислота, полилактид, полигликолид, сополимер лактида с гликолидом, сополимеры с PEG, полиангидриды, полиортоэфиры, полиуретаны, полимасляная кислота, поливалериановая кислота, сополимер лактида с капролактоном, их смеси и сополимеры. Наиболее предпочтительный полимер представляет собой сополимер лактида с гликолидом с соотношением лактида к гликолиду 50:50 (т.е. 1:1) и полимер, обладающий средневесовой молекулярной массой в диапазоне 20000-40000 Дальтон. Средневесовая молекулярная масса (Mw) полимера представляет собой средний молекулярный вес, исходя из расчета массы молекул с данным молекулярно-массовым распределением отдельных полимерных цепей. Mw можно определять с помощью гель-проникающей хроматографии (GPC). Гидрофобные соединения В предпочтительном варианте осуществления полимер содержит гидрофобное соединение, как описано в патенте США № 5837221. Как правило, включение соединений, таких как липиды, которые гидрофобны и в эффективном количестве в полимерах, ограничивает проникновение и/или поглощение воды микрочастицами и поэтому ограничивает утечку газа из микрочастиц. Это эффективно при увеличении длительности работы улучшенного изображения, обеспеченного микрочастицами, которые содержат липид, синтетический полимер и инкапсулированный в них газ, в частности, фторсодержащие газы, такие как перфторуглерод. Липиды, которые могут быть использованы для обеспечения устойчивости газа внутри полимерных микрочастиц, включают в себя, но ими не ограничиваются, следующие классы липидов: жирные кислоты и производные, моно-, ди- и триглицериды, фосфолипиды, сфинголипиды, холестерин и стероидные производные, терпены и витамины. Жирные кислоты и их производные могут включать в себя, но ими не ограничиваться, насыщенные и ненасыщенные жирные кислоты, четное или нечетное количество жирных кислот, цис- и транс-изомеры, и производные жирных кислот, включающих спирты, сложные эфиры, ангидриды, жирные гидроксикислоты и простагландины. Насыщенные и ненасыщенные жирные кислоты, которые могут быть использованы, включают в себя, но ими не ограничиваются, молекулы, которые содержат от 12 углеродных атомов до 22 углеродных атомов как в неразветвленной, так и в разветвленной форме. Примеры насыщенных жирных кислот, которые могут быть использованы, включают в себя, но ими не ограничиваются, лауриновую, миристиновую, пальмитиновую и стеариновую кислоты. Примеры ненасыщенных жирных кислот, которые могут быть использованы, включают в себя, но ими не ограничиваются, лауриновую, физотерическую, миристолеиновую, пальмитолеиновую, петроселиновую и олеиновую кислоты. Примеры разветвленных жирных кислот, которые могут быть использованы, включают в себя, но ими не ограничиваются, изолауриновую, изомиристиновую, изопальмитиновую и изостеариновую кислоты и изопреноиды. Производные жирных кислот включают 12-(((7′-диэтиламинкумарин-3-ил)карбонил)метиламино)октадеканоиновую кислоту; N-[12-(((7′-диэтиламинокумарин-3-ил)карбонил)метиламино)октадеканоил]-2-аминопальмитиновую кислоту, N-сукцинилдиолеоилфосфатидилэтаноламин и пальмитоилгомоцистеин; и/или их комбинации. Моно-, ди- и триглицериды или их производные, которые могут быть использованы, включают в себя, но ими не ограничиваются, молекулы, которые содержат жирные кислоты или смеси жирных кислот, содержащих от 6 до 24 атомов углерода, дигалактозилдиглицерид, 1,2-диолеоил-sn-глицерол; 1,2-дипальмитоил-sn-3-сукцинилглицерол; и 1,3-дипальмитоил-2- сукцинилглицерол. Фосфолипиды, которые могут быть использованы, включают в себя, но ими не ограничиваются, фосфатидные кислоты, фосфатидилхолины как с насыщенными, так и с ненасыщенными липидами, фосфатидилэтаноламины, фосфатидилглицерины, фосфатидилсерины, фосфатидилинозиты, лизофосфатидилпроизводные, кардиолипин и Сфинголипиды, которые могут быть использованы, включают в себя церамиды, сфингомиелины, цереброзиды, ганглиозиды, сульфатиды и лизосульфатиды. Примеры сфинголипидов включают в себя, но ими не ограничиваются, ганглиозиды GM1 и GM2. Стероиды, которые могут быть использованы, включают в себя, но ими не ограничиваются, холестерин, холестеринсульфат, холестерингемисукцинат, 6-(5-холестерол-3в-илокси)гексил-6-амино-6-дезокси-1-тио-б-D-галактопиранозид, 6-(5-холестен-3в-илокси)гексил-6-амино-6-дезоксил-l-тио-б-D-маннопиранозид и холестерил)-4′-триметил-35-аммонио)бутаноат. Вспомогательные липидные соединения, которые можно использовать, включают в себя токоферол и производные и масла и производные масел, такие как стеариламин. Можно использовать различные катионогенные липиды, такие как DOTMA, N-[1-(2,3-диолеоилокси)пропил-N,N,N-триметиламмония хлорид; DOTAP, 1,2-диолеоилокси-3-(триметиламмоний)пропан; и DOTB, 1,2-диолеоил-3-(4′-триметиламмоний)бутаноил-sn-глицерин. Наиболее предпочтительные липиды представляют собой липиды и фосфолипиды, предпочтительно DPPC, DAPC, DSPC, DTPC, DBPC, DLPC и наиболее предпочтительно DPPC, DSPC, DAPC и DBPC. Содержание липидов варьирует от 0,01 до 30% (масса липида/масса полимера); предпочтительно от 0,1 до 20% (масса липида/масса полимера) и наиболее предпочтительно 1-12% (масса липида/масса полимера). При получении описанными способами размер микрочастиц постоянно воспроизводим. В рамках настоящей заявки термины “размер” или “диаметр” по отношению к частицам относятся к среднечисловому размеру частиц, за исключением особо указанных случаев. Ниже представлен пример формулы, которая может быть использована для определения количества средней величины частиц (Xn): где ni = число частиц данного диаметра (di). В рамках настоящей заявки термин “объем среднего диаметра” относится к средней величине объемного массового диаметра. Ниже представлен пример формулы, которая может быть использована для определения диаметра среднего объема (Xv): где ni = число частиц данного диаметра (di). Анализ размера частиц может быть выполнен на счетчике Коултера, световой микроскопией, сканирующей электронной микроскопией, трансмиссионной электронной микроскопией, способами лазерной дифракции, такими как способы, использующие Malvern Mastersizer, способами светорассеяния или способами отбора частиц по времени пролета. В рамках настоящей заявки “способ Коултера” относится к способу, в котором порошок диспергируется в электролите, и полученную суспензию анализировали с использованием Coulter Multisizer II, снабженным 50-мкм диаметром объектива трубы. В этом способе обеспечивают измерения размеров и концентраций частиц. В предпочтительном варианте осуществления для получения вводимых инъекцией, способных проникать через капиллярный слой легких микрочастиц, микрочастицы имеют диаметр меньше, чем 8 микрон. Микрочастицы большего размера могут забивать легочную выстилку, а более маленькие частицы могут не обеспечить достаточного контрастного действия. Предпочтительный размер микрочастицы для внутривенного введения ультразвукового контрастного средства представляет собой от 0,75 до 5 микрон, а наиболее предпочтительно – от 1,8 до 3,0 микрон. В предпочтительном варианте осуществления микрочастицы представляют собой ячеистую структуру или губкоподобную структуру, образованную порами по всему полимеру, или микрочастицы обладают полимерной оболочкой с ячеистой или губкоподобной, пористой структурой. В обоих случаях поры заполнены газом. Эти микрочастицы образуются сушкой с распылением полимерного раствора, содержащего образующее пустоты средство, такое как углекислый аммоний, как описано ниже. Контрастные средства для ультразвуковой визуализации Примеры фторсодержащих газов включают в себя CF4,C2F4, C2F6, C3F6, C3F8, C4F8, C4F10 и SF6. н-Перфторбутан (C4F10) особенно предпочтителен, так как он обеспечивает нерастворимость газа, который не будет растворяться при температуре использования, и является фармакологически приемлемым. Количество газа, содержащегося в микрочастицах, будет зависеть от вида газа, но обычно составляет 75-500 мкг/мл введенного объема суспензии микрочастиц. Для н-перфторбутана предпочтительное содержание газа составляет 100-400 мкг/мл введенного объема суспензии микрочастиц, а наиболее предпочтительно – составляет 150-350 мкг/мл введенного объема суспензии микрочастиц. Для н-октафторпропана предпочтительное содержание газа составляет 75-375 мкг/мл введенного объема суспензии микрочастиц, а наиболее предпочтительно – 120-300 мкг/мл введенного объема суспензии микрочастиц. III. Способы получения микрочастиц Микрочастицы можно получать различными способами, а предпочтительно получать сушкой с распылением. Основным способом оценки является то, что полимер должен быть растворен или расплавлен с гидрофобным соединением или липидом до образования микрочастицы. Растворители Во время образования полимер обычно растворяют в растворителе. В рамках настоящей заявки полимерный растворитель представляет собой органический растворитель, который легко испаряется или обладает сравнительно низкой точкой кипения, или может быть устранен под действием вакуума, и который приемлем для введения людям в микроколичествах, такой как дихлорметан. Также могут использоваться другие растворители, такие как этилацетат, этиловый эфир муравьиной кислоты, этанол, метанол, диметилформамид (DMF), ацетон, ацетонитрил, тетрагидрофуран (THF), формамид, уксусная кислота, диметилсульфоксид (ДМСО) и хлороформ, или их сочетания. Как правило, полимер растворяют в растворителе для образования полимерного раствора, имеющего концентрацию от 0,1 до 60% массы к объему (мас./об.), более предпочтительно от 0,25 до 30% (мас./об.) и наиболее предпочтительно 0,5-10% (мас./об.). Сушка с распылением Предпочтительно получать микрочастицы сушкой с распылением растворением биосовместимого полимера и липида в подходящем растворителе, диспергируя поры образующего средства как твердые или как раствор внутри раствора полимера, а затем сушка с распылением раствора полимера и поры образующего средства, для образования микрочастицы. В рамках настоящей заявки способ “сушка с распылением” раствора полимера и образующее поры средство относят к способу, в котором раствор полимера и образующее поры средство тончайше измельчают для образования мелкодисперсного тумана и высушивают непосредственным контактом с горячими газами-носителями. В предлагаемом в данной области техники применении распылительных сушек раствор и образующее поры средство могут быть тонко измельчены на входе в камеру распылительной сушилки, проходя как минимум через одну сушильную камеру, а затем собирают в виде порошка. Температура может изменяться в зависимости от используемых газа или полимера. Температуру на входе и выходе в камеру можно контролировать для получения целевых продуктов. Размер и морфология полученных во время сушки распылением микрочастиц зависит от распылителя, служащего для распыления раствора полимера и образующего поры средства, давления распылителя, объемной скорости раствора полимера с образующим поры средством, используемого полимера, концентрации полимера в растворе, вида полимерного растворителя, вида и количества образующего поры средства, температуры распыления (температура и на входе и на выходе) и молекулярной массы полимера. Обычно при более высокой молекулярной массе полимера, при большем размере частицы полученная концентрация полимерного раствора совпадает. Обычно технологические параметры для сушки с распылением состоят в следующем: температура на входе = 30-200°C, температура на выходе = 5-100°C и объемная скорость полимера = 10-5000 мл/мин. Газообразное диагностическое средство можно инкапсулировать преобразованным в эмульсию газом с раствором полимера и образующим поры средством до сушки с распылением. Альтернативно, заполненные воздухом микрочастицы можно получать во время этапа сушки с распылением, а впоследствии воздух заменяют на газ перфторуглерода, направив поток данного газа в микрочастицы, или вытягивающим воздействием вакуума на микрочастицы для удаления инкапсулированного воздуха, заполняя затем данным газом перфторуглерода. Лиофилизатор или вакуумную камеру можно использовать для замены газа на этапе использования вакуума. Добавки для упрощенного образования микрочастиц Различные поверхностно-активные вещества можно добавлять во время образования микрочастиц. Типичные эмульгирующие средства (эмульгаторы) или поверхностно-активные вещества, которые можно использовать (0,1-15% мас./мас. полимера) включают наиболее физиологически приемлемые эмульгирующие средства. В примеры включают природные и синтетические формы солей желчных кислот или желчных кислот, как связанных с аминокислотами, так и несвязанных, таких как тауродезоксихолат и холевая кислота. Образующие поры средства содержатся в растворе полимера в количестве от 0,01% до 90% вес./об. раствора полимера для увеличения порообразования. Например, при сушке с распылением образующее поры средство, такое как углекислый аммоний, например, бикарбонат аммония, уксуснокислый аммоний, карбонат аммония, хлорид аммония или бензоат аммония или другой углекислый аммоний в твердом виде или в растворе с растворителем, таким как вода, можно использовать. Твердое образующее поры средство или раствор, содержащий образующее поры средство, потом эмульгируется в растворе полимера для создания рассеяния или капель образующего поры средства в полимере. Это рассеивание или эмульгирование потом высушивают распылением для устранения как раствора полимера, так и порообразующего средства. Потом полимер осаждают, затвердевшие микрочастицы могут затвердеть и лиофилизироваться для удаления любых порообразующих средств, не удаленных во время этапа осаждения полимера. Выделенную микрочастицу создают, применяя полимер, сополимер лактида с гликолидом с соотношением лактида с гликолидом 50:50 и имеющим средневесовую молекулярную массу в интервале 20000-40000 Дальтон и фосфолипид, диарахидоилфосфатидилхолин ((1,2-диарахидоил-sn-глицеро-3-фосфохолин (DAPC)) в соотношении 5-6,6% (мас. DAPC/мас. полимера). Далее микрочастицы формируют в растворе маннита и TWEEN® 80 и подвергают обработке полученный сухой порошок из микрочастиц, которые заполняют на лиофилизаторе н-перфторбутана. Сухой порошок восстанавливают 5 мл стерильной воды до использования посредством добавления воды в ампулу с сухим порошком и встряхивания полученной суспензии микрочастиц в изоосмотическом манните. Свойства выделенных микрочастиц суспензии представляют собой содержание газа 150-350 мкг/мл н-перфторбутана на каждый введенный объем суспензии микрочастиц, 1,5-2,8·109 микрочастиц/мл введенного объема суспензии микрочастиц, 30-45 мг микрочастиц/мл введенного объема суспензии микрочастиц и средний размер частиц в интервале 1,8-3,0 микрон. IV. Применения микрочастиц 1. Препаративные формы для назначения пациенту Микрочастицы далее можно подвергать дополнительной обработке с наполнителями для получения сухого порошка. Наполнители обеспечивают концентрацию или осмотическую концентрацию или ослабление несущей способности микрочастиц после восстановления фармацевтически приемлемым носителем до введения пациенту. Пригодные для придания осмолярности или концентрации наполнители представляют собой сахара, которые включают в себя, но ими не ограничиваются, маннит, декстрозу или глюкозу, и соли, которые включают в себя, но ими не ограничиваются, хлористый натрий и фосфат натрия. Пригодные для придания ослабления несущей способности микросфер наполнители включают любой фармацевтически приемлемый увлажнитель или поверхностно-активное вещество, включая, но ими не ограничиваясь, полисорбат 80 (TWEEN® 80), полисорбат 20(TWEEN® 20), Pluronic или полиэтиленгликоль. Пригодные для придания осмолярности или тоничности наполнители или наполнители, которые могут использоваться в качестве увлажнителей, описаны в ссылках, таких как Handbook of Pharmaceutical Excipients (Fourth Edition, Royal Pharmaceutical Society of Great Britain, Science & Practice Publishers) or Remingtons: The Science and Practice of Pharmacy (Nineteenth Edition, Mack Publishing Company). Сухой порошок микрочастиц и наполнители образуются путем суспендирования микрочастиц в растворе наполнителей. При необходимости можно использовать стадии дальнейшего фракционирования по размеру. Микрочастицами в растворе наполнителей заполняют ампулы или шприцы, замораживают и лиофилизируют для получения препаративной формы в виде сухого порошка. В завершение стадии лиофилизации микрочастицы наполняют газом перфторуглеродом, заполняя лиофилизатор газом перфторуглеродом. Ампулы или шприцы потом закрывают или накрывают и, в случае ампул, спрессовывают. Это приводит к накоплению перфторуглерода в свободном пространстве ампулы или шприца. Альтернативно, микрочастицы могут представлять собой сухую смесь с фармацевтическими наполнителями, и затем ими заполняют ампулы или шприцы. Микрочастицы могут быть заполнены газом перфторуглеродом, с применением вакуума после заполнения ампул и шприцев в лиофилизаторе или вакуумной камере. Ампулы или шприцы затем закрывают или накрывают и, в случае ампул, спрессовывают. Это приводит к накоплению перфторуглерода в свободном пространстве ампулы или шприца. 2. Единицы дозы Можно использовать различные величины единиц дозы. Например, маленькие дозы могут содержать 25-75 мг микрочастиц. Средние дозы могут содержать 75-150 мг. Большие дозы могут содержать 150-250 мг микрочастиц. Очень большие дозы могут содержать 250-1000 мг микрочастиц. При образовании суспензии микрочастиц после восстановления массовая концентрация микросфер в суспензии обычно варьирует от 20 до 60 мг/мл. Предпочтительная массовая концентрация микросфер в суспензии составляет 25-50 мг/мл, а наиболее предпочтительная массовая концентрация микросфер в суспензии составляет от 30 до 45 мг/мл. Предпочтительная концентрация микрочастиц в суспензии составляет 1,0-3,5·109 микрочастиц/мл суспензии, а наиболее предпочтительная концентрация микрочастиц в суспензии составляет 1,5-2,8·109 микрочастиц/мл. Микрочастицы имеют предпочтительный средний размер частиц менее чем 8 микрон, наиболее предпочтительно в интервале 1,8-3,0 микрон. Фармацевтически приемлемые носители могут содержать воду для инъекций, стерильную воду, солевой раствор, солевой раствор с глицерином, солевой раствор с TWEEN® 20, солевой раствор с TWEEN® 80, изоосмотическую декстрозу (5%), изоосмотическую декстрозу (2,5%), изоосмотический маннит (5%), изоосмотический маннит (2,5%), изотонический маннит с TWEEN® 20 и изотонический маннит с TWEEN® 80. 3. Наборы Можно обеспечить наборы для парентерального введения микрочастиц, содержащих газ перфторуглерод. Набор содержит как минимум 2 компонента. Один компонент содержит единицу дозы сухого порошка контрастного средства в ампуле или шприце, а другой компонент содержит фармацевтически приемлемый носитель в ампуле или шприце. До введения пациенту фармацевтически приемлемый носитель добавляют к единице дозы сухого порошка контрастного средства для образования суспензии заполненных газом микрочастиц, которые используются в качестве контрастного средства для ультразвукового изображения при диагностической визуализации любым путем введения. 4. Ампулы или контейнеры для микрочастиц Для наборов не требуется какой-либо специфической ампулы или шприца или контактных систем; ампулы обычного типа, шприцы и наконечники можно использовать с микрочастицами. Поэтому качество герметизации стало вопросом особой важности; любое разрушение герметической целостности может сделать возможным проникновение нежелательных веществ в ампулу или сделать возможным улетучивание газа. В дополнение к обеспечению стерильности сохранение вакуумного пространства имеет важное значение для закрытой продукции при пониженном давлении для обеспечения безопасности и правильного восстановления. Что касается пробок, они могут быть соединением или многокомпонентным соединением на основе упругого полимера, такого как полиизобутилен или “бутилкаучук” и должны быть непроницаемыми для используемого газа. Размер ампулы подбирают в зависимости от суммарной дозы сухого порошка в ампуле. Предпочтительны объемы ампул 5 мл, 10 мл, 20 мл и 30 мл. Размер шприца подбирают в зависимости от суммарной дозы сухого порошка в шприце. Предпочтительные размеры шприца составляют 5 мл, 10 мл, 20 мл и 50 мл. 5. Диагностические применения Составы микрочастиц можно использовать во многих диагностических применениях, включающих ультразвуковое изображение, магнитно-резонансную томографию, флуороскопию, рентгеновское исследование и компьютерную томографию. В предпочтительном варианте осуществления микрочастицы использовали для ультразвуковых процедур, таких как визуализация кровеносных сосудов и эхокардиография, включающая в себя, но ими не ограниваясь, визуализацию камер желудочка, оценку коронарного кровотока, оценку объема крови в миокарде, диагностику болезни коронарных артерий и оценку фракции изгнания. Микрочастицы можно применять при сосудистой визуализации, а также дополнительно при выявлении заболеваний печени и почек, при выявлении и характеристике опухолевых образований и тканей и при оценке скорости периферической крови. Также микрочастицы могут связываться с лигандами, которые уменьшают адгезию тканей или которые направляют микрочастицы на специфические области организма in vivo. Общепринятый способ получения изображений До введения микрочастицы в форме сухого порошка восстанавливают фармацевтически приемлемыми носителями, затем эффективное количество для выявления вводят пациенту, используя подходящий путь, инъекцией в кровеносный сосуд (такой как внутривенно (i.v.) или внутриартериально (i.a.)), или орально. Состав микрочастицы можно вводить пациенту внутривенно, например, ударной инфузией или краткой инфузией (меньше, чем 30 мин). Предпочтительно, введение инъекции свыше периода времени в диапазоне от 15 сек до 20 мин, наиболее предпочтительно в диапазоне от 30 сек до 15 мин. Обычно дозу в диапазоне от 0,025 до 8 мг/кг веса тела на инъекцию вводят внутривенно пациенту, предпочтительно доза изменяется в пределах от 0,05 до 4 мг/кг. Для диагностических применений ультразвука энергией воздействуют, по крайней мере, на определенную область пациента для получения изображения ткани-мишени. Потом получают визуальное изображение внутренней области пациента таким образом, что можно установить наличие или отсутствие поврежденной ткани. Способы ультразвуковой визуализации, включающие изображение второй гармоники и синхронизированную визуализацию, хорошо известны в данной области техники и описаны, например, в Uhlendorf, IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 14(1): 70-79 (1994) and Sutherland, et al., Journal of the American Society of Echocardiography, 7(5): 441-458 (1994), таким образом, демонстрация каждого входит в состав этого документа. Ультразвуковые колебания применяют с измерительным преобразователем. Если желательно, ультразвук может быть импульсным или непрерывным. Таким образом, ультразвуковая диагностика обычно вызывает наложение отраженных звуков, после которых в течение периода выслушивания ультразвуковой преобразователь принимает отраженные сигналы. Можно использовать гармоники, ультрагармоники или субгармоники. Можно выгодно использовать другой режим работы на гармониках, при котором воспринимается 2х частота, где х представляет собой случайную частоту. Это может способствовать уменьшению сигнала от основного материала и усилить сигнал от преобразователя, использующего радиофармацевтические средства, которые можно направить в желательное место, например, кровяные сгустки. Другие сигналы гармоник, такие как сигналы нечетных гармоник, например, 3х или 5х, подобным образом представляли бы использование этого способа. Сигналы субгармоники, например, х/2 и х/3, также можно представить и подвергнуть обработке с тем, чтобы формировать изображение. Кроме того, можно применять энергетическое доплеровское исследование или цветовое доплеровское исследование. В случае энергетического доплеровского исследования сравнительно высокая энергия энергетического доплеровского исследования может резонировать полости. Это может вызвать звуковые излучения, которые могут находиться в диапазоне субгармоник и ультрагармоник или, в ряде случаев, в той же самой частоте, так как применяют ультразвук. Специфические приложения изображения Описанные здесь микрочастицы можно использовать как в кардиологических, так и радиологических применениях. Для кардиологических применений составы микрочастиц вводят пациенту и пациента сканируют с использованием ультразвукового прибора для получения визуальных изображений сердечно-сосудистой области. При желании соединение микрочастиц вводят в сочетании с фармакологическими или физиологическими средствами, вызывающими стресс. Подходящие фармакологические средства, вызывающие стресс, включают в себя коронарное сосудорасширяющее средство, такое как дипиридамол или аденозин, инотропное средство (т.е. увеличивает силу сердечного сокращения), такое как добутамин или хронотропное средство (т.е. увеличивает частоту сокращения), такое как добутамин. Подходящие физиологические средства, вызывающие стресс, включают физическое упражнение, такое как с использованием «бегущей дорожки» и велоэргометра. Для радиологических применений составы микрочастиц вводят пациенту и пациента сканируют с использованием ультразвукового прибора для получения визуальных изображений области пациента для обследования. Можно использовать микрочастицы для оценки функции сердечно-сосудистой системы, а также оценки коронарного кровотока или объема крови в миокарде или для диагностики ишемической болезни сердца (болезнь коронарных артерий). Например, микрочастицы могут усиливать изображения камер желудочка и таким образом способствовать изучению регионарной функции сердца, благодаря изучению движения стенок, и оценке общей функции сердца, благодаря измерениям фракции выброса. Также микрочастицы можно использовать для оценки коронарного кровотока для установки различий функционирования сердечной ткани или от ишемической сердечной ткани (недостаточный кровоток), или инфарктной (мертвой) сердечной ткани. Контрастные сигналы, зарегистрированные в миокарде, можно использовать как оценку объема крови миокарда с контрастными средствами для ультразвука, расположенными внутрисосудисто после внутривенного введения. Отсутствие или уменьшение интенсивности контраста или яркости изображения в той или иной миокардиальной области со временем свидетельствует об уменьшенном кровотоке (т.е. нарушении). Наиболее часто, если у пациента тяжелая ишемическая болезнь, кровоток в различных областях сердца при оценке такими способами, как ультразвуковое контрастирование, будет выглядеть нормальным. Для того чтобы обнаружить нарушения кровотока у пациента без тяжелых заболеваний сердца или чтобы обнаружить небольшие повреждения коронарного кровотока, необходимо увеличить потребность сердца в кровотоке, включая состояние стресса. Стресс может быть вызван выполняемым пациентом упражнением или введением фармакологического соединения, такого как сосудорасширяющее средство, инотропное средство или хронотропное средство. Во время упражнения или фармакологического стресса нарушения кровотока можно легко обнаружить, так как снижена способность увеличивать кровоток в области, снабжаемой коронарными артериями со стенозом. Сравнение ультразвуковых изображений миокарда после введения ультразвукового контрастного средства можно сделать как в предстрессовом состоянии (т.е. состоянии покоя), так и в состоянии стресса. Область миокарда без увеличенной яркости, обнаруженная во время изображения стресса, но не во время отдыха, свидетельствует об ишемии. Область миокарда без увеличенной яркости, обнаруженная во время изображения стресса и во время изображения отдыха, свидетельствует об инфаркте. В одном варианте осуществления коронарный кровоток можно измерить (1) введением первой инъекции композиции микрочастиц пациенту, (2) сканированием пациента с использованием прибора для ультразвуковой визуализации для получения видимого изображения сердечно-сосудистой области, (3) включением состояния стресса у пациента с использованием фармакологического средства, вызывающего стресс, или упражнение, (4) введением второй инъекции композиции микрочастиц и продолжающегося сканирования и (5) оцениванием различий в изображениях, полученных на стадии (2) и (4), или визуально или с использованием количественного анализа изображения. При радиологических применениях можно использовать микрочастицы для улучшения возможностей ультразвуковой визуализации для радиологических индикаций, включая изображение почки, печени, болезни периферических сосудов, усиление видимости кровотока и контуры кровотока и улучшая определение небольших поражений или глубоких структур внутри организма. Можно использовать микрочастицы как для макрососудистых, так и микрососудистых индикаций. При макрососудистых индикациях (диагностика состояний заболевания и состояний главных артерий и вен организма) микрочастицы могут способствовать определению инсультных и предынсультных состояний посредством визуализации внутричерепных кровеносных сосудов, определению атеросклероза в крупных сосудах, таких как сонные артерии, оценивая уровень стеноза сонных артерий, проходимость сосудистого трансплантанта и тромбоз периферических сосудов. При микрососудистых индикациях (диагностика состояний заболевания и анализ кровотока в небольших сосудах) микрочастицы могут способствовать идентификации повреждений, опухолей или других заболеваний в печени (например, аденома или гемангиома), почках, селезенке (например, аневризмы селезеночной артерии), груди и яичниках и в других тканях и органах. Пораженные ткани у больного можно диагностировать введением композиций микрочастиц пациенту и сканированием пациента с применением ультразвуковой визуализации для получения видимых изображений любых пораженных тканей у пациента. Пораженные ткани можно выявить как область увеличенной яркости или область, которая не обозначена увеличенной яркостью. Улучшенные изображения, полученные с использованием композиций микрочастиц После введения микрочастицы создают улучшенное изображение. Можно выявить улучшенные изображения увеличением яркости в изображении по сравнению с теми, когда не вводится никакого ультразвукового контрастного средства или при значительном удалении из организма искажений в изображении. Таким образом, в связи с ультразвуковой визуализацией сердечно-сосудистой области, которая включает в себя сердечную ткань и связанную с ней сосудистую сеть, усиленное изображение можно выявить, например, увеличением яркости в изображении сердечно-сосудистой области и/или усиленным очищением в возникновении искажений в изображении сердечно-сосудистой области. После однократного введения средства изображения сохраняются в течение от 10 сек до 60 мин. Предпочтительно изображения сохраняются от 20 сек до 30 мин и наиболее предпочтительно сохраняются от 30 сек до 20 мин. В предпочтительном варианте осуществления ультразвуковая визуализация усиливается в камерах желудочков более чем за 5 мин или в миокарде – более чем за 1 мин. Усиление яркости изображения можно оценить либо визуально невооруженным глазом, либо с использованием количественного анализа изображений. С конкретной ссылкой на серую шкалу (от 0 до 255 VDU или серых уровней), установленную раньше, предпочтительно существует увеличение уровня яркости, по крайней мере, при 10 VDU (серые уровни). Наиболее предпочтительно, когда изображение имеет увеличенную яркость выше, чем при 10 VDU, например, при 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 VDU. В некоторых вариантах осуществления увеличенная яркость выше, чем при 100 VDU, например, при 105, 110, 115, 120, 125, 130, 135, 140, 145 или 150 VDU. В других вариантах осуществления увеличенная яркость выше, чем при 150 VDU, например, при 155, 160, 165, 170, 175, 180, 185, 190, 195 или 200 VDU. Альтернативно, увеличенная яркость выше, чем при 200 VDU, например, при примерно 205, 210, 215, 220, 225, 230, 235, 240, 245, 250 или 255 VDU. Вышеуказанные способы и составы далее будут представлены на основании следующих, но не ограничивающихся ими, примеров. Примеры Материалы Уксусная кислота, гидрокарбонат аммония, маннита USP и полисорбат 80 (никаких полученных от животных компонентов) были приобретены у Spectrum Chemicals, Gardena, CA. Полимер (сополимер лактида с гликолидом (PLGA) (50:50)) и диарахидоилфосфатидилхолин (1,2-диарахидоил-sn-глицеро-3-фосфохолин (DAPC)) были получены от Boehringer Ingelheim (Ingelheim, Germany) и Avanti (Alabaster, AL), соответственно. Дихлорметан был приобретен у EM Science (EMD Chemicals, Gibbstown, NJ). Ампулы (30 мл трубчатые ампулы) и пробки (20 мм, серые, с единичным отверстием, Fluro-Tec) были получены от West Pharmaceutical Services (Lionville, PA). Газ н-перфторбутан (DFB) был приобретен у F2 Chemicals Ltd, Lancashire, UK. Аналитические способы Количественная оценка массовой концентрации микрочастиц Массовая концентрация микрочастиц в ампулах была количественно оценена с использованием ICP-MS (масс-спектрометрия с индуктивно связанной плазмой). Количество полимера в микрочастицах определяли, рассчитывая на олово ICP-MS. Количество полимера, находящегося в микрочастицах, определяли, основываясь на сравнении количества олова, обнаруженного в микрочастицах, к количеству олова, найденного в специфическом множестве полимера, использованном для получения микрочастиц. Количество фосфолипидов в микрочастицах определяли анализом фосфора на ICP-MS. Количество фосфора, находящегося в микрочастицах, было определено на основании количества фосфора, обнаруженного в фосфолипидах. Масса микрочастиц на мл суспензии была посчитана добавлением количества полимера и фосфолипида на ампулу, и потом диспергирование этого объединения восстанавливающим объемом (5 мл). Анализ размера частиц Образец восстановленных микрочастиц добавляли к раствору электролитов, и полученную суспензию анализировали по размеру частиц и концентрации микрочастиц с использованием Coulter Multisizer II, снабженного отверстием трубы с диаметром 50 мкм. Содержание газа микрочастиц Сухой порошок в ампулах был восстановлен 5 мл воды и встряхиванием для образования суспензии микрочастиц. Полученная суспензия была проанализирована на содержание DFB извлечением ряда из 0,3 мл аликвот через крышку с использованием иглы или шприца. Эти аликвоты были введены внутрь запечатанного воздушного пространства ампул. Воздушное пространство ампул уравновесили по крайней мере на 10 часов при комнатной температуре. Образцы потом были нагреты до 45°С в течение 20 мин в свободном воздушном пространстве сушилки. Газ над суспензией анализировали газовой хроматографией с использованием освобожденного от пробки входа и детектора ионизации пламени. Была произведена количественная оценка с использованием области, основанной на одноточечной калибровке. Параметры системы GC и температурная программа приводятся в таблице 1 и 2.
Пример 1: Получение микрочастиц для использования в качестве контрастного средства для ультразвука Органический раствор был получен растворением 176 г PLGA, 10,6 г диарахидоилфосфатидилхолина (1,2-диарахидоил-sn-глицеро-3-фосфохолин (DAPC)) и 2,26 г уксусной кислоты в 5,88 л дихлорметана при 25°C. Водный раствор, состоящий из 68,5 г бикарбоната аммония, растворенного в 338 мл воды для инъекций, был добавлен к органическому раствору и гомогенизирован в течение 10 мин при 4310 об/мин в 10-л сосуде для гомогенизации с использованием мешалки-эмульгатора ротора-статора. Полученная в результате эмульсия была подвергнута распылительной сушке с использованием азота и как распылитель, и как сушильный газ. Эмульсии подвергали распылительной сушке на рабочей поверхности, распылительная сушилка с использованием пневматически распыляющей насадки распылительных систем (Wheaton, IL) и стеклянной сушильной камеры/циклонной системы Buchi (Brinkmann, Westbury, NY). Условия распылительной сушки состояли в следующем: 40 мл/мин – объемная скорость потока эмульсии, 30 л/мин – расход распыления газа, 46 кг/час – расход сушильного газа и 12°C – температура на выходе. Продукт сушки с распылением далее подвергают обработке при помощи стадий рассеивания, затвердевания и лиофилизации. Водный растворитель был получен растворением 140 г маннита и 4,10 г полисорбата 80 в 5,0 л воды. Высушенные распылением микрочастицы были рассеяны в растворителе в концентрации 25 мг/мл. Рассеянные частицы собирали с использованием нержавеющей стали, серии 800, проточно-электролитного ультразвукового аппарата Misonix Incorporated (Farmingdale, NY) и просеивали через вибрационное сито с диаметром 10″ (RBF-10) Vorti-Siv (Salem, OH). Ультразвуковой аппарат заключали в рубашку с 4°C для предотвращения нагревания рассеянных частиц. Рассеянные частицы просеивали через 25-мкм и 20-мкм ячейки сита последовательно при 150 мл/мин. Просеянными рассеянными частицами заполняют ампулы (10 мл наполняют 30-мл ампулы), частично закупоривают и замораживают погружением в жидкий азот. После замораживания ампулы лиофилизировали. По окончании лиофилизирования камеру изолировали и заполняли ампулы н-перфторбутаном (DFB) при давлении в 5 килопаскалей вплоть до закупоривания. Сухой порошок восстанавливали 5 мл стерильной воды до использования добавления воды в ампулы с сухим порошком и встряхивали для получения суспензии микрочастиц в изоосмотическом манните. Суспензия содержала 2,2·109 микрочастиц/мл суспензии и 37 мг микрочастиц/мл суспензии, а микрочастицы обладали средним размером 2,2 микрона. Пример 2: Скорость утечки газа из микрочастиц Скорость утечки газа из двух разделенных партий (партия 1 и партия 2) микрочастиц, как получено в способах примера 1, оценивали с использованием газовой хроматографии (GC), как описано в разделе аналитических способов. Третью партию микросфер (партия 3) получили сходным с примером 1 способом, однако фосфолипид, диарахидоилфосфатидилхолин (1,2-диарахидоил-sn-глицеро-3-фосфохолин (DAPC)) выделяли во время получения микрочастиц.
Содержащие DAPC микрочастицы теряли приблизительно 10% содержания пускового газа спустя 70 мин, тогда как микрочастицы, которые не содержат DAPC, теряли 87% содержания пускового газа. Кроме того, микрочастицы, которые содержат DAPC, имеют более высокое содержание пускового исходного газа по сравнению с микрочастицами без DAPC. Это означает, что включение DAPC является важным для образования внутренней поровой структуры микрочастиц во время распылительной сушки, а также при сохранении газа внутри микрочастиц. Общая продолжительность предполагаемого использования контрастного средства для ультразвука после введения субстанции обычно представляет собой от 30 сек до 60 мин в зависимости от вида кардиологии или радиологии проведенного ультразвукового исследования. Таким образом проводят оценку утечки газа из микрочастиц, содержащих липид DAPC, чтобы она была незначительной на протяжении ультразвукового исследования. Пример 3: Улучшение сердечного изображения в зависимости от дозы микрочастиц Микрочастицы, как получено способами примера 1, были изучены на здоровых взрослых людях. Сухой порошок восстанавливали до использования добавлением 5 мл стерильной воды в ампулу и встряхиванием ампулы десять раз. Конечная концентрация микросфер в полученной суспензии приблизительно составляла 37 мг/мл. Испытуемые получали одну из доз 0,5, 2,0 или 4,0 мг/кг массы тела. Испытуемых подвергали трансторакальной ультразвуковой визуализации с использованием изображения непрерывной гармоники (скорость передачи кадров – 15 Гц и частота преобразователя – 2,1/4,2 МГц). Изображения оценивали визуально по интенсивности и длительности оптимизации. Длительность улучшения камеры желудочка превышала 9 мин при дозах как в 2 мг/кг, так и 4 мг/кг. Контрастное действие было еще заметно у 13 из 15 испытуемых при этих двух дозах, когда испытуемым провели повторную визуализацию в 30 мин, указывая на большую продолжительность улучшения, обусловленную микрочастицами. Данные о продолжительности улучшения камеры желудочка сведены в таблицу 4.
Пример 4: Сравнительная характеристика микрочастиц в коммерческом продукте для оценки изображений сердца Сравнительное изучение изображений при эхокардиографии было проведено у двух взрослых людей, подобранных по весу тела и функции сердца. Первый испытуемый получал однократное введение микрочастиц, как получено способом в примере 1. Сухой порошок восстанавливали до использования введением 5 мл стерильной воды в ампулу и встряхиванием ампулы 10 раз. Конечная концентрация микросфер в полученной суспензии приблизительно составляла 37 мг/мл, и содержание газа в суспензии приблизительно составляло 250 мкг/мл суспензии. Первый испытуемый получал дозу 4 мг микрочастиц/кг, что соответствует дозе газа 27 мкг/кг массы тела. Второй испытуемый получал однократную дозу продаваемого контрастного средства для ультразвука, OPTISON® (Amersham Health), которое содержит перфторпропан с микросферами альбумина. Два испытуемых получали одинаковое общее количество газа (27 мкг/кг массы тела), который является акустически активным компонентом. Двух испытуемых подвергали трансторакальной ультразвуковой визуализации с использованием изображения непрерывной гармоники (скорость передачи кадров 15 Гц и частота преобразователя 2,1/4,2 МГц). Изображения оценивали визуально по интенсивности и длительности оптимизации. Длительность оптимизации камеры желудочка сведена в таблицу 5.
Микрочастицы, полученные с использованием описанного в примере 1 способа, обеспечивают оптимизированные изображения как камер желудочка, так и миокарда, которые являются значительно более долгими, чем OPTISON®, и которые есть при адекватной длительности для сопровождения завершения исследования сердца ультразвуком. Пример 5: Оценка коронарного кровотока для оценки ишемии с использованием препаратов микрочастиц Микрочастицы, полученные, как в способе примера 1, были введены индивидууму, подлежащему оценке на предмет ишемической болезни сердца. Испытуемый получал две инъекции микрочастиц, разделенных 60 мин. Первую инъекцию микрочастиц (“инъекция в покое”, 1,7 мг/кг) использовали для оценки миокарда в покое. До второй инъекции микрочастиц испытуемого подвергли фармакологическому стрессу с использованием коронарного сосудорасширителя, дипиридамола (0,56 мг/кг). После вызывания стресса испытуемый получал вторую инъекцию микрочастиц (“инъекция в стрессе” 1,3 мг/кг) для оценки миокарда после стресса. Сравнение изображений во время покоя и стресса в динамике по времени после введения микрочастиц субъекту обозначает область миокарда, которая обладает усилением в оптимизации изображения, и эта область становится больше в размерах при последующем вызывании стресса. Это указывает зону ткани миокарда, имеющую как инфарктный, так и ишемический компоненты. Было подтверждено выявление ишемии с использованием альтернативного диагностического способа, радионуклидной визуализации. Радионуклидную перфузию в покое и при стрессе проводили после введения 99Tc (MIBI) и получали изображение испытуемого с использованием коммерческого счетчика гамма-излучений. Замеченные повреждения при ультразвуковой визуализации в покое и стрессе были подтверждены изображениями радионуклидной перфузии в покое и при стрессе.
Формула изобретения
1. Дозированная препаративная форма, обеспечивающая улучшенные ультразвуковые контрастные изображения, содержащая микросферы, содержащие биологически совместимый синтетический полимер и содержащая введенный в нее перфторуглерод, который представляет собой газ при температуре тела, где микросферы являются пористыми сферами с ячеистой структурой или губкоподобной стуктурой, где дозированная препаративная форма содержит дозу микросфер, эффективную для обеспечения улучшенных ультразвуковых изображений в течение более 5 мин в камерах желудочков или более 1 мин в миокарде, когда микросферы вводят внутривенно, и где доза составляет от 0,025 до 8,0 мг микросфер/кг массы тела. 2. Препаративная форма по п.1, содержащая дозу в диапазоне от 0,05 до 4,0 мг микросфер/кг массы тела. 3. Препаративная форма по п.1 в форме сухого порошка микросфер, которую можно перед использованием растворять стерильной водой, добавляя воду в ампулу или шприц с сухим порошком и встряхивая для получения изоосмотической суспензии микросфер. 4. Препаративная форма, обеспечивающая улучшенные ультразвуковые контрастные изображения, содержащая микросферы, содержащая биологически совместимый синтетический полимер и содержащая введенный в нее перфторуглерод, который представляет собой газ при температуре тела, где микросферы являются пористыми сферами с ячеистой структурой или губкоподобной структурой, где препаративная форма содержит дозу микросфер, эффективную для обеспечения улучшенных ультразвуковых изображений в камерах желудочков в течение более 5 мин или более 1 мин в миокарде, когда микросферы вводят внутривенно, и где микросферы растворяют стерильной водой до использования с образованием суспензии с концентрацией микросфер в пределах от 1,0·109 до 3,5·109 микросфер/мл суспензии или массовой концентрацией микросфер в пределах от 25 до 50 мг микросфер/мл суспензии. 5. Препаративная форма по п.1 или 4, обеспечивающая улучшенные ультразвуковые изображения в камерах желудочков в течение более 9 мин. или для миокарда в течение более 2 мин. 6. Препаративная форма по п.1 или 4, обеспечивающая улучшенные ультразвуковые изображения в камерах желудочков в течение по меньшей мере 30 мин. 7. Препаративная форма по п.4, образующая суспензию, имеющую концентрацию микросфер в диапазоне от 1,5·109 до 2,8·109 микросфер/мл суспензии или массовую концентрацию микросфер в диапазоне от 30 до 45 мг микросфер/мл суспензии. 8. Препаративная форма по п.1 или 4, где микросферы имеют средний размер меньше, чем 8 микрон. 9. Препаративная форма по п.8, где микросферы имеют средний размер в диапазоне от 1,9 до 2,6 мкм. 10. Препаративная форма по п.1, содержащая дозу в диапазоне от 0,5 до 4,0 мг микросфер/кг массы тела. 11. Препаративная форма по п.10, где дозу выбирают из группы, состоящей из 0,5 мг микросфер/кг массы тела, 2,0 мг микросфер/кг массы тела и 4,0 мг микросфер/кг массы тела. 12. Препаративная форма по п.1 или 4, где газ выбирают из группы, состоящей из CF4, C2F4, C2F6, С3F6, C3F8, C4F8 и C4F10. 13. Препаративная форма по п.12, где газ представляет собой н-перфторбутан (С4F10), который содержится в количестве от 75 до 500 мкг/мл введенного объема суспензии микросфер. 14. Препаративная форма по п.13, где н-перфторбутан (С4F10) обеспечивают в количестве от 100 до 400 мкг/мл введенного объема суспензии микросфер. 15. Препаративная форма по п.14, где н-перфторбутан (С4F10) обеспечивают в количестве от 150 до 350 мкг/мл введенного объема суспензии микросфер. 16. Препаративная форма по п.12, где газ представляет собой н-октафторпропан (C3F8), обеспечиваемый в количестве от 75 до 375 мкг/мл введенного объема суспензии микросфер. 17. Препаративная форма по п.16, где н-октафторпропан (C3F8) обеспечивают в количестве от 120 до 300 мкг/мл введенного объема суспензии микросфер. 18. Препаративная форма по п.1 или 4, где микросфера образуется из синтетического полимера, выбранного из группы, состоящей из полигидроксикислот, полиангидридов, полиортоэфиров, полиамидов, поликарбонатов, полиалкиленов, полиалкиленгликолей, полиалкиленоксидов, поливалериановой кислоты, сополимера лактида с капролактоном, и сополимеров и их смесей. 19. Препаративная форма по п.1 или 4, содержащая дополнительно включенное в полимер гидрофобное соединение в соотношении от 0,01 до 30% (вес гидрофобного соединения/вес полимера). 20. Препаративная форма по п.19, где гидрофобное соединение представляет собой липид, включенный в полимер в соотношении от 0,01 до 30% (вес липида/вес полимера). 21. Препаративная форма по п.20, где липид представляет собой фосфолипид, выбранный из группы, состоящей из диолеоилфосфатидилхолина (DOPC), димиристоилфосфатидилхолина (DMPC), дипентадеканоилфосфатидилхолина (DPDPC), дилауроилфосфатидилхолина (DLPC), дипальмитоилфосфатидилхолина (DPPC), дистеароилфосфатидилхолина (DSPC), диарахидоилфосфатидилхолина (DAPC), дибехеноилфосфатидилхолина (DBPC), дитрикозаноилфосфатидилхолина (DTPC), дилигноцероилфатидилхолина (DLGPC) и фосфатидилэтаноламинов. 22. Препаративная форма по п.21, где полимер представляет собой сополимер лактида с гликолидом с соотношением лактида к гликолиду 1:1 и средневесовая молекулярная масса варьирует от 20 до 40 кДа, и где липид представляет собой диарахидоилфосфатидилхолин, включенный в полимер в соотношении от 5 до 6,6% (вес липида/вес полимера). 23. Препаративная форма по п.1 или 4 в ампуле или шприце, содержащая сухой порошок из микросфер. 24. Препаративная форма по п.23, где ампула или шприц дополнительно содержит один или более наполнителей, выбранных из группы, состоящей из сахаров, солей и поверхностно-активных веществ. 25. Препаративная форма по п.1 или 4 в наборе, содержащем ампулу или шприц с сухими микросферами и ампулу или шприц с раствором для ресуспендирования микросфер. 26. Препаративная форма по п.1 или 4, состоящая по существу из одной или двух доз. 27. Препаративная форма по п.1 или 6, состоящая по существу до пяти доз. 28. Способ обеспечения улучшенных ультразвуковых изображений, включающий введение пациенту препаративной формы по любому из пп.1-27, и затем визуализация области пациента для получения улучшенного изображения по сравнению с тем, когда не присутствует никакого контрастного средства. 29. Способ по п.28, дополнительно включающий введение пациенту средства, вызывающего стресс сердечно-сосудистой системы пациента, и повторную визуализацию пациента. 30. Способ по п.28, где область для визуализация выбирают из группы, состоящей из сердечно-сосудистой области, печени, почек, селезенки, груди и яичников. 31. Набор, содержащий препаративную форму по любому из пп.1-27 и раствор для растворения препаративной формы. 32. Способ для получения препаративной формы для ультразвуковой контрастной визуализации, включающий суспендирование микросфер, содержащих биологически совместимый полимер и гидрофобное соединение в растворе, необязательно включающем наполнители, помещение суспензии в ампулу или шприц, замораживание суспензии, лиофилизацию ампулы для получения сухого порошкообразного средства в ампуле или шприце, и заполнение лиофилизатора газом перфторуглеродом, для получения препаративной формы по любому из пп.1-27. 33. Способ изготовления дозированной препаративной формы для ультразвуковой контрастной визуализации, включающей сухое смешивание микросфер, включающих биологически совместимый полимер и гидрофобное соединение, необязательно включающих наполнители, помещение смеси в ампулу или шприц, вакуумирование ампулы для удаления инкапсулированного воздуха, и заполнение ампулы или шприца газом перфторуглеродом, получение препаративной формы по любому из пп.1-27.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -ацилалкилфосфолипиды. Примеры фосфолипидов включают в себя, но ими не ограничиваются, фосфатидилхолины, такие как диолеоилфосфатидилхолин (DOPC), димиристоилфосфатидилхолин (DMPC), дипентадеканоилфосфатидилхолин (DPDPC), дилауроилфосфатидилхолин (DLPC), дипальмитоилфосфатидилхолин (DPPC), дистеароилфосфатидилхолин (DSPC), диарахидоилфосфатидилхолин (DAPC), дибехеноилфосфатидилхолин (DBPC), дитрикозаноилфосфатидилхолин (DTPC), дилигноцероилфосфатидилхолин (DLPC); и фосфатидилэтаноламины, такие как диолеоилфосфатидилэтаноламин или 1-гексадецил-2- пальмитоилглицерофосфоэтаноламин. Также могут быть использованы синтетические фосфолипиды с асимметричными ацильными цепями (например, с одной ацильной цепью из 6 углеродов и другой ацильной цепью из 12 углеродов).
-ацилалкилфосфолипиды. Примеры фосфолипидов включают в себя, но ими не ограничиваются, фосфатидилхолины, такие как диолеоилфосфатидилхолин (DOPC), димиристоилфосфатидилхолин (DMPC), дипентадеканоилфосфатидилхолин (DPDPC), дилауроилфосфатидилхолин (DLPC), дипальмитоилфосфатидилхолин (DPPC), дистеароилфосфатидилхолин (DSPC), диарахидоилфосфатидилхолин (DAPC), дибехеноилфосфатидилхолин (DBPC), дитрикозаноилфосфатидилхолин (DTPC), дилигноцероилфосфатидилхолин (DLPC); и фосфатидилэтаноламины, такие как диолеоилфосфатидилэтаноламин или 1-гексадецил-2- пальмитоилглицерофосфоэтаноламин. Также могут быть использованы синтетические фосфолипиды с асимметричными ацильными цепями (например, с одной ацильной цепью из 6 углеродов и другой ацильной цепью из 12 углеродов).