|
|
(21), (22) Заявка: 2003136746/13, 17.05.2002
(24) Дата начала отсчета срока действия патента:
17.05.2002
(30) Конвенционный приоритет:
21.05.2001 US 60/291,968
(43) Дата публикации заявки: 20.05.2005
(46) Опубликовано: 20.01.2009
(56) Список документов, цитированных в отчете о
поиске:
SU 979508 A1, 07.12.1982. HATTON M.W., REGOECZI E. The relevance of the structure of lysine bound to Sepharose for the affinity of rabbit plasminogen, Biochim Biophys Acta. 1975 Feb 27; 379(2):504-11. MOROZ L.A., GILMORE N.J. Fibrinolysis in normal plasma and blood: evidence for significant mechanisms independent of the plasminogen-plasmin system.
(85) Дата перевода заявки PCT на национальную фазу:
22.12.2003
(86) Заявка PCT:
EP 02/05462 (17.05.2002)
(87) Публикация PCT:
WO 02/095019 (28.11.2002)
Адрес для переписки:
129010, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. Е.Е.Назиной, рег. № 517
|
(72) Автор(ы):
НУР Исраэль (IL),
БАР Лилиана (IL),
АЦАХИ Малкит (IL)
(73) Патентообладатель(и):
ОМРИКС БИОФАРМАСЬЮТИКАЛС С.А. (BE)
|
(54) УДАЛЕНИЕ ПЛАЗМИН(ОГЕН)А ИЗ БЕЛКОВЫХ РАСТВОРОВ
(57) Реферат:
Изобретение относится к области биохимии и может быть использовано в фармацевтической промышленности для очистки смесей природного происхождения, содержащих плазминоген и фибриноген, от плазминогена. Плазминоген удаляют из смеси, содержащей плазминоген и фибриноген, с помощью нерастворимой матрицы для хроматографии, ковалентно сшитой с транексамовой кислотой через аминогруппу с помощью линкера, длина которого составляет более трех атомов углерода. Для этого указанную смесь наносят на хроматографическую колонку, содержащую указанную нерастворимую матрицу. Затем колонку промывают нейтральным раствором, содержащим соли, и собирают несвязавшийся материал. Применение изобретения позволяет расширить технические возможности очистки смесей природного происхождения, содержащих плазминоген и фибриноген, от плазминогена с сохранением при этом исходного количества фибриногена в смеси. 2 н. и 13 з.п. ф-лы, 1 ил., 13 табл.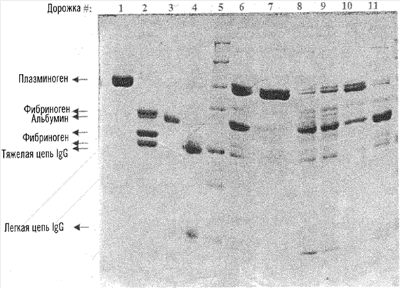
(56) (продолжение):
CLASS=”b560m”Blood. 1976 Oct; 48(4):531-45. IWAMOTO M. Plasminogen-plasmin system IX. Specific binding of tranexamic acid to plasmin. Thromb Diath Haemorrh. 1975 Jun 30; 33(3):573-85.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Область техники
Данное изобретение относится к использованию смолы и созданию способа для специфического удаления плазмин(оген)а и его производных из белковых растворов, причем полученный белковый раствор можно использовать для внутривенного введения и для местных применений, то есть в виде матриксного носителя для пролонгированного высвобождения и заживления ран, или в виде индивидуального активного компонента, или в сочетании с другими фармацевтическими соответствующими лекарственными средствами. Удаление плазмин(оген)а позволяет сохранять целостность и функцию белкового раствора во время более длительных периодов инкубации. Данное изобретение также относится к получению высокоочищенного плазмин(оген)а для терапевтического применения.
Смежная область
Плазмин(оген) или его активная молекула плазмин (в дальнейшем плазмин(оген)) очень часто загрязняет белковые растворы, особенно растворы, экстрагированные из жидкостей или органов животных. С признанием плазмин(оген)а в качестве стабильного фармацевтического продукта присутствие плазмин(оген)а в белковом растворе представляет многократную опасность, обусловленную известной протеолитической активностью молекулы в отношении различных белков и пептидов по пептидным связям аргинила и лизила (Weinstein M.J., Doolittle RF. Differential specificities of the thrombin, plasmin and trypsin with regard to synthetic and natural substrates and inhibitors RF Biochim Biophys Acta. 1972. 258: 577-90 и Ling CM, Summaria L, Robbins KC. Mechanism of formation of bovine plasmin(ogen) activator from human plasmin. J. Biol. Chem. 1965. 240: 4212-B) и основных аминокислот, его стимулирующей активностью в отношении различных тканей, особенно ткани центральной нервной системы, и его ролью в связывании (Chen ZL, Strickland S. Neuronal death in the hippocampus is promoted by plasmincatalyzed degradation of liminin. Cell. 1997. 91: 917-25) и, вероятно, поддержании прионов в крови млекопитающих (Fischer MB, Roeckl C, Parizek P, Schwarz HP. Aguzzi A Binding of disease associated prion protein to plasmin(ogen). Nature. 2000. 408: 479-83).
Разработано несколько хроматографических способов очистки плазмин(оген)а из белковых растворов и, следовательно, удаления плазмин(оген)а из белкового раствора.
Упомянутые способы по существу базируются на двух принципах. Первая группа способов основана на нескольких последовательных стадиях очистки, в которых используют различную растворимость, изоэлектрическую точку или распределение по размеру молекул (Alkjaerisig N. The purification and properties of human plasmin(ogen). Biochem. J. 1963, 93: 171-182). Так как их основной целью было очистить плазмин(оген), упомянутые способы полностью изменяли состав белкового раствора. Вторая группа способов основана на одностадийной аффинной очистке. Очистка базируется на связывании плазмин(оген)а с различными синтетическими лигандами  -аминокарбоновых кислот, которые могут связываться по лизинсвязывающим участкам на тяжелой цепи плазмин(оген)а. Названные участки, состоящие из 5 дисульфидных мостиков тройной петли с гомологией внутренних последовательностей, известных как крингл-домены плазмин(оген)а, локализованных на NH2-конце тяжелой цепи плазмин(оген)а и на большом расстоянии от каталитического центра, расположенного на СООН-конце легкой цепи, связывают фибрин(оген). Другой возможной перспективой для аффинной хроматографии является связывание плазмин(оген)а через каталитический центр, потенциально менее специфическое связывание, так как он может связывать многие белки, такие как сериновые протеазы, имеющие подобное или более низкое сродство к пептидным связям аргинила или лизила и основным аминокислотам. Кратко можно заключить, что, по существу, плазмин(оген)-аффинную хроматографию проводят с помощью определенного лиганда, который химически и по ионогенности напоминает -аминокарбоновых кислот, которые могут связываться по лизинсвязывающим участкам на тяжелой цепи плазмин(оген)а. Названные участки, состоящие из 5 дисульфидных мостиков тройной петли с гомологией внутренних последовательностей, известных как крингл-домены плазмин(оген)а, локализованных на NH2-конце тяжелой цепи плазмин(оген)а и на большом расстоянии от каталитического центра, расположенного на СООН-конце легкой цепи, связывают фибрин(оген). Другой возможной перспективой для аффинной хроматографии является связывание плазмин(оген)а через каталитический центр, потенциально менее специфическое связывание, так как он может связывать многие белки, такие как сериновые протеазы, имеющие подобное или более низкое сродство к пептидным связям аргинила или лизила и основным аминокислотам. Кратко можно заключить, что, по существу, плазмин(оген)-аффинную хроматографию проводят с помощью определенного лиганда, который химически и по ионогенности напоминает  -аминокарбоновую кислоту или субстрат каталитического центра плазмина. Лиганд связывается со смолой через соответствующий связывающий мостик или линкер. Однако идеальная аффинная смола для удаления плазмин(оген)а по существу не является той смолой, которую создавали как идеальную для очистки плазмин(оген)а. Такие смолы должны содержать лиганд, который связывает плазмин(оген) с высоким сродством и имеет очень низкое сродство к другим белкам, таким как другие сериновые протеазы, и особенно очень низкое сродство к фибриногену, который является главным белком во фракции I Кона (Cohn) плазмы или в криопреципитатах. Также важно, что удаление плазмин(оген)а с использованием данной аффинной хроматографии может быть проведено с помощью различных буферов и не ограничено определенным буфером, который может нарушать стабильность и целостность тех белков в растворе, которые, в отличие от плазмино(оген)а, и представляют интерес. -аминокарбоновую кислоту или субстрат каталитического центра плазмина. Лиганд связывается со смолой через соответствующий связывающий мостик или линкер. Однако идеальная аффинная смола для удаления плазмин(оген)а по существу не является той смолой, которую создавали как идеальную для очистки плазмин(оген)а. Такие смолы должны содержать лиганд, который связывает плазмин(оген) с высоким сродством и имеет очень низкое сродство к другим белкам, таким как другие сериновые протеазы, и особенно очень низкое сродство к фибриногену, который является главным белком во фракции I Кона (Cohn) плазмы или в криопреципитатах. Также важно, что удаление плазмин(оген)а с использованием данной аффинной хроматографии может быть проведено с помощью различных буферов и не ограничено определенным буфером, который может нарушать стабильность и целостность тех белков в растворе, которые, в отличие от плазмино(оген)а, и представляют интерес.
Антифибринолитическая активность (способность ингибировать высокоаффинное связывание плазмин(оген)а с фибриногеном)  -аминокарбоновых кислот зависит от присутствия свободной амино- и карбоксильной группы и от расстояния между СООН-группой и атомами углерода, к которым присоединяется NH2-группа (Markwardt 1978), такая как группа -аминокарбоновых кислот зависит от присутствия свободной амино- и карбоксильной группы и от расстояния между СООН-группой и атомами углерода, к которым присоединяется NH2-группа (Markwardt 1978), такая как группа  -аминокапроновой кислоты (ЕАСА) и пара-аминобензамидина (PAMBA). Сравнение антифибринолитических активностей ЕАСА и PAMBA показало, что последний является приблизительно в три раза более активным. Shimura et al. (1984) предложили смолу, в которой пара-аминобензамидин связан с микрочастицами гидрофильного винилполимера через связующий (линкерный) фрагмент. С использованием описанной смолы Shimura et al. удалось разделить плазмин и плазмин(оген) методом аффинной хроматографии высокого разрешения. Факты, что плазмин(оген) невозможно элюировать с помощью одной только 6-аминогексаноевой кислоты и что 3 М мочевина должна быть введена в элюционный буфер, указывают на двухцентровое взаимодействие плазмина с названным иммобилизованным лигандом, то есть с лизинсвязывающими участками на тяжелой цепи и с каталитическим участком на легкой цепи. Это может объяснить данные, полученные другими исследователями, что пара-аминобензамидин удаляет также некоторые другие белки. Другую смолу, лизин-смолу, производят и применяют для аффинной очистки плазмин(оген)а. Однако антифибринолитическая активность лизина очень низка, а следовательно, также и его сродство связывания. Он также связывается с другими белками и его специфичность зависит от буфера. -аминокапроновой кислоты (ЕАСА) и пара-аминобензамидина (PAMBA). Сравнение антифибринолитических активностей ЕАСА и PAMBA показало, что последний является приблизительно в три раза более активным. Shimura et al. (1984) предложили смолу, в которой пара-аминобензамидин связан с микрочастицами гидрофильного винилполимера через связующий (линкерный) фрагмент. С использованием описанной смолы Shimura et al. удалось разделить плазмин и плазмин(оген) методом аффинной хроматографии высокого разрешения. Факты, что плазмин(оген) невозможно элюировать с помощью одной только 6-аминогексаноевой кислоты и что 3 М мочевина должна быть введена в элюционный буфер, указывают на двухцентровое взаимодействие плазмина с названным иммобилизованным лигандом, то есть с лизинсвязывающими участками на тяжелой цепи и с каталитическим участком на легкой цепи. Это может объяснить данные, полученные другими исследователями, что пара-аминобензамидин удаляет также некоторые другие белки. Другую смолу, лизин-смолу, производят и применяют для аффинной очистки плазмин(оген)а. Однако антифибринолитическая активность лизина очень низка, а следовательно, также и его сродство связывания. Он также связывается с другими белками и его специфичность зависит от буфера.
Moroz LA. Gilmore NJ в Fibrinolysis in normal plasma and blood: evidence for significant mechanisms independent of the plasminogen-plasmin system, Blood, 1976, 48, 531-45, описывают получение плазмы, не содержащей плазмин(оген), методом аффинной хроматографии. На основании использованных методов авторами сделано сообщение относительно данных, указывающих, что процессы, которые в высшей степени способствуют образованию фибринолитического фермента плазмина, играют в лучшем случае минорную роль в спонтанной или базальной фибринолитической активности, измеряемой в нормальной плазме человека. Транексамовую кислоту используют вместе с другими ингибиторами протеаз в качестве ингибиторов плазмина для измерения фибринолитической активности. Для получения плазмы, не содержащей плазмин(оген), используют способ Deutsch and Meltz, Science 170: 1095-1096, 1997.
Iwamoto в Thrombos. Diathes. Heamorrh. (Stuttg.), 1975, 33, 573 описывает специфическое связывание транексамовой кислоты с плазмином. Хотя транексамовая кислота идентифицирована как эффективный лиганд плазмина, показано, что антифибринолитическое действие транексамовой кислоты является результатом не только связывания плазмин(оген)а, а также увеличения кооперации природных антиплазминов. Поэтому следует заключить, что связывание транексамовой кислоты с твердым носителем будет удалять из плазмы не только плазмин(оген), но также и природные антиплазмины. Также следует предположить, что транексамовые кислоты могут вызывать образование агрегатов (конгломератов) с ингибиторами плазмина. Это понимание базируется на различиях, которые могут быть установлены при сравнении антифибринолитических активностей  -аминокапроновой кислоты и транексамовой кислоты, приводящих к 98% и 91% ингибированию плазмы, стимулированной урокиназой, по сравнению с плазмой, которая получена из перорально гепаринизированной крови (65 и 39% для -аминокапроновой кислоты и транексамовой кислоты, приводящих к 98% и 91% ингибированию плазмы, стимулированной урокиназой, по сравнению с плазмой, которая получена из перорально гепаринизированной крови (65 и 39% для  -аминокапроновой кислоты и транексамовой кислоты соответственно – ср. таблицы 2 и 7 в статье Moroz et al.). Следует предположить, что вследствие их высокого коэффициента связывания транексамовая кислота и -аминокапроновой кислоты и транексамовой кислоты соответственно – ср. таблицы 2 и 7 в статье Moroz et al.). Следует предположить, что вследствие их высокого коэффициента связывания транексамовая кислота и  -аминокапроновая кислота являются хорошими кандидатами на высокоаффинные лиганды. Однако также следует предположить, что названные лиганды будут блокировать аффинную колонку в результате связывания плазмина и комплексов плазмин-ингибитор. -аминокапроновая кислота являются хорошими кандидатами на высокоаффинные лиганды. Однако также следует предположить, что названные лиганды будут блокировать аффинную колонку в результате связывания плазмина и комплексов плазмин-ингибитор.
Наконец, в качестве ближайшего аналога заявленного в настоящем изобретении способа удаления плазминогена из смеси, содержащей фибриноген и плазминоген, можно указать авторское свидетельство SU 1727839 A1 (Чупов В.В., Николайчик В.В., Бычко Г.Н. и соавт., от 23.04.1992). В соответствии с указанным документом плазминоген из плазмы крови удаляли путем пропускания последней через колонку с равновесно набухшим сополимером акриламида, N,N’-метиленбисакриламида и метакрилоил-L-лизина. В результате использования такого сорбента с ковалентно иммобилизованным L-лизином получали 100% очистку плазмы от плазминогена, а потери лизина составляли менее 0,3%. По сравнению с этими результатами предлагаемый в настоящем изобретении способ удаления плазминогена позволяет расширить технические возможности очистки жидких смесей природного происхождения, содержащих плазминоген и фибриноген, от плазминогена с сохранением при этом исходного количества фибриногена в смеси.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На чертеже представлен градиентный электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) (5-12% полиакриламид) 7 мкг белков, элюированных двумя способами (описаны в разделе Материалы и методы), с трех различных смол – ТЕА-сефарозы, Lys-Ceramic Hyper DF и Lys-сефарозы 4В. Дорожки: 1 – Glu-плазминоген; 2 – фибриноген; 3 – альбумин; 4 – иммуноглобулин G; 5 – стандарт молекулярных масс; элюционные пики: 6 – способа с использованием ТЕА; 7 – способа 2 с использованием ТЕА; 8 – способа 1 с использованием лизин-Ceramic Hyper D; 9 – способа 1 с использованием лизин-сефарозы; 10 – способа 1 с лизин-Ceramic Hyper D; 11 – способа 1 с использованием лизин-сефарозы.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение базируется на данных, что неподвижная аминокислота, как было установлено, способна специфически связывать плазмин(оген). В контексте описания изобретения выражение «специфически связывать» означает, что из смеси, содержащей белки, такие как плазмин(оген) и фибриноген, в основном удаляется плазмин(оген), тогда как фибриноген удерживается в смеси почти без изменений. Предпочтительно удаляют, по меньшей мере, от 85 до 99% плазмин(оген)а и, по меньшей мере, 85% фибриногена остается в смеси. Более предпочтительно удаляют, по меньшей мере, от 98,0% до 99,9% плазминогена или сохраняют 95%-99% фибриногена.
Аминогруппа аминокислоты и карбоксильная группа аминокислоты находятся на расстоянии около 6-8 Ангстрем, предпочтительно около 7 Ангстрем, неподвижная аминокислота ковалентно связана с носителем через аминогруппу аминокислоты. Особенно предпочтительными являются транексамовая кислота в ее трансконфигурации и 4-аминометилбицикло-[2.2.2.]-октан-1-карбоновая кислота (EMBOCA).
Неожиданно было установлено, что, во-первых,  -аминокапроновая кислота не работает так, как транексамовая кислота, и что как только транексамовая кислота связывается с твердой поверхностью, она проявляет всю свою повышенную плазмин(оген)-связывающую способность (так называемая кооперативность), а смола удаляет из плазмы или из продуктов плазмы только плазмин(оген). Если -аминокапроновая кислота не работает так, как транексамовая кислота, и что как только транексамовая кислота связывается с твердой поверхностью, она проявляет всю свою повышенную плазмин(оген)-связывающую способность (так называемая кооперативность), а смола удаляет из плазмы или из продуктов плазмы только плазмин(оген). Если  -аминокапроновую кислоту присоединяют к колонке, ее повышенная активность в отношении плазмин(оген)а еще остается прежней, но тем не менее она связывает фибриноген и другие белки из плазмы, тогда как согласно изобретению полностью исключается повышенная активность транексамовой кислоты в отношении плазмин(оген)а. Однако сродство смолы с транексамовой кислотой к плазмин(оген)у не изменяется. -аминокапроновую кислоту присоединяют к колонке, ее повышенная активность в отношении плазмин(оген)а еще остается прежней, но тем не менее она связывает фибриноген и другие белки из плазмы, тогда как согласно изобретению полностью исключается повышенная активность транексамовой кислоты в отношении плазмин(оген)а. Однако сродство смолы с транексамовой кислотой к плазмин(оген)у не изменяется.
Ригидную аминокислоту присоединяют к соответствующему связывающему мостику, в частности, более длинному, чем 3 углеродных атома, а носитель и аффинный материал могут удалять плазмин(оген) из смеси, содержащей белки, без дальнейшего изменения состава белкового раствора. Удаление можно проводить в присутствии различных буферов. Способ изобретения также подходит для получения чистых фракций плазмин(оген)а после элюции с аффинного носителя.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к созданию способа специфического удаления или выделения плазмин(оген)а в присутствии фибриногена из смеси, содержащей плазмин(оген), в результате контакта смеси с неподвижной аминокислотой, в которой аминогруппа аминокислоты и карбоксильная группа аминокислоты находятся на расстоянии около 6-8 Ангстрем, предпочтительно около 7 Ангстрем, а неподвижная аминокислота ковалентно связана с носителем через аминогруппу аминокислоты.
Предпочтительно в способе согласно изобретению смесь выбирают из группы, состоящей из жидкостей организма, таких как кровь; из фракций крови, криопреципитата, клеточных культур, экстрактов тканей животных, таких как легкие быка, бычий кишечник, или экстракты костей животных; желатина, бычьего сывороточного альбумина, а также несмешивающихся с водой жиров животного происхождения, таких как ланолин (РС-фосфатидилхолин).
Способ согласно изобретению можно использовать для получения высокоочищенного плазмин(оген)а из соответствующих смесей. После контакта смеси, например, с хроматографирующим веществом, связанным с ригидной аминокислотой, плазмин(оген) можно элюировать с твердого аффинного вещества. Как таковые в данном случае также можно применять известные принципы твердофазной экстракции. Плазмин(оген) можно элюировать раствором, содержащим лиганд, который конкурирует со связывающими участками ригидной аминокислоты, например транексамовой кислоты, за плазмин(оген)овый белок. Такими лигандами обычно являются  -аминокислоты, предпочтительно лизин. Например, лизин можно применять в концентрациях от 0,85 до 0,99% мас. Также возможно использование других концентраций, особенно когда ионная сила элюционной среды уравновешена другими ингредиентами, например электролитами. -аминокислоты, предпочтительно лизин. Например, лизин можно применять в концентрациях от 0,85 до 0,99% мас. Также возможно использование других концентраций, особенно когда ионная сила элюционной среды уравновешена другими ингредиентами, например электролитами.
Плазмин(оген), элюирующийся с твердой фазы, может быть освобожден от элюционного буфера по способу, при котором буферные компоненты экстрагируют, например, диализом. Полученный согласно способу данного изобретения плазмин(оген) характеризуется очень высокой степенью чистоты. Исключительное свойство становится очевидным из следующих данных:
Суммарная таблица 1
Сравнение удельной активности, степени очистки и выхода плазмин(оген)а из криоистощенной FFP-плазмы в предпочтительных условиях нанесения и элюции для каждой из смол |
Использованная
смола |
Способ |
Удельная активность
(мг плазмин(оген)а/
мг белка) |
Степень
очистки |
Выход
(%) |
| ТЕА-сефароза 4В |
2 |
0,794 |
567 |
91,6 |
| Лизин-Ceramic Hyper DF |
2 |
0,444 |
444 |
10,9 |
| Лизин-сефароза 4В |
1 |
0,121 |
101 |
11,6 |
| Суммарная таблица 2: Сравнение удаления плазмин(оген)а из криоистощенной FFP-плазмы в предпочтительных условиях нанесения для каждой смолы |
| Использованная смола |
Способ |
Удаление (%) |
| ТЕА-сефароза 4В |
1 и 2* |
99,5 |
| Лизин-Ceramic Hyper DF |
1 |
54,6 |
| Лизин-сефароза 4В |
1 |
58,0 |
| *Оба способа являются идентичными вплоть до сбора несвязанного пика, включая и саму эту стадию. |
Как можно видеть из суммарной таблицы, когда коммерчески поставляемые смолы с иммобилизованными лизиновыми лигандами и ТЕА-смолу использовали при оптимизированных условиях хроматографии, выход и удельная активность плазмин(оген)а были выше в случае ТЕА-смолы (суммарная таблица 1). Также достойно внимания то, что смола ТЕА оказалась значительно более эффективной при удалении плазмин(оген)а (как показали при исследовании Glu-плазмин(оген)а) из криоистощенной плазмы, чем лизин-смола (суммарная таблица 2).
Чистоту элюатов оценивали с помощью SDS-гель-электрофореза. Элюаты с трех разных смол (ТЕА-сефарозы, Lys-Ceramic Hyper DF и Lys-сефарозы 4В) подвергали SDS-PAGE с использованием 5-12% градиента акриламида и при нанесении 7 мкг белка на дорожку. Полученный гель, окрашенный кумасси голубым, изображен на чертеже.
На чертеже представлен градиентный гелевый SDS-PAGE (5-12% полиакриламид) белков по 7 мкг, элюированных двумя способами (описано в разделе Материалы и методы) с трех разных смол – ТЕА-сефарозы, Lys-Ceramic Hyper DF и Lys-сефарозы 4В. Дорожки: 1 – Glu-плазмин(оген); 2 – фибриноген; 3 – альбумин; 4 – иммуноглобулин G; 5 -стандарт молекулярных масс; Элюционные пики: 6 – способа с использованием ТЕА; 7 – способа 2 с использованием ТЕА; 8 – способа 1 с использованием лизин-Ceramic Hyper D; 9 – способа 1 с использованием лизин-сефарозы; 10 – способа 1 с лизин-Ceramic Hyper D; 11 – способа 1 с использованием лизин-сефарозы.
Полученные белковые зоны и чистота продукта хорошо коррелировали с удельной активностью полазмин(оген)а, которая указана в суммарной таблице 1. Данные показывают, что применение ТЕА-сефарозы дает высокоочищенный плазмин(оген) лишь с минорным загрязнением альбумином. Очевидно, что по клиническим критериям никакой дальнейшей очистки не требуется для применения этого продукта.
Поэтому содержащая плазмин(оген) композиция также является предметом изучения данного изобретения.
Предметом рассмотрения данного изобретения также является носитель, ковалентно связанный с ригидной аминокислотой, причем аминогруппа аминокислоты и карбоксильная группа аминокислоты находятся на расстоянии приблизительно 6-8 Ангстрем, предпочтительно приблизительно 7 Ангстрем.
Предпочтительным для осуществления способа данного изобретения носителем является хроматографическое вещество, которое способно связывать ригидную аминокислоту, в которой аминогруппа аминокислоты и карбоксильная группа аминокислоты находятся на расстоянии около 6-8 Ангстрем, предпочтительно около 7 Ангстрем. Расстояние между аминогруппой и карбоксильной группой, по существу, поддерживается постоянным жесткой структурой аминокислоты. Жесткость аминокислоты может быть получена с помощью алициклических колец, предпочтительно циклогексанового кольца, причем амино- и карбоксильная группы расположены в 1,4-положении алициклического кольца. Также к области, охватываемой данным изобретением, относятся ароматические системы, например, замещенные бензойные кислоты или анилин-замещенная уксусная кислота.
Согласно изобретению носитель предпочтительно связывают с аминокислотами, выбранными из группы, состоящей из транексамовой кислоты и ЕМВОСА.
Хроматографическим веществом, которое применяют согласно способу данного изобретения, является, например, гидрофильное вещество, такое как агароза, целлюлоза, стекло с регулируемой пористостью, силикагели, декстраны или органический синтетический полимер, такой как полимер на основе полиакриламидов, полистиролов. Обычные вещества поставляются коммерчески под торговыми названиями сефакрил® (Pharmacia, Sweden), ультрагель® (Biosepara, France), TSK-гель Toyopearl® (Toso Corp., Japan), HEMA (Alltech Ass. (Deer-field, Il, USA), Eupergit® (Rohm Pharma, Darmstadt, Germany). Также можно использовать материалы, созданные на основе азлактонов (3M, St. Paul, Minn, USA). Особо предпочтительной является агароза® или сефароза®. Названные материалы поставляются коммерчески, например, фирмой Sigma, St. Louis.
В предпочтительном аспекте способ согласно изобретению осуществляют при использовании корпускулярного хроматографического материала из макрочастиц или монолитного блок-вещества. Корпускулярное вещество можно суспендировать в соответствующей среде, и полученную суспензию можно использовать, например, в хроматографической колонке. Однако способ согласно изобретению можно осуществлять порциями. Кроме того, полимеры могут быть использованы в виде корпускулярного вещества или также в форме мембран.
Транексамовую кислоту связывают с носителем предпочтительно через линкер, в частности бифункциональный линкер между носителем и транексамовой кислотой. Если применяют бифункциональный линкер, его можно выбрать из группы, состоящей из N-гидроксисукцинимида, DAPA, CNBr, эпокси, диаминодипропиламина (DADPA), 1,6-диаминогексана, янтарной кислоты, 1,3-диамино-2-пропанола, этилендиамина (EDA), TNB, пиридилсульфида, иодацетамида, активированного малеимидом носителя или их комбинаций.
Для осуществления способа согласно изобретению носитель предпочтительно модифицируют по фрагменту, который взаимодействует с первичными или вторичными аминогруппами.
В соответствии со способом согласно изобретению смесь инкубируют с носителем в течение достаточного периода времени, и после контакта смеси с носителем, связанным с транексамовой кислотой, элюируют нейтральным водным раствором, содержащим соли натрия, соли кальция, буферные соли. Впоследствии плазмин или плазмин(оген) можно элюировать водным раствором, содержащим достаточное количество лизина или эквивалента, который конкурирует с ковалентно связанной транексамовой кислотой.
Предметом изобретения является полученная из природных источников смесь, которая по существу свободна от плазмин(оген)а и плазмина.
В частности, смесью согласно изобретению является кровь, производное крови или фракция крови, криопреципитат.
Производным крови согласно изобретению является, в частности, фактор свертывания крови, полученный из плазмы, или смесь факторов свертывания крови, таких как FVIII, FIX, фибриноген, фибронектин,  1-антитрипсин, антитромбин III, фактор фон Виллебранда, альбумин, иммуноглобулин. 1-антитрипсин, антитромбин III, фактор фон Виллебранда, альбумин, иммуноглобулин.
Кроме того, носитель, содержащий ковалентно связанную транексамовую кислоту, также является предметом данного изобретения. Носитель согласно изобретению предпочтительно является хроматографическим веществом, более предпочтительно – гидрофильным хроматографическим веществом, таким как декстраны или органический синтетический полимер, такой как упомянутые выше. Наиболее предпочтительным носителем является агароза® или сефароза®, с которой связывается транексамовая кислота.
Хроматографический материал, который образует носитель, может быть корпускулярным веществом или монолитным блок-веществом. Последний описан в цитируемой работе Hermanson et al., (Hermanson GT, Mallia AK and Smith PK 1992 “Immobilization Affinity Ligand Techniques” pp. 454 Academic Press, Inc. San Diego, USA).
В другом предпочтительном аспекте согласно изобретению транексамовая кислота связывается с носителем через линкер между носителем и транексамовой кислотой. Благоприятно, когда носитель не имеет функциональных групп, способных ковалентно связывать транексамовую кислоту. В таком случае носитель сначала активируют, а затем вводят в реакцию с линкером, который способен связывать транексамовую кислоту. Спейсерные группы, или привязи, являются низкомолекулярными молекулами, которые применяют как промежуточные линкеры между носителем или матриксом и аффинным лигандом, который в соответствии с изобретением представляет собой аминокислоту, имеющую жесткую структуру и аминогруппу на расстоянии около 6-7 Ангстрем от карбоксильной группы. Предпочтительно спейсерные группы содержат две функциональные группы на обоих концах для легкого взаимодействия с лигандом и носителем. Обычно спейсерная группа представляет собой углеводородное соединение, имеющее на концах две функциональные группы. Один из двух концов ковалентно присоединяется к матриксу с помощью общепринятых или известных реакций. Второй конец ковалентно связывается с лигандом с помощью другого способа присоединения.
Предпочтительно линкером является бифункциональный линкер, такой как N-гидроксисукцинимид, DAPA, CNBr, эпокси, диаминодипропиламин (DADPA), 1,6-диаминогексан, янтарная кислота, 1,3-диамино-2-пропанол, этилендиамин (EDA), TNB, пиридилсульфид, иодацетамид, активированный малеимидом носитель или их комбинации.
Так как большинство активированных носителей поставляется коммерчески, может оказаться полезным начинать с носителя, модифицированного по фрагменту, который взаимодействует с первичными или вторичными аминогруппами.
Кроме того, способ согласно изобретению более подробно описан с использованием в качестве примера получения криопреципитата, по существу свободного от плазмин(оген)а, который может быть исходным материалом для многочисленных продуктов, полученных из крови.
Криопреципитат подвергают аффинной хроматографии с иммобилизованным лигандом, чтобы получить адсорбированную фракцию и неадсорбированную фракцию. Вещество, которое может быть элюировано из адсорбированной фракции, представляет собой плазмин(оген).
Иммобилизованный лиганд может быть любым аналогом, который может взаимодействовать с лизинсвязывающими участками плазмин(оген)а. Способ получения иммобилизованных лигандов, которые используют согласно изобретению, описан ниже. Следующие примеры иллюстрируют изобретение, но не ограничивают его.
ПРИМЕР 1: Иммобилизация различных лигандов  -аминокарбоновых кислот. -аминокарбоновых кислот.
Несколько лигандов  -аминокарбоновых кислот в комбинации с различными спейсерами в нескольких смолах либо получали, либо покупали (если они коммерчески доступны), чтобы оценить удаление плазмин(оген)а из растворов, полученных из плазмы. В следующей таблице суммированы все изученные комбинации (номера смол внизу относятся к разделу, в котором описан ниже синтез для каждой комбинации): -аминокарбоновых кислот в комбинации с различными спейсерами в нескольких смолах либо получали, либо покупали (если они коммерчески доступны), чтобы оценить удаление плазмин(оген)а из растворов, полученных из плазмы. В следующей таблице суммированы все изученные комбинации (номера смол внизу относятся к разделу, в котором описан ниже синтез для каждой комбинации):
| Таблица 1 |
Лиганд
Линкер |
Пара-бензамидин |
Аргинин |
Транексамовая кислота |
 -аминогексаноевая кислота -аминогексаноевая кислота |
Лизин |
| N-гидроксиянтарная |
|
|
|
Сефароза 4В
(1) |
|
| DADPA |
Агароза
4% (2) |
Агароза
4% (3) |
Агароза
4% (4) |
|
|
| CNBr |
|
Сефароза
4В (5) |
Сефароза
4В (6) |
|
|
| Эпокси |
Сефароза
6В (10) |
Сефароза
6В (7) |
Сефароза
6В (8) |
|
Ceramic
Hyper DF
(9) |
1) Сложный N-гидроксисукцинимидный эфир  -аминогексаноевой кислоты-сефароза 4В был произведен на фирме Sigma. -аминогексаноевой кислоты-сефароза 4В был произведен на фирме Sigma.
2) Изготовление пара-аминобензамидин-4% агарозы.
Следующий способ использовали для иммобилизации диаминодипропиламина (DADPA) на 4% агарозе (Pierce), реакция происходила на аминоконцевом связующем геле, который затем модифицировали ангидридом.
25 мл DADPA-агарозного геля промывали очищенной водой, а затем гель суспендировали в равном объеме очищенной воды. Суспензионную смесь медленно перемешивали в течение 1 часа при комнатной температуре, добавляя к нему 2,5 г янтарного ангидрида. В конце перемешивания сукцинилированный гель последовательно промывали очищенной водой, 1 М NaCl и снова очищенной водой, чтобы удалить избыток непрореагировавшей янтарной кислоты.
Негативный тест с TNBS (Sigma) показал, что все амины DADPA были успешно блокированы янтарной кислотой.
Иммобилизованный сукцинилированный DADPA промывали 250 мл очищенной воды, затем избыток воды отсасывали, чтобы высушить до влажного осадка, и переносили в 500-мл химический стакан. Гель повторно суспендировали в 25 мл 0,1 М MES-буфера, рН 4,7 и медленно перемешивали, добавляя 0,25 г пара-аминобензамидина (Sigma) и 0,75 г EDC (Pierce). РН реакционной смеси поддерживали при 4,7 в течение 1 часа, непрерывно добавляя 0,5 М NaOH. Затем реакционную смесь оставляли на ночь при комнатной температуре при постоянном медленном перемешивании.
Гель последовательно промывали 0,5 л каждого из следующих компонентов: очищенной водой, 0,1 М ацетатом натрия, рН 4,7, 0,5 М бикарбонатом натрия и очищенной водой.
Иммобилизованный пара-аминобензамидин хранили до использования в 0,02% азиде натрия при 4°С.
3) Аргинин-4% агароза
Синтез аргинин-4% агарозы проводили в соответствии с вышеописанным способом для пара-аминобензамидин-4% агарозы (см. 2).
4) Транексамовая кислота (ТЕА)-4% агароза
Синтез транексамовой кислоты (ТЕА)-4% агарозы предпочтительно проводили в соответствии с вышеописанной процедурой для пара-аминобензамидин-4% агарозы (см. 2).
5) Аргинин-сефароза 4В
Следующий способ использовали, чтобы иммобилизовать аргинин или транексамовую кислоту на CNBr-сефарозе 4В (Pharmacia) в качестве связующего геля. Синтезы двух лигандов при двух различных концентрациях (10 ммоль или 0,01 ммоль/мл сухого геля) были одинаковыми, как указано в этом и следующем разделах (5-6).
2,5 г CNBr-активированной сефарозы 4В суспендировали в 50 мл 1 мМ HCl. Гель оставляли для набухания в течение 10 минут при комнатной температуре с последующим 15-минутным промыванием 500 мл 1 мМ HCl на агломерированном стеклянном фильтре.
Аргинин растворяли в 12,5 мл связывающего буфера, 0,1 М NaHCO3, pH 8,3, содержащего 0,5 М NaCl. Связывающий раствор, содержащий лиганд, смешивали с гелем в пластиковой пробирке с последующим вращением в течение ночи при 4°С.
В конце инкубации полученную смесь отмывали от избытка лиганда 10 гелевыми объемами связывающего буфера через агломерированный стеклянный фильтр. Белковый раствор промывали 3 циклами по 50 мл буфера при изменении значений рН (0,1 М ацетатный буфер, рН 4, содержащий 0,5 М NaCl, с последующим промыванием 0,1 М трис-HCl-буфером, рН 8, содержащим 0,5 М NaCl). Иммобилизованную аргинин-сефарозу 4В хранили до использования в 0,02% азиде натрия при 4°С.
6) Транексамовая кислота (ТЕА)-сефароза 4В
Этот синтез проводили в соответствии с описанным выше способом для аргинин-сефарозы 4В (см. раздел 5).
7) Аргинин-сефароза 6В
Аргинин в двух различных концентрациях (2 ммоль или 0,2 ммоль/мл сухого геля) присоединяли к коммерческой иммобилизованной эпокси-сефарозе 6В (Pharmacia) следующим образом:
2,5 г эпокси-активированной сефарозы 6В суспендировали в 200 мл очищенной воды. Гель оставляли для набухания приблизительно в течение 5 минут при комнатной температуре, затем промывали в течение 1 часа 500 мл очищенной воды, добавляемой в аликвотах, через агломерированный стеклянный фильтр.
20 мл связывающего буфера (0,1 М NaHCO3, рН 9,3 и 0,5 М NaCl) и набухший гель вливали в две пробирки, содержащие аргинин. Смеси перемешивали в пластиковой пробирке в течение ночи при RT (комнатной температуре).
В конце инкубации полученную смесь отмывали от избытка лиганда 5 гелевыми объемами связывающего буфера через агломерированный стеклянный фильтр. Продукт промывали 3 циклами с изменением рН (0,1 М ацетатный буфер, рН 4,0 и 0,5 М NaCl, с последующим промыванием 0,1 М трис-HCl-буфером, рН 8 и 0,5 М NaCl). Иммобилизованную аргинин-сефарозу 6В хранили до использования в 0,02% азиде натрия при 4°С.
8) Транексамовая кислота (ТЕА)-сефароза 6В
Этот синтез проводили в соответствии с описанным выше способом для аргинин-сефарозы 6В (см. раздел 7).
9) L-Лизин эпоксиактивированный Ceramic Hyper DF-гидрогель приобретали на фирме Sigma.
10) пара-Аминобензамидин, ковалентно присоединенный к сефарозе 6В, приобретали на фирме Pharmacia.
ПРИМЕР 2: Тестирование различных аффинных хроматографических смол для удаления плазмин(оген)а. Объединенный криопреципитат плазмы человека, содержащий 1 МЕ/мл плазмин(оген)а и 50 мг/мл фибриногена, использовали для следующего исследования.
Аликвоты замороженного криопреципитата подвергали оттаиванию при 37°С и диализовали против буфера BN1 (0,12 М NaCl, 10 мМ Tri Na-цитрат, 1 мМ CaCl2 при рН 7,0). Полученный белковый раствор фильтровали через глубокий фильтр 5 мкм, чтобы получить прозрачный раствор. В цилиндр 5-мл шприца с диаметром 8,36 мм вносили 1,5 мл (влажный объем) следующих аффинных смол, описанных в примере 1: иммобилизованная  -аминогексаноевая кислота (Сефароза 4В, использовали CNBr в качестве спейсера), иммобилизованные пара-аминобензамидин/аргинин/ТЕА (4% Агароза, с использованием DADPA в качестве спейсера), иммобилизованные аргинин/ТЕА (Сефароза 4В с использованием CNBr в качестве спейсера), иммобилизованные аргинин/ТЕА (Сефароза 6В с использованием эпокси в качестве спейсера) и иммобилизованный L-лизин (Ceramic Hyper DF-гидрогель с использованием эпокси в качестве спейсера). Оптимизированный способ упаковки геля заключался в следующем: упакованный гель промывали 4 объемами: i) очищенной воды, ii) 1 М NaCl, iii) очищенной воды, iv) буфера TLN 0,1 (0,05 М Трис, 0,02 М лизин, 0,1 М NaCl, рН 9,0), v) буфера TLN 1 (0,05 М Трис, 0,02 М лизин, 1 М NaCl, рН 9,0) и vi) очищенной воды. Все образцы буфера для нанесения и промывания вносили в цилиндр шприца после центрифугирования при 1000 оборотов в минуту в течение 1 минуты при 25°С. Уравновешивание проводили 4 объемами BN1, и предварительно профильтрованный, концентрированный криопреципитат наносили на смолу (2:1, об./об., соответственно), затем полученную смесь инкубировали в течение 1 часа при комнатной температуре. Аликвоты несвязанных «спин»-промывок собирали в пластиковые пробирки после каждого центрифугирования. Смолу промывали по меньшей мере 13 колоночными объемами BN1-буфера до тех пор, пока O.D280 (оптическая плотность) не достигала 0,02. Элюцию плазмин(оген)а проводили буфером TLN 1 с последующим промыванием четырьмя объемами слоя 3 М NaCl. Мини-колонки плотно закрывали и хранили при 4°С. -аминогексаноевая кислота (Сефароза 4В, использовали CNBr в качестве спейсера), иммобилизованные пара-аминобензамидин/аргинин/ТЕА (4% Агароза, с использованием DADPA в качестве спейсера), иммобилизованные аргинин/ТЕА (Сефароза 4В с использованием CNBr в качестве спейсера), иммобилизованные аргинин/ТЕА (Сефароза 6В с использованием эпокси в качестве спейсера) и иммобилизованный L-лизин (Ceramic Hyper DF-гидрогель с использованием эпокси в качестве спейсера). Оптимизированный способ упаковки геля заключался в следующем: упакованный гель промывали 4 объемами: i) очищенной воды, ii) 1 М NaCl, iii) очищенной воды, iv) буфера TLN 0,1 (0,05 М Трис, 0,02 М лизин, 0,1 М NaCl, рН 9,0), v) буфера TLN 1 (0,05 М Трис, 0,02 М лизин, 1 М NaCl, рН 9,0) и vi) очищенной воды. Все образцы буфера для нанесения и промывания вносили в цилиндр шприца после центрифугирования при 1000 оборотов в минуту в течение 1 минуты при 25°С. Уравновешивание проводили 4 объемами BN1, и предварительно профильтрованный, концентрированный криопреципитат наносили на смолу (2:1, об./об., соответственно), затем полученную смесь инкубировали в течение 1 часа при комнатной температуре. Аликвоты несвязанных «спин»-промывок собирали в пластиковые пробирки после каждого центрифугирования. Смолу промывали по меньшей мере 13 колоночными объемами BN1-буфера до тех пор, пока O.D280 (оптическая плотность) не достигала 0,02. Элюцию плазмин(оген)а проводили буфером TLN 1 с последующим промыванием четырьмя объемами слоя 3 М NaCl. Мини-колонки плотно закрывали и хранили при 4°С.
Смолы, которые разрушались во время процесса или удаляли менее 50% плазмин(оген)а, исключали еще в начале исследования. Результаты суммированы в таблице 2.
Таблица 2
Удаление плазмин(оген)а Р
в несвязанном материале с использованием различных иммобилизованных лигандов с буфером BN1 |
| Иммобилизованные лиганды |
Удаление плазмин(оген)а (%) |
 -Аминогексаноевая кислота, использовали CNBr в качестве спейсера -Аминогексаноевая кислота, использовали CNBr в качестве спейсера |
13,36 |
| пара-Аминобензамидин, использовали DADPA в качестве спейсера |
Нет
(колонка упакована) |
| пара-Аминобензамидин, использовали эпокси в качестве спейсера |
19,78 |
| Аргинин, использовали DADPA в качестве спейсера |
6,04* |
| ТЕА (высокая концентрация), использовали CNBr в качестве спейсера |
0 |
| ТЕА (низкая концентрация), использовали CNBr в качестве спейсера |
0 |
| Аргинин (низкая концентрация), использовали CNBr в качестве спейсера |
23,25 |
| Аргинин (низкая концентрация), использовали эпокси в качестве спейсера |
0 |
| Аргинин (высокая концентрация), использовали эпокси в качестве спейсера |
5,61 |
| *Приведенные данные являются средней величиной из трех опытов. |
В вышеприведенной таблице показано, что лучшие лиганды для удаления плазмин(оген)а из криопреципитата содержали аффинные гели, которые были достаточно сильными, чтобы выдержать последствия нанесения, промывания и элюции без сжатия, или гели, которые удерживают более 50% нанесенного фибриногена.
В таблица 3 продемонстрирована как эффективность различных типов гелей при удалении плазмин(оген)а, так и их способность удерживать фибриноген в концентрированном криопреципитате.
Присутствующий в криопреципитате остаточный плазмин(оген) адсорбировался смолами, тогда как фибриноген не адсорбировался, что делает полученный супернатант по существу свободным от плазмин(оген)а.
Содержание фибриногена определяли по времени свертывания, тогда как содержание плазмин(оген)а определяли при исследовании с хромогенным субстратом.
Рассчитанный выход плазмин(оген)а и фибриногена с лизин-гелей служил в качестве золотого стандарта для всех других использованных гелевых лигандов. Результаты, представленные в таблице 2, показывают, что только ТЕА-лиганды с эпокси-спейсером обеспечивали хорошее удаление плазмин(оген)а и высокий выход фибриногена (см. таблицу 3). Высокая концентрация иммобилизованной ТЕА обеспечивала лучшее удаление плазмин(оген)а и сравнимый выход фибриногена по сравнению со связанным с лизином лигандом: выход 89% против 92% в случае фибриногена и 89% против 56% в случае удаления плазмин(оген)а соответственно. Все другие смолы оказались значительно менее эффективными либо при удалении плазмин(оген)а, либо в отношении выхода фибриногена.
Таблица 3
Сводка данных по выходу фибриногена и удалению плазмин(оген)а в несвязанный материал, полученных при использовании различных иммобилизованных лигандов с буфером BN1 |
| Иммобилизованные лиганды |
Удаление плазмин(оген)а (%) |
Выход фибриногена (%) |
Лизин, при использовании
эпокси в качестве спейсера |
56* |
92* |
| ТЕА, при использовании DADP в качестве спейсера |
49 |
84 |
ТЕА (низкая
концентрация), при использовании эпокси в качестве спейсера |
44,35 |
88,62 |
ТЕА (высокая
концентрация), при использовании эпокси в качестве спейсера |
89 |
89 |
| Аргинин (высокая концентрация), при использовании CNBr в качестве спейсера |
91,26 |
49 |
| *Приведенные данные являются средними величинами из трех исследований. |
ПРИМЕР 3: Влияние фосфатного и BN1 буфера на профиль аффинной хроматографии на смоле с иммобилизованным лизином и ТЕА.
Криопреципитат обрабатывали гидроокисью алюминия, чтобы адсорбировать факторы свертывания, зависящие от витамина К, а затем инкубировали со смесью детергентных растворителей (SD-1% Tri (н-бутил)фосфат, 1% тритон Х-100) в течение 4 часов при 30°С, чтобы инактивировать вирусы в липидной оболочке. SD-Реагенты удаляли экстракцией касторовым маслом и хроматографией гидрофобного взаимодействия, препарат впоследствии пастеризовали (10 часов при 60°С) в присутствии сахарозы и глицина в качестве стабилизаторов.
После пастеризации сахарозу и глицин удаляли диафильтрацией. Транексамовую кислоту (ТЕА) и аргинин-гидрохлорид добавляли в качестве стабилизаторов перед фильтрацией в стерильных условиях. Аликвоты стабилизированного продукта хранили до применения при -30°С.
Аликвоты замороженного криопреципитата с инактивированными вирусами подвергали оттаиванию при 37°С и диализовали против буфера BN1 (состоящего из 0,12 М NaCl, 0,01 М Tri Na-цитрата, 1 мМ CaCl2, при рН 7,0) или, альтернативно, против 25 мМ фосфатного буфера. Последний раствор фильтровали через глубокий фильтр 5 мкм, чтобы получить прозрачный раствор.
В колонку, 10 мм в диаметре (Biorad, USA), вносили 6 мл (влажный объем) либо иммобилизованной ТЕА (ТЕА-сефароза 6В), либо иммобилизованного лизина (Ceramic Hyper DF/сефароза 4В) и по очереди промывали 4 объемами каждого из следующих растворов: i) очищенная вода, ii) 1 M NaCl, iii) очищенная вода, iv) буфер TLN 0,1 (0,1 М NaCl, лизин 0,02 М, 0,05 М трис, рН 9,0), v) буфер TLN 1 (1 М NaCl, лизин 0,02 М, 0,05 М трис, рН 9) и vi) очищенная вода. Уравновешивание осуществляли 4 объемами BN1 или, альтернативно, фосфатным буфером. Профильтрованный криопреципитат наносили на колонку при скорости тока 100 мкл/мин.
Образцы несвязанного материала собирали в пластиковые пробирки, а смолу промывали 16 колоночными объемами или буфера BN1, или фосфатного буфера. Элюцию плазмин(оген)а проводили буфером TLN 1 с последующим промыванием четырьмя объемами 3 М раствора NaCl, четырьмя объемами очищенной воды и четырьмя объемами 25% этанола, дополненного 1 М NaCl.
Таблица 4 иллюстрирует эффективность удаления плазмин(оген)а различными видами смол и выход фибриногена. Содержание фибриногена определяли по времени свертывания (анализ Клауса (Clauss)), в то время как содержание плазмин(оген)а определяли с помощью хромогенного субстрата.
Сравнение различных смол показало, что от 95,4 до 96,4% содержания фибриногена оставалось в несвязанном пике при использовании буфера BN1. В противоположность этому, выход фибриногена был низким, если использовали фосфатный буфер. Неожиданно выяснилось, что только смола с иммобилизованной ТЕА обеспечивала как высокую степень очистки от плазмин(оген)а, так и высокий выход фибриногена.
Результаты, полученные на лизин-смоле, также продемонстрировали улучшенную эффективность с буфером BN1 по сравнению с фосфатным буфером.
Таблица 4
Сводка данных, полученных при определении выхода фибриногена и плазмин(оген)а при использовании иммобилизованных смол либо с буфером BN1, либо с фосфатным буфером |
| Иммобилизованные лиганды |
Удаление плазмин(оген)а (%) |
Выход фибриногена
(%) |
ТЕА (высок. конц.)
эпокси+буфер BN1 |
77,1 |
96,4 |
| Лизин-эпокси+буфер BN1 |
68,87 |
95,4 |
Лизин-эпокси+
фосфатный буфер |
100 |
66,9 |
| Лизин CNBr+ буфер BN1 |
62,5 |
121,8 |
Лизин CNBr+
фосфатный буфер |
100 |
62,2 |
ПРИМЕР 4
Аликвоты замороженного криопреципитата с инактивированными вирусами подвергали оттаиванию при 37°С и диализовали против буфера BN1 (0,12 М NaCl, 0,01 М Tri Na-цитрат, 1 мМ CaCl2, при рН 7,0) или, альтернативно, против 25 мМ фосфатного буфера. Последний раствор фильтровали через глубокий фильтр 5 мкм, чтобы удалить нерастворенные вещества.
В колонку, 26 мм в диаметре (Pharmacia, Sweden), вносили 50 мл (влажный объем) иммобилизованной ТЕА (ТЕА-сефароза 6В) и промывали 4 объемами очищенной воды и таким же объемом буфера TLN 0,1 (0,1 М NaCl, лизин 0,02 М, 0,05 М трис, рН 9,0), буфера TLN 1 (1 М NaCl, лизин 0,02 М, 0,05 М трис, рН 9) и очищенной водой. Уравновешивание осуществляли 4 объемами буфера BN1 (NaCl, Tri Na-цитрат, CaCl2, рН 7,0) и отфильтрованный ВАС пропускали через колонку при скорости тока 700 мкл/мл.
Образцы несвязанного материала собирали в пластиковые чашки, а смолу промывали по меньшей мере 3 гелевыми объемами буфера BN1. Элюцию плазмин(оген)а осуществляли буфером TLN 1 с последующим промыванием 3 М NaCl.
Несвязанные фракции от двух пропусканий объединяли и хранили при 4°С до концентрирования. Наконец, ВАС концентрировали приблизительно до первоначального объема диафильтрацией, используя мембрану, отсекающую 100, и против буфера В1 (глицин, NaCl, Tri Na-цитрат, CaCl2, рН 7) с последующим фильтрованием через 0,45 мкм фильтр. К фильтрату добавляли 2% аргинин.
Для контроля стабильности полученный продукт фильтровали в стерильных условиях через 0,2 мкм фильтр.
Как показано в таблице 5, использование более крупной и более длинной колонки улучшало эффективность ТЕА-лиганда, выход фибриногена составлял 100%, а удаление плазмин(оген)а оказалось ниже определяемого уровня при исследовании плазмин(оген)а хромогенным способом.
При сравнении продукта до и после диафильтрации выявили, что содержание фибриногена снижается на 33%. Этот феномен можно объяснить техническими проблемами, которые возникают только при обработке небольших количеств. Смола с иммобилизованной ТЕА несомненно обеспечивала как хорошее удаление плазмин(оген)а, так и хороший выход фибриногена.
Таблица 5
Сводка данных, полученных при определении выхода фибриногена и плазмин(оген)а в несвязанный пик. Каждый пункт данных представляет собой среднюю величину из двух пропусканий |
| Проба |
Выход фибриногена (%) |
Выход плазмин(оген)а (%) |
| После нанесения |
100 |
0 |
После нанесения и
диафильтрации |
66,2 |
0* |
| *Выход плазмин(оген)а после того как объединенную пробу концентрировали в 3,7 раз. |
Никакой оставшейся ТЕА не обнаруживали как в элюированном белковом растворе, так и в концентрированном ультрафильтрацией продукте. Анализы остаточного уровня транексамовой кислоты осуществляли с помощью ВЭЖХ.
Проводили четыре дополнительных эксперимента по удалению плазмин(оген)а, используя одну и ту же смолу и такие условия пропускания, как описано выше (пример 4). Вообще результаты для всех исследованных проб оказались подобными первым результатам, представленным выше.
Никакой оставшейся ТЕА не обнаруживали как в элюированном белковом растворе, так и в концентрированном ультрафильтрацией продукте. Анализы остаточного уровня транексамовой кислоты осуществляли с помощью ВЭЖХ.
Не наблюдали никакой адгезии ни в случае полосок перед удалением плазмин(оген)а, ни после того как его исследовали на крысиной модели.
Криопреципитат до и после удаления плазмин(оген)а исследовали в отношении деградации во время его инкубации при комнатной температуре. Данные, выраженные как процент коагулированных белков (по поглощению в УФ), для различных проб представлены в таблице 6.
Таблица 6
Процент коагулированных белков после инкубации при комнатной температуре концентрированного криопреципитата после двойной инактивации вирусов до и после удаления плазминогена на эпокси-сефарозе 6В, связанной с транексамовой кислотой |
| Время инкубации (недели) |
| |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
| До обработки |
62,91 |
0 |
0 |
0 |
0 |
0 |
0 |
| После обработки |
73,44 |
70,80 |
68,24 |
65,6 |
63,69 |
63,84 |
62,46 |
Исследования стабильности проводили на полосках, которые готовили из криопреципитата до и после удаления плазмин(оген)а, с последующей инкубацией при 37°С в присутствии буфера. Названные полоски обрабатывали добавлением или без добавления глицина и/или аргинина. Результаты суммированы в таблице 7 ниже.
Таблица 7
Время деградации на полосках до и после удаления плазмин(оген)а |
| Приготовление |
Время деградации полосок (дни) |
| 0 |
1 |
2 |
3 |
4 |
5 |
6 |
| До обработки |
+++ |
|
|
|
|
|
|
До обработки+
2% аргинин |
+++ |
– |
– |
– |
– |
– |
– |
До обработки+
2% аргинин+
1% глицин |
+++ |
– |
– |
– |
– |
– |
– |
| После обработки |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
– |
| После обработки+2% аргинин+1% глицин |
+++ |
+++ |
+++ |
+++ |
+++ |
+++ |
– |
+++ Этот набор данных означает наличие полоски.
– Этот набор данных означает деградацию полоски. |
1. Исследования, описанные в следующих примерах, проводили на криоистощенной объединенной свежезамороженной плазме от нормальных здоровых доноров. Вследствие высокой концентрации антиплазмина и небольшого количества плазмина у нормальных здоровых доноров (1) плазмин не может быть определен с помощью функционального (хромогенного) способа (Schreiber AD, Kaplan AP, Austen KF, Plasma inhibitors of the components of the fibrinolytic pathway in man. J. Clin. Invest 52: 1394-1401, 1973). Следовательно, невозможно продемонстрировать удаление, очистку и выход с ТЕА-смолы плазмина из образцов плазмы здоровых доноров. Однако коммерческий ELISA-набор для определения очень низких количеств Glu-плазмин(оген)а и, как было установлено в предыдущих исследованиях, ТЕА-смола характеризуются одинаковым сродством к обеим формам плазмин(оген)а, а также плазмина (Fredenburgh JP, Nesheim ME. Lys-plasmin(ogen) is a significant intermediate in the activation of Glu-plasmin(ogen) during fibrinolysis in vitro. J. Biol. Chem. 267. 26150-6. 1992 и Miyashita C, Wenzel E., Heiden M. Plasmin(ogen): a brief introduction into ist biochemistry and function. Haemostasis 1:7-13, 1988).
2. Таким образом, определение glu-плазмин(оген)а можно использовать как показатель общего плазмин(оген)а в плазме.
ПРИМЕР 5
Стадия хроматографии.
Исследования проводили, чтобы установить эффективность ТЕА, иммобилизованной на сефарозе 4FF, при удалении плазмин(оген)а из криоистощенной свежезамороженной плазмы (FFP), содержащей 1 МЕ/мл плазмин(оген)а. Аликвоты криоистощенной свежезамороженной плазмы подвергали оттаиванию при 37°С и фильтровали через 3 мкм глубокий фильтр, чтобы удалить нерастворимые белки.
В колонку, 10 мм в диаметре (Pharmacia, Sweden), вносили 2 мл (влажный объем) иммобилизованной ТЕА и промывали 4 объемами очищенной воды и таким же объемом буфера TLN 0,1 (0,1 М NaCl, 0,02 М лизин, 0,05 М трис, рН 9,0), буфера TLN 1 (1 М NaCl, лизин 0,02 М, 0,05 М трис, рН 9,0) и очищенной водой. Уравновешивание осуществляли 4 объемами буфера BN1 (0,12 М NaCl, 0,01 М Tri Na-цитрат, 1 мМ CaCl2, рН 7,0), и отфильтрованную плазму (20 МЕ плазмин(оген)а) пропускали через колонку при скорости тока 1 мл/мл.
Протекающий через колонку материал собирали и замораживали в пластиковом флаконе, а смолу промывали по меньшей мере 3 колоночными объемами буфера BN1. Элюцию плазмин(оген)а осуществляли буфером TLN-1 с последующим промыванием приблизительно тремя объемами 3 М раствора NaCl, двумя объемами очищенной воды и двумя объемами 20% этанола + 1 М NaCl (способ 1). По второму способу (способ 2) выполняли такую же процедуру, которую использовали для способа 1, но с дополнительным промыванием 3 М NaCl перед элюцией плазмин(оген)а.
Аналитические исследования.
Способ определения Glu-плазмин(оген)а: ELISA-набор для Glu-плазмин(оген)а, имунклон, (Imunclone®) (American Diagnostica, Greenwich, CT, USA), использованный в описываемых экспериментах, представляет собой иммуноферментный сэндвич-анализ, специфичный для определения уровней нативного плазмин(оген)а человека. Количественный порог анализа (в соответствии с наиболее низким стандартом калибровочной кривой) в плазме или производных плазмы составляет 0,063 мкг/мл.
Активность плазмина: фибринолитическое исследование проводили полуколичественным определением активности плазмина в элюатах. Кратко, свободный от фибриногена плазмин(оген) (Enzyme Research) инкубировали с разными концентрациями нормальной объединенной плазмы (Unicalibrator, Stago) или очищенного плазминогена, элюированного с аффинных колонок, в присутствии избытка стрептокиназы. Время, в течение которого завершалась деградация сгустка, регистрировали и сравнивали с полной деградацией сгустка в образце.
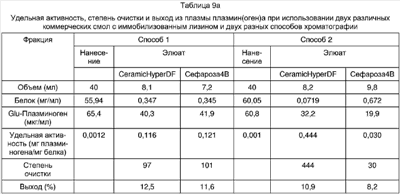
Определение белка: Общий белок анализировали, используя метод Бредфорда (Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72: 248-54, 1976). В таблицах 8а и 8b представлены результаты хроматографического удаления и очистки Glu-плазмин(оген)а плазмы человека с помощью ТЕА-лиганда. В таблице 8а суммированы данные, полученные при очистке плазмин(оген)а. В таблице показано, что способ 2 дает несколько лучшую очистку плазмин(оген)а, чем способ 1, с очисткой в 567-раз и выходом 91,6%. В таблице 8b показано, что в среднем 99,5% плазмин(оген)а удаляли из несвязанной фракции, большей частью составленных количеством, полученным в элюате (таблица 8а).
Таблица 8а
Влияние дополнительного промывания ТЕА-смолы 3 М хлоридом натрия (способ 1 по сравнению со способом 2) на удельную активность, очистку и выход плазмин(оген)а из плазмы |
| |
Способ 1 |
Способ 1 |
Способ 2 |
Способ 2 |
| Фракция |
Исходный материал |
Элюат |
Исходный материал |
Элюат |
| Объем (мл) |
40 |
13,2 |
40 |
20 |
| Белок (мг/мл) |
46,96 |
0,291 |
55,41 |
0,180 |
Glu-плазмин(оген)
(мкг/мл) |
65,4 |
18,2 |
78,0 |
142,9 |
Плазмин(оген)
(МЕ/мл) |
Не проводили |
0,5 |
1 |
Удельная активность
(мг плазмин(оген)а/
мг белка) |
0,0014 |
0,625 |
0,0014 |
0,794 |
| Степень очистки |
446 |
567 |
Выход плазмин(оген)а,
% |
91,8 |
91,6 |
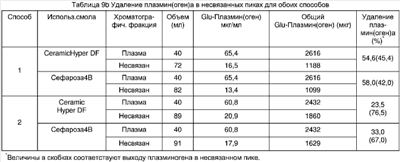
Таблица 8b
Удаление плазмин(оген)а из плазмы (среднее значение результатов для двух способов)* |
| Способ |
Хроматогра-
фическая фракция |
Glu-
Плазмин(оген) (среднее,
мкг/мл) |
Объем
(средний, мл) |
Удаление плазмин(оген)а
(%) |
| 1 & 2* |
Плазма |
71,7 |
40,0 |
99,5 |
| |
Несвязанная фракция |
0,18 |
83,5 |
| *Способы 1 и 2 являются идентичными и включающими сбор несвязанной (протекающей) фракции. |
ПРИМЕР 6: Влияние условий хроматографии на эффективность лизин-иммобилизованного лиганда при аффинной очистке плазмин(оген)а.
Стадия хроматографии.
Изучали аффинную очистку с применением смолы с иммобилизованным лизиновым лигандом, используя две коммерческие лизин-смолы. Использовали способ хроматографии, представленный в литературе (см. Robbins KC, Summaria L. Plasmin(ogen) and Plasmin. Methods Enzymol. 45: 257-73, 1976., для способа 2, описанного ниже), и способ, разработанный в лаборатории авторов изобретения (способ 1, ниже).
Каждую из двух смол с иммобилизованным лизином (Ceramic Hyper DF получены с помощью Biosepra и сефарозы 4В производства фирмы Pharmacia) вносили в колонки с диаметром 10 мм (Pharmacia, Sweden). Каждая колонка содержала 2 мл (влажный объем) смолы.
Аликвоты криоистощенной свежезамороженной плазмы подвергали оттаиванию при 37°С и фильтровали через глубокий фильтр 3 мкм, чтобы получить прозрачный раствор.
Стадию хроматографии проводили, используя один из следующих способов:
Способ 1
Колонку промывали 4 объемами каждого из следующих растворов: 1) очищенной воды, 2) TLN-0,1, 3) TLN-1 и 4) очищенной воды. Уравновешивание осуществляли 4 объемами BN1. Отфильтрованную плазму (40 мл) наносили на колонку при скорости тока 1 мл/мин. Образцы протекающего через колонку материала собирали в пластиковые флаконы, а смолу промывали буфером BN1. Элюцию плазмин(оген)а проводили буфером TLN-1 с последующим промыванием 3 М раствором NaCl, 2 объемами очищенной воды и 2 объемами 20% этанола+1 М NaCl.
Способ 2: (ссылка 5)
Аликвоты криоистощенной свежезамороженной плазмы (40 мл) фильтровали через фильтр глубиной 3 мкм. К 40 мл отфильтрованной плазмы добавляли 4 мл 0,5 М триса, 0,2 М лизина, 1 М NaCl-буфера, рН 9.
Колонку промывали 4 колоночными объемами очищенной воды и уравновешивали 0,1 М фосфатным буфером, рН 7,4. Разбавленную плазму пропускали через смолу со скоростью 1 мл/мин. Образцы несвязанного материала собирали в пластиковые флаконы, и смолу промывали 0,1 М фосфатным буфером, рН 7,4 до тех пор, пока оптическое поглощение вытекающей жидкости при 280 нм не достигало базисной величины. Затем плазмин(оген) элюировали 0,2 М  -аминокапроновой кислотой, растворенной в 0,1 М фосфатном буфере, рН 7,4, и собирали в пластиковую чашку. За элюцией следовало промывание приблизительно 2 объемами 3 М раствора NaCl и очищенной воды. -аминокапроновой кислотой, растворенной в 0,1 М фосфатном буфере, рН 7,4, и собирали в пластиковую чашку. За элюцией следовало промывание приблизительно 2 объемами 3 М раствора NaCl и очищенной воды.
В таблицах 9а и 9b сравнивают удаление и очистку плазмин(оген)а с помощью двух коммерческих смол с иммобилизованным лизином, используя для каждой смолы два различных способа очистки. Хотя имеется относительно небольшое различие в выходе плазмин(оген)а в элюаты (табл. 9а), можно видеть, что при использовании способа 2 и смолы Ceramic Hyper DF достигается более высокая очистка плазминогена.
Результаты показали, что при применении смолы Lys-Ceramic Hyper DF и хроматографического способа 2 удавалось достичь 444-кратной очистки. Кроме того, большую часть плазмин(оген)а исходного материала получали во фракциях пика (76,5% в несвязанной фракции + 10,9% в элюате, приблизительно только 10% нанесенного плазмин(оген)а остается неучтенным). Однако удаление плазмин(оген)а из несвязанной фракции составляло только 23,5%.
Формула изобретения
1. Способ специфического удаления плазминогена из смеси, содержащей данное вещество и фибриноген, путем нанесения указанной смеси на хроматографическую колонку, содержащую нерастворимую матрицу для хроматографии, ковалентно сшитую с транексамовой кислотой, промывки колонки нейтральным водным раствором, содержащим соли, и сбора несвязавшегося материала, причем транексамовая кислота связана с матрицей через аминогруппу с помощью линкера, длина которого составляет более 3 атомов углерода.
2. Способ по п.1, отличающийся тем, что смесь выбрана из группы, состоящей из жидкостей организма, таких как кровь; из фракций крови, криопреципитата, клеточных культур, экстрактов тканей животных, таких как легкие быка, бычий кишечник, или экстрактов костей животных, а также несмешивающихся с водой животных жиров.
3. Способ по п.1, отличающийся тем, что матрица для хроматографии представляет собой хроматографическое вещество, которое является гидрофильным веществом, таким как агароза, целлюлоза, стекло с регулируемыми порами, силикагель, декстран или органический синтетический полимер, такой как полимер на основе полиакриламидов-полистиролов.
4. Способ по п.1, отличающийся тем, что матрица для хроматографии представляет собой хроматографическое вещество, которое является агарозой или сефарозой.
5. Способ по п.1, отличающийся тем, что матрица для хроматографии представляет собой хроматографическое вещество, которое является корпускулярным веществом или монолитным блок-материалом.
6. Способ по п.1, отличающийся тем, что линкер является бифункциональным линкером.
7. Способ по п.6, отличающийся тем, что бифункциональный линкер выбран из группы, состоящей из N-гидроксисукцинимида, DAPA, 1,6-диаминогексана, янтарной кислоты, TNB, пиридилдисульфида или их комбинаций.
8. Способ по п.1, отличающийся тем, что смесь после нанесения на хроматографическую колонку инкубируют с указанной матрицей в течение периода времени, достаточного для того, чтобы связать плазминоген.
9. Нерастворимая матрица для очистки смеси, содержащей плазминоген и фибриноген, от плазминогена с помощью аффинной хроматографии, представляющая собой нерастворимую матрицу для хроматографии, которая ковалентно сшита с транексамовой кислотой через аминогруппу указанной аминокислоты с помощью линкера, длина которого составляет более трех атомов углерода.
10. Нерастворимая матрица по п.9, отличающаяся тем, что нерастворимая матрица для хроматографии представляет собой хроматографическое вещество.
11. Нерастворимая матрица по п.10, отличающаяся тем, что хроматографическое вещество является гидрофильным веществом, таким как агароза, целлюлоза, стекло с регулируемыми порами, силикагель, декстран или органический синтетический полимер, такой как полимер на основе полиакриламидов-полистиролов.
12. Нерастворимая матрица по п.10, отличающаяся тем, что хроматографическое вещество является агарозой или сефарозой.
13. Нерастворимая матрица по п.10, отличающаяся тем, что хроматографическое вещество является корпускулярным веществом или монолитным блок-материалом.
14. Нерастворимая матрица по п.9, отличающаяся тем, что линкер является бифункциональным линкером.
15. Нерастворимая матрица по п.9, отличающаяся тем, что бифункциональный линкер выбран из группы, состоящей из N-гидроксисукцинимида, DAPA, 1,6-диаминогексана, янтарной кислоты, TNB, пиридилсульфида или их комбинаций.
РИСУНКИ
|
|