Патент на изобретение №2344134
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) 1,1,2,2-ТЕТРА (ГЕТЕРО) АРИЛЭТАНЫ ИЛИ 1,1,2-ТРИ (ГЕТЕРО) АРИЛ-2-ГЕТЕРОЦИКЛИЛЭТАНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КАЛИЕВЫХ КАНАЛОВ
(57) Реферат:
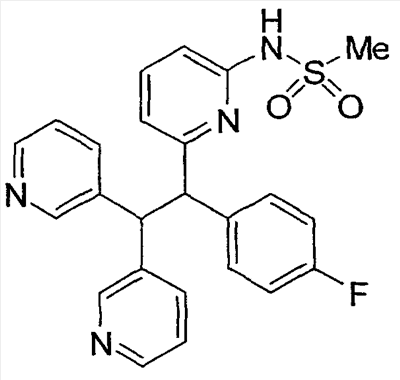
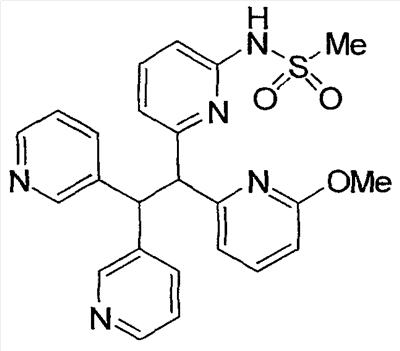
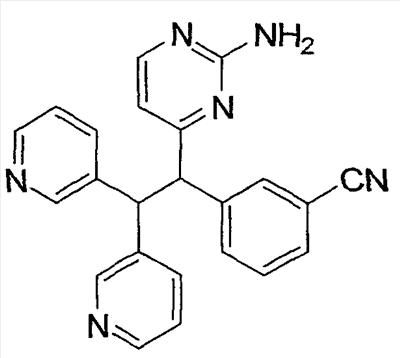
Настоящее изобретение относится к соединениям, выбранным из группы, состоящей из (R)-N-{6-[1-(4-фторфенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (S)-N-{6-[1-(4-фторфенил])-2,2-дипиридин-3-илэтил] пиридин-2-ил}метансульфонамида, (R)-N-{6-[1-(3-цианофенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (S)-N-{6-[1-(3-цианофенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (R)-N-{6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (S)-N-{6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (R)-3-[1-(2-аминопиримидин-4-ил)-2,2-дипиридин-3-илэтил]бензонитрила и (S)-3-[1-(2-аминопиримидин-4-ил)-2,2-дипиридин-3-илэтил]бензонитрила, а также к способу лечения состояния у млекопитающего, лечение которого осуществляют или облегчают ингибированием KV1.5, к фармацевтическому препарату с ингибирующим в отношении Kv1.5 действием и к фармацевтической композиции, обладающей ингибирующим в отношении Kv1.5 действием. Технический результат: получены новые соединения, которые могут найти свое применение в качестве ингибиторов калиевого канала для лечения сердечных аритмий. 4 н. и 2 з.п. ф-лы.
(56) (продолжение): CLASS=”b560m”CHEMISTRY. Vol.56, no. 7, 2003, pages 657-664. R. HABERL et al. 1,2-di-.alphy.-pyridyl-1,2-diphenylethane. MONATSHEFTE FUER CHEMIE. Vol.88, 1957, p.47-51. W.CZUBA. Effects of substituent groups on the rearrangement of 3-nitroaminopyridine derivatives. BULLETIN DE L
Настоящее описание относится, в широком смысле, к соединениям, которые используют в качестве ингибиторов калиевого канала. Соединения этого класса могут быть использованы в качестве антагонистов Kvl.5 для лечения и предотвращения сердечных аритмий и т.п. Предсердная фибрилляция (AF) представляет собой наиболее распространенную стабильную (стойкую) сердечную аритмию в клинической практике и, вероятно, уровень распространения этого заболевания растет вместе со старением населения. Хотя AF редко имеет летальный исход, это заболевание может ослабить кардиальную функцию и привести к осложнениям, таким как развитие застойной сердечной недостаточности, тромбоэмболия или фибрилляция желудочков. Доступные в настоящее время антиаритмические средства были разработаны для лечения желудочковой экстрасистолии и предсердной/суправентрикулярной аритмии. Злокачественная желудочковая экстрасистолия непосредственно угрожает жизни пациента и требует неотложной медицинской помощи. Фармакотерапия для желудочковой экстрасистолии включает антиаритмические средства класса Ia (например, прокаинамид, хинидин), класса Ic (например, флекаинид, пропафенон) и класса III (амиодарон), прием которых приводит к достоверным рискам возникновения проаритмии. Эти лекарственные средства классов I и III, как было показано, конвертируют AF в синусовый ритм и предотвращают рецидив AF (Mounsey, JP, DiMarco, JP, Circulation, 102:2665-2670), однако они являются провоцирующим фактором развития желудочковой проаритмии с потенциально возможным летальным исходом и тем самым могут способствовать росту смертности (Pratt, CM, Moye, LA, Am J. Cardiol, 65:20B-29B, 1990; Waldo et al., Lancet, 348:7-12, 1996; Torp-Pedersen et al., Expert Opin. Invest. Drugs, 9:2695-2704, 2000). Эти результаты наблюдений отчетливо демонстрируют неудовлетворенную потребность в разработке безопасных и более эффективных лекарственных средств для лечения предсердных аритмий. Антиаритмические средства класса III вызывают селективное пролонгирование APD без существенного угнетения проводящей системы сердца или сократительной функции миокарда. Единственным селективным лекарственным средством класса III, разрешенным для клинического использования в лечении предсердной фибрилляции, является дофетилид, который опосредует свои антиаритмические действия путем блокирования IKr, быстро активирующего компонента IK, обнаруженного как в предсердии, так и в желудочке (сердца) у людей (Mounsey, JP, DiMarco, JP, Circulation, 102:2665-2670). Поскольку блокаторы IKr увеличивают APD и резистентность как в предсердиях, так и желудочке, не воздействуя на проводимость per se, то теоретически они представляют собой потенциально полезные средства для лечения аритмий, подобных AF (Torp-Pedersen, et al., Expert Opin. Invest. Drugs, 9:2695-2704, 2000). Однако эти средства, в основном, ответственны за повышение риска развития проаритмии при урежении сердечных сокращений. Сверхбыстрый запаздывающий выпрямленный K+ ток, IKur, был обнаружен, специфически, в предсердии человека и не обнаружен в желудочке. Молекулярным коррелятом IKur в предсердии человека является калиевый канал, обозначаемый Kvl.5. Считают, что IKur вносит существенный вклад в реполяризацию в человеческом предсердии. Следовательно, специфический блокатор IKur, т.е. соединение, которое блокирует Kvl.5, вероятно, мог бы преодолеть недостаток других соединений путем пролонгирования реполяризации через замедление реполяризации в предсердии человека, не вызывая замедления желудочковой реполяризации, которая лежит в основе аритмогенных следовых деполяризаций и синдрома приобретенного удлинения интервала QT, наблюдаемых во время лечения современными лекарственными средствами класса III. Блокаторы Kvl.5, обладающие этими свойствами, были описаны в (Peukert et al., J. Med. Chem., 46:486-498, 2003; Knobloch et al., Naunyn-Schmedieberg’s Arch. Pharmacol. 366:482-287, 2002; Merck & Co., Inc. WO 0224655, 2002). Соединения, описанные в данном изобретении, представляют собой новый структурный класс антагониста Kvl.5. Краткое изложение существа изобретения Данное изобретение относится к соединениям формулы I, которые проявляют антагонизм в отношении калиевого канала Kvl.5:
Соединения по данному изобретению применяют для лечения и предупреждения аритмий сердца и т.п. В пределах объема данного изобретения также находятся фармацевтические препараты (составы), содержащие соединение формулы I и фармацевтический носитель. Детальное описание изобретения Данное изобретение относится к соединениям формулы I, которые являются антагонистами калиевого канала Kvl.5:
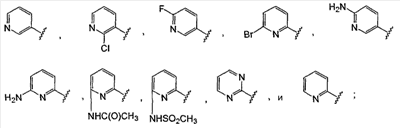
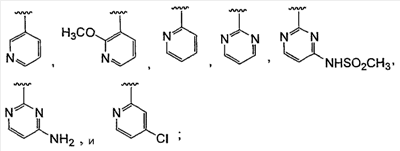
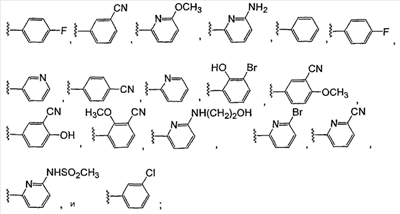
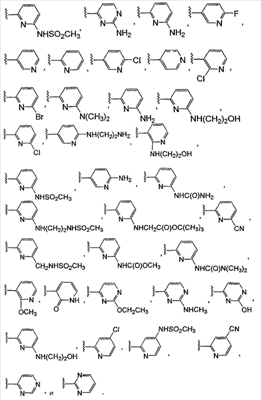
где: А, В и С независимо выбраны из группы, состоящей из: 1) арильного кольца, и 2) гетероарильного кольца, где точкой присоединения к гетероарильному кольцу является атом углерода и гетероарильное кольцо выбрано из группы, состоящей из: а) 5-членной ненасыщенной моноциклической структуры с 1, 2, 3 или 4 гетероатомами в цикле, выбранными из группы, состоящей из N, О или S, b) 6-членной ненасыщенной моноциклической структуры с 1, 2, 3 или 4 гетероатомами в цикле, выбранными из группы, состоящей из N, О или S, и c) 8-, 9- или 10-членной ненасыщенной бициклической структуры с 1, 2, 3 или 4 гетероатомными циклическими атомами, выбранными из группы, состоящей из N, О или S, указанное арильное и гетероарильное кольцо является незамещенным, монозамещенным R4, дизамещенным группами, независимо выбранными из R4, тризамещенным группами, независимо выбранными из R4, или тетразамещенным группами, выбранными из R4, и где любой стабильный атом S или N гетероарильного или гетероциклического кольца является незамещенным или замещенным оксо, причем замещения R4 указанного гетероарильного кольца находятся на одном или нескольких атомах углерода гетероарильного кольца; при условии, что, по крайней мере, один из (заместителей) А, В и С представляет собой гетероарильное кольцо; D выбран из группы, состоящей из: 1) арильного кольца, 2) гетероарильного кольца, где точкой присоединения к гетероальному кольцу является атом углерода и гетероарильное кольцо выбрано из группы, состоящей из: а) 5-членной ненасыщенной моноциклической структуры с 1, 2, 3 или 4 гетероатомами в цикле, выбранными из группы, состоящей из N, О или S, b) 6-членной ненасыщенной моноциклической структуры с 1, 2, 3 или 4 гетероатомами в цикле, выбранными из группы, состоящей из N, О или S, и c) 8-, 9- или 10-членной ненасыщенной бициклической структуры с 1, 2, 3 или 4 гетероатомными циклическими атомами, выбранными из группы, состоящей из N, О или S, и 3) (4-6)-членного насыщенного гетероциклического кольца с 1, 2 или 3 гетероатомами в кольце, выбранными из группы, состоящей N, О и S, где точкой присоединения к гетероциклическому кольцу является атом углерода, указанное арильное, гетероарильное, насыщенное гетероциклическое кольцо является незамещенным, монозамещенным R4, дизамещенным группами, независимо выбранными из R4, тризамещенным группами, независимо выбранными из R4, или тетразамещенным группами, независимо выбранными из R4, и где любой стабильный атом S или N гетероарильного или гетероциклического кольца является незамещенным или замещенным оксо, причем замещения R4 указанного гетероарильного кольца находятся на одном или нескольких атомах углерода гетероарильного кольца; X и Y независимо выбраны из группы, состоящей из H и OR5; Ra, в каждом случае, в котором он появляется, независимо выбран из группы, состоящей из водорода, C1-С6алкила и галогена; R4, в каждом случае, в котором он появляется, независимо выбран из группы, состоящей из водорода, галогена, CN, CR4=C(R5)2, (CRа 2)nOR5, (CRа 2)nN(R5)2, (CRа 2)nC(O)R5, N(R5)C(O)R5, C(O)OR5 и N(R5)S(O)mR5; R5, в каждом случае, в котором он появляется, независимо выбран из группы, состоящей из водорода, незамещенного или замещенного C1-С6алкила, незамещенного или замещенного C3-C10циклоалкила, незамещенного или замещенного арила и незамещенного или замещенного гетероциклила; m равно, независимо, 0, 1 или 2; и n равно, независимо, 0, 1, 2, 3, 4, 5 или 6. Выражение “при условии, что, по крайней мере, один из (заместителей) А, В и С представляет собой гетероарильное кольцо” означает, что изобретение не включает соединения, в которых A, B и С представляют собой одновременно арил. Соединения по данному изобретению включают соединения, в которых любой один из А, В и С представляет собой гетероарильное кольцо, соединения, в которых два из А, В и С представляют собой гетероарильные кольца, и соединения, в которых все три из А, В и С представляют собой гетероарильные кольца. Вариантом (осуществления) изобретения является соединение, где A представляет собой гетероарильное кольцо, где точкой присоединения к гетероарильному кольцу является атом углерода, где гетероарильное кольцо представляет собой 6-членную ненасыщенную моноциклическую структуру с 1 или 2 атомами N в цикле, указанное гетероарильное кольцо является незамещенным, моно-замещенным R4, дизамещенным группами, независимо выбранными из R4, тризамещенным группами, независимо выбранными из R4, или тетразамещенным группами, выбранными из R4, и где любой стабильный атом N гетероарильного кольца является незамещенным или замещенным оксо, причем замещения R4 указанного гетероарильного кольца находятся на одном или нескольких атомах углерода гетероарильного кольца; В представляет собой гетероарильное кольцо, где точкой присоединения к гетероарильному кольцу является атом углерода, и гетероарильное кольцо представляет собой 6-членную ненасыщенную моноциклическую структуру с 1 или 2 атомами N, указанное гетероарильное кольцо является незамещенным, монозамещенным R4, дизамещенным группами, независимо выбранными из R4, тризамещенным группами, независимо выбранными из R4, или тетразамещенным группами, выбранными из R4, и где любой стабильный атом N гетероарильного кольца является незамещенным или замещенным оксо, причем замещения R4 указанного гетероарильного кольца находятся на одном или нескольких атомах углерода гетероарильного кольца; С выбран из группы, состоящей из 1) арильного кольца, и 2) гетероарильного кольца, где точкой присоединения к гетероарильному кольцу является атом углерода, где гетероарильное кольцо представляет собой 6-членную ненасыщенную моноциклическую структуру с 1 атомом N, указанное арильное и гетероарильное кольцо является незамещенным, монозамещенным R4, дизамещенным группами, независимо выбранными из R4, тризамещенным группами, независимо выбранными из R4, или тетразамещенным группами, выбранными из R4, и где любой стабильный атом N гетероарильного или гетероциклического кольца является незамещенным или замещенным оксо, причем замещения R4 указанного гетероарильного кольца находятся на одном или нескольких атомах углерода гетероарильного кольца; и D представляет собой гетероарильное кольцо, где точкой присоединения к гетероарильному кольцу является атом углерода, и гетероарильное кольцо представляет собой 6-членную ненасыщенную моноциклическую структуру с 1 или 2 атомами N в цикле, и указанное гетероарильное кольцо является незамещенным, монозамещенным R4, дизамещенным группами, независимо выбранными из R4, тризамещенным группами, независимо выбранными из R4, или тетразамещенным группами, выбранными из R4, и где любой стабильный атом N гетероарильного кольца является незамещенным или замещенным оксо, причем замещения R4 указанного гетероарильного кольца находятся на одном или нескольких атомах углерода гетероарильного кольца. Предпочтительным вариантом данного изобретения является соединение, где X выбран из группы, состоящей из водорода и -OH; Y выбран из группы, состоящей из водорода и -OH; A выбран из группы, состоящей из В выбран из группы, состоящей из С выбран из группы, состоящей из D выбран из группы, состоящей из Примером соединения по данному изобретению является соединение, выбранное из группы, состоящей из (R)-N-{6-[1-(4-фторфенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (S)-N-{6-[1-(4-фторфенил])-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (R)-N-{6-[1-(3-цианофенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (S)-N-{6-[1-(3-цианофенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (R)-N-{6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (S)-N-{6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (R)-3-[1-(2-аминопиримидин-4-ил)-2,2-дипиридин-3-илэтил]бензонитрила и (S)-3-[1-(2-аминопиримидин-4-ил)-2,2-дипиридин-3-илэтил]бензонитрила. Вышеперечисленные соединения являются активными в одном или нескольких анализах на Kvl.5, описанных ниже. Другой вариант осуществления изобретения представляет собой способ лечения или предотвращения состояния у млекопитающего, лечение или предотвращение которого осуществляют или облегчают ингибированием KVl.5, который включает введение эффективного при ингибировании Kvl.5 количества соединения формулы I. Предпочтительным вариантом является способ лечения или предотвращения сердечных аритмий, например предсердной фибрилляции, трепетания предсердий, аритмии предсердий и суправентрикулярной тахикардии, у млекопитающего, который включает введение терапевтически эффективного количества соединения формулы I. Другим предпочтительным вариантом является способ предотвращения тромбоэмболических осложнений (событий), таких как инсульт. Другим предпочтительным вариантом является способ предотвращения застойной сердечной недостаточности. Другим предпочтительным вариантом является способ лечения или предотвращения иммунодепрессии или расстройства, связанного с иммунодепрессией, такого как СПИД, рак, старческая деменция, травма (включая заживление раны, травматическую операцию, травматический шок), хроническая бактериальная инфекция, некоторые нарушения центральной нервной системы и состояния, включающие резистентность к трансплантации органов или ткани, гомологические [вторичные] болезни (реакции “трансплантат против хозяина”), вызванные трансплантацией костного мозга. В пределах этого варианта предлагается также способ лечения или предотвращения иммунодепрессии путем введения соединения по данному изобретению вместе с иммунодепрессивным соединением (средством). Другим предпочтительным вариантом является способ лечения или предотвращения глиом, включая глиомы с небольшой и повышенной степенью злокачественности, предпочтительно глиомы с повышенной степенью злокачественности. Другой предпочтительный вариант представляет собой способ индуцирования у пациента, страдающего предсердной фибрилляцией, состояния с нормальным синусовым ритмом, в котором индуцированный ритм соответствует ритму, который обычно считается нормальным для индивидуума, имеющего сходные с пациентом габаритные и возрастные характеристики, который включает лечение пациента соединением по данному изобретению. Другим предпочтительным вариантом является способ лечения тахикардии (т.е. учащения сердечных сокращений, например 100 ударов в минуту) у пациента, который включает лечение пациента устройством, восстанавливающим ритм сердца (например, дефибриллятор или пейсмекер (сердечный ритмоводитель), в комбинации с соединением по п.1. Настоящее изобретение также охватывает фармацевтический препарат (состав), содержащий фармацевтически приемлемый носитель и соединение формулы I или его фармацевтически приемлемую кристаллическую форму или его гидрат. Предпочтительным вариантом является фармацевтическая композиция соединения формулы I, содержащая, кроме того, второе средство. Соединения по данному изобретению могут иметь хиральные центры, например, один хиральный центр (обеспечивая наличие двух стереоизомеров, (R) и (S)), или два хиральных центра (обеспечивая наличие вплоть до четырех стереоизомеров, (R,R), (S,S), (R,S) и (S,R)). Данное изобретение включает все указанные изомеры и их смеси. Всякий раз, когда не указан изомерный состав, предполагается включение всех возможных изомеров. Таутомеры соединений, определенных в формуле I, также входят в объем настоящего изобретения. Например, соединения, содержащие карбонильные -CH2C(O)-группы (кетогруппы), могут претерпевать таутомеризм, образуя гидроксильные -CH=C(OH)-группы (энольные формы). В объем настоящего изобретения включены как кето-, так и энольные формы. Кроме того, соединения с углерод-углеродными двойными связями могут существовать в Z- и E-формах, и эти все изомерные формы соединений также входят в настоящее изобретение. Перечень сокращений:
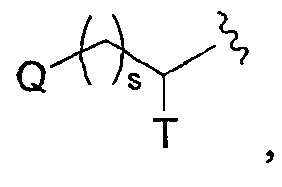
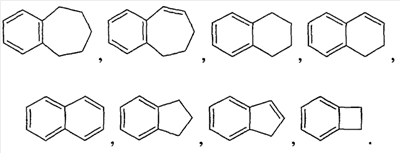
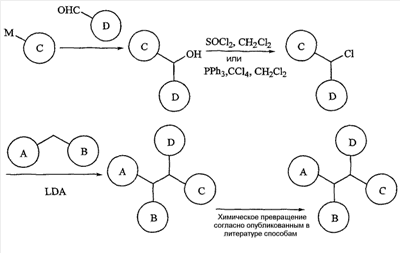
Используемый здесь термин “алкил”, если не оговорено особо, как подразумевается, включает насыщенные алифатические углеводородные группы как с разветвленной, так и с прямой цепью, включая все (возможные) изомеры, содержащие определенное число углеродных атомов. На протяжении всего описания для алкильных групп используются обычно применяемые аббревиатуры, например, метил может быть представлен “Me” или CH3, этил может быть представлен “Et” или CH2CH3, пропил может быть представлен “Pr” или CH2CH2CH3, бутил может быть представлен “Bu” или CH2CH2CH2CH3 и т.д. “C1-6алкил” (или “C1-С6алкил”), например, означает алкильные группы с прямой или разветвленной цепью, включая все (возможные) изомеры, содержащие определенное число углеродных атомов. C1-6алкил включает все гексилалкильные и пентилалкильные изомеры, а также н-, изо-, втор- и трет-бутил, н- и изопропил, этил и метил. “C1-4алкил” означает н-, изо-, втор- и трет-бутил, н- и изопропил, этил и метил. Термин “алкокси” представляет прямую или разветвленную алкильную группу с указанным числом атомов углерода, присоединенную через кислородный мостик. Термин “алкенил” включает ненасыщенные углеводородные группы с прямой или разветвленной цепью, содержащие, по крайней мере, два углеродных атома, соединенных двойной связью. Алкен, этилен, представляют, например, как “CH2CH2” или альтернативно, как “H2C=CH2“. “C2-5алкенил” (или “C2-C5алкенил”), например, означает алкенильные группы с прямой или разветвленной цепью, содержащие от 2 до 5 атомов углерода, и включает все пентенильные изомеры, а также 1-бутенил, 2-бутенил, 3-бутенил, 1-пропенил, 2-пропенил и этенил (или этиленил). Подобные термины, такие как “С2-3алкенил”, имеют аналогичное значение. Термин “алкинил” включает ненасыщенные углеводородные группы с прямой или разветвленной цепью, содержащие, по крайней мере, два углеродных атома, соединенных тройной связью. Алкин, ацетилен, представляют, например, как “CHCH” или альтернативно, как “HCCH”. “C2-5алкинил” (или “C2-C5алкинил”), например, означает алкинильные группы с прямой или разветвленной цепью, содержащие от 2 до 5 атомов углерода, и включает все пентинильные изомеры, а также 1-бутинил, 2-бутинил, 3-бутинил, 1-пропинил, 2-пропинил и этинил (или ацетиленил). Сходные термины, такие как “C2-3алкинил”, имеют аналогичное значение. Если конкретно не оговорено иначе как только “незамещенный” или только “замещенный”, то алкильные, алкенильные и алкинильные группы являются незамещенными или замещены 1-3 заместителями на каждом углеродном атоме, выбранными из галогена, C1-C20алкила, CF3, NH2, N(C1-C6алкил)2, NO2, оксо, CN, N3, -OH, -O(C1-C6алкила), С3-С10циклоалкила, C2-C6алкенила, С2-С6алкинила, (C0-C6алкил)S(О)0-2-, (C0-C6алкил)S(О)0-2(C0-C6алкил)-, (С0-С6алкил)C(O)NH-, H2N-C(NH)-, -O(C1-C6алкил)CF3, (С0-С6алкил)C(O)-, (С0-С6алкил)OC(O)-, (C0-C6алкил)O(C1-C6алкил)-, (C0-C6алкил)C(O)1-2(C0-C6алкил)-, (С0-С6алкил)OC(O)NH-, -NH(C1-C6алкил)NHC(O)NH(C1-C6алкил), -NH(C1-C6алкил)NHSO2(C1-C6алкил), -(C1-С6алкил)NHSO2(C1-C6алкил), арила, аралкила, гетероцикла, гетероциклилалкила, галогенарила, галогенаралкила, галогенгетероцикла, галоген-гетероциклилалкила, цианоарила, цианоаралкила, цианогетероцикла и цианогетероциклилалкила. Термин “C0“, используемый в выражениях, таких как “C0-6алкил” означает прямую ковалентную связь. Аналогично, в тех случаях, когда целое число, определяющее присутствие определенного числа атомов в группе, равно нулю, это означает, что атомы, расположенные рядом, связаны непосредственно связью. Например, в структуре
где s представляет целое число, равное нулю, 1 или 2, вышеуказанная структура представляет собой
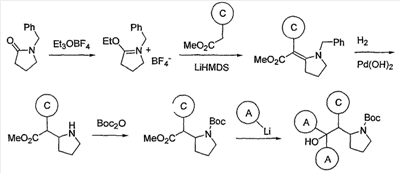
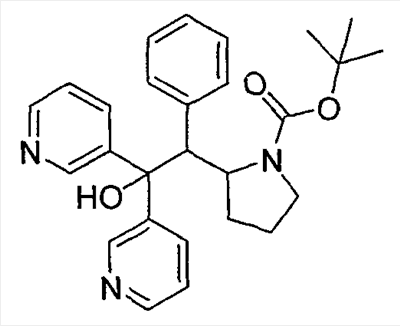
когда s равно нулю. Термин “C3-8циклоалкил” (или “С3-C8циклоалкил”) означает циклическую структуру алкана, содержащую, суммарно, от трех до восьми атомов углерода (т.е. циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил). Термины “C3-7циклоалкил”, “C3-6циклоалкил”, “C5-7циклоалкил” и т.п. имеют аналогичные значения. Термин “галоген” (или “гало”) относится к фтору, хлору, брому или йоду (альтернативно обозначаемым F, Cl, Br и I). Термин “C1-6 галогеналкил” (который альтернативно может быть называем как “C1-С6 галогеналкил” или “галогенированный C1-С6алкил”) означает (C1-C6) прямую или разветвленную алкильную группу, определенную выше, с одним или несколькими заместителями-галогенами. Термин “С1-4 галогеналкил” имеет аналогичное значение. Термин “C1-6фторалкил” имеет аналогичное значение, за исключением того, что заместители-галогены ограничены фтором. Подходящие фторалкилы включают ряд (CH2)0-4CF3 (т.е. трифторметил, 2,2,2-трифторэтил, 3,3,3-трифтор-н-пропил и т.д.). Используемый здесь термин “карбоцикл (углеродный цикл)” (и его вариации, такие как “карбоциклик” или “карбоциклил”), если не оговорено иначе, относится к (1) (C3-C8) моноциклической насыщенной или ненасыщенной циклической структуре или (ii) (C7-C12) бициклической насыщенной или ненасыщенной циклической структуре. Каждый цикл в (ii) является либо независимым, либо конденсирован с другим циклом, и каждый цикл является насыщенным или насыщенным. Карбоцикл может быть присоединен к остатку молекулы при любом углеродном атоме, при условии образования при этом стабильного соединения. Конденсированные бицикликлические карбоциклические структуры представляют собой подмножество карбоциклических структур; т.е. термин “конденсированный бициклический карбоцикл”, как правило, относится к (С7– С10)бициклической структуре, в которой каждый цикл (кольцо) является насыщенным или ненасыщенным и в которой два соседних углеродных атомов принадлежат (одновременно) каждому из циклов в указанной циклической структуре. Конденсированный бициклический карбоцикл, в котором один цикл (кольцо) является насыщенным и другой цикл (кольцо) насыщенным, представляет собой насыщенную бициклическую структуру. Конденсированный бициклический карбоцикл, в котором одно кольцо представляет собой бензол, а другое кольцо является насыщенным, представляет собой ненасыщенную бициклическую структуру. Конденсированный бициклический карбоцикл, в котором одно кольцо представляет собой бензол и другое кольцо является ненасыщенным, представляет собой ненасыщенную циклическую структуру. Насыщенные карбоциклические структуры также называют циклоалкилами, например циклопропил, циклобутил и т.д. Если не оговорено иначе, карбоцикл является незамещенным или замещен C1-6алкилом, C1-6алкенилом, C1-6алкинилом, арилом, галогеном, NH2 или OH. Подмножество конденсированных бициклических ненасыщенных карбоциклов представляют собой бициклические карбоциклы, в которых одно кольцо представляет собой бензол и другое кольцо является насыщенным или ненасыщенным, с присоединением через любой атом углерода, с образованием стабильного соединения. Типичные примеры этого подмножества включают нижеследующее: Термин “арил” относится к ароматическим моно- и поликарбоциклическим структурам, в которых индивидуальные карбоциклы в полициклических структурах конденсированы или связаны друг с другом посредством простой (ординарной) связи. Подходящие арильные группы включают фенил, нафтил и бифениленил. Термин “гетероцикл” (и его вариации, такие как “гетероциклик” или “гетероциклил”), в широком смысле, относится к (i) стабильной (4-8)-членной, насыщенной или ненасыщенной моноциклической структуре, или (ii) стабильной (7-12)-членной бициклической структуре, где каждый цикл в (ii) является независимым от, или конденсирован с другим циклом или циклами и каждый цикл является насыщенным или ненасыщенным, и моноциклическая структура или бициклическая структура содержит один или несколько гетероатомов (например, от 1 до 6 гетероатомов, или от 1 до 4 гетероатомов), выбранных из N, О и S и баланс углеродных атомов (моноциклическая структура обычно содержит, по крайней мере, один атом углерода и циклические структуры обычно содержат, по крайней мере, два атома углерода); и где любой один или несколько из гетероатомов азота и серы необязательно находится в окисленной форме, и любой один или несколько из гетероатомов азота необязательно кватернизованы. Если не оговорено особо, гетероциклическая структура может быть присоединена при любом гетероатоме или атоме углерода, при условии, что присоединение приводит к созданию стабильной структуры. Если не оговорено иначе, то очевидно, что в тех случаях, когда гетероциклическая структура имеет заместители, эти заместители могут быть присоединены к любому атому в цикле, будь это гетероатом или атом углерода, при условии, что при этом будет получена стабильная химическая структура. Если специально не оговорено иначе как только “незамещенный” или только “замещенный”, то циклоалкильные, арильные и гетероциклические группы являются незамещенными или замещенными. Используемые здесь термины “замещенный C3-C10циклоалкил”, “замещенный арил” и “замещенный гетероцикл”, как подразумевается, включают циклическую группу, содержащую от 1 до 3 заместителей помимо точки присоединения к остатку соединения. Предпочтительно, заместители выбирают из группы, которая включает, но ими не ограничиваются, галоген, С1-C20алкил, CF3, NH2, N(C1-C6алкил)2, NO2, оксо, CN, N3, -OH, -О(С1-C6алкил), C3-C10циклоалкил, C2-C6алкенил, C2-C6алкинил, (С0-C6алкил)S(O)0-2-, арил-S(O)0-2-, (C0-C6алкил)S(О)0-2(C0-C6алкил)-, (С0-С6алкил)C(O)NH-, H2N-C(NH)-, -O(C0-C6алкил)CF3, (C0-C6алкил)С(О)-, (С0-С6алкил)OC(O)-, (C0-C6алкил)О(C1-C6алкил)-, (С0-С6алкил)C(О)1-2(C0-C6алкил)-, (С0-С6алкил)OC(O)NH-, арил, аралкил, гетероарил, гетероциклилалкил, галогенарил, галогенаралкил, галоген-гетероцикл, галогенгетероциклилалкил, цианоарил, цианоаралкил, цианогетероцикл и цианогетероциклилалкил. Насыщенные гетероциклы образуют подмножество гетероциклов; т.е. термин “насыщенный гетероцикл” обычно относится к гетероциклу, определенному выше, в котором циклическая структура, в целом, (моно- ли, или полициклическая) является насыщенной. Термин “насыщенное гетероциклическая структура” относится к (4-8)-членной насыщенной моноциклической структуре или стабильной (7-12)-членной бициклической структуре, которая состоит из углеродных атомов и одного или нескольких гетероатомов, выбранных из N, О и S. Типичные примеры включают пиперидинил, пиперазинил, азепанил, пирролидинил, пиразолидинил, имидазолидинил, оксазолидинил, изоксазолидинил, морфолинил, тиоморфолинил, тиазолидинил, изотиазолидинил и тетрагидрофурил (или тетрагидрофуранил). Гетероароматические циклы образуют другое подмножество гетероциклов; т.е. термин “гетероароматический цикл” (альтернативно “гетероарил”) обычно относится к гетероциклу, определенному выше, в котором циклическая структура, в целом, (моно- ли, или полициклическая) представляет собой ароматическую циклическую структуру. Термин “гетероароматическая циклическая структура” относится к 5- или 6-членной моноциклической ароматической структуре или (7-12)-членной бициклической структуре, которая состоит из атомов углерода и одного или нескольких гетероатомов, выбранных из N, О и S. В случае замещенных гетероарилов, содержащих, по крайней мере, один атом азота (например, пиридин), такие замещения могут быть замещениями, приводящими к образованию N-оксида. Типичные примеры гетероароматических циклов включают пиридил, пирролил, пиразинил, пиримидинил, пиридазинил, тиенил, (или тиофенил), тиазолил, фуранил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изооксазолил, оксадиазолил, тиазолил, изотиазолил и тиадиазолил. Типичные примеры бициклических гетероциклов включают бензотриазолил, индолил, изоиндолил, индазолил, индолинил, изоиндолинил, хиноксалинил, хиназолинил, циннолинил, хроманил, изохроманил, тетрагидрохинолинил, хинолинил, тетрагидроизохинолинил, изохинолинил, 2,3-дигидробензофуранил, 2,3-дигидробензо-1,4-диоксинил (т.е. Если специально не оговорено обратное, то “ненасыщенный” цикл представляет собой частично или полностью ненасыщенное кольцо. Например, “ненасыщенный моноциклический С6 карбоцикл” относится к циклогексену, циклогексадиену и бензолу. Если специально не оговорено обратное, то все диапазоны, цитированные здесь, носят охватывающий характер. Например, гетероцикл, описанный как содержащий от “1 до 4 гетероатомов”, означает, что гетероцикл может содержать 1, 2, 3 или 4 гетероатома. Если какая-либо переменная встречается больше чем один раз в каком-либо заместителе или в какой-либо формуле, изображающей или описывающей соединения по данному изобретению, то ее определение в каждом случае не зависит от ее определения в каждом другом случае. Кроме того, комбинации заместителей и/или переменных допустимы только в тех случаях, если такие комбинации приводят к образованию стабильных соединений. Термин “замещенный” (например, как в выражении “арил, который необязательно замещен одним или несколькими заместителями…”) включает моно- и полизамещение поименованным заместителем в степени, в которой такое разовое и кратное замещение (включая кратное замещение в одном и том же месте) химически допустимо. В соединениях по данному изобретению, имеющих пиридил-N-оксидные части, пиридил-N-оксидную часть структурно изображают, используя обычные представления, такие как которые имеют эквивалентные значения. Для определений переменных, содержащих термины, имеющие повторяющиеся элементы, например (CRiRj)r, где r представляет целое число, равное 2, Ri представляет собой определенную переменную и Rj представляет собой определенную переменную, значение Ri может различаться (из определения) в каждом случае, в котором Ri встречается, и Rj может различаться в каждом случае, в котором Rj имеет место. Например, если Ri и Rj независимо выбраны из группы, состоящей из метила, этила, пропила и бутила, то (CRiRj)2 может представлять собой Фармацевтически приемлемые соли включают как соли металлов (неорганические соли), так и органические соли; перечень которых приводится в Remington’s Pharmaceutical Sciences, 17th Edition, pg. 1418 (1985). Специалисту в данной области известно, что подходящую солевую форму выбирают, исходя из физической и химической стабильности, текучести (сыпучести порошкообразных веществ), гигроскопичности и растворимости. Как очевидно специалистам в данной области, фармацевтически приемлемые соли включают, но не ограничиваются ими, соли неорганических кислот, такие как гидрохлорид, сульфат, фосфат, дифосфат, гидробромид и нитрат, или соли органических кислот, такие как малат, малеат, фумарат, тартрат, сукцинат, цитрат, ацетат, лактат, метансульфонат, п-толуолсульфонат или пальмоат, салицилат и стеарат. Аналогично, фармацевтически приемлемые катионы включают, но ими не ограничиваются, натрий, калий, кальций, алюминий, литий и аммоний (в особенности, соли аммония с вторичными аминами). Предпочтительные соли по данному изобретению, по указанным выше причинам, включают соли калия, натрия, кальция и аммония. В объем данного изобретения включены также кристаллические формы, гидраты и сольваты соединений Формулы I. Способы получения соединений по данному изобретению иллюстрированы на схемах, представленных ниже. Протоколы других синтезов указанных соединений очевидны специалистам в данной области техники. Примеры иллюстрируют получение соединений Формулы I и эти примеры не следует рассматривать как ограничение данного изобретения, изложенного в нижеследующей формуле изобретения. СХЕМА I Переменные А, В, С и D на схеме имеют значения, определенные в “формуле I”. Пример I-1 (R и S) N-{6-[1-(4-фторфенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамид Стадия A К смеси 6-бром-2-пиридинкарбоксальдегида (6,12 г, 32,90 ммоль) в безводном THF (150 мл) при -78°C в атмосфере N2 добавляют по каплям 4-фторфенилмагнийбромид (2 M в диэтиловом эфире, 17,27 мл). Реакционную смесь нагревают до 0°C и перемешивают в течение 1,5 ч. Реакцию гасят насыщенным водным NH4Cl. Объединенные органические слои сушат (безводный Na2SO4), фильтруют и концентрируют, получая (6-бромпиридин-2-ил)(4-фторфенил)метанол. 1Н ЯМР (500 МГц, CDCl3) LRMS m/z (M+H) выч.: 282,0, найдено: 282,0. Стадия_B К смеси (6-бромпиридин-2-ил)(4-фторфенил)метанола в CH2Cl2 (120 мл) при 0°C добавляют SOCl2 (5,870 г, 49,34 ммоль). Смеси дают возможность медленно нагреться до комнатной температуры и перемешивают в течение 16 ч. Смесь вновь охлаждают до 0°C и гасят насыщенным водным NaHCO3. Полученную смесь экстрагируют 3x CH2Cl2. Объединенные органические экстракты сушат (безводный Na2SO4), фильтруют и концентрируют. Полученный остаток очищают хроматографией на силикагеле (20-30% CH2Cl2 в гексанах), получая 2-бром-6-[хлор(4-фторфенил)метил]пиридин. 1Н ЯМР (500 МГц, CDCl3) LRMS m/z (M+H) Выч.: 300,0, найдено: 300,0. Стадия С К раствору 3-(пиридин-3-илметил)пиридина (2,5 г, 14,69 ммоль) в безводном THF (75 мл) в атмосфере N2. Смесь охлаждают до -78°C и по каплям добавляют LDA (12,24 мл, 1,8 M). Смесь перемешивают при -78°C в течение 1 ч и добавляют 2-бром-6-[хлор(4-фторфенил)метил]пиридин (4,64 г, 15,42 ммоль). Смесь нагревают до 0°C и перемешивают в течение 2 ч. Реакционную смесь гасят насыщенным водным NH4Cl и экстрагируют 3x EtOAc. Объединенные органические экстракты сушат (безводный Na2SO4), фильтруют и концентрируют. Полученный остаток очищают хроматографией на силикагеле (1-3% MeOH в CH2Cl2), получая 2-бром-6-[1-(4-фторфенил)-2,2-дипиридин-3-илэтил]пиридин. lH ЯМР (500 МГц, CDCl3) LRMS m/z (M+H) Выч.: 434,0, найдено: 434,0. Рацемическую смесь разделяют с помощью ChiralPak AD (30% iPrOH в гексане+DEA 1 мл/л). Первый пик представляет собой энантиомер A 2-бром-6-[1-(4-фторфенил)-2,2-дипиридин-3-илэтил]пиридина; HRMS m/z (M+H) выч.: 434,0663, найдено: 434,0648. И второй пик представляет собой энантиомер В 2-бром-6-[1-(4-фторфенил)-2,2-дипиридин-3-илэтил]пиридина; HRMS m/z (M+H) выч.: 434,0633, найдено: 434,0646. Стадия D Смесь 2-бром-6-[1-(4-фторфенил)-2,2-дипиридин-3-илэтил]пиридина (энантиомер A) (0,550 г, 1,266 ммоль), метансульфонамида (0,144 г, 1,518 ммоль), Cs2CO3 (0,578 г, 1,774 ммоль), Pd2(dba)3 (23 мг, 0,025 ммоль) и ксантфос (44 мг, 0,076 ммоль) перемешивают в безводном диоксане (5 мл). Смесь дегазируют (3х насос/N2) и нагревают до 100°C в течение 16 ч в атмосфере N2. Смесь охлаждают до комнатной температуры, разбавляют CHCl3 и фильтруют через подушку целита. Целит промывают CHCl3 и EtOAc. Фильтрат концентрируют и очищают хроматографией на силикагеле (1-5% MeOH в CH2Cl2), получая энантиомер A N-{6-[1-(4-фторфенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида. lH ЯМР (500 МГц, d6 ДМСО) HRMS m/z (M+H) Выч.: 449,1442, найдено: 449,1450. Энантиомер В N-{6-[1-(4-фторфенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида (HRMS m/z (M+H) выч.: 449,1442, найдено: 449,1459) синтезируют, используя способ, описанный выше, за исключением того, что в качестве исходного вещества (на этой стадии) используют энантиомер В 2-бром-6-[1-(4-фторфенил)-2,2-дипиридин-3-ил]этил]пиридина. Пример I-2 (R и S) N-{6-[1-(3-цианофенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамид Стадия A К смеси 2,6-дибромпиридина (6 г, 25,33 ммоль) в безводном THF (150 мл) в атмосфере N2 при -78°C добавляют по каплям н-BuLi (10,13 мл, 2,5 M). Смесь перемешивают при -78°C в течение 15 мин и добавляют 3-цианобензальдегид (3,32 г, 25,33 ммоль) в безводном THF (10 мл, промытый 5 мл). Смесь перемешивают в течение 20 мин при -78°C, затем нагревают до 0°C и перемешивают в течение 1 ч. Смесь гасят насыщенным водным NH4Cl, и полученную смесь экстрагируют 3x EtOAc. Объединенные органические экстракты сушат (безводный Na2SO4), фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (15-30% EtOAc в гексанах), получая 3-[(6-бромфенил-2-ил)(гидрокси)метил]бензнитрил. LRMS m/z (M+H) выч.: 289,0, найдено 289,1. Стадия В К смеси 3-[(6-бромпиридин-2-ил)(гидрокси)метил]бензнитрила (4,88 г, 16,88 ммоль) в CH2Cl2 (60 мл) при 0°C в атмосфере N2 добавляют SOCl2 (2,01 мл, 16,88 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 48 ч. Смесь охлаждают до 0°C и гасят насыщенным водным бикарбонатом натрия и экстрагируют 3x CH2Cl2. Объединенные органические экстракты сушат (безводный Na2SO4), фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (25-50% CH2Cl2 в гексанах), получая 3-[(6-бромпиридин-2-ил)(хлор)метил]бензонитрил. LRMS m/z (M+H) выч.: 307,0, найдено: 307,0. Стадия С К смеси 3-(пиридин-3-илметил)пиридина (0,700 г, 4,11 ммоль) в безводном THF (20 мл) при -78°C в атмосфере N2 добавляют по каплям LDA (3,43 мл, 1,8 M). Смесь перемешивают в течение 1 ч при -78°C и добавляют 3-[(6-бромпиридин-2-ил)(хлор)метил]бензонитрил. Реакционную смесь нагревают до 0°C и перемешивают в течение 2 ч. Полученную смесь гасят насыщенным водным NH4Cl и экстрагируют 3x EtOAc. Объединенные органические экстракты сушат (безводный Na2SO4), фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (1-4% MeOH в CH2Cl2), получая рацемический 3-[1-(6-бромпиридин-2-ил)-2,2-дипиридин-3-илэтил]бензонитрил. LRMS m/z (M+H) выч.: 441,0, найдено 441,0. Рацемическую смесь разделяют с помощью ChiralPak AD (градиентное элюирование смесью 40% iPrOH в гексанах + 1 мл/л DEA до 80% iPrOH в гексанах + 1 мл/л DEA на протяжении 45 мин). Первый пик представляет собой энантиомер A 3-[1-(6-бромпиридин-2-ил)-2,2-дипиридин-3-илэтил]бензонитрила, и второй пик представляет собой энантиомер В 3-[1-(6-бромпиридин-2-ил)-2,2-дипиридин-3-илэтил]бензонитрила. Стадия D Смесь энантиомера A 3-[1-(6-бромпиридин-2-ил)-2,2-дипиридин-3-илэтил]бензонитрила (0,318 г, 0,721 ммоль), метансульфонамида (0,082 г, 0,865 ммоль), Cs2CO3 (0,329 г, 1,01 ммоль), Pd2(dba)3 (13 мг, 0,014 ммоль) и ксантфоса (25 мг, 0,043 ммоль) перемешивают в безводном диоксане (5 мл). Смесь дегазируют (3x насос/N2) и нагревают до 100°C в течение 16 ч в атмосфере N2. Реакционную смесь охлаждают до комнатной температуры, разбавляют CHCl3, и фильтруют через подушку целита. Целит промывают CHCl3 и EtOAc, чтобы избавиться от примесей. Затем целит промывают MeOH. Фильтрат концентрируют и очищают хроматографией на силикагеле (1-5% MeOH в CH2Cl2), получая энантиомер A N-{6-[1-(3-цианофенил-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида. lH ЯМР (500 МГц, d6 ДМСО) HRMS m/z (M+H) выч.: 456,1489, найдено: 456,1460. Энантиомер В N-{6-[1-(3-цианофенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида (HRMS m/z (M+H) выч.: 456,1489, найдено: 456,1469) синтезируют, используя способ, описанный выше, за исключением того, что в качестве исходного вещества (на этой стадии) используют энантиомер В 3-[1-(6-бромпиридин-2-ил)-2,2-дипиридин-3-илэтил]бензонитрила. Пример I-3 (R и S) N-{6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамид Стадия A К смеси 2-бром-6-метоксипиридина (5,00 г, 26,59 ммоль) в безводном THF (100 мл) при -78°C в атмосфере N2 добавляют по каплям н-BuLi (11,701 мл, 2,5 M). Смесь перемешивают в течение 20 мин и добавляют 6-бром-2-пиридинкарбоксальдегид (4,95 г, 26,93 ммоль). Смесь нагревают до 0°C и перемешивают в течение 1 ч. Полученную смесь гасят насыщенным водным NH4Cl и экстрагируют 3x EtOAc. Объединенные органические экстракты сушат (безводный Na2SO4), фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (15% EtOAc в гексанах), получая (6-бромпиридин-2-ил)(6-метоксипиридин-2-ил)метанол. 1Н ЯМР (500 МГц, CDCl3) LRMS m/z, (M+H) выч.: 295,0, найдено: 295,1. Стадия В К смеси (6-бромпиридин-2-ил)(6-метоксипиридин-2-ил)метанола (5,11 г, 17,31 ммоль) в CH2Cl2 (56 мл) при 0°C в атмосфере N2 добавляют SOCl2 (3,09 г, 25,97 ммоль). Затем смеси предоставляют возможность нагреться до комнатной температуры в течение 3 ч. Затем смесь вновь охлаждают до 0°C и гасят насыщенным водным бикарбонатом натрия. Полученную смесь экстрагируют 3x CH2Cl2. Объединенные органические экстракты сушат (Na2SO4), фильтруют и концентрируют. Полученный остаток очищают хроматографией на силикагеле (25-35% CH2Cl2 в гексанах), получая 2-бром-6-[хлор(6-метоксипиридин-2-ил)метил]пиридин. 1Н ЯМР (500 МГц, CDCl3) LRMS m/z (M+H) выч.: 313,0, найдено: 312,9. Стадия С К смеси 3-(пиридин-3-илметил)пиридина (2 г, 11,75 ммоль) в безводном THF (40 мл) при -78°C в атмосфере N2 добавляют по каплям LDA (9,79 мл, 1,8 M). Смесь перемешивают при -78C в течение 1 ч и добавляют 2-бром-6-[хлор(6-метоксипиридин-2-ил)метил]пиридин. Смесь нагревают до 0°C и перемешивают в течение 2 ч. Реакционную смесь гасят насыщенным водным NH4Cl и экстрагируют 3x EtOAc. Объединенные органические экстракты сушат (безводный Na2SO4), фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (1-5% MeOH в CH2Cl2), получая 2-бром-6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридин. 1Н ЯМР (500 МГц, CDCl3) LRMS m/z (M+H) выч.: 447,1, найдено: 447,1. Рацемическую смесь разделяют с помощью ChiralPak AD (40% EtOH в гексанах + DEA 1 мл/л). Первый пик представляет собой энантиомер A 2-бром-6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридина и второй пик представляет собой энантиомер В 2-бром-6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридина. Стадия D Смесь энантиомера A 2-бром-6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридина (1,00 г, 2,235 ммоль), метансульфонамида (0,255 г, 2,683 ммоль), Cs2CO3 (1,02 г, 3,13 ммоль), Pd2(dba)3 (41 мг, 0,045 ммоль) и ксанфоса (78 мг, 0,134 ммоль) в безводном диоксане (10 мл) в атмосфере N2 дегазируют (3x насос/N2) и нагревают до 100°C в течение 16 ч. Смесь охлаждают до комнатной температуры и разбавляют CHCl3. Смесь фильтруют через подушку целлита и промывают CHCl3 и EtOAc. Фильтрат концентрируют и очищают хроматографией на силикагеле (1-5% MeOH в CH2Cl2). Затем смесь очищают ВЭЖХ с кислотной обращенной фазой (градиент 95% H2О:5% CH3CN до 100% CH3CN + 0,1% TFA). Фракции концентрируют, затем гасят насыщенным водным бикарбонатом натрия и экстрагируют 3x EtOAc. Объединенные органические экстракты сушат (безводный Na2SO4), фильтруют и концентрируют, получая N-{6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамид. lH ЯМР (500 МГц, d6 ДМСО) LRMS m/z (M+H) выч.: 462,1595, найдено 462,1597. Энантиомер В N-{6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида (LRMS m/z (M+H) выч.: 462,1595, найдено: 462,1597) синтезируют, используя способ, описанный выше, за исключением того, что в качестве исходного вещества (на этой стадии) используют энантиомер В 2-бром-6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридина. Пример I-4 (R и S)-3-[1-(2-аминопиридин-4-ил)-2,2-дипиридин-3-илэтил]бензонитрил Стадия A К раствору 4-иод-2-(метилтио)пиримидина (2,52 г, 10 ммоль) в THF (50 мл) при 0°C добавляют i-PrMgCl (5 мл, 2,0 M, 10 ммоль) и перемешивают в течение 1 ч. Добавляют 3-цианобензальдегид (1,31 г, 10 ммоль). Смесь перемешивают при 0°C в течение 2 ч. Реакционную смесь гасят насыщенным водным раствором NH4Cl и экстрагируют СН2Cl2. Объединенный органический слой сушат, фильтруют и концентрируют. Остаток очищают хроматографией на силикагеле (20-50% EtOAc в гексане), получая 3-{гидрокси[2-(метилтио)пиримидин-4-ил]метил}бензонитрил. 1Н ЯМР (500 МГц, CDCl3) LRMS m/z (M+H) выч.: 258,3, найдено: 258,1. Стадия В К раствору 3-{гидрокси[2-(метилтио)пиримидин-4-ил]метил}бензонитрила (1,65 г, 6,41 ммоль) в CCl4 (10 мл) и CH2Cl2 (10 мл) добавляют трифенилфосфин (2,36 г, 8,98 ммоль) и перемешивают в течение 4 ч. Смесь концентрируют и остаток очищают хроматографией на силикагеле (20% EtOAc в гексане), получая 3-{хлор[2-(метилтио)пиримидин-4-ил]метил}бензонитрил]. lH ЯМР (500 МГц, CDCl3) LRMS m/z (M+H) выч.: 276,8, найдено: 276,0. Стадия С К раствору 3-(пиридин-3-илметил)пиридина (1,24 г, 7,26 ммоль) в THF (32 мл) при -78°C добавляют LDA (4,4 мл, 1,8 M) и перемешивают в течение 1 ч. Добавляют 3-{хлор[2-(метилтио)пиримидин-4-ил]метил}бензонитрил (20 г, 7,25 ммоль) в THF (5 мл). Смесь перемешивают при 0°C в течение 2 ч. Реакционную смесь гасят льдом и экстрагируют CH2Cl2. Объединенный органический слой сушат, фильтруют и концентрируют, получая твердое вещество. Твердое вещество очищают хроматографией на силикагеле (3% MeOH в CH2Cl2), получая (±)-3-{1-[2-(метилтио)пиримидин-4-ил]-2,2-дипиридин-3-илэтил}бензонитрил. LRMS m/z (M+H) выч.: 410,5, найдено: 410,1. Стадия D К раствору 3-{1-[2-(метилтио)пиримидин-4-ил]-2,2-дипиридин-3-илэтил}бензонитрила (1,2 г, 2,93 ммоль) в CHCl3 (15 мл) при 0°C добавляют м-хлорпероксибензойную (м-хлорнадбензойную) кислоту (0,657 г, 77%, 2,93 ммоль) и перемешивают в течение 1 ч. Реакционную смесь концентрируют и очищают хроматографией на силикагеле (6% MeOH в CH2Cl2), получая диастереомерную смесь (±)-3-{1-[2-(метилсульфинил)пиримидин-4-ил]-2,2-дипиридин-3-илэтил}бензонитрила. LRMS m/z (M+H) выч.: 426,6, найдено: 426,1. Стадия E Раствор диастереомерной смеси (±)-3-{1-[2-(метилсульфинил)пиримидин-4-ил]-2,2-дипиридин-3-илэтил}бензонитрила (0.11 г, 0,25 ммоль) в DMSO (2 мл), насыщенном NH3, нагревают до 100°C в микроволновой печи в течение 2 ч. Смесь концентрируют и остаток очищают хроматографией на силикагеле (5% MeOH в CH2Cl2), получая (±)-3-[1-(2-аминопиримидин-4-ил)-2,2-дипиридин-3-илэтил]бензонитрил. lH ЯМР (500 МГц, ДМСО-d6) LRMS m/z (M+H) выч.: 379,4, найдено: 379,2. Рацемическую смесь разделяют с помощью Chiralcel OD (50% i-PrOH в гексане). Первый пик представляет собой (-)-3-[1-(2-аминопиримидин-4-ил)-2,2-дипиридин-3-илэтил]бензонитрил. Второй пик представляет собой (+)-3-[1-(2-аминопиримидин-4-ил)-2,2-дипиридин-3-илэтил]бензонитрил. СХЕМА II Переменные С и A в схеме такие, как определены для “формулы I”. Пример II-1 (±)-трет-бутил 2-(2-гидрокси-1-фенил-2,2-дипиридин-3-илэтил)пирролидин-1-карбоксилат(диастереомер A) Стадия A: К раствору N-бензилпирролидинона (2,18 г, 12,4 ммоль) в 25 мл простого эфира добавляют при 0°C тетрафторборат триэтилоксония (2,15 г, 11,3 ммоль). Реакционной смеси предоставляют возможность нагреться до температуры окружающей среды и перемешиваться в течение 30 минут, и во время этого периода времени из реакционной смеси осаждается твердый продукт. Эфир декантируют и оставшийся остаток промывают три раза эфиром. Остаточный растворитель удаляют в вакууме, получая 1-бензил-5-этокси-3,4-дигидро-2H-пирролий тетрафторборат. Стадия B: Раствор гексаметилдисилазида лития (8,39 мл 1 M в тетрагидрофуране, 8,39 ммоль) добавляют к сухому THF и охлаждают до -78°C. Добавляют по каплям метилфенилацетат (1,15 мл, 7,99 ммоль) и реакционную смесь перемешивают в течение 15 минут. По каплям добавляют раствор 1-бензил-5-этокси-3,4-дигидро-2Н-пирролий тетрафторбората в 5 мл тетрагидрофурана и по истечении одного часа реакционной смеси дают возможность нагреться до комнатной температуры. Смесь гасят насыщенным раствором NaHCO3, нагревают до температуры окружающей среды и выливают в воду. Водный слой экстрагируют EtOAc и органический экстракт промывают насыщенным раствором соли, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (смесь 25-30% EtOAc/гексан), получая метил 2-(1-бензилпирролидин-2-илиден)(фенил)ацетат. ESI+ MS: 308,3 [M+H]+. Стадия C: К раствору метил 2-(1-бензилпирролидин-2-илиден)(фенил)ацетата (0,505 г, 1,64 ммоль) в 5 мл метанола добавляют гидроксид палладия (II) (231 мг, 1,64 ммоль) и реакционную смесь перемешивают в атмосфере газа-водорода. Через 3 дня смесь фильтруют через целит, подушку целита промывают смесью СН2Cl2/МеОН и фильтрат концентрируют в вакууме, получая метил фенил(пирролидин-2-ил)ацетат в виде смеси двух диастереомеров. ESI+ MS: 220,2 [М+Н]+. Стадия D: К раствору метил фенил(пирролидин-2-ил)ацетата (0,360 г, 1,64 ммоль) в 5 мл тетрагидрофурана добавляют ди-трет-бутилдикарбонат (717 мг, 3,28 ммоль) и реакционную смесь перемешивают на протяжении ночи. Смесь концентрируют в вакууме, затем очищают хроматографией на силикагеле (смесь 20% EtOAc/гексан), получая трет-бутил 2-(2-метокси-2-оксо-1-фенилэтил)пирролидин-1-карбоксилат. ESI+MS: 264,2 [M+H – изобутилен]+. Стадия E: 3-бромпиридин (0,790 мл, 8,20 ммоль) растворяют в 30 мл сухого Et2O и охлаждают до -78°C. н-Бутиллитий (3,28 мл, 2,5 M раствор в гексанах, 8,20 ммоль) добавляют по каплям с помощью шприца на протяжении 10 минут. После перемешивания на протяжении 15 минут по каплям добавляют раствор трет-бутил 2-(2-метокси-2-оксо-1-фенилэтил)пирролидин-1-карбоксилата (0,524 г, 1,64 ммоль) в 5 мл эфира. Реакционную смесь перемешивают в течение 45 минут при -78°C, гасят насыщенным водным раствором NaHCO3 и выливают в насыщенный водный раствор NaHCO3 и EtOAc. Органический слой экстрагируют насыщенным раствором соли, сушат Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают препаративной ВЭЖХ с обращенной фазой и объединенные чистые фракции распределяют между (несмешивающимися) CH2Cl2 и насыщенным водным раствором NaHCO3. Концентрирование органической фракции дает один диастереомер указанного в заголовке соединения. lH ЯМР (500 МГц, CDCl3): HRMS [M+H] C27H32N3O3 выч.: 446,2438, найдено: 446,2424. Используя методологии, описанные ниже, была произведена оценка типичных соединений по данному изобретению и было установлено, что они проявляют активность в Kvl.5 анализах, тем самым демонстрируя и подтверждая полезность соединений по данному изобретению в качестве ингибиторов Kvl.5 и в качестве антиаритмических средств. Соединения этого типа могут проявлять прямую скорость-зависимость, блокируя выходящие K+ токи в большей степени или предпочтительно при более быстрых скоростях деполяризации или частотах сердечных сокращений. Такое соединение может быть идентифицировано в электрофизиологических исследованиях, как описано ниже. Например, во время последовательности деполяризаций, производимых при частотах 1 Гц и 3 Гц, блокада является “скорость-зависимой”, если величина блокады, наблюдаемая во время 10-секундной последовательности, при 3 Гц больше, чем величина блокады при 1 Гц. Блокатор Kvl.5 может также демонстрировать применение-зависимость, во время которой блокада выходящих K+ токов усиливается с применением, или во время повторяющейся деполяризации кардиальной (сердечной) клетки. Применение-зависимость блокады проявляется все в большей степени с каждой последующей деполяризацией в цепи или последовательности импульсов или деполяризаций при заданной скорости или частоте. Например, во время последовательности из 10 деполяризаций при частоте 1 Гц блокада является “применение–зависимой”, если величина блокады больше для 10-го импульса, чем для 1-ого импульса последовательности. Блокатор Kvl.5 может проявлять как применение-зависимость, так и скорость-зависимость. Блокатор Kvl.5 может быть также идентифицирован посредством электрофизиологических исследований нативного IKur, используя сердечные миоциты (мышечные клетки) или другую ткань (проводящей системы сердца) от различных биологических видов, включая, но не ограничиваясь ими, человека, крысу, мышь, собаку, обезьяну, хорька, кролика, морскую свинку или козу. В нативных тканях Kvl.5 может существовать в виде гомоолигомера или в виде гетероолигомера с другими представителями семейства Kv, или может существовать в комплексе с Анализы Kvl.5 Высокоразрешающий анализ Kvl.5 методом планарной фиксации потенциала представляет собой систематический первичный скрининг. Он подтверждает активность и обеспечивает функциональную меру активности средств, которые специфически воздействуют на калиевые Kvl.5. Kiss et al. (Assay and Drug Dev. Tech., 1(1-2): 127-135,2003) and Schroeder et al. (J. of Biomol. Screen., 8(l);50-64, 2003) описывают использование этого инструмента для Kvl.5, а также других управляемых напряжением ионных каналов. Клетки яичника китайского хомячка (CHO), стабильно экспрессирующие альфа субъединицу человеческого калиевого канала Kvl.5, клонированную от человеческого сердца, культивируют до 90-100% слияния в среде Ham F12, дополненной 10% FBS, 100 Е/мл пенициллина, 100 нг/мл стрептомицина, 1000 мг/мл сульфата G-418. Клетки субкультивируют обработкой Versene, затем суспендируют в забуференном фосфатом физиологическом растворе (PBS) и центрифугируют. Дебрис ресуспендируют в PBS и полученную суспензию помещают в клеточный резервуар (измерительного) прибора Ion WorksTM HT. Электрофизиологические регистрации осуществляют с внутриклеточным раствором, содержащим (мМ): K-глюконат 100, KCl 140, MgCl2 3,2, EGTA 3, N-2-гидроксилэтилпиперазин-N1-2-этансульфоновую кислоту (HEPES) 5; доведенный до pH 7,3. Амфотерицин (Sigma) получают в виде 30 мг/мл исходного раствора и разбавляют до конечной рабочей концентрации 0,1 мг/мл во внутреннем буферном растворе. Наружный раствор представляет собой PBS по Дульбекко (Invitrogen) и содержит (мМ): CaCl2 0,90, KCl 2,67, K3PO4 1,47, MgCl2 0,50, NaCl 138, Na3PO4 8,10 и имеет pH 7,4. Все соединения получают в виде 10 мМ исходных растворов в DMSO. Соединения разбавляют в наружном буфере, затем переносят с планшета с лекарственным средством в пэтч-планшет на время эксперимента (конечная концентрация DMSO <0,66%, об.). Ионные токи Kvl.5 регистрируют при комнатной температуре. Мембранные токи усиливают [RMS (средняя реальная мощность) 10 пА] и прикладывают при 10 кГц. Для всех экспериментов проводят вычитание утечки, применяя 160 мс гиперполяризующие (10 мВ) пред-импульсы 200 мс до проверочных (испытательных) импульсов 200, чтобы измерить проводимость утечки. Протокол воздействия фиксацией потенциала следующим образом: 1. Лунки пэтч-планшета нагружают 3,5 мкл наружного буфера. 2. Определяют сопротивление планарного микропипеточного отверстия (Rp), прикладывая 10 мВ, 160 мс разность потенциалов на противоположные концы каждого отверстия (Hole test). 3. Клетки пипетируют в пэтч-планшет и образуют уплотнения высокого сопротивления с отверстиями 1-2 мкм на дне каждой лунки пэтч-планшета. Осуществляют проверочное сканирование (просмотр) на уплотнение, чтобы определить какое число лунок пэтч-планшета имеет клетки, которые образовали уплотнения. 4. Внутриклеточный раствор, содержащий амфотерицин, циркулируют в течение 4 минут с нижней стороны пэтч-планшета, для получения электрического доступа к клеткам. 5. К каждой лунке на пэтч-планшета, до добавления соединения, прикладывают проверочный импульс. Протокол: Клетки фиксируют напряжением при трансмембранном удерживающем потенциале -80 мВ на протяжении 15 секунд. За этим следует применение 5 Гц стимулирующей последовательности (27×150 мс деполяризаций до +40 мВ). Шаги трансмембранного потенциала до +40 мВ вызывают выходящие (положительные) ионные токи. 6. В каждую лунку пэтч-планшета добавляют соединение. Соединениям предоставляют возможность инкубироваться в течение 5 минут. 7. После добавления соединения прикладывают проверочный импульс. Протокол: Клетки фиксируют напряжением при трансмембранном удерживающем потенциале -80 мВ на протяжении 15 секунд. За этим следует применение 5 Гц стимулирующей последовательности (27×150 мс деполяризаций до +40 мВ). Анализ данных проводят автономно. Парные сравнения между экспериментами до добавления лекарственного средства и после добавления лекарственного средства используют для определения ингибирующего действия каждого соединения. % ингибирования от максимального контрольного тока во время 27-й деполяризации до +40 мВ (в 5 Гц последовательности) представляют (графически) как функцию концентрации антагониста. Концентрации лекарственного средства, требуемые для ингибирования тока на 50% (IC50) определяли, используя уравнение Хилла для данных концентрация-ответ: % контроля=100×(1+([Drug]/IC50)р)-1. Для каждой клетки получают четыре арифметические метрики: 1) сопротивление уплотнения 2) базальная метрика (средний ток при -70 мВ от 5 до 45 мс до первой деполяризации до +40 мВ) 3) метрика возрастания тока (средняя амплитуда тока, проба до добавления соединения, во время 1-й деполяризации до +40 мВ минус средняя амплитуда тока, проба до добавления соединения, во время 27-й деполяризации до +40 мВ) 4) максимальный ток (максимальная амплитуда тока во время 27-й деполяризации до +40 мВ во время 5 Гц последовательности). Все метрики получают во время экспериментов как до добавления, так и после добавления соединения. Клетки исключают из дальнейшего анализа, если сопротивление уплотнения <50 мОм базальная метрика >±100 пА во время эксперимента до добавления соединения метрика возрастания тока >-0,2 нА предварительно считываемая пиковая метрика <400 пА. Вышеперечисленные соединения обеспечивают ингибирование при концентрации 33 мкМ или меньше в анализе Kvl.5 методом планарной фиксации потенциала (пэтч-кламп), описанном выше. Протокол атомно-абсорбционной спектроскопии: Этот анализ идентифицирует средства, которые, в частности, блокируют человеческий K+ канал Kvl.5, гетерогенно экспрессируемый в CHO клетках, измеряемый по оттоку Rb+, используя метод пламенной атомно-абсорбционной спектроскопии (FAAS). Это применение FAAS для измерения активности ионного канала адаптировано, исходя из Terstappen et al., Anal. Biochem., 272:149-155, 1999. CHO клетки, экспрессирующие человеческий Kvl.5, культивируют, как описано выше, затем собирают с помощью смеси трипсин-EDTA и промывают средой. 1. 40000 клеток на лунку высеивают в 96-луночный культуральный планшет (аналитический планшет) и клеткам предоставляют возможность расти в течение 48 часов при 37°C. 2. Среду удаляют и добавляют 200 мкл Rb Load Буфера (Aurora Biomed, Vancouver, ВС) и (выдерживают) в течение 3 часов при 37°C в атмосфере 5% CO2. 3. Клетки промывают 5 раз 200 мкл сбалансированного солевого раствора Хэнкса (HBSS) с последующим добавлением 100 мкл HBSS, содержащего испытуемое соединение или 0,5% DMSO. 4. Через 10 мин добавляют 100 мкл забуференного HEPES физиологического раствора, содержащего 140 мМ KCl и планшет инкубируют при КТ в течение 5 мин при осторожном встряхивании. 5. Сразу после этого 150 мкл супернатанта переносят в свежий 96-луночный планшет и оставшийся супернатант аспирируют (отсасывают). 6. 120 мкл буфера для лизиса клеток (Aurora Biomed, Vancouver, ВС) добавляют в аналитический планшет и встряхивают на протяжении 10 мин до анализа. 7. Содержание Rb измеряют в пробах супернатанта (SUP) и лизата (LYS), используя автоматизированный (измерительный) прибор для AAS модели ICR-8000 (Aurora Biomed, Vancouver, ВС). %FLUX=100%·(SUP/(LYS+SUP)). %INH=100%·(1-(A-B)/(C-B)), где A представляет собой %FLUX в присутствии испытуемого соединения, В представляет собой %FLUX в присутствии 10 мМ хлорида (6-метокси-2-метил-1-оксо-4-фенил-1,2-дигидроизохинолин-3-ил)-N,N-диметилметанаминия, С представляет собой %FLUX в присутствии 0,25% DMSO; FLUX – (ионный Rb+) поток. Вышеперечисленные соединения обеспечивают ингибирование при концентрации 25 мкМ или меньше в AAS анализе, описанном выше. Соединения по данному изобретению могут вводиться для лечения или предотвращения недугов, болезней и расстройств в соответствии с данным изобретением любым способом, который осуществляет контакт активного соединения-компонента с местом действия в теле теплокровного животного. Например, введение может быть пероральным, местным, включая трансдермальное, (внутри)глазное, буккальное, интраназальное, путем ингаляции, интравагинальное, ректальное, интрацистернальное и парентеральное. Используемый здесь термин “парентеральный” относится к способам введения, которые включают подкожную, внутривенную, внутримышечную, внутрисуставную инъекцию или инфузию, надчревную и интраперитонеальную. Соединения могут быть введены любым обычным способом, пригодным для использования в связи с фармацевтическими препаратами, либо в виде индивидуальных терапевтических средств, либо в комбинации терапевтических средств. Они могут вводиться как таковые, однако обычно их вводят вместе с фармацевтическим носителем, выбранным с учетом выбранного пути введения и обычной фармацевтической практики. Для данного раскрытия теплокровное животное является представителем большой группы животных, устойчивость организма которых обеспечивается гомеостатическими процессами, и включает млекопитающих и птиц. Вводимая доза обычно зависит от возраста, состояния здоровья и массы тела реципиента, тяжести заболевания, вида сопутствующего (параллельного) лечения, если оно вообще имеется, частоты лечения и характера желательного действия. Как правило, суточная доза активного соединения составляет около 1-500 мг в день. Обычно для получения желательных результатов эффективна суточная доза от 10 до 100 мг в день, принимаемая один или несколько раз в день. Эти дозы являются эффективными количествами для лечения и предотвращения недугов, болезней и расстройств, описанных выше, например сердечные аритмии, такие как фибрилляция предсердий (мерцательная аритмия), трепетание предсердий, предсердная аритмия, и суправентрикулярная тахикардия, тромбоэмболические осложнения, такие как инсульт и застойная сердечная недостаточность, и иммунодепрессия. Активный компонент может быть введен перорально в виде твердых лекарственных форм, таких как капсулы, таблетки, пастилки, драже, гранулы и порошки, или в виде жидких лекарственных форм, таких как эликсиры, сиропы, эмульсии, дисперсии и суспензии. Активный компонент может быть также введен парентерально, в виде стерильных жидких лекарственных форм, таких как дисперсии, суспензии или растворы. Другие лекарственные формы, которые также могут быть использованы для введения активного компонента, включают для местного введения – мазь, крем, капли, трансдермальный пластырь или порошок; для (внутри)глазного введения – офтальмический раствор или суспензия, т.е. глазные капли; для ингаляции или интраназального введения – аэрозольный спрэй или порошковый состав; для ректального или вагинального введения – крем, мазь, спрэй или суппозиторий. Желатиновые капсулы содержат активный компонент и порошкообразные носители, такие как лактоза, крахмал, производные целлюлозы, стеарат магния, стеариновую кислоту и т.п. Аналогичные разбавители могут быть использованы для получения спрессованных таблеток. Как таблетки, так и капсулы могут быть изготовлены в виде продуктов с пролонгированным действием, которые обеспечивают непрерывное высвобождение лекарственного средства на протяжении (нескольких) часов. Спрессованные таблетки могут иметь сахарное покрытие или пленочное покрытие для маскировки какого-либо неприятного вкуса и защиты таблетки от (воздействия) атмосферы, или энтеросолюбильное покрытие для селективной дезинтеграции (распада) в желудочно-кишечном тракте. Жидкие лекарственные формы для перорального введения могут содержать краситель и ароматизатор для повышения восприятия у пациента. В общем, подходящими носителями для парентеральных растворов являются вода, подходящее масло, физиологический раствор, водная декстроза (глюкоза) и растворы родственных сахаров и гликоли, такие как пропиленгликоль или полиэтиленгликоли. Растворы для парентерального введения предпочтительно содержат растворимую в воде соль активного компонента, подходящие стабилизирующие средства и, если требуется, буферные вещества. Антиоксиданты, такие как бисульфит натрия, сульфит натрия или аскорбиновая кислота, либо по отдельности, либо в сочетании, являются подходящими стабилизирующими средствами. Также используют лимонную кислоту и ее соли и натрий EDTA. Кроме того, парентеральные растворы могут содержать консерванты, такие как хлорид бензалкония, метил- или пропилпарабен и хлорбутанол. Подходящие фармацевтические носители описаны в Remington’s Pharmaceutical Sciences, A. Osol, книга стандартных справочных данных в этой области техники. Для введения ингаляцией соединения по данному изобретению могут удобно доставляться в форме аэрозольного спрэя из упаковок под (избыточным) давлением или распылителей. Соединения могут быть также доставлены в виде порошков, которые могут составлены, и порошковая композиция может быть введена ингаляцией (вдуванием) с помощью инсуффлятора (аппарата-ингалятора для введения порошкообразных веществ вдуванием). Предпочтительной системой доставки для ингаляции является аэрозоль с контролируемой по расходу дозой для ингаляции (MDI), который получают в виде суспензии или раствора соединения формулы I в подходящих пропеллентах, таких как фторуглероды или углеводороды. Для (внутри)глазного введения, может быть приготовлен офтальмопрепарат (глазной препарат) в виде раствора или суспензии соединений формулы I подходящей концентрации (% масс.) в подходящем офтальмонаполнителе (глазном наполнителе), так чтобы соединение удерживалось в контакте с поверхностью глаза на протяжении периода времени, достаточного для того, чтобы допустить проникновение соединения в корнеальную (роговичную) и внутреннюю области глаза. Используемые фармацевтические лекарственные формы для введения соединений по данному изобретению включают, но ими не ограничиваются, твердые и мягкие желатиновые капсулы, таблетки, парентерально инъецируемые суспензии и пероральные суспензии. Большое число единичных капсул получают наполнением стандартных твердых желатиновых капсул, состоящих их двух частей, каждую 100 мг порошкообразного активного компонента, 150 мг лактозы, 50 мг целлюлозы и 6 мг стеарата магния. Получают смесь активного компонента в легко усваиваемом масле, таком как соевое масло, хлопковое масло или оливковое масло, и впрыскивают с помощью объемного (поршневого) насоса в желатин, получая мягкие желатиновые капсулы, содержащие 100 мг активного компонента. Капсулы промывают и сушат. Большое число таблеток получают обычными способами, так что стандартная доза включает в себя 100 мг активного компонента, 0,2 мг коллоидного диоксида кремния, 5 мг стеарата магния, 275 мг микрокристаллической целлюлозы, 11 мг крахмала и 98,8 мг лактозы. Для повышения вкусовой привлекательности или замедления абсорбции могут быть применены соответствующие покрытия. Парентеральную композицию, подходящую для введения путем инъекции, получают перемешиванием 1,5% масс. активного компонента в 10%, по объему, пропиленгликоля. Раствор доводят до объема водой для инъекции и стерилизуют. Водную суспензию для перорального введения получают так, что каждые 5 мл содержат 100 мг тонко диспергированного активного компонента, 100 мг натрийкарбоксиметилцеллюлозы, 5 мг бензоата натрия, 1,0 г раствора сорбита, U.S.P., и 0,025 мл ванилина. Идентичные лекарственные формы могут быть также использованы в тех случаях, когда соединения по данному изобретению вводят ступенчато или в сочетании с другим терапевтическим средством. Если лекарственные средства вводят в физической комбинации, то лекарственную форму и путь (способ) введения следует выбирать с учетом совместимости комбинируемых лекарственных средств. Таким образом, очевидно, что термин совместное введение включает введение двух средств сопутствующим образом или последовательно, или альтернативно, в виде комбинации двух активных компонентов с постоянной (заранее определенной) дозой. Соединения по данному изобретению можно вводить в виде единственного активного компонента или в комбинации со вторым активным компонентом, включая другие антиаритмические средства, имеющие блокирующие активности в отношении Kvl.5, такие как хинидин, пропафенон, амбасилид, амиодарон, флекаинид, соталол, бретилий, дофетилид, альмокалант, бепридил, клофилий, другие соединения, имеющие блокирующие активности в отношении Kvl.5, такие как клотримазол, кетоконазол, бупивакаин, эритромицин, верапамил, нифедипин, затебрадин, бисиндолилмалеимид, или другие сердечно-сосудистые средства, такие как, но не ограничиваясь ими, ингибиторы ACE, как например беназеприл, каптоприл, эналаприл, фосиноприл, лисиноприл, моэкзиприл, периндоприл, эрбумин, хинаприл, рамиприл и трандолаприл, антагонисты ангиотензина II, такие как кандесартан, эпросартан, ирбесартан, лосартан, олмесартан, телмисартан и валсартан, сердечные гликозиды, такие как дигоксин, блокаторы кальциевого канала L-типа, блокаторы кальциевого канала T-типа, селективные и неселективные бета-блокаторы, иммунодепрессивное соединение, антагонисты эндотелина, ингибиторы тромбина, аспирин, неселективные NSAID, другие, чем аспирин, такие как напроксен, варфарин, ингибиторы фактора Xa, низкомолекулярный гепарин, нефракционированный гепарин, клопидогрел, тиклопидин, антагонисты рецептора IIb/IIIa, такие как тирофибан, антагонисты рецептора 5HT, антагонисты рецептора интегрина, антагонисты рецептора тромбоксана, ингибиторы TAFI и антагонисты рецептора P2T. Соединения по данному изобретению можно также вводить в виде единственного активного компонента или в комбинации с электронным стимулятором сердца или дефибриллятором (устройством, восстанавливающим ритм сердца).
Формула изобретения
1. Соединение, выбранное из группы, состоящей из (R)-N-{6-[1-(4-фторфенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (S)-N-{6-[1-(4-фторфенил])-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (R)-N-{6-[1-(3-цианофенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (S)-N-{6-[1-(3-цианофенил)-2,2-дипиридин-3-илэтил]пиридин-2-ил} метансульфонамида, (R)-N-{6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (S)-N-{6-[1-(6-метоксипиридин-2-ил)-2,2-дипиридин-3-илэтил]пиридин-2-ил}метансульфонамида, (R)-3-[1-(2-аминопиримидин-4-ил)-2,2-дипиридин-3-илэтил]бензонитрила и (S)-3-[1-(2-аминопиримидин-4-ил)-2,2-дипиридин-3-илэтил]бензонитрила. 2. Способ лечения состояния у млекопитающего, лечение которого осуществляют или облегчают ингибированием Kv1.5, который включает введение эффективного для ингибирования Kv1.5 количества соединения по п.1. 3. Способ по п.2, где состояние представляет собой сердечную аритмию. 4. Способ по п.3, где сердечная аритмия представляет собой фибрилляцию предсердий. 5. Фармацевтический препарат, обладающий ингибирующим в отношении Kv1.5 действием, содержащий фармацевтически приемлемый носитель и соединение по п.1 или его фармацевтически приемлемую кристаллическую форму или его гидрат. 6. Фармацевтическая композиция, обладающая ингибирующим в отношении Kv1.5 действием, полученная объединением соединения по п.1 и фармацевтически приемлемого носителя.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 Alessandro, D.M. et all. Mono- and di-nuclear complexes of the ligands 3,4-di(2-pyridyl)-1,2,5-oxadiazole and 3,4-di(2-pyridyl)-1,2,5-thiadiazole; …). AUSTRALIAN JOURNAL OF
Alessandro, D.M. et all. Mono- and di-nuclear complexes of the ligands 3,4-di(2-pyridyl)-1,2,5-oxadiazole and 3,4-di(2-pyridyl)-1,2,5-thiadiazole; …). AUSTRALIAN JOURNAL OF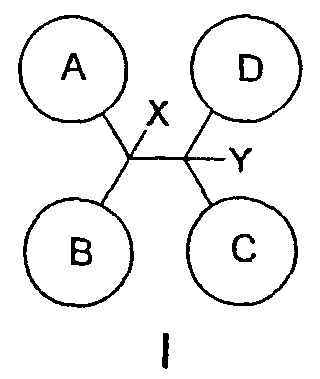
 ,
,
 ), имидазо(2,1-b)(1,3)тиазол (т.е.
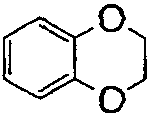
), имидазо(2,1-b)(1,3)тиазол (т.е. 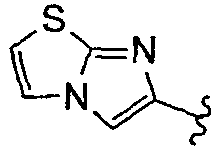 ) и бензо-1,3-диоксолил (т.е.
) и бензо-1,3-диоксолил (т.е. 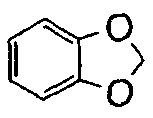 ). В некоторых контекстах здесь,
). В некоторых контекстах здесь, 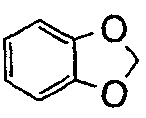 альтернативно называют фенилом, имеющим заместитель, метилендиокси, присоединенный к двум соседним атомам углерода.
альтернативно называют фенилом, имеющим заместитель, метилендиокси, присоединенный к двум соседним атомам углерода.
 7,50 (т, 1Н, J=7,7), 7,40 (д 1H, J=7,8), 7,38-7,32 (м, 2H), 7,10 (д, 1Н, J=7,6), 7,03 (т, 2H, J=8,7), 5,73 (д, 1Н, J=4,2), 4,43 (д, 1H, J=4,4).
7,50 (т, 1Н, J=7,7), 7,40 (д 1H, J=7,8), 7,38-7,32 (м, 2H), 7,10 (д, 1Н, J=7,6), 7,03 (т, 2H, J=8,7), 5,73 (д, 1Н, J=4,2), 4,43 (д, 1H, J=4,4).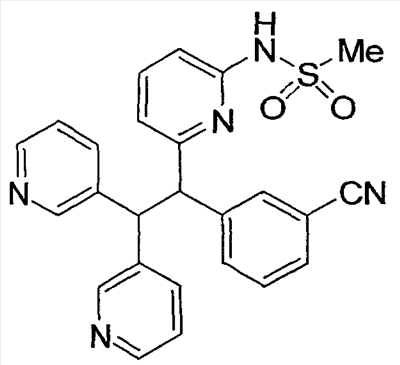
 -субъединицей. Соединения по данному изобретению могут блокировать гомо- или гетероолигомеры Kvl.5 или Kvl.5 в комплексах с
-субъединицей. Соединения по данному изобретению могут блокировать гомо- или гетероолигомеры Kvl.5 или Kvl.5 в комплексах с