Патент на изобретение №2344133
|
||||||||||||||||||||||||||
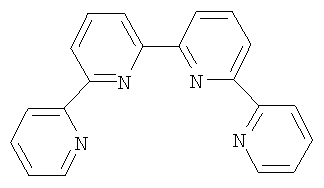
(54) СПОСОБ ПОЛУЧЕНИЯ 2,2′:6′,2”:6”,2”’-ТЕТРАПИРИДИНА
(57) Реферат:
Предложен способ получения 2′:6′,2″:6″,2″‘-тетрапиридина,
включающий димеризацию, отличающийся тем, что проводят димеризацию N-оксида бипиридина в присутствии 0,5 экв. трет-бутиллития с последующим восстановлением триэтилфосфитом. Технический результат: предлагаемый способ является более простым и более привлекательным с экологической точки зрения, также нет необходимости в использовании дорогих катализаторов.
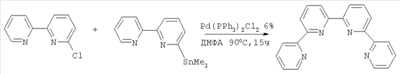
Изобретение относится к области синтеза 2,2′:6′,2″:6″,2″‘-тетрапиридина (дальше по тексту тетрапиридин), соединения, способного образовывать прочные комплексы с переходными металлами и их солями и служить строительными блоками в металлосупрамолекулярной химии. 2,2′:6’,2″:6″,2″‘-Тетрапиридин относится к классу олигопиридинов, обладающих возможностью контролировать сборку спиральных супрамолекулярных систем [Constable, Е.С.Tetrahedron 1992, 48, 10013. Constable, Е.С.Prog. Inorg. Chem. 1994, 42, 67. Potts, К. Т.; Keshavarz-K, M.; Tham, F. S.; Abruna, H.D.; Arana, C. R. Inorg. Chem. 1993, 32, 4422. Lindsey, J. S. New J. Chem. 1991, 15, 153. Balzani, V.; Campagna, S.; Denti, G.; Juris, A.; Serroni S.; Venturi, M. Acc. Chem. Res. 1998, 31, 26. Piguet, C; Berardinelli, G.; Hopfgartner, G. Chem. ReV. 1997, 97, 2005]. Главное преимущество комплексов металлов и тетрапиридина в том, что они содержат планарный лиганд в тетрадентатном координационном состоянии, особенно для ионов с октаэдрической или планарно-квадратной геометрией. В случае тетраэдральной геометрии, обычно d10 конфигураций меди (I) и серебра (I), образуются диядерные двухспиральные комплексы, где тетрапиридин играет роль мостикового лиганда, спирально оборачиваясь вокруг металла благодаря вращению вокруг С-С связей между пиридинами [Lehn, J. М.; Sauvage, J. P.; Simon, J.; Ziessel, R.; Piccinni-Leopardi, C; Germain, G.; Declercq, J. P.; Van Meerssche, M. Nou V.J. Chem. 1983, 7, 413; Constable, E. C; Hannon, M. J.; Martin, P. A.; Raithby, P. R.; Tocher D. A. Polyhedron 1992, 11, 2967]. Изобретение может быть использовано в аналитической химии, катализе стереоселективного синтеза и в супрамолекулярной химии. Актуальность проблемы катализа в стереоселективном синтезе (отход от синтеза рацемических смесей лекарств), поиск новых материалов, обладающих уникальными свойствами, такими как способность хранения информации на молекулярном уровне, материалов для нанотехнологии и т.д., вызывает постоянную потребность в синтезе лигандов с хорошим выходом без использования жестких условий и в отсутствие катализа. Описано получение 2,2′:6′,2″:6″,2″‘-тетрапиридина в результате реакции аза Дильса-Альдера между бицикло[2.2.1]гепта-2,5-диеном и 1,2,4-триазином [Gunther R. Pabst and Jiirgen Sauer A New and Simple ‘LEGO’ System for the Synthesis of 2,6-Oligopyridines, Tetrahedron Letters 39 (1998) 6687-6690], общий выход 67%, однако синтез требует многодневной выдержки на стадии получения 3,5-дизамещенного триазина: Известно получение тетрапиридина с помощью реакции кросс-сочетания Стилле [Diego J. Cárdenas, Jean-Pierre Sauvage Improved Synthesis of 2,6-Oligopyriflines by Stille Cross-coupling Reaction, Synlett, 1996 (9), 916-918] (выход 46%): Наиболее близким к предлагаемому способу является реакция кросс-сочетания 6-хлор-2,2′-бипиридина в присутствии никелевого катализатора Ni(PPh3)2Cl2 и избытка Zn, которая была выбрана прототипом [Daniela Belli Dell’ Amico, Fauslo Calderazzo, Matteo Curiardi, Urea Labella, and Fabio Marchetli Bis-qtpy (qtpy=2,2′:6′,2″:6″,2″‘-quaterpyridine) Metal Complexes, [M(qtpy)2]2+, Inorganic Chemistry 2004, 43(17), 5459-5465], выход 40-63%: Недостатками известных способов получения 2,2′:6′,2″:6″,2″‘-тетрапиридина являются длительность процесса пролучения (до 3 суток), низкие выходы, необходимость утилизации галогенпроизводных бипиридина, использование катализаторов, в том числе в одном методе дорогостоящего палладиевого. Предлагается новый способ синтеза 2′:6′,2″:6″,2″‘-тетрапиридина, основанный на реакции моно N-оксида бипиридина с недостатком не нуклеофильного литиирующего агента, такого как третбутиллитий. В результате металлирования половины N-оксида бипиридина получается его литиевое производное, которое выступает в качестве нуклеофила в дальнейшей реакции нуклеофильного замещения водорода между N-оксидом бипиридина (электрофил) и его литийпроизводным (нуклеофил). В результате реакции получается 1′-оксид 2′:6’,2″:6″,2″‘-тетрапиридина, который с количественным выходом восстанавливается триэтилфосфитом до 2′:6’,2″:6″,2″‘-тетрапиридина: Общий выход по предлагаемой схеме получения 2,2′:6′,2″:6″,2″‘-тетрапиридина составляет 72%. В спектре 1Н ЯМР полученного по предлагаемому способу тетрапиридина присутствуют пики: (DMSO-d6/CCl4, шкала В качестве прототипа выбрана реакция кросс-сочетания 6-хлор-2,2′-бипиридина в присутствии никелевого катализатора Ni(PPh3)2Cl2 и избытка Zn [Daniela Belli Dell’ Amico, Fauslo Calderazzo, Matteo Curiardi. Urea Labella, and Fabio Marchetli Bis-qtpy (qtpy=2,2′:6′,2″:6″,2″‘-quaterpyridine) Metal Complexes, [M(qtpy)2]2+, Inorganic Chemistry 2004, 43(17), 5459-5465]. Таким образом, предлагаемый способ позволяет получить больший выход 2′:6′,2″:6″,2″‘-тетрапиридина (74% против 63% по способу-прототипу). Предлагаемый способ более простой и более привлекательный с экологической точки зрения. В предлагаемом способе нет необходимости предварительного введения в молекулу исходного соединения галогена, а затем утилизации его из продуктов реакции. В предлагаемом способе нет необходимости в использовании дорогих катализаторов и длительной выдержки реакционной массы. Ниже приведен синтез 2′:6′,2″:6″,2″‘-тетрапиридина и физико-химические характеристики получаемых соединений. Спектры 1Н ЯМР (в.DMSO-d6 с добавлением CCl4) записаны на приборе Bruker WM-250, внутренний стандарт – ТМС. Масс-спектры получены на приборе “Varian МАТ-311А”, ионизация потоком электронов, энергия ионизирующих электронов 70эВ, прямой ввод образцов, температура ионизационной камеры 100-300°С. Элементный анализ осуществлялся на приборе Perkin-Elmer 2400-II. Температуры плавления не корректировались. Контроль за ходом реакции и чистотой продуктов осуществлялся методом ТСХ на пластинах Silufol UV-254, элюент – этилацетат, проявление – УФ-светом. Синтез 1′-оксида 2′:6′,2″:6″,2″‘-тетрапиридина 2 В 100 мл круглодонную колбу, снабженную отводом с запорным краном, помещают раствор моно N-оксида бипиридина (1.72 г, 10 ммоль) в 50 мл абсолютном ТГФ, колбу вакуумируют и промывают аргоном, охлаждают до -78°С и через мембрану шприцем вносят 1.5М раствор трет-бутиллития в гексане (3.7 мл, 5.5 ммоль). Реакционную массу выдерживают при этой температуре 30 минут и оставляют нагреваться до комнатной температуры (1-2 часа). Реакционную массу упаривают в вакууме, остаток обрабатывают дистиллированной водой и полученную суспензию фильтруют, осадок на фильтре промывают дистиллированной водой, сушат на воздухе. Кристаллизуют из н-бутанола. Выход 1.20 г, 74%. Т пл. 204°С. 1Н ЯМР (DMSO-d6/CCl4, шкала Синтез 2′:6′,2″:6″,2″‘-тетрапиридина 3 В 10 мл круглодонную колбу, снабженную обратным холодильником, помещают 978 мг (3 ммоль) 1′-оксида 2′:6′,2″:6″,2″‘-тетрапиридина и 1.5 мл (9 ммоль) триэтилфосфита. Смесь кипятят с обратным холодильником до тех пор, пока на ТСХ не будет фиксироваться присутствие исходного оксида тетрапиридина. Смесь упаривают в вакууме. Остаток перекристаллизовывают из этанола. Выход 911 мг, 98%. Т пл. 210-212°С. 1Н ЯМР (DMSO-d6/CCl4, шкала Схема прототипа
Формула изобретения
Способ получения 2,2′:6′,2″:6″,2″‘-тетрапиридина,
включающий димеризацию, отличающийся тем, что проводят димеризацию N-оксида бипиридина в присутствии 0,5 экв. трет-бутиллития с последующим восстановлением триэтилфосфитом.
|
||||||||||||||||||||||||||

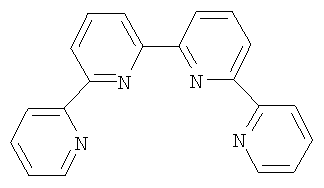

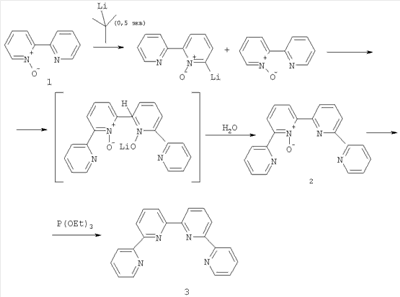
 ) 8.8-8.6 (м, 6Н), 8.5 (дд, 2Н), 8.1 (тд, 2Н), 7.9 (тдд, 2Н), 7.4 (дт, 2Н). В масс-спектре присутствует пик молекулярного иона 310(100) М+. Температура плавления полученного образца 210-212°С (из н-бутанола) соответствует Т пл., описанной в литературе 208-210°С (из бензола) [Gunther R. Pabst and Jiirgen Sauer A New and Simple ‘LEGO’ System for the Synthesis of 2,6-Oligopyridines, Tetrahedron Letters 39 (1998) 6687-6690].
) 8.8-8.6 (м, 6Н), 8.5 (дд, 2Н), 8.1 (тд, 2Н), 7.9 (тдд, 2Н), 7.4 (дт, 2Н). В масс-спектре присутствует пик молекулярного иона 310(100) М+. Температура плавления полученного образца 210-212°С (из н-бутанола) соответствует Т пл., описанной в литературе 208-210°С (из бензола) [Gunther R. Pabst and Jiirgen Sauer A New and Simple ‘LEGO’ System for the Synthesis of 2,6-Oligopyridines, Tetrahedron Letters 39 (1998) 6687-6690].