|
|
(21), (22) Заявка: 2005134685/04, 06.04.2004
(24) Дата начала отсчета срока действия патента:
06.04.2004
(30) Конвенционный приоритет:
10.04.2003 FR 0304486
(43) Дата публикации заявки: 10.06.2006
(46) Опубликовано: 20.01.2009
(56) Список документов, цитированных в отчете о
поиске:
WO 01/55122 A, 02.08.2001. JP 54014986 A, 03.02.1979. US 3894027 А, 08.07.1975. Терентьев А.П., Потапов В.М. Основы стереохимии. – М., 1964, с.388-94.
(85) Дата перевода заявки PCT на национальную фазу:
10.11.2005
(86) Заявка PCT:
EP 2004/002476 (06.04.2004)
(87) Публикация PCT:
WO 2004/089917 (21.10.2004)
Адрес для переписки:
101000, Москва, М.Златоустинский пер., 10, кв.15, ЕВРОМАРКПАТ, пат.пов. И.А.Веселицкой, рег. № 11
|
(72) Автор(ы):
МУАНЕ Жерар (FR),
КРАВО Даньель (FR),
ПАССЕМАР Тьерри (FR)
(73) Патентообладатель(и):
МЕРК ПАТЕНТ ГМБХ (DE)
|
(54) СПОСОБ РАЗДЕЛЕНИЯ АМИНОВ, КОТОРЫЕ ЯВЛЯЮТСЯ ПОЛЕЗНЫМИ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ, АССОЦИИРОВАННЫХ С СИНДРОМОМ ИНСУЛИНРЕЗИСТЕНТНОСТИ
(57) Реферат:
Описывает способ разделения рацемического соединения формулы (I), представленной ниже
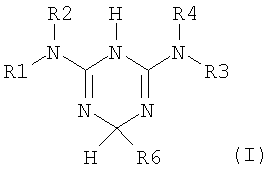
в которой R1, R2, R3 и R4 независимо означают – Н или C1-6алкил; R6 – С1-6алкил или С3-8циклоалкил, путем реакции, рацемического соединения I с хиральной кислотой, как-то: (-)-ди-O,O’-п-толил-L-винная, R(-)- или S(+)-1,1′-бинафталин-2,2′-диил гидрофосфат, с последующей очисткой полученной диастереоизомерной соли и высвобождением необходимого энантиомера формулы (I) в виде фармацевтически приемлемой соли. Способ позволяет легко и экономично получить чистые энантиомеры. 9 з.п. ф-лы, 4 ил.
Настоящее изобретение направлено на процесс разделения аминов, полученных из дигидро-1,3,5-триазинов, из соответствующей рацемической смеси.
Соединения семейства дигидротриазинов являются предпочтительными, в частности, с точки зрения их фармакологических свойств.
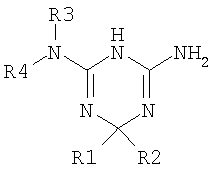
В литературе имеется множество документов, касающихся дигидро-1,3,5-триазинов. Так, патентная заявка WO 01/53276 описывает дигидротриазины, которые имеют следующую формулу:
в которой R1 может быть водородом, в качестве ингибиторов тригидрофолатредуктазы, в частности, обладающих антималярийной активностью.
Реферат JP 48064088 описывает дигидротриазины, имеющие следующую формулу:
в которой R1 может быть водородом. Эти соединения описаны как такие, которые обладают активностью снижения уровня глюкозы в крови.
Реферат JP 54014986 описывает дигидротриазины, имеющие следующую формулу:
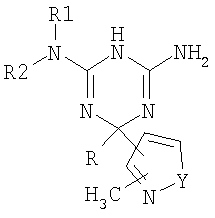
в которой R может быть водородом, в качестве соединений, обладающих антидиабетической активностью.
Патент US 3287,366 описывает дигидротриазины формулы
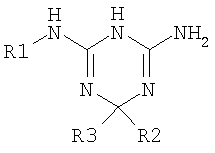
в которой R3 может быть водородом, в качестве гербицидных соединений.
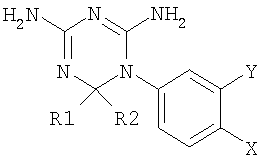
Описание к патентной заявке WO 01/55122 описывает дигидротриазины, соответствующие следующей формуле:
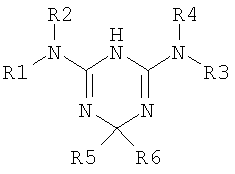
в которой R5 может быть водородом. Эти соединения могут использоваться при лечении расстройств, ассоциированных с синдромом инсулинрезистентности.
Все эти соединения несут асимметричный углерод, когда R группы, указанные выше, представляют собой водород. Соответствующие энантиомеры не были раскрыты в публикациях. Подобно этому ни один из документов, опубликованных на данный момент, не описывает или не предлагает способа для их получения.
Известно, что биологическая активность энантиомеров рацемических соединений может отличаться в значительной степени для двух энантиомеров. Таким образом, часто существует один энантиомер, который обладает более выраженной активностью, что делает его более предпочтительным в качестве активного начала лекарственного средства.
Применение энантиомера вместо рацемата является преимущественным. В частности, более высокая активность идентифицированного энантиомера дает возможность уменьшить дозу активного начала в лекарственном средстве. Более низкая доза также позволяет снизить вредные побочные эффекты. Таким образом, для активного начала является желательным, чтобы оно содержало только чистый энантиомер, который обладает самыми высокими желательными биологическими эффектами.
Существуют многочисленные способы для разделения рацемической смеси на два чистых изомера. Для дальнейшей информации в этом отношении можно сделать ссылку на книгу «Хиротехнология» Р.А. Шелдона (1993), опубликованную издательством Деккер.
Примеры таких способов, которые могут быть упомянуты, включают:
– разделение на основе различия физических свойств;
– разделение на основе применения биотехнологических способов (цельные клетки, ферменты, и т.д.);
– разделение на основе применения хроматографических способов;
– разделение на основе образования диастереоизомеров (солей, добавление хирального центра).
Целью настоящего изобретения является, таким образом, предложить способ разделения рацемической смеси аминопроизводных дигидро-1,3,5-триазинов, как определено выше.
В процессе разделения рацемической смеси необходимо иметь доступный способ мониторинга энантиомерного избытка. Стандартный способ заключается в мониторинге изменения оптического вращения диастереоизомерной соли или энантиомера. Однако этот способ является относительно неприемлемым в случае соединений с низким оптическим вращением.
Применение хиральной ВЭЖХ также является способом, который часто используется. Однако было обнаружено, что этот способ не позволяет получить результат, который можно использовать.
Мы неожиданно обнаружили, что применение хиральной ВЭЖХ в суперкритической фазе позволяет визуализировать два энантиомера. Эта технология в настоящее время была подвергнута значительным усовершенствованиям в аналитической и препаративной части. Основные принципы этой технологии описаны, например, в книге «Chromatographies en phase liquide et supercritique [Liquid-phase and supercritical-phase chromatography]», опубликованной издательством Masson, Paris, 1991.
Способ в соответствии с изобретением, таким образом, позволяет легко и экономично получить чистые энантиомеры.
Процесс разделения, в частности, вовлекает этап асимметричного превращения рацемического соединения структуры (I), представленной ниже
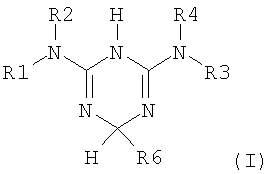
в которой:
R1, R2, R3 и R4 являются независимо выбранными из следующих групп:
-Н;
– алкила (С1-С20), необязательно замещенного галогеном, алкилом (С1-С5), алкокси (С1-С5) или циклоалкилом (С3-С8);
– алкилена (С2-С20), необязательно замещенного галогеном, алкилом (С1-С5) или алкокси (С1-С5);
– алкина (С2-С20), необязательно замещенного галогеном, алкилом (С1-С5) или алкокси (С1-С5);
– циклоалкила (С3-С8), необязательно замещенного алкилом (С1-С5) или алкокси (С1-С5);
– гетероциклоалкила (С3-С8), несущего один или более гетероатомов, выбранных из N, О и S, и необязательно замещенного алкилом (С1-С5) или алкокси (С1-С5);
– арил (С6-С14) алкила (С1-С20), необязательно замещенного амино, гидроксилом, тио, галогеном, алкилом (С1-С5), алкокси (С1-С5), алкилтио (С1-С5), алкиламино (С1-С5), арил (С6-С14) окси, арил (С6-С14) алкокси (С1-С5), циано, трифторметилом, карбоксилом, карбоксиметилом или карбоксиэтилом;
– арила (С6-С14), необязательно замещенного амино, гидроксилом, тио, галогеном, алкилом (С1-С5), алкокси (С1-С5), алкилтио (С1-С5), алкиламино (С1-С5), арил (С6-С14) окси, арил (С6-С14) алкокси (С1-С5), циано, трифторметилом, карбоксилом, карбоксиметилом или карбоксиэтилом; или
– гетероарила (С1-С13), несущего один или более гетероатомов, выбранных из N, О и S, и необязательно замещенного амино, гидроксилом, тио, галогеном, алкилом (С1-С5), алкокси (С1-С5), алкилтио (С1-С5), алкиламино (С1-С5), арил (С6-С14) окси, арил (С6-С14) алкокси (С1-С5), циано, трифторметилом, карбоксилом, карбоксиметилом или карбоксиэтилом;
R1 и R2, с одной стороны, и R3 и R4, с другой стороны, возможно образующие с атомом азота n-членное кольцо (n представляет собой число от 3 до 8), необязательно включают один или более гетероатомов, выбранных из N, О и S, и возможно являются замещенными одной из следующих групп: амино, гидроксилом, тио, галогеном, алкилом (С1-С5), алкокси (С1-С5), алкилтио (С1-С5), алкиламино (С1-С5), арил (С6-С14) окси, арил (С6-С14) алкокси (С1-С5), циано, трифторметилом, карбоксилом, карбоксиметилом или карбоксиэтилом;
R6 является выбранным из следующих групп:
– алкила (С1-С20), необязательно замещенного амино, гидроксилом, тио, галогеном, алкилом (С1-С5), алкокси (С1-С5), алкилтио (С1-С5), алкиламино (С1-С5), арил (С6-С14) окси, арил (С6-С14) алкокси (С1-С5), циано, трифторметилом, карбоксилом, карбоксиметилом или карбоксиэтилом;
– алкилена (С2-С20), необязательно замещенного амино, гидроксилом, тио, галогеном, алкилом (С1-С5), алкокси (С1-С5), алкилтио (С1-С5), алкиламино (С1-С5), арил (С6-С14) окси, арил (С6-С14) алкокси (С1-С5), циано, трифторметилом, карбоксилом, карбоксиметилом или карбоксиэтилом;
– алкина (С2-С20), необязательно замещенного амино, гидроксилом, тио, галогеном, алкилом (С1-С5), алкокси (С1-С5), алкилтио (С1-С5), алкиламино (С1-С5), арил (G6-C14) окси, арил (С6-С14) алкокси (С1-С5), циано, трифторметилом, карбоксилом, карбоксиметилом или карбоксиэтилом;
– циклоалкила (С3-С8), необязательно замещенного амино, гидроксилом, тио, галогеном, алкилом (С1-С5), алкокси (С1-С5), алкилтио (С1-С5), алкиламино (С1-С5), арил (С6-С14) окси, арил (С6-С14) алкокси (С1-С5), циано, трифторметилом, карбоксилом, карбоксиметилом или карбоксиэтилом;
– гетероциклоалкила (С3-С8), несущего один или более гетероатомов, выбранных из N, О и S, и необязательно замещенного амино, гидроксилом, тио, галогеном, алкилом (С1-С5), алкокси (С1-С5), алкилтио (С1-С5), алкиламино (С1-С5), арил (С6-С14) окси, арил (С6-С14) алкокси (С1-С5), циано, трифторметилом, карбоксилом, карбоксиметилом или карбоксиэтилом;
– арила (С6-С14), необязательно замещенного амино, гидроксилом, тио, галогеном, алкилом (С1-С5), алкокси (С1-С5), алкилтио (С1-С5), алкиламино (С1-С5), арил (С6-С14) окси, арил (С6-С14) алкокси (С1-С5), циано, трифторметилом, карбоксилом, карбоксиметилом или карбоксиэтилом;
– гетероарила (С1-С13), несущего один или более гетероатомов, выбранных из N, О и S, и необязательно замещенного амино, гидроксилом, тио, галогеном, алкилом (С1-С5), алкокси (С1-С5), алкилтио (С1-С5), алкиламино (С1-С5), арил (С6-С14) окси, арил (С6-С14) алкокси (С1-С5), циано, трифторметилом, карбоксилом, карбоксиметилом или карбоксиэтилом;
– арил (С6-С14) алкила (С1-С5), необязательно замещенного амино, гидроксилом, тио, галогеном, алкилом (С1-С5), алкокси (С1-С5), алкилтио (С1-С5), алкиламино (С1-С5), арил (С6-С14) окси, арил (С6-С14) алкокси (С1-С5), циано, трифторметилом, карбоксилом, карбоксиметилом или карбоксиэтилом.
Для одной предпочтительной подгруппы соединений формулы (I), R3 и R4 представляют собой атом водорода. Для другой предпочтительной подгруппы соединений формулы (I) R1 и R2 представляют собой С1-С3 алкильную группу, предпочтительно метил.
Соединения формулы (I), которые являются особенно предпочтительными, представляют собой: гидрохлорид (+)-2-амино-3,6-дигидро-4-диметиламино-6-метил-1,3,5-триазина; гидрохлорид (-)-2-амино-3,6-дигидро-4-диметиламино-6-метил-1,3,5-триазина; гидрохлорид (+)-2-амино-6-циклогексил-3,6-дигидро-4-диметиламино-1,3,5-триазина и гидрохлорид (-)-2-амино-6-циклогексил-3,6-дигидро-4-диметиламино-1,3,5-триазина.
Способ в соответствии с изобретением в более общем виде включает следующие этапы:
– получение диастереизомерных солей соединений в соответствии с формулой (I);
– очистку полученного диастереоизомера;
– высвобождение чистого энантиомера из очищенного диастереоизомера.
Разделение осуществляют в присутствии хирального реагента.
Поскольку целевые соединения представляют собой амины, то хиральная кислота преимущественно используется в качестве хирального реагента для разделения рацемической смеси.
Полученную таким образом диастереоизомерную соль потом подвергают этапу очистки, и впоследствии энантиомер высвобождают из очищенной соли.
Примеры хиральных кислот, которые могут использоваться, включают: (+)-D-ди-О-бензоилвинную кислоту, (-)-L-ди-О-бензоилвинную кислоту, (-)-ди-О,О’-п-толил-L-винную кислоту, (+)-ди-O,O’-п-толил-D-винную кислоту, R(+)-яблочную кислоту, S-(-)-яблочную кислоту, (+)-камфановую кислоту, (-)-камфановую кислоту, R(-)-1,1′-бинафталин-2,2′-диил гидрофосфат, S(+)-1,1′-бинафталин-2,2′-диил гидрофосфат, (+)-камфарную кислоту, (-)-камфарную кислоту, S(+)-2-фенилпропионовую кислоту, R(-)-2-фенилпропионовую кислоту, D(-)-манделовую кислоту, L(+)-манделовую кислоту, D-винную кислоту, L-винную кислоту или их смеси.
Хиральную кислоту предпочтительно выбирают из группы, состоящей из (-)-ди-O,O’-п-толил-L-винной кислоты, (+)-ди-O,O’-п-толил-D-винной кислоты, R(-)-1,1′-бинафталин-2,2′-диил гидрофосфата, S(+)-1,1′-бинафталин-2,2′-диил гидрофосфата, D-винной кислоты и L-винной кислоты.
Образование диастереоизомерной соли может быть осуществлено в полярном растворителе или в смеси растворителей, включающей, по крайней мере, один полярный растворитель.
Образование диастереоизомерной соли может быть осуществлено при температуре, которая колеблется от -10°С до точки кипения растворителя или смеси растворителей.
Когда диастереоизомерная соль уже изолирована, а в более общем случае в любой момент времени, энантиомерный избыток проверяется с помощью суперкритической хиральной ВЭЖХ.
При осуществлении методики ВЭЖХ суперкритической фазы мобильная фаза, которая прошла через стационарную фазу, содержит газ в суперкритическом состоянии.
Этот газ предпочтительно представляет собой диоксид углерода, принимая во внимание его дешевизну, его высокую летучесть, а также его безвредность для атмосферы. Таким образом, эта методика имеет, в частности, на промышленных предприятиях, где количества смеси мобильной фазы могут быть значительными, то преимущество, что является безвредной как для рабочих, так и для окружающей среды. Кроме того, высокая летучесть позволяет легко осуществлять разделение очищенного соединения, когда очистка завершена.
Мобильная фаза ВЭЖХ будет в общем случае содержать от 60 об.% до 100 об.% СО2. Остаток готовят при использовании растворителя или смеси растворителей. Они предпочтительно представляют собой полярные растворители, используемые как модификаторы полярности мобильной фазы. Эти растворители могут быть выбраны, например, из спиртов, галогенированных алкилов, простых эфиров и нитрилов.
Мобильная фаза ВЭЖХ может также включать кислые или основные модификаторы полярности. Примеры кислых модификаторов полярности, которые могут быть, в частности, упомянуты, включают необязательно галогенированные карбоновые кислоты, такие как трифторуксусная кислота, уксусная кислота и муравьиная кислота. Основные модификаторы полярности, которые могут быть упомянуты, включают алкиламины, такие как диэтиламин и триэтиламин. Мобильная фаза ВЭЖХ в общем случае включает от 0,01 об.% до 2 об.% кислого или основного модификатора полярности.
Стационарную фазу ВЭЖХ (колонку) выбирают из энантиоселективных стационарных фаз. Колонки на основе олигосахаридов или полисахаридов являются особенно приемлемыми. Такие колонки являются коммерчески доступными, в частности, под наименованиями Chiralcel® от Daicel или Chirose® от Chiralsep.
Температуру и давление в колонке устанавливают таким образом, что газ, содержащийся в мобильной фазе, находится в суперкритическом состоянии. Обычно выбирают давление от 80 до 350 бар, предпочтительно от 100 до 200 бар и, в частности, от 120 до 170 бар.
Температуру предпочтительно устанавливают на уровне от 30 до 50°С.
Диастереоизомерная соль в раствор вводится в количестве, которое зависит от используемых колонок, и, в частности, от их размера. Способ будет, в частности, осуществляться с объемами от 5 до 50 мкл.
Скорость истечения мобильной фазы обычно устанавливают в интервале от 1 до 3,5 мл/мин и предпочтительно от 2 до 3 мл/мин.
Когда диастереоизомерная соль изолирована, она очищается до желаемой диастереоизомерной чистоты, например, с помощью перекристаллизации в приемлемом растворителе или смеси растворителей.
Очищенную диастереоизомерную соль впоследствии растворяют в основной или кислой среде в приемлемом растворителе или смеси растворителей. Таким образом, желаемый энантиомер восстанавливают из рацемической смеси соединения структуры (I).
Если энантиомер структуры (I), полученный из рацемической смеси, изолируют в основной форме, то он может быть преобразован в соль при использовании фармацевтически приемлемой органической или неорганической кислоты.
Объектом изобретения также являются энантиомеры формулы (I), в которой R1, R2, R3, R4 и R6 имеют значения, приведенные выше.
Энантиомеры являются особенно полезными для получения лекарственных средств для лечения диабета, расстройств, ассоциированных с синдромом инсулинрезистентности, или, альтернативно, патологий, связанных с диабетом, таких как атеросклероз и микро- и макроангиопатия. В завершение, энантиомеры в соответствии с изобретением являются также полезными для получения лекарственных средств, которые используются для лечения малярии.
Изобретение иллюстрируется с помощью следующих фигур, которые показывают:
Фиг.1: хроматограмму хиральной ВЭЖХ с суперкритической фазой исходного рацемического соединения Примера 1, при этом время удержания составляет 8,77 минут для (+) энантиомера и 10,48 минут для (-) энантиомера;
Фиг.2: хроматограмму хиральной ВЭЖХ с суперкритической фазой (+) энантиомерного соединения Примера 1 после осуществления очистки;
Фиг.3: хроматограмму хиральной ВЭЖХ с суперкритической фазой исходного рацемического соединения Примера 2, при этом время удержания составляет 11,74 минуты для (+) энантиомера и 13,84 минуты для (-) энантиомера;
Фиг.4: хроматограмму хиральной ВЭЖХ с суперкритической фазой (-) энантиомерного соединения Примера 2 после осуществления очистки.
Изобретение также будет описано более подробно с помощью примеров, которые приведены ниже и которые не предназначены для его ограничения.
Пример 1
Получение гидрохлорида (+)-2-амино-3,6-дигидро-4-диметиламино-6-метил-1,3,5-триазина
Раствор 348,5 г (-)-ди-O,O’-п-толил-L-винной кислоты в 1 л метанола прибавляли к раствору 200 г (±)-2-амино-3,6-дигидро-4-диметиламино-6-метил-1,3,5-триазина (хроматограмма Фигуры 1) в 1 л метанола. После перемешивания в течение 5 часов образовавшийся преципитат отфильтровывали при отсасывании (выход – 33%, чистота – 70%, определенная с помощью суперкритической хиральной ВЭЖХ, которую осуществляли на SF3 модели «суперкритической жидкостной хроматографической системы» от Giison при следующих условиях):
– давление:150 бар;
– скорость истечения: 2,5 мл/мин;
– стационарная фаза: Chirose ® W1-T (доступная от Chiralsep);
– мобильная фаза: 69,8% СО2, 30% метанола и 0,2% диэтиламина;
– температура колонки: 40°С;
– УФ-определение при 240 нм;
– вводимый объем: 20 мкл;
– концентрация: 1 мг/мл.
Состав мобильной фазы указан в значениях объема при рабочих условиях колонки.
Диастереоизомерную соль перекристаллизовывали из смеси ДМФ/95° этанол (1/1) (выход – 38%; чистота – 94%).
Обогащенную соль суспендировали в смеси вода/ацетат (1/1) и эту смесь охлаждали до температуры 0°С. Один эквивалент 2М соляной кислоты прибавляли таким образом, чтобы температура не превысила 5°С.
Интенсивное перемешивание поддерживали в течение 15 часов. Органическую фазу восстанавливали для того, чтобы повторно использовать (-)-ди-O,O’-п-толил-L-винную кислоту. Концентрировали водную фазу. Полученное твердое вещество перекристаллизовывали из 95° этанола с получением 20 г белого порошка (чистота – >99%; средний выход – 10%, 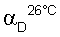 (С=5, Н2О)=+ 2,10) (Фигура 2). (С=5, Н2О)=+ 2,10) (Фигура 2).
Пример 2
Получение гидрохлорида (-)-2-амино-6-циклогексил-3,6-дигидро-4-диметиламино-1,3,5-триазина
Раствор 150 г (±)-2-амино-6-циклогексил-3,6-дигидро-4-диметиламино-1,3,5-триазина (Фигура 3) в 1,5 л этилацетата и 750 мл 95° этанола выдерживали при температуре 80°С до завершения растворения. Прибавляли раствор 100,9 г D(-)-винной кислоты в 750 мл 95° этанола, осуществляли нагревание в течение 1 часа, а потом смесь оставляли для охлаждения при комнатной температуре. Отфильтровывали образовавшийся преципитат с помощью отсасывания (выход -30%, чистота – 80,6%, определенная с помощью суперкритической хиральной ВЭЖХ на модели SF3 «суперкритической жидкостной хроматографической системы» от Giison, при следующих условиях:
– давление:150 бар;
– скорость истечения: 2,5 мл/мин;
– стационарная фаза: Chirose ® W1-Т (доступная от Chiralsep);
– мобильная фаза: 91% СО2, 8% метанола и 1% диэтиламина;
– температура колонки: 40°С;
– УФ-определение при 240 нм;
– вводимый объем: 20 мкл;
– концентрация: 1 мг/мл.
Состав мобильной фазы приведен в значениях объема при рабочих условиях колонки.
Твердое вещество растворяли в воде и прибавляли изобутанол. Прибавляли гидроокись натрия при интенсивном перемешивании и через несколько минут изолировали органическую фазу, высушивали над сульфатом натрия и концентрировали. Концентрат переносили в ацетонитрил и охлаждали до температуры 0°С, прибавляли один эквивалент гидрохлорида, растворенного в изопропаноле, таким образом, чтобы температура не превысила 5°С. Через несколько часов образовавшийся преципитат отфильтровывали при отсасывании, а потом перекристаллизовывали из этанола (24 г; чистота – >99%; средний выход – 16%, 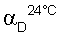 (C=5, H2O)=-109,40) (Фигура 4). (C=5, H2O)=-109,40) (Фигура 4).
Формула изобретения
1. Способ разделения рацемического соединения формулы (I), представленной ниже
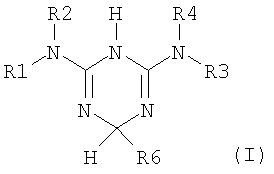
где R1, R2, R3 и R4 являются независимо выбранными из следующих групп:
-Н; алкил(С1-С6),
R6 является выбранным из следующих групп:
алкил(С1-С6), циклоалкил (С3-С8),
заключающийся в том, что осуществляют
а) взаимодействие рацемического соединения структуры (I) с хиральной кислотой, выбранной из группы, включающей (-)-ди-O,O’-п-толил-L-винную кислоту, R(-)-1,1′-бинафталин-2,2′-диил гидрофосфат, S(+)-1,1′-бинафталин-2,2′-диил гидрофосфат, с образованием соответствующей диастереоизомерной соли;
б) очистку полученной таким образом диастереоизомерной соли; и
в) высвобождение диастереоизомерной соли в виде одного из двух энантиомеров формулы (I) в форме фармацевтически приемлемой соли.
2. Способ по п.1, где R1 и R2 представляют собой СН3.
3. Способ по п.1 или 2, где R3 и R4 представляют собой Н.
4. Способ по любому из пп.1-3, в котором проверяют энантиомерный избыток одного из двух энантиомеров формулы (I) посредством суперкритической хиральной ВЭЖХ.
5. Способ по п.4, в котором мобильная фаза ВЭЖХ включает от 60 до 100 об.% CO2.
6. Способ по п.4 или 5, в котором мобильная фаза ВЭЖХ также включает полярный растворитель.
7. Способ по любому из пп.4-6, в котором мобильная фаза ВЭЖХ также включает кислотный или основной модификатор полярности.
8. Способ по любому из пп.4-7, в котором стационарная фаза ВЭЖХ представляет собой таковую на основе олигосахаридов или полисахаридов.
9. Способ по любому из пп.1-8, в котором энантиомер высвобождают из диастереоизомерной соли с помощью растворения его в основной или кислой среде в приемлемом растворителе или смеси растворителей.
10. Способ по любому из пп.1-9, в котором энантиомерно чистые соединения формулы (I) выбраны из группы, которая состоит из
гидрохлорида (+)-2-амино-3,6-дигидро-4-диметиламино-6-метил-1,3,5-триазина;
гидрохлорида (-)-2-амино-3,6-дигидро-4-диметиламино-6-метил-1,3,5-триазина;
гидрохлорида (+)-2-амино-6-циклогексил-3,6-дигидро-4-диметиламино-1,3,5-триазина и
гидрохлорида (-)-2-амино-6-циклогексил-3,6-дигидро-4-диметиламино-1,3,5-триазина;
РИСУНКИ
PC4A – Регистрация договора об уступке патента СССР или патента Российской Федерации на изобретение
Прежний патентообладатель:
Мерк Патент ГмбХ (DE)
(73) Патентообладатель:
ПОКСЕЛЬ САС (FR)
Договор № РД0053582 зарегистрирован 12.08.2009
Извещение опубликовано: 20.09.2009 БИ: 26/2009
|
|