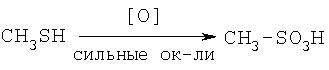Патент на изобретение №2344126
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СПОСОБ ПОЛУЧЕНИЯ МЕТАНСУЛЬФОКИСЛОТЫ
(57) Реферат:
Настоящее изобретение относится к способу получения метансульфокислоты. Предложенный способ получения метансульфокислоты состоит в том, что метансульфокислоту получают путем электролиза 1,0-4,0 М водного раствора диметилсульфоксида в присутствии фонового электролита в анодном отделении диафрагменного электролизера при плотностях тока 0,06-0,12 А/см2. Технический результат – разработка упрощенного эффективного синтеза метансульфокислоты без применения сильных окислителей и катализаторов. 2 табл.
Изобретение относится к области технологии получения серосодержащих органических соединений, в частности к с синтезу метансульфокислоты, используемой в качестве катализатора реакции нитрования, нитрозирования, этерификации, ацилирования, полимеризации алефинов, а также может быть использовано в химической, электронной и радиотехнической отраслях промышленности. Известен химический способ получения метансульфокислоты путем окисления метилмеркаптана сильными окислителями (азотная кислота, концентрированный раствор пероксида водорода и др.) [Химический энциклопедический словарь. М.: Советская энциклопедия, 1983, С.327, 552].
К недостаткам способов получения метансульфокислоты из метилмеркаптана относятся: использование легколетучих исходных веществ, обладающих низкой температурой кипения 37-38°С, кроме того, они обладают отвратительным запахом, работа с ними требует специальных мер предосторожности, необходимость использования сильных окислителей и сложность проведения реакций. Наиболее близким по сущности и достигнутому результату к заявленному изобретению является способ получения метансульфоскилоты по патенту [Патент №2062268 (Россия), кл. С1 от 20.06.1996 г. Способ получения метансульфокислоты / Котов Л.В., Артышова Н.И. и др.]. Согласно этому способу метансульфокислоту получают гидролизом метансульфохлорида при нагревании в присутствии катализатора сульфокислоты формулы: R-SO3Н, где R-C1-C18 алкил или незамещенный или замещенный алкилом финил, в количестве 0,1-1,05 мас.% при 65-95°С. Недостатком этого способа является использование исходного токсичного вещества, высокой температуры, а также катализаторов, что делает способ трудоемким и дорогим. Задачей данного изобретения является синтез метансульфокислоты путем электролиза водных растворов диметилсульфоксида. Технический результат заключается в упрощении процесса и повышении эффективности синтеза метансульфокислоты без применения сильных окислителей, катализаторов. Сущность предложенного способа заключается в том, что проводят электролиз 1,0-4,0 М водного раствора диметилсульфоксида в присутствии фонового электролита в анодном отделении диафрагменного электролизера на платиновом аноде при плотностях тока 0,06-0,12 А/см2. Процесс можно проводить и на диоксидносвинцовом аноде. Известно, что в водных растворах при высоких положительных потенциалах, соответствующих плотностям тока 0,06-0,12 А/см2, на аноде создаются благоприятные условия образования реакционно-способных ОН-частиц, пероксида водорода – Н2O2, приводящих к окислению диметилсульфоксида до метансульфокислоты. Сущность изобретения поясняется примерами. Пример 1. Электросинтез проводят в электролизере с разделением катодного и анодного пространства катионитовой мембраной. Анодом служит платина, катодом стальная пластина. В катодное отделение заливали 0,2 М H2SO4. В анодное – 3,0 М раствора ДМСО и 0,2 М раствора Н2SO4. Электролиз проводят при плотности анодного тока 0,1 А/см2 в течение 27 часов. После завершения электролиза осаждают сульфат-ионы добавлением гидроксида бария. Раствор отделяют от осадка и упаривают до получения расплывающейся на воздухе кристаллической массы, которая представляет собой метансульфокислоту. Идентификацию проводили путем определения температуры плавления, которая составляет 20°С, что соответствует справочному значению, а также методом снятия ИК-спектров натриевой соли метансульфокислоты. ИК-спектр снимали на спектрометре FT-801 с Фурье преобразованием. Полоса, характерная для S=O группы, проявляется при 1070- 1030 см-1. Количественное определение метансульфокислоты проводили гравиметрическим методом и методом кислотно-основного титрования. Метансульфокислота (СН3SO3Н) представляет собой сильную кислоту, t пл. 20°С, d=1.484, смешивается с водой, растворяется в полярных органических растворителях. Пример 2. Проводился аналогично примеру 1. Электролизу подвергали 0,5 М раствор диметилсульфоксида в водном растворе серной кислоты в течение 4,5 часов. Пример 3. Проводился аналогично примеру 1. Электролизу подвергали 4,5 М раствор диметилсульфоксида в водном растворе серной кислоты в течение 40 часов. Данные препаративного электросинтеза метансульфокислоты при различных концентрациях диметилсульфона представлены в таблице 1.
Из таблицы 1 видно, что наибольший выход метансульфокислоты по току и по веществу наблюдается в области концентраций 1,0-4,0 М ДМСО. За пределами этих концентраций выход сульфокислоты существенно падает. В табл.2 представлены данные препаративного электролиза метансульфокислоты, полученные путем электролиза раствора диметилсульфоксида оптимальной концентрации при различных плотностях тока. Пример 4. Электролиз проводится идентично примеру 1. Электролизу подвергают 2,0 М раствор диметилсульфоксида на фоне 0,2 М серной кислоты. Электролиз проводили при плотности тока 0,1 А/см2 в течение 18 часов. Пример 5. Проводился аналогично примеру 4 при плотности анодного тока 0,06 А/см2 в течение 31,5 часа. Пример 6. Проводился аналогично примеру 4 при плотности анодного тока 0,2 А/см2 в течение 9 часов. Данные препаративного электросинтеза метансульфокислоты при различных плотностях тока представлены в таблице 2.
Как следует из таблицы 2, ниже 0,06 и выше 0,2 А/см2 выход по току метансульфокислоты уменьшается, что обусловлено протеканием побочных реакций окисления диметилсульфоксида. Метансульфокислота, синтезируемая путем электролиза водных растворов диметилсульфоксида (ДМСО), получается в виде расплывающейся на воздухе массы высокой чистоты. Предложенный метод имеет некоторые преимущества по сравнению с химическим способом получения его из метилмеркаптана: 1. Синтез метансульфокислоты в предложенном методе осуществляют с использованием малотоксичного вещества – диметилсульфоксида, в то время как в химическом способе используется сильно пахучий и токсичный метилмеркаптан. 2. Синтез проводят без использования дорогих реактивов и сильных окислителей (азотная кислота, пероксид водорода). 3. Метансульфокислота получается высокой степени чистоты без осуществления большого числа операций. 4. Электросинтез метансульфокислоты осуществляется непрерывно с автоматическим контролем всего процесса. Таким образом, для заявленного способа в том виде, в каком он охарактеризован в описании, подтверждена возможность его осуществления просто и без использования дорогих реактивов и оборудования. Синтезируемое соединение – метансульфокислота находит применение в качестве реагента и катализатора в препаративном органическом синтезе и в фармацевтической промышленности.
Формула изобретения
Способ получения метансульфокислоты, отличающийся тем, что проводят электролиз 1,0-4,0 М водного раствора диметилсульфоксида в присутствии фонового электролита в анодном отделении диафрагменного электролизера при плотностях тока 0,06-0,12 А/см2.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||