Патент на изобретение №2344121
|
||||||||||||||||||||||||||
(54) СПОСОБЫ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ У МЛЕКОПИТАЮЩИХ
(57) Реферат:
Данное изобретение относится к
Предшествующий уровень техники Данное изобретение относится к некоторым Краткое изложение сущности изобретения Данное изобретение относится к соединениям формулы I
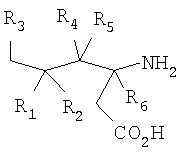
где R1 представляет собой водород или (С1-С6)алкил, возможно замещенный атомами фтора в количестве от одного до пяти; R2 представляет собой водород или (С1-С6)алкил, возможно замещенный атомами фтора в количестве от одного до пяти; или R1 и R2, вместе с атомом углерода, к которому они присоединены, образуют трех-шестичленное циклоалкильное кольцо; R3 представляет собой (С1-С6)алкил, (С3-С6)циклоалкил, (С3-С6)циклоалкил-(С1-С3)алкил, фенил, фенил-(С1-С3)алкил, пиридил, пиридил-(С1-С3)алкил, фенил-N(Н)- или пиридил-N(Н)-, где каждая из вышеупомянутых алкильных группировок может быть возможно замещена атомами фтора в количестве от одного до пяти, предпочтительно атомами фтора в количестве от нуля до трех, и где указанный фенил и указанный пиридил и фенильная и пиридильная группировки указанного фенил-(С1-С3)алкила и указанного пиридил-(С1-С3)алкила соответственно могут быть возможно замещены заместителями в количестве от одного до трех, предпочтительно заместителями в количестве от нуля до двух, независимо выбранными из хлоро, фторо, амино, нитро, циано, (С1-С3)алкиламино, (С1-С3)алкила, возможно замещенного атомами фтора в количестве от одного до трех, и (С1-С3)алкокси, возможно замещенного атомами фтора в количестве от одного до трех; R4 представляет собой водород или (С1-С6)алкил, возможно замещенный атомами фтора в количестве от одного до пяти; R5 представляет собой водород или (С1-С6)алкил, возможно замещенный атомами фтора в количестве от одного до пяти; и R6 представляет собой водород или (С1-С6)алкил; и фармацевтически приемлемым солям таких соединений. Конкретные воплощения данного изобретения включают следующие соединения формулы I и их фармацевтически приемлемые соли: 3-амино-5,8-диметил-нонановую кислоту; 3-амино-5,5,7-триметил-октановую кислоту; 3-амино-5,5,8-триметил-нонановую кислоту: 3-амино-5,5,6-триметил-гептановую кислоту; (3S,5S)-3-амино-5,8-диметил-нонановую кислоту; (3S,5R)-3-амино-5,8-диметил-нонановую кислоту; (3S)-3-амино-5,5,6-триметил-гептановую кислоту; (3S)-3-амино-5,5,7-триметил-октановую кислоту; (3S)-3-амино-5,5,8-триметил-нонановую кислоту и (3S)-3-амино-5,5,9-триметил-декановую кислоту. Другие примеры конкретных воплощений данного изобретения представляют собой следующие соединения формулы I и их фармацевтически приемлемые соли: 3-амино-6-циклобутил-5-метил-гексановую кислоту; 3-амино-7-циклопропил-5-метил-гептановую кислоту; 3-амино-7-циклобутил-5-метил-гептановую кислоту; 3-амино-7-циклопентил-6-метил-гептановую кислоту; 3-амино-7-циклогексил-5-метил-гептановую кислоту; 3-амино-8-циклопропил-5-метил-октановую кислоту; 3-амино-8-циклобутил-5-метил-октановую кислоту; 3-амино-8-циклопентил-5-метил-октановую кислоту; 3-амино-8-циклогексил-5-метил-октановую кислоту; 3-амино-6-циклопропил-5,5-диметил-гексановую кислоту; 3-амино-6-циклобутил-5,5-диметил-гексановую кислоту; 3-амино-6-циклопентил-5,5-диметил-гексановую кислоту; 3-амино-6-циклогексил-5,5-диметил-гексановую кислоту; 3-амино-7-циклопропил-5,5-диметил-гептановую кислоту; 3-амино-7-циклобутил-5,5-диметил-гептановую кислоту; 3-амино-7-циклопентил-5,5-диметил-гептановую кислоту; 3-амино-7-циклогексил-5,5-диметил-гептановую кислоту; (3S,5R)-3-амино-6-циклобутил-5-метил-гексановую кислоту; (3S,5R)-3-амино-7-циклопропил-5-метил-гептановую кислоту; (3S,5R)-3-амино-7-циклобутил-5-метил-гептановую кислоту; (3S,5R)-3-амино-7-циклопентил-5-метил-гептановую кислоту; (3S,5R)-3-амино-7-циклогексил-5-метил-гептановую кислоту; (3S,5R)-3-амино-8-циклопропил-5-метил-октановую кислоту; (3S,5R)-3-амино-8-циклобутил-5-метил-октановую кислоту; (3S,5R)-3-амино-8-циклопентил-5-метил-октановую кислоту; (3S,5R)-3-амино-8-циклогексил-5-метил-октановую кислоту; (3S,5S)-3-амино-6-циклобутил-5-метил-гексановую кислоту; (3S,5S)-3-амино-7-циклопропил-5-метил-гептановую кислоту; (3S,5S)-3-амино-7-циклобутил-5-метил-гептановую кислоту; (3S,5S)-3-амино-7-циклопентил-5-метил-гептановую кислоту; (3S,5S)-3-амино-7-циклогексил-5-метил-гептановую кислоту; (3S,5S)-3-амино-8-циклопропил-5-метил-октановую кислоту; (3S,5S)-3-амино-8-циклобутил-5-метил-октановую кислоту; (3S,5S)-3-амино-8-циклопентил-5-метил-октановую кислоту; (3S,5S)-3-амино-8-циклогексил-5-метил-октановую кислоту; (3S)-3-амино-6-циклопропил-5,5-диметил-гексановую кислоту; (3S)-3-амино-6-циклобутил-5,5-диметил-гексановую кислоту; (3S)-3-амино-6-циклопентил-5,5-диметил-гексановую кислоту; (3S)-3-амино-6-циклогексил-5,5-диметил-гексановую кислоту; (3S)-3-амино-7-циклопропил-5,5-диметил-гептановую кислоту; (3S)-3-амино-7-циклобутил-5,5-диметил-гептановую кислоту; (3S)-3-амино-7-циклопентил-5,5-диметил-гептановую кислоту и (3S)-3-амино-7-циклогексил-5,5-диметил-гептановую кислоту. Другие конкретные воплощения данного изобретения включают следующие соединения формулы 1 и их фармацевтически приемлемые соли: 3-амино-5-метил-гептановую кислоту; 3-амино-5-метил-октановую кислоту; 3-амино-5-метил-нонановую кислоту; 3-амино-5,5-диметил-нонановую кислоту; 3-амино-5,5-диметил-декановую кислоту; (3S)-3-амино-5,5-диметил-нонановую кислоту и (3S)-3-амино-5,5-диметил-декановую кислоту. Данное изобретение также относится к соединениям формулы IA
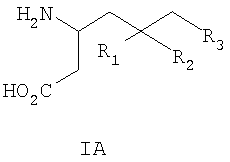
где R1 представляет собой водород или (С1-С3)алкил, возможно замещенный атомами фтора в количестве от одного до пяти; R2 представляет собой водород или (С1-С3)алкил, возможно замещенный атомами фтора в количестве от одного до пяти; или R1 и R2, вместе с атомом углерода, к которому они присоединены, образуют трех-шестичленное циклоалкильное кольцо; R3 представляет собой (С1-С6)алкил, (С3-С6)циклоалкил, (С3-С6)циклоалкил-(С1-С3)алкил, фенил, фенил-(С1-С3)алкил, пиридил, пиридил-(С1-С3)алкил, фенил-N(Н)- или пиридил-N(Н)-, где каждая из вышеупомянутых алкильных группировок может быть возможно замещена атомами фтора в количестве от одного до пяти, предпочтительно атомами фтора в количестве от нуля до двух, и где указанный фенил и указанный пиридил и фенильная и пиридильная группировки указанного фенил-(С1-С3)алкила и указанного пиридил-(С1-С3)алкила соответственно могут быть возможно замещены заместителями в количестве от одного до трех, предпочтительно заместителями в количестве от нуля до двух, независимо выбранными из хлоро, фторо, амино, нитро, циано, (С1-С3)алкиламино, (С1-С3)алкила, возможно замещенного атомами фтора в количестве от одного до трех, и (С1-С3)алкокси, возможно замещенного атомами фтора в количестве от одного до трех; при условии, что когда R1 представляет собой водород, тогда R2 не является водородом; и фармацевтически приемлемым солям таких соединений. Данное изобретение также относится к соединениям формулы IA-1
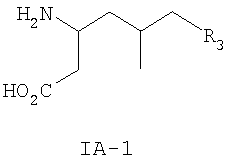
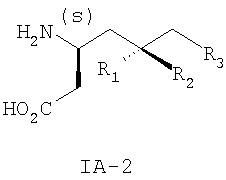
где R3 такой, как определено для формулы I выше, и фармацевтически приемлемым солям таких соединений. Другие конкретные воплощения данного изобретения включают следующие соединения формулы IA и их фармацевтически приемлемые соли: 3-амино-5-метил-8-фениламино-октановую кислоту; 3-амино-5-метил-7-фениламино-гептановую кислоту; 3-амино-5-метил-6-фениламино-гексановую кислоту; (3S,5R)-3-амино-5-метил-8-фениламино-октановую кислоту; (3S,5R)-3-амино-5-метил-7-фениламино-гептановую кислоту; (3S,5R)-3-амино-5-метил-6-фениламино-гексановую кислоту; (3S,5S)-3-амино-5-метил-8-фениламино-октановую кислоту; (3S,5S)-3-амино-5-метил-7-фениламино-гептановую кислоту; (3S,5S)-3-амино-5-метил-6-фениламино-гексановую кислоту; 3-амино-5-метил-8-фенил-октановую кислоту; 3-амино-8-(2-фтор-фенил)-5-метил-октановую кислоту; 3-амино-8-(3-фтор-фенил)-5-метил-октановую кислоту; 3-амино-8-(4-фтор-фенил)-5-метил-октановую кислоту; 3-амино-8-(2-трифтор-фенил)-5-метил-октановую кислоту; 3-амино-8-(3-трифтор-фенил)-5-метил-октановую кислоту; 3-амино-8-(4-трифтор-фенил)-5-метил-октановую кислоту; 3-амино-5-метил-8-орто-толил-октановую кислоту; 3-амино-5-метил-8-мета-толил-октановую кислоту; 3-амино-5-метил-8-пара-толил-октановую кислоту; 3-амино-5-метил-8-пара-толил-октановую кислоту; 3-амино-8-(2,3-дифтор-фенил)-5-метил-октановую кислоту; 3-амино-8-(2,4-дифтор-фенил)-5-метил-октановую кислоту; 3-амино-8-(2,5-дифтор-фенил)-5-метил-октановую кислоту; 3-амино-8-(2,6-дифтор-фенил)-5-метил-октановую кислоту; (3S,5R)-3-амино-5-метил-8-фенил-октановую кислоту; (3S,5S)-3-амино-5-метил-8-фенил-октановую кислоту; (3S,5R)-3-амино-8-(2-фтор-фенил)-5-метил-октановую кислоту; (3S,5S)-3-амино-8-(2-фтор-фенил)-5-метил-октановую кислоту; (3S,5R)-3-амино-8-(3-фтор-фенил)-5-метил-октановую кислоту; (3S,5S)-3-амино-8-(3-фтор-фенил)-5-метил-октановую кислоту; (3S,5R)-3-амино-8-(4-фтор-фенил)-5-метил-октановую кислоту; (3S,5S)-3-амино-8-(4-фтор-фенил)-5-метил-октановую кислоту; (3S,5R)-3-амино-8-(2-трифтор-фенил)-5-метил-октановую кислоту; (3S,5S)-3-амино-8-(2-трифтор-фенил)-5-метил-октановую кислоту; (3S,5R)-3-амино-8-(3-трифтор-фенил)-5-метил-октановую кислоту; (3S,5S)-3-амино-8-(3-трифтор-фенил)-5-метил-октановую кислоту; (3S,5R)-3-амино-8-(4-трифтор-фенил)-5-метил-октановую кислоту; (3S,5S)-3-амино-8-(4-трифтор-фенил)-5-метил-октановую кислоту; (3S,5R)-3-амино-5-метил-8-орто-толил-октановую кислоту; (3S,5S)-3-амино-5-метил-8-орто-толил-октановую кислоту; (3S,5R)-3-амино-5-метил-8-мета-толил-октановую кислоту; (3S,5S)-3-амино-5-метил-8-мета-толил-октановую кислоту; (3S,5R)-3-амино-5-метил-8-пара-толил-октановую кислоту; (3S,5S)-3-амино-5-метил-8-пара-толил-октановую кислоту; (3S,5R)-3-амино-8-(2,3-дифтор-фенил)-5-метил-октановую кислоту; (3S,5S)-3-амино-8-(2,3-дифтор-фенил)-5-метил-октановую кислоту; (3S,5R)-3-амино-8-(2,4-дифтор-фенил)-5-метил-октановую кислоту; (3S,5S)-3-амино-8-(2,4-дифтор-фенил)-5-метил-октановую кислоту; (3S,5R)-3-амино-8-(2,5-дифтор-фенил)-5-метил-октановую кислоту; (3S,5S)-3-амино-8-(2,5-дифтор-фенил)-5-метил-октановую кислоту; (3S,5R)-3-амино-8-(2,6-дифтор-фенил)-5-метил-октановую кислоту и (3S,5S)-3-амино-8-(2,6-дифтор-фенил)-5-метил-октановую кислоту. Предпочтительные соединения по данному изобретению включают соединения формулы IA-2
где R1, R2 и R3 такие, как определено для формулы I выше. Примеры более предпочтительных соединений по данному изобретению представляют собой соединения формулы IA-2, где R1 представляет собой водород, R2 представляет собой метил и R3 такой, как определено для формулы I выше. Примеры конкретных воплощений данного изобретения представляют собой следующие соединения формулы IA-2 и их фармацевтически приемлемые соли: (3S,5R)-3-амино-5-метил-гептановую кислоту; (3S,5R)-3-амино-5-метил-октановую кислоту и (3S,5R)-3-амино-5-метил-нонановую кислоту. Данное изобретение также относится к соединениям формулы IB
и их фармацевтически приемлемым солям, где R3 такой, как определено выше, и где указанные соединения выбраны из следующих соединений и их фармацевтически приемлемых солей: 3-амино-4,5-диметил-гексановой кислоты; 3-амино-4,6-диметил-гептановой кислоты; 3-амино-4,7-диметил-октановой кислоты; 3-амино-4,8-диметил-нонановой кислоты; 3-амино-4,9-диметил-декановой кислоты; 3-амино-4-циклопропил-пентановой кислоты; 3-амино-4-циклобутил-пентановой кислоты; 3-амино-4-циклопентил-пентановой кислоты; 3-амино-4-циклогексил-пентановой кислоты; 3-амино-5-циклопропил-4-метил-пентановой кислоты; 3-амино-5-циклобутил-4-метил-пентановой кислоты; 3-амино-5-циклопентил-4-метил-пентановой кислоты; 3-амино-5-циклогексил-4-метил-пентановой кислоты; 3-амино-6-циклопропил-4-метил-гексановой кислоты; 3-амино-6-циклобутил-4-метил-гексановой кислоты; 3-амино-6-циклопентил-4-метил-гексановой кислоты; 3-амино-6-циклогексил-4-метил-гексановой кислоты; 3-амино-7-циклопропил-4-метил-гептановой кислоты; 3-амино-7-циклобутил-4-метил-гептановой кислоты; 3-амино-7-циклопентил-4-метил-гептановой кислоты; 3-амино-7-циклогексил-4-метил-гептановой кислоты; 3-амино-8-циклопропил-4-метил-октановой кислоты; 3-амино-8-циклобутил-4-метил-октановой кислоты; 3-амино-8-циклопентил-4-метил-октановой кислоты; 3-амино-8-циклогексил-4-метил-октановой кислоты; 3-амино-9-циклопропил-4-метил-нонановой кислоты; 3-амино-9-циклобутил-4-метил-нонановой кислоты; 3-амино-9-циклопентил-4-метил-нонановой кислоты; 3-амино-9-циклогексил-4-метил-нонановой кислоты; 3-амино-4-метил-октановой кислоты; 3-амино-4-метил-нонановой кислоты; 3-амино-4-метил-декановой кислоты; (3R,4R)-3-амино-4,5-диметил-гексановой кислоты; (3R,4R)-3-амино-4,6-диметил-гептановой кислоты; (3R,4R)-3-амино-4,7-диметил-октановой кислоты; (3R,4R)-3-амино-4,8-диметил-нонановой кислоты; (3R,4R)-3-амино-4,9-диметил-декановой кислоты; (3R,4R)-3-амино-4-циклопропил-пентановой кислоты; (3R,4R)-3-амино-4-циклобутил-пентановой кислоты; (3R,4R)-3-амино-4-циклопентил-пентановой кислоты; (3R,4R)-3-амино-4-циклогексил-пентановой кислоты; (3R,4R)-3-амино-5-циклопропил-4-метил-пентановой кислоты; (3R,4R)-3-амино-5-циклобутил-4-метил-пентановой кислоты; (3R,4R)-3-амино-5-циклопентил-4-метил-пентановой кислоты; (3R,4R)-3-амино-5-циклогексил-4-метил-пентановой кислоты; (3R,4R)-3-амино-6-циклопропил-4-метил-гексановой кислоты; (3R,4R)-3-амино-6-циклобутил-4-метил-гексановой кислоты; (3R,4R)-3-амино-6-циклопентил-4-метил-гексановой кислоты; (3R,4R)-3-амино-6-циклогексил-4-метил-гексановой кислоты; (3R,4R)-3-амино-7-циклопропил-4-метил-гептановой кислоты; (3R,4R)-3-амино-7-циклобутил-4-метил-гептановой кислоты; (3R,4R)-3-амино-7-циклопентил-4-метил-гептановой кислоты; (3R,4R)-3-амино-7-циклогексил-4-метил-гептановой кислоты; (3R,4R)-3-амино-8-циклопропил-4-метил-октановой кислоты; (3R,4R)-3-амино-8-циклобутил-4-метил-октановой кислоты; (3R,4R)-3-амино-8-циклопентил-4-метил-октановой кислоты; (3R,4R)-3-амино-8-циклогексил-4-метил-октановой кислоты; (3R,4R)-3-амино-9-циклопропил-4-метил-нонановой кислоты; (3R,4R)-3-амино-9-циклобутил-4-метил-нонановой кислоты; (3R,4R)-3-амино-9-циклопентил-4-метил-нонановой кислоты; (3R,4R)-3-амино-9-циклогексил-4-метил-нонановой кислоты; (3R,4R)-3-амино-4-метил-октановой кислоты; (3R,4R)-3-амино-4-метил-нонановой кислоты; (3R,4R)-3-амино-4-метил-декановой кислоты; (3R,4S)-3-амино-4,5-диметил-гексановой кислоты; (3R,4S)-3-амино-4,6-диметил-гептановой кислоты; (3R,4S)-3-амино-4,7-диметил-октановой кислоты; (3R,4S)-3-амино-4,8-диметил-нонановой кислоты; (3R,4S)-3-амино-4,9-диметил-декановой кислоты; (3R,4S)-3-амино-4-циклопропил-пентановой кислоты; (3R,4S)-3-амино-4-циклобутил-пентановой кислоты; (3R,4S)-3-амино-4-циклопентил-пентановой кислоты; (3R,4S)-3-амино-4-циклогексил-пентановой кислоты; (3R,4S)-3-амино-5-циклопропил-4-метил-пентановой кислоты; (3R,4S)-3-амино-5-циклобутил-4-метил-пентановой кислоты; (3R,4S)-3-амино-5-циклопентил-4-метил-пентановой кислоты; (3R,4S)-3-амино-5-циклогексил-4-метил-пентановой кислоты; (3R,4S)-3-амино-6-циклопропил-4-метил-гексановой кислоты; (3R,4S)-3-амино-6-циклобутил-4-метил-гексановой кислоты; (3R,4S)-3-амино-6-циклопентил-4-метил-гексановой кислоты; (3R,4S)-3-амино-6-циклогексил-4-метил-гексановой кислоты; (3R,4S)-3-амино-7-циклопропил-4-метил-гептановой кислоты; (3R,4S)-3-амино-7-циклобутил-4-метил-гептановой кислоты; (3R,4S)-3-амино-7-циклопентил-4-метил-гептановой кислоты; (3R,4S)-3-амино-7-циклогексил-4-метил-гептановой кислоты; (3R,4S)-3-амино-8-циклопропил-4-метил-октановой кислоты; (3R,4S)-3-амино-8-циклобутил-4-метил-октановой кислоты; (3R,4S)-3-амино-8-циклопентил-4-метил-октановой кислоты; (3R,4S)-3-амино-8-циклогексил-4-метил-октановой кислоты; (3R,4S)-3-амино-9-циклопропил-4-метил-нонановой кислоты; (3R,4S)-3-амино-9-циклобутил-4-метил-нонановой кислоты; (3R,4S)-3-амино-9-циклопентил-4-метил-нонановой кислоты; (3R,4S)-3-амино-9-циклогексил-4-метил-нонановой кислоты; (3R,4S)-3-амино-4-метил-октановой кислоты; (3R,4S)-3-амино-4-метил-нонановой кислоты и (3R,4S)-3-амино-4-метил-декановой кислоты. Данное изобретение также относится к соединениям формулы IC
и их фармацевтически приемлемым солям, где R3 такой, как определено выше, и где указанные соединения выбраны из следующих соединений и их фармацевтически приемлемых солей: 3-амино-6-метил-декановой кислоты; 3-амино-6-циклопропил-гептановой кислоты; 3-амино-6-циклобутил-гептановой кислоты; 3-амино-6-циклопентил-гептановой кислоты; 3-амино-6-циклогексил-гептановой кислоты; 3-амино-7-циклопропил-6-метил-гептановой кислоты; 3-амино-7-циклобутил-6-метил-гептановой кислоты; 3-амино-7-циклопентил-6-метил-гептановой кислоты; 3-амино-7-циклогексил-6-метил-гептановой кислоты; 3-амино-8-циклопропил-6-метил-октановой кислоты; 3-амино-8-циклобутил-6-метил-октановой кислоты; 3-амино-8-циклопентил-6-метил-октановой кислоты; 3-амино-8-циклогексил-6-метил-октановой кислоты; 3-амино-9-циклопропил-6-метил-нонановой кислоты; 3-амино-9-циклобутил-6-метил-нонановой кислоты; 3-амино-9-циклопентил-6-метил-нонановой кислоты; 3-амино-9-циклогексил-6-метил-нонановой кислоты; 3-амино-10-циклопропил-6-метил-декановой кислоты; 3-амино-10-циклобутил-6-метил-декановой кислоты; 3-амино-10-циклопентил-6-метил-декановой кислоты; 3-амино-10-циклогексил-6-метил-декановой кислоты; 3-амино-6-изопропил-гептановой кислоты; 3-амино-6,8-диметил-нонановой кислоты; 3-амино-6,9-диметил-декановой кислоты; (3S,6R)-3-амино-6-метил-декановой кислоты; (3S,6R)-3-амино-6-циклопропил-гептановой кислоты; (3S,6R)-3-амино-6-циклобутил-гептановой кислоты; (3S,6R)-3-амино-6-циклопентил-гептановой кислоты; (3S,6R)-3-амино-6-циклогексил-гептановой кислоты; (3S,6R)-3-амино-7-циклопропил-6-метил-гептановой кислоты; (3S,6R)-3-амино-7-циклобутил-6-метил-гептановой кислоты; (3S,6R)-3-амино-7-циклопентил-6-метил-гептановой кислоты; (3S,6R)-3-амино-7-циклогексил-6-метил-гептановой кислоты; (3S,6R)-3-амино-8-циклопропил-6-метил-октановой кислоты; (3S,6R)-3-амино-8-циклобутил-6-метил-октановой кислоты; (3S,6R)-3-амино-8-циклопентил-6-метил-октановой кислоты; (3S,6R)-3-амино-8-циклогексил-6-метил-октановой кислоты; (3S,6R)-3-амино-9-циклопропил-6-метил-нонановой кислоты; (3S,6R)-3-амино-9-циклобутил-6-метил-нонановой кислоты; (3S,6R)-3-амино-9-циклопентил-6-метил-нонановой кислоты; (3S,6R)-3-амино-9-циклогексил-6-метил-нонановой кислоты; (3S,6R)-3-амино-10-циклопропил-6-метил-декановой кислоты; (3S,6R)-3-амино-10-циклобутил-6-метил-декановой кислоты; (3S,6R)-3-амино-10-циклопентил-6-метил-декановой кислоты; (3S,6R)-3-амино-10-циклогексил-6-метил-декановой кислоты; (3S,6R)-3-амино-6-изопропил-гептановой кислоты; (3S,6R)-3-амино-6,8-диметил-нонановой кислоты; (3S,6R)-3-амино-6,9-диметил-декановой кислоты; (3S,6S)-3-амино-6-метил-октановой кислоты; (3S,6S)-3-амино-6-метил-нонановой кислоты; (3S,6S)-3-амино-6-метил-декановой кислоты; (3S,6S)-3-амино-6-циклопропил-гептановой кислоты; (3S,6S)-3-амино-6-циклобутил-гептановой кислоты; (3S,6S)-3-амино-6-циклопентил-гептановой кислоты; (3S,6S)-3-амино-6-циклогексил-гептановой кислоты; (3S,6S)-3-амино-7-циклопропил-6-метил-гептановой кислоты; (3S,6S)-3-амино-7-циклобутил-6-метил-гептановой кислоты; (3S,6S)-3-амино-7-циклопентил-6-метил-гептановой кислоты; (3S,6S)-3-амино-7-циклогексил-6-метил-гептановой кислоты; (3S,6S)-3-амино-8-циклопропил-6-метил-октановой кислоты; (3S,6S)-3-амино-8-циклобутил-6-метил-октановой кислоты; (3S,6S)-3-амино-8-циклопентил-6-метил-октановой кислоты; (3S,6S)-3-амино-8-циклогексил-6-метил-октановой кислоты; (3S,6S)-3-амино-9-циклопропил-6-метил-нонановой кислоты; (3S,6S)-3-амино-9-циклобутил-6-метил-нонановой кислоты; (3S,6S)-3-амино-9-циклопентил-6-метил-нонановой кислоты; (3S,6S)-3-амино-9-циклогексил-6-метил-нонановой кислоты; (3S,6S)-3-амино-10-циклопропил-6-метил-декановой кислоты; (3S,6S)-3-амино-10-циклобутил-6-метил-декановой кислоты; (3S,6S)-3-амино-10-циклопентил-6-метил-декановой кислоты; (3S,6S)-3-амино-10-циклогексил-6-метил-декановой кислоты; (3S,6S)-3-амино-6-изопропил-гептановой кислоты; (3S,6S)-3-амино-6,8-диметил-нонановой кислоты и (3S,6S)-3-амино-6,9-диметил-декановой кислоты. Данное изобретение также относится к соединениям формулы II
где R1, R2 и R3 такие, как определено для формулы I выше, и фармацевтически приемлемым солям таких соединений. Примеры конкретных воплощений данного изобретения представляют собой следующее соединение формулы IV и его фармацевтически приемлемые соли: 2-аминометил-4-пропил-гептановую кислоту. Данное изобретение также относится к соединениям формулы IIA
где R3 такой, как определено для формулы I выше, и фармацевтически приемлемым солям таких соединений. Другие конкретные воплощения данного изобретения включают следующие соединения формулы II и их фармацевтически приемлемые соли: 2-аминометил-4-метил-7-фенил-гептановую кислоту; 2-аминометил-4-метил-6-фенил-гексановую кислоту; 2-аминометил-7-(4-фтор-фенил)-4-метил-гептановую кислоту; 2-аминометил-7-(3-фтор-фенил)-4-метил-гептановую кислоту; 2-аминометил-7-(2-фтор-фенил)-4-метил-гептановую кислоту; 2-аминометил-7-(2,4-дифтор-фенил)-4-метил-гептановую кислоту; 2-аминометил-7-(3,4-дифтор-фенил)-4-метил-гептановую кислоту; 2-аминометил-4-метил-7-(2-трифторметил-фенил)-гептановую кислоту; 2-аминометил-4-метил-7-(3-трифторметил-фенил)-гептановую кислоту; 2-аминометил-4-метил-7-(4-трифторметил-фенил)-гептановую кислоту; 2-аминометил-4-метил-6-фениламино-гексановую кислоту; 2-аминометил-4-метил-7-фениламино-гептановую кислоту; 2-аминометил-4-метил-8-фениламино-октановую кислоту; (2R,4R)-2-аминометил-4-метил-7-фенил-гептановую кислоту; (2R,4R)-2-аминометил-4-метил-6-фенил-гексановую кислоту; (2R,4R)-2-аминометил-7-(4-фтор-фенил)-4-метил-гептановую кислоту; (2R,4R)-2-аминометил-7-(3-фтор-фенил)-4-метил-гептановую кислоту; (2R,4R)-2-аминометил-7-(2-фтор-фенил)-4-метил-гептановую кислоту; (2R,4R)-2-аминометил-7-(2,4-дифтор-фенил)-4-метил-гептановую кислоту; (2R,4R)-2-аминометил-7-(3,4-дифтор-фенил)-4-метил-гептановую кислоту; (2R,4R)-2-аминометил-4-метил-7-(2-трифторметил-фенил)-гептановую кислоту; (2R,4R)-2-аминометил-4-метил-7-(3-трифторметил-фенил)-гептановую кислоту; (2R,4R)-2-аминометил-4-метил-7-(4-трифторметил-фенил)-гептановую кислоту; (2R,4R)-2-аминометил-4-метил-6-фениламино-гексановую кислоту; (2R,4R)-2-аминометил-4-метил-7-фениламино-гептановую кислоту; (2R,4R)-2-аминометил-4-метил-8-фениламино-октановую кислоту; (2R,4S)-2-аминометил-4-метил-7-фенил-гептановую кислоту; (2R,4S)-2-аминометил-4-метил-6-фенил-гексановую кислоту; (2R,4S)-2-аминометил-7-(4-фтор-фенил)-4-метил-гептановую кислоту; (2R,4S)-2-аминометил-7-(3-фтор-фенил)-4-метил-гептановую кислоту; (2R,4S)-2-аминометил-7-(2-фтор-фенил)-4-метил-гептановую кислоту; (2R,4S)2-аминометил-7-(2,4-дифтор-фенил)-4-метил-гептановую кислоту; (2R,4S)-2-аминометил-7-(3,4-дифтор-фенил)-4-метил-гептановую кислоту; (2R,4S)-2-аминометил-4-метил-7-(2-трифторметил-фенил)-гептановую кислоту; (2R,4S)-2-аминометил-4-метил-7-(3-трифторметил-фенил)-гептановую кислоту; (2R,4S)-2-аминометил-4-метил-7-(4-трифторметил-фенил)-гептановую кислоту; (2R,4S)-2-аминометил-4-метил-6-фениламино-гексановую кислоту; (2R,4S)-2-аминометил-4-метил-7-фениламино-гептановую кислоту; (2R,4S)-2-аминометил-4-метил-8-фениламино-октановую кислоту; (2R,4S)-2-аминометил-6-циклогексил-4-этил-гексановую кислоту; 2-аминометил-3-(1-метил-циклопропил)-пропионовую кислоту; 2-аминометил-3-(1-этил-циклопропил)-пропионовую кислоту; 2-аминометил-3-(1-пропил-циклопропил)-пропионовую кислоту; 2-аминометил-3-(1-изопропил-циклопропил)-пропионовую кислоту; 2-аминометил-3-(1-бутил-циклопропил)-пропионовую кислоту; 2-аминометил-3-(1-изобутил-циклопропил)-пролионовую кислоту; 2-аминометил-3-[1-(4-метил-пентил)-циклопропил]-пропионовую кислоту; 2-аминометил-3-(1-метил-циклобутил)-пропионовую кислоту; 2-аминометил-3-(1-этил-циклобутил)-пропионовую кислоту; 2-аминометил-3-(1-пропил-циклобутил)-пропионовую кислоту; 2-аминометил-3-(1-метил-циклопентил)-пропионовую кислоту; 2-аминометил-3-(1-этил-циклопентил)-пропионовую кислоту; 2-аминометил-3-(1-пропил-циклопентил)-пропионовую кислоту; 2-аминометил-3-(1-метил-циклогексил)-пропионовую кислоту; 2-аминометил-3-(1-этил-циклогексил)-пропионовую кислоту; 2-аминометил-3-(1-пропил-циклогексил)-пропионовую кислоту; 2-аминометил-4-этил-гексановую кислоту; 2-аминометил-4-этил-5-метил-гексановую кислоту; 2-аминометил-4-этил-гептановую кислоту; 2-аминометил-4-этил-6-метил-гептановую кислоту; 2-аминометил-4-этил-октановую кислоту; 2-аминометил-4-этил-7-метил-октановую кислоту; 2-аминометил-4-этил-нонановую кислоту; 2-аминометил-4-этил-8-метил-нонановую кислоту; 2-аминометил-4,4-диметил-гептановую кислоту; 2-аминометил-4,4,8-триметил-нонановую кислоту; 2-аминометил-5-этил-гептановую кислоту; 2-аминометил-5-этил-6-метил-гептановую кислоту; 2-аминометил-7-циклопропил-5-этил-гептановую кислоту; 2-аминометил-7-циклобутил-5-этил-гептановую кислоту; 2-аминометил-7-циклопентил-5-этил-гептановую кислоту; 2-аминометил-7-циклогексил-5-этил-гептановую кислоту; 2-аминометил-5-этил-октановую кислоту; 2-аминометил-5-этил-7-метил-октановую кислоту; 2-аминометил-5-этил-нонановую кислоту; 2-аминометил-5-этил-8-метил-нонановую кислоту; 2-аминометил-4-циклопропил-масляную кислоту; 2-аминометил-4-(1-метил-циклопропил)-масляную кислоту; 2-аминометил-4-(1-этил-циклопропил)-масляную кислоту; 2-аминометил-4-циклобутил-масляную кислоту; 2-аминометил-4-(1-метил-циклобутил)-масляную кислоту; 2-аминометил-4-(1-этил-циклобутил)-масляную кислоту; 2-аминометил-4-циклопентил-масляную кислоту; 2-аминометил-4-(1-метил-циклопентил)-масляную кислоту; 2-аминометил-4-(1-этил-циклопентил)-масляную кислоту; 2-аминометил-4-циклогексил-масляную кислоту; 2-аминометил-4-(1-метил-циклогексил)-масляную кислоту; 2-аминометил-4-(1-этил-циклогексил)-масляную кислоту; (2R,4S)-2-аминометил-6-циклопентил-4-этил-гексановую кислоту; (2R,4S)-2-аминометил-6-циклобутил-4-этил-гексановую кислоту и (2R,4S)-2-аминометил-6-циклопропил-4-этил-гексановую кислоту. Другие конкретные воплощения данного изобретения включают следующие соединения формулы IIA и их фармацевтически приемлемые соли: 2-аминометил-4-метил-гексановую кислоту; 2-аминометил-4-метил-гептановую кислоту; 2-аминометил-4-метил-октановую кислоту; 2-аминометил-4-метил-нонановую кислоту; 2-аминометил-4-метил-декановую кислоту; (2R,4R)-2-аминометил-4-метил-гексановую кислоту; (2R,4R)-2-аминометил-4-метил-гептановую кислоту; (2R,4R)-2-аминометил-4-метил-октановую кислоту; (2R,4R)-2-аминометил-4-метил-нонановую кислоту; (2R,4R)-2-аминометил-4-метил-декановую кислоту; (2R,4S)-2-аминометил-4-метил-гексановую кислоту; (2R,4S)-2-аминометил-4-метил-гептановую кислоту; (2R,4S)-2-аминометил-4-метил-октановую кислоту; (2R,4S)-2-аминометил-4-метил-нонановую кислоту; (2R,4S)-2-аминометил-4-метил-декановую кислоту; 2-аминометил-5-циклопропил-4-метил-пентановую кислоту; 2-аминометил-5-циклобутил-4-метил-пентановую кислоту; 2-аминометил-5-циклопентил-4-метил-пентановую кислоту; 2-аминометил-5-циклогексил-4-метил-пентановую кислоту; 2-аминометил-6-циклопропил-4-метил-гексановую кислоту; 2-аминометил-6-циклобутил-4-метил-гексановую кислоту; 2-аминометил-6-циклопентил-4-метил-гексановую кислоту; 2-аминометил-6-циклогексил-4-метил-гексановую кислоту; 2-аминометил-7-циклопропил-4-метил-гептановую кислоту; 2-аминометил-7-циклобутил-4-метил-гептановую кислоту; 2-аминометил-7-циклопентил-4-метил-гептановую кислоту; 2-аминометил-7-циклогексил-4-метил-гептановую кислоту; 2-аминометил-8-циклопропил-4-метил-октановую кислоту; 2-аминометил-8-циклобутил-4-метил-октановую кислоту; 2-аминометил-8-циклопентил-4-метил-октановую кислоту; 2-аминометил-8-циклогексил-4-метил-октановую кислоту; (2R,4S)-2-аминометил-5-циклопропил-4-метил-пентановую кислоту; (2R,4S)-2-аминометил-5-циклобутил-4-метил-пентановую кислоту; (2R,4S)-2-аминометил-5-циклопентил-4-метил-пентановую кислоту; (2R,4S)-2-аминометил-5-циклогексил-4-метил-пентановую кислоту; (2R,4S)-2-аминометил-6-циклопропил-4-метил-гексановую кислоту; (2R,4S)-2-аминометил-6-циклобутил-4-метил-гексановую кислоту; (2R,4S)-2-аминометил-6-циклопентил-4-метил-гексановую кислоту; (2R,4S)-2-аминометил-6-циклогексил-4-метил-гексановую кислоту; (2R,4S)-2-аминометил-7-циклопропил-4-метил-гептановую кислоту; (2R,4S)-2-аминометил-7-циклобутил-4-метил-гептановую кислоту; (2R,4S)-2-аминометил-7-циклопентил-4-метил-гептановую кислоту; (2R,4S)-2-аминометил-7-циклогексил-4-метил-гептановую кислоту; (2R,4S)-2-аминометил-8-циклопропил-4-метил-октановую кислоту; (2R,4S)-2-аминометил-8-циклобутил-4-метил-октановую кислоту; (2R,4S)-2-аминометил-8-циклопентил-4-метил-октановую кислоту; (2R,4S)-2-аминометил-8-циклогексил-4-метил-октановую кислоту; (2R,4R)-2-аминометил-5-циклопропил-4-метил-пентановую кислоту; (2R,4R)-2-аминометил-5-циклобутил-4-метил-пентановую кислоту; (2R,4R)-2-аминометил-5-циклопентил-4-метил-пентановую кислоту; (2R,4R)-2-аминометил-5-циклогексил-4-метил-пентановую кислоту; (2R,4R)-2-аминометил-6-циклопропил-4-метил-гексановую кислоту; (2R,4R)-2-аминометил-6-циклобутил-4-метил-гексановую кислоту; (2R,4R)-2-аминометил-6-циклопентил-4-метил-гексановую кислоту; (2R,4R)-2-аминометил-6-циклогексил-4-метил-гексановую кислоту; (2R,4R)-2-аминометил-7-циклопропил-4-метил-гептановую кислоту; (2R,4R)-2-аминометил-7-циклобутил-4-метил-гептановую кислоту; (2R,4R)-2-аминометил-7-циклопентил-4-метил-гептановую кислоту; (2R,4R)-2-аминометил-7-циклогексил-4-метил-гептановую кислоту; (2R,4R)-2-аминометил-8-циклопропил-4-метил-октановую кислоту; (2R,4R)-2-аминометил-8-циклобутил-4-метил-октановую кислоту; (2R,4R)-2-аминометил-8-циклопентил-4-метил-октановую кислоту и (2R,4R)-2-аминометил-8-циклогексил-4-метил-октановую кислоту. Данное изобретение также относится к соединениям формулы III
и их фармацевтически приемлемым солям, где R3 такой, как определено для формулы I выше. Данное изобретение также относится к соединениям формулы IV
и их фармацевтически приемлемым солям, где R1 и R3 такие, как определено для соединений формулы I выше. Другие конкретные воплощения данного изобретения включают следующие соединения формулы IV и их фармацевтически приемлемые соли: 2-аминометил-6-циклопропил-5-метил-гексановую кислоту; 2-аминометил-6-циклобутил-5-метил-гексановую кислоту; 2-аминометил-6-циклопентил-5-метил-гексановую кислоту; 2-аминометил-6-циклогексил-5-метил-гексановую кислоту; 2-аминометил-7-циклопропил-5-метил-гептановую кислоту; 2-аминометил-7-циклобутил-5-метил-гептановую кислоту; 2-аминометил-7-циклопентил-5-метил-гептановую кислоту; 2-аминометил-7-циклогексил-5-метил-гептановую кислоту; 2-аминометил-8-циклопропил-5-метил-октановую кислоту; 2-аминометил-8-циклобутил-5-метил-октановую кислоту; 2-аминометил-8-циклопентил-5-метил-октановую кислоту; 2-аминометил-8-циклогексил-5-метил-октановую кислоту; 2-аминометил-5-метил-гептановую кислоту; 2-аминометил-5-метил-октановую кислоту; 2-аминометил-6-метил-гептановую кислоту; 2-аминометил-5-метил-нонановую кислоту; (2R,6S)-2-аминометил-6-циклопропил-5-метил-гексановую кислоту; (2R,6S)-2-аминометил-6-циклобутил-5-метил-гексановую кислоту; (2R,6S)-2-аминометил-6-циклопентил-5-метил-гексановую кислоту; (2R,6S)-2-аминометил-6-циклогексил-5-метил-гексановую кислоту; (2R,6S)-2-аминометил-7-циклопропил-5-метил-гептановую кислоту; (2R,6S)-2-аминометил-7-циклобутил-5-метил-гептановую кислоту; (2R,6S)-2-аминометил-7-циклопентил-5-метил-гептановую кислоту; (2R,6S)-2-аминометил-7-циклогексил-5-метил-гептановую кислоту; (2R,6S)-2-аминометил-8-циклопропил-5-метил-октановую кислоту; (2R,6S)-2-аминометил-8-циклобутил-5-метил-октановую кислоту; (2R,6S)-2-аминометил-8-циклопентил-5-метил-октановую кислоту; (2R,6S)-2-аминометил-8-циклогексил-5-метил-октановую кислоту; (2R,6S)-2-аминометил-5-метил-гептановую кислоту; (2R,6S)-2-аминометил-5-метил-октановую кислоту; (2R,6S)-2-аминометил-5-метил-гептановую кислоту; (2R,6S)-2-аминометил-5-метил-нонановую кислоту; (2R,6R)-2-аминометил-6-циклопропил-5-метил-гексановую кислоту; (2R,6R)-2-аминометил-6-циклобутил-5-метил-гексановую кислоту; (2R,6R)-2-аминометил-6-циклопентил-5-метил-гексановую кислоту; (2R,6R)-2-аминометил-6-циклогексил-5-метил-гексановую кислоту; (2R,6R)-2-аминометил-7-циклопропил-5-метил-гептановую кислоту; (2R,6R)-2-аминометил-7-циклобутил-5-метил-гептановую кислоту; (2R,6R)-2-аминометил-7-циклопентил-5-метил-гептановую кислоту; (2R,6R)-2-аминометил-7-циклогексил-5-метил-гептановую кислоту; (2R,6R)-2-аминометил-8-циклопропил-5-метил-октановую кислоту; (2R,6R)-2-аминометил-8-циклобутил-5-метил-октановую кислоту; (2R,6R)-2-аминометил-8-циклопентил-5-метил-октановую кислоту; (2R,6R)-2-аминометил-8-циклогексил-5-метил-октановую кислоту; (2R,6R)-2-аминометил-5-метил-гептановую кислоту; (2R,6R)-2-аминометил-5-метил-октановую кислоту; (2R,6R)-2-аминометил-5-метил-гептановую кислоту и (2R,6R)-2-аминометил-5-метил-нонановую кислоту. Данное изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I, IA, IA-1, IA-2, IB, IC, II, IIA, III или IV или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Данное изобретение также относится к способу лечения расстройства или состояния, выбранного из эпилепсии, приступов головокружения, фибромиалгии, гипокинезии, краниальных расстройств, приливов, эссенциального тремора, химических зависимостей и аддикций (например, зависимостей от, или аддикций, к алкоголю, амфетаминам (или амфетаминподобным веществам), кофеину, марихуане, кокаину, героину, галлюциногенам, табаку, средствам для ингаляции и аэрозольным пропеллентам, никотину, опиоидам, фенилглицидиновым производным, седативным средствам, снотворным средствам, бензодиазепинам и другим анксиолитикам) и симптомов абстиненции, ассоциированных с такими зависимостями, или аддикциями, пагубных привычек, таких как страсть к азартным играм; мигрени, спастичности, включая мышечную спастичность и гипотонию с параличом, сопровождающуюся параличом, артрита, синдрома раздраженного кишечника (IBS), хронической боли, острой боли, невропатической боли, сосудистой головной боли, синусной головной боли, воспалительных расстройств (например, ревматоидного артрита, остеоартрита, болезни, представляющей собой модификацию остеоартритного заболевания, повреждения хрящей, псориаза), диуреза, предменструального синдрома, предменструального дисфорического расстройства, шума в ушах и повреждения желудка у млекопитающего, в том числе человека, включающему введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I, IA, IA-1, IA-2, IB, IC, II, IIA, III или IV или его фармацевтически приемлемой соли. Настоящее изобретение также относится к способу прекращения курения, синдрома отмены веществ, вызывающих привыкание и зависимости, стимуляции увеличения массы тела млекопитающего, имеющего или страдающего от анорексии, рака, старости и/или слабости, у млекопитающего, в том числе людей, включающему введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I, IA, IA-1, IA-2, IB, IC, II, IIA, III или IV или его фармацевтически приемлемой соли. Настоящее изобретение также охватывает лечение нейродегенеративных расстройств, выраженных при острой черепно-мозговой травме. Такие расстройства включают удар, травму головы и асфиксию, но не ограничены ими. Удар относится к заболеванию сосудов головного мозга и может также относиться к острому нарушению мозгового кровообращения (cerebral vascular incident, (CVA)) и включает острый тромбоэмболический удар. Удар включает как фокальную, так и глобальную ишемию. Кроме того, включены преходящие нарушения мозгового кровообращения и другие проблемы с сосудами головного мозга, сопровождающиеся ишемией головного мозга, такие как те, которые встречаются у пациентов, подвергающихся эндартерэктомии сонной артерии или другим хирургическим или диагностическим процедурам на сосудах, в том числе на сосудах головного мозга, включающим ангиографию головного мозга и тому подобное. Соединения формул I, IA, IA-1, IA-2, IB, IC, II, IIA, III и IV также полезны при лечении травмы головы, травмы спинного мозга или повреждения в результате общей кислородной недостаточности, гипоксии, гипогликемии, гипотензии, а также подобных повреждений, наблюдаемых во время процедур, в результате эмболии, гиперфузии и гипоксии. Они также полезны в предотвращении нейронального повреждения, которое возникает во время операции шунтирования сосудов сердца, в случаях внутричерепного кровоизлияния, при перинатальной асфиксии, при остановке сердца и эпилептическом состоянии. Данное изобретение также относится к способу лечения расстройства или состояния, выбранного из группы, состоящей из делирия, деменции и амнестических и других когнитивных или нейродегенеративных расстройств, таких как болезнь Паркинсона (PD), болезнь Гентингтона (HD), болезнь Альцгеймера, сенильная деменция, деменция альцгей морского типа, расстройство памяти, сосудистая деменция и другие деменции, например, приобретенные в результате ВИЧ-заболевания, травмы головы, болезни Паркинсона, болезни Гентигтона, болезни Пика, болезни Крейтцфельда-Якоба или имеющие множественную этиологию; двигательных расстройств, таких как акинезии, дискинезии, включая пароксизмальные семейные дискинезии, спастические состояния, синдром Туретта, синдром Скотта, PALSYS и акинетико-ригидный синдром; экстрапирамидных двигательных расстройств, таких как двигательные расстройства, вызванные приемом лекарств, например нейролептический паркинсонизм, злокачественный нейролептический синдром, острая нейролептическая дистония, острая нейролептическая акатизия, поздняя нейролептическая дискинезия и вызванный приемом лекарств постуральный тремор; синдрома Дауна; демиелинизирующих заболеваний, таких как рассеянный склероз (MS) и боковой амиотрофический склероз (ALS), периферической невропатии, например диабетической и вызванной химиотерапией невропатии, и постгерпетической невралгии, невралгии тройничного нерва, сегментной или межреберной невралгии и других невралгий; и цереброваскулярных расстройств вследствие острого или хронического поражения сосудов мозга, такого как ишемический инфаркт, субарахноидальное кровоизлияние или церебральный отек, у млекопитающего, в том числе человека, включающему введение указанному млекопитающему такого количества соединения формулы I, IA, IA-1, IA-2, IB, IC, II, IIA, III или IV или его фармацевтически приемлемой соли, которое является эффективным в лечении такого расстройства или состояния. Когнитивная способность может быть также усилена у пациентов, кто имеет фибромиалгию, болезнь Альцгеймера и болезнь Паркинсона, путем улучшения сна у млекопитающего, включая человека, страдающего этим, посредством введения млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I, IA, IA-1, IA-2, IB, IC, II, IIA, III или IV или его фармацевтически приемлемой соли. Боль относится к острой, а также хронической боли. Острая боль обычно является преходящей и ассоциирована с гиперактивностью симпатической нервной системы. Примеры представляют собой послеоперационную боль и аллодинию. Хроническую боль обычно определяют как боль, продолжающуюся от 3 до 6 месяцев, и она включает соматогенную боль и психогенную боль. Другой тип боли представляет собой ноцицептивную боль. Примеры типов боли, которые можно лечить с помощью соединений формул I, IA, IA-1, IA-2, IB, IC, II, IIA, III и IV по настоящему изобретению и их фармацевтически приемлемыми солями, включают боль, причиной которой является повреждение мягких тканей и периферическое повреждение, такое как острая травма, боль, ассоциированную с остеоартритом и ревматоидным артритом, скелетно-мышечную боль, такую как боль, испытываемую после травмы; боль в спине, зубную боль, болевой мышечно-лицевой синдром, боль в результате эпизиотомии и боль от ожогов; глубоко локализующуюся и висцеральную боль, такую как боль в сердце, мышечную боль, глазную боль, ротолицевую боль, например одонталгию, абдоминальную боль, гинекологическую боль, например дисменорею, родовые схватки и боль, ассоциированную с эндометриозом; боль, ассоциированную с повреждением нерва и нервных корешков, такую как боль, ассоциированную с заболеваниями периферических нервов, например ущемлением нерва и авульсией плечевого сплетения, ампутацией, периферическими невропатиями, невралгией тройничного нерва, атипичную лицевую боль, повреждение нервных корешков, тригеминальную невралгию, невропатическую боль в нижней части спины, невропатическую боль, ассоциированную с ВИЧ-инфекцией, невропатическую боль, ассоциированную с раком, диабетическую невропатическую боль и арахноидит; невропатическую и не относящуюся к невропатической боль, ассоциированную с карциномой, часто упоминаемую как раковая боль; боль, связанную с центральной нервной системой, такую как боль вследствие повреждения спинного мозга или ствола мозга; боль в нижней части спины; ишиалгию; фантомную боль от ампутированной конечности, головную боль, включая мигрень и другие сосудистые головные боли, острую и хроническую головную боль напряжения, кластерную головную боль, височно-нижнечелюстную боль и верхнечелюстную боль; боль в результате анкилозирующего спондилоартрита и подагры; боль, вызванную повышенными сокращениями мочевого пузыря; послеоперационную боль; боль в результате рубцевания и хроническую боль, не относящуюся к невропатической, такую как боль, ассоциированную с фибромиалгией, ВИЧ, ревматоидным и остеоартритом, антралгией и миалгией, растяжениями, нагрузками и травмой, такой как переломы костей; боль после хирургического вмешательства. Еще один тип боли вызван повреждением или инфекцией периферических чувствительных нервов. Он включает боль в результате травмы периферического нерва, герпес-вирусной инфекции, сахарного диабета, фибромиалгии, каузалгии, авульсии сплетения, невромы, ампутации конечности и васкулита, но не ограничен ими. Невропатическая боль также вызвана поражением нервов в результате хронического алкоголизма, инфекции вируса иммунодефицита человека, гипотиреоза, уремии или витаминной недостаточности. Невропатическая боль включает боль, вызванную повреждением нерва, такую как, например, боль, от которой страдают диабетики, но не ограничена этим. Психогенная боль представляет собой боль, которая не имеет органического происхождения, такая как боль в нижней части спины, атипичная лицевая боль и хроническая головная боль. Другие типы боли представляют собой воспалительную боль, остеоартритную боль, невралгию тройничного нерва, раковую боль, диабетическую невропатию, синдром “усталых ног”, острую герпетическую и постгерпетическую невралгию, каузалгию, авульсию плечевого сплетения, затылочную невралгию, подагру, фантомную боль, боль при ожоге и другие формы невралгии, синдром невропатической и идиопатической боли. Соединения по данному изобретению также полезны при лечении депрессии. Депрессия может возникать в результате органического заболевания, от стресса, ассоциированного с личной утратой, или быть идиопатической по природе. Существует строгая тенденция к семейному проявлению некоторых форм депрессии, подтверждая механистическую причину для по меньшей мере некоторых форм депрессии. Диагноз депрессии ставят главным образом по числу колебаний настроения пациента. Такие оценки настроения, как правило, осуществляются врачом или определяются нейропсихологом с использованием достоверных оценочных шкал, таких как шкала Гамильтона для оценки депрессии (Hamilton Depression Rating Scale) или краткая психиатрическая оценочная шкала (Brief Psychiatric Rating Scale). Множество других шкал было разработано для определения и измерения степени колебаний настроения у пациентов с депрессией, таких как бессонница, затрудненность концентрации, отсутствие энергии, ощущение бесполезности и чувства вины. Стандартные критерии для диагностики депрессии, а также всех психиатрических диагнозов собраны в руководстве по диагностике и статистике психических расстройств (Diagnostic and Statistical Manual of Manual Disorders, четвертое издание), известном как руководство DSM-IV-R, опубликованное Американской психиатрической ассоциацией в 1994 году. Данное изобретение также относится к способу лечения расстройства или состояния, выбранного из группы, состоящей из расстройств настроения, таких как депрессия или, более конкретно, депрессивные расстройства, например единичные эпизодические или рекуррентные большие депрессивные расстройства, дистимические расстройства, депрессивный невроз и невротическая депрессия, меланхолическая депрессия, включая анорексию, потерю массы, инсомнию, слишком раннее пробуждение по утрам и психомоторную задержку, атипичная депрессия (или реактивная депрессия), включая повышенный аппетит, гиперсомнию, психомоторное возбуждение или раздражительность, сезонное аффективное расстройство и детская депрессия; или биполярных расстройств или маниакальной депрессии, например, биполярного расстройства I типа, биполярного расстройства II типа и циклотимического расстройства; расстройства поведения и расстройства разрушительного поведения; тревожных расстройств, таких как паническое расстройство с агорафобией или без агорафобии, агорафобия без предыстории панического расстройства, специфические фобии, например специфические фобии животных, боязнь перелетов, социальное тревожное расстройство, социальная фобия, обсессивно-компульсивное расстройство, стрессовые расстройства, включая посттравматическое стрессовое расстройство и острое стрессовое расстройство, и генерализованные тревожные расстройства; пограничного расстройства личности; шизофрении и других психотических расстройств, например шизофреноподобных расстройств, шизоаффективных расстройств, бредовых расстройств, кратковременных психотических расстройств, совместных (shared) психотических расстройств, психотических расстройств с бредом или галлюцинациями, психотических эпизодов тревоги, тревоги, связанной с психозом, психотических расстройств настроения, таких как тяжелое большое депрессивное расстройство; расстройств настроения, связанных с психотическими расстройствами, таких как острая мания, и депрессия, связанная с биполярным расстройством, расстройства настроения, связанные с шизофренией; поведенческих нарушений, связанных с задержкой психического развития, аутистического расстройства и расстройства поведения у млекопитающего, в том числе человека, включающему введение указанному млекопитающему такого количества соединения формулы I, IA, IA-1, IA-2, IB, IC, II, IIA, III или IV или его фармацевтически приемлемой соли, которое является эффективным в лечении такого расстройства или состояния. Соединения по данному изобретению также полезны при лечении расстройств сна. Расстройства сна представляют собой нарушения, которые влияют на способность засыпать и/или пребывать в состоянии сна, которые включают слишком долгий сон, или которые приводят к аномальному поведению, ассоциированному со сном. Такие расстройства включают, например, инсомнию, бессонницу, связанную с лекарствами, гиперсомнию, нарколепсию, синдромы ночного апноэ и парасомнии. Данное изобретение также относится к способу лечения расстройства или состояния, выбранного из группы, состоящей из расстройств сна (например инсомнии, бессонницы, связанной с лекарствами, расстройства поведения в REM-стадии сна, гиперсомнии, нарколепсии, расстройств цикла сна-бодрствования, синдромов ночного апноэ, парасомнии, синдрома “усталых ног”, синдрома смены часовых поясов (jet lag), синдрома периодических движений конечностей, измененной структуры сна и расстройств сна, связанных со сменным режимом работы и нерегулярным режимом работы) у млекопитающего, в том числе человека, включающему введение указанному млекопитающему такого количества соединения формулы I, IA, IA-1, IA-2, IB, IC, II, IIA, III или IV или его фармацевтически приемлемой соли, которое является эффективным в лечении такого расстройства или состояния. Соединения формул I, IA, IA-1, IA-2, IB, IC, II, IIA, III и IV содержат по меньшей мере один хиральный центр и поэтому могут существовать в различных энантиомерных и диастереомерных формах. Данное изобретение относится ко всем оптическим изомерам и всем стереоизомерам соединений формул I, IA, IA-1, IA-2, IB, IC, II, IIA, III и IV как в виде рацемических смесей, так и в виде индивидуальных энантиомеров и диастереоизомеров таких соединений и их смесям и ко всем фармацевтическим композициям и способам лечения, определенным выше, которые содержат или используют их соответственно. Индивидуальные изомеры могут быть получены известными способами, такими как оптическое разделение, оптически избирательное взаимодействие или хроматографическое разделение при получении конечного продукта или его промежуточного соединения. Индивидуальные энантиомеры соединений по данному изобретению могут иметь преимущества по сравнению с рацемическими смесями этих соединений в лечении различных расстройств или состояний. Настоящее изобретение также включает меченные изотопами соединения, которые идентичны соединениям, описываемым формулами I, IA, IA-1, IA-2, IB, IC, II, IIA, III и IV, но с тем отличием, что один или более чем один атом заменен атомом, имеющим атомную массу или атомный номер, отличные от атомной массы или атомного номера, обычно обнаруживаемых в природе. Примеры изотопов, которые могут быть включены в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как 2H, 3H, 13С, 11С, 14С, 15N, 18О, 17О, 31Р, 32P, 35S, 18F и 36Cl соответственно. Соединения по настоящему изобретению, их пролекарства и фармацевтически приемлемые соли указанных соединений или указанных пролекарств, которые содержат вышеупомянутые изотопы и/или другие изотопы других атомов, входят в объем настоящего изобретения. Некоторые меченные изотопами соединения по настоящему изобретению, например соединения, в которые включены радиоактивные изотопы, такие как 3H и 14С, полезны в анализах распределения лекарства и/или субстрата в тканях. Изотопы тритий, то есть 3H, и углерод-14, то есть 14C, являются особенно предпочтительными благодаря их легкому получению и детектируемости. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, то есть 2H, может дать определенные терапевтические преимущества, вытекающие из большей метаболической стабильности, например увеличенного периода полувыведения in vivo, или уменьшенных дозовых потребностей и поэтому может быть предпочтительным в некоторых случаях. Меченные изотопами соединения формулы I по данному изобретению и их пролекарства могут быть в целом получены путем осуществления методик, раскрытых ниже в Схемах и/или в Примерах и Подготовительных Примерах, путем замещения реагента, не меченного изотопами, легко доступным меченным изотопами реагентом. Термин “алкил”, как он использован здесь, если не указано иначе, включает насыщенные одновалентные углеводородные радикалы, имеющие неразветвленные, разветвленные или циклические группировки или их комбинации. Примеры “алкильных’ групп включают метил, этил, пропил, изопропил, бутил, изо-, втор- и трет-бутил, пентил, гексил, гептил, 3-этилбутил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, норборнил и тому подобное, но не ограничены ими. Термин “алкокси”, как он использован здесь, если не указано иначе, означает “алкил-O-“, где “алкил” является таким, как определено выше. Примеры “алкокси” групп включают метокси, этокси, пропокси, бутокси и фенокси, но не ограничены ими. Термин “лечение”, как он использован здесь, относится к защите, обращению, облегчению, замедлению прогрессирования или предотвращению расстройства или состояния, для которого такой термин применяют, или предотвращению одного или более чем одного симптома такого состояния или расстройства. Термин “лечение”, как он использован здесь, относится к акту лечения, как и термин “лечить”, как определено непосредственно выше. Поскольку аминокислоты являются амфотерными, то фармакологически совместимые соли могут представлять собой соли соответствующих неорганических или органических кислот, например соляной, серной, фосфорной, уксусной, щавелевой, молочной, лимонной, яблочной, салициловой, малоновой, малеиновой, янтарной и аскорбиновой. Исходя из соответствующих гидроксидов или карбонатов, образуют соли со щелочными или щелочноземельными металлами, например натрием, калием, магнием или кальцием. Соли с ионами четвертичного аммония могут быть также получены, например с ионом тетраметил-аммония. Эффективность перорально вводимого лекарства зависит от эффективного транспорта этого лекарства через эпителий слизистой оболочки и его стабильности при кишечно-печеночной циркуляции. Лекарства, которые эффективны после парентерального введения, но менее эффективны перорально, или лекарства, чей период полувыведения из плазмы считается слишком коротким, могут быть химически модифицированы в пролекарственную форму. Пролекарство представляет собой лекарство, которое было химически модифицировано и может быть биологически неактивным в месте его действия, но которое может подвергаться разложению или модификации под действием одного или более чем одного ферментативного или другого процесса in vivo с образованием исходной биологически активной формы. Такое химически модифицированное лекарство, или пролекарство, должно иметь фармакокинетический профиль, отличный от фармакокинетического профиля исходного лекарства, обеспечивая более легкое всасывание через эпителий слизистой оболочки, лучшее образование соли и/или растворимость, улучшенную системную стабильность (например, в отношении увеличения периода полувыведения из плазмы крови). Такие химические модификации могут представлять собой: 1) сложноэфирные или амидные производные, которые могут расщепляться, например, эстеразами или липазами. Для сложноэфирных производных указанный сложный эфир получают по карбоксильной группировке молекулы лекарства известными способами. Для амидных производных указанный амид может быть получен по карбоксильной группировке или амидной группировке молекулы лекарства известными способами; 2) пептиды, которые могут распознаваться специфическими или неспецифическими протеиназами. Пептид может быть получен сочетанием молекулы лекарства посредством образования амидной связи с аминной или карбоксильной группировкой молекулы лекарства известными способами; 3) производные, которые накапливаются в месте действия через мембранный отбор пролекарственной формы или модифицированной лекарственной формы; 4) любую комбинацию с 1 по 3. Недавнее исследование в экспериментах на животных показало, что пероральное всасывание некоторых лекарств может быть увеличено посредством получения “мягких” четвертичных солей. Четвертичную соль называют “мягкой” четвертичной солью, поскольку, в противоположность обычным четвертичным солям, например R-N+(CH3)3, она может высвобождать активное лекарство после гидролиза. “Мягкие” четвертичные соли имеют полезные физические свойства по сравнению с основным лекарством или его солями. Растворимость в воде может быть увеличена по сравнению с другими солями, такими как гидрохлорид, но более важным может быть повышенное всасывание лекарства из кишечника. Повышенное всасывание возможно имеет место вследствие того факта, что “мягкая” четвертичная соль обладает свойствами поверхностно-активного вещества и способна к образованию мицелл и неионизированных ионных пар с желчными кислотами и т.д., которые способны более эффективно проникать через эпителий тонкого кишечника. Пролекарство после всасывания быстро гидролизуется с высвобождением активного исходного лекарства. Пролекарства соединений формул I, IA, IA-1, IA-2, IB, IC, II, IIA, III и IV включены в объем данного изобретения. Пролекарства и мягкие лекарства известны в данной области (Palomino Е., Drugs of the Future, 1990; 15(4):361-368). Два последние источника информации включены в данное описание путем ссылки. Некоторые соединения по настоящему изобретению могут существовать в несольватированных формах, а также сольватированных формах, включая гидратированные формы. В общем, сольватированные формы, включая гидратированные формы, эквивалентны несольватированным формам и включены в объем настоящего изобретения. Подробное описание изобретения Соединения по данному изобретению могут быть получены, как описано ниже. В реакционных схемах и следующем обсуждении структурные формулы I, IA, IA-1, IA-2, IB, IC, II, IIA, III и IV и радикалы R1, R2, R3, R4, R5 и R6, если не указано иначе, являются такими, как определено выше. Различные способы существуют для получения хиральных и рацемических Способы, описанные ниже, являются иллюстрацией способов, которые могут быть использованы для получения таких соединений, но не ограничивают их объем. Способ А Согласно методике Lazar и др. (Synth. Commun, 1998, 28(2), 219-224), соединения формулы IA могут быть получены путем нагревания до флегмообразования соединений формулы 1 в спиртовом растворителе, таком как этанол, в присутствии малоновой кислоты и ацетата аммония. Альдегиды формулы 1 могут быть получены из имеющихся в продаже веществ с использованием способов, хорошо известных специалистам в данной области. Соединения, которые могут быть получены способом, описанным выше, включают следующие соединения, но не ограничены ими: 3-амино-6-циклопропил-5-метил-гексановую кислоту; 3-амино-6-циклобутил-5-метил-гексановую кислоту; 3-амино-6-циклопентил-5-метил-гексановую кислоту; 3-амино-6-циклогексил-5-метил-гексановую кислоту; 3-амино-7-циклопропил-5-метил-гептановую кислоту; 3-амино-7-циклобутил-5-метил-гептановую кислоту; 3-амино-7-циклопентил-5-метил-гептановую кислоту; 3-амино-7-циклогексил-5-метил-гептановую кислоту; 3-амино-8-циклопропил-5-метил-октановую кислоту; 3-амино-8-циклобутил-5-метил-октановую кислоту; 3-амино-8-циклопентил-5-метил-октановую кислоту; 3-амино-8-циклогексил-5-метил-октановую кислоту; 3-амино-6-циклопропил-5,5-диметил-гексановую кислоту; 3-амино-6-циклобутил-5,5-диметил-гексановую кислоту; 3-амино-6-циклопентил-5,5-диметил-гексановую кислоту; 3-амино-6-циклогексил-5,5-диметил-гексановую кислоту; 3-амино-7-циклопропил-5,5-диметил-гептановую кислоту; 3-амино-7-циклобутил-5,5-диметил-гептановую кислоту; 3-амино-7-циклопентил-5,5-диметил-гептановую кислоту и 3-амино-7-циклогексил-5,5-диметил-гептановую кислоту. Способ В Использование добавок хиральных аминов к Соединения формулы 7 могут быть получены из соответствующих соединений формулы 6 с использованием условий гидрогенолиза, которые хорошо известны специалистам в данной области. Например, данное взаимодействие может быть осуществлено путем обработки соединений формулы 6 палладиевым металлическим катализатором, таким как, например, гидроксид палладия на углероде, или палладий на углероде, или никель Рэнея, в растворителе, таком как, например, метанол, этанол или тетрагидрофуран, в атмосфере водорода (при давлении приблизительно от 1 до 5 атмосфер (от 98,1 до 490,3 кПа)) с получением желаемого соединения формулы 7. Предпочтительно данное взаимодействие осуществляют с использованием палладия на углероде в этаноле под давлением водорода приблизительно 1 атмосфера (98,1 кПа). Соединения формулы 6 могут быть получены путем обработки соответствующих соединений формулы 4 подходящим амином, таким как (R)-(+)-N-бензил- Соединения формулы 4 могут быть получены из соответствующих соединений формулы 3 путем их обработки подходящим фосфонатным сложным эфиром в присутствии подходящего основания, такого как гидрид натрия, диизопропиламид лития или триэтиламин и либо хлорид лития, либо бромид лития, в растворителе, таком как эфир или ТГФ. Предпочтительно соединение формулы 3 подвергают взаимодействию с фосфонатным сложным эфиром (ALK представляет собой метил, этил, изопропил, бензил и тому подобное) в присутствии бромида лития и триэтиламина в тетрагидрофуране при приблизительно комнатной температуре. Соединения формулы 3 могут быть получены из имеющихся в продаже веществ с использованием способов, хорошо известных специалистам в данной области. Следует понимать, что соединения формулы 3 могут иметь один или более чем один стереогенный центр. Используя описанный выше способ, могут быть получены соединения, имеющие конкретные стереохимические конфигурации. Соединения, которые могут быть получены данным способом, включают, но не ограничены следующими соединениями: (3S,5R)-3-амино-6-циклопропил-5-метил-гексановую кислоту; (3S,5R)-3-амино-6-циклобутил-5-метил-гексановую кислоту; (3S,5R)-3-амино-6-циклогексил-5-метил-гексановую кислоту; (3S,5R)-3-амино-8-циклопропил-5-метил-октановую кислоту; (3S,5R)-3-амино-8-циклобутил-5-метил-октановую кислоту; (3S,5R)-3-амино-8-циклопентил-5-метил-октановую кислоту; (3S,5R)-3-амино-8-циклогексил-5-метил-октановую кислоту; (3S,5S)-3-амино-6-циклопропил-5-метил-гексановую кислоту; (3S,5S)-3-амино-6-циклобутил-5-метил-гексановую кислоту; (3S,5S)-3-амино-6-циклопентил-5-метил-гексановую кислоту; (3S,5S)-3-амино-6-циклогексил-5-метил-гексановую кислоту; (3S,5S)-3-амино-8-циклопропил-5-метил-октановую кислоту; (3S,5S)-3-амино-8-циклобутил-5-метил-октановую кислоту; (3S,5S)-3-амино-8-циклопентил-5-метил-октановую кислоту; (3S,5S)-3-амино-8-циклогексил-5-метил-октановую кислоту; (3S)-3-амино-6-циклопропил-5,5-диметил-гексановую кислоту; (3S)-3-амино-6-циклобутил-5,5-диметил-гексановую кислоту; (3S)-3-амино-6-циклопентил-5,5-диметил-гексановую кислоту; (3S)-3-амино-6-циклогексил-5,5-диметил-гексановую кислоту; (3S)-3-амино-7-циклопропил-5,5-диметил-гептановую кислоту; (3S)-3-амино-7-циклобутил-5,5-диметил-гептановую кислоту; (3S)-3-амино-7-циклопентил-5,5-диметил-гептановую кислоту и (3S)-3-амино-7-циклогексил-5,5-диметил-гептановую кислоту. Способ С Диастереоалкилирование имидов, таких как имиды формулы 10, с получением хиральных сукцинатных аналогов, таких как аналоги формулы 11, было описано ранее в качестве подхода к получению Соединения структуры 11 могут быть получены из соединений структуры 10 в присутствии подходящего производного сложного эфира (PG является таким, как определено выше, LG представляет собой Br, или I, или CI), такого как, например, трет-бутилбромацетат, бензилбромацетат, с металлоорганическм основанием, таким как, например, диизопропиламид лития, или бис(триметилсилил)амид лития, или бис(триметилсилил)амид натрия и тому подобное, в растворителе, таком как, например, тетрагидрофуран, эфир и тому подобное. Данное взаимодействие может быть осуществлено с использованием бис(триметилсилил)амида натрия в тетрагидрофуране при -78°С и обработки полученного в результате промежуточного аниона трет-бутилбромацетатом при температуре от -78°С до -30°С. Соединения формулы 12 могут быть получены путем гидролиза соответствующих соединений формулы 11 в присутствии гидроксида лития и пероксида водорода в растворителе, таком как вода или ТГФ, при температуре от приблизительно 0°С до приблизительно комнатной температуры. Предпочтительно данное взаимодействие осуществляют с использованием пероксида водорода и гидроксида лития в водном тетрагидрофуране при приблизительно 0°С в соответствии со способом, описанным в литературе (смотри Yuen P-W., Kanter G.D., Taylor C.P., и Vartanian M.G., Bioorganic и Medicinal Chem. Lett., 1994;4(6):823-826). Обработка соединения формулы 12 дифенилфосфорилазидом в присутствии подходящего спирта, такого как трет-бутанол, бензиловый спирт или пара-метоксибензиловый спирт, в присутствии подходящего растворителя, такого как толуол, бензол или ТГФ, при температуре от приблизительно 50°С до приблизительно температуры флегмообразования этой реакционной смеси дает соответствующее соединение формулы 13, где R5 представляет собой метил, этил, трет-бутил, бензил или пара-метоксибензил. R5 зависит от выбора используемого спирта. Предпочтительно данное взаимодействие осуществляют с использованием толуольного растворителя в присутствии пара-метоксибензилового спирта в условиях флегмообразования. Соединения формулы 13 могут быть преобразованы в желаемые соединения формулы IA путем гидролиза или гидрогенолиза, используя условия, хорошо известные специалистам в данной области (смотри Т.W.Greene и Р.G.M.Wuts., “Protective groups in organic synthesis”, Wiley, 1991, для подробного описания образования и удаления подходящих защитных групп). Например, данное взаимодействие может быть осуществлено в гидролитических условиях путем обработки соответствующей кислотой, такой как соляная кислота или серная кислота, при температуре от приблизительно комнатной температуры до приблизительно температуры флегмообразования этой реакционной смеси, предпочтительно при температуре флегмообразования, или путем обработки подходящим неорганическим основанием, таким как гидроксид натрия, гидроксид калия или гидроксид лития, предпочтительно гидроксид натрия, при температуре от приблизительно комнатной температуры до приблизительно температуры флегмообразования, предпочтительно при приблизительно комнатной температуре. Данное взаимодействие предпочтительно осуществляют с использованием соляной кислоты при температуре флегмообразования. Однако когда PG представляет собой трет-бутил, данное взаимодействие предпочтительно осуществляют в трифторуксусной кислоте (ТФУ). Когда PG представляет собой основную группу, гидролиз может быть осуществлен в щелочных условиях с использованием способов, хорошо известных специалистам в данной области, например, используя гидроксид натрия или калия. Соединения формулы 10 могут быть получены путем обработки соответствующих соединений формулы 8 аминооснованием, таким как триэтиламин, в присутствии триметилацетилхлорида в эфирном растворителе, таком как ТГФ, и затем путем обработки промежуточных соединений, образованных посредством данного взаимодействия [in situ], хиральным оксазолидиноном формулы 9. Примеры других оксазолидинонов, которые могут быть использованы в данном способе, представляют собой: (4S)-(-)-4-изопропил-2-оксазолидинон; (S)-(-)-4-бензил-2-оксазолидинон; (4S,5R)-(-)-4-метил-5-фенил-2-оксазолидинон; (R)-(+)-4-бензил-2-оксазолидинон, (S)-(+)-4-фенил-2-оксазолидинон; (R)-(-)-4-фенил-2-оксазолидинон; (R)-4-изопропил-2-оксазолидинон и (4R,5S)-(+)-4-метил-5-фенил-2-оксазолидинон)) и хлорид лития. Предпочтительно данное взаимодействие осуществляют путем обработки кислоты формулы 8 триметилацетилхлоридом и триэтиламином в тетрагидрофуране при приблизительно -20°С с последующей обработкой промежуточного соединения, образованного в такой реакции, оксазолидиноном формулы 9 и хлоридом лития при приблизительно комнатной температуре, в соответствии с методиками, описанными в литературе (смотри Но G-J. и Mathre D.J., J. Org. Chem., 1995; 60:2271-2273). Альтернативно, соединения формулы 10 могут быть получены путем обработки соответствующих соединений формулы 9 хлорангидридом, полученным в результате обработки соответствующего соединения формулы 8 оксалилхлоридом, в растворителе, таком как дихлорметан, в присутствии диметилформамида (ДМФА). Кислоты формулы 8 могут быть получены из имеющихся в продаже веществ с использованием способов, хорошо известных специалистам в данной области. Эти кислоты могут иметь один или более чем один хиральный центр. Использование цитронеллилбромида и цитронеллола в синтезе таких кислот описано в Примерах 1, 2 и 3 данной заявки. Соединения, которые могут быть получены описанным выше Способом С, включают, но не ограничены следующими соединениями: (3S,5R)-3-амино-5-метил-гептановую кислоту; (3S,5R)-3-амино-5-метил-октановую кислоту; (3S,5R)-3-амино-5-метил-нонановую кислоту; (3S,5R)-3-амино-5-метил-декановую кислоту; (3S,5S)-3-амино-5-метил-гептановую кислоту; (3S,5S)-3-амино-5-метил-октановую кислоту; (3S,5S)-3-амино-5-метил-нонановую кислоту; (3S,5S)-3-амино-5-метил-декановую кислоту; (3S)-3-амино-5,5-диметил-гептановую кислоту; (3S)-3-амино-5,5-диметил-октановую кислоту; (3S)-3-амино-5,5-диметил-нонановую кислоту; (3S)-3-амино-5,5-диметил-декановую кислоту; (3S,5R)-3-амино-7-циклопропил-5-метил-гептановую кислоту; (3S,5R)-3-амино-7-циклобутил-5-метил-гептановую кислоту; (3S,5R)-3-амино-7-циклопентил-5-метил-гептановую кислоту; (3S,5R)-3-амино-7-циклогексил-5-метил-гептановую кислоту; (3S,5S)-3-амино-7-циклопропил-5-метил-гептановую кислоту; (3S,5S)-3-амино-7-циклобутил-5-метил-гептановую кислоту; (3S,5S)-3-амино-7-циклопентил-5-метил-гептановую кислоту и (3S,5S)-3-амино-7-циклогексил-5-метил-гептановую кислоту. Альтернативно, ссылаясь на реакционную схему (Способ D) ниже, соединения формулы 11 могут быть обработаны подходящей кислотой (например, трифторуксусной кислотой (ТФУ), когда используют трет-бутиловый эфир) с получением соответствующих соединений формулы 14, которые могут затем быть подвергнуты перегруппировке Курциуса (где R5 является таким, как определено выше) с получением соответствующих соединений формулы 15 (смотри Arvanitis et al, J. Chem. Soc. Perkin Trans 1., 1998, 521 для описания этого подхода). Последующий гидролиз имидной группы (с получением соответствующего соединения формулы 16) и карбаматной группы дает желаемые Соединение 16 может быть получено из соединения 15, как описано выше для превращения соединения формулы 11 в соединения формулы 12. Соединения формулы 17 могут быть получены из соответствующих соединений формулы 16 посредством обработки сильной кислотой, такой как соляная кислота или тому подобное, или сильным основанием, таким как гидроксид натрия или калия, либо, если R5 представляет собой бензил или пара-метоксибензил, в условиях гидрогенолиза, используя палладий на углероде в этаноле или ТГФ в атмосфере водорода. Этот подход, который сохраняет стереохимию по хиральному центру в соединениях формулы 11, который также присутствует в продукте формулы II, описан в Примере 4 данной заявки. Способ D Соединения, которые могут быть получены данным способом, включают, но не ограничены следующими соединениями: (2R,4R)-2-аминометил-4-метил-гексановую кислоту; (2R,4R)-2-аминометил-4-метил-гептановую кислоту; (2R,4R)-2-аминометил-4-метил-октановую кислоту; (2R,4R)-2-аминометил-4-метил-нонановую кислоту; (2R,4R)-2-аминометил-4-метил-декановую кислоту; (2R,4S)-2-аминометил-4-метил-гексановую кислоту; (2R,4S)-2-аминометил-4-метил-гептановую кислоту; (2R,4S)-2-аминометил-4-метил-октановую кислоту; (2R,4S)-2-аминометил-4-метил-нонановую кислоту; (2R,4S)-2-аминометил-4-метил-декановую кислоту; (2R,4S)-2-аминометил-6-циклопропил-4-метил-гексановую кислоту; (2R,4S)-2-аминометил-6-циклобутил-4-метил-гексановую кислоту; (2R,4S)-2-аминометил-6-циклопентил-4-метил-гексановую кислоту и (2R,4S)-2-аминометил-6-циклогексил-4-метил-гексановую кислоту. Другие альтернативные подходы к синтезу Способ Е Способ F, описанный ниже, иллюстрирует альтернативный способ получения соединений формулы II. Способ F Согласно методике, описанной Hoffmann-La Roche (FR 1377736 19641106), соединения формулы 3 могут быть получены из ненасыщенных цианоэфиров формулы 2 путем восстановления и гидролиза. В свою очередь, цианоэфиры 2 могут быть получены посредством конденсации Кневенагеля (Knoevenagel) альдегидов 1 с цианоуксусными эфирами (например, Paine, J.В.; Woodward, R.В.; Dolphin, D., J. Org. Chem. 1976, 41, 2826). Альдегиды формулы 1 могут быть получены из имеющихся в продаже веществ способами, известными специалистам в данной области. Соединения формул III и IV могут быть получены с использованием методик, аналогичных методикам Способа F, которые будут очевидны специалистам в данной области. При синтезе соединения формулы III исходное вещество должно представлять собой соединение, подобное формуле 1 в Способе F, но где водород, присоединенный к карбонильной группе в формуле 1, заменен метильной группой. Использование хиральных иминов с получением Способ G Конечная стадия в описанной выше схеме представляет собой гидролиз и сульфонамидной, и сложноэфирной групп. Данное взаимодействие обычно осуществляют с использованием сильной кислоты, такой как соляная кислота, бромоводородная кислота или серная кислота, в растворителе, таком как вода или диоксан или смесь воды и диоксана, при температуре от приблизительно 20°С до приблизительно 50°С, предпочтительно при приблизительно комнатной температуре. Получение соединений по данному изобретению, которые не описаны конкретно в предыдущем экспериментальном разделе, может быть осуществлено с использованием комбинаций взаимодействий, описанных выше, которые очевидны специалистам в данной области. В каждом из взаимодействий, обсужденных или проиллюстрированных выше, давление не является существенным, если не указано иначе. Давления от приблизительно 0,5 атмосфер (49 кПа) до приблизительно 5 атмосфер (490,3 кПа) обычно являются приемлемыми, и давление окружающей среды, то есть приблизительно 1 атмосфера (98,1 кПа), является предпочтительным как более удобное. Соединения формулы I, IA, IA-1, IA-2, IB, IC, II, IIA, III или IV и промежуточные соединения, показанные в описанных выше реакционных схемах, могут быть выделены и очищены общепринятыми методиками, такими как перекристаллизация или хроматографическое разделение. Способность соединений по настоящему изобретению связываться с Использовали анализ связывания радиолиганда с использованием [3Н]-габапентина и Активность соединений по данному изобретению in vivo может быть определена на животных моделях. Смотри, например, Sluka, К., et al., “Unilateral Intramuscular Injections Of Acidic Saline Produce A Bilateral, Long-Lasting Hyperalgesia,” Muscle Nerve 24: 37-46 (2001); Dixon, W., “Efficient ansiysis of experimental observations,” Ann Rev Pharmacoi Toxicol 20:441-462, (1980); Randall L.O. и SelittoJ.J., “A Method For Measurement Of Analgesic Activity On Inflamed Tissue,” Arch. Int. Pharmacodyn.;4:409-419, (1957); Hargreaves K., Dubner R., Brown F., Flores С. и Joris J. “A New And Sensitive Method For Measuring Thermal Nociception In Cutaneous Hyperalgesia,” Pain. 32:77-88 (1988)(hyperalgesia). Смотри также Vogel J.R., Beer В. и Clody D.E., “A Simple И Reliable Conflict Procedure For Testing Anti-Anxiety Agents,” Psychopharmacologia 21-:1-7(1971) (тревога). Соединения по настоящему изобретению и их фармацевтически приемлемые соли могут быть введены млекопитающим посредством перорального, парентерального (такого как подкожное, внутривенное, внутримышечное, внутригрудное введение и инфузия), ректального, трансбуккального или интраназального путей. Новые соединения по настоящему изобретению могут быть введены по отдельности или в комбинации с фармацевтически приемлемыми носителями или разбавителями с использованием любых путей введения, указанных выше, и такое введение может быть осуществлено в однократных или многократных дозах. Более конкретно, новые терапевтические агенты по данному изобретению могут быть введены в широком разнообразии различных лекарственных форм, то есть они могут быть объединены с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек, пастилок, твердых леденцов, суппозиториев, желе, гелей, паст, мазей, водных суспензий, инъецируемых растворов, эликсиров, сиропов и тому подобное. Такие носители включают твердые разбавители или наполнители, стерильные водные среды и различные нетоксичные органические растворители и т.д.. Более того, пероральные фармацевтические композиции могут быть подходящим образом подслащены и/или ароматизированы. В целом, массовое отношение новых соединений по данному изобретению к фармацевтически приемлемому носителю находится в диапазоне от приблизительно 1:6 до приблизительно 2:1 и предпочтительно от приблизительно 1:4 до приблизительно 1:1. Для перорального введения таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, фосфат кальция и глицин, могут быть использованы наряду с различными разрыхлителями, такими как крахмал (и предпочтительно кукурузный, картофельный или маниоковый крахмал), альгиновая кислота и некоторые комплексные силикаты, вместе со связующими для гранулирования типа поливинилпирролидона, сахарозы, желатина и гуммиарабика. Дополнительно, смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк, часто являются очень полезными для целей таблетирования. Твердые композиции подобного типа могут также быть использованы в качестве наполнителей в желатиновых капсулах; предпочтительные материалы в этом отношении также включают лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Когда водные суспензии и/или эликсиры желательны для перорального введения, активный ингредиент можно объединять с различными подсластителями или корригентами, окрашивающими агентами или красителями и, если это желательно, также с эмульгирующими и/или суспендирующими агентами, вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и их различные подобные комбинации. Для парентерального введения могут быть использованы растворы соединения по настоящему изобретению в кунжутовом либо арахисовом масле или в водном пропиленгликоле. Водные растворы должны быть соответствующим образом забуферены (предпочтительно рН более чем 8), если необходимо, и водный разбавитель прежде всего должен оставаться изотоничным. Эти водные растворы подходят для целей внутривенных инъекций. Масляные растворы подходят для целей внутрисуставных, внутримышечных и подкожных инъекций. Приготовление всех таких растворов в стерильных условиях легко осуществить стандартными фармацевтическими способами, хорошо известными специалистам в данной области. Для интраназального введения или введения посредством ингаляции новые соединения по данному изобретению удобно доставлять в форме раствора или суспензии из контейнера с пульверизатором, который сжимается или нагнетается пациентом, или в форме аэрозольного спрея из находящегося под давлением контейнера или небулайзера, с использованием подходящего пропеллента, например дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае находящегося под давлением аэрозоля стандартная доза может быть определена посредством предложения клапана для доставки отмеренного количества. Находящийся под давлением контейнер или небулайзер может содержать раствор или суспензию активного соединения. Капсулы и картриджи (сделанные, например, из желатина) для применения в ингаляторе или инсуффляторе могут быть изготовлены содержащими порошкообразную смесь соединения по данному изобретению и подходящей порошкообразной основы, такой как лактоза или крахмал. Препараты активных соединений по данному изобретению для лечения состояний, на которые ссылались выше, у среднего взрослого человека предпочтительно составляют таким образом, чтобы каждая отмеренная доза или “впрыск” аэрозоля содержал от 20 мкг до 1000 мкг активного соединения. Суммарная суточная доза, доставляемая аэрозолем, будет находиться в диапазоне от 100 мкг до 10 мг. Введение может быть осуществлено несколько раз в сутки, например 2, 3, 4 или 8 раз, давая каждый раз, например, 1, 2 или 3 дозы. Соединения по настоящему изобретению могут быть изготовлены и введены в виде широкого разнообразия пероральных и парентеральных лекарственных форм. Таким образом, соединения по настоящему изобретению могут быть введены путем инъекции, а именно внутривенно, внутримышечно, внутрикожно, подкожно, интрадуоденально или внутрибрюшинно. Кроме того, соединения по настоящему изобретению могут быть введены путем ингаляции, например, интраназально. Дополнительно, соединения по настоящему изобретению могут быть введены трансдермально. Специалистам в данной области очевидно, что упомянутые лекарственные формы могут содержать в качестве активного компонента либо соединение формулы I, IA, IA-1, IA-2, IB, IC, II, IIA, III или IV, либо соответствующую фармацевтически приемлемую соль такого соединения. Для изготовления фармацевтических композиций из соединений по настоящему изобретению фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Препараты в виде твердых форм включают порошки, таблетки, пилюли, капсулы, облатки, суппозитории и диспергируемые гранулы. Твердый носитель может представлять собой одно или более чем одно вещество, которое может также выполнять функцию разбавителя, корригента, связывающего агента, консерванта, разрыхлителя для таблеток или инкапсулирующего материала. В порошках носитель представляет собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченным активным компонентом. В таблетках активный компонент смешан с носителем, обладающим необходимыми связующими свойствами, в подходящих соотношениях и спрессован в форму желаемого вида и размера. Порошки и таблетки предпочтительно содержат от пяти или десяти до приблизительно семидесяти процентов активного соединения. Подходящие носители представляют собой карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант, метил целлюлозу, карбоксимеилцеллюлозу натрия, низкоплавкий воск, масло какао и тому подобное. Термин “препарат” предназначен для включения препарата активного соединения с инкапсулирующим материалом в качестве носителя, обеспечивая капсулу, в которой активный компонент с другими носителями или без них окружен носителем, который таким образом находится в ассоциации с ним. Подобным образом включены облатки и лепешки. Таблетки, порошки, капсулы, пилюли, облатки и лепешки могут быть использованы в качестве твердых лекарственных форм, подходящих для перорального введения. Для изготовления суппозиториев низкоплавкий воск, такой как смесь глицеридов жирных кислот или масло какао, сначала расплавляют и активный компонент гомогенно диспергируют в нем, в то же время перемешивая. Расплавленную гомогенную смесь затем разливают в формы подходящего размера, оставляют охлаждаться и таким образом затвердевать. Препараты в виде жидких форм включают растворы, суспензии и эмульсии, например водные растворы или растворы в водном пропиленгликоле. Для парентеральной инъекции жидкие препараты могут быть приготовлены в виде раствора в водном растворе полиэтиленгликоля. Водные растворы, подходящие для перорального применения, могут быть приготовлены путем растворения активного компонента в воде и добавления подходящих красителей, корригентов, стабилизаторов и загустителей, если желательно. Водные суспензии, подходящие для перорального применения, могут быть приготовлены путем диспергирования тонкоизмельченного активного компонента в воде вместе с вязким материалом, таким как природные или синтетические смолы, полимеры, метилцеллюлоза, карбоксиметиллцеллюлоза натрия и другие хорошо известные суспендирующие агенты. Также включены препараты в виде твердых форм, которые предназначены для преобразования, непосредственно перед применением, в препараты в виде жидких форм для перорального введения. Такие жидкие формы включают растворы, суспензии и эмульсии. Эти препараты могут содержать, в добавление к активному компоненту, красители, корригенты, стабилизаторы, буферы, искусственные и натуральные подсластители, диспергирующие агенты, загустители, солюбилизаторы и тому подобное. Фармацевтический препарат предпочтительно представлен в стандартной лекарственной форме. В такой форме препарат подразделен на стандартные дозы, содержащие соответствующие количества активного компонента. Стандартная лекарственная форма может представлять собой упакованный препарат, где упаковка содержит дискретные количества препарата, например упакованные таблетки, капсулы и порошки во флаконах или ампулах. Кроме того, стандартная лекарственная форма сама по себе может представлять собой капсулы, таблетку, облатку или лепешку, либо она может представлять собой подходящее количество любой из них в упакованной форме. Количество активного компонента в стандартном лекарственном препарате может варьироваться, или его можно регулировать, от 0,01 мг до 1 г, в соответствии с конкретным применением и эффективностью активного компонента. При медицинском применении лекарство может быть введено три раза в сутки, как, например, капсулы по 100 или 300 мг. Композиция может также содержать, если желательно, другие совместимые терапевтические агенты. При терапевтическом применении соединения, используемые в фармацевтическом способе по данному изобретению, вводят в первоначальной дозировке от приблизительно 0,1 мг до приблизительно 1 г в сутки. Однако дозировки могут изменяться в зависимости от потребностей пациента, тяжести состояния, которое необходимо лечить, и соединения, которое применяют. Определение подходящей дозировки для конкретной ситуации находится в компетенции специалиста в данной области. В целом, лечение начинают с меньших дозировок, которые меньше оптимальной дозы соединения. Затем дозировку увеличивают небольшими прибавлениями вплоть до достижения оптимального эффекта в данных обстоятельствах. Для удобства суммарная суточная дозировка может быть разделена и введена в виде порций в течение суток, если желательно. Следующие Примеры иллюстрируют получение соединений по настоящему изобретению. Они не предназначены для ограничения объема изобретения. Точки плавления не откорректированы. Данные ядерного магнитного резонанса (ЯМР) даны в частях на миллион и используют в качестве стандарта дейтериевый сигнал от образца растворителя. Примеры Пример 1. Гидрохлорид (3S,5R)-3-амино-5-метил-октановой кислоты (R)-2,6-Диметил-нон-2-ен. К (S)-цитронеллилбромиду (50 г, 0,228 моль) в ТГФ (800 мл) при 0°С добавляли LiCI (4,3 г), а затем CuCl2 (6,8 г). Через 30 минут добавляли хлорид метилмагния (152 мл 3 М раствора в ТГФ, Aldrich) и этот раствор нагревали до комнатной температуры. Через 10 часов раствор охлаждали до 0°С и осторожно добавляли насыщенный водный раствор хлорида аммония. Полученные в результате два слоя разделяли и водную фазу экстрагировали эфиром. Объединенные органические фазы сушили (MgSO4) и концентрировали с получением (R)-2,6-диметил-нон-2-ена. 32,6 г; 93%. Использовали без дополнительной очистки. 1H ЯМР (400 МГц; CDCI3) (R)-4-Метил-гептановая кислота. К (R)-2,6-диметил’нон-2-ену (20 г, 0,13 моль) в ацетоне (433 мл) добавляли раствор CrO3 (39 г, 0,39 моль) в H2SO4 (33 мл)/Н2O (146 мл) в течение 50 минут. Через 6 часов добавляли дополнительное количество CrO3 (26 г, 0,26 моль) в H2SO4 (22 мл)/Н2O (100 мл). Через 12 часов раствор разбавляли соляным раствором и этот раствор экстрагировали эфиром. Объединенные органические фазы сушили (MgSO4) и концентрировали. Флэш-хроматография (градиент от 6:1 до 2:1 смеси гексан/EtOAc) давала (R)-4-метил-гептановую кислоту в виде масла. 12,1 г; 65%. MS, m/z (относительная интенсивность): 143 [М-Н, 100%]; 1H ЯМР (400 МГц; CDCI3) (4R,5S)-4-Метил-3-((R)-4-метил-гептаноил)-5-фенил-оксазолидин-2-он. К (R)-4-метил-гептановой кислоте (19 г, 0,132 моль) и триэтиламину (49,9 г, 0,494 моль) в ТГФ (500 мл) при 0°С добавляли триметилацетилхлорид (20 г, 0,17 моль). Через 1 час добавляли LiCl (7,1 г, 0,17 моль), а затем (4R,5S)-(+)-4-метил-5-фенил-2-оксазолидинон) (30 г, 0,17 моль). Эту смесь нагревали до комнатной температуры и через 16 часов фильтрат удаляли путем фильтрования и раствор концентрировали при пониженном давлении. Флэш-хроматография (7:1 гексан/EtOAc) давала (4R,5S)-4-метил-3-((R)-4-метил-гептаноил)-5-фенил-оксазолидин-2-он в виде масла. 31,5 г; 79%. [ трет-Бутиловый эфир (3S,5R)-5-метил-3-((4R,5S)-4-метил-2-оксо-5-фенил-оксазолидин-3-карбонил)-октановой кислоты. К (4R,5S)-4-метил-3-((R)-4-метил-гептаноил)-5-фенил-оксазолидин-2-ону (12,1 г, 0,04 моль) в ТГФ (200 мл) при -50°С добавляли бис(триметилсилил)амид натрия (48 мл 1 М раствора в ТГФ). Через 30 минут добавляли трет-бутилбромацетат (15,6 г, 0,08 моль). Этот раствор перемешивали в течение 4 часов при -50°С и затем нагревали до комнатной температуры. Через 16 часов добавляли насыщенный водный раствор хлорида аммония и два слоя разделяли. Водную фазу экстрагировали эфиром и объединенные органические фазы сушили (MgSO4) и концентрировали. Флэш-хроматография (9:1 гексан/ЕЮАс) давала трет-бутиловый эфир (3S,5R)-5-метил-3-((4R,5S)-4-метил-2-оксо-5-фенил-оксазолидин-3-карбонил)-октановой кислоты в виде белого твердого вещества, 12 г; 72%. [ 4-трет-Бутиловый эфир (S)-2-((R)-2-метил-пентил)-янтарной кислоты. К трет-бутиловому эфиру (3S,5R)-5-метил-3-((4R,5S)-4-метил-2-оксо-5-фенил-оксазолидин-3-карбонил)-октановой кислоты (10,8 г, 0,025 моль) в Н2О (73 мл) и ТГФ (244 мл) при 0°С добавляли предварительно смешанный раствор LiOH (51,2 мл 0,8 М раствора) и Н2O2 (14,6 мл 30%-ного раствора). Через 4 часа добавляли дополнительные 12,8 мл LiOH (0,8 М раствор) и 3,65 мл Н2O2 (30%-ный раствор). Через 30 минут добавляли бисульфит натрия (7 г), сульфит натрия (13 г) и воду (60 мл), а затем гексан (100 мл) и эфир (100 мл). Два слоя разделяли и водный слой экстрагировали эфиром. Объединенные органические фазы концентрировали с получением масла, которое растворяли в гептане (300 мл). Полученное в результате твердое вещество отфильтровывали и фильтрат сушили (MgSO4) и концентрировали с получением 4-трет-бутилового эфира (S)-2-((R)-2-метил-пентил)-янтарной кислоты (6 г, 93%), который использовали непосредственно без дополнительной очистки. MS, m/z (относительная интенсивность): 257 [М+Н, 100%]. трет-Бутиловый эфир (3S,5R)-3-бензилоксикарбониламино-5-метил-октановой кислоты. Раствор 4-трет-бутилового эфира (S)-2-((R)-2-метил-пентил)-янтарной кислоты (6,0 г, 23,22 ммоль) и триэтиламина (3,64 мл, 26,19 ммоль) в толуоле (200 мл) обрабатывали дифенилфосфорилазидом (5,0 мл, 23,22 мл) и перемешивали при комнатной температуре в течение 0,5 часа. Затем эту реакционную смесь нагревали при температуре флегмообразования в течение 3 часов и быстро охлаждали, добавляли бензиловый спирт (7,2 мл, 69,7 ммоль) и этот раствор нагревали в течение еще 3 часов. После этого реакционную смесь оставляли охлаждаться, разбавляли этиловым эфиром (200 мл) и объединенный органический слой осторожно промывали насыщенным NaHCO3 и соляным раствором и сушили (Na2SO4). Концентрированный органический компонент очищали путем хроматографии (жидкостной хроматографии среднего давления, MPLC), элюируя смесью гексаны:этилацетат 8:1 с получением трет-бутилового эфира (3S,5R)-3-бензилоксикарбониламино-5-метил-октановой кислоты, (6,4 г, 75,8%). MS: M+1: 364,2, 308,2. 1H ЯМР (400 МГц, CDCl3) трет-Бутиловый эфир (3S,5R)-3-амино-5-метил-октановой кислоты. Раствор трет-бутилового эфира (38,5К)-3-бензилоксикарбониламино-5-метил-октановой кислоты (2,14 г.5,88 ммоль) в ТГФ (50 мл) обрабатывали Pd/C (0,2 г) и H2 при давлении 50 фунт/кв.дюйм (345 кПа) в течение 2 часов. Реакционную смесь затем фильтровали и концентрировали в вакууме до образования масла с получением трет-бутилового эфира (3S,5R)-3-амино-5-метил-октановой кислоты с количественным выходом. MS: М+1: 230,2, 174,1. 1Н ЯМР (400 МГц, CDCl3) Гидрохлорид (3S,5R)-3-амино-5-метил-октановой кислоты. Суспензию трет-бутилового эфира (3S,5R)-амино-5-метил-октановой кислоты (2,59 г, 11,3 ммоль) в 6 н. HCI (100 мл) кипятили с обратным холодильником 18 часов, охлаждали и фильтровали через Целит. Фильтрат концентрировали в вакууме до 25 мл и полученные в результате кристаллы собирали и сушили с получением гидрохлорида (3S,5R)-3-амино-5-метил-октановой кислоты, т.пл. 142,5-142,7°С (1,2 г, 50,56%). Вторую порцию (0,91 г) получили из фильтрата. Аналитически рассчитано для C9H19NO2·HCl: С: 51,55, Н: 9,61, N: 6,68, Cl: 16,91. Обнаружено: С: 51,69, Н: 9,72, N: 6,56, Cl: 16,63. M8: М+1: 174,1. 1Н ЯМР (CD3OD) Гидрохлорид (3S,5R)-3-амино-5-метил-октановой кислоты. 5,3 г 4-трет-Бутилового эфира 2S-(2R-метил-пентил)-янтарной кислоты, содержащегося в 30 мл метил-трет-бутилового эфира, подвергали взаимодействию при комнатной температуре с 3,5 мл триэтиламина, а затем 6,4 г дифенилфосфорилазида. После того как реакционную смесь оставляли достигать экзотермического эффекта до 45°С и перемешиваться в течение по меньшей мере 4 часов, ее оставляли охлаждаться до комнатной температуры и отстаиваться, в то же время разделяя фазы. Нижний слой отбрасывали, а верхний слой промывали водой, а затем разбавляли водной HCI. Этот верхний слой затем объединяли 10 мл 6 н. водной HCl и перемешивали при 45-65°С. Реакционную смесь концентрировали путем дистилляции в вакууме до приблизительно 10-14 мл и оставляли кристаллизоваться, в то же время охлаждая до приблизительно 5°С. После сбора продукта путем фильтрования этот продукт промывали толуолом и повторно суспендировали в толуоле. Продукт сушили путем нагревания под вакуумом с получением в результате 2,9 г (67%) белого кристаллического продукта. Этот продукт может быть перекристаллизован из водной HCl. Т.пл. 137°С, 1Н ЯМР (400 МГц, D6 DMSO) дельта 0.84-0.88 (перекрывание d и t, 6H), 1.03-1.13 (m, 1H), 1.16-1.37 (m, 4H), 1.57-1.68 (m, 2H), 2.55 (dd, 1H, J=7, 17 Гц), 2.67 (dd, 1H, J=6, 17 Гц), 3.40 (m, 1H),8.1 (br s, 3H), 12.8 (br s, 1H). Пример 2. (3S,5R)-Амино-5-метил-гептановая кислота (S)-3,7-Диметил-окт-6-ениловый эфир метансульфоновой кислоты. К S-(-)-цитронеллолу (42,8 г, 0,274 моль) и триэтиламину (91 мл, 0,657 моль) в CH2CI2 (800 мл) при 0°С добавляли метансульфонилхлорид (26 мл, 0,329 моль) в CH2Cl2 (200 мл). Через 2 часа при 0°С этот раствор промывали 1 н. HCl, a затем соляным раствором. Органическую фазу сушили (MgSO4) и концентрировали с получением указанного в заголовке соединения в виде масла (60,5 г, 94%), которое использовали без дополнительной очистки. MS, m/z (относительная интенсивность): 139 [100%], 143 [100%]. 1Н ЯМР (400 МГц; CDCl3) (R)-2,6-Диметил-окт-2-ен. К (S)-3,7-Диметил-окт-6-ениловому эфиру метансульфоновой кислоты (60 г, 0,256 моль) в ТГФ (1 л) при 0°С добавляли алюмогидрид лития (3,8 г, 0,128 моль). Через 7 часов добавляли дополнительные 3,8 г алюмогидрида лития и этот раствор нагревали до комнатной температуры. Через 18 часов добавляли дополнительные 3,8 г алюмогидрида лития. Через еще 21 час эту реакционную смесь осторожно гасили 1 н. лимонной кислотой и этот раствор дополнительно разбавляли соляным раствором. Полученные в результате две фазы разделяли и органическую фазу сушили (MgSO4) и концентрировали с получением указанного в заголовке соединения в виде масла, которое использовали без дополнительной очистки. MS, m/z (относительная интенсивность): 139 [М+Н, 100%]. (R)-4-Метил-гексановая кислота. Использовали методику, аналогичную синтезу (R)-4-метил-гептановой кислоты, с получением указанной кислоты в виде масла (9,3 г, 56%). IR (пленка) 2963, 2931, 2877, 2675, 1107, 1461, 1414 см-1; MS, m/z (относительная интенсивность): 129 [М-Н, 100%]; 1H ЯМР (400 МГц; CDCl3) (4R,5S)-4-Метил-3-((R)-4-метил-гексаноил)-5-фенил-оксазолидин-2-он. Использовали методику, аналогичную синтезу (4R,5S)-4-метил-3-((R)-4-метил-гептаноил)-5-фенил-оксазолидин-2-она, с получением указанного в заголовке соединения в виде масла (35,7 г, 95%). MS, m/z (относительная интенсивность): 290 [М+Н, 100%]; 1H ЯМР (400 МГц; CDCl3) трет-Бутиловый эфир (3S,5R)-5-метил-3-[1-((4R,5S)-4-метил-2-оксо-5-фенил-оксазолидин-3-ил)-метаноил]-гептановой кислоты. Следовали методике, аналогичной получению трет-бутилового эфира (3S,5R)-5-метил-3-((4R,5S)-4-метил-2-оксо-5-фенил-оксазолидин-3-карбонил)-октановой кислоты, с получением указанного в заголовке соединения в виде масла (7,48 г; 31%). IR (пленка) 2967, 2934, 1770, 1716, 1696, 1344, 1148, 1121, 1068, 1037, 947 см-1; MS, m/z (относительная интенсивность): 178 [100%], 169 [100%]; [ 4-трет-Бутиловый эфир (S)-2-((R)-2-метил-бутил)-янтарной кислоты. трет-Бутиловый эфир (3S,5R)-5-метил-3-[1-((4R,5S)-4-метил-2-оксо-5-фенил-оксазолидин-3-ил)-метаноил]-гептановой кислоты (7,26 г, 0,018 моль) в Н2О (53 мл) и ТГФ (176 мл) при 0°С добавляли в предварительно смешанный раствор LiOH (37 мл 0,8 М раствора) и Н2O2 (10,57 мл 30%-ного раствора) и этот раствор нагревали до комнатной температуры. Через 2 часа добавляли бисульфит натрия (7 г), сульфит натрия (13 г) и воду (60 мл) и два слоя разделяли и водный слой экстрагировали эфиром. Объединенные органические фазы концентрировали с получением масла, которое растворяли в гептане (200 мл). Полученное в результате твердое вещество отфильтровывали и фильтрат сушили (MgSO4) и концентрировали с получением указанного в заголовке соединения в виде масла (4,4 г), которое использовали без дополнительной очистки. MS, m/z (относительная интенсивность): 243 [100%]; 1Н ЯМР (400 МГц; CDCl3) трет-Бутиловый эфир (3S,5R)-3-бензилоксикарбониламино-5-метил-гептановой кислоты. Это соединение получали, как описано выше, исходя из 4-трет-бутилового эфира (S)-2-((R)-2-метил-бутил)-янтарной кислоты, с получением трет-бутилового эфира (3S,5R)-3-бензилоксикарбониламино-5-метил-гептановой кислоты в виде масла (выход 73,3%). 1H ЯМР (400 МГц; CDCI3) трет-Бутиловый эфир (3S,5R)-амино-5-метил-гептановой кислоты. Это соединение получали, как описано выше, исходя из 4-трет)-бутилового эфира (3S,5R)-3-бензилоксикарбониламино-5-метил-гептановой кислоты вместо трет-бутилового эфира (3S,5R)-3-бензилоксикарбониламино-5-метил-октановой кислоты, с получением указанного в заголовке соединения. 1H ЯМР (400 МГц; CDCl3) Гидрохлорид (3S,5R)-амино-5-метил-гептановой кислоты. Суспензию трет-бутилового эфира (3S,5R)-амино-5-метил-гептановой кислоты (1,44 г, 6,69 ммоль) в 3 н. HCI нагревали при температуре флегмообразования в течение 3 часов, фильтровали в горячем виде через Целит и концентрировали до сухого состояния. Посредством растирания полученного в результате твердого вещества в этиловом эфире получили гидрохлорид (3S,5R)-3-амино-5-метил-гептановой кислоты (0,95 г, 85%), т.пл. 126,3-128,3°С.1Н ЯМР (400 МГц; CD3OD) Пример 3. (3S,5R)-3-Амино-5-метил-нонановая кислота (R)-4-Метил-октановая кислота. Хлорид лития (0,39 г, 9,12 ммоль) и хлорид меди(1) (0,61 г, 4,56 ммоль) объединяли в 45 мл ТГФ при температуре окружающей среды и перемешивали 15 минут, затем охлаждали до 0°С, в то же время добавляя бромид этилмагния (1 М раствор в ТГФ, 45 мл, 45 ммоль). Добавляли по каплям (S)-цитронеллилбромид (5,0 г, 22,8 ммоль) и этот раствор оставляли медленно нагреваться до температуры окружающей среды при перемешивании в течение ночи. Реакцию останавливали путем осторожного добавления насыщ. NH4Cl (водн.) и перемешивали с Et2O и насыщ. NH4Cl (водн.) в течение 30 минут. Фазы разделяли и органическую фазу сушили (MgSO4) и концентрировали. Неочищенный (R)-2,6-диметил-дец-2-ен использовали без дополнительной очистки. К раствору (R)-2,6-диметил-дец-2-ена (3,8 г, 22,8 ммоль) в 50 мл ацетона при 0°С добавляли реагент Джонса (Jones) (2,7 М в H2SO4 (водн.), 40 мл, 108 ммоль) и этот раствор оставляли медленно нагреваться до температуры окружающей среды при перемешивании в течение ночи. Смесь распределяли между Et2O и H2O, фазы разделяли и органическую фазу промывали соляным раствором, сушили (MgSO4) и концентрировали. Остаток очищали путем флэш-хроматографии (смесь гексаны:EtOAc 8:1) с получением 2,14 г (59%) указанного в заголовке соединения в виде бесцветного масла: LRMS: m/z 156,9 (М+); 1H ЯМР (400 МГц; CDCl3) (4R,5S)-4-Метил-3-((R)-4-метил-октаноил)-5-фенил-оксазолидин-2-он. К (R)-4-метил-октановой кислоте (2,14 г, 13,5 ммоль) в 25 мл CH2Cl2 при 0°С добавляли 3 капли ДМФА, а затем оксалилхлорид (1,42 мл, 16,2 ммоль), приводя в результате к энергичному выделению газа. Этот раствор непосредственно нагревали до температуры окружающей среды, перемешивали 30 минут и концентрировали. В это же время к раствору оксазолидинона (2,64 г, 14,9 ммоль) в 40 мл ТГФ при -78°С добавляли по каплям н-бутиллитий (1,6М раствор в гексанах 9,3 мл, 14,9 ммоль). Эту смесь перемешивали в течение 10 минут, в то же время добавляя по каплям хлорангидрид в 10 мл ТГФ. Реакционную смесь перемешивали 30 минут при -78°С, затем нагревали непосредственно до температуры окружающей среды и гасили насыщ. NH4Cl. Эту смесь распределяли между Et2O и насыщ. NH4Cl (водн.), фазы разделяли и органическую фазу сушили (MgSO4) и концентрировали с получением 3,2 г указанного в заголовке соединения в виде бесцветного масла. LRMS: m/z 318,2 (М+); 1H ЯМР (400 МГц; CDCl3) трет-Бутиловый эфир (3S,5R)-5-метил-3-((4R,5S)-4-метил-2-оксо-5-фенил-оксазолидин-3-карбонил)-нонановой кислоты. К раствору диизопропиламина (1,8 мл, 12,6 ммоль) в 30 мл ТГФ при -78°С добавляли н-бутиллитий (1,6 М раствор в гексанах, 7,6 мл, 12,1 ммоль) и эту смесь перемешивали 10 минут, в то же время добавляя по каплям (4R,5S)-4-метил-3-((R)-4-метил-октаноил)-5-фенил-оксазолидин-2-он (3,2 г, 10,1 ммоль) в 10 мл ТГФ. Этот раствор перемешивали в течение 30 минут, быстро по каплям добавляли трет-бутилбромацетат (1,8 мл, 12,1 ммоль) при -50°С и эту смесь оставляли медленно нагреваться до 10°С в течение 3 часов. Смесь распределяли между Et2O и насыщ. NH2Cl (водн.), фазы разделяли и органическую фазу сушили (MgSO4) и концентрировали. Остаток очищали путем флэш-хроматографии (16:1 до 8:1 гексаны:EtOAc) с получением 2,65 г (61%) указанного в заголовке соединения в виде бесцветного крситаллического твердого вещества, т.пл.=84-86°С. [ 4-трет-Бутиловый эфир (S)-2-((R)-2-метил-гексил)-янтарной кислоты. К раствору трет-бутилового эфира (3S,5R)-5-метил-3-((4R,5S)-4-метил-2-оксо-5-фенил-оксазолидин-3-карбонил)-нонановой кислоты (2,65 г, 6,14 ммоль) в 20 мл ТГФ при 0°С добавляли предварительно охлажденный (0°С) раствор моногидрата LiOH (1,0 г, 23,8 ммоль) и пероксид водорода (30 масс.% водный раствор, 5,0 мл) в 10 мл Н2O. Эту смесь энергично перемешивали в течение 90 минут, затем нагревали до температуры окружающей среды и перемешивали 90 минут. Реакцию останавливали при 0°С путем добавления 100 мл 10% NaHSO3 (водн.), затем экстрагировали Et2O. Фазы разделяли и органическую фазу промывали соляным раствором, сушили (MgSO4) и концентрировали. Указанное в заголовке соединение использовали без дополнительной очистки. трет-Бутиловый эфир (3S,5R)-3-бензилоксикарбониламино-5-метилнонановой кислоты. Это соединение получали аналогично тому, как описано выше, исходя из 4-трет-бутилового эфира (S)-2-((R)-2-метилгексил)-янтарной кислоты вместо 4-трет-бутилового эфира (S)-2-((R)-2-метилпентил)-янтарной кислоты, с получением указанного в заголовке соединения в виде масла (выход 71,6%). 1H ЯМР (400 МГц; CDCl3) трет-Бутиловый эфир (3S,5R)-3-амино-5-метил-нонановой кислоты. Это соединение получали, как описано выше, исходя из трет-бутилового эфира (3S,5R)-бензилоксикарбониламино-5-метил-нонановой кислоты вместо трет-бутилового эфира (3S,5R)-3-бензилоксикарбониламино-5-метил-октановой кислоты. Выход=97%. 1Н ЯМР (400 МГц; CDCl3) Гидрохлорид (3S,5R)-3-амино-5-метил-нонановой кислоты. Смесь трет-бутилового эфира (3S,5R)-3-амино-5-метил-нонановой кислоты (1,50 г, 6,16 ммоль) в 3 н. HCl (100 мл) нагревали при температуре флегмообразования в течение 3 часов, фильтровали в горячем виде через Целит и концентрировали до 30 мл в вакууме. Полученные в результате кристаллы собирали, промывали дополнительным количеством 3 н. HCl и сушили с получением указанного в заголовке соединения, т.пл. 142,5-143,3°С. Дополнительную порцию получили из фильтрата с получением 1,03 г (70,4%). 1H ЯМР (400 МГц; CD3OD) Пример 4. (2R,4R)-2-Аминометил-4-метил-гептановая кислота 5R-Метил-3R-(4S-метил-2-оксо-5R-фенилоксазолидин-3-карбонил)октановая кислота. Раствор трет-бутилового эфира (3R,5R)-5-метил-3-((4S,5R)-4-метил-2-оксо-5-фенил-оксазолидин-3-карбонил)-октановой кислоты (3,9 г, 9,34 ммоль) в дихлорметане (150 мл) обрабатывали трифторуксусной кислотой (7,21 мл, 93,4 мл) и перемешивали 18 часов при температуре окружающей среды. Затем растворители и реагент удаляли в вакууме, полученный в результате остаток растирали в 100 мл гексанов с получением 3,38 г указанного в заголовке соединения (100%), т.пл. 142-143°С.MS M+1=362,1. 1H ЯМР (400 МГц; CDCl3) Бензиловый эфир [4R-метил-2R-(4S-метил-2-оксо-5R-фенилоксазолидин-3-карбонил)гептил]карбаминовой кислоты. Раствор 5R-метил-3R-(4S-метил-2-оксо-5R-фенилоксазолидин-3-карбонил)октановой кислоты (1,98 г, 5,48 ммоль) и триэтиламина (0,92 мл, 6,57 ммоль) обрабатывали дифенилфосфорилазидом (1,2 мл, 5,48 ммоль), перемешивали 30 минут при температуре окружающей среды и затем нагревали при температуре флегмообразования в течение 3 часов. После быстрого охлаждения реакционную смесь обрабатывали бензиловым спиртом (2,8 мл, 27,4 ммоль) и нагревали в течение дополнительных 3 часов при температуре флегмообразования. Реакционную смесь охлаждали, разбавляли этиловым эфиром (150 мл), осторожно промывали насыщенным NaHCO3 и соляным раствором, сушили (MgSO4) и концентрировали в вакууме с получением масла. Путем хроматографии (MPLC, элюция смесью 4:1 гексаны:этилацетат) получили указанное в заголовке соединение (2,0 г, 78,3%) в виде масла. MS М+1=467,1. 1Н ЯМР (400 МГц; CDCI3) 2R-(Бензилоксикарбониламинометил)-4R-метилгептановая кислота. Раствор бензилового эфира 4R-метил-2R-(4S-метил-2-оксо-5R-фенилоксазолидин-3-карбонил)гептил]карбаминовой кислоты (4,12 г, 8,83 ммоль) в смеси 3:1 ТГФ:вода (100 мл) охлаждали до 0°С и обрабатывали смесью 0,8 н. LiOH (17,5 мл, 14 ммоль) и 30% Н2О2 (4,94 мл, 44 ммоль). Затем реакционную смесь перемешивали на холоде 3 часа, гасили суспензией NaHSO3 (2,37 г) и Na2SO3 (4,53 г) в воде (30 мл) и перемешивали 1 час. Реакционную смесь разбавляли этиловым эфиром (200 мл), распределяли и органический слой промывали соляным раствором и сушили (MgSO4). Концентрированный органический экстракт хроматографировали (MPLC), элюируя этилацетатом с получением 1,25 г 2R (бензилоксикарбониламинометил)-4R-метилгептановой кислоты (46%). MS M+1=308,1. 1H ЯМР (400 МГц; CDCl3) Гидрохлорид (2R,4R)-2-амино-4-метил-гептановой кислоты. Смесь 2R-(бензилоксикарбониламинометил)-4R-метил-гептановой кислоты (1,25 г, 4,07 ммоль) и Pd/C (20%, 0,11 г) в метаноле (50 мл) гидрировали при 50 фунт./кв. дюйм (345 кПа) в течение 18 часов. Затем катализатор удаляли путем фильтрования, растворитель удаляли в вакууме и полученное в результате твердое вещество растирали в эфире с получением гидрохлорида (2S,4R)-2-амино-4-метил-гептановой кислоты (0,28 г, 40%), т.пл. 226,3-228,0°С. MS M+1=174,0. 1H ЯМР (400 МГц; CD3OD) Пример 5. Гидрохлорид 2-аминометил-4,4-диметил-гептановой кислоты Этиловый эфир 2-циано-4,4-диметил-гепта-2,6-диеновой кислоты. Раствор 2,2-диметил-пент-4-еналя (5,0 г, 44 ммоль), этилового эфира цианоуксусной кислоты (5,12 мл, 48 ммоль), пиперидина (1,3 мл, 14 ммоль) и уксусной кислоты (4,52 мл, 80 ммоль) в 170 мл толуола кипятили с обратным холодильником в течение 18 часов в колбе, оборудованной сепаратором Дина-Старка. Несколько мл воды собирали в ловушку. Реакционную смесь охлаждали и промывали последовательно 1 н. HCI, NaHCO3 и соляным раствором. Органические слои сушили над Na2SO4 и концентрировали с получением масла. Это масло хроматографировали, элюируя 20% EtOAc в гексане с получением двух объединенных партий в сумме 8,3 г (91%). 1H ЯМР (400 МГц; CDCl3) Гидрохлорид 2-аминометил-4,4-диметил-гептановой кислоты. Этиловый эфир 2-циано-4,4-диметил-гепта-2,6-диеновой кислоты (5,88 г, 28 ммоль) растворяли в смеси 91 мл этанола и 6 мл HCl и обрабатывали 0,4 г PtO2. Это взаимодействие осуществляли под давлением водорода 100 фунт/кв.дюйм (689,5 кПа) при комнатной температуре в течение 15 часов. Катализатор отфильтровывали и фильтрат концентрировали с получением 3,8 г желаемого продукта этилового эфира 2-аминометил-4,4-диметил-гептановой кислоты в виде масла. MS (APCI): 216,2 (М+1)+. Это масло кипятили с обратным холодильником в 75 мл 6 н. HCI в течение 18 часов. Пока реакционную смесь охлаждали, образовывался осадок. Твердое вещество отфильтровывали, промывали дополнительным количеством раствора HCI и растирали с эфиром с получением чистого указанного в заголовке соединения. MS (APCI): 188,1 (М+1)+. 186,1 (М-1)+. 1H ЯМР (400 МГц; CD3OD) Пример 6. (S)-3-Амино-5,5-диметил-октановая кислота 3-(4,4-Диметил-гептаноил)-(R)-4-метил-(S)-5-фенил-оксазолидин-2-он. Раствор 4,4-диметил-гептановой кислоты (1,58 г, 10 ммоль) и триэтиламина (4,6 мл) в 50 мл ТГФ охлаждали до 0°С и обрабатывали 2,2-диметил-пропионилхлоридом (1,36 мл). Через один час добавляли 4R-метил-фенил-оксазолидин-2-он (1,95 г, 11 ммоль) и хлорид лития (0,47 г, 11 ммоль) и эту смесь перемешивали в течение 18 часов. Осадок отфильтровывали и тщательно промывали дополнительным количеством ТГФ. Фильтрат концентрировали в вакууме с получением маслянистого твердого вещества. Это твердое вещество растворяли в 200 мл Et2O, промывали последовательно насыщенным NaHCO3, 0,5 н. HCl и насыщенным NaCl, сушили (MgSO4) и концентрировали в вакууме с получением указанного в заголовке соединения в виде масла (3,0 г, 95%). 1H ЯМР (400 МГц; CDCl3) трет-Бутиловый эфир 5,5-диметил-(S)-3-((R)-метил-2-оксо-(S)-5-фенил-оксазолидин-3-карбонил)-октановой кислоты. В соответствии с примером 1, из 5,07 г (16 ммоль) 3-(4,4-диметил-гептаноил)-4-метил-5-фенил-оксазолидин-2-она, 18 мл (1 н., 18 ммоль) раствора гексаметилдисилазана натрия (NaHMDS) и 4,72 мл (32 ммоль) трет-бутилового эфира бромуксусной кислоты получили 3,40 г (49,3%) указанного в заголовке соединения в виде кристаллического твердого вещества. 1Н ЯМР (400 МГц; CDCl3) 4-трет-Бутиловый эфир (S)-2-(2,2-диметил-пентил)-янтарной кислоты. В соответствии с примером 1 из 3,4 г (7,9 ммоль) трет-бутилового эфира 5,5-диметил-3-(4-метил-2-оксо-5-фенил-оксазолидин-3-карбонил)-октановой кислоты, 16 мл (12,8 ммоль) 0,8 н. LiOH и 4,5 мл 30% Н2O2 получили 2,42 г (>100%) указанного в заголовке соединения в виде масла. 1H ЯМР (400 МГц; CDCl3) трет-Бутиловый эфир (S)-3-бензилоксикарбониламино-5,5-диметил-октановой кислоты. В соответствии с примером 1, из 2,14 г (7,9 ммоль) 4-трет-бутилового эфира 2-(2,2-диметил-пентил)-янтарной кислоты, 1,7 мл DPPA, 1,1 мл Et3N и 2,44 мл BnOH получили 1,63 г (54,8% за две стадии) указанного в заголовке соединения в виде масла. 1H ЯМР (400 МГц; CDCl3) трет-Бутиловый эфир (S)-3-амино-5,5-диметил-октановой кислоты. В соответствии с примером 1 из 1,63 г трет-бутилового эфира 3-бензилоксикарбониламино-5,5-диметил-октановой кислоты и 0,2 г 20% Pd/C получили указанное в заголовке соединение. 1H ЯМР (400 МГц; CDCl3) Гидрохлорид (S)-3-амино-5,5-диметил-октановой кислоты. В соответствии с примером 1 трет-бутиловый эфир 3-амино-5,5-диметил-октановой кислоты обрабатывали 3 н. HCl с получением 286 мг указанного в заголовке соединения в виде твердого вещества. 1H ЯМР (400 МГц; CD3OD) Пример 7. 2-Аминометил-3-(1-метил-циклопропил)-пропионовая кислота Этиловый эфир 2-циано-3-(1-метил-циклопропил)-акриловой кислоты. К 1-метилциклопропан-метанолу (Aldrich, 1,13 мл, 11,6 ммоль) в 50 мл CH2Cl2 добавляли нейтральный алюминий (2,5 г) и затем хлорохромат пиридиния (РСС) (2,5 г, 11,6 ммоль) и эту смесь перемешивали 3 часа при температуре окружающей среды. Смесь фильтровали через слой 1 см набивки силикагеля под вакуумом и промывали Et2O. Фильтрат концентрировали до приблизительно 5 мл общего объема. К остатку добавляли ТГФ (10 мл), этилцианоацетат (1,2 мл, 11,3 ммоль), пиперидин (5 капель) и наконец уксусную кислоту (5 капель). Всю смесь перемешивали при температуре окружающей среды в течение ночи, затем распределяли между Et2O и насыщ. водн. NaHCO3. Фазы разделяли и органическую фазу промывали соляным раствором, сушили (MgSO4) и концентрировали. Флэш-хроматография остатка (10 Этиловый эфир 2-аминометил-3-(1-метил-циклопропил)-пропионовой кислоты. К этиловому эфиру 2-циано-3-(1-метил-циклопропил)-акриловой кислоты (0,45 г, 2,51 ммоль) в 16 мл EtOH:ТГФ (1:1) добавляли RaNi (0,4 г) и эту смесь гидрировали в шейкере Парра (Parr) при давлении 48 фунт/кв.дюйм (331 кПа) в течение 15,5 часов. Затем добавляли катализатор Перлмана (Pearlman) (0,5 г) и гидрирование продолжали в течение дополнительных 15 часов. Эту смесь фильтровали и концентрировали. Флэш-хроматография остатка 2 2-Аминометил-3-(1-метил-циклопропил)-пропионовая кислота. К раствору этилового эфира 2-аминометил-3-(1-метил-циклопропил)-пропионовой кислоты (0,25 г, 1,35 ммоль) в 10 мл метанола при 0°С добавляли 10% водн. NaOH (10 мл). Эту смесь перемешивали при температуре окружающей среды в течение ночи, затем концентрировали с удалением метанола. Остаток охлаждали до 0°С и подкисляли до рН 2 концентрированной HCI. После того как эту смесь оставили нагреваться до температуры окружающей среды, ее загружали на колонку с ионообменной смолой DOWEX-50WX8-100 и элюировали водой (Н2О) до нейтральной реакции по лакмусовой бумаге. Элюцию продолжали 5%-ным водн. NH4OH (100 мл) и щелочные фракции концентрировали с получением 0,15 г (71%) указанной аминокислоты в виде бесцветного твердого вещества. 1H ЯМР (CDCl3) Пример 8. (3S,5R)-3-Амино-5-метил-октановая кислота трет-Бутиловый эфир (5S)-5-метил-окта-2,6-диеновой кислоты. К раствору этилового эфира (S)-3-метил-гекс-4-еновой кислоты (1,0 г, 6,4 ммоль) в 30 мл толуола при -78°С добавляли по каплям в течение 5 минут гидрид диизобутилалюминия (DIBAH) (1,0 М в ТГФ, 6,4 мл). Эту смесь перемешивали при -78°С 45 минут, в то же время добавляя 5 капель метанола, что приводило в результате к энергичному выделению H2. Метанол добавляли до тех пор, пока не наблюдали, что газ больше не выделяется (приблизительно 5 мл). В этот момент охлаждающую баню удаляли и добавляли приблизительно 5 мл насыщ. водн. Na+K+ тартрата. Когда температура смеси достигла комнатной, добавляли дополнительное количество насыщ. водн. Na+K+ тартрата и Et2O и перемешивание продолжали до тех пор, пока фазы не становились почти прозрачными (приблизительно 1 час). Эти фазы разделяли и органическую фазу промывали соляным раствором, сушили (MgSO4) и концентрировали до приблизительно 10 мл общего объема вследствие летучести. Неочищенную смесь объединяли с дополнительной порцией альдегида, полученного из 10 ммоль указанного эфира способом, описанным выше, и всю смесь использовали без очистки. К суспензии гидрида натрия (60%-ная дисперсия в минеральном масле) в 25 мл ТГФ добавляли трет-бутил-Р,Р-диметилфосфоноацетат (3,0 мл, 15 ммоль) по каплям в течение 1 часа, так чтобы контролировать выделение Н2. После завершения добавления быстро по каплям добавляли неочищенный альдегид в толуоле (приблизительно 20 мл общего объема) и эту смесь перемешивали при температуре окружающей среды в течение ночи. Смесь распределяли между Et2O и насыщ. водн. NH4Cl, фазы разделяли, органическую фазу промывали соляным раствором, сушили (MgSO4) и концентрировали. Флэш-хроматография остатка (0 *Этиловый эфир (S)-3-метил-гекс-4-еновой кислоты получали из (S)-транс-3-пентен-2-ола [Liang, J.; Hoard, D. W.; Van Khau, V.; Martinelli, M.J.; Moher, E.D.; Moore, R.E.; Tius, M.A.J. Org. Chem., 1999, 64, 1459] посредством перегруппировки Джонса-Клайзена (Johnson-Claisen) с использованием триэтилортоацетата в соответствии с методикой, описанной в литературе [Hill, R.К.; Soman, R.; Sawada, S., J. Org. Chem., 1972, 37, 3737]. трет-Бутиловый эфир (3R,5S)-3-[бензил-(1-фенил-этил)-амино]-5-метил-окт-6-еновой кислоты. К раствору (S)-(-)-N-бензил- (3S,5R)-3-Амино-5-метил-октановая кислота. К раствору трет-бутилового эфира (3R,5S)-3-[бензил-(1-фенил-этил)-амино]-5-метил-окт-6-еновой кислоты (0,92 г, 2,18 ммоль) в 50 мл МеОН добавляли 20% Pd/C (0,20 г), и эту смесь гидрировали в шейкере Парра при давлении 48 фунт/кв.дюйм (331 кПа) в течение 23 часов. Смесь фильтровали и концентрировали. К неочищенному аминоэфиру в 10 мл CH2CI2 добавляли 1,0 мл трифторуксусной кислоты и этот раствор перемешивали при температуре окружающей среды в течение ночи. Смесь концентрировали и остаток растворяли в минимальном количестве Н2O и загружали на колонку с ионообменной смолой DOWEX-50WX8-100. Колонку элюировали Н2O до нейтрального рН по лакмусовой бумаге, затем элюцию продолжали 5% водн. NH4OH (100 мл). Щелочные фракции концентрировали с получением 0,25 г (66%, две стадии) указанной аминокислоты в виде беловатого твердого вещества. 1H ЯМР (CD3OD) Пример 9. 2-Аминометил-8-метил-нонановая кислота Использовали методику, аналогичную методике получения 2-аминометил-4,4,8-триметил-нонановой кислоты, с получением 2-аминометил-8-метил-нонановой кислоты из 6-метил-1-гептанола, m/z 202,1 (М+). 2-Аминометил-4,8-диметил-нонановая кислота (R)-2,6-диметил-гептан-1-ол. Магниевую стружку (2,04 г, 84 ммоль) и кристаллы иода суспендировали в 5 мл ТГФ для добавления 1-бром-3-метилбутана (0,3 мл, чистого). Эту смесь нагревали для начала образования по Гриньяру. Оставшийся 1-бром-3-метилбутан (8,63 мл, 72 ммоль) разбавляли в ТГФ (60 мл) и добавляли по каплям. Эту смесь перемешивали при температуре окружающей среды в течение 2 часов и охлаждали до -5°С. Раствор хлорида меди (1,21 г, 9 ммоль) и LiCI (0,76 г, 18 ммоль) в ТГФ (50 мл) добавляли по каплям, поддерживая температуру ниже 0°С. Полученную в результате смесь перемешивали в течение 20 минут и добавляли по каплям (R)-3-бром-2-метилпропанол в ТГФ (20 мл), в то же время поддерживая температуру ниже 0°С. Эту смесь оставляли медленно достигать температуры окружающей среды в течение ночи. Реакционную смесь гасили гидроксидом аммония и водой. Эту смесь разбавляли EtOAc и экстрагировали 3×20 мл EtOAc. Органическую фазу промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали. Оставшееся масло очищали посредством хроматографии на силикагеле (90/10 гексан/EtOAc) с получением 2,67 г (R)-2,6-диметилгептан-1-ола. (R)-1-Иод-2,6-диметилгептан. К смеси трифенилфосфина на подложке (6,55 г, 19,67 ммоль) в CH2Cl2 при 0°С добавляли иод (4,99 г, 19,67 ммоль) и имидазол (1,33 г, 19,67 ммоль). Эту смесь нагревали до температуры окружающей среды, перемешивали в течение 1 часа и охлаждали до 0°С для добавления по каплям (R)-2,6-диметилгептан-1-ола в СН2Cl2 (5 мл). Смесь оставляли достигать температуры окружающей среды и перемешивали в течение 1 часа, во время которого ее фильтровали через набивку целита и твердые вещества промывали CH2Cl2. Фильтрат концентрировали и неочищенный продукт очищали посредством хроматографии на силикагеле с получением (R)-1-иод-2,6-диметилгептана (2,44 г). трет-Бутиловый эфир (4R)-4,8-диметилнонановой кислоты. К диизопропиламину (0,827 мл, 5,9 ммоль) в ТГФ (8 мл) при -78°С добавляли nBuLi (2,65 мл 2,6 М раствора в пентане). Этот раствор перемешивали в течение 30 минут при -78°С, а затем добавляли трет-бутилацетат (0,8 мл, 5,9 ммоль). Смесь перемешивали при -78°С в течение 2 часов и затем добавляли (R)-1-иод-2,6-диметилгептан (0,3 г, 1,18 ммоль) и гексаметилфосфорамид (НМРА) (1,5 мл) в ТГФ (1 мл). Реакционную смесь перемешивали при -78°С и оставляли медленно достигать температуры окружающей среды в течение ночи, затем нагревали при 35°С, чтобы реакция прошла полностью. Реакцию останавливали путем добавления хлорида аммония (насыщенного водного раствора) и эту смесь экстрагировали EtOAc (2×10 мл). Органические фазы объединяли, промывали водой, сушили (MgSO4), фильтровали и концентрировали. Хроматография на силикагеле (98/2 гексан/EtOAc) давала 0,25 г трет-бутилового эфира (4R)-4,8-диметилнонановой кислоты. (4R)-4,8-диметилнонановая кислота. трет-Бутиловый эфир (4R)-4,8-диметилнонановой кислоты в 25 мл CH2Cl2 при 0°С обрабатывали ТФУ (6 мл). Эту смесь оставляли достигать температуры окружающей среды и перемешивали в течение ночи. Растворитель удаляли посредством выпаривания на роторном испарителе и эту смесь очищали путем хроматографии на силикагеле (95/5 гексан/EtOAc) с получением 0,962 г (4R)-4,8-диметилнонановой кислоты, m/z 185 (М-). 3-(4R,8-Диметил-нонаноил)-4(S)-метил-5(R)-фенил-оксазолидин-2-он. Использовали методику, аналогичную получению (4R,5S)-4-метил-3-(R)-4-метил-гептаноил)-5-оксазолидин-2-она, с получением 3-(4R,8-диметил-нонаноил)-4(S)-метил-5(R)-фенил-оксазолидин-2-она (1,35 г), m/z 346,5 (М+). Бензиловый эфир [4R,8-диметил-2R-(4R-метил-2-оксо-5R-фенил-оксазолидин-3-карбонил)-нонил]-карбаминовой кислоты. К раствору 3-(4(R),8-диметил-нонаноил)-4(S)-метил-5(R)-фенил-оксазолидин-2-она (1,05 г, 3,04 ммоль) в CH2Cl2 (12 мл) и TiCl4 (3,04 мл 1 М раствора в CH2CI2) добавляли диизопропилэтиламин (0,55 мл, 3,19 ммоль) при -20°С. Полученный в результате темно-красный раствор перемешивали при -20°С в течение 30 минут перед добавлением раствора N-метоксиметилбензилкарбамата (0,652 г, 3,34 ммоль) в CH2Cl2(3,5 мл) и TiCl4 (3,34 мл). Эту смесь перемешивали при 0°С в течение 4 часов. Реакцию останавливали путем добавления насыщенного водного раствора хлорида аммония. Эту смесь экстрагировали CH2Cl2 (3×15 мл). Органические фазы объединяли, промывали 1 н. HCl и нейтрализовали NaOH, а затем промывали соляным раствором. Органические вещества сушили (MgSO4), фильтровали, концентрировали и очищали путем хроматографии на силикагеле (95/5 гексан/EtOAc) с получением 0,555 г бензилового эфира [4R,8-диметил-2R-(4R-метил-2-оксо-5R-фенил-оксазолидин-3-карбонил)-нонил]-карбаминовой кислоты. 2(R)-(Бензилоксикарбониламинометил)-4(R),8-диметил-нонановая кислота. Использовали методику, аналогичную получению трет-бутилового эфира (S)-2-((R)-2-метил-пентил)-янтарной кислоты, с получением 0,198 г 2(R)-(бензилоксикарбониламинометил)-4(R),8-диметил-нонановой кислоты. 2-Аминометил-4,8-диметилнонановая кислота. 2(R)-(Бензилоксикарбониламино-метил)-4(R),8-диметил-нонановую кислоту (0,148 г, 0,566 ммоль) обрабатывали водородом в присутствии 20% Pd/C с получением 0,082 г 2-аминометил-4,8-диметилнонановой кислоты после фильтрования и очистки путем хроматографии на силикагеле (85/15 CH2Cl2/MeOH). m/z 216,3 (M+). Пример 10. 2-Аминометил-4,4,8-триметил-нонановая кислота Метиловый эфир 2,2,6-триметил-гептановой кислоты. К диизопропиламину (1,54 мл, 11,03 ммоль) в ТГФ (22 мл) при -78°С добавляли nBuLi (6,89 мл 1,6 М раствора в гексане). Этот раствор перемешивали в течение 30 минут при -78°С с последующим добавлением метилизобутирата (0,97 мл, 8,48 ммоль). Эту смесь перемешивали при -78°С в течение 2 часов и затем добавляли 1-иод-4-метилпентан (1,8 г, 8,48 ммоль) и 1,3-диметил-3,4,5,6-тетрагидро-2(1H)-пиримидинон (DMPU) (0,55 мл, 4,24 ммоль) в ТГФ (6 мл). Реакционную смесь перемешивали при -78°С и оставляли медленно достигать температуры окружающей среды в течение 16 часов. Реакцию останавливали путем добавления хлорида аммония (насыщенного водного раствора) и смесь экстрагировали EtOAc (2×10 мл). Органические фазы объединяли, промывали водой, сушили (MgSO4), фильтровали и концентрировали. Хроматография на силикагеле (99/1 гексан/EtOAc) давала 1,57 г метилового эфира 2,2,6-триметил-гептановой кислоты. 2,2,6-Триметил-гептан-1-ол. Метиловый эфир 2,2,6-триметил-гептановой кислоты (1,97 г, 10,6 ммоль) переносили в толуол (65 мл) и охлаждали до -78°С. Добавляли по каплям гидрид диизобутилалюминия (DiBALH) (12,7 мл 1 н. раствор в толуоле). Через 45 минут добавляли 1,5 мл DiBALH. Через 2 часа реакцию останавливали путем добавления 15 мл МеОН при -78°С. Смесь нагревали до температуры окружающей среды и затем охлаждали снова до -78°С для добавления 10 мл 1 н. HCl. Эту смесь экстрагировали EtOAc (3×15 мл). Объединенные органические фазы промывали соляным раствором, сушили (MgSO4), фильтровали и концентрировали. Оставшееся масло очищали посредством хроматографии на силикагеле (95/5 гексан/EtOAc) с получением 2,2,6-триметил-гептан-1-ола (0,88 г), m/z 159 (М+). 2,2,6-Триметил-гептаналь. Хлорохромат пиридиния (РСС, 4,17 г, 19,4 ммоль) объединяли с нейтральным алюминием (14,6 г) в CH2Cl2 и перемешивали при температуре окружающей среды в течение 15 минут. Спирт разбавляли в СН2Cl2 и эту смесь перемешивали при температуре окружающей среды в течение 2 часов. Этот раствор фильтровали через набивку диоксида кремния и твердые вещества промывали СН2Cl2. Фильтрат упаривали с получением 1,05 г, m/z 157 (М+), 2,2,6-триметил-гептаналя, который использовали без дополнительной очистки. Бензиловый эфир 2-циано-4,4,8-триметил-нон-2-еновой кислоты. К смеси 2,2,6-триметил-гептаналя (1,05 г, 6,73 ммоль), пиперидина (0,19 мл, 2,01 ммоль) и бензилцианоацетата (1,29 г, 7,4 ммоль) в толуоле (50 мл) добавляли ледяную уксусную кислоту (0,72 г, 12,1 ммоль). Колбу оснащали ловушкой Дина-Старка и смесь нагревали при флегмообразовании в течение 18 часов. Смесь охлаждали, обрабатывали разбавленной HCl и слои разделяли. Органические фазы промывали насыщенным раствором бикарбоната натрия, а затем соляным раствором и сушили (MgSO4), фильтровали и концентрировали. Оставшееся масло очищали путем хроматографии на силикагеле (98/2 гексан/EtOAc) с получением 1,3 г бензилового эфира 2-циано-4,4,8-триметил-нон-2-еновой кислоты, m/z 314 (М+). 2-Аминометил-4,4,8-триметил-нонановая кислота. Бензиловый эфир 2-циано-4,4,8-триметил-нон-2-еновой кислоты (1,3 г, 4,14 ммоль) в ТГФ (50 мл) обрабатывали водородом в присутствии 20% Pd/C с получением смеси цианокислоты и цианометилового эфира. Эту смесь очищали путем хроматографии на силикагеле с получением 278 мг 80105×41-1-2. Эту кислоту затем обрабатывали водородом в присутствии Ni Рэнея в МеОН/NH4OH с получением 0,16 г 2-аминометил-4,4,8-триметил-нонановой кислоты, m/z 230,3 (М+). Пример 11. 2-Аминометил-4-этил-октановая кислота Использовали методику, аналогичную получению 2-аминометил-4,4,8-триметил-нонановой кислоты, с получением 2-аминометил-4-этил-октановой кислоты из 2-этилгексаналя. m/z 202,1 (М+). Пример 12. 2-Аминометил-4-этил-8-метил-нонановая кислота Использовали методику, аналогичную получению 2-аминометил-4,4,8-триметил-нонановой кислоты, с получением 2-аминометил-8-метил-нонановой кислоты из 2,6-ди-трет-бутил-4-метилфенилциклопропилкарбоксилата. m/z 230,2 (М+). Пример 13. 3-Амино-2-[1-(4-метил-пентил)-циклопропилметил]-пропионовая кислота Использовали методику, аналогичную получению 2-аминометил-4,4,8-триметил-нонановой кислоты, с получением 2-аминометил-8-метил-нонановой кислоты из 2,6-ди-трет-бутил-4-метилфенилциклопропилкарбоксилата. m/z 228,2 (М+). Пример 14. 2-Аминометил-4-этил-гексановая кислота Использовали методику, аналогичную получению 2-аминометил-4,8-диметил-нонановой кислоты, с получением 2-аминометил-4-этил-гексановой кислоты из 4-этилгексановой кислоты, m/z 174,1. Пример 15. 3(S)-Амино-3,5-диметил-гептановая кислота (1,3-Диметил-пентилиден)-амид 2-метил-пропан-2(S)-сульфиновой кислоты. Раствор (S)-(-)-2-метил-2-пропансульфонамида (500 мг, 4,1 ммоль), 4-метил-2-гексанона (470 мг, 4,1 ммоль) и этоксида титана (IV) (1,7 мл, 8,3 ммоль) нагревали при флегмообразовании в течение 18 часов. Реакционную смесь вливали в 20 мл соляного раствора при интенсивном перемешивании. Полученный в результате раствор фильтровали через целит и органический слой отделяли. Водный слой экстрагировали этилацетатом (2×20 мл). Объединенные органические фазы сушили (Na2SO4), фильтровали и концентрировали. Полученное в результате масло очищали путем хроматографии на силикагеле (25% EtOAc в гексане) с получением 575 мг (1,3-диметил-пентилиден)-амида 2-метил-пропан-2(S)-сульфиновой кислоты в виде желтого масла. Метиловый эфир 3,5-диметил-3-(2-метил-пропан-2(S)-сульфиниламино)-гептановой кислоты. К охлажденному до -78°С раствору бис(триметилсилил)амида лития (5,1 мл 1 М раствора в ТГФ) в ТГФ (6 мл) добавляли по каплям метилацетат ((0,41 мл, 5,1 ммоль). После перемешивания в течение 20 минут добавляли по каплям раствор триизопропоксида хлортитана (2,5 мл, 10 ммоль) в ТГФ (3 мл). Через 1 час добавляли по каплям при -78°С (1,3-диметил-пентилиден)-амид 2-метил-пропан-2(S)-сульфиновой кислоты (560 мг, 2,6 ммоль) в ТГФ (3 мл). Реакционную смесь перемешивали при -78°С в течение 5 часов, затем гасили путем добавления 10 мл раствора хлорида аммония и нагревали до комнатной температуры. Эту смесь разбавляли 10 мл воды и фильтровали. Водный слой экстрагировали этилацетатом (2×20 мл). Объединенные органические фазы промывали соляным раствором, сушили (Na2SO4), фильтровали и концентрировали. Полученное в результате масло очищали путем хроматографии на силикагеле (30% EtOAc в гексане) с получением 360 мг метилового эфира 3,5-диметил-3-(2-метил-пропан-2(S)-сульфиниламино)-гептановой кислоты. 3(S)-Амино-3,5-диметил-гептановая кислота. Метиловый эфир 3,5-диметил-3-(2-метил-пропан-2(S)-сульфиниламино)-гептановой кислоты (360 мг, 1,2 ммоль) растворяли в 6 н. HCl (2 мл) и диоксане (2 мл) и нагревали при 100°С в течение 6 часов. Эту смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали EtOAc (15 мл). Органические фазы очищали путем ионообменной хроматографии с получением 3(S)-амино-3,5-диметил-гептановой кислоты (270 мг) и затем повторно очищали путем хроматографии на силикагеле (70:25:5 CH2Cl2/MeOH/NH4OH) с получением 203 мг 3(S)-амино-3,5-диметил-гептановой кислоты в виде белого твердого вещества. m/z 174 (C9H19NO2+H). Пример 16. 3(S)-Амино-3,5-диметил-нонановая кислота Использовали методику, аналогичную получению 3(S)-амино-3,5-диметил-гептановой кислоты, с получением 3(S)-амино-3,5-диметил-нонановой кислоты, m/z 202,1 (C11H23NO2+H). Пример 17. 3(S)-Амино-3,5-диметил-октановая кислота Использовали методику, аналогичную получению 3(S)-амино-3,5-диметил-гептановой кислоты, с получением 3(S)-амино-3,5-диметил-нонановой кислоты, m/z 188,1 (C10H21NO2+H).
Формула изобретения
1. Способ связывания с альфа-2-дельта-субъединицей кальциевого канала, включающий введение млекопитающему терапевтически эффективного количества соединения формулы I
где R1 представляет собой водород или (С1-С6)алкил; R2 представляет собой (С1-С6)алкил; R3 представляет собой (С1-С6)алкил; R4 представляет собой водород; R5 представляет собой водород; и R6 представляет собой водород или (С1-С6)алкил; или фармацевтически приемлемой соли такого соединения. 2. Способ по п.1, где связывание с альфа-2-дельта-субъединицей кальциевого канала используется для лечения заболеваний, таких как эпилепсия, постгерпетическая невралгия, хроническая головная боль, боль в нижней части спины, боль в результате хирургического вмешательства, повреждения хрящей. 3. Способ по п.1, где соединение имеет формулу IA
где R1 представляет собой водород или (С1-С3)алкил; R2 представляет собой (С1-С3)алкил; и R3 представляет собой (С1-С2)алкил; или является фармацевтически приемлемой солью такого соединения. 4. Способ по п.3, где соединение имеет формулу IA-1
где R3 представляет собой (С1-С6)алкил; или является фармацевтически приемлемой солью такого соединения. 5. Способ по п.3, где соединение имеет формулу IA-2
где R1 представляет собой водород или (С1-С3)алкил; R2 представляет собой (С1-С3)алкил; и R3 представляет собой (С1-С6)алкил; или является фармацевтически приемлемой солью такого соединения.
|
||||||||||||||||||||||||||

 -аминокислотам, а именно к способу связывания с альфа-2-дельта-субъединицей кальциевого канала, включающий введение млекопитающему терапевтически эффективного количества соединения формулы I. Эти соединения и их фармацевтически приемлемые соли являются полезными и могут использоваться для лечения заболеваний, таких как эпилепсия, постгерпетическая невралгия, хроническая головная боль, боль в нижней части спины, боль в результате хирургического вмешательства, повреждения хрящей. 4 з.п. ф-лы.
-аминокислотам, а именно к способу связывания с альфа-2-дельта-субъединицей кальциевого канала, включающий введение млекопитающему терапевтически эффективного количества соединения формулы I. Эти соединения и их фармацевтически приемлемые соли являются полезными и могут использоваться для лечения заболеваний, таких как эпилепсия, постгерпетическая невралгия, хроническая головная боль, боль в нижней части спины, боль в результате хирургического вмешательства, повреждения хрящей. 4 з.п. ф-лы.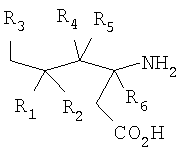
 2
2 )-субъединицей кальциевого канала. Эти соединения и их фармацевтически приемлемые соли являются полезными в лечении ряда психиатрических расстройств, боли и других расстройств.
)-субъединицей кальциевого канала. Эти соединения и их фармацевтически приемлемые соли являются полезными в лечении ряда психиатрических расстройств, боли и других расстройств.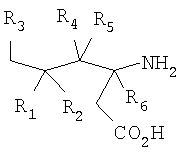
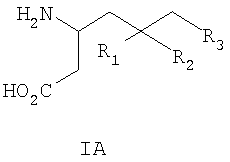
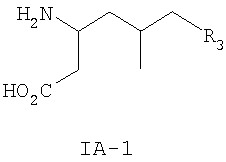
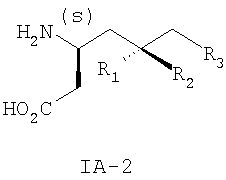
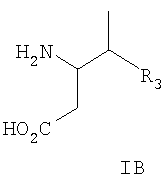
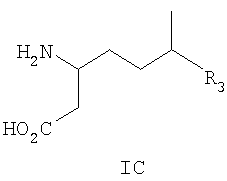
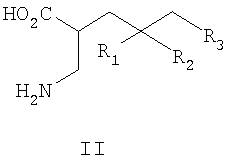
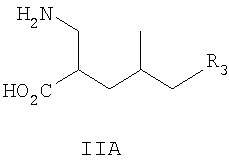
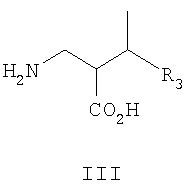
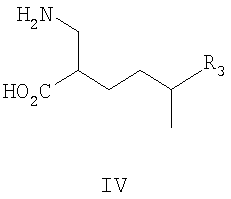

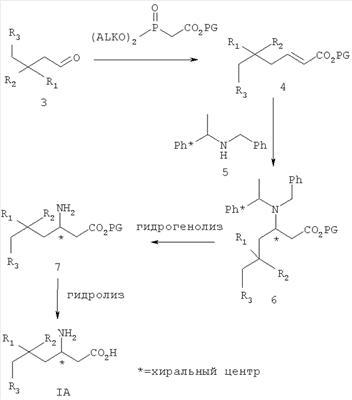
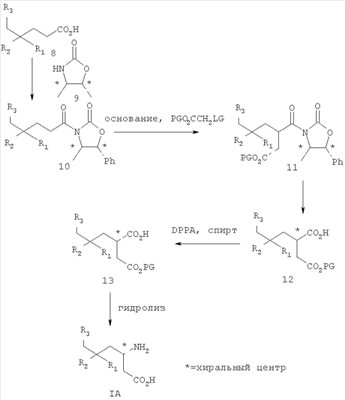
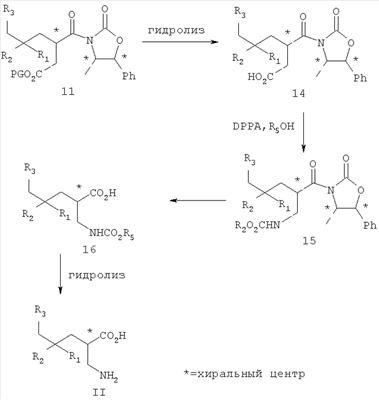
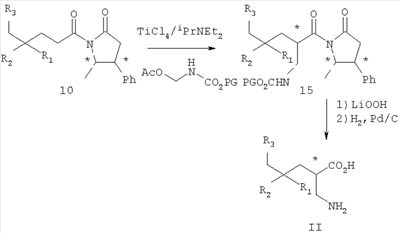
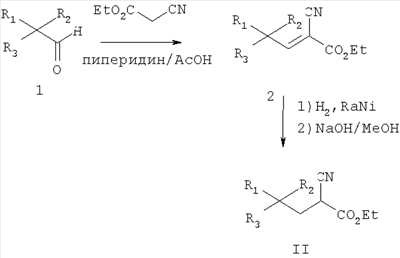
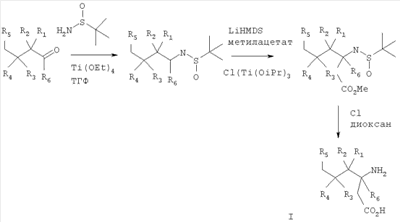
 М, (2R,4R)-2-аминометил-4-метил-гептановая кислота связывается с аффинностью 29 нМ, 2-аминометил-4,4-диметил-гептановая кислота связывается с аффинностью 83 нМ.
М, (2R,4R)-2-аминометил-4-метил-гептановая кислота связывается с аффинностью 29 нМ, 2-аминометил-4,4-диметил-гептановая кислота связывается с аффинностью 83 нМ. 15% ЕЮАс/гексаны) давала 0,53 г (25%) указанного эфира в виде бесцветного масла, которое кристаллизовалось при стоянии, т.пл. 35-37°С.1H ЯМР (CDCI3)
15% ЕЮАс/гексаны) давала 0,53 г (25%) указанного эфира в виде бесцветного масла, которое кристаллизовалось при стоянии, т.пл. 35-37°С.1H ЯМР (CDCI3)