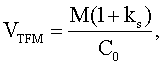Патент на изобретение №2343924
|
||||||||||||||||||||||||||
(54) АДГЕЗИВНЫЕ ПРОТИВООПУХОЛЕВЫЕ КОМПОЗИЦИИ
(57) Реферат:
Изобретение относится к химико-фармацевтической промышленности и касается противоопухолевой композиции, содержащей тауролидин, таурултам или их смесь в концентрации приблизительно 0,1-160 мг/мл в сочетании с биоразложимым адгезивом, включающим фибриновый герметик, обладающий способностью прилипать к ткани живого организма. Изобретение также касается способа обработки для предупреждения или ингибирования роста раковых клеток, заключающегося в нанесении противоопухолевой композиции на определенную область ткани живого организма после иссечения опухоли. Композиция наносится на ткань организма слоем толщиной от 0,1 до 10 мм. Заявленное изобретение позволяет с высокой степенью эффективности предотвращать повторное развитие опухоли после ее иссечения из тканей организма. 2 н. и 16 з.п. ф-лы.
Предпосылки создания изобретения Область техники, к которой относится изобретение Настоящее изобретение относится к противоопухолевым композициям и способам их применения. Описание существующего уровня техники Тауролидин (бис(1,1-диоксопергидро-1,2,4-тиадиазинил-4)метан) был разработан фирмой Geistlich Pharma. Он представляет собой белую кристаллическую субстанцию, обладающую слабой (до 2%) растворимостью в воде. Он состоит из двух молекул тауринамида и трех молекул формальдегида, которые образуют состоящую из двух колец структуру, соединенную мостиком, представляющим собой метиленовую группу. Тауролидин обладает прежде всего антибиотическим и антиэндотоксическим действием. Основой этого действия является химическая реакция, поэтому до сих пор не было обнаружено устойчивости микроорганизмов к нему. Это действие тауролидина опосредуется его активными метаболитами, которые являются донорами функционально активных метилоловых групп: метилол-тауритамом и метилол-тауринамидом. Функционально активные метилольные группы инактивируются при взаимодействии с оболочкой клетки бактерии и с первичными аминогруппами эндотоксинов. В предыдущие годы были описаны другие действия тауролидина: ингибирование TNF и IL-1-бета в мононуклеарных клетках (Bedrosian, 1991), ингибирование токсичности фактора некроза опухоли и ингибирование роста клеток перитонеальной опухоли при лапароскопической хирургической операции (Jacobi, 1997). Растворы тауролидина применяли в качестве растворов для закапывания или промывочных растворов для брюшной полости в случаях перитонита. При послеоперационном закапывании находящиеся в сознании пациенты сообщали о побочном действии, таком как раздражение и в некоторых случаях чувство жжения. Monson и др. в РСТ WO 92/00743 описали избирательное непосредственное ингибирующее действие тауролидина и/или таурултама на определенные типы опухолей (Monson JRT, Ramsey PS, Donohue JH. Preliminary evidence that taurolidine is anti-neoplastic as well as anti-endotoxin and anti-microbial. Реферат Br. J. Surg. 77(6) 1990, A711), на клетки меланомы линии В 16 и клетки саркомы линии Meth А в опытах in vivo на модели с использованием мышей и с использованием фибробластных опухолевых клетках в опытах in vitro на клетках карциномы ободочной кишки линии LS174T и клетках Jurkat (лейкоз) (Международная заявка на патент РСТ No. PCT/EP91/01269, опубликованная международная заявка на патент WO 92/00743 РСТ “Use of Taurolidine and/or Таурултам for the treatment of tumors”). При системной химиотерапии противоопухолевый агент неспецифически распределяется в организме с помощью системы кровообращения. При этом пролиферирующие клетки в здоровых органах подвергаются действию таких же концентраций агента, которые используются для опухолевых клеток. Кроме того, распределению агента внутри опухоли могут препятствовать различные гемодинамические факторы опухоли. Противоопухолевое действие большинства химиотерапевтических агентов зависит от различия в скорости пролиферации здоровых клеток и опухолевых клеток. Если эти скорости одинаковы, то могут возникать побочные действия, которые обусловливают ограничение дозы. Обычно предполагается, что эффективность химиотерапии возрастает при увеличении концентрации агента в опухоли и продолжительности его действия. С другой стороны, системное введение ограничивается серьезными побочными действиями. Один из подходов для решения указанной проблемы заключается в том, что химиотерапевтические агенты вводят местно и их распределение осуществляется путем диффузии. При местной терапии противоопухолевый агент вводят непосредственно в опухоль или в область, окружающую опухоль. Возникающий в результате этого градиент давления приводит к диффузии противоопухолевого агента в опухоль. Такой путь введения по сравнению с системным введением не только способствует повышению концентрации агента в опухоли, но также приводит к более низким концентрациям в других тканях. В системах местного введения лекарственных средств применяют различные материалы, такие как коллаген или биоразложимые полимеры или силиконы. Материалы служат в качестве матриц, с помощью которых заключенные в них цитостатические агенты местного действия, такие как BCNU, митоксантрон или цисплатин, вводят в полость, образующуюся после иссечения опухоли. Кроме того, силиконы применяли для местного введения противоопухолевых агентов. Потенциальные проблемы, связанные с такой формой введения лекарственного средства, могут возникать в том случае, когда матрица носителя содержит компоненты, которые полностью разлагаются только через очень большой промежуток времени или совсем не разлагаются. Другой риск представляет неконтролируемое распределение противоопухолевого агента в цереброспинальной жидкости (ЦСЖ), что, кроме того, затрудняет точное определение концентрации в мишени. Послеоперационные изменения формы и размера полости, образовавшейся после иссечения опухоли, которые связаны с образованием отека, могут препятствовать полному заполнению полости содержащими лекарственное средство носителями. В результате этого образуется неравномерное распределение лекарственного средства, которое может приводить к существенным локальным повышениям концентрации лекарственного средства, что может оказывать токсическое действие на соседнюю здоровую ткань. Другой подход для местного лечения опухоли представляет собой так называемое усиленное путем конвекции проникновение лекарственного средства (CEED), при котором лекарственное средство вводят путем инфузии в опухоль или окружающую ткань головного мозга. Лекарство распределяется путем конвективного транспорта. Однако такой путь введения в большинстве случаев требует применения катетера, что повышает риск возникновения инфекции и случаев образования послеоперационной ЦСЖ-фистулы. Кроме того, такой подход более пригоден для тех случаев, когда не производят иссечения опухолей. Его трудно применять после осуществления иссечения опухоли. Таким образом, в данной области сохраняется необходимость в разработке новых методов и композиций, предназначенных для лечения опухолей. Краткое изложение сущности изобретения В настоящем изобретении предложена противоопухолевая композиция. Противоопухолевая композиция содержит эффективное в отношении лечения опухоли количество агента-переносчика метилола (МТА) в сочетании с биоразложимым адгезивом, который обладает способностью прилипать к тканям живого организма. Подробное описание изобретения Было установлено, что агенты-переносчики метилола, такие как обладающее антибактериальным и антитоксическим действием лекарственное средство тауролидин и родственный ему продукт таурултам, оказывают модифицирующее действие на токсичность, обусловленную фактором некроза опухоли (TNF), который применяют среди прочего для лечения опухолей. Кроме того, было установлено, что агенты-переносчики метилола обладают избирательным действием, благодаря которому они не оказывают существенного ингибирующего влияния на рост здоровых линий клеток. Действие тауролидина заключается в том, что он переносит три метилольные группы в область-мишень, таурултам представляет собой промежуточный метаболит, который сам переносит одну метилольную группу, что сопровождается высвобождением обладающего очень хорошей переносимостью тауринамида и, наконец, таурина. Таурин представляет собой аминокислоту, которая присутствует в больших количествах в организме, прежде всего в сердце и головном мозге. Следует отметить, что перенос метилола отличается от переноса метила, который является характерным для многих обладающих высокой токсичностью противоопухолевых лекарственных средств. Тауролидин и таурултам обладают низкой токсичностью и не оказывают цитотоксического действия в отношении здоровых клеток. Способ осуществляют путем введения индивидууму, например больному раком млекопитающему, композиции, содержащей активное содержащее метилол соединение, в дозе, достаточной для того, чтобы индуцировать гибель опухолевых клеток путем апоптоза. Понятие “содержащее метилол соединение” или “агент-переносчик метилола” относится к соединению, которое содержит или из которого в физиологических условиях образуется молекула метилола. Содержащее метилол соединение отличается тем, что оно имеет группу R-N-СН2-ОН, где R обозначает алкил, арил или гетерогруппу. Объектом изобретения является также применение соединений, из которых могут образовываться или которые могут превращаться в соединение, имеющее R-N-СН2-ОН-структуру. Агенты-переносчики метилола включают содержащие метилол соединения, такие как тауролидин и таурултам, их производные и их органические или неорганические соли. Тауролидин и таурултам описаны в US 5210083. Другими содержащими метилол соединениями, которые можно применять согласно изобретению, являются производные таурина, производные тауринамида, производные мочевины, их органические или неорганические соли. Примеры производных тауролидина, таурултама, тауринамида и мочевины, которые можно применять согласно настоящему изобретению, описаны в WO 01/39763 А2. Наиболее предпочтительными агентами-переносчиками метилола для применения согласно настоящему изобретению являются тауролидин, таурултам, их биологически активные производные и смеси. В альтернативном варианте соединение представляет собой производное тауринамида или производное мочевины. Примеры производных тауролидина, таурултама, тауринамида и мочевины, которые можно применять согласно настоящему изобретению, описаны в WO 01/39763 А2. Понятие производное тауролидина или таурултама обозначает сульфонамидное соединение, которое обладает по меньшей мере 10% противоопухолевой активности тауролидина или таурултама соответственно. Сульфонамидное соединение представляет собой соединение формулы R2N-SO2R’. Представленные в настоящем описании производные этих соединений могут отличаться по своей структуре от исходного соединения, например тауролидина или таурултама, но предпочтительно они сохраняют по меньшей мере 50% биологической активности исходного соединения, например, в отношении индукции апоптоза клеток. Предпочтительно производное обладает по меньшей мере 75%, 85%, 95%, 99% или 100% биологической активности исходного соединения. В некоторых случаях биологическая активность производного может превосходить уровень активности исходного соединения. Производные могут обладать характеристиками или активностями, которыми не обладает исходное соединение. Например, производное может обладать пониженной токсичностью, более продолжительным клиническим временем полужизни или повышенной способностью проникать через гематоэнцефалический барьер. Типы рака, в отношении которых можно применять настоящее изобретение, включают возвратную глиобластому, глиому, нейробластому, астроцитому, карциноматозный менингит, рак яичника, рак предстательной железы, рак центральной нервной системы (ЦНС), рак легкого, рак желудка, рак пищевода, рак мочевого пузыря, лейкоз, мезотелиому, лимфому, меланому, рак клеток почек и метастазы. Другие типы рака, в отношении которых способ, предлагаемый в настоящем изобретение, обладает эффективностью, включают другие типы карцином, сарком или лимфом, рак головы и шеи, рак печени, рак молочной железы и рак поджелудочной железы. Особенно предпочтительные варианты осуществления изобретения относятся к лечению различных типов рака центральной нервной системы (ЦНС), а также ингибированию метастазов этих опухолей. В изобретении предложен способ лечения, предназначенный для предупреждения или ингибирования роста раковых клеток, заключающийся во введении противоопухолевой композиции в ткань живого индивидуума, нуждающегося в таком лечении. Противоопухолевая композиция содержит эффективное в отношении противоопухолевого действия количество агента-переносчика метилола (МТА) в сочетании с биоразложимым адгезивным средством, обладающим способностью прилипать к ткани живого индивидуума. В контексте настоящего описания понятие “биоразложимый” включает биоабсорбирующиеся или разрушающиеся адгезивные средства. В предпочтительных вариантах осуществления изобретения композиции, предлагаемые в изобретении, первоначально находятся в текучем или полутекучем состоянии, наиболее предпочтительно в жидком или полужидком состоянии. В предпочтительных вариантах осуществления изобретения композицию, предлагаемую в изобретении, вводят после по меньшей мере частичного удаления первичных и/или вторичных опухолей головного мозга или других опухолей центральной нервной системы (ЦНС). Другими предпочтительными применениями являются лечение опухолей кожи, опухолей в области рта/челюсти/лица, плоскоклеточной карциномы, опухолей мочеполовых органов, опухолей внешней части глаза и век, опухолей костной ткани, опухолей паренхиматозных органов и опухолей желудочно-кишечного тракта. В предпочтительных вариантах осуществления изобретения после по меньшей мере частичного удаления опухоли из определеной области ткани живого индивидуума композицию, предлагаемую в настоящем изобретении, наносят на указанную область ткани в виде слоя, предпочтительно путем распыления композиции или нанесения ее с помощью кисти на поверхность полости, образовавшейся после удаления опухоли. Как указано выше, предпочтительно композиция, предлагаемая в изобретении, первоначально в момент ее нанесения находится в жидком или полужидком состоянии и она прилипает к области ткани, из которой была удалена опухоль. В наиболее предпочтительных вариантах осуществления изобретения после нанесения вязкость адгезива повышается или он по меньшей мере частично отверждается при прилипании к ткани. Как указано выше, согласно одному из объектов изобретения композицию, предлагаемую в изобретении, наносят на определенную область в виде слоя путем распыления или с помощью кисти. Согласно одному из вариантов осуществления изобретения толщина слоя оставляет приблизительно 0,1-10 мм, предпочтительно приблизительно 1-5 мм, наиболее предпочтительно приблизительно 1,5-2,5 мм. В предпочтительных вариантах осуществления изобретения концентрация агента-переносчика метилола в композиции, предлагаемой в изобретении, составляет приблизительно 0,1-99 мас.%, более предпочтительно приблизительно 0,5-80 мас.%, еще более предпочтительно приблизительно 2-80 мас.% и еще более предпочтительно приблизительно 3-80 мас.%. В других вариантах осуществления изобретения концентрация МТА в композиции, предлагаемой в изобретении, составляет приблизительно 0,1-160 мг/мл, предпочтительно приблизительно 20-100 мг/мл и более предпочтительно приблизительно 50-80 мг/мл. В предпочтительных вариантах осуществления изобретения в качестве адгезива, применяемого согласно настоящему изобретению, используют матрицу из фибринового герметика (фибриновый клей). Фибриновый клей представляет собой двухкомпонентную систему, включающую хранящиеся по отдельности растворы фибриногена и тромбина/кальция. Когда два раствора объединяют, то процесс в образовавшейся смеси имитирует конечные стадии каскада свертывания, в результате чего образуется фибриновый сгусток. Компонент, представляющий собой фибриноген, можно получать без специальной подготовки из аутологичного одного и того же донора или из собранной крови. Фибриновый клей поступает в продажу в Европе под товарными знаками Beriplast, Tissel и Tissucol. Фибриновый клей широко используют при различных хирургических операциях для восстановления, герметического закрытия и приклеивания тканей в различных областях организма. В наиболее предпочтительных вариантах осуществления изобретения после нанесения слоя композиции, предлагаемой в изобретении, на область, подлежащую обработке, на этот слой наносят и герметически закрывают с помощью герметизующего второго слоя, который не содержит агента-переносчика метилола. Герметизующий второй слой может представлять собой тот же самый биоразложимый адгезив, который применяют в композиции, предлагаемой в изобретении, например фибриновую герметизующую матрицу. В других вариантах осуществления изобретения биоразложимый адгезив, применяемый в композиции, предлагаемой в изобретении, представляет собой гель (например, адгезивный коллагеновый гель), смесь гель/фибрин, порошок или т.п.Например, МТА можно капсулировать в адгезивные фибриновые частицы для непрерывного высвобождения МТА. В альтернативном варианте микрокапсулы, содержащие МТА, можно суспендировать в адгезиве. Для злокачественных глиом в большинстве случаев выявлена тенденция к рецидиву. Повторные глиомы могут образовываться из живых опухолевых клеток, присутствующих в зоне, окружающей область резекции опухоли. Повторные глиомы растут очень быстро и быстро приводят к смерти пациента. Настоящее изобретение позволяет сочетать резекцию опухоли и местную химиотерапию, осуществляемую с использованием противоопухолевого, но нетоксичного агента. Тауролидин обладает избирательным противоопухолевым действием благодаря тому, что он индуцирует запрограммированную гибель клеток и он обладает антиангиогенной активностью. Фибриновый герметик является полностью разложимым и прочно прилипает к ткани головного мозга, тем самым обеспечивая получение матрицы для введения тауролидина-тауролидин-матрица из фибринового герметика (ТФМ), при местном лечении опухолей головного мозга. Тауролидин или другие МТА можно гомогенно суспендировать как в тромбиновом, так и в прокоагулянтном протеиновом компонентах фибринового герметика. Матрица из фибринового герметика представляет собой пригодный носитель для суспензии тауролидина или других МТА в концентрациях, которые обеспечивают высвобождение in vitro терапевтически эффективных количеств лекарственного средства в течение периода времени до двух недель или более. На противоопухолевое действие тауролидина не оказывает влияние заключение его в матрицу из фибринового герметика. Систему введения лекарственного средства, предлагаемую в изобретении, можно применять в процессе хирургической операции для местного лечения опухолей головного мозга после полного или частичного их иссечения или опухолей, которые не поддаются иссечению вследствие их расположения. Злокачественные глиомы поражают окружающую ткань и вследствие этого в большинстве случаев имеют тенденцию к повторному возникновению даже после казалось бы полного иссечения. В 80-90% случаев глиомы повторно возникают в пределах 2 см от края области первоначального иссечения. Таким образом, повторно возникающие глиомы могут образовываться из живых опухолевых клеток, присутствующих в этой зоне, вокруг краев области, подвергнутой иссечению. Степень иссечения опухоли коррелирует с выживанием после операции. Кроме того, метастазы злокачественных глиом являются очень редкими и в основном расположены вне головного мозга. Согласно одному из вариантов осуществления изобретения полное или частичное иссечение опухоли сочетают с местной химиотерапией с использованием агента, обладающего избирательной противоопухолевой активностью и не повреждающего здоровую ткань головного мозга. Согласно еще одному варианту осуществления изобретения способ введения лекарственного средства в головной мозг обеспечивает тесный контакт с опухолью или со стенками полости, образовавшейся после иссечения. Способ позволяет вводить лекарственное средство в терапевтически эффективных концентрациях с минимальными токсическими действиями на здоровую ткань головного мозга. Кроме того, способ введения позволяет исключать риск инфекции и после его применения не остается остатка, который может вызывать местные осложнения. Кроме того, поскольку в головном мозге страдающих глиобластомой пациентов уровень таурина является аномально низким, введение тауролидина и/или таурултама приводит к дополнительному преимуществу, связанному с повышением уровня таурина в головном мозге, поскольку в результате метаболизма обоих соединений в конечном итоге образуется таурин. Тауролидин оказывает двойное действие на опухоли. Он инициирует индукцию запрограммированной гибели опухолевых клеток (апоптоз) и он обладает также антиангиогенной активностью в результате ингибирования сосудистого эндотелиального фактора роста (VEGF) и фактора роста Т-клеток (TGF)-бета. Пациентам, страдающим глиобластомой, можно одновременно внутривенно вводить также МТА, такой как тауролидин. Пример Матрицу из фибринового герметика получали с помощью набора типа Tissel (фирма Immuno AG, Вена, Австрия, любезно предоставленным фирмой Baxter Deutschland GmbH, Гейдельберг, Германия) согласно инструкциям производителя. Тауролидин (ультрачистый) был любезно предоставлен фирмой Geistlich Pharma AG, Волхузен, Швейцария. Тауролидин в различных концентрациях гомогенно суспендировали в двух компонентах фибринового герметика. Затем два компонента смешивали в лунках 24-луночного планшета для получения матриц с одинаковыми общими объемами 400 мкл/лунку, которые содержали конечные концентрации тауролидина 10, 20, 40 и 80 мг/мл. Толщина образовавшейся матрицы составляла 2±0,4 мм. Кроме того, для изучения влияния размера матрицы на высвобождение тауролидина получали матрицы с объемами 400 и 800 мкл, которые содержали 10 или 40 мг/мл тауролидина. Матрица объемом 800 мкл имела толщину 4±0,3 мм. В качестве контролей служили матрицы такого же объема и толщины, не содержащие тауролидина. После отверждения в каждую лунку добавляли по 400 мкл надосадочной жидкости забуференного фосфатом физиологического раствора (ЗФР). Многолуночные планшеты инкубировали при 37°С. Надосадочную жидкость собирали пипеткой с 24-часовыми интервалами в течение 7 дней и заменяли идентичными количествами свежеприготовленного ЗФР. Кинетику высвобождения тауролидина в течение продолжительного периода времени исследовали с 24-часовыми интервалами в течение 14 дней путем гомогенного суспендирования различных концентраций тауролидина в двух компонентах фибринового герметика таким образом, чтобы достигались конечные концентрации, составляющие 10, 40 и 80 мг/мл в 400 мкл свежеприготовленного ЗФТ. Объединяли надосадочную жидкость из лунок, содержащих одинаковые концентрации тауролидина. Определяли концентрации тауролидина в надосадочной жидкости. Для определения того, влияет ли заключение в матрицу на противоопухолевую активность тауролидина, клетки глиальной опухоли линий LN18, LN229, U87MG и клетки из только что выделенной глиобластомы ex vivo инкубировали в течение различных периодов времени в присутствии тауролидина, высвобождающегося из матриц. Клетки опухоли линий LN18, LN229 и U87MG и клетки глиобластомы ех vivo высевали в пластиковые колбы объемом 150 см3 для культур клеток до тех пор, пока конфлюэнция клеток не достигала 80%. Образовавшиеся клеточные суспензии центрифугировали при 1200 об/мин в течение 5 мин и затем разбавляли до получения клеточных суспензий, содержащих 5×104 клеток/мл. Аликвоты по 200 мкл клеточных суспензий вносили пипеткой в лунки 96-луночного планшета. Через 12 ч после прилипания клеток среду удаляли и заменяли свежей средой. Клетки инкубировали в течение 24 ч и исследовали раствор тауролидина, высвободившийся через различные промежутки времени из матриц, содержащих различные концентрации тауролидина. В качестве отрицательных контролей использовали опухолевые клетки, инкубированные с таким же объемом надосадочной жидкости матриц фибринового герметика, не содержащих тауролидин. В качестве положительных контролей использовали обработанные аналогичным образом клетки, к которым добавляли Fas-лиганд в концентрации 25%. После инкубации в течение 24 ч надосадочную жидкость удаляли и добавляли 100 мкл раствора красителя кристаллического фиолетового (0,5% кристаллического фиолетового в 19,5% метанола и 80% дистиллированной воды). Через 10 мин раствор удаляли и остаток красителя отмывали водопроводной водой. Затем планшеты оставляли сушиться на воздухе в течение 12 ч, после чего осуществляли подсчет с помощью счетчика для микропланшетов при 540 нм. Были проверены теоретические предположения, лежащие в основе контролируемого диффузией высвобождения тауролидина из матрицы из фибринового герметика. На основе модели местного метаболизма тауролидина были изучены факторы, влияющие на контролируемое диффузией высвобождение тауролидина из матрицы. Два компонента фибринового герметика, содержащие суспендированный тауролидин, распыляли через форсунку с одним отверстием при давлении 1,5 бар с использованием стерилизованного путем фильтрации сжатого воздуха. Для исследования использовали наибольшую возможную концентрацию тауролидина в матрице. Определяли, может ли быть достигнуто однородное распределение TFM. На основе изучения высвобождения тауролидина из матрицы из фибринового герметика в течение 1 недели был установлено, что увеличение кумулятивного количества высвобождаемого тауролидина происходит по экспоненциальному закону. Выявлено статистически достоверное различие кумулятивных количеств высвобождаемого в надосадочную жидкость тауролидина при различных концентрациях включенного в матрицу тауролидина [дисперсионный анализ (ANOVA), критерий Крускала-Уоллиса (Kruskal-Wallis); p<0,001]. Экспоненциальная зависимость кумулятивного высвобождения тауролидина из матрицы приводила к тому, что в течение первых дней происходило высвобождение наибольшего количества тауролидина. Временную зависимость процента высвобождения тауролидина определяли по отношению к исходному количеству тауролидина в матрице. Результаты свидетельствуют о том, что вне зависимости от исходной концентрации тауролидина приблизительно 50% общего количества тауролидина высвобождалось из матрицы в течение первых 2 дней (54,7±1,44%) и приблизительно 75% – в течение 6 дней (75,2±6,64%). Скорость процентного высвобождения не различалась существенно для различных концентраций тауролидина, заключенного в TFM (дисперсионный анализ, критерий Крускала-Уоллиса; р=0,522). При использовании постоянных концентраций тауролидина для различных объемов матрицы кумулятивное высвобождение тауролидина существенно различалось (дисперсионный анализ и критерий Холма-Сидака (Holm-Sidak); p<0,001), в то время как для одинаковых начальных количеств тауролидина в матрицах, имеющих различные объемы, не было обнаружено статистически достоверных различий в кумулятивном высвобождении тауролидина (дисперсионный анализ и критерий Холма-Сидака; р=0,934 (исходное количество 8 мг) и р=0,159 (исходное количество 32 мг). Количество тауролидина, включенного в матрицу, по-видимому, является фактором, имеющим решающее значение для высвобождения. Очевидно, что толщина матрицы не имеет существенного значения для контроля высвобождения тауролидина. Этот результат имеет решающее значение для практического применения матрицы из фибринового герметика, поскольку невозможно во всех случаях обеспечивать одинаковую толщину матрицы. Для обеспечения местного лечения в течение соответствующего периода времени требуется продолжительное время жизни TFM. Время жизни фибриновой матрицы ограничивается началом фибринолиза. Имеющиеся в настоящее время данные свидетельствуют о том, что время жизни in vivo можно в большинстве случаев увеличивать до 12-14 дней при добавлении антифибринолитического средства, такого как апротинин. Кроме того, скорость разложения матрицы из фибринового герметика варьируется в зависимости от протеолитической активности в области нанесения. При создании изобретения изучали, происходит ли высвобождение тауролидина в течение всей максимальной продолжительности жизни матрицы, составляющей 14 дней. На используемой для этого экспериментальной модели было установлено, что в течение 14-дневного периода наблюдения происходило высвобождение эффективных в отношении опухоли количеств тауролидина при применении исходных (включаемых в матрицу) концентраций тауролидина, составляющих 25 мг/мл или выше. Для концентраций 50 мг/мл или выше в день 14 происходило высвобождение свыше 100 мкг/мл тауролидина. Такой уровень тауролидина превышает значение ЕС50 острой цитотоксичности для большинства линий клеток, для которых ранее проводили тестирование с использованием тауролидина. Для различных включаемых в матрицу количеств тауролидина проводили изучение высвобождения тауролидина в зависимости от времени в течение 14 дней. Независимо от включаемых концентраций 98,93%±0,33 тауролидина высвобождалось из матрицы в течение 10 дней и почти 100% (99,99%±0,02) – в течение 14 дней. Процент высвобождения не изменялся для различных включаемых концентраций тауролидина (дисперсионный анализ, критерий Крускала-Уоллиса; р=0,830). Было установлено, что ингибирование пролиферации всех исследованных линий опухолевых клеток и клеток глиобластомы ex vivo происходило зависимым от концентрации образом. При начальной включенной концентрации 10 мг/мл количество тауролидина, высвобождавшегося из TMF в день 13, уже не оказывало влияния на пролиферацию клеток. Это согласуется с данными о концентрации тауролидина, высвободившегося из матрицы в это время. В отличие от этого было установлено, что количество тауролидина, высвободившегося в день 3, при концентрации включенного тауролидина 100 мг/мл уменьшает количество клеток по меньшей мере на 60%. Матрицы из фибринового герметика, содержащие тауролидин, применяли в процессе операции после удаления опухоли таким образом, чтобы обеспечивать прочное соединение со стенкой полости и заполнения всех неровностей поверхности. Затем происходила диффузия тауролидина из компартмента матрицы в компартмент головного мозга путем градиентной диффузии, что представляет собой основной механизм высвобождения тауролидина. В это же время начинался процесс выведения тауролидина из области головного мозга, примыкающей к матрице, с одной стороны, в результате метаболизма и, с другой стороны, в результате диффузии в более глубокие области головного мозга. Помимо этого тауролидин может проникать и распределяться в области, содержащей цереброспинальную жидкость (ЦСЖ). Это распределение обусловлено диффузией через поверхность матрицы, обращенную к полости, образовавшейся в результате иссечения, и усиливается в результате конвекции ЦСЖ, прежде всего в том случае, когда полость, образовавшаяся в результате иссечения, остается “открытой”. Для того чтобы препятствовать этим нежелательным потерям, применяли многослойную матрицу, верхний слой которой состоял из фибринового герметика, не содержащего тауролидина. Этот дополнительный слой уменьшал потерю лекарственного средства, происходящую вследствие диффузии и конвекции в ЦСЖ. Потери лекарственного средства в результате этого процесса учитывали с использованием коэффициента безопасности при расчете количества вводимого тауролидина. TFM подвергается довольно слабому растворению или эрозии и поэтому высвобождение суспендированного в нем лекарственного средства происходит в основном путем диффузии. Высвобождение главным образом определяется скоростью диффузии лекарственного средства из матрицы в окружающую ткань. В этих условиях скорости высвобождения прямо пропорциональны корню квадратному от времени. Количество тауролидина, высвобождаемого из матрицы, прямо пропорционально площади, на которой происходит диффузия. Поэтому для различных исходных концентраций тауролидина в матрице определяли коэффициент пропорциональности, который затем использовали для расчета высвобождения тауролидина в зависимости от времени и площади, на которой происходит диффузия. Результаты, полученные в эксперименте, и расчетные данные свидетельствуют о том, что нет статистически достоверных различий между любыми из изученных исходных концентраций тауролидина. Высвобождение тауролидина из TFM в течение 14 дней позволяло обеспечивать его концентрацию, достаточную для оказания противоопухолевого действия. Результаты экспериментов in vitro позволяют сделать вывод о том, что пригодная исходная концентрация тауролидина составляет 80 мг/мл. Необходимый объем матрицы рассчитывали исходя из количества высвобождаемого тауролидина и исходной концентрации тауролидина, c0, согласно уравнению
где VTFM обозначает необходимый объем TFM [мл]; М=кумулятивное количество высвободившегося тауролидина [мг], ks обозначает коэффициент безопасности; c0 обозначает исходную концентрацию тауролидина в TFM [мг/мл]. Коэффициент безопасности вводили для компенсации потерь вследствие диффузии в защитный слой из фибринового герметика и последующих потерь в результате конвекции. Коэффициент безопасности был выбран равным 1. TFM наносили на полость, образовавшуюся в результате иссечения, путем распыления. Нанесение путем распыления облегчает получение равномерного распределения матрицы на стенках полости, образовавшейся в результате иссечения. Суспендирование тауролидина в двух компонентах фибринового герметика и нанесение путем распыления системы введения лекарственного средства не представляло проблем для исходных вводимых концентраций тауролидина вплоть до 80 мг/мл. Благодаря небольшому времени коагулирования оказалось возможным наносить TFM очень гомогенно и равномерно несколькими слоями. Ограничения, присущие известному из существующего уровня техники местному применению лекарственного средства, могут быть преодолены с помощью приведенного в настоящем описании способа введения МТА (например, тауролидина) в адгезивной матрице. Такую матрицу распыляли на стенки полости, образовавшейся в результате полного или частичного иссечения опухоли. В процессе коагулирования фибриноген превращается в фибрин и формирует ковалентные связи с окружающими протеинами, образуя слой обладающего гемостатической активностью герметика, который затем расщепляется в результате протеолитической активности. Такая матрица обладает гемостатическими свойствами, которые необходимы после проведения хирургической операции. С другой стороны, ковалентное связывание с окружающими протеинами гарантирует то, что матрица будет оставаться точно в том месте, на которое она была нанесена. Это имеет решающее значение, поскольку смещение структур головного мозга после иссечения опухоли и образование послеоперационного отека приводят к изменению размера и формы полости, образовавшейся после иссечения. Результаты эксперимента свидетельствуют о том, что в условиях неограниченного поглощения тауролидин высвобождался из TFM в течение 2 недель в концентрациях, которые оказывали выраженное противоопухолевое действие на изученные при создании изобретения линии опухолевых клеток и опухолевые клетки ex vivo. Результаты опыта по изучению высвобождения антибиотиков из фибриновой матрицы позволяют сделать вывод о том, что наиболее пригодной для описания условий in vivo является модель, основанная на ограниченном поглощении. Результаты экспериментов с использованием различных линий опухолевых клеток и клеток глиобластомы ех vivo свидетельствуют о том, что заключение тауролидина в матрицу из фибринового герметика не оказывает влияния на его противоопухолевую активность. Известно, что тауролидин не оказывает цитотоксическое действие на здоровые клетки. Результаты проведенных ранее экспериментов с использованием культур нейронных и глиальных клеток головного мозга, полученных из эмбрионов крыс на 15 день беременности, свидетельствуют о том, что тауролидин не оказывает цитотоксического действия на эти клетки. Тауролидин в концентрации 80 мг/мл фибринового герметика гомогенно суспендировался в матрице. Фибриновая матрица является пригодным носителем суспензии тауролидина в концентрации, которая обеспечивает высвобождение in vitro терапевтически эффективных количеств лекарственного средства в течение 2 недель. На противоопухолевую активность тауролидина не оказывало влияния его заключение в матрицу из фибринового герметика и высвобождение из нее. Модель высвобождения лекарственного средства из матриц, предложенная Хигучи (Higuchi), является пригодным приближением для описания контролируемого диффузией высвобождения тауролидина из матрицы из фибринового герметика. Описанную систему введения лекарственного средства можно применять для местного лечения тауролидином опухолей головного мозна после полного или частичного иссечения опухолей или опухолей, которые являются неоперабельными вследствие их расположения.
Формула изобретения
1. Противоопухолевая композиция, содержащая тауролидин, таурултам или их смесь в концентрации приблизительно 0,1-160 мг/мл в сочетании с биоразложимым адгезивом, включающий фибриновый герметик, обладающий способностью прилипать к ткани живого организма. 2. Композиция по п.1, где композиция первоначально находится в жидком, полужидком или суспензионном состоянии. 3. Композиция по п.1, где концентрация составляет приблизительно 20 -100 мг/мл. 4. Композиция по п.3, где концентрация составляет приблизительно 50-80 мг/мл. 5. Способ обработки с целью предупреждения или ингибирования роста раковых клеток, заключающийся в том, что противоопухолевую композицию по п.1 наносят на ткань живого организма пациента, нуждающегося в таком лечении. 6. Способ по п.5, где концентрация составляет приблизительно 20-100 мг/мл. 7. Способ по п.6, где концентрация составляет приблизительно 50-80 мг/мл. 8. Способ по п.5, где перед нанесением опухоль удаляют из определенной области ткани. 9. Способ по п.8, где композицию наносят на указанную область в виде слоя. 10. Способ по п.9, где толщина слоя составляет приблизительно 0,1-10 мм. 11. Способ по п.10, где толщина слоя составляет приблизительно 1-5 мм. 12. Способ по п.10, где толщина слоя составляет приблизительно 1,5-2,5 мм. 13. Способ по п.12, где слой наносят путем распыления композиции на указанную область. 14. Способ по п.9, где после нанесения слоя на указанный слой наносят покрытие и герметически закрывают его с помощью герметизирующего второго слоя, который не содержит тауролидин или таурултам. 15. Композиция по любому из пп.1, 3, 5 или 6, в которой указанный фибриновый адгезив, включает независимо тромбин и прокоагулянтные протеиновые компоненты. 16. Композиция по п.15, в которой тауролидин, таурултам или их смесь суспендируется в тромбиновом компоненте. 17. Композиция по п.15, в которой тауролидин, таурултам или их смесь суспендируется в прокоагулянтном компоненте. 18. Способ по любому из пп.8-14, где опухолью является глиобластома.
|
||||||||||||||||||||||||||