|
|
(21), (22) Заявка: 2004133342/13, 15.04.2003
(24) Дата начала отсчета срока действия патента:
15.04.2003
(43) Дата публикации заявки: 10.06.2005
(46) Опубликовано: 20.01.2009
(56) Список документов, цитированных в отчете о
поиске:
US 6005076 А, 21.12.1999. US 4370267 А, 25.01.1983. Растительный белок, под ред. МИКУЛОВИЧ Т.П. – М.: ВО АГРОПРОМИЗДАТ, 1991, с.150, 152, 162-164.
(85) Дата перевода заявки PCT на национальную фазу:
15.11.2004
(86) Заявка PCT:
CA 03/00557 (15.04.2003)
(87) Публикация PCT:
WO 03/088760 (30.10.2003)
Адрес для переписки:
103735, Москва, ул. Ильинка, 5/2, ООО “Союзпатент”, пат.пов. А.Ю.Соболеву
|
(72) Автор(ы):
ЛОДЖИ Джеймс (CA),
МИЛАНОВА Радка (CA)
(73) Патентообладатель(и):
БАРКОН НЬЮТРАСАЙНС (МБ) КОРП. (CA)
|
(54) КОМПОЗИЦИЯ ИЗОЛЯТА КАНОЛОВОГО БЕЛКА (CANOLA PROTEIN)
(57) Реферат:
Изобретение относится к пищевой промышленности. Выделенный и очищенный каноловый белок имеет определенный аминокислотный состав, который обеспечивает новые функциональные свойства изолята белка канолы. 3 н. и 6 з.п. ф-лы, 10 табл., 7 ил.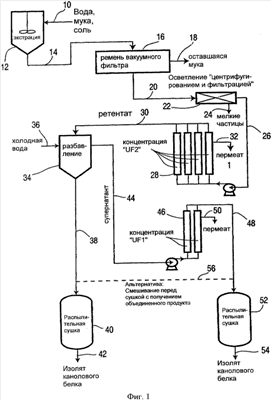
Родственные заявки
В соответствии с USC 119(е) приоритетом настоящей заявки являются совместно поданные заявки на патенты США №№60/372 165 от 15 Апреля 2002 г. и 60/430 от 4 Декабря 2002 г.
Область техники, к которой относится изобретение
Настоящее изобретение относится к составам изолята канолового белка и индивидуальным белковым компонентам таких композиций.
Уровень техники
Изоляты канолового белка могут быть получены из каноловой муки. В совместно поданных заявках на патент США №№60/288415 от 4 мая 2001 г., 60/326987 от 5 октября 2001 г., 60/331066 от 7 ноября 2001 г., 60/333494 от 26 ноября 2001 г., 60/374801 от 24 апреля 2002 г. и 10/137391 от 3 мая 2002 г., уступленных правопреемнику, на которые ссылаются в настоящем документе, раскрывается способ получения изолятов канолового белка из каноловой муки, имеющих содержание белка, по меньшей мере, 100% (N×6,25). Такой способ представляет собой многостадийный процесс, включающий экстракцию каноловой муки солевым раствором, отделение полученного водного раствора белка от оставшейся жмыховой муки, повышение концентрации белка в водном растворе, по меньшей мере, до 200 г/л, при поддержании с помощью селективной мембранной технологии практически постоянного значения ионной силы раствора, разбавление полученного концентрированного белкового раствора охлажденной водой с образованием белковых мицелл, осаждение белковых мицелл с образованием аморфной, липкой, гелеобразной глютеноподобной белковой мицеллярной массы (РММ) и выделение белковой мицеллярной массы из супернатанта, имеющего содержание белка, по меньшей мере, 100% в соответствие с определением азота по Кьельдалю (Kjeldahl), как (N)×6,25. Содержание белка приведено в расчете на сухое вещество. Выделенная РММ может быть подвергнута сушке.
В одном из воплощений описанного выше способа, раскрытого в заявках №№60/326987, 60/331066, 60/333494, 60/374801 и 10/137391, супернатант со стадии осаждения РММ подвергают обработке с целью регенерации белкового изолята, содержащего сухой белок из влажной РРМ и супернатанта. Такой способ может осуществляться путем начального концентрирования супернатанта с использованием ультрафильтрационных мембран, смешивания концентрированного супернатанта с влажной РММ и сушки полученной смеси. Полученный изолят канолового белка имеет чистоту, по меньшей мере, 90% масс. белка (N×6,25), предпочтительно, по меньшей мере, 100% масс. белка (N×6,25).
Согласно другому воплощению описанного выше способа, раскрытого в заявках №№60333494, 60374801 и 10137391, супернатант со стадии осаждения РММ подвергают обработке с целью выделения белка из супернатанта. Такой способ может осуществляться путем начального концентрирования супернатанта с использованием ультрафильтрационных мембран с последующей сушкой концентрата. Чистота полученного изолята канолового белка соответствует, по меньшей мере, 90% масс. белка (N×6,25), предпочтительно, по меньшей мере, 100% масс. белка (N×6,25).
В указанных выше заявках на патенты США в основном описаны периодические процессы. В совместно поданных заявках на патент США №№60/331066 от 2 ноября 2001 г., 60/383809 от 30 мая 2002 г. и 10/298678 от 19 ноября 2002 г., уступленных правопреемнику, на которые ссылаются в настоящем документе, раскрывается непрерывный способ получения изолятов каноловых белков. В соответствии с этими способами каноловую муку непрерывно смешивают с солевым раствором, полученную смесь пропускают через трубопровод, проводя экстракцию белка из каноловой муки с образованием водного раствора белка, водный раствор белка непрерывно отделяют от оставшейся каноловой муки и непрерывно пропускают через селективную мембрану для повышения содержания белка до значения, по меньшей мере, 200 г/л при поддержании постоянного значения ионной силы раствора, полученный концентрированный белковый раствор непрерывно смешивают с охлажденной водой с целью образования белковых мицелл и осуществляют их непрерывное осаждение при непрерывном оттоке супернатанта до накопления желаемого количества РММ в отстойнике. Выделенная из отстойника РММ может быть подвергнута сушке. Содержание белка в РММ, определенное как произведение содержания азота по Кьельдалю (N)×6,25, составляет, по меньшей мере, 90% масс., предпочтительно, по меньшей мере, около 100% масс. (N×6,25).
Как указывается в упомянутых выше заявках на патенты США №№60/326987, 60/331066, 60/333494, 60/374801 и 10/137391, отведенный супернатант может быть подвергнут обработке для извлечения из него изолята канолового белка.
Известно, что каноловое семя содержит около 10-30% масс. белков, а также некоторые другие белковые компоненты. Такие белки отличаются друг от друга различными коэффициентами седиментации (S). Такие известные и идентифицированные белки включают 12S глобулин, известный под названием круциферин, а также 2S запасной белок, известный под названием напин.
Канола также известна как рапсовое семя или семя рапса.
Раскрытие изобретения
Авторами настоящего изобретения было установлено, что при выделении изолята канолового белка, содержащего белки 12S и 2S, также образуются значительные количества нового 7S белка. Соответственно, один из аспектов настоящего изобретения относится к выделению и очистке 7S белка.
Авторы настоящего изобретения также установили, что каноловый изолят из белковой мицеллярной массы и каноловый изолят из супернатанта, полученные описанными выше способами, отличаются относительным содержанием белков 12S, 7S и 2S. Было установлено, что изолят канолового белка из РММ, с содержанием белка, по меньшей мере, около 90% масс. (N×6,25), предпочтительно, по меньшей мере, около 100% масс., включает около 60-98% масс. 7S белка, около 1-15% масс. 12S белка и около 0-25% масс. 2S белка. В отличие от этого изолят канолового белка из супернатанта с содержанием белка, по меньшей мере, около 90% масс. (N×6,25), предпочтительно, по меньшей мере, около 100% масс., включает около 0-5% масс. 12S белка, около 5-40% масс. 7S белка и около 60-95% масс. 2S белка.
Изолят канолового белка из РММ предпочтительно содержит около 88-98% масс. 7S белка, около 1-10% масс. 12S белка и около 0-6% масс. 2S белка, тогда как изолят канолового белка из супернатанта предпочтительно содержит около 70-95% масс. 2S белка, около 5-30% масс. 7S белка и около 0-2% масс. 12S белка.
Таким образом, профили содержания компонентов для двух указанных изолятов канолового белка существенно отличаются друг от друга. В случае изолята канолового белка из РММ доминирующей разновидностью белка является 7S, тогда в изоляте канолового белка из супернатанта, главным образом, присутствует белок 2S. Такое отличие предопределяет различное поведение изолятов канолового белка в различных окружающих средах.
Различные профили содержания белка позволяют получать композиции изолята канолового белка при применении нужных количеств смесей двух различных изолятов канолового белка, что гарантирует любой желательный профиль содержания белков 2S/7S/12S, являющийся промежуточным между их содержанием в изоляте из РММ и изоляте из супернатанта.
Изолят из супернатанта является новым изолятом канолового белка. Согласно другому аспекту настоящее изобретение обеспечивает изолят канолового белка с содержанием белка, по меньшей мере, около 90% масс., предпочтительно, по меньшей мере, около 100% масс., в расчете на сухое вещество согласно определению азота по Кьельдалю в виде произведения N×6,25, причем такой белок содержит около 60-95% масс. белка 2S, около 5-40% масс. 7S белка и около 0-5% масс. 12S белка. Предпочтительный профиль содержания белков в изоляте канолового белка из супернатанта включает около 70-95% масс. белка 2S, около 5-30% масс. 7S белка и около 0-2% масс. 12S белка.
Комбинация из любого количества изолята канолового белка из РММ с любым количеством изолята канолового белка из супернатанта, содержащая желательные количества 2S, 7S и 12S белка, представляет собой новую композицию изолята канолового белка. В соответствии с этим другой аспект настоящего изобретения относится к композиции изолята канолового белка, содержащей (1) первый изолят канолового белка с содержанием белка, по меньшей мере, около 90% масс., предпочтительно, по меньшей мере, около 100% масс. в расчете на сухое вещество, установленным определением азота по Кьельдалю в виде N×6,25, имеющим белковый профиль, составляющий около 60-98% масс. 7S белка, около 1-15% масс. 12S белка и около 0-25% масс. 2S белка, и (2) второй изолят канолового белка с содержанием белка, по меньшей мере, около 90% масс., предпочтительно, по меньшей мере, около 100% масс. в расчете на сухое вещество, установленным определением азота по Кьельдалю в виде N×6,25, имеющим белковый профиль, составляющий около 60-95% масс. 2S белка, около 5-40% масс. 7S белка и около 0-5% масс. 12S белка.
Предпочтительный белковый профиль первого изолята канолового белка составляет около 88-98% масс. 7S белка, около 1-10% масс. 12S белка и около 0-6% масс. 2S белка. Предпочтительный белковый профиль второго изолята канолового белка соответствует предпочтительному белковому профилю нового изолята канолового белка, описанного в настоящем документе.
Изменения в соотношении 12S/7S/2S белков в конкретном изоляте канолового белка из РММ и/или конкретном изоляте канолового белка из супернатанта, могут быть достигнуты изменением технологических условий процесса получения соответствующих изолятов канолового белка из каноловой муки.
Индивидуальные компоненты изолята канолового белка были выделены, очищены и охарактеризованы. Индивидуальные белки могут быть выделены из соответствующих РММ- и супернатант-производных изолятов канолового белка, полученных описанными выше способами, с помощью любого традиционного метода, обеспечивающего разделение белковых смесей на основе размерных отличий, предпочтительно с помощью препаративной жидкостной хроматографии высокого давления (HPLC), с последующей ультрафильтрацией, направленной на уменьшение объема элюата, и диализом, обеспечивающим уменьшение остаточного растворяющего солевого компонента. Диализированный материал может быть высушен с целью удаления чистого белка.
Еще один аспект настоящего изобретения относится к способу выделения и очистки индивидуальных каноловых белков из изолята канолового белка, содержащего смесь, по меньшей мере, двух различных каноловых белков, выбранных из группы, состоящей из 2S, 7S и 12S белков, включающего описанные в настоящем документе изолят канолового белка из РРМ и изолят канолового белка из супернатанта.
2S белок обычно выделяют из РММ-производного изолята канолового белка, после чего подвергают очистке, тогда как белки 7S и 12S обычно выделяют и очищают из белковой мицеллярной массы. 2S белок имеет молекулярную массу, определенную с помощью MALDI-MS, порядка 14 kDa, молекулярная масса 7S белка, определенная с помощью MALDI-MS, составляет 145 kDa, а молекулярная масса 12S белка, определенная с помощью MALDI-MS, составляет 290 kDa.
Белки 7S и 12S имеют близкий аминокислотный профиль и состоят из ряда одинаковых субъединиц, каждая из которых содержит примерно 413 аминокислот. 7S белок содержит около 1240 аминокислот, тогда как 12S белок содержит примерно 2480 аминокислот. Аминокислотный профиль белка 2S полностью отличается от соответствующих профилей белков 7S и 12S и содержит примерно 120 аминокислот. Установленные аминокислотные профили представлены в следующих ниже примерах.
Обеспечение индивидуальными и очищенными 2S, 7S и 12S каноловыми белками позволяет получать композиции 7S белка с различными количествами белков 12S и/или 2S, обладающие уникальными функциональными свойствами при использовании очищенных белков. Еще один аспект настоящего изобретения имеет отношение к таким композициям.
Изоляты каноловых белков, полученные способом настоящего изобретения, могут найти применение в традиционных использованиях белковых изолятов, например, в качестве белковых обогатителей пищевых продуктов, эмульгаторов масел, формообразователей кулинарных изделий и пенообразователей в продуктах, предназначенных для улавливания газов. Кроме этого, изоляты канолового белка могут быть сформированы в виде белковых волокон, используемых в мясных аналогах, могут использоваться в качестве заменителя яичного белка или наполнителя пищевых продуктов, в которых яичный белок используют в качестве связующего вещества. Изолят канолового белка может использоваться в качестве пищевой добавки. Кроме этого, изоляты канолового белка могут найти применение в качестве добавок в корм домашних животных и в комбикорма, а также в промышленности, косметологии и в продуктах личной гигиены. Индивидуальные выделенные и очищенные белки могут использоваться в аналогичных целях.
Краткое описание чертежей
Фигура 1 изображает технологическую схему способа получения изолятов канолового белка с различным белковым профилем в соответствии с одним из воплощений настоящего изобретения;
фигура 2 изображает технологическую схему непрерывного способа получения изолятов канолового белка с различными белковыми профилями в соответствии с другим воплощением настоящего изобретения;
на фигурах 3-5 представлены HPLC хроматограммы экстрактов свежезамороженной муки; и
фигуры 6 и 7 изображают результаты наложения семи последовательных HPLC хроматограмм, полученных при сборе индивидуальных 2S, 7S и 12S каноловых белков.
Осуществление изобретения
Соответствующий РММ-производный изолят канолового белка и супернатант-производный изолят канолового белка могут быть выделены из каноловой муки с помощью периодического, непрерывного или полунепрерывного способов, описанных в указанных выше заявках на патенты США.
Начальная стадия процесса получения изолятов канолового белка заключается в растворении белкового материала из каноловой муки. Белковой материал, выделенный из каноловой муки, может представлять собой природный белок канолового семени или других масличных семян, или генетически модифицированный белок, обладающий гидрофобными и полярными свойствами природного белка. Каноловая мука может представлять собой любую каноловую муку, полученную в результате удаления канолового масла из семян канолы при различных содержаниях неденатурированного белка, что достигается в результате экстракции гексаном или при использовании методов экструзии холодного масла. Удаление канолового масла из семян канолы обычно представляет собой отдельную стадию процесса выделения белкового изолята.
Наиболее эффективное растворение белка проводят с использованием раствора соли пищевого сорта, поскольку присутствие соли способствует удалению растворимого белка из муки масличного растения. В том случае, когда изолят канолового белка предназначается для непищевого использования, могут использоваться химикалии непищевого сорта. Применяемая соль обычно представляет собой хлористый натрий, хотя могут использоваться и другие соли, например хлористый калий. Для растворения значительных количеств белка необходимо, чтобы ионная сила солевого раствора составляла, по меньшей мере, 0,10, предпочтительно, по меньшей мере, 0,15. По мере повышения ионной силы солевого раствора вначале наблюдается увеличение степени растворения белка муки масличного растения, после чего достигается ее максимальное значение. Дальнейшее повышение ионной силы раствора не приводит к увеличению количества растворенного общего белка. Значение ионной силы раствора соли пищевого сорта, обеспечивающее максимальное растворение белка, может изменяться в зависимости от природы соли и выбранной муки масличного растения.
Учитывая тот факт, что при повышенной ионной силе для осаждения белка требуется большая степень разбавления, предпочтительно использовать значения ионной силы менее 0,8, более предпочтительно 0,15-0,6.
При проведении периодического процесса растворение белка под действием соли проводят при температуре, по меньшей мере, 5°С, предпочтительно при температуре до 35°С, желательно в условиях перемешивания с целью уменьшения времени растворения, которое обычно составляет 10-60 минут. Предпочтительно проводить растворение в такой степени, чтобы обеспечить максимально возможную в практических условиях экстракцию белка из муки масличного растения, с целью обеспечения высокого общего выхода продукта.
Выбор нижнего температурного предела, составляющего 5°С, обусловлен слишком медленной скоростью растворения при более низких температурах, тогда как выбор верхнего температурного предела, составляющего 35°С, обусловлен тем, что при более высоких температурах периодический процесс становится экономически невыгодным.
При проведении непрерывного процесса экстракцию белка из каноловой муки проводят любым способом, удовлетворяющим требованиям непрерывной экстракции белка из каноловой муки. Согласно одному из воплощений муку каноловых семян непрерывно смешивают с раствором соли пищевого сорта и полученную смесь пропускают через трубу или трубопровод определенной длины с такой объемной скоростью, которая обеспечивает достаточное время пребывания для осуществления желаемой экстракции при указанных технологических параметрах. При проведении такого непрерывного процесса осуществляют быструю, занимающую до 10 минут, стадию растворения под действием соли с целью экстракции максимально возможного количества белка из каноловой муки в реальных технологических условиях. Стадию растворения в непрерывном процессе предпочтительно проводить при повышенных температурах, предпочтительно при температуре до около 35°С, обычно до около 65°С.
Как подробно описано ниже, для образования белкового изолята мицеллярным путем необходимо, чтобы водный раствор соли пищевого сорта и каноловой муки имел рН в интервале около 5-6,8.
В области граничных значений указанного интервала значений рН, формирование белкового изолята по мицеллярному пути осуществляется лишь частично и с более низкими выходами, чем те, которые достигаются при значениях рН внутри указанного интервала. По этой причине предпочтительно использовать умеренно кислые значения рН, порядка около 5,3-6,2.
рН солевого раствора на стадии экстракции может устанавливаться на любом значении в интервале около 5-6,8 в результате использования любой традиционной кислоты, обычно хлористо-водородной кислоты, или щелочи, обычно гидроксида натрия.
Концентрация муки масличного растения в растворе соли пищевого сорта на стадии растворения может меняться в широких пределах. Обычные значения концентрации составляют около 5-15% масс./объем.
Растворимые жиры, которые могут присутствовать в каноловой муке, способны оказывать влияние на стадию экстракции белка водным солевым раствором, и в результате такие жиры могут присутствовать в водной фазе.
Раствор, полученный на стадии экстракции, обычно имеет концентрацию белка около 5-40 г/л, предпочтительно около 10-30 г/л.
Водную фазу, полученную в ходе экстракции, можно отделять от оставшейся каноловой муки любым традиционным способом, например, вакуумной фильтрацией с последующим центрифугированием и/или фильтрацией для удаления оставшейся муки. Выделенная каноловая мука может быть высушена для дальнейшего использования.
Цвет конечного изолята канолового белка может быть улучшен в том, что касается яркости и меньшей интенсивности желтого оттека, в результате смешивания порошкообразного активированного угля или другого вещества, адсорбирующего пигменты, с выделенным водным раствором белков и последующего удаления адсорбента фильтрацией с получением белкового раствора. Для удаления пигментов можно использовать метод диафильтрации.
Стадия удаления пигмента может проводиться при любых подходящих условиях, например при комнатной температуре выделенного водного раствора белка, с использованием подходящего поглотителя пигмента. Порошкообразный активированный уголь используют в количестве около 0,025-5%, предпочтительно около 0,05-2% масс./объем.
В том случае, когда мука канолового семени содержит значительное количество жира, как описано в патентах США №№5884086 и 6005076, уступленных правопреемнику, на которые ссылаются в настоящем документе, можно проводить стадии обезжиривания выделенного водного белкового раствора и описанного ниже концентрированного водного белкового раствора. Если используется стадия улучшения цветовых характеристик, ее проводят после стадии первого обезжиривания.
В качестве альтернативы экстракции муки масличной культуры водным раствором соли может использоваться экстракция только водой, хотя при использовании чистой воды из муки масличной культуры экстрагируется меньшее количество белка, чем при экстракции водным раствором соли. При использовании такого альтернативного решения соль в указанных выше концентрациях может добавляться в белковый раствор после отделения от оставшейся муки масличной культуры с целью поддержания белка в растворенном состоянии в ходе обсуждаемой ниже стадии концентрирования. При проведении стадий устранения цвета и/или первой стадии удаления жира, добавление соли проводят после завершения указанных операций.
Другой альтернативный способ заключается в экстракции муки масличной культуры раствором соли пищевого сорта при относительно высоких значениях рН в интервале около 6,8-9,9. Это значение рН раствора соли пищевого сорта может устанавливаться в результате применения любой щелочи пищевого сорта, например водного раствора гидроксида натрия. С другой стороны, муку масличной культуры можно экстрагировать солевым раствором при относительно низком значении рН, например около 5-3. При использовании такой альтернативы водную фазу, полученную на стадии экстракции муки масличной культуры, отделяют от оставшейся муки любым традиционным способом, например в результате вакуумной фильтрации с последующим центрифугированием и/или фильтрацией для удаления муки. Выделенная мука может быть высушена в целях дальнейшего использования.
Перед проведением описанной ниже последующей обработки рН водного белкового раствора, полученного на стадии экстракции при высоком или низком рН, устанавливают в указанном выше интервале около 5-6,8, предпочтительно 5,3-6,2. Такое регулирование рН можно проводить с помощью любой традиционной кислоты, например хлористо-водородной кислоты, или щелочи, например гидроксида натрия.
Для повышения концентрации белка в полученном водном растворе его подвергают концентрированию при практически постоянном значении ионной силы раствора. Такое концентрирование проводят для получения белкового раствора с концентрацией белка, по меньшей мере, около 200 г/л, предпочтительно, по меньшей мере, около 250 г/л.
Стадию концентрирования можно проводить любым традиционным способом, соответствующим периодическому или непрерывному режиму, например с использованием обычной селективной мембранной технологии, например ультрафильтрации или диафильтрации, с применением половолокнистых или спиральных мембран с нужным отсечением молекулярной массы, например, около 3000-50000 дальтон, выполненных из различных материалов и имеющих различные конфигурации, причем в случае непрерывного процесса размерные факторы мембран должны обеспечивать желательную степень концентрации водного раствора белка по мере его прохода через мембрану.
Стадию концентрирования можно проводить при любой удобной температуре, обычно при около 20-60°С, в течение времени, обеспечивающего желаемую степень концентрирования. Температура и другие режимные параметры в некоторой степени зависят от типа мембранного оборудования, используемого на стадии концентрирования, а также от желательной концентрации белка в растворе.
Концентрирование раствора до концентрации белка выше 200 г/л не только увеличивает выход до значений выше 40%, в расчете на количество экстрагированного белка, выделенного в виде сухого белкового изолята, предпочтительно до значений выше 80%, но также понижает концентрацию соли в конечном белковом изоляте после сушки. Возможность регулирования концентрации соли в изоляте является важным обстоятельством при таких использованиях изолята, когда концентрация соли влияет на функциональные и сенсорные свойства пищевого продукта.
Как хорошо известно, ультрафильтрация и аналогичные мембранные технологии обеспечивают проход низкомолекулярных веществ через мембрану и препятствуют прониканию высокомолекулярных веществ. Низкомолекулярные вещества включают не только ионные производные соли, но также низкомолекулярные материалы, экстрагированные из исходного вещества, например углеводы, пигменты и непитательные факторы, а также низкомолекулярные формы белка. Обычно с учетом материалов, из которых выполнена мембрана, и ее конфигурации выбирают такое значение молекулярно-массового отсечения мембраны, которое обеспечивает удерживание значительной части белка в растворе и пропускание через нее загрязняющих примесей.
В зависимости от температуры, используемой на стадии концентрирования, концентрированный белковый раствор можно нагревать до температуры, по меньшей мере, около 20-60°С, предпочтительно около 25-40°С с целью понижения вязкости концентрированного белкового раствора, что способствует проведению последующей стадии разбавления и мицеллобразования. Концентрированный белковый раствор не следует нагревать до температуры, выходящей за рамки указанного выше интервала, препятствующей образованию мицелл при разбавлении охлажденной водой. При необходимости концентрированный белковый раствор может быть подвергнут дополнительному обезжириванию в соответствии со способами, раскрытыми в US Patent №№5884086 и 6005076.
Затем концентрированный белковый раствор, полученный в результате проведения стадий концентрирования и необязательного обезжиривания, подвергают разбавлению с целью образования мицелл, путем смешивания с таким объемом охлажденной воды, который требуется для достижения желательной степени разбавления. Степень разбавления концентрированного белкового раствора может изменяться в зависимости от того, какое количество канолового белка желательно получать по мицеллярному пути и какое количество – из супернатанта. В общем случае, чем выше степень разбавления, тем большее количество канолового белка остается в водной фазе.
Если желательно, чтобы по мицеллярному пути образовывалось большее количество белка, концентрированный белковый раствор разбавляют примерно в 15 или менее раз, предпочтительно примерно в 10 и менее раз.
Охлажденная вода, с которой смешивают концентрированный белковый раствор, имеет температуру около менее 15°С, обычно примерно менее 3-15°С, предпочтительно около менее 10°С, поскольку при указанных факторах разбавления пониженные температуры обеспечивают улучшенные выходы белкового изолята в виде белковой мицеллярной массы.
При периодическом процессе загрузку концентрированного белкового раствора добавляют в желательный объем охлажденной воды, находящийся в статическом состоянии. Разбавление концентрированного белкового раствора и последующее уменьшение ионной силы приводит к образованию воздушной массы высокоассоциированных белковых молекул в виде дискретных белковых капелек, имеющих форму мицелл. При проведении периодического процесса белковые мицеллы осаждаются в охлажденной воде с образованием агрегированной, сросшейся, плотной, аморфной липкой клейковиноподобной белковой мицеллярной массы (РММ). Осаждение может ускоряться центрифугированием. Такое индуцированное осаждение обычно понижает содержание жидкости в белковой мицеллярной массе от около 70-95% масс. до около 50-80% масс. в расчете на общую массу мицелл. Уменьшение влагосодержания мицеллярной массы приводит к уменьшению содержания окклюдированной соли в мицеллярной массе и, следовательно, содержания соли в сухом изоляте.
Согласно другому варианту операция разбавления может проводиться путем непрерывной подачи концентрированного белкового раствора в одно из входных отверстий Т-образной трубы при подаче разбавляющей воды в другое входное отверстие Т-образной трубы, в результате чего обеспечивается перемешивание в трубе. Разбавляющую воду подают в Т-образную трубу со скоростью, достаточной для достижения желаемой степени разбавления.
Смешивание в трубе концентрированного белкового раствора и разбавляющей воды инициирует образование белковых мицелл, полученную смесь непрерывно выводят из Т-образной трубы и подают в отстойник, из которого по мере его переполнения отводится супернатант. Введение смеси в массу жидкости в отстойнике предпочтительно осуществлять таким образом, чтобы минимизировать турбулентность жидкости.
При проведении непрерывного процесса белковые мицеллы осаждаются в отстойнике с образованием агрегированной, сросшейся, плотной, аморфной липкой клейковиноподобной белковой мицеллярной массы (РММ) и процесс продолжают до накопления желаемого количества РММ в нижней части отстойника, после чего образовавшуюся РММ выводят из отстойника.
Комбинация технологических параметров концентрирования белкового раствора до содержания белка, по меньшей мере, около 200 г/л, и использование коэффициента разбавления менее 15 обеспечивает более высокие выходы, часто значительно более высокие выходы продукта при регенерации белка в виде белковой мицеллярной массы из исходного мучного экстракта, и более чистые изоляты в отношении содержания белка, чем при использовании известных методов получения белковых изолятов, описанных в цитированных выше патентах США.
В результате использования непрерывного процесса регенерации канолового белкового изолята вместо периодического процесса длительность стадии экстракции исходного белка может быть значительно сокращена при одинаковом уровне экстракции белка, причем на стадии экстракции могут использоваться существенно более высокие температуры. Кроме этого, при непрерывном режиме меньше шансов загрязнения, чем при периодическом режиме, что обеспечивает получение продукта более высокого качества и возможность осуществления процесса с использованием более компактного оборудования.
Осажденный изолят отделяют от оставшейся жидкой фазы или супернатанта декантацией водной фазы с осажденной массы или центрифугированием. РММ может использоваться во влажном состоянии или может быть подвергнута сушке любым общепринятым способом, например сушке распылением, сушке сублимацией или вакуумной сушке до сухого состояния. РРМ характеризуется высоким содержанием белка, превышающим примерно 90% масс., предпочтительно составляющим, по меньшей мере, около 100% масс. (рассчитанным, как N по Кьельдалю × 6,25) и является практически неденатурированным материалом (что установлено методом дифференциальной сканирующей калориметрии). Сухая РММ, выделенная из муки жирной масличной культуры при использовании способов, раскрытых в US Patents 5844086 и 6005076, также характеризуется низким содержанием остаточного жира, составляющим около менее 1% масс.
РММ-производный изолят канолового белка состоит преимущественно из 7S канолового белка и содержит небольшие количества 12S канолового белка и, необязательно, незначительные количества 2S канолового белка. Как правило, РММ содержит:
около 60-98% масс. 7S белка
около 1-15% масс. 12S белка
около 0-25% масс. 2S белка
Предпочтительная РММ содержит:
около 88-98% масс. 7S белка
около 1-10% масс. 12S белка
около 0-6% масс. 2S белка
Супернатант со стадии образования и осаждения РММ содержит значительные количества канолового белка, не осажденного на стадии разбавления, и его подвергают обработке для выделения изолята канолового белка. Супернатант со стадии разбавления, после удаления РММ, концентрируют с целью повышения содержания белка. Такое концентрирование осуществляют с использованием любой удобной селективной мембранной технологии, например ультрафильтрации, с применением мембран с подходящим отсечением низкомолекулярных веществ, включающих солевые и другие не белковые низкомолекулярные материалы, экстрагированные из исходного источника белка, проходящие через мембрану, тогда как каноловый белок остается в растворе. Для этой цели могут использоваться ультрафильтрационные мембраны с отсечением молекулярных масс в интервале около 3000-10000 дальтон, выполненные из различных материалов и имеющие различные конфигурации. Такое концентрирование супернатанта способствует уменьшению объема жидкости, удаляемой в результате сушки с целью регенерации белка. Обычно перед сушкой супернатант концентрируют до содержания белка около 100-400 г/л, предпочтительно 200-300 г/л. Такое концентрирование можно проводить в периодическом или непрерывном режиме, описанном выше для стадии концентрирования раствора белка.
Сушку концентрированного супернатанта можно проводить любым традиционным способом, например, распылением, сублимацией или используя вакуумную сушку с получением дополнительного количества изолята канолового белка. Такой дополнительный изолят канолового белка характеризуется высоким содержанием белка, превышающим около 90% масс., предпочтительно составляющим, по меньшей мере, около 100% масс. (рассчитанному, как N по Кьельдалю × 6,25) и является практически неденатурированным продуктом (что установлено методом дифференциальной сканирующей калориметрии).
Высушенный супернатант преимущественно состоит из 2S канолового белка и содержит небольшие количества 7S канолового белка и, необязательно, незначительные количества 12S канолового белка. Как правило, супернатантпроизводный каноловый белок содержит:
около 60-95% масс. 2S белка
около 5-40% масс. 7S белка
около 0-5% масс. 12S белка
Предпочтительный супернатантпроизводный каноловый белок содержит:
около 70-95% масс. 2S белка
около 5-30% масс. 7S белка
около 0-2% масс. 12S белка
Если желательно, то, по меньшей мере, часть влажной РММ можно объединять с, по меньшей мере, частью концентрированного супернатанта перед сушкой объединенных белковых потоков любым общепринятым способом с получением объединенного изолята канолового белка настоящего изобретения. Относительные количества смешанных белковых материалов могут выбираться таким образом, чтобы получить состав изолята канолового белка с желаемым распределением 2S/7S/12S белков. С другой стороны, высушенные белковые изоляты могут объединяться в любых желаемых количествах с получением желаемого специфического распределения 2S/7S/12S белков и с получением композиции настоящего изобретения. Объединенная композиция изолята канолового белка характеризуется высоким содержанием белка, превышающим около 90% масс., предпочтительно, по меньшей мере, около 100% масс. (рассчитанным, как N по Кьельдалю × 6,25) и является практически неденатурированным продуктом (что установлено методом дифференциальной сканирующей калориметрии).
Согласно другому варианту, в котором лишь часть концентрированного супернатанта смешивают лишь с частью РММ и полученную в результате смесь сушат, оставшаяся часть концентрированного супернатанта и оставшаяся часть РММ могут также подвергаться сушке. Кроме этого, как обсуждается ниже, высушенная РММ и высушенный супернатант могут смешиваться в сухом состоянии в любых желательных соотношениях.
С использованием такого метода может быть выделен ряд изолятов канолового белка в виде сухой РММ, сухого супернатанта и сухих смесей с различными количествами изолята РММ-производного канолового белка и изолята супернатантпроизводного канолового белка, в массовых соотношениях примерно от 5:95 до 95:5, которые обеспечивают различные функциональные и питательные свойства продукта, связанные с различным распределением 2S/7S/12S белков в композициях.
В качестве альтернативы растворению концентрированного белкового раствора в охлажденной воде и обработке полученного осадка и супернатанта описанным выше способом белок может быть выделен из концентрированного белкового раствора в результате его диализа с целью уменьшения содержания соли. Уменьшение содержания соли в концентрированном белковом растворе приводит к образованию в диализной трубке белковых мицелл. Полученные в результате диализа белковые мицеллы могут быть осаждены, собраны и высушены описанным выше способом. Супернатант со стадии осаждения белковых мицелл может быть подвергнут описанной выше обработке с целью выделения дополнительного количества белка. Согласно другому варианту содержимое диализной трубки может быть подвергнуто прямой сушке. Последний вариант особенно полезен для получения небольших партий белка в лабораторных условиях.
Относительные количества соответствующих белков в конкретном белковом изоляте могут быть определены с помощью традиционного аналитического оборудования, например аналитической разделительной техники. Для этой цели чаще всего используют селективную среду в разделительной колонке, позволяющую осуществлять разделение по размеру. При применении гель-проникающей хроматографии (GPC) используют гелеобразные материалы. При применении давления, например в жидкостной хроматографии высокого давления (HPLC), используют твердую среду. Последний способ известен также как размерно-вытеснительная хроматография (SEC). В следующих ниже примерах представлены результаты использования описанных методов применительно к образцам изолята канолового белка, полученным описанными выше способами.
Масс-спектроскопия (MS) может использоваться для идентификации и анализа белковых образцов, содержащих описанные выше 2S, 7S и 12S белки канолы. При использовании масс-спектроскопии с ионизацией пучком электронов (ESI) белок подвергается бомбардировке электронами низкой энергии с детекцией заряженных осколков или фрагментов, образовавшихся в результате столкновения. Для этой цели может использоваться лазерный десорбционно-ионизационный масс-спектрометр с матричным ускорением (MALDI), в котором осуществляется лазерное испарение анализируемого образца сухого материала, содержащего специфическую молекулярную матрицу. Матрица содержит совместимую, низкомолекулярную органическую молекулу, обеспечивающую достаточную защиту анализируемого биополимера с целью уменьшения числа ионизированных фрагментов, образующихся в результате воздействия лазерной энергии.
Данные, полученные при исследовании образцов белкового изолята описанными выше методами, подтверждают, что 2S белок не устойчив в бомбардировке электронами с помощью ESI-MS и легко распадается на множество полипептидных фрагментов размером 4, 10 и 21 кДа. Однако при использовании MALDI-MS была получена фракция интактного 2S с молекулярной массой, близкой к 14000 дальтонам.
Белок 7S в РММ-производном белковом изоляте также образует большое число фрагментов с массой менее 10 кДа, что позволяет сделать вывод о его молекулярной нестабильности к бомбардировке электронами в ESI-MS. Кроме этого, при анализе 7S белка из изолята РРМ-производного канолового белка были идентифицированы фрагменты массой 21 кДа, которые отсутствовали в 7S белке из изолята супернатант-производного канолового белка.
При ESI-MS анализе 7S белка из РММ-производного белкового изолята было идентифицировано шесть белков с молекулярными массами в интервале 126-166 кДа,. тогда как при анализе 7S белка из изолята супернатантпроизводного канолового белка был идентифицирован один крупный фрагмент массой 167 кДа.
Результаты MALDI-MS анализа показывают, что 2S белок имеет молекулярную массу в интервале 13960-14250 дальтон и полностью устойчив к мягкой кислотной обработке. 7S и 12S белки состоят из одинаковых строительных блоков с базовой субъединицей массой 48200-48400 дальтон. Белок 7S имеет молекулярную массу, соответствующую трем таким субъединицам, т.е. около 145000 дальтон, тогда как белок 12S содержит 6 субъединиц с общей молекулярной массой 290000 дальтон. При кислотном гидролизе 7S и 12S белков образования 2S белка не наблюдалось и были получены почти одинаковые результаты, подтверждающие факт образования двух таких белков из одинаковых субъединиц.
Индивидуальные белки 2S, 7S и 12S могут быть выделены и очищены из соответствующих белковых изолятов любыми общепринятыми методами, включающими аналитическую жидкостную хроматографию высокого давления (HPLC) для получения небольших количеств белка и препаративную HPLC для получения больших партий белка. Могут использоваться и другие методы получения композиции с различными молекулярными массами. Обычно белок 2S выделяют и очищают из изолята супернатант-производного канолового белка, тогда как 7S и 12S белок обычно выделяют и очищают из изолята РММ-производного канолового белка. Изолят канолового белка солюбилизируют, например, с использованием солевого раствора, после чего пропускают через HPLC колонку. Разделенные методом HPLC белки, содержащиеся во фракциях элюента, содержащих один из белков, обычно подвергают ультрафильтрации для уменьшения объема элюента с последующим диализом белкового изолята с целью уменьшения остаточного содержания соли в белках. Подвергнутый диализу материал может быть высушен с целью получения выделенного и очищенного сухого индивидуального канолового белка.
Описание предпочтительных воплощений изобретения
На фигуре 1 изображена технологическая схема периодического способа получения изолятов канолового белка. Каноловую муку и водную экстракционную среду по линии 10 подают в экстрактор 12, в котором проводят экстракцию каноловой муки и получают водный раствор белка. Водную суспензию белка и оставшуюся каноловую муку подают по линии 14 в зону вакуумной фильтрации 16 для отделения оставшейся каноловой муки, которую выводят по линии 18. Затем водный раствор белка по линии 20 подают в зону осветления 22, где водный раствор белка подвергают центрифугированию и фильтрации с целью отделения мелких частиц, которые выводят по линии 24.
Осветленный водный раствор белка прокачивают по линии 26 и пропускают через ультрафильтрационную мембрану 28 с образованием концентрированного белкового раствора, подаваемого в виде ретентата по линии 30, причем пермеат выделяют по линии 32. Концентрированный раствор белка подают в отстойник 34, в который по линии 36 вводят холодную воду. Белковую мицеллярную массу, образовавшуюся в отстойнике 34, выводят по линии 38 и пропускают через распылительную сушилку 40, в результате чего получают сухой изолят канолового белка 42.
Супернатант из отстойника 34 отводят по линии 44 и прокачивают через ультрафильтрационную мембрану 46 с получением раствора концентрированного белка в виде ретентата, отводимого по линии 48, причем образовавшийся пермеат отводят по линии 50. Концентрированный белковый раствор пропускают через распылительную сушилку 52, в результате чего получают дополнительное количество сухого изолята канолового белка 54.
Согласно другому воплощению концентрированный белковый раствор из линии 48 может подаваться по линии 56 и смешиваться с белковой мицеллярной массой, после чего смесь направляют в распылительную сушилку 40.
На фигуре 2 изображена технологическая схема непрерывного способа получения изолятов канолового белка. Каноловую муку и водную экстракционную среду подают по соответствующим линиям 110 и 112 в смеситель 114, в котором осуществляют смешивание каноловой муки и водной экстракционной среды, после чего полученную смесь подают по линии 116 в трубчатый смеситель 118. В трубчатом смесителе 118 осуществляется экстракция муки и образуется водный раствор белка. Водную суспензии белка и оставшуюся муку масличной культуры подают по линии 20 в зону вакуумной фильтрации 122 для отделения оставшейся муки масличной культуры, которую отводят по линии 124. Затем водный раствор белка по линии 126 подают в зону осветления 128, где водный белковый раствор подвергают центрифугированию и фильтрации с целью удаления мелких частиц, который удаляют по линии 130.
Осветленный водный раствор белка подают по линии 132 и прокачивают через ультрафильтрационные мембраны 134 для обеспечения желаемой степени концентрирования водного белкового раствора с образованием концентрированного белкового раствора, отводимого в виде ретентата по линии 136, и пермеата, отводимого по линии 138. Концентрированный белковый раствор подают во входное отверстие Т-образного смесителя 140, в который по линии 142 вводят холодную воду, объем которой достаточен для обеспечения желаемой степени разбавления. Полученный раствор по линии 144 подают в отстойник 146 для осаждения белковой мицеллярной массы. Осажденную в отстойнике 146 мицеллярную белковую массу периодически выводят по линии 148 и подают в распылительную сушилку 150, в которой образуется сухой изолят канолового белка.
Супернатант из отстойника отводят по линии 154 и прокачивают через ультрафильтрационные мембраны 152 с получением раствора концентрированного белка в виде ретентата, отводимого по линии 158, причем образовавшийся пермеат отводят по линии 160. Концентрированный белковый раствор пропускают через распылительную сушилку 162, в результате чего получают дополнительное количество сухого изолята канолового белка 164.
Согласно другому варианту концентрированный белковый раствор из линии 158 может подаваться по линии 166 и смешиваться с белковой мицеллярной массой, после чего смесь направляют на распылительную сушку 150.
ПРИМЕРЫ
Пример 1
Настоящий пример иллюстрирует методику получения изолятов канолового белка настоящего изобретения.
При температуре окружающего воздуха «а» кг промышленной каноловой муки добавляли к «b» л 0,15 М раствора NaCl и смесь перемешивали в течение 30 минут с получением раствора с концентрацией белка «с» г/л. Оставшуюся каноловую муку удаляли и промывали на вакуумном фильтре. Полученный белковый раствор осветляли центрифугированием с получением «d» литров осветленного раствора с концентрацией белка «е» г/л.
Аликвоту раствора белкового экстракта объемом «f» литров подвергали ультрафильтрационному концентрированию до объема «g» литров с использованием мембран с отсечением молекулярной массы «h» дальтон. Концентрация белка в полученном концентрированном растворе составляла «i» л/г.
Полученный концентрированный раствор при «j» °C разбавляли «k» литрами холодной воды с температурой 4°С. Раствор сразу же становился мутным, и взвеси давали оседать. Верхний водный слой удаляли, а осажденную вязкую клейкую массу (РММ) выделяли из нижней части сосуда с выходом «l» % масс. в расчете на экстрагированный белок. Было установлено, что высушенный РММ-производный материал имеет концентрацию белка «m» % (N×6,25) d.b. (Процентное содержание азота определяли с использованием Leco FP528 Nitrogen Determinator). Полученному продукту был присвоен индекс «n».
В следующей ниже таблице I приведены значения параметров «а»-«n» для пяти изолятов РММ-производного канолового белка:
| Таблица I |
| n |
BW-AL017-B14-02A-C300 |
BW-AL017-В20-02А-С300 |
BW-AL017-D29-C300 |
BW-AL021-I24-02А-С300 |
BW-AL021-I30-02А-С300 |
| a |
150 |
150 |
150 |
150 |
150 |
| b |
1000 |
1000 |
1000 |
1000 |
1000 |
| с |
22,0 |
22,6 |
20,2 |
29,3 |
30,0 |
| d |
1000 |
1040 |
1040 |
1080 |
1080 |
| e |
15,4 |
15,3 |
14,6 |
20,8 |
19,2 |
| f |
600 |
500 |
1040 |
1080 |
1080 |
| g |
18 |
17 |
44 |
47,5 |
48,0 |
| h |
3000 |
3000 |
5000 |
5000 |
5000 |
| i |
289 |
236 |
225 |
311 |
218 |
| j |
31 |
32 |
30 |
24 |
19 |
| k |
1:15 |
1:15 |
1:15 |
1:15 |
1:15 |
| l |
19 |
22 |
29 |
35 |
20 |
| m |
105,8 |
102,9 |
103,2 |
105,4 |
103,0 |
Объем удаленной воды уменьшали ультрафильтрацией до концентрации белка «р» г/л с использованием мембраны с отсечением молекулярной массы «о» дальтон. Полученный концентрат сушили. С учетом дополнительного количества белка, выделенного из супернатанта, общий выход выделенного белка составил «q» % масс. Высушенный материал имел концентрацию белка «r» % масс. (N×6,25) d.b.
Продукту был присвоен индекс «s». Значения параметров «о»-«s» для пяти изолятов супернатант-производного канолового белка представлены в следующей ниже Таблице II:
| Таблица II |
| s |
BW-AL017-В14-02А-С200 |
BW-AL017-В20-02А-С200 |
BW-AL017-D29-C200 |
BW-AL021-I24-02А-С200 |
BW-AL021-I30-02А-С200 |
| о |
3000 |
3000 |
5000 |
5000 |
5000 |
| р |
60,8 |
57,8 |
121,8 |
78,0 |
68,1 |
| q |
31.0 |
33,0 |
45 |
49 |
33 |
| r |
97,8 |
103,6 |
100,8 |
103,7 |
97,8 |
Пример 2
В этом примере иллюстрируется анализ РММ-производных и супернатантпроизводных белковых изолятов Примера 1.
Cradi-Frac (Pharmacia Amercham) белковый сепаратор с 100 см колонкой и средой Sephacryl 300 HR (Sephacryl 300 HR представляет собой декстрановый полимер, сшитый с метилен бис-акриламидом, обеспечивающий разделение глобулярных белков размером 10000-1500000 дальтон) калибровали с использованием серии стандартов белкового происхождения для определения времени удерживания (RT) для каждого компонента, измеренного при длине волны 280 нм и скорости элюйрования 1,0 мл/мин. В качестве растворителя использовали солевой раствор с установленным значением рН, содержащий азид натрия в качестве противомикробного агента. Образцы элюента объемом 5 мл собирали в пробирки автоматического пробоотборника. Относительные содержания белка рассчитывали по площади пика, полученной умножением времени, соответствующего середине основания пика на высоту пика в точке максимума.
Разделение белков молекулярной массы 5000-700000 дальтон проводили на жидкостном хроматографе высокого давления Varian с использованием 300×7,8 мм BioSep S3000 вытеснительной хроматографической (SEC) колонки с твердым носителем, представляющим собой частицы гидрофильно связанного оксида кремния диаметром 5 мм и размером пор 290 Å, применяя те же BioRad белковые стандарты, что использовались для системы Gradi-Frae. BioRad белки охватывают интервал молекулярных масс от 17000 дальтон (миоглобулин) до 670000 дальтон (тироглобулин) при использовании витамина В12 в качестве низкомолекулярного маркера с массой 1350 дальтон. Определение каждого компонента проводили при 280 нм и скорости элюирования 1,0 мл/мин. В качестве растворителя в колонке и для растворения сухих образцов использовали солевой раствор с установленным значением рН, содержащий азид натрия в качестве противомикробного агента. После УФ детекции образцы элюента выбрасывали, поскольку для каждого опыта требовалось не более 50 мкл образца. С помощью системы HPLC Prostar производился автоматический расчет времен удерживания и площадей пиков, и полученные значения распечатывались в виде отчета.
Образцы изолятов РММ-производного и супернатантпроизводного канолового белка, полученные по методике Примера 1, соответствующие партиям BW-AL017-B14-02А-С300 и BW-AL017-B20-02A-C300, испытывали на каждой из колонок. Для каждого пика проводили преобразование подсчета площади пика в процентное содержание. Для расчета использовали все пики из различных опытов и затем в отдельности пересчитывали три основных белковых фракции, 12S, 7S и 2S.
Кроме этого, в определениях методами GPC и HPLC для расчета примерных молекулярных масс трех белковых фракций 12S, 7S и 2S использовали калибровочные кривые, полученные с использованием BioRad стандартов. Система Gradi-Frac более вариабельна, чем HPLC система, что связано с большим объемом пробы (1 мл против 25 микролитров) и большим диаметром колонки, вследствие чего расчеты результатов Gradi-Frac проводятся вручную и для них требуется большее время (25 минут для HPLC против 5 часов для Gradi-Frac). Кроме этого, в системе Gradi-Frac для расчета времени удерживания белка используется объем, тогда как в HPLC используется время.
Указанные отличия обусловливают вариацию данных, представленных в Таблицах III-IV. В статистическом отношении система HPLC лучше (меньшая дисперсность), чем система Gradi-Frac. В отличие от HPLC система Gradi-Frac не обеспечивает преимуществ в анализе индивидуальных образцов, подлежащих дополнительному анализу (например, методом масс-спектрометрии).
В следующей ниже таблице III представлены результаты, полученные для изолята РММ-производного канолового белка (CPI), а в таблице IV – для изолята супернатантпроизводного канолового белка (CPI).
| Таблица III |
| |
РММ-производный CPI |
HPLC GPC белковые соотношения |
| HPLC-SEC |
|
| Белок |
|
Белковые фракции |
% от всех пиков |
2, 7, 12S |
Другие |
Расчетные молекулярные массы |
| % |
% |
% |
% |
% |
% |
% от всех |
% от всех |
в килодальтонах |
| Тип |
Мука: |
№оп |
12S |
7S |
2S |
12S |
7S |
2S |
пиков |
пиков |
12S |
7S |
2S |
| |
| РРМ |
AL017 |
В14 |
6 |
94 |
0,1 |
6 |
92 |
0 |
98 |
2 |
341 |
147 |
12,1 |
| РРМ |
AL017 |
В20 |
6 |
94 |
0,1 |
6 |
92 |
0 |
98 |
2 |
342 |
146 |
11,5 |
| |
среднее |
6 |
94 |
0 |
6 |
92 |
0 |
98 |
2 |
342 |
146 |
11,8 |
| s.d. |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
0,4 |
| Gradi-Frac GPS |
|
| Бе-лок |
|
Белковые фракции |
% от всех пиков |
2, 7, 128 |
Другие |
Расчетные молекулярные массы |
| % |
% |
% |
% |
% |
% |
% от всех |
% от всех |
в килодальтонах |
| Тип |
Мука: |
№оп |
12S |
7S |
2S |
12S |
7S |
2S |
пиков |
пиков |
12S |
7S |
2S |
| |
| РРМ |
AL017 |
В14 |
8 |
82 |
9 |
8 |
82 |
9 |
99 |
1 |
354 |
152 |
8,7 |
| РРМ |
AL017 |
В20 |
9 |
89 |
2 |
9 |
88 |
2 |
99 |
1 |
403 |
163 |
8,6 |
| |
| |
среднее |
9 |
86 |
6 |
8 |
85 |
6 |
99 |
1 |
378 |
158 |
8,6 |
| s.d. |
0 |
5 |
5 |
0 |
5 |
5 |
0 |
0 |
35 |
8 |
0,0 |
| Расчеты молекулярных масс с использованием BioRad стандартов, содержащих животные белки |
| Таблица IV |
| |
Суперна-тант-производ-ный CPI |
HPLC GPC белковые соотношения |
| HPLC-SEC |
|
| Белок |
|
Белковые фракции |
% от всех пиков |
2, 7, 12S |
Другие |
Расчетные молекулярные массы |
| % |
% |
% |
% |
% |
% |
% от всех |
% от всех |
в килодальтонах |
| Тип |
Мука: |
№оп |
12S |
7S |
2S |
12S |
7S |
2S |
пиков |
пиков |
12S |
7S |
2S |
| |
| Суперна-тант |
AL017 |
В14 |
0 |
25 |
75 |
0 |
25 |
75 |
99 |
1 |
Нет |
126 |
13,9 |
| Суперна-тант |
AL017 |
В20 |
0 |
24 |
76 |
0 |
24 |
76 |
99 |
1 |
Нет |
135 |
15,2 |
| |
среднее |
0 |
24 |
76 |
0 |
24 |
75 |
99 |
1 |
|
130 |
14,5 |
| s.d. |
0 |
1 |
1 |
0 |
1 |
1 |
0 |
0 |
|
6 |
1,0 |
| Gradi-Frac GPS |
|
| Белок |
|
Белковые фракции |
% от всех пиков |
2, 7, 12S |
Другие |
Расчетные молекулярные массы |
| % |
% |
% |
% |
% |
% |
% от всех |
% от всех |
в килодальтонах |
| Тип |
Мука: |
№оп |
12S |
7S |
2S |
12S |
7S |
2S |
пиков |
пиков |
12S |
7S |
2S |
| |
| Суперна-тант |
AL017 |
В14 |
0 |
37 |
63 |
0 |
29 |
50 |
79 |
21 |
Нет |
147 |
10,6 |
| Суперна-тант |
AL017 |
В20 |
о |
37 |
63 |
0 |
27 |
46 |
73 |
27 |
Нет |
152 |
11,0 |
| |
| |
среднее |
о |
37 |
63 |
0 |
28 |
48 |
76 |
24 |
|
150 |
10,8 |
| s.d. |
о |
0 |
0 |
0 |
1 |
3 |
4 |
4 |
|
4 |
0,3 |
| Расчеты молекулярных масс с использованием BioRad стандартов, содержащих животные белки |
Как видно из данных, представленных в Таблице III, РММ-производные образцы содержат большое количество 7S белка и небольшие количества белков 2S и 12S.
Из данных, приведенных в Таблице IV, следует, что в изоляте супернатантпроизводного канолового белка отсутствует белок 12S и преобладает белок 2S, а также содержатся небольшие количества белка 7S.
Молекулярные массы, рассчитанные по данным HPLC ниже для белков 12S и 7S, но выше для белка 2S. Явные расхождения могут быть частично приписаны трудности точного определения высот пиков в GPC экспериментах, которое проводилось вручную.
Рассчитанная по данным GPC молекулярная масса 12S, равная 385000 дальтон выше литературного (справочного) значения для канолового круциферина, составляющего 300000-310000 дальтон. Рассчитанные по данным GPC и HPLC молекулярные массы 7S имеют близкие значения и соответствуют литературному значению 150000 дальтон. Рассчитанное по данным HPLC значения для 2S выше, чем среднее GPC значение и обе величины меньше литературного значения для напина, равного 14000 дальтон.
Как следует из приведенных данных, изоляты РММ-производного канолового белка в тестированных образцах содержат 7S фракцию в количестве 82-89% (по данным GPC) и 94% (по данным HPLC). Как отмечалось выше, методика HPLC является более быстрой и точной, чем методика GPC. В расчете на значения площадей для трех белковых фракций, можно считать, что РММ-производные образцы содержат:
около 88-98% масс. 7S белка
около 1-10% масс. 12S белка
около 0-6% масс. 2S белка
Аналогичным образом, в расчете на значения площадей трех белковых фракций можно считать, что супернатантпроизводные образцы содержат:
около 70-95% масс. 2S белка
около 5-30% масс. 7S белка
около 0-2% масс. 12S белка
Используемый термин «белковая фракция» определяется, как площадь пика, со временем удерживания в анализе методом HPLC (или GPC), соответствующая рассчитанным молекулярным массам в указанных выше интервалах, в соответствии с такими принятыми для GPC/HPLC стандартами, как материалы от BioRad. Такие пики могут содержать другие компоненты, но, если они соответствуют приведенным интервалам целевых молекулярных масс, ими можно пренебречь.
С учетом информации, содержащейся в настоящем примере, приемлемые молекулярные массы имеют следующие значения:
12S: 300000-360000 дальтон
7S: 125000-160000 дальтон
2S: 9000-15 000 дальтон
Пример 3:
В этом примере показано влияние некоторых параметров на процесс экстракции.
В первой серии экспериментов 50 г образцы каноловой муки, подвергнутой термообработке (LT мука) при 100°С для удаления оставшегося растворителя, добавляли в 500 мл образцы 0,05-0,10 М раствора NaCl при комнатной температуре (20°С) и полученную смесь перемешивали в течение 15 минут. Суспензию центрифугировали при 5000g в течение 10 минут с целью экстракции, в результате чего получали отработанную муку.
Во второй экспериментальной серии 500 мл воды, не содержащей соли, вначале нагревали до 60°С на перемешивающем устройстве с нагревательной панелью, после чего добавляли 50 г каноловой муки, подвергнутой температурной обработке при 100°С для удаления остаточного растворителя и полученную смесь перемешивали в течение 15 минут при постоянной температуре. Экстракт отделяли от отработанной муки центрифугированием при 5000g в течение 10 минут.
Концентрации белка в различных водных растворах, полученных в этих экспериментах, представлены в следующей Таблице V:
Таблица V
Концентрации белка в экстрактах (% масс.) |
| |
0,05 М солевой раствор |
0,10 М солевой раствор |
Вода при 60°С |
| Мука LT |
1,11 |
1,44 |
0,98 |
Экстрагируемость белка из образцов муки определяли по концентрациям белка, приведенным в Таблице V; полученные результаты приведены в Таблице VI:
Таблица VI
Экстрагируемость белков (% масс.)* |
| |
0,05 М солевой раствор |
0,10 М солевой раствор |
Вода при 60°С |
| Мука LT |
28,6 |
37,4 |
25,5 |
| * определено, как процентное количество экстрагированного белка в расчете на его общее содержание в муке. |
Образцы экстрактов, полученных по методике настоящего примера, анализировали на HPLC и SEC колонках, описанных в Примере 2. Площадь каждого пика преобразовывали в процентное количество. Рассчитывались все экспериментальные пики и затем по отдельности пересчитывались три основных белковых фракции 12S, 7S и 2S.
Полученные результаты графически представлены на фигурах 2-4.
На каждой хроматограмме присутствует отчетливый пик, соответствующий фракции 7S канолового белка и небольшой «горб», соответствующий фракции 12S канолового белка. Среди пиков других компонентов экстракта присутствует пик фракции 2S канолового белка. Пики в области малых молекулярных масс не были точно идентифицированы, но предположительно они соответствуют небелковым азотистым соединениям, например, коротким пептидам и свободным аминокислотам, а также других компонентам муки, например фенольным соединениям, глюкозинолятам и фитатам.
Пример 4:
В этом примере показан анализ образцов изолятов канолового белка.
Методом гельпроникающей хроматографии, описанной в примере 2, анализировались высушенные распылением образцы изолятов канолового белка из партий BW-AL017-D29-C200 и BW-AL017-D29-C300, описанных в примере 1, которые были получены с использованием четырех белковых фракций, обозначенных, как 2S, >2S, 7S и 12S, где фракции 2S и, возможно, >2S относятся к мелким, вводно-растворимым альбуминам, а 7S и 12S – к более гидрофобным глобулинам, менее растворимым в воде.
Эти фракции и образцы после мягкой кислотной обработки анализировали методом MALDI масс-спектроскопии и при этом были получены следующие результаты:
2S фракция:
Методом MALDI-MS была определена молекулярная масс около 14000 дальтон. Пик близкого диапазона наблюдался в области расщепления вершины пика, причем максимальный пик соответствовал массам 13960-14259 дальтон, что соответствует различию в 2-3 аминокислоты, что свидетельствует о присутствии разных белковых изоэнзимов.
При 24-часовой обработке 2S фракции 5% раствором уксусной кислоты не было обнаружено полипептидов с массами менее 8000 дальтон, что свидетельствует об устойчивости 2S белка в мягких кислотных условиях.
Фракция >2S:
При MS сканировании указанного материала было установлено наличие небольшого пика, соответствующего массе 13950-13990 дальтон, отнесенного к 2S белку и основного пика, соответствующего массе 13380-13410 дальтон неизвестного происхождения. Фракция также содержала значительный, но менее интенсивный пик, соответствующий массе 17160-17260 дальтон также неизвестной природы.
В результате 24-часовой мягкой кислотной обработки последней фракции 5% раствором уксусной кислоты уменьшался только пик, соответствующий 13400 дальтон и при этом появлялись небольшие пики, соответствующие компонентам с массой 7000-8000 дальтон, которые возможно являются продуктами гидролиза. Пик соответствующий 2S оставался без изменений.
7S фракция:
При MS сканировании указанного материала было установлено, что наиболее значительный пик соответствует массе 48150-49950 дальтон, с основным пиком 48400±100 дальтон. Менее интенсивный и уширенный пик имел два максимума 95940 и 87510 дальтон, соответственно, что свидетельствует о наличии небольшого количества белка, содержащего две субъединицы. Анализ по методике Примера 2 подтвердил значение молекулярной массы 15000 дальтон для 7S белка, тогда как согласно MALDI анализу была определена несколько меньшая масса около 145000 дальтон.
В области основного пика фракции >2S зарегистрирован побочный компонент с массой 13420 дальтон, а не 14000 дальтон. Основной триплетный пик соответствует массе в интервале 16975-17905 дальтон. Такие пики могут быть отнесены к основному полипептиду в белковой субъединице и они зарегистрированы во фракции >2S, но отсутствуют во фракции 2S.
В результате 24 часовой кислотной обработки фракции 7S 1% раствором уксусной кислоты было установлено, что основной пик с массой 48300 остается без изменения и появляется пик меньшей массы порядка 47500 дальтон (возможно в связи с потерей небольшого полипептида). Появляются новые пики, соответствующие массам 16310, 22710 и 24070 дальтон, вероятно относящиеся к продуктам гидролиза.
Фракцию 7S подвергали дополнительной обработке 20% раствором муравьиной кислоты. Сканирование проводилось после одночасовой обработки и далее после 3-дневного воздействия муравьиной кислоты.
После одночасового воздействия были зарегистрированы новые пики, соответствующие массе 26300 дальтон, а после обработки 5% уксусной кислотой появлялись другие пики. Трехдневное воздействие приводило к уменьшению интенсивности пика основной субъединицы (48260 дальтон) при росте интенсивности основных пиков, соответствующих массам 16316 и 17850 дальтон.
В результате сканирования области ниже 9000 дальтон была обнаружена характерная картина из шести пиков соответствующих массам 4490, 5720, 6530, 7030 и 7330 дальтон, хотя пик, соответствующий массе 4490 дальтон, значительно увеличивался к третьему дню.
Фракция 12S:
MALDI-MS анализ фракции 12S позволил установить наличие пика с центром в области 48150-48200 дальтон, относящегося к основной белковой субъединице. Появляется основной пик с массой 94260 дальтон и пики меньшей интенсивности с массами 64620, 77540, 126990 и 143280 дальтон. Пики больших молекулярных масс имеют низкое разрешение и их действительные молекулярные массы могут быть определены только приблизительно. Другие основные пики имеют массу, соответствующую двум молекулярным массам субъединицы, тогда как пик 143200 дальтон близок к утроенной массе субъединицы.
Другие заметные пики, соответствующие массам 13400, 16400, 17900, 29000 и 29700 дальтон, могут быть отнесены к полипептидам, достраивающим белковые субъединицы.
В результате 24-часовой кислотной обработки 5% раствором уксусной кислоты обнаруживается белковый профиль практически идентичный профилю 7S фракции. Трехдневная обработка 20% муравьиной кислотой приводит к потере основной субъединицы с массой 48100 дальтон и увеличению в области молекулярных масс порядка 17900 дальтон.
Сканирование области ниже 9000 дальтон почти идентично результатам одночасового гидролиза фракции 7S 20% муравьиной кислотой и обнаруживает наличие пиков, соответствующих массам 4480, 5730, 6510, 6650, 7020 и 7310 дальтон. В отличие от результатов, полученных с использованием 7S фракции, на третий день обработки муравьиной кислотой не наблюдается существенного увеличения интенсивности пика, соответствующего массе 4480 дальтон.
На основании результатов MALDI-MS анализа, приведенных в настоящем Примере, можно сделать следующие выводы:
(a) 2S белок имеет молекулярную массу в интервале 13960-14250 дальтон, что согласуется с литературным значением 14000 дальтон, и полностью устойчив к мягкой кислотной обработке.
(b) белки 7S и 12S состоят из одинаковых строительных блоков с основной субъединицей размером 42800-48400 дальтон. Белок 7S имеет молекулярную массу, соответствующую трем субъединицам или 145000 дальтон, а белок 12S содержит 6 субъединиц с общей молекулярной массой 290000 дальтон. Эти значения ниже величин, рассчитанных из данных GPL и HPLC SEC в примере 2, однако в этих расчетах использовались стандарты животного происхождения.
(c) Кислотный гидролиз 7S и 12S белков не приводит к образованию белка 2S.
(d) В результате кислотного гидролиза двух указанных глобулярных белков были получены идентичные результаты, что подтверждает их образование из одинаковых субъединиц.
Пример 5:
Этот пример иллюстрирует применение препаративной жидкостной хроматографии высокого давления (HPLC).
Разделение каноловых белков проводили на препаративном жидкостном хроматографе высокого давления Varian, снабженном основной вытеснительной хроматографической колонкой Phenomenex BioSep S3000 size размером 3000×21,20 мм, содержащей твердый носитель на основе гидрофильно-связанного оксида кремния с частицами диаметром 5 микрон и размером пор 290 Å. Перед основной колонкой размещена предколонка размером 60×21,20 мм, содержащая такой же наполнитель.
Каждый аналит подвергали мониторингу при 280 нм при скорости элюирования 6-8 мл/мин. При таких расходах не превышается верхний предел давления колонки, равный 1000 фунт/дюйм2. Солевой раствор, содержащий азид натрия в качестве противомикробного агента, использовали в качестве подвижной фазы, а также для растворения образцов сухого канолового белка. Элюент собирали в коллектор фракций Varian Model 701. В зависимости от образца время определения составляло 12-15 минут.
Объем вводимой пробы составлял 1,0-1,5 мл при концентрации образца 2,0-3,0% в расчете на сухую массу белкового изолята, что соответствует 20-45 мг твердого материала в пробе. В зависимости от типа образца и его концентрации максимальная емкость колонки может составлять 1,5 мл. Некоторые препараты перемешивали в течение не менее 30 минут перед 20-минутным центрифугированием со скоростью 10000 об/мин. Затем супернатант подвергали вакуумной фильтрации через мембранный диск толщиной не менее 0,45 микрон.
Хотя система может непрерывно функционировать в течение 24 часов, обычно она эксплуатируется в течение меньшего времени, поскольку для удаления загрязнений с колонки требуется ежедневная очистка смесью ацетонитрила с водой. Даже при этих условиях ежедневно можно проводить 80-100 определений со сбором аналита в количестве 0,5-1,2 г.
Использовали следующие образцы, полученные по методике Примера 1 из изолятов РММ-производного и супернатантпроизводного канолового белка: BW-AL-017-D29-02A-C200, BW-AL-021-I24-02A-C200, BW-AL-021-I30-02A-C200, BW-AL-017-D29-02А-С300, BW-AL-021-I24-02A-C300 и BW-AL-021-I30-02A-C300.
РММ-производные (С300) образцы использовали для сбора белков 7S и 12S, тогда как супернатантпроизводные (С200) образцы использовались преимущественно для сбора белка 2S. Чистоту аликвот полученных фракций определяли на приборе Varian Analytical SEC-HPLC. Уровень содержания белка обычно составлял менее 0,3% масс. (N×6,26) или менее 2,0 единиц оптического поглощения при длине волны 280 нм, а содержание соли, определенное по электропроводности, обычно составляло 0,5-0,7% масс. NaCl.
Пример 6:
В этом примере иллюстрируется ультрафильтрация и диализ фракций, собранных в Примере 1.
Ультрафильтрация с последующим диализом использовалась для уменьшения объема элюента и высокого соотношения соль:белок. Разбавленный элюент, полученный с использованием препаративной HPLC системы Varian, описанной в Примере 5, подвергали концентрированию в двух ультрафильтрационных устройствах со смесительными ячейками Amicon Series 8000, максимальная номинальная емкость каждого из которых составляла 400 мл.
Каждое устройство снабжено 76 мм мембраной с определенным отсечением молекулярной массы. Мембраны, используемые для белка 2S, включали: Ultracel Amicon Ymi UF диски из регенерированной целлюлозы, 1000 NMWL (предельная номинальная молекулярная масса), #13342 и Ultracel Amicon YM10 UF диски из регенерированной целлюлозы, 10000 NMWL, #13642.
Для более крупных глобулярных белков 7S и 12S использовали мембраны с более высоким NMWL: Biomax PBQK UF диски из полиэтиленсульфона (PES), 50000 NMWL, #PDQ 07610, или Biomax PBHK UF диски из PES, 100000 NMWL, #РВНК 07610.
При использовании мембран с более высоким NMWL происходят небольшие потери удерживаемого белка, обозначаемого, как ретентат, но при этом могут быть удалены низкомолекулярные примеси, слабосвязанные с белком. Более высокие значения NMWL отсечения уменьшают время работы UF мембран. Типичное время обработки 1200 мл HPLC образца на двух UF системах составляет 4-5 часов.
В типичном опыте образец помещали в каждую установку до отметки 325 мл. В ходе перемешивания уровни поднимались до отметки 375 мл. Установки герметизировали и при перемешивании образцов повышали давление до 60 фунт/дюйм2. При уменьшении уровня ретентата внутри установки до 100 мл, давление сбрасывали и в каждую установку вводили дополнительное количество образца. Процесс продолжали до добавления всего образца. Конечный ретентат концентрировали до объема в каждой ячейке 75-100 мл.
Элюент, называемый пермеатом, выводили из каждого устройства и по электропроводности определяли содержание соли, а содержание белка определяли по поглощению при 280 нм с использованием 1 см ячейки UV-Visible UltraSpec 1000E спектрофотометра. Рассчитывали массовый баланс для получения информации об эффективности UF мембран. Чистоту образцов UF пермеата и конечного ретентата определяли методом аналитической SEC-HPLC по методике Примера 2.
Ультрафильтрационный ретентат выливали на диализные мембраны Spectra/Por, 1000 MWCO (отсечка молекулярной массы), диаметром 24,2 мм, #132104. Каждый кусочек трубки обрезали до 300 мм. Заполненные мембраны помещали в закрытые 4-литровые бутыли с RO водой. RO воду дважды заменяли перед удалением диализированных образцов из трубок и их помещением в чаши для замораживания до -65°С. По данным электропроводности конечная соленость составляла 0,1% масс.
После этого замороженные образцы помещали в сублимационную сушилку Virtis SRCX-15. Время сушки может меняться в зависимости от содержания воды. Перед проведением анализа высушенные образцы вынимали из чаш и взвешивали.
Пример 7:
В этом примере описывается аминокислотный анализ.
После ультрафильтрации, диализа и сублимационной сушки, индивидуальные образцы каноловых белков 2S, 7S и 12S, полученные по методикам примеров 5 и 6, анализировали на содержание аминокислот. Образец 2S был получен из изолята канолового белка AL021-I30-02A С2000, тогда как белки 7S и 12S были получены из изолята канолового белка AL017-D29-02A С3000.
Результаты аминокислотного анализа представлены в следующей ниже Таблице VII:
| Таблица VII |
| г/100 г сухого вещества |
| ММ Аминокислоты (1) |
Аминокислота |
AL021-I30-02A 2S |
AL017-D29-02A 7S |
AL017-D29-02A 12S |
| 133,1 |
Аспартамовая |
3,18 |
11,60 |
3,02 |
| 119,1 |
Треонин |
2,70 |
3,34 |
1,00 |
| 105,1 |
Серин |
3,84 |
4,52 |
1,23 |
| 204,2 |
Триптофан |
1,16 |
1,42 |
0,40 |
| 146,1 |
Глутаминовая |
25,10 |
21,50 |
5,91 |
| 75,1 |
Глицин |
3,91 |
5,44 |
1,45 |
| 89,1 |
Аланин |
3,67 |
4,47 |
1,18 |
| 121,1 |
Цистеин |
4,13 |
1,19 |
0,34 |
| 117,1 |
Валин |
4,02 |
5,92 |
1,55 |
| 149,2 |
Метионин |
2,55 |
1,74 |
0,41 |
| 131,2 |
Изолейцин |
2,89 |
5,12 |
1,31 |
| 131,2 |
Лейцин |
6,13 |
8,70 |
2,31 |
| 181,2 |
Тирозин |
1,14 |
2,67 |
0,70 |
| 165,2 |
Фенилаланин |
2,43 |
5.01 |
1,28 |
| 155,2 |
Гистидин |
2,58 |
1,60 |
0,46 |
| 146,2 |
Лизин |
5,92 |
3.17 |
0,88 |
| 174,2 |
Аргинин |
5,99 |
8,02 |
2,13 |
| 115,1 |
Пролин |
9,02 |
5,83 |
1,68 |
| |
Сумма: |
90,36 |
101,26 |
27,24 |
| Avg.aaMW(l) |
134,61 |
134,86 |
134,77 |
| Безводный MW(2) |
116,59 |
116,85 |
116,75 |
Примечания: (1): Молекулярная масса «свободных» аминокислот.
(2): Средневесовая молекулярная масса полимерных аминокислот.
Значения, представленные в Таблице VII, относятся к количеству аминокислот в граммах на 100 г сухого вещества. Образец 12S содержал остаточную соль даже после ультрафильтрации, вследствие чего образец содержал меньшие количества аминокислот по сравнению с образцами 7S и 12S. Полученные результаты были пересчитаны на 100 г аминокислоты и такие данные представлены в следующей Таблице VIII:
| Таблица VIII |
| Суммарное количество аминокислот: г/100 г аминокислот |
| Гидрофобность: Гиббс: кДж/100 г |
Аминокислота |
AL021-I30-02А 2S |
AL017-D29-02А 7S |
AL017-D29-02А 12S |
| – |
Аспарагиновая* |
3,5 |
11,5 |
11,1 |
| 1,40 |
Треонинe |
3,0 |
3,3 |
3,7 |
| – |
Серин |
4,2 |
4,5 |
4,5 |
| 6,96 |
Триптофанe |
1,3 |
1,4 |
1,5 |
| – |
Глутаминовая* |
27,8 |
21,2 |
21,7 |
| – |
Глицин |
4,3 |
5,4 |
5,3 |
| 2,35 |
Аланин |
4,1 |
4,4 |
4,3 |
| 3,45 |
Цистинe |
4,6 |
1,2 |
1,2 |
| 5,35 |
Валинe |
4,4 |
5,8 |
5,7 |
| 3,64 |
Метионинe |
2,8 |
1,7 |
1,5 |
| 9,56 |
Изолейцинe |
3,2 |
5,1 |
4,8 |
| 7,32 |
Лейцинe |
6,8 |
8,6 |
8,5 |
| 5,30 |
Тирозин |
1,3 |
2,6 |
2,6 |
| 6,33 |
Фенилаланинe |
2,7 |
4,9 |
4,7 |
| 1,35 |
Гистидинe |
2,9 |
1,6 |
1,7 |
| – |
Лизинe |
6,6 |
3,1 |
3,2 |
| – |
Аргининe |
6,6 |
7,9 |
7,8 |
| 9,44 |
Пролин |
10,0 |
5,8 |
6,2 |
| |
Сумма: |
100,0 |
100,0 |
100,0 |
| Сумма необходимых аа: |
44,8 |
44,7 |
44,3 |
| Гидрофобность аа, % |
46,9 |
46,4 |
46,3 |
| Гидрофоб. кДж/100 г |
274,5 |
279.3 |
277,7 |
е=11 необходимых аминокислот, аа=аминокислоты.
* Глютаминовая кислота и аспарагиновая кислота в основном амидированы до глютамина и аспарагина.
Как можно видеть из Таблицы VIII, альбуминовый 2S белок отличается от глобулярных белков 7S и 12S относительным содержанием различных аминокислот. Основные различия связаны с содержанием аспарагиновой кислоты, глютаминовой кислоты, цистеина, лизина и пролина, хотя также отличаются и содержания большинства других перечисленных аминокислот. Аминокислотные профили белков 7S и 12S практически идентичны в рамках ошибок определений в данном анализе. Указанные количества глютаминовой кислоты даны с учетом глютамина, а содержания аспарагиновой кислоты – с учетом аспарагина. Глютамин и аспарагин дезаминируются в ходе кислотного гидролиза, что приводит к детекции соответствующих аминокислот в ходе анализа.
В Таблице VII приведены молекулярные массы индивидуальных аминокислот. В Таблице приведены индивидуальные количества и средние молекулярные массы «свободных» аминокислот для белков 2S, 7S и 12S, имеющие значения ниже 135 дальтон. Также приведены безводные средневзвешенные молекулярные массы, поскольку белки представляют собой биополимеры безводных аминокислот (без молекулы воды и исключая одну концевую аминокислоту в расчете на полипептид). Несмотря на различия между двумя такими разновидностями белков средние молекулярные массы полимерной аминокислоты имеют почти одинаковое значение, близкое к 117 дальтон. Это означает, что 2S с молекулярной массой 14 кДа, определенной методом MALDI-MS, должен состоять примерно из 120 аминокислот, 7S с определенной методом MALDI-MS молекулярной массой 145 кДа, должен содержать примерно 1240 аминокислот, а 12S должен содержать удвоенное количество, т.е. 2480 аминокислот. Каждая 7S/12S субъединица содержит около 413 аминокислот.
В Таблице VIII указаны незаменимые аминокислоты, которые не могут быть синтезированы человеком. Белки обоих типов имеют очень близкое общее содержание одиннадцати незаменимых аминокислот. Недостаток в одной аминокислоте компенсируется повышенным количеством другой незаменимой аминокислоты. Содержание лизина в белке 2S почти вдвое превосходит его содержание в 7S и 12S. Однако глобулярные белки содержат повышенные количества таких незаменимых ароматических аминокислот, как тирозин и фенилаланин, и более высокие количества незаменимых алифатических гидрофобных аминокислот, за исключением метионина и цистеина.
Значения гидрофобности аминокислот, приведенные в Таблице VIII, определялись с использованием величин свободной энергии Гиббса, выраженной в кДж на 100 г аминокислоты. Значения свободной энергии Гиббса взяты из Food Chemistry, 3rd ed., edited by Owen Fennema, Marcel Dekker, New York, 1996, р.330. Два типа белков с различной гидрофобностью несущественно отличаются по суммарным массам и суммарной энергии, при этом гидрофобность также зависит от структурной ориентации полипептидов, но не зависит от химических свойств индивидуальных аминокислот. Согласно обзору Mieth et al., посвященному рапсовым белкам (см. Таблицу IX), глобулярные белки имеют изоэлектрическую точку, близкую к нейтральному значению рН (7,2), тогда как 2S имеет изоэлектрическую точку выше рН 9,0. 2S имеет очень небольшую молекулярную массу, тогда как белки 7S и 12S имеют значительно большую молекулярную массу и могут содержать большее количество потенциально гидрофобных внутренних участков, устойчивых к гидратации водой.
Аминокислотный состав может быть превращен в последовательность аминокислотных остатков с использованием оценки числа аминокислотных остатков в биополимере. Как отмечалось выше, согласно MALDI-MS анализу 2S содержит примерно 120 аминокислотных остатков, тогда как 7S содержит около 1240, а 12S около 2480 остатков.
В следующей ниже Таблице IX представленные выше результаты аминокислотного анализа трансформированы в аминокислотный состав для 2S и приведены результаты сравнения с соответствующими опубликованными интервалами содержания аминокислот.
| Таблица IX |
Сравнение аминокислотных остатков в белке 2S с литературными значениями
Значения по аминокислотным остаткам |
| Аминокислота |
AL021-I30-02A 2S |
2S@ 120аа |
2S литр, интервал1 |
2S литр, интервал2 |
| Аспарагиновая |
3,4 |
4 |
2-5 |
2 |
| Треонинe |
3,2 |
4 |
3-4 |
4 |
| Серин |
5,2 |
6 |
4-7 |
6-7 |
| Триптофанe |
0,8 |
1 |
1-2 |
1 |
| Глютаминовая |
24,6 |
29 |
27-32 |
29-34 |
| Глицин |
7,4 |
9 |
6-10 |
7-9 |
| Аланин |
5,9 |
7 |
6-7 |
6-8 |
| Цистинe |
4,9 |
6 |
8 |
7-8 |
| Валинe |
4,9 |
6 |
5-7 |
6-7 |
| Метионинe |
2,4 |
3 |
1-3 |
2-3 |
| Изолейцинe |
3,2 |
4 |
4-7 |
4 |
| Лейцинe |
6,7 |
8 |
7-9 |
8-9 |
| Тирозин |
0,9 |
1 |
1-2 |
1 |
| Фенилаланинe |
2,1 |
3 |
3-5 |
2-3 |
| Гистидинe |
2,4 |
3 |
3-4 |
3-4 |
| Лизинe |
5,8 |
7 |
5-9 |
6-9 |
| Аргининe |
4,9 |
6 |
5-8 |
4-6 |
| Пролин |
11,2 |
13 |
13-14 |
12-15 |
| Сумма: |
100,0 |
120 |
114-126 |
110-133 |
е=11 незаменимых аминокислот, аа=аминокислоты.
Согласно данным MALDI-MS молекулярная масса 2S составляет около 14000 дальтон, или 120 полимерных аминокислот.
* Глютаминовая и аспарагиновая кислоты в основном находятся в амидированном состоянии.
1Monslve et al., J. Experimental Botany, vol.41, #222, pp.89-94, January 1990. 2 Mieth et al., Die Nahrung, 27,7, 1983, pp.675-697.
Приведенные выше преобразованные данные очень хорошо согласуются с литературными данными. В недавно опубликованных работах Monslave et al. (1990, Таблица IX), а также работах Gehrig et al., Proc. Natl. Acad. Sci. USA, vol.93, pp.3647-3652, April, 1996 и Ericson et al., J.Biological Chem., vol.261, #31, pp.14576-14581, Nov.1986 приведена подробная информация, касающаяся белка 2S и молекулы предшественника, про-напина, а также данные аминокислотного анализа.
Содержания индивидуальных аминокислот соответствуют опубликованным интервалам, приведенным в Таблице IX. Указанные интервальные значения могут быть связаны с вариациями, касающимися разновидностей рапса, а также с гидролитическими потерями при проведении эксперимента.
Хотя опубликовано значительно меньше данных, касающихся круциферина (12S), все, что известно о глобулярных каноловых белках, хорошо согласуется с данными настоящей работы. В Таблице Х представлена трансформация результатов аминокислотного анализа в данные по аминокислотным остаткам и проведено сравнение с опубликованными интервалами значения для белков 12S.
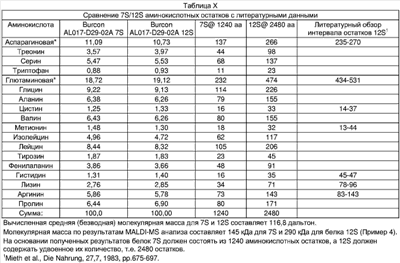
Опубликованная информация содержится в обзоре Mieth et al., 1983, касающемся рапсовых белков. В этом обзоре приводятся интервалы конкретных аминокислотных остатков. Как показано выше, данные представленные в настоящем документе в основном согласуются с опубликованными интервалами.
Авторы (Mieth et al.) указывают, что молекула 12S содержит 6 основных субъединиц, каждая из которых состоит из двух полипептидов с молекулярными массами 18000 и 31000 дальтон. Эти данные также согласуются с результатами MALDI-MS, представленными в Примере 4.
Резюме изобретения
Настоящее изобретение предусматривает новые составы изолята канолового белка с уникальным профилем 2S, 7S и 12S белков, а также индивидуальные выделенные и очищенные белки. Область изобретения охватывает возможные модификации.
Формула изобретения
1. Выделенный и очищенный 7S белок канолы, аминокислотный анализ которого соответствует следующему, г/100 г сухого вещества:
| Аспарагиновая кислота |
11,60 |
| Треонин |
3,34 |
| Серин |
4,52 |
| Триптофан |
1,42 |
| Глутаминовая кислота |
21,50 |
| Глицин |
5,44 |
| Аланин |
4,47 |
| Цистеин |
1,19 |
| Валин |
5,92 |
| Метионин |
1,74 |
| Изолейцин |
5,12 |
| Лейцин |
8,70 |
| Тирозин |
2,67 |
| Фенилаланин |
5,01 |
| Гистидин |
1,60 |
| Лизин |
3,17 |
| Аргинин |
8,02 |
| Пролин |
5,83 |
или (в г/100 г аминокислот):
| Аспарагиновая кислота |
|
| (в основном амидированная до аспарагина) |
11,5 |
| Треонин |
3,3 |
| Серин |
4,5 |
| Триптофан |
1,4 |
| Глутаминовая кислота |
|
| (в основном амидированная до глутамина) |
21,2 |
| Глицин |
5,4 |
| Аланин |
4,4 |
| Цистеин |
1,2 |
| Валин |
5,8 |
| Метионин |
1,7 |
| Изолейцин |
5,1 |
| Лейцин |
8,6 |
| Тирозин |
2,6 |
| Фенилаланин |
4,9 |
| Гистидин |
1,6 |
| Лизин |
3,1 |
| Аргинин |
7,9 |
| Пролин |
5,8 |
2. Белок по п.1 с молекулярной массой, определенной методом MALDI-MS, около 145 кДа.
3. Белок по п.2, состоящий из трех субъединиц, каждая из которых содержит примерно 413 аминокислот.
4. Белок по любому из пп.1-3, который выделяют и очищают из белковой мицеллярной массы канолового белка.
5. Белок по п.4, отличающийся тем, что указанная белковая мицеллярная масса образуется в результате разбавления концентрированного солевого раствора канолового белка, экстрагированного из каноловой муки в мягких кислотных условиях.
6. Композиция, отличающаяся тем, что она содержит смесь из выделенного и очищенного 7S канолового белка по любому из пп.1-5 и, по меньшей мере, одного дополнительного выделенного и очищенного канолового белка, выбранного из группы, состоящей из 2S и 12S каноловых белков.
7. Способ выделения и очистки индивидуального канолового белка из изолята канолового белка, содержащего смесь, по меньшей мере, двух различных каноловых белков, выбранных из группы, состоящей из 2S, 7S по любому из пп.1-5 и 12S белков, отличающийся тем, что он включает следующие стадии:
получение указанного изолята канолового белка, содержащего белок в количестве, по меньшей мере, 90 мас.%, предпочтительно, по меньшей мере, 100 мас.% в расчете на сухое вещество, в соответствии с пересчетом на азот по Кельдалю N×6,25,
растворение изолята канолового белка,
разделение полученного белкового раствора по молекулярным массам методом препаративной жидкостной хроматографии высокого давления или эквивалентным методом,
сбор фракций элюата, содержащих индивидуальный выбранный каноловый белок,
ультрафильтрацию отобранных фракций с целью уменьшения объема элюата,
диализ концентрированного элюата для удаления растворяющего материала, и
сушку диализата с целью регенерации индивидуального канолового белка.
8. Способ по п.7, отличающийся тем, что указанный изолят канолового белка имеет следующий профиль распределения белков:
60-98 мас.% белка 7S
1-15 мас.% белка 12S, и
0-25 мас.% белка 2S, предпочтительно
88-98 мас.% белка 7S,
1-10 мас.% белка 12S, и
0-6 мас.% белка 2S,
и его подвергают обработке с целью выделения и очистки 7S и/или 12S белка.
9. Способ по п.7 или 8, отличающийся тем, что указанный изолят канолового белка имеет следующий профиль распределения белков:
60-95 мас.% белка 2S,
5-30 мас.% белка 7S и
0-2 мас.% белка 12S, предпочтительно
70-95 мас.% белка 2S,
5-30 мас.% белка 7S,
0-2 мас.% белка 12S,
и его подвергают обработке с целью выделения и очистки 2S белка.
РИСУНКИ
|
|