|
|
(21), (22) Заявка: 2007115916/28, 22.09.2005
(24) Дата начала отсчета срока действия патента:
22.09.2005
(30) Конвенционный приоритет:
27.09.2004 JP 2004-279864
31.08.2005 JP 2005-252270
(46) Опубликовано: 10.01.2009
(56) Список документов, цитированных в отчете о
поиске:
WO 02/094342 A2, 21.04.2002. WO 02/011695 A2, 14.02.2002. WO 02/013860 A, 21.02.2002. JP 2002248171 A, 03.09.2002. RU 2175866 C2, 20.11.2001. RU 2179037 С2, 10.02.2002.
(85) Дата перевода заявки PCT на национальную фазу:
27.04.2007
(86) Заявка PCT:
JP 2005/018070 (22.09.2005)
(87) Публикация PCT:
WO 2006/035923 (06.04.2006)
Адрес для переписки:
129090, Москва, ул. Б.Спасская, 25, стр.3, ООО “Юридическая фирма Городисский и Партнеры”, пат.пов. А.В.Миц
|
(72) Автор(ы):
МАСАДА Йохеи (JP),
СУГИТА Масару (JP),
КАНЕКО Хидеки (JP),
МИЯЗАКИ Такеси (JP)
(73) Патентообладатель(и):
КЭНОН КАБУСИКИ КАЙСЯ (JP)
|
(54) ЭЖЕКТИРУЕМАЯ ЖИДКОСТЬ, СПОСОБ ЭЖЕКЦИИ, СПОСОБ ФОРМИРОВАНИЯ КАПЕЛЕК ЖИДКОСТИ, КАССЕТА ДЛЯ ЭЖЕКЦИИ ЖИДКОСТИ И ЭЖЕКЦИОННОЕ УСТРОЙСТВО
(57) Реферат:
Изобретение относится к области медицины и направлено на обеспечение стабильности регулируемого выбрасывания белкового раствора или пептида с получением желаемого объема микрокапли. Этот результат обеспечивается за счет того, что предлагается эжекционная жидкость, способная к стабильной эжекции при помощи устройства, использующего термическую энергию. Эта жидкость содержит, по меньшей мере, одно вещество, выбранное из группы, состоящей из белков и пептидов. Возможность применения жидкости в чернильно-струйном устройстве, использующем термическую энергию, улучшается добавлением, по меньшей мере, одного вещества, выбранного из группы, состоящей из аминокислот и их солей, и поверхностно-активного вещества к водному раствору, содержащему, по меньшей мере, одно вещество, выбранное из группы, состоящей из белков и пептидов. 5 н. и 9 з.п. ф-лы, 9 ил., 2 табл.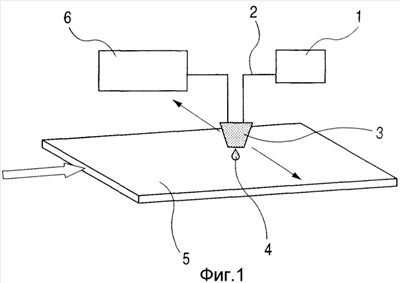
Область техники
Настоящее изобретение относится к жидкой композиции, содержащей, по меньшей мере, один тип белка и пептида, подходящий для формирования капелек жидкости, и к способу формирования капелек жидкости, а также к эжекционному устройству, использующему способ формирования капелек жидкости.
Описание предшествующего уровня техники
В настоящее время предпринимается много попыток применения раствора белка в форме капелек жидкости. Такие капельки жидкости раствора белка и методика их получения применяются в способе доставки лекарственных препаратов посредством введения через слизистые оболочки и в биологическом чипе и биологическом датчике, требующих крайне небольшое количество белка. Кроме того, внимание привлекается к способу формирования мелких капелек жидкости белка при регулировании белковых кристаллов и скрининге физиологически активных веществ (см. заявку на патент Японии №2002-355025, Allain LR et. al. “Fresenius J. Anal. Chem.”, 2001, Vol.371, p.146-150 and Howard EI, Cachau RE “Biotechniques”, 2002, Vol.33, p.1302-1306).
В последнее время генетическими рекомбинантными методиками началось крупномасштабное производство белков, в частности ферментов и полезных белков, обладающих физиологическими видами активности. В этих условиях средство формирования жидких капелек белка может быть полезным инструментом для скрининга и применения новых белковых препаратов и разработки областей их применения. Среди них все большее значение приобретает средство введения пациентам различных препаратов в форме мелких капелек жидкости. В частности, становится важным средство для введения биологических веществ, включая белки и пептиды, через легкие. В легких имеются легочные альвеолы, площадь поверхности которых достигает от 50 до 140 м2, и эпителий, служащий в качестве барьера адсорбции, толщина которого крайне мала, достигая 0,1 мкм, а также имеющей низкую ферментную активность по сравнению с ферментной активностью пищеварительного тракта. По этим причинам легкие привлекли внимание в качестве потенциального пути введения вместо инъекционного пути для препаратов на основе макромолекулярных пептидов, представленных инсулином.
В целом, известно, что осаждение мелких жидких капелек препарата внутри легких варьируется в зависимости от среднемассового аэродинамического диаметра. Для доставки жидких капелек в легочные альвеолы, присутствующие в самых глубоких отделах внутри легких, капельки жидкости, имеющие узкое распределение размера частиц в пределах от 1 до 5 мкм, должны вводиться с высокой воспроизводимостью. Поэтому требуется разработка формы введения, обеспечивающей такое введение, и устойчивого лекарственного средства.
Существуют некоторые обычные способы введения лекарственного препарата в организм, особенно в дыхательные органы. Эти способы будут описаны ниже.
В ингаляторе с отмеренной дозой (MDI) для введения суспензии в аэрозольной форме путем использования сжиженного невоспламеняемого газа или газа с замедленным воспламенением в качестве газа-вытеснителя ввиду того, что регулируется единичный объем, то есть объем одномоментного подаваемого сжиженного газа, можно распылять постоянное количество капелек жидкости. Однако еще остаются нерешенные проблемы регулирования размера капелек жидкости путем регулирования единичного объема сжиженного газа. Кроме того, трудно сказать, что газ-вытеснитель полезен для здоровья.
В способе аэрозольного распыления для жидкого средства, содержащего в качестве среды воду или этанол, средство превращается в мелкие капельки жидкости посредством его эжекции вместе с находящимся под избыточным давлением газом-носителем через капилляр. Поэтому теоретически возможно регулировать количество аэрозоля капелек жидкости регулированием количества жидкого агента, которое подлежит подаче в капиллярный канал. Однако еще трудно регулировать размер капелек.
В частности, в способе распыления аэрозоля находящийся под избыточным давлением газ, используемый для превращения жидкого агента в мелкие капельки жидкости, также используется в виде газообразного носителя (воздушного потока) для переноса распыляемых мелких капелек жидкости. Поэтому структурно трудно изменить количество мелких капелек жидкости (плотности), плавающих в воздушном потоке газа-носителя в соответствии с предполагаемым применением.
О способе формирования капелек жидкости, имеющих узкое распределение размеров частиц, сообщается в документах (патент США №5894841 и заявка на патент Японии №2002-248171). В этом способе формируются крайне мелкие капельки жидкости генератором капелек жидкости на основе принципа эжекции жидкости, используемого в струйных принтерах. При эжекции жидкости устройством струйной эжекции чернил эжекционная жидкость направляется в небольшую камеру, и затем на жидкость действует физическая сила, выталкивающая жидкость из отверстий в виде капелек жидкости. Когда жидкость выталкивается термическим преобразователем, таким как тонкопленочный резистор, через отверстия (каналы эжекции), сформированные в верхней части камеры, генерируются воздушные пузырьки (пузырьково-струйное устройство и термическое чернильно-струйное устройство). Жидкость может выталкиваться использованием пьезовибратора непосредственно через отверстия в верхней части камеры (называемым чернильно-струйным пьезоустройством). Камера для введения жидкости и отверстия объединены в устройство печатной головки, которое далее соединено не только с источником подачи жидкости, но также с регулирующим устройством для регуляции эжекции капелек жидкости.
Для обеспечения возможности всасывания препарата в легких, в частности белково/пептидного препарата, необходимо точно регулировать дозу лекарственного средства. В связи с этим очень предпочтительно формировать капельки жидкости на основе принципа чернильно-струйного устройства, поскольку можно регулировать количество эжекции. В этом устройстве, хотя желательно эжектировать жидкость без отказов, белково/пептидный раствор, подобранный только по поверхностному натяжению и вязкости, стабильно не эжектируется, и его трудно в некоторых случаях эжектировать с высокой воспроизводимостью и эффективностью.
Описание изобретения
Целью настоящего изобретения является предоставление эжекционной жидкости (жидкой композиции) с целью устойчивой эжекции для формирования капелек жидкости, содержащих, по меньшей мере, одно вещество из белков и пептидов, на основе чернильно-струйного устройства, использующего термическую энергию, и способ и устройство, подходящие для эжекции эжекционной жидкости.
В соответствии с настоящим изобретением предоставляется эжекционная жидкость для использования в устройстве эжекции эжекционной жидкости из канала эжекции путем использования термической энергии, отличающаяся тем, что она включает, по меньшей мере, одно вещество, выбранное из группы, состоящей из белков и пептидов, по меньшей мере, одно вещество, выбранное из группы, состоящей из аминокислот и их солей, и поверхностно-активное вещество в жидкой среде, содержащей воду в качестве основного компонента.
В соответствии с настоящим изобретением предоставляется способ эжекции эжекционной жидкости, основанный на принципе чернильно-струйного устройства.
В соответствии с настоящим изобретением предоставляется кассета для эжекции жидкости, отличающаяся тем, что она включает емкость для хранения эжекционной жидкости и эжекционную головку на основе принципа термического чернильно-струйного устройства.
В соответствии с настоящим изобретением предоставляется способ формирования капелек жидкости эжекционной жидкости, содержащей, по меньшей мере, одно вещество, выбранное из группы, состоящей из белков и пептидов, воздействием на жидкость термической энергии, отличающийся тем, что способ включает стадию подачи термической энергии на жидкость, которой заполнен канал, и посредством этого эжекцию жидкости в форме капелек жидкости из канала эжекции, сообщающегося с каналом. И жидкость представляет собой указанную выше эжекционную жидкость.
В соответствии с настоящим изобретением эжекционную жидкость для использования при достижении устойчивой эжекции на основе устройства эжекции жидкости из канала эжекции подачей термической энергии можно получить добавлением аминокислот и поверхностно-активного вещества к раствору, содержащему, по меньшей мере, одно вещество, выбранное из группы, состоящей из белков и пептидов. Эжекционная жидкость, если она содержит лекарственный компонент в виде, по меньшей мере, одного выбранного из группы, состоящей из белков и пептидов, эжектируется из портативного эжекторного устройства для формирования капелек жидкости и обеспечения возможности пользователю вдыхать их. Таким образом, лекарственный компонент, который представляет собой, по меньшей мере, одно вещество, выбранное из группы, состоящей из белков и пептидов, может достичь легких и затем поглощаться легкими. Кроме того, биологический чип и биологический датчик можно получить эжекцией капелек жидкости способом на субстрат и использовать для выявления и скрининга биологических веществ.
Другие признаки и преимущества настоящего изобретения будут очевидны из следующего описания, взятого в сочетании с сопровождающими чертежами, в которых по всем чертежам описания одинаковые обозначающие цифры обозначают одни и те же или одинаковые части.
Краткое описание чертежей
Фиг.1 представляет собой схематическую иллюстрацию для демонстрации способа эжекции белка на субстрат.
Фиг.2 представляет собой образец жидких капелек белка, расположенных на субстрате.
Фиг.3 представляет собой схематическую иллюстрацию блока кассеты головки ингалятора.
Фиг.4 представляет собой вид ингалятора в перспективе.
Фиг.5 представляет собой вид ингалятора в перспективе, показанного на фиг.4, с открытой крышкой доступа.
Фиг.6 представляет собой график, показывающий эжектируемое количество, когда раствор альбумина эжектируется пузырьково-струйным устройством.
Фиг.7 представляет собой график, показывающий уровень глюкозы в крови крыс в зависимости от времени введения инсулина.
Фиг.8 представляет собой график, показывающий эжектируемое количество, когда раствор инсулина эжектируется пузырьково-струйным устройством.
Фиг.9 представляет собой модель, показывающую экспериментальный способ примера.
Наилучший способ осуществления изобретения
Предпочтительные варианты осуществления настоящего изобретения теперь будут описаны в деталях в соответствии с сопровождающими чертежами.
Теперь настоящее изобретение будет объяснено в деталях. Белок, используемый в настоящем изобретении, означает полипептид, составленный из многочисленных аминокислот, связанных через пептидную связь, способную растворяться или диспергироваться в водном растворе. Пептид, используемый в настоящем изобретении, составлен из 50 или менее (включая оба вида) аминокислот, связанных через пептидную связь. Белок/пептид можно химически синтезировать или выделить очисткой из естественных источников; однако обычно он представляет собой рекомбинант естественного белка/пептида. Обычно белок/пептид химически модифицируется ковалентным связыванием аминокислотного остатка с молекулой белка/пептида. Посредством такой модификации терапевтический эффект белка/пептида можно продлить и улучшить.
При осуществлении настоящего изобретения можно использовать различные типы белков и пептидов, желательно включенные в капельки жидкости. Белки и пептиды, которые можно использовать в настоящем изобретении, конкретно не ограничиваются, пока они обладают видами физиологической активности в отношении живого организма и действуют внутри живого организма. Типичнее всего, включение белка/пептида в соответствии с настоящим изобретением в капельки жидкости подходит для доставки терапевтически полезного белка/пептида в легкие.
Примеры такого белка/пептида включают гемопоэтические факторы, такие как кальцитонин, фактор свертывания крови, циклоспорин, G-CSF, GM-CSF, SCF, EPO, GM-MSF CSF-1; интерлейкины, такие как IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, и IL-12; и цитокины, включая M-CSF, тимозин, TNF и LIF. Кроме того, примеры других имеющихся терапевтически эффективных пептидов включают вазоактивные пептиды, интерфероны (такие как  -, -,  -, -,  – или общий интерферон), ростовые факторы или гормоны, такие как человеческий гормон роста или гормоны роста других животных (например, коровий, свиной и птичий факторы роста и другие), инсулин, окситоцин, ангиотензин, метионин энкефалин, субстанция Р, ЕТ-1, FGF, KGF, EGF, IGF, PDGF, LHRH, FSH, DDAVP, PTH, вазопрессин, глюкагон и соматостатин. Можно применять ингибиторы протеазы, такие как лейпептин, пепстатин и ингибиторы металлопротеиназы (например, TIMP-1, TIMP-2 и другие ингибиторы протеиназы); нервные ростовые факторы, такие как BDNF и NT3; факторы, активирующие плазминоген, такие как tPA, урокиназа и стрептокиназа; и частичный пептидный фрагмент белка, имеющего всю или часть основной структуры материнского белка и имеющего, по меньшей мере, часть биологических признаков материнского белка. Можно также использовать аналоги, образованные замещением или делецией, или модифицированные аминокислоты, такие как аналоги пептидов, указанные выше вещества, модифицированные растворимыми в воде полимерами, такими как PEG и PVA спирт. То, что указанные выше белки/пептиды можно доставить в легкие, было выяснено в документе (Critical Reviews in Therapeutic Drug Carrier Systems, 12 (2&3) (1995)). – или общий интерферон), ростовые факторы или гормоны, такие как человеческий гормон роста или гормоны роста других животных (например, коровий, свиной и птичий факторы роста и другие), инсулин, окситоцин, ангиотензин, метионин энкефалин, субстанция Р, ЕТ-1, FGF, KGF, EGF, IGF, PDGF, LHRH, FSH, DDAVP, PTH, вазопрессин, глюкагон и соматостатин. Можно применять ингибиторы протеазы, такие как лейпептин, пепстатин и ингибиторы металлопротеиназы (например, TIMP-1, TIMP-2 и другие ингибиторы протеиназы); нервные ростовые факторы, такие как BDNF и NT3; факторы, активирующие плазминоген, такие как tPA, урокиназа и стрептокиназа; и частичный пептидный фрагмент белка, имеющего всю или часть основной структуры материнского белка и имеющего, по меньшей мере, часть биологических признаков материнского белка. Можно также использовать аналоги, образованные замещением или делецией, или модифицированные аминокислоты, такие как аналоги пептидов, указанные выше вещества, модифицированные растворимыми в воде полимерами, такими как PEG и PVA спирт. То, что указанные выше белки/пептиды можно доставить в легкие, было выяснено в документе (Critical Reviews in Therapeutic Drug Carrier Systems, 12 (2&3) (1995)).
Кроме того, примеры вещества для использования при получении биологического чипа и биологического датчика и при скрининге белка/пептида включают указанные выше белки и пептиды и, кроме того, включают ферменты, такие как оксидаза, редуктаза, трансфераза, гидраза, лиаза, изомераза, синтетаза, эпимераза, мутаза и рацемаза; антитела, такие как IgG и IgE, рецепторы и их антигены; и белки/пептиды для применения в диагностике, такие как аллерген, шаперон, авидин и биотин, причем указанные выше вещества модифицированы иммобилизационным реагентом.
Белок/пептид, подлежащий включению в эжекционную жидкость, могут иметь молекулярную массу в пределах диапазона от 0,3 до 150 кДа. Содержание, по меньшей мере, одного типа белка/пептида, выбранного из указанных выше примеров, в эжекционной жидкости варьируется в зависимости от предполагаемого применения и типов белка/пептида, предпочтительно выбранного из диапазона от 1 мкг/мл до 200 мг/мл, а предпочтительнее от 0,1 мг/мл до 60 мг/мл.
Известно, что выполнение эжекции чернила чернильно-струйным устройством можно в целом улучшить добавлением поверхностно-активного вещества и растворителя, такого как этиленгликоль. Однако когда производилась эжекция раствора, содержащего, по меньшей мере, один тип белка/пептида, выполнение эжекции не улучшалась простым добавлением их. Таким образом, требовалась новая добавка.
В соответствии с исследованиями заявителей настоящего изобретения было подтверждено, что когда жидкость, содержащая белок/пептид в концентрации, достаточной для проявления эффективной физиологической активности, и не содержит добавки для эжекции термическим чернильно-струйным устройством, то жидкость, по существу, не эжектируется при частоте эжекции 20 кГц, если молекулярная масса составляет 3000 или более, хотя состояние эжекции варьируется в зависимости от типа белка/пептида.
Когда термическое чернильно-струйное устройство применялось в настоящем изобретении, было получено наилучшее выполнение эжекции. Поэтому ниже структура будет описана на основании принципа термического чернильно-струйного устройства.
Когда используется термическое чернильно-струйное устройство, можно увеличить отверстие эжекционного канала, увеличить количество тепла термического импульса, используемого для эжекции, повысить точность размера микронагревателя или подобного устройства, используемого для эжекции, и улучшить воспроизводимость. Соответственно, можно достичь узкого распределения размера капелек жидкости во всех многочисленных элементах эжекции жидкости, расположенных с высокой плотностью в головке. Поскольку головку можно изготовить с низкими затратами, ее можно эффективно применить в небольшом устройстве, головку которого необходимо часто заменять. Следовательно, когда требуются портативность и удобство, предпочтительно устройство для эжекции жидкости типа термического чернильно-струйного устройства.
В чернильно-струйном устройстве жидкость формируется в капельки жидкости и распыляется. Возможность регуляции чернильно-струйного устройства преимущественно высока, даже если используется крайне маленькое количество жидкости. В качестве устройства распыления крайне мелких капелек жидкости в соответствии с чернильно-струйным устройством известны вибрационное устройство, использующее пьезоэлектрическое устройство, и термическое чернильно-струйное устройство, использующее устройство микронагревателя.
В вибрационном устройстве, использующем пьезоэлектрическое устройство, степень миниатюризации подлежащего использованию пьезоэлектрического устройства ограничена, так что количество эжекционных каналов, расположенных на единицу площади, ограничено. По мере увеличения количества эжекционных каналов, которые предстоит расположить на единицу площади, затраты на изготовление каналов значительно увеличиваются. Напротив, в термическом чернильно-струйном устройстве устройство микронагревателя, подлежащее использованию, относительно легко миниатюризировать, что приводит к возможности увеличения количества эжекционных каналов, расположенных на единицу площади, а затраты на изготовление каналов можно значительно снизить по сравнению с вибрационным устройством, использующим пьезоэлектрическое устройство.
В случае использования термического чернильно-струйного устройства необходимо контролировать физические свойства жидкости, подлежащей эжекции, для соответствующей регуляции состояния аэрозоля и количества жидкости в микрокапельках жидкости, подлежащих эжекции из отдельных эжекционных каналов. Конкретнее, для получения желательного количества мелких капелек жидкости композицию жидкости, составляющей подлежащий эжекции образец, исследуют с учетом типа и состава растворителя и концентрации растворенного вещества.
Кроме того, различные технические усовершенствования эжекционных механизмов капелек жидкости производились на основании принципа термического чернильно-струйного устройства. Настоящее изобретение можно подходящим образом применять к механизмам эжекции жидкости. В обычной чернильно-струйной головке, подлежащей установке в принтер, количество жидкости в каждой из эжектируемых капелек жидкости составляет лишь примерно несколько пиколитров. Напротив, был разработан эжекционный механизм и способ для получения крайне мелких капелек жидкости, причем каждая содержит жидкость в количестве порядка субпиколитров (Выполненная заявка на патент Японии №2003-154655).
Когда лекарственное средство наносится на объект соматической клетки в нескольких мкм, то препарат может распыляться в форме указанных выше крайне мелких капелек жидкости.
Когда капельки жидкости белка/пептида сформированы на основании принципа чернильно-струйного устройства, то возникает проблема хрупкой конфигурации белка/пептида. Для более конкретного объяснения, когда конфигурация разрушается, белок/пептид агрегируется и распадается, вероятно, воздействуя на правильную работу эжекции.
Физическая сила, действующая, когда капельки жидкости формируются на основании принципа чернильно-струйного устройства, например давление, сила сдвига и высокая поверхностная энергия, присущая мелким капелькам жидкости, придает неустойчивость конфигурациям многих белков и пептидов (когда используются пузырьково-струйное устройство и термическое чернильно-струйное устройство, к указанным выше силам добавляется тепло).
В частности, когда капельки жидкости формируются с использованием чернильно-струйного устройства, требуется не только устойчивость при длительном хранении самой эжекционной жидкости, но также устойчивость к различным типам нагрузок, как указано выше. Конкретнее, указанное выше физическое действие значительно больше, чем сила сдвига и термической энергии, подаваемой общим действием перемешивания и тепловой обработки (например, в случае термического чернильно-струйного устройства одномоментно подается нагрузка с давлением 90 атмосфер примерно при 300°С). Кроме того, поскольку множество физических сил подается одновременно, устойчивость белка имеет тенденцию к снижению гораздо легче, чем в случае, когда белок обрабатывается в обычных условиях. Поэтому обычные методики стабилизации, применяемые отдельно, недостаточны для поддержания устойчивости. Когда возникает такая проблема, белок/пептид агрегируется, закупоривая сопло. Таким образом, становится трудным эжектировать капельки жидкости.
Кроме того, поскольку капельки жидкости размером от 1 до 5 мкм, подходящие для ингаляции в легкие, очень малы по сравнению с размером (16 мкм) обычных капелек жидкости имеющегося в продаже в настоящее время принтера, капельки жидкости получали бы большую поверхностную энергию и силу сдвига. Поэтому очень трудно эжектировать мелкие капельки жидкости белка/пептида, подходящие для ингаляции в легкие.
С другой стороны, в качестве способа стабилизации белка/пептида известно, что добавляются поверхностно-активное вещество, глицерин, различные сахариды, растворимый в воде полиэтиленгликоль и альбумин. Кроме того, известно, что устойчивость при длительном хранении белкового препарата приобретается путем добавления аминокислоты к эритропоэтину, G-CSF и интерферону (патент Японии №03618633, WO 02/017957 и Национальная публикация Международной патентной заявки №2003-510368). Однако в соответствии с исследованиями заявителей в зависимости от типов и концентраций белка/пептида и концентрации добавки (добавок) невозможно эжектировать капельки жидкости в соответствии с принципом термического чернильно-струйного устройства.
Кроме того, известно добавление дополнительных веществ, подходяще используемых в чернилах для чернильно-струйной печати, конкретнее, полиолов, таких как этиленгликоль и глицерин, и увлажняющего вещества (например, мочевины). Однако в соответствии с исследованиями заявителей, даже если добавляются эти дополнительные вещества, они оказывают небольшой эффект на улучшение эжекции белка/пептида.
Как известно (WO 02/094342), в жидкую композицию белка/пептида добавляют соединение для регулирования поверхностного натяжения и увлажнитель для формирования капелек жидкости для ингаляции в легкие, в соответствии с принципами термического чернильно-струйного устройства. В этом случае поверхностно-активное вещество и растворимый в воде полимер, такой как полиэтиленгликоль, добавляются для увеличения устойчивости белка/пептида раствора внутри капелек жидкости под действием поверхностного натяжения и вязкости раствора и удерживающего влагу действия.
Однако в документе WO 02/094342 нет указаний на стабильность эжекции.
Кроме того, в соответствии с исследованиями заявителей было обнаружено, что добавление поверхностно-активного вещества и растворимого в воде полимера отдельно оказывает небольшой эффект на улучшение стабильности эжекции, в зависимости от типов белка/пептида. Когда концентрация белка/пептида высокая, эффект добавки недостаточен и наоборот, сама добавка, вероятно, может ингибировать стабильность эжекции.
Кроме того, во многих случаях одно поверхностно-активное вещество не дает эффекта, свидетельствуя о том, что стабильность эжекции раствора белка/пептида не регулируется поверхностным натяжением и вязкостью или действием удерживания влаги.
Другими словами, способы, описанные в указанных выше документах, не используются как руководство для обеспечения стабильности эжекции, когда белок/пептид эжектируется в соответствии с принципами термического чернильно-струйного устройства.
На основании данных заявители исследовали жидкость, содержащую белок/пептид, на стабильность эжекции, имея в виду получение руководства для обеспечения стабильности эжекции для осуществления настоящего изобретения.
Для использования белка/пептида эжекцией его в соответствии с принципом термического чернильно-струйного устройства способ формирования белкового чипа раскрыт в патенте №03610231 и WO 02/092813.
Однако нет описания того, действительно ли стабильно эжектируется белок/пептид или нет.
Заявители провели интенсивные исследования и обнаружили, что раствор, содержащий, по меньшей мере, один тип белка и пептида в качестве активного ингредиента с добавлением аминокислоты, ее соли и поверхностно-активного вещества, может стабильно эжектироваться в соответствии с принципом чернильно-струйного устройства, использующего термическую энергию.
К удивлению, раствор, содержащий белок/пептид с добавлением одной аминокислоты, или раствор, содержащий белок/пептид с добавлением одного поверхностно-активного вещества, оказывает небольшой эффект на стабильность эжекции, когда эжекция выполняется в соответствии с принципом чернильно-струйного устройства. Даже хотя каждое из этих двух типов веществ само по себе оказывает небольшой эффект, при объединении они оказывают высокий синергический эффект. Поэтому раствор, содержащий белок/пептид, может очень стабильно эжектироваться в соответствии с принципом чернильно-струйного устройства.
Причина того, почему аминокислота и поверхностно-активное вещество при объединении вносят большой вклад в стабильность эжекции раствора, содержащего белок/пептид, неясна, но, как предполагается, состоит в следующем. В растворе, к которому одновременно добавляется поверхностно-активное вещество и аминокислота, не происходит изменения критической концентрации мицеллы и возможности вспенивания поверхностно-активного вещества. В результате этого аминокислота предположительно слабо взаимодействует с белком/пептидом, что приводит к увеличению концентрации аминокислоты на поверхности белка/пептида. В этом состоянии, если раствор, содержащий белок/пептид, эжектируется в соответствии с принципом чернильно-струйного устройства, нагрузка прилагается к белку/пептиду для обнажения гидрофобной части белка/пептида. Аминокислота взаимодействует с обнаженной гидрофобной частью для подавления сталкивания между другими частицами белка и пептида, затрудняя агрегацию. Эффект аминокислоты достаточен для удерживания раствора белка и пептида в том виде, в каком он имеется, но недостаточен для стабилизации раствора, имеющего нагрузку, действующую под влиянием эжекции. Таким образом, считается, что добавление одной аминокислоты к раствору белка/пептида не дает никакого эффекта.
С другой стороны, поверхностно-активное вещество предположительно действует на вещества, нерастворимые в воде (преципитаты), которые образуются, когда гидрофобная часть белка/пептида обнажается вследствие нагрузки во время эжекции или когда молекулы воды удаляются из белка/пептида или действует на агрегаты, которые образуются взаимодействием гидрофобных частей, посредством этого повторно растворяя преципитаты и агрегаты в воде. Однако одно поверхностно-активное вещество не может подавить агрегацию белка/пептида или помочь белку и пептиду удерживать молекулы воды. Поэтому эффект повторного растворения поверхностно-активного вещества считается слишком слабым для обеспечения стабильности эжекции.
Как описано выше, предполагается, что эти два различных эффекта работают в комбинации для быстрого повторного растворения преципитатов и агрегатов, которые неизбежно генерируются в некоторой степени в воде, в то же самое время предотвращая образование большого количества агрегатов, что приводит к тому, что можно стабилизировать передачу тепловой энергии к раствору для стабилизации эжекции.
При осуществлении настоящего изобретения, чем ниже частота, подводимая к термической головке чернильно-струйного устройства, тем лучше. Стабильность эжекции различается в зависимости от подводимой частоты, потому что когда эжекционная жидкость нагревается нагревателем термической головки чернильно-струйного устройства, белок/пептид становится частично нерастворимым в воде, предотвращая передачу энергии от нагревателя к раствору. Когда подводимая частота низкая, то даже если моментально продуцируются нерастворимые вещества, они могут повторно растворяться до следующей операции подвода частоты. Напротив, когда подводимая частота высокая, повторное растворение выполняется недостаточно до следующей операции подвода частоты, снижая вследствие этого стабильность эжекции. Тем не менее, для эффективной эжекции большого количества раствора эжекция должна выполняться с высокой частотой, выше заданного уровня. Предпочтительно частота привода в действие в настоящем изобретении находится в диапазоне от 0,1 кГц до 100 кГц, а предпочтительнее от 1 кГц до 30 кГц.
Термин «аминокислота» означает соединение, имеющее аминогруппу и карбоксильную группу с помещенным между ними атомом углерода. Аминокислоты по настоящему изобретению представляют 20 типов аминокислот, присутствующих в белках и пептидах, составляющих живой организм. Используемая здесь аминокислота может быть или D-формы, или L-формы.
Примеры предпочтительных аминокислот включают аргинин, пролин, глицин, глутамин, аспарагиновую кислоту, валин, треонин, аланин и их соли. Из них предпочтительно применение аргинина, пролина и глицина и их солей.
Содержание, по меньшей мере, одной из аминокислот и ее солей в эжекционной жидкости выбирается в зависимости от типа и содержания белка/пептида и предпочтительно выбрано из количества от 10 мкг/мл до 2,0 г/мл, а предпочтительнее от 1,0 мг/мл до 200 мг/мл.
Термин «поверхностно-активное вещество», используемый в настоящем изобретении, означает соединение, имеющее как полярную часть, так и неполярную часть в одной молекуле, другими словами, имеющее полярную часть и неполярную часть, соединенные через вторичную связь, такую как ионная связь. Поверхностно-активное вещество не только снижает поверхностное натяжение между двумя несмешиваемыми фазами совмещением молекул на поверхности, но также обладает признаком формирования мицеллы. Другими словами, поверхностно-активное вещество представляет собой соединение, имеющее эти полярные и неполярные части локально в областях, удаленных друг от друга.
Поверхностно-активное вещество, которое можно использовать здесь, не ограничивается и предпочтительно представляет собой, по меньшей мере, вещество, выбранное из неионных поверхностно-активных веществ и аминокислотных поверхностно-активных веществ, используемых, например, в областях пищевой промышленности и медицины.
Типичные примеры такого поверхностно-активного вещества включают сложные эфиры жирных кислот сорбитана, такие как сорбитан монокаприлат, сорбитан монолаурат, сорбитан монопальмитат; N-ацильные аминокислоты, которые представляют собой поверхностно-активное вещество, имеющее аминокислоту в виде гидрофильной группы, такую как глицин жирной кислоты N-кокосового масла, глутамат жирной кислоты N-кокосового масла и N-лауроилглутаминовая кислота; соли жирной кислоты аминокислоты; сложные эфиры жирных кислот глицерина, такие как глицерин монокаприлат, глицерин мономиристат и глицерин моностеарат; сложные эфиры жирных кислот полиглицерина, такие как декаглицерил моностеарат, декаглицерил дистеарат и декаглицерил монолинолеат; сложные эфиры жирных кислот полиоксиэтиленсорбитана, такие как монолаурат полиоксиэтиленсорбитана, моноолеат полиоксиэтиленсорбитана, моностеарат полиоксиэтиленсорбитана, монопальмитат полиоксиэтиленсорбитана, триолеат полиоксиэтиленсорбитана и тристеарата полиоксиэтиленсорбитана; сложные эфиры жирных кислот полиоксиэтиленсорбитана, такие как тетрастеарат полиоксиэтиленсорбита и тетраолеат полиоксиэтиленсорбита; сложные эфиры жирных кислот полиоксиэтиленглицерина, такие как моностеарат полиоксиэтиленглицерина; сложные эфиры жирных кислот полиэтиленгликоля, такие как дистеарат полиэтиленгликоля; простые алкиловые эфиры полиоксиэтилена, такие как простой лауриловый эфир полиоксиэтилена, простые алкиловые эфиры полиоксиэтилена-полиоксипропилена, такие как простой гликолевый эфир полиоксиэтилена-полиоксипропилена, простой пролиловый эфир полиоксиэтилена-полиоксипропилена и простой цетиловый эфир полиоксиэтилена-полиоксипропилена; простые алкилфениловые эфиры полиоксиэтилена, такие как простой нонилфениловый эфир полиоксиэтилена; отвержденные полиоксиэтилированные касторовые масла, такие как полиоксиэтилированное касторовое масло и отвержденные полиоксиэтилированные касторовые масла (гидрированное полиоксиэтилированное касторовое масло); производные пчелиного воска-полиоксиэтилена, такие как пчелиный воск-полиоксиэтиленсорбит; производные полиоксиэтиленланолина, такие как полиоксиэтиленланолин; амиды жирных кислот полиоксиэтилена (имеющие гидрофильный липофильный баланс (HLB) от 6 до 18), такие как амид стеариновой кислоты полиоксиэтилена; анионные поверхностно-активные вещества, например алкилсульфаты, имеющие алкильную группу с 8-18 атомами углерода, такие как цетилсульфат натрия, лаурилсульфат натрия и олеилсульфат натрия; сульфаты простого сложного эфира полиоксиэтилена, имеющие в среднем 2-4 аддукта этиленоксида на 1 моль и алкильную группу с 8-18 атомами углерода, такие как полиоксиэтилен лаурилсульфат натрия; сульфонаты алкилбензола, имеющие алкильную группу с 8-18 атомами углерода, такие как лаурилбензолсульфонат натрия; сложные алкиловые эфиры сульфосакцината, имеющие алкильную группу с 8-18 атомами углерода, такие как лаурилсульфосакцинат натрия; естественные поверхностно-активные вещества, например лецитин; глицерофосфорный липид; сфингофосфолипид, такой как сфингомиелин и сложный эфир жирной кислоты сахарозы, имеющий 8-18 атомов углерода. Эти поверхностно-активные вещества можно добавлять отдельно или в комбинации двух или более типов к эжекционной жидкости (жидкой композиции) по настоящему изобретению.
Примеры предпочтительных поверхностно-активных веществ включают сложный эфир жирной кислоты полиоксиэтиленсорбитана. Примеры особенно предпочтительных поверхностно-активных веществ включают монолаурат полиоксиэтилен (20) сорбитана, моностеарат полиоксиэтилен (20) сорбитана, тристеарат полиоксиэтилен (20) сорбитана, монолаурат полиоксиэтилен (20) сорбитана, глицин жирной кислоты N-кокосового масла, глутамат жирной кислоты N-кокосового масла, N-лауроилглицин, N-лаурилглутаминовая кислота, N-лауроилсаркозин, лаурамидпропилбетаин и соль аргинина жирной кислоты кокосового масла. Примеры самых предпочтительных поверхностно-активных веществ включают монолаурат полиоксиэтилен (20) сорбитана, моноолеат полиоксиэтилен (20) сорбитана, глицин жирной кислоты N-кокосового масла, глутамат жирной кислоты N-кокосового масла, N-лауроилсаркозин, лаурамидпропилбетаин и соль аргинина жирной кислоты кокосового масла. Примеры поверхностно-активных веществ, подходящих для поглощения легкими, включают монолаурат полиоксиэтилен (20) сорбитана, моноолеат полиоксиэтилен (20) сорбитана.
Концентрация поверхностно-активного вещества, подлежащего добавлению, варьируется в зависимости от типа и содержания сосуществующего белка/пептида; однако ее можно выбрать из критической концентрации мицеллобразования или более в пределах диапазона от 1 мкг/мл до 1,0 г/мл, а предпочтительнее от 0,1 мг/мл до 200 мг/мл.
Соотношение белка/пептида: аминокислоты: поверхностно-активного вещества варьируется в зависимости от типов отдельных компонентов; однако белок/пептид, аминокислоты/их соли и поверхностно-активное вещество предпочтительно используется в соотношении от 1:0,1 до 200:0,01 к 100 частям по массе, а предпочтительнее от 1:1 до 20:0,1 к 100 частям по массе.
В настоящем изобретении белок, аминокислота и поверхностно-активное вещество предпочтительно однородно смешиваются перед эжекцией, или предварительно, или сразу после эжекции.
В вариантах осуществления настоящего изобретения можно добавить антибактериальное средство, дезинфицирующее средство и/или антисептическое средство для устранения микробного воздействия. Примеры такого средства (средств) включают соли четвертичного аммония, такие как бензалконийхлорид и бензатонийхлорид; производные фенола, такие как фенол, крезол и анизол; бензойные кислоты, такие как бензойная кислота и сложный эфир параоксибензойной кислоты, и сорбиновая кислота.
В вариантах осуществления настоящего изобретения можно добавить масло, глицерин, этанол, мочевину, целлюлозу, полиэтиленгликоль и альгинат для увеличения физической устойчивости эжекционной жидкости во время хранения. Также можно добавить аскорбиновую кислоту, лимонную кислоту, циклодекстрин, токоферол и другие антиоксиданты для увеличения ее химической устойчивости.
Можно добавить буфер для регулирования рН эжекционной жидкости. Примеры такого буфера включают аскорбиновую кислоту, лимонную кислоту, разбавленную хлористоводородную кислоту и разбавленный гидроксид натрия. Кроме них можно использовать такой буфер, как гидрофосфат натрия, дигидрофосфат натрия, гидрофосфат калия, дигидрофосфат калия, PBS, HEPES или Tris.
В качестве агента тоничности для жидкости можно добавить аминоэтилсульфонат, хлорид калия, хлорид натрия, глицерин и кислый карбонат натрия.
Когда эжекционная жидкость в соответствии с настоящим изобретением используется в качестве аэрозольного раствора, можно добавить такие сахариды, как астерперм и ароматизирующие агенты в качестве средств, улучшающих вкус и запах. Можно использовать не только гидрофильные соединения, но также гидрофобные соединения. Соединения можно использовать в масляной форме.
Кроме того, при необходимости, можно добавить в соответствующих количествах разнообразные типы добавок, такие как регулятор поверхностного натяжения, регулятор вязкости, растворитель и увлажнитель, подходящий для предполагаемого использования эжекционной жидкости. Определенные примеры добавок, которые можно добавить, могут включать гидрофильные связывающие вещества, гидрофобные связывающие вещества, гидрофильные загустители, гидрофобные загустители, производные гликоля, спирты и электролиты. Добавки, выбранные из приведенных выше примеров, можно использовать отдельно или в форме смеси. Вещества, которые можно использовать в качестве добавок, описаны в качестве небольших компонентов, которые можно добавить при получении терапевтических жидких средств, например, в фармакопее каждой страны. Предпочтительно использовать добавки, приемлемые для медицинского применения или применения в пищевых продуктах и косметических средствах.
Пропорции добавок, подлежащих добавлению, варьируются в зависимости от типа белка/пептида; однако, в целом, предпочтительно укладываются в диапазон от 0,001 до 40 мас.%, а предпочтительнее от 0,01 до 20 мас.%. Количество добавок варьируется в зависимости от типов, количеств и их комбинации; однако предпочтительно укладываются в диапазон от 0,1 до 200 частей по массе относительно 1 части по массе указанного выше белка/пептида с точки зрения эжекционных свойств.
Когда эжекционная жидкость в соответствии с настоящим изобретением используется для изготовления биологического чипа и биологического датчика и для скрининга белка/пептида, можно использовать, по существу, те же устройства, как и имеющиеся в настоящее время в продаже чернильно-струйные принтеры.
С другой стороны, устройство для эжекции жидкости в соответствии с настоящим изобретением имеет эжекционную головку, основанную на принципе термического чернильно-струйного устройства, то есть способно эжектировать мелкие капельки эжекционной жидкости, в соответствии с принципом термического чернильно-струйного устройства. Эжекционная головка предпочтительно составлена из многочисленных эжекционных элементов, независимо приводимых в действие. В устройстве электрический соединитель, который посылает множество контрольных сигналов к отдельным эжекторным элементам для независимого их привода в действие, изготовлен единым блоком с проводом, который соединяет электрический соединитель с каждым из эжекторных элементов. Кроме того, резервуар имеет емкость, содержащую эжекционную жидкость, и канал жидкости для подачи эжекционной жидкости от резервуара к эжекторной головке в соответствии с принципом термического чернильно-струйного устройства. Эти части предпочтительно встроены в кассету с эжекционной жидкостью.
На фиг.1 схематически показано устройство для формирования пятен белка и пептида на субстрате путем использования эжекционной жидкости в соответствии с настоящим изобретением. Субстрат 5 используется в качестве детекторной пластины, имеющей иммобилизационную область, на которой иммобилизовано стандартное вещество, такое как белок, пептид, фермент или антитело, для выявления различных веществ, содержащихся в образце. Эжекционная головка 3 для жидкости имеет, по меньшей мере, жидкостный канал (не показан) и сообщающееся с каналом эжекторное отверстие (не показано), в которые подается эжекционная энергия. Когда жидкость подается из резервуара 1, хранящего жидкость, через канал 2 и эжекционная энергия подается на жидкость в канале 2, жидкость эжектируется из эжекторного отверстия в заданное положение поверхности субстрата 5 в форме капельки жидкости 4. Головка 3 установлена на кассете, способной перемещаться в направлении в плоскости, указанном стрелками. Положение изгнания капли жидкости 4 на субстрат 5 можно определить движением головки 3. Время эжекции капли жидкости 4 регулируется регулятором 6, электрически соединенным с эжекционной головкой 3. На фиг.2 показан вид в плане типа пятен белка/пептида, расположенного на поверхности субстрата. На фиг.1 используется один тип эжекционной жидкости. Однако, если в эжекторной головке расположено множество эжекторных элементов, причем каждый независимо приводится в действие, и эжектирует другую эжекционную жидкость, и соединен с заданными устройствами подачи для эжекционных жидкостей, то можно сформировать множество пятен, отличающихся по типу. Кроме того, путем изменения количества подачи жидкости в отдельные положения формирования пятна можно формировать пятна, имеющие различные количества осаждения.
В это время эжекционную головку 3 можно конструировать различными путями, в зависимости от размера пятна, сформированного на субстрате, и интервала между пятнами. Когда формируются капельки жидкости порядка пиколитров или фемто-литров, то можно использовать эжекторную головку (раскрытую в заявке на патент Японии №2003-154655), способную эжектировать крайне мелкие капельки жидкости с превосходной возможностью регулирования.
Затем эжекционная жидкость в соответствии с настоящим изобретением вносится в распылительное устройство, в частности ингалятор. Такой ингалятор предпочтительно имеет часть для превращения эжекционной жидкости (жидкого агента) в мелкие капельки жидкости и часть, в котором распыленные мелкие капельки жидкости смешиваются с газообразным носителем в виде дискретных элементов. Ввиду раздельного формирования части для превращения эжекционной жидкости (жидкого агента) в мелкие капельки жидкости и части для формирования воздушного потока, содержащего мелкие капельки жидкости, количество белка/пептида, служащего в качестве активного ингредиента, то есть заданную дозу на его введение, можно равномерно добавить к воздушному потоку, ингаляция которого проводится индивидууму, которому вводится активный агент. Кроме того, эжекционная головка, если она сконструирована для эжекции различных активных ингредиентов для каждого из множества эжекторных элементов, причем каждый имеет множество эжекторных портов, может регулировать эжектируемые количества множества активных ингредиентов.
Путем использования эжекционной головки в соответствии с принципом термического чернильно-струйного устройства, имеющего эжекторные порты, плотно расположенные на единицу площади в виде механизма распыления, ингалятор можно миниатюризировать так, что пользователь может его носить.
В ингаляторе для легких важно, чтобы капельки жидкости, содержащиеся в воздушном потоке, имели узкое распределение размера в пределах диапазона от 1 до 5 мкм. Кроме того, ингалятор должен быть миниатюризирован, когда пользователь носит его.
На фиг.3 показана схематическая структура части для эжекции жидкости такого ингалятора. Часть для эжекции жидкости имеет кожух 10, который вмещает головную часть 13, резервуар 11 для хранения эжекционной жидкости, жидкостный канал 12 для подачи жидкости из резервуара 11 в головную часть 13, часть электрического соединения 15 для взаимообмена подводимых сигналов и регулирующих сигналов с регулятором для регулировки привода отдельных элементов эжекции жидкости из головной части 13 и внутренний провод 14, соединяющий головную часть 13 и часть электрического соединения 15. Эти части интегрально сформированы в одну блочную структуру в виде блока головной кассеты. Блок головной кассеты съемно (при необходимости) встроен в ингалятор в виде неотъемлемой части. Головная часть 13 может также иметь конструкцию эжекционной головки для капелек жидкости, описанную в заявке на патент Японии №2003-154665.
Устройство портативного ингалятора (ингалятора), имеющего блок головной кассеты, имеющей такую структуру, объяснено со ссылкой на фиг.4 и 5. Ингалятор, показанный на фиг.4 и 5, представляет собой ингалятор для медицинского применения, уменьшенный в размере так, чтобы пользователь мог носить его.
Фиг.4 представляет собой вид в перспективе, показывающий внешний вид ингалятора. Чехол состоит из основного корпуса 20 ингалятора и крышки доступа 16. В чехол помещены регулятор и источник питания, т.е. аккумуляторная батарея (не показана). На фиг.5 показано состояние, в котором крышка доступа 16 открыта. Когда крышка доступа 16 открыта, виден соединительный отдел между блоком 21 головной кассеты и мундштуком 18. Обозначающая цифра 19 указывает кнопку включения источника питания. При вдыхании пользователем воздух поступает из воздушного впускного канала 17 в ингалятор и направляется в мундштук 18, где воздух смешивается с капельками жидкости, эжектируемыми из эжекторного канала, предоставленного в головной части 13 блока 21 головной кассеты, для образования смешанного воздушного потока, который течет в направлении к выпускному отверстию мундштука 18, сконструированного для удобного удерживания губами пользователя. Когда пользователь вставляет верхнюю часть мундштука в рот и вдыхает, в то же время удерживая его между зубами, то пользователь может эффективно вдыхать капельки жидкости, эжектируемые из части для эжекции жидкости блока головной кассеты.
Блок 21 головной кассеты может быть съемно (при необходимости) прикреплен к ингалятору.
Благодаря структуре, показанной на фиг.4 и 5, мелкие капельки жидкости формируются и естественно с вдыхаемым воздухом достигают горло и трахею индивидуума (которому предстоит введение). Поэтому количество жидкости в сформированных распыляемых капельках (то есть дозу активного ингредиента) можно регулировать безотносительно объема вдыхаемого воздуха.
Примеры
Эталонный пример 1
Перед описанием примеров будет показано эжектируемое количество, когда раствор, содержащий один белок, эжектируется, в соответствии с принципом термического чернильно-струйного устройства, для облегчения понимания того, почему трудно эжектировать раствор белка. Раствор альбумина в PBS получали в виде раствора белка в различных концентрациях. Каждый из растворов эжектировали устройством для эжекции жидкости, которое было модифицировано из пузырьково-струйного принтера (торговое название: PIXUS 950i, изготавливаемого Canon Inc.) с тем, чтобы собирать раствор. Эжектированное количество (количество одиночной капельки жидкости) каждого раствора альбумина указано на основании количества чистой воды (эжектированной таким же образом), составляющего 100%. Результаты показаны на фиг.6.
Эжекция не полностью стабильна даже при столь низкой концентрации альбумина, как 1 мкг/мл. Продемонстрировано, что эжектированное количество постепенно снижается по направлению к нулю по мере увеличения концентрации белка. Если эжектированное количество значительно варьируется в зависимости от концентрации белка, концентрацию белка/пептида в пятнах нельзя довести до желательного уровня при расположении их на субстрате в одинаковом количестве. Кроме того, когда белок/пептид содержится в одинаковом количестве на дозу при нанесении ее в качестве препарата использованием ингалятора, трудно довести концентрацию белка/пептида в эжекционной жидкости. Более того, при использовании в ингаляторе капельки жидкости должны формироваться в еще меньшие размеры эжекцией. Эжекция раствора белка/пептида таким путем считается трудной.
Теперь настоящее изобретение будет описано более детально в виде примеров, которые будут предоставлены для облегчения дальнейшего понимания изобретения, и, таким образом, их не следует рассматривать, как ограничивающие изобретение. Следует отметить, что обозначение «%» указывает «мас.%».
Примеры 1-24 и Сравнительные примеры 1-11
Формирование капелек жидкости раствора белка на основе принципа пузырьково-струйного устройства
Эжекционную жидкость получали растворением инсулина в соответствующей концентрации в водном 0,1 М растворе HCl, добавлением аминокислот и их солей и поверхностно-активного вещества при перемешивании к полученной выше смеси растворов, доведением рН смеси до 7,4 0,1М NaOH и доведением концентрации инсулина полученного раствора буфером при рН 7,4 до заданной величины.
С другой стороны, была получена головка для эжекции жидкости, имеющая сопло диаметром 3 мкм, в соответствии с принципом пузырьково-струйного устройства. Резервуар, соединенный с соплом, заполняли водным раствором 30% этанола. Эжекционная головка приводилась в действие регулятором, электронно-соединенным с головкой для эжекции жидкости, посредством этого эжектируя жидкость из эжекторных каналов. Полученные капельки жидкости (распыленные капельки) анализировали и размер частиц и распределение размера частиц подтверждали с использованием лазерного дифракционного устройства для измерения распределения размера частиц (Sprayteck, изготовленным Malvern Inc.). В результате анализа было обнаружено, что капельки жидкости имели узкое распределение размера частиц с центром примерно 3 мкм.
Эжекционную жидкость, полученную указанным выше образом, загружали в резервуар, соединенный с головкой для эжекции жидкости, имеющей сопло диаметром 3 мкм. Эжекцию (первую эжекцию) выполняли в течение 1 с, в то же самое время приводя в действие эжекторную головку регулятором эжекции с частотой 20 кГц и напряжением 12 В. После интервала 3 сек вторую эжекцию выполняли в течение 1 сек. Эту процедуру повторяли 50 раз. То, проводилась ли эжекция непрерывно или нет, контролировалось визуально. Случаи, когда капельки жидкости эжектировались непрерывно даже 50 раз или более, обозначены символом 0; случаи, когда эжекция капелек жидкости прерывалась в диапазоне от 15 до 50 раз, обозначены символом  ; а случаи, когда эжекция капелек жидкости прерывалась менее чем 15 раз, обозначены символом х. Кроме того, перед и после эжекции жидкость подвергали анализу ВЭЖХ в условиях анализа (прибор: изготовленный JASCO, колонка: YMC-Pack Diol-200, 500x внутренний диаметр 8,0 мм, элюент: 0,1 М KH2PO4-K2HPO4 (рН 7,0), содержащий 0,2М NaCl, скорость потока: 0,7 мл/мин, температура: 25°С, детекция: УФ при 215 нм) для подтверждения изменения композиции эжекционной жидкости. ; а случаи, когда эжекция капелек жидкости прерывалась менее чем 15 раз, обозначены символом х. Кроме того, перед и после эжекции жидкость подвергали анализу ВЭЖХ в условиях анализа (прибор: изготовленный JASCO, колонка: YMC-Pack Diol-200, 500x внутренний диаметр 8,0 мм, элюент: 0,1 М KH2PO4-K2HPO4 (рН 7,0), содержащий 0,2М NaCl, скорость потока: 0,7 мл/мин, температура: 25°С, детекция: УФ при 215 нм) для подтверждения изменения композиции эжекционной жидкости.
В качестве сравнительных примеров получали чистую воду, раствор инсулина, раствор инсулина, содержащий одну аминокислоту (аминокислоты), и подвергали такому же эксперименту эжекции жидкости, как в «Примерах».
Следует отметить, что составы и результаты «Примеров» и «Сравнительных примеров» показаны в табл.1.
| Таблица 1 |
| |
Белок |
Аминокислота |
Поверхностно-активное вещество |
Оценка выполнения эжекции |
| Тип |
Концентрация |
Тип |
Концентрация |
Тип |
Концентрация |
| Пример 1 |
Инсулин |
4 мг/мл |
Пролин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 2 |
Инсулин |
4 мг/мл |
Аргинин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 3 |
Инсулин |
4 мг/мл |
Глицин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 4 |
Инсулин |
4 мг/мл |
Валин |
5,0 мг/мл |
Tween 80 |
5,0 мг/мл |
о |
| Пример 5 |
Инсулин |
4 мг/мл |
Глутаминовая кислота |
5,0 мг/мл |
Tween 80 |
5,0 мг/мл |
о |
| Пример 6 |
Инсулин |
4 мг/мл |
Аспарагиновая кислота |
5,0 мг/мл |
Tween 80 |
5,0 мг/мл |
о |
| Пример 7 |
Инсулин |
4 мг/мл |
Треонин |
5,0 мг/мл |
Tween 80 |
5,0 мг/мл |
о |
| Пример 8 |
Инсулин |
4 мг/мл |
Аланин |
5,0 мг/мл |
Tween 80 |
5,0 мг/мл |
о |
| Пример 9 |
Инсулин |
4 мг/мл |
Пролин |
2,5 мг/мл |
N-лауроилсаркозин |
2,5 мг/мл |
о |
| Пример 10 |
Инсулин |
4 мг/мл |
Аргинин |
10 мг/мл |
N-лауроилсаркозин |
0,2 мг/мл |
о |
| Пример 11 |
Инсулин |
4 мг/мл |
Аргинин |
2,5 мг/мл |
N-лауроилсаркозин |
2,5 мг/мл |
о |
| Пример 12 |
Инсулин |
4 мг/мл |
Глицин |
2,5 мг/мл |
N-лауроилсаркозин |
2,5 мг/мл |
о |
| Пример 13 |
Инсулин |
4 мг/мл |
Пролин |
5,0 мг/мл |
Глицин жирной кислоты N-кокосового масла |
1,0 мг/мл |
о |
| Пример 14 |
Инсулин |
4 мг/мл |
Аргинин |
5,0 мг/мл |
Глицин жирной кислоты N-кокосового масла |
1,0 мг/мл |
о |
| Пример 15 |
Инсулин |
4 мг/мл |
Глицин |
5,0 мг/мл |
Глицин жирной кислоты N-кокосового масла |
1,0 мг/мл |
о |
| Пример 16 |
Инсулин |
4 мг/мл |
Пролин |
2,5 мг/мл |
Глутамат жирной кислоты N-кокосового масла |
2,5 мг/мл |
о |
| Пример 17 |
Инсулин |
4 мг/мл |
Аргинин |
2,5 мг/мл |
Глутамат жирной кислоты N-кокосового масла |
2,5 мг/мл |
о |
| Пример 18 |
Инсулин |
4 мг/мл |
Глицин |
2,5 мг/мл |
Глутамат жирной кислоты N- кокосового масла |
2,5 мг/мл |
о |
| Пример 19 |
Инсулин |
4 мг/мл |
Пролин |
2,5 мг/мл |
Лаурамидпропилбетаин |
2,5 мг/мл |
о |
| Пример 20 |
Инсулин |
4 мг/мл |
Аргинин |
10 мг/мл |
Лаурамидпропилбетаин |
|
о |
| Пример 21 |
Инсулин |
4 мг/мл |
Глицин |
2,5 мг/мл |
Лаурамидпропилбетаин |
2,5 мг/мл |
о |
| Пример 22 |
Инсулин |
4 мг/мл |
Пролин |
2,5 мг/мл |
Соль аргинина жирной кислоты кокосового масла |
2,5 мг/мл |
о |
| Пример 23 |
Инсулин |
4 мг/мл |
Аргинин |
2,5 мг/мл |
Соль аргинина жирной кислоты кокосового масла |
2,5 мг/мл |
о |
| Пример 24 |
Инсулин |
4 мг/мл |
Глицин |
2,5 мг/мл |
Соль аргинина жирной кислоты кокосового масла |
2,5 мг/мл |
о |
| Сравнительный Пример 1 |
Вода |
|
нет |
– |
нет |
– |
о |
| Сравнительный Пример 2 |
Инсулин |
4 мг/мл |
Пролин |
10 мг/мл |
нет |
– |
х |
| Сравнительный Пример 3 |
Инсулин |
4 мг/мл |
Глицин |
10 мг/мл |
нет |
– |
х |
| Сравнительный Пример 4 |
Инсулин |
4 мг/мл |
Глутаминовая кислота |
10 мг/мл |
нет |
– |
х |
| Сравнительный Пример 5 |
Инсулин |
4 мг/мл |
Треонин |
10 мг/мл |
нет |
– |
х |
| Сравнительный Пример 6 |
Инсулин |
4 мг/мл |
Аланин |
10 мг/мл |
нет |
– |
х |
| Сравнительный Пример 7 |
Инсулин |
4 мг/мл |
нет |
– |
Tween 80 |
2,5 мг/мл |
 |
| Сравнительный Пример 8 |
Инсулин |
4 мг/мл |
нет |
– |
N-лауроилсаркозин |
2,5 мг/мл |
 |
| Сравнительный Пример 9 |
Инсулин |
4 мг/мл |
нет |
– |
Глицин жирной кислоты N-кокосового масла |
2,5 мг/мл |
 |
| Сравнительный Пример 10 |
Инсулин |
4 мг/мл |
нет |
– |
Глутамат жирной кислоты N-кокосового масла |
2,5 мг/мл |
 |
| Сравнительный Пример 11 |
Инсулин |
4 мг/мл |
нет |
– |
Лаурамидпропилбетаин |
2,5 мг/мл |
 |
Чистая вода из сравнительного примера 1, поскольку она не содержала инсулина, эжектировалась непрерывно и стабильно. Чистая вода, содержащая не только инсулин, но также одну аминокислоту (аминокислоты), не проявил существенной эжекции. Кроме того, в случае чистой воды, содержащей не только инсулин, но также одно поверхностно-активное вещество, эжектируемое количество было нестабильным. Напротив, для примеров 1-24 эжекция выполнялась должным образом при стабильном состоянии эжекции. Когда образцы «Примеров» подвергались анализу ВЭЖХ, то различия положения и интенсивности пика перед и после эжекции не наблюдались. В результате этого не наблюдалось изменение состава. Когда образец сравнительного примера 7 таким же образом подвергали анализу ВЭЖХ, пик инсулина снижался. В результате этого было подтверждено, что произошло изменение состава.
Пример 25
Подтверждение фармакологической активности
Композицию, показанную в примере 10, анализировали на наличие фармакологической активности до и после эжекции. После инъекции анестетика нембутала крысам Wistar (самцам в возрасте 8 недель массой примерно 250 г), голодавшим 1 день, из хвостовой вены брали кровь. Ее использовали в качестве основы (контроля). Затем раствор, имеющий состав примера 10, эжектировали в соответствии с принципом термического чернильно-струйного устройства. Полученные капельки жидкости собирали и подкожно инъецировали крысам в дозе 1,6 ЕД/кг. Кровь брали из хвостовой вены через 15, 30, 60 и 120 мин после инъекции. Образцы крови, взятые таким образом, сепарировали в центрифуге и анализировали уровни глюкозы в сыворотке образцов крови (каждая группа включала 6 крыс). Аналогичный эксперимент выполняли с использованием раствора инсулина, не имеющего добавок и не эжектировавшегося в соответствии с принципом термического чернильно-струйного устройства, как в «Сравнительном примере». Присутствие и отсутствие фармакологической активности анализировали на основании изменения уровня глюкозы у крыс, получавших инъекцию капельками жидкости примера 10 (сформированных эжекцией в соответствии с принципом термического чернильно-струйного устройства). Результаты показаны на фиг.7.
Как очевидно из полученных результатов, уровень глюкозы крови у крыс, получивших инъекцию инсулина, быстро снижался. Наблюдался эффект инсулина, снижающий уровень глюкозы в крови. Наблюдался также эффект композиции примера 10 (эжектированной в соответствии с принципом термического чернильно-струйного устройства) в снижении уровня глюкозы в крови. В любой точке измерения не наблюдалось значимого различия снижения уровня глюкозы в крови. Было подтверждено, что активность должным образом поддерживалась после эжекции композиции примера 10 в соответствии с принципом термического чернильно-струйного устройства.
Пример 26
Эффективность эжекции
Растворы, содержащие инсулин в концентрации 1,0 мг/мл с добавкой (добавками) и без них, эжектировали в соответствии с принципом термического чернильно-струйного устройства. Количество эжектируемого раствора и его воспроизводимость оценивали в случаях, когда добавка добавлялась и не добавлялась к раствору.
Оценку проводили с использованием
раствора 1,0 мг/мл инсулина, содержащего 1,0 мг/мл пролина и 1,0 мг/мл Tween 80 (Ins/Pro/Tw);
раствора 1,0 мг/мл инсулина, содержащего 1,0 мг/мл пролина (Ins/Pro);
раствора 1,0 мг/мл инсулина, содержащего 1,0 мг/мл Tween 80 (Ins/Tw);
раствора 1,0 мг/мл инсулина.
Эти растворы эжектировали использованием устройства для эжекции жидкости, модифицированного из пузырьково-струйного принтера (торговое название: PIXUS950i, изготовленного Canon Inc.) с тем, чтобы собирать жидкость. Данные, отражающие эжектируемое количество каждого раствора, наносили на график (фиг.8) на основании данных эжектируемого количества чистой воды, эжектируемой таким же образом, как выше, составляющего 100%. Такой же эксперимент повторяли 5 раз для каждого раствора для получения средней величины и стандартного отклонения, которые показаны на графике.
Раствор, содержащий один инсулин, и раствор, содержащий инсулин с добавлением пролина, не проявляют существенной эжекции. Эффективность эжекции крайне низкая. Эжектируемое количество раствора, содержащего инсулин с добавлением Tween 80, составляет примерно 40% относительно эжектируемого количества чистой воды; однако эжектируемое количество варьируется без воспроизводимости. С другой стороны, эжектируемое количество раствора, содержащего инсулин с добавлением пролина и Tween 80, по существу, такое же, как чистой воды, при высокой воспроизводимости. Эжектируемое количество раствора, содержащего инсулин с добавлением пролина и Tween 80, не менее чем в 100 раз больше количества раствора, содержащего один инсулин, и раствора, содержащего инсулин с добавлением пролина, и примерно в 2,5 раза больше количества раствора, содержащего инсулин с добавлением Tween 80. Поэтому продемонстрировано, что эффективность эжектируемого количества раствора, содержащего инсулин с добавлением пролина и Tween 80, крайне высока.
Примеры 27-58 и Сравнительные примеры 12-25
Воздействия на различные белки и концентрацию добавок
В последующем отбирали раствор, содержащий пролин + Tween 80 и пролин + соль аргинин жирной кислоты кокосового масла, и добавляли к различным типам белков в заданной концентрации. Эжектируемый раствор получали растворением белка/пептида в соответствующей концентрации в буфере (рН 7,4), добавляя аминокислоты и их соли и поверхностно-активное вещество к полученному раствору при перемешивании и доводя рН раствор буфером (до рН 7,4), так что белок/пептид содержался в заданной концентрации. Эжектируемый раствор подвергали тесту эжекции таким же образом, как в примере 1, для оценки выполнения эжекции. Следует отметить, что композиции, использованные в Примерах, и результаты показаны ниже в табл.2.
| Таблица 2 |
| |
Белок |
Аминокислота |
Поверхностно-активное вещество |
Оценка выполнения эжекции |
| Тип |
Концентрация |
Тип |
Концентрация |
Тип |
Концентрация |
| Пример 27 |
Глюкагон |
1 мг/мл |
Пролин |
1,0 мг/мл |
Tween 80 |
1,0 мг/мл |
о |
| Пример 28 |
GLP-1 |
1 мг/мл |
Пролин |
1,0 мг/мл |
Tween 80 |
1,0 мг/мл |
о |
| Пример 29 |
hGH |
1 мг/мл |
Пролин |
1,0 мг/мл |
Tween 80 |
1,0 мг/мл |
о |
| Пример 30 |
Эритропоэтин |
1 мг/мл |
Пролин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 31 |
IFN  |
1 мг/мл |
Пролин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 32 |
IFN  |
1 мг/мл |
Пролин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 33 |
Кальцитонин |
1 мг/мл |
Пролин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 34 |
 -глобулин -глобулин |
1 мг/мл |
Пролин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 35 |
Альбумин |
1 мг/мл |
Пролин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 36 |
IL-2 |
1 мг/мл |
Пролин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 37 |
IL-6 |
1 мг/мл |
Пролин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 38 |
G-CSF |
1 мг/мл |
Пролин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 39 |
TNF |
1 мг/мл |
Пролин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 40 |
Антитромбин III |
1 мг/мл |
Пролин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 41 |
LYHY |
1 мг/мл |
Пролин |
1,0 мг/мл |
Tween 80 |
1,0 мг/мл |
о |
| Пример 42 |
Лизозим |
5 мг/мл |
Пролин |
2,5 мг/мл |
Tween 80 |
2,5 мг/мл |
о |
| Пример 43 |
Глюкагон |
1 мг/мл |
Пролин |
0,5 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
0,5 мг/мл |
о |
| Пример 44 |
GLP-1 |
1 мг/мл |
Пролин |
0,5 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
0,5 мг/мл |
о |
| Пример 45 |
hGH |
1 мг/мл |
Пролин |
0,5 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
0,5 мг/мл |
о |
| Пример 46 |
Эритропоэтин |
1 мг/мл |
Пролин |
1,0 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
1,0 мг/мл |
о |
| Пример 47 |
IFN  |
1 мг/мл |
Пролин |
1,0 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
1,0 мг/мл |
о |
| Пример 48 |
IFN  |
1 мг/мл |
Пролин |
1,0 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
1,0 мг/мл |
о |
| Пример 49 |
Кальцитонин |
1 мг/мл |
Пролин |
1,0 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
1,0 мг/мл |
о |
| Пример 50 |
 -глобулин -глобулин |
1 мг/мл |
Пролин |
1,0 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
1,0 мг/мл |
о |
| Пример 51 |
Альбумин |
1 мг/мл |
Пролин |
1,0 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
1,0 мг/мл |
о |
| Пример 52 |
IL-2 |
1 мг/мл |
Пролин |
1,0 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
1,0 мг/мл |
о |
| Пример 53 |
IL-6 |
1 мг/мл |
Пролин |
1,0 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
1,0 мг/мл |
о |
| Пример 54 |
G-CSF |
1 мг/мл |
Пролин |
1,0 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
1,0 мг/мл |
о |
| Пример 55 |
TNF  |
1 мг/мл |
Пролин |
1,0 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
1,0 мг/мл |
о |
| Пример 56 |
Антитромбин III |
1 мг/мл |
Пролин |
1,0 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
1,0 мг/мл |
о |
| Пример 57 |
LHRH |
1 мг/мл |
Пролин |
0,5 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
0,5 мг/мл |
о |
| Пример 58 |
Лизозим |
5 мг/мл |
Пролин |
1,0 мг/мл |
Соль жирной кислоты аргинина кокосового масла |
1,0 мг/мл |
о |
| Сравнительный пример 12 |
Глюкагон |
1 мг/мл |
нет |
– |
нет |
– |
х |
| Сравнительный пример 13 |
GLP-1 |
1 мг/мл |
нет |
– |
нет |
– |
х |
| Сравнительный пример 14 |
hGH |
1 мг/мл |
нет |
– |
нет |
– |
х |
| Сравнительный пример 15 |
Эритропоэтин |
1 мг/мл |
нет |
– |
нет |
– |
х |
| Сравнительный пример 16 |
IFN  |
1 мг/мл |
нет |
– |
нет |
– |
х |
| Сравнительный пример 17 |
IFN  |
1 мг/мл |
нет |
– |
нет |
– |
|
| Сравнительный пример 18 |
Кальцитонин |
1 мг/мл |
нет |
– |
нет |
– |
х |
| Сравнительный пример 19 |
 -глобулин -глобулин |
1 мг/мл |
нет |
– |
нет |
– |
х |
| Сравнительный пример 20 |
Альбумин |
1 мг/мл |
нет |
– |
нет |
– |
х |
| Сравнительный пример 21 |
IL-2 |
1 мг/мл |
нет |
– |
нет |
– |
|
| Сравнительный пример 22 |
IL-2 |
1 мг/мл |
нет |
– |
нет |
– |
х |
| Сравнительный пример 23 |
G-CSF |
1 мг/мл |
нет |
– |
нет |
– |
х |
| Сравнительный пример 24 |
TNF |
1 мг/мл |
нет |
– |
нет |
– |
х |
| Сравнительный пример 25 |
Антитромбин III |
1 мг/мл |
нет |
– |
нет |
– |
х |
В примерах 27-58, где пролин и поверхностно-активное вещество добавляли к 16 типам белков/пептидов, было подтверждено, что эжекция выполняется должным образом. Как показано в примерах 12-25, где к этим белкам/пептидам не добавляли добавок, существенная эжекция по существу или полностью не наблюдалась. Поэтому было продемонстрировано, что эти композиции эффективны при стабильной эжекции растворов белков/пептидов. Кроме того, в результате анализа ЭЖХ растворов примеров 27-58 на диаграмме не наблюдалось изменения пика. Было подтверждено, что жидкая композиция не изменялась до и после эжекции.
Пример 59
Получение чипа с антителом с использованием чернильно-струйного принтера и операции определения
Фиг.9 представляет собой модель, показывающую экспериментальный способ данного примера. На этом чертеже обозначающая цифра 30 указывает субстрат, 31 – маскирующий агент, 32 – вещество (например, белок, пептид), специфически взаимодействующее с испытуемым веществом, 33 – испытуемое вещество, 34 – вещество, специфичное для испытуемого вещества, и 35 – метка. На этом чертеже схематически показана серия операций определения с использованием чипа с антителом, полученного здесь.
Операция конкретнее будет объяснена ниже. Каждое из человеческого IL2 моноклонального антитела, человеческого IL4 моноклонального антитела и человеческого IL6 моноклонального антитела получали в концентрации от 0,1 до 500 мкг/мл. Затем к каждому раствору антител добавляли Tween 80, так что обе концентрации стали 0,1 (мас./мас.)%. Полученные таким путем эжекционные жидкости загружали в головку чернильно-струйного принтера (торговое название: PIXUS 950i, изготавливаемого Canon Inc.), и эжектировали в форме пятен на стеклянную пластину, покрытую поли-L-лизином, в соответствии с заданным типом расположения.
Стеклянную пластину с имеющимися на ней пятнами жидкости инкубировали при 4°С и затем верхнюю поверхность стеклянной пластины маскировали 1% BSA (бычьим сывороточным альбумином). После маскировки стеклянную пластину тщательно промывали для получения субстрата чипа с антителом. В последующем получали растворы, содержащие испытуемые вещества, рекомбинанты IL2, IL4 и IL6 в концентрации 1 мкг/мл, и затем добавляли Tween 80 и BSA до концентраций соответственно 0,5 (мас./мас.)%, 0,5 (мас./мас.)% и 0,1 (мас./мас.)%. Каждый из растворов загружали в головку чернильно-струйного принтера (торговое название: PIXUS 950i, изготавливаемого Canon Inc.) и эжектировали на субстрат чипа с антителом таким же образом, как указано выше. Субстрат чипа с антителом, имеющий добавленное к нему испытуемое вещество, покрывали покровным стеклом и взаимодействие выполняли при 4°С. После завершения взаимодействия субстрат чипа с антителом тщательно промывали, сушили и использовали в качестве субстрата выявления.
В последующем выполняли мечение для выявления испытуемого вещества, захваченного субстратом выявления. В качестве метки использовали биотин, способный специфически связываться с испытуемым веществом. К растворам антитела, содержащим меченное биотином человеческое IL2 моноклональное антитело, меченное биотином человеческое IL4 моноклональное антитело и меченное биотином человеческое IL6 моноклональное антитело, каждое в концентрации 1 мкг/мл, пролин, Tween 80 и BSA, добавляли до конечной концентрации соответственно 0,5 (мас./мас.)%, 0,5 (мас./мас.)% и 0,1 (мас./мас.)%. Затем каждый из растворов загружали в головку чернильно-струйного принтера (торговое название: PIXUS 950i, изготавливаемого Canon Inc.) и аналогичным образом эжектировали на субстрат выявления. Субстрат выявления, имеющий меченые пятна, покрывали покровным стеклом и реакцию проводили при 4°С. После завершения реакции субстрат выявления тщательно промывали и сушили.
Для оптического выявления метки получали раствор, содержащий меченый Су3 стрептовидин в концентрации 10 мкг/мл. К раствору добавляли пролин, Tween 80 и BSA до конечной концентрации соответственно 0,5 (мас./мас.)%, 0,5 (мас./мас.)% и 0,1 (мас./мас.)%. Раствор загружали в головку чернильно-струйного принтера (торговое название: PIXUS 950i, изготавливаемого Canon Inc.) и эжектировали на субстрат выявления таким же образом, как в приведенном выше примере. После завершения операции эжекции субстрат выявления покрывали покровным стеклом и реакцию выполняли при 4°С. После реакции субстрат выявления тщательно промывали, сушили и затем облучали возбуждающим светом. Количество светоизлучения Су3 (количество флюоресцентного сигнала) выявляли флюоресцентным сканнером, имеющим фильтр, проницаемый для волн длиной 532 нм. В результате выявлялись флюоресцентные сигналы, варьировавшие в зависимости от типов и концентрации.
Настоящее изобретение не ограничивается приведенными выше вариантами осуществления, и в него могут быть внесены различные изменения и модификации в пределах сущности и объема настоящего изобретения. Поэтому для общей оценки объема настоящего изобретения составлена следующая формула изобретения.
Настоящая заявка претендует на приоритет заявки на патент Японии №2004-279864, поданной 27 сентября 2004 г., и заявки на патент Японии №2005-252270, поданной 31 августа 2005 г., которые включены сюда в качестве ссылки.
Формула изобретения
1. Эжекционная жидкость для использования в устройстве для эжекции эжекционной жидкости из канала эжекции путем использования термической энергии, отличающаяся тем, что она включает, по меньшей мере, одно вещество, выбранное из группы, состоящей из белков и пептидов, по меньшей мере, одно вещество, выбранное из группы, состоящей из аминокислот и их солей, и поверхностно-активное вещество в жидкой среде, содержащей воду в качестве основного компонента.
2. Эжекционная жидкость по п.1, отличающаяся тем, что аминокислоты относятся, по меньшей мере, к одной, выбранной из группы, состоящей из аргинина, пролина, глицина, глутаминовой кислоты, аспарагиновой кислоты, валина, треонина и аланина.
3. Эжекционная жидкость по п.1, отличающаяся тем, что аминокислоты относятся, по меньшей мере, к одной, выбранной из группы, состоящей из аргинина, пролина и глицина.
4. Эжекционная жидкость по п.1, отличающаяся тем, что поверхностно-активное вещество представляет собой, по меньшей мере, одно, выбранное из группы, состоящей из неионных поверхностно-активных веществ и аминокислотных поверхностно-активных веществ.
5. Эжекционная жидкость по п.1, отличающаяся тем, что поверхностно-активное вещество представляет собой, по меньшей мере, одно, выбранное из группы, состоящей из сложного эфира жирной кислоты полиоксиэтиленсорбитана, алкиламидалкилбетаина, N-ацилсаркозина, N-ацилглутаминовой кислоты, N-ацилглицина и соли аргинина жирной кислоты.
6. Эжекционная жидкость по п.1, отличающаяся тем, что, по меньшей мере, одно вещество, выбранное из группы, состоящей из белков и пептидов, представляет собой, по меньшей мере, одно вещество, выбранное из группы, состоящей из кальцитонина, инсулинов, глюкагонов, интерферонов, ингибиторов протеазы, цитокинов, ростовых гормонов, белков гематопоэтических факторов, антител; и их аналогов, производных и химически модифицированных веществ.
7. Эжекционная жидкость по п.1, отличающаяся тем, что она включает от 1 до 200 мас.ч. аминокислот и их солей и от 0,01 до 100 мас.ч. добавленного поверхностно-активного вещества относительно 1 мас.ч. белков и пептидов.
8. Эжекционная жидкость по п.1, применяемая в термическом чернильно-струйном устройстве.
9. Способ эжекции эжекционной жидкости по п.1 на основе принципа термического чернильно-струйного устройства.
10. Кассета для эжекции жидкости, отличающаяся тем, что она включает емкость для хранения эжекционной жидкости по п.1 и эжекционную головку.
11. Кассета для эжекции жидкости по п.10, отличающаяся тем, что эжекционная головка эжектирует жидкость термическим чернильно-струйным устройством.
12. Эжекционное устройство, отличающееся тем, что оно включает кассету по п.10, часть, содержащую канал и отверстие для направления жидкости, эжектируемой из части для эжекции жидкости головкой кассеты, к участку вдыхания пользователем.
13. Эжекционное устройство по п.12 для применения в виде ингаляции пользователем из ротовой полости.
14. Способ формирования капелек жидкости эжекционной жидкости, содержащей, по меньшей мере, одно вещество, выбранное из группы, состоящей из белков и пептидов, воздействием на жидкость термической энергии, отличающийся тем, что способ включает стадию подачи эжекционной энергии к жидкости, которой заполнен канал, и посредством этого эжекцию жидкости в форме капелек жидкости из канала эжекции, сообщающегося с каналом, и где жидкость представляет собой эжекционную жидкость по п.1.
РИСУНКИ
|
|