Патент на изобретение №2342931
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(54) СОСТАВ НА ОСНОВЕ КОМПЛЕКСА АРИПИПРАЗОЛА
(57) Реферат:
Изобретение относится к фармакологии. Фармацевтическая композиция содержит арипипразол и в виде комплекса включения с
Область, к которой относится изобретение Данное изобретение относится к комплексу включения арипипразола с замещенным Предпосылки создания изобретения В патенте США №5006528, Oshiro и др., описаны 7-[(4-фенилпиперазино)-бутокси]карбостирилы, которые включают арипипразол, используемые в качестве антагонистов допаминергических нейротрасмиттеров. Арипипразол, который имеет следующую структуру: является атипическим антипсихотическим агентом, используемым для лечения шизофрении. Он плохо растворяется в воде (<1 мг/мл при комнатной температуре). При применении на его основе внутримышечного (IM) инъецируемого раствора арипипразол вызывает неприемлемое (от умеренного до сильного) раздражение ткани в месте инъекции при применении со многими смешивающимися с водой сорастворителями и системами несмешивающийся с водой растворитель – сорастворитель, такими как гексаноевая кислота : триглицерид с цепями средней длины (10:90), полиэтиленгликоль 400 : этанол : молочная кислота (35:15:50), бензиловый спирт : сезамовое масло (10:90), бензиловый спирт : триглицерид с цепями средней длины (10:90), бензиловый спирт : трибутирин (5:95) и полисорбат 80 в 25 мМ винной кислоты. Известно, что циклодекстрины увеличивают растворимость лекарств. Они действуют за счет образования комплексов включения с гидрофобными молекулами. К сожалению, существует много лекарств, для которых образование комплекса с циклодекстрином или является невозможным, или не дает очевидных преимуществ, как описано J. Szejtli, Cyclodextrins in Drug Formulations: Part II, Pharmaceutical Technology, 24-38, August, 1991. В патентах США №№5134127 и 5376645 описаны производные сульфоалкиловых эфиров циклодекстрина и их применение в качестве солюбилизирующих агентов для водонерастворимых лекарств для перорального, интраназального или парентерального введения, включая внутривенное и внутримышечное. Патенты описывают комплекс включения водонерастворимого лекарства и производного сульфоалкилового эфира циклодекстрина и фармацевтические композиции, его содержащие. Примеры производных сульфоалкиловых эфиров декстрина включают моносульфобутиловый эфир В патенте США №6232304 раскрыты комплексы включения арилгетероциклических солей, таких как тартрат зипрасидода с циклодекстрином, таким как сульфобутиловый эфир В заявке на патент JP №09301867 А2 от 25 ноября 1997 г. описаны антидепрессантные композиции в виде таблеток, содержащих арипипразол. В заявке ЕР 1145711 А1 от 17 октября 2001 г. описаны быстро плавящиеся оральные составы, содержащие арипипразол. В патенте США №5904929 описаны трансмукозные и трансдермальные фармацевтические композиции, содержащие лекарство и перацилированный циклодекстрин в качестве солюбилизирующего агента. Примеры лекарств включают антидепрессанты, такие как амитриптилин · HCl, амоксапин, бутриптилин · HCl, кломипрамин · HCl, десипрамин · HCl, дотиепин · HCl, доксепин · HCl, флуоксетин, гепирон, имипрамин, карбонат лития, миансерин · HCl, милнаципран, нортриптилин · HCl и пароксетин · HCl; антимускариновые агенты, такие как атропинсульфат и гиосцин; седативные агенты, такие как алпразолам, буспирон · HCl, хлордиазэпоксид · HCl, хлорпромазин, клозапин, диазепам, флупентиксол · HCl, флуфеназин, флуразепам, лоразепам, мазапертин, оланзапин, оксазепам, пимозид, пипамперон, пирацетам, промазин, рисперидон, селфотел, серокел, сулпирид, темазепам, тиотиксен, триазолам, трифлуперидол, зипрасидон; антимигреневые лекарства, такие как алнидитан и суматриптан; блокаторы бета-адренорецепторов, такие как атенолол, карведилол, метопролол, небиволол и пропранолол; агенты антипаркинсонизма, такие как мезилат бромокриптина, леводопа и селегилин · HCl; опиоидные анальгетики, такие как бупренорфин · HCl, кодеин, декстроморамид и дигидрокодеин; парасимпатомиметики, такие как галантамин, неостигмин, физостимин, такрин, донерезил, ENA 713 (экселон) и ксаномелин; и вазодилаторные средства, такие как амлодипин, буфломедил, амилнитрит, дилтиазем, дитридамол, глицерилтринитрат, динитрат изосорбида, лидофлазин, молсидомин, никардипин, нифедипин, окспентифиллин и тетранитрат пентраэритрита. Краткое описание изобретения. Согласно данному изобретению создан комплекс включения арипипразола в замещенном Неожиданно было установлено, что когда арипипразол образует комплекс с замещенным Кроме того, согласно данному изобретению предусмотрена фармацевтическая композиция, которую образуют комплекс включения арипипразола и замещенного Согласно предпочтительному варианту фармацевтический состав по изобретению бывает в виде водного парентерального или инъецируемого состава. Однако фармацевтический состав по изобретению может быть в виде других дозированных форм, такие как лиофилизированный инъецируемый, оральный (например, таблетки, капсулы, эликсиры и т.п.), трансдермальный или трансмукозный препараты или составы для ингаляции. Далее, согласно данному изобретению предусмотрен способ введения инъецируемого арипипразола без появления неприемлемого раздражения в месте инъекции, причем вышеуказанный инъецируемый состав вводят пациенту, нуждающемуся в лечении, предпочтительно внутримышечно. Далее, согласно данному изобретению предусмотрен способ лечения шизофрении, который включает стадию введения пациенту, нуждающемуся в лечении, вышеуказанного состава, предпочтительно в инъецируемой форме, без появления раздражения в месте инъекции, будь то мышечная ткань или другое место. Подробное описание изобретения Арипипразол плохо растворяется в воде и поэтому на его основе трудно получить водный инъецируемый состав. Согласно данному изобретению было установлено, что растворимость арипипразола в воде может быть значительно увеличена, чтобы на его основе можно было приготовить водный инъецируемый раствор за счет комплексообразования арипипразола с замещенным Как будет видно далее, состав на основе арипипразола в виде водного инъецируемого препарата включает кислый буфер и основание для регулирования рН до желательных величин. Замещенный Термины «чрезмерное раздражение» или «неприемлемое раздражение» в месте инъекции или в мышечной ткани относится к умеренному и сильному раздражению, неприемлемому для пациента и неблагоприятно сказывающемуся на его состоянии. Термин «уменьшенное раздражение» в месте инъекции или в мышечной ткани относится к вообще минимальному и среднему раздражению, которое приемлемо для пациента и не сказывается неблагоприятно на его состоянии. Арипипразол образует комплекс с замещенным Комплекс или физическая смесь могут быть запрессованы в таблетки или введены в капсулы. Препараты арипипразола по изобретению могут быть получены из сухих физических смесей арипипразола и замещенного Состав на основе арипипразола в форме водного инъецируемого препарата согласно изобретению включает кислый буфер для регулирования рН водного раствора в пределах от примерно 3,5 до примерно 5. Примеры кислых буферов, пригодных для использования по изобретению, включают кислоты, такие как соляную, серную, фосфорную, бромисто-водородную и т.п., и органические кислоты, такие как щавелевая кислота, малеиновая кислота, фумаровая кислота, молочная кислота, малевая кислота, винная кислота, лимонная кислота, бензойная кислота, уксусная кислота, метансульфокислота, толуолсульфокислота, бензолсульфокислота, этансульфокислота и т.п. Могут быть также использованы кислые соли этих кислот. Предпочтительными кислотами являются винная кислота, лимонная кислота и соляная кислота. Наиболее предпочтительна винная кислота. Инъецируемый состав по изобретению будет иметь рН в интервале от примерно 3,5 до примерно 5, предпочтительно от примерно 4 до примерно 4,6 и, наиболее предпочтительно примерно 4,3. При получении инъецируемого состава, если это необходимо, можно регулировать рН основанием, таким как гидроокись щелочного металла, например, NaOH, КОН или LiOH, предпочтительно, NaOH, или гидроокись щелочноземельного металла, такая как Mg(OH)2 или Са(ОН)2. При приготовлении водных инъецируемых составов по изобретению замещенный Арипипразол содержится в водном инъецируемом составе в количестве от примерно 0,1 до примерно 2,5% по весу, предпочтительно, от примерно 0,2 до примерно 1,5% по весу в расчете на вес инъецируемого состава. Согласно предпочтительным вариантам арипипразол содержится в водном инъецируемом составе в количестве от примерно 1 до примерно 20 мг/мл, предпочтительно, от примерно 1,5 до примерно 8 мг/мл состава. Согласно еще более предпочтительным вариантам составы по изобретению содержат 2 мг/мл, 5 мг/мл и 7,5 мг/мл арипипразола. Объем капсул предпочтительно составляет 0,5 мл и 2 мл. Предпочтительный инъецируемый состав содержит: (1) арипипразол – в количестве от примерно 1,5 до примерно 8 мг/мл раствора; (2) SBECD – в количестве от примерно 100 до примерно 200 мг/мл раствора; (3) кислый буфер (предпочтительно, винная кислота) – в количестве от примерно 7 до примерно 9 мг/мл раствора для достижения рН от примерно 3,5 до примерно 5; (4) основание для регулирования рН, предпочтительно гидроокись щелочного металла, предпочтительно NaOH – в количестве для достижения рН от примерно 4 до 4,6; (5) воду – до 1 мл. Инъецируемый состав на основе арипипразола может быть получен следующим образом. Винную кислоту или другой кислый буфер растворяют в воде для инъекций. Замещенный Полученный раствор фильтруют, например, через фильтрующую мембрану толщиной 0,22 мкм и помещают в пузырьки. Пузырьки закрывают, герметизируют и стерилизуют. Водный инъецируемый состав по изобретению обеспечивает количество арипипразола, равное, по меньшей мере, 2 мг арипипразола, предпочтительно по меньшей мере, 5 мг арипипразола/мл, причем количество арипипразола, обеспечиваемое комплексом, измеряется при концентрации циклодекстрина в воде 5% об./вес. Составы на основе арипипразола используют для лечения шизофрении у людей. Предпочтительная доза инъецируемого состава согласно изобретению составляет 2 мл раствора, содержащего 7,5 мг арипипразола/мл или 15 мг, вводимые пациенту трижды в день с интервалом в 2 часа. Инъецируемый состав вводят, предпочтительно, внутримышечно, хотя эффективными являются также подкожные и внутривенные инъекции. Нижеследующий пример представляет предпочтительный вариант изобретения. Пример. Прозрачный бесцветный инъецируемый раствор арипипразола (2 мг арипипразола/мл, 4 мг/пузырек), практически не содержащий твердых частиц при визуальном осмотре, приготавливали следующим образом. В сосуд из нержавеющей стали загружали соответствующее количество воды для инъекции USP. При непрерывном перемешивании в сосуд добавляли 78 г гранул винной кислоты USP и 1500 г сульфобутилового эфира Затем в сосуд добавляли 20 г арипипразола и перемешивание продолжали до растворения арипипразола. К полученному раствору добавляли гидроокись натрия, IN, для регулирования рН до примерно 4,3. Для получения конечного объема, равного 10 л, добавляли в раствор при перемешивании дополнительное количество воды для инъекции USP. Полученный раствор асептически фильтровали через мембранный фильтр 0,22 мкм в стерильный контейнер, затем в асептических условиях в стерильные пузырьки помещали по 4 мг полученного раствора, закрывали пузырьки в асептических условиях пробками для герметизации. Получение композиций арипипразола (BMS-337039) с 1) Кавитроном (HPBCD) и 2) молочной кислотой. 1. Состав на основе Кавитрона Композиция: Объем емкости = 50 мл
70% Кавитрон в воде + винная кислота + лекарство – регулировка рН – достаточное количество мл в 2 см3 пузырек (объем для заполнения = 1 мл) и хранение при 50°, комнатной температуре и 8°С. Хранение исходного образца при -70°С до ВЭЖХ анализа. 2. Состав на основе молочной кислоты Композиция: Объем емкости = 50 мл.
Особые наблюдения были сделаны в процессе установления рН с помощью молочной кислоты. После того как лекарство полностью растворилось в гомогенном растворе, рН раствора при перемешивании составило 3.6. Однако при прекращении перемешивания, рН упало до 8. Такие наблюдения были сделаны неоднократно. Определение растворимости арипипразола в 20% растворе Кавитрона при различных рН (КТ – комнатная температура), приготовленном из 40% растворах Кавитрона. Готовили 25 мл 40% раствора Кавитрона. Кавитрон добавляли очень медленно в воду для предотвращения образования комочков. Получение образца: 2,5 мл раствора Кавитрона (40%) помещали в емкость с мешалкой и 2,5 мл воды, которую добавляли в нее для получения 20% концентрации, регистрировали общий вес раствора, и затем добавляли лекарство в каждый пузырек с различными рН, установленными с помощью 0,1Н HCl. – рН суспензии 20% Кавитрона с лекарством составляет 7,6. – рН, которое устанавливается с помощью 0,1 Н HCl, составляет 7,6 и ниже. – Образцы перемешиваются в течение 48 часов, для анализа с помощью ВЭЖХ.
Растворимость арипипразола (ВМС-337039-01). Растворимость арипипразола (ВМС-337039-01) в различных маслах и буфере лактата. Разведение: 10 мл 0.1 мл Посл. №4239
Замечание: Образцы лактата хранились при комнатной температуре в течение 3 дней и некоторый осадок наблюдался в лактате рН буфера при 8 мг/мл. Твердая фаза отделялась и твердая высушенная фаза подвергалась ДСК. Наблюдали точку плавления, отличную от арипипразола (150°С) и твердой фазы с лактатом (около 140°С), содержащим 8 мг при рН 3.0, 4.0, 4.8, 6.5 и 8. Изучение рН растворимости и стабильности арипипразола с различными буферами (цират и фосфат) при рН 3.0, 4.0, 4.8, 6.4 и 8.0. Приготовление раствора: (Ссылка: Manoj’s N.B. 42871) Начальный анализ: растворы 0.05 мг/мл были приготовлены и значения рН установлены. Образцы были проанализированы в отсутствии, какого-либо растворения. Образцы с рН 6.5 и 8.0 получали в суспензионной форме и фильтровали через 0.2 мм фильтр и затем анализировали. Все образцы хранили при 8°С, комнатной температуре и 50°С, 70°С. Их анализировали в отношении стабильности.
Растворимость арипипразола в лактатном и ацетатном буфере
Приготовление растворов: рН устанавливали с помощью ледяной уксусной кислоты и 85% молочной кислоты. Замечание: молочная кислота не была гидролизована или разбавлена. Непосредственное приготовление солей BMS-337039. Следующие соли были выбраны для изучения образования солей, основанных на их константах кислотности (pkas). Кислоты: pkas 1. Уксусная кислота 2. Винная кислота 3. Фумаровая кислота 4. Малеиновая кислота 5. Метансульфокислота 0.1 М буферы этих кислот были приготовлены при рН 3.0 1. Цитратный буфер, рН 3.0 Взвешивают 1.92 г уксусной кислоты (Sigma Co). Добавляют к 75 мл воды. рН устанавливают 0.1 Н NaOH до 3.0, воду добавляют до 100 мл. 2. Тартратный буфер, рН 3.0 Взвешивают 1.50 г винной кислоты (Sigma Со). Добавляют к 75 мл воды – растворяют. рН устанавливают 0.1 Н NaOH до 3.0, воду добавляют до 100 мл. 3. Фумаратный буфер, рН 3.0 Взвешивают 1.16 г фумаровой кислоты. Добавляют 75 мл воды. рН устанавливают 0.1 Н NaOH до 3.0. Воду добавляют до 100 мл. 4. Цитратный буфер, рН 3.0 Взвешивают 1.16 г метансульфокислоты. Добавляют 75 мл воды. рН устанавливают 0.1 Н NaOH до 3.0. Воду добавляют до 100 мл. Эффект понижения концентрации циклодекстрина (SBECD) на установление устойчивости растворимости BMS-337039 при различных значениях рН. Концентрации циклодекстрина, используемые в данном исследовании.
Способ: Готовят 25 мл 5, 10,15 и 20%-ные растворы SBECD и 20% растворы HPBCD в воде. Добавляют избыток лекарства в эти растворы. Берут первоначальные «как есть» образцы. Начинают устанавливать рН с помощью 1Н HCl. Значения рН растворов устанавливались до следующих величин.
Эти растворы перемешивались в течение 24 ч на ротационной мешалке.
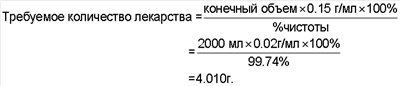
Расчеты: Плотность раствора = 1.062 г/мл 1. Вес конечного объема (г) = конечный объем × плотность раствора = 2000 мл × 1.062 г/мл = 2124 г 2. Начальная загрузка воды = Вес конечного объема × 0.70 = 1486.8 г 3. Количество винной кислоты = конечный объем × 0.0078 г/мл. Требуемое = 2000 мл × 0.0078 г/мл = 15.6 г 4. Требуемое количество Captisol = конечный объем × 0.15 г/мл = 2000 мл × 0.15 г/мл = 300 г 6. Количество гидроксида натрия, требуемое = 186 г (приблизительно) Процесс: Вначале вода добавляется в сосуд – Captisol и винную кислоту – растворяют (полностью) – лекарство – растворяют – pH устанавливают 4.3 – стерильно фильтруют (0.2 мм фильтр) – наполняют 5 см3 шприц 2.55 мл каждый + 3% – передают для различных тестов AR & ID в стабильном состоянии.
Расчеты: Плотность раствора = 1.062 г/мл 1. Вес конечного объема (г) = конечный объем × плотность раствора = 2000 мл × 1.062 г/мл = 2124 г 2. Начальная загрузка воды = Вес конечного объема × 0.70 = 1486.8 г 3. Количество винной кислоты = конечный объем × 0.0078 г/мл. Требуемое = 2000 мл × 0.0078 г/мл = 15.6 г 4. Требуемое количество Captisol = конечный объем × 0.15 г/мл = 2000 мл × 0.15 г/мл = 300 г 6. Требуемое количество гидроксида натрия=140 г. Процесс: Вначале вода добавляется в сосуд – Captisol и винную кислоту – полностью растворяют – требуемое количество лекарства – растворяют – рН устанавливают 4.3 с помощью IN гидроксида натрия – стерильно фильтруют (0.2 мм фильтр) – наполняют 5 см3 шприц 2.55 мл + 3% каждый – передают AR & ID в стабильном состоянии для различных исследований. Начальный и 5-дневный анализ композиций, содержащих Captisol Образцы хранились при различных условиях. Начальные образцы хранились при 5°С
Формула изобретения
1. Фармацевтическая композиция, содержащая арипипразол и замещенный 2. Композиция по п.1, находящаяся в виде инъецируемого состава. 3. Композиция по п.1, у которой замещенный 4. Композиция по п.1, представляющая собой водный инъецируемый состав, имеющий рН в интервале от примерно 3,5 до примерно 5. 5. Композиция по п.4, дополнительно включающая в себя кислый буфер. 6. Композиция по п.5, у которой кислый буфер представляет собой винную кислоту или ее соль, лимонную кислоту или ее соль, соляную кислоту или ее соль, уксусную кислоту или ее соль, малеиновую кислоту или ее соль, малевую кислоту или ее соль, серную кислоту или ее соль, толуолсульфокислоту или ее соль, бензолсульфокислоту или ее соль, нафталинсульфокислоту или ее соль или этансульфокислоту или ее соль. 7. Композиция по п.6, дополнительно включающая основание для регулирования рН водного состава до величины в пределах от примерно 3,5 до примерно 5. 8. Композиция по п.5, в которой замещенный 9. Композиция по п.5, в которой кислый буфер содержится в весовом отношении к арипипразолу в пределах от 2:1 до 10:1. 10. Композиция по п.2, у которой арипипразол содержится в количестве, обеспечивающем дозу от 1 до 10 мг арипипразола/мл. 11. Композиция по п.2, в которой замещенный 12. Композиция по п.2, в которой арипипразол и замещенный 13. Фармацевтический водный инъецируемый состав, содержащий арипипразол, SBECD, винную кислоту, гидроокись натрия и воду, причем этот состав имеет рН в пределах от 4 до 4,6. 14. Состав по п.13, который содержит арипипразол в количестве от 1,5 до 8 мг/мл состава; SBECD в количестве в пределах от 100 до 200 мг/мл; винную кислоту в количестве в пределах от 7 до 9 мг/мл, гидроокись натрия в количестве, обеспечивающем рН в пределах от 4 до 4,6, и воду до 1 мл. 15. Состав по п.14, в котором арипипразол и замещенный 16. Состав по п.13, предназначенный для внутримышечного введения, не вызывающего неприемлемого раздражения. 17. Способ лечения шизофрении, который включает введение пациенту, нуждающемуся в лечении, композиции по п.2. 18. Способ по п.17, при котором композицию вводят внутримышечно.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 -циклодекстрином, предпочтительно, сульфобутиловым эфиром
-циклодекстрином, предпочтительно, сульфобутиловым эфиром 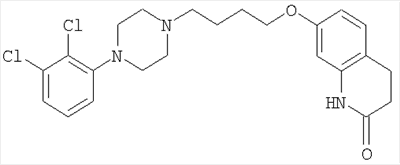
 10 мл во всех маслах с М-Р/МеОН
10 мл во всех маслах с М-Р/МеОН
 Очищенное лекарство
Очищенное лекарство