|
(21), (22) Заявка: 2007113737/14, 12.04.2007
(24) Дата начала отсчета срока действия патента:
12.04.2007
(46) Опубликовано: 20.12.2008
(56) Список документов, цитированных в отчете о
поиске:
SANTORO J. et al. “Rat model of experimental endocarditis” Infect Immun. 1978 Mar; 19 (3):915-8. RU 2109524 C1 21.02.1994 г. ЛАРИОНОВ П.М. Новая экспериментальная модель септического эндокардита. Современные технологии хирургической коррекции пороков сердца с учетом их естественного развития. 1995, с.97-98. КЛИМОВ И. А. Новые модели бескаркасных
Адрес для переписки:
664079, г.Иркутск, Юбилейный, 100, а/я 23, ГУ НЦ РВХ ВСНЦ СО РАМН, патентоведу
|
(72) Автор(ы):
Пешков Евгений Валерьевич (RU),
Пушкарев Борис Георгиевич (RU),
Гольдберг Олег Аронович (RU),
Желтовский Юрий Всеволодович (RU),
Коваль Елена Владимировна (RU),
Корякина Лариса Борисовна (RU),
Зарицкая Лариса Васильевна (RU)
(73) Патентообладатель(и):
Государственное учреждение Научный центр реконструктивной и восстановительной хирургии Восточно-Сибирского научного центра Сибирского отделения Российской Академии медицинских наук (RU)
|
(54) СПОСОБ МОДЕЛИРОВАНИЯ ИНФЕКЦИОННОГО ЭНДОКАРДИТА У МЕЛКИХ ЛАБОРАТОРНЫХ ЖИВОТНЫХ
(57) Реферат:
Изобретение относится к медицине, а именно к экспериментальной кардиологии, и может быть использовано для моделирования инфекционного эндокардита у мелких лабораторных животных. Для этого предварительно внутривенно вводят раствор гидрокортизона ацетата в дозе 0,125 мг на 100 г веса животного. Через 72 часа проводят катетеризацию яремной вены и внутрисердечно вводят 1,0 мл смеси культур E.coli 107 и Ps. Aeruginosa 107, взятых в соотношении 1:1, и полиэтиленовую струну, дистальный конец которой размещают в правом желудочке. После чего катетер извлекают, а проксимальный конец струны фиксируют. Способ обеспечивает адекватную воспроизводимость модели со 100%-й выживаемостью экспериментальных животных в длительные послеоперационные сроки. 1 табл., 2 ил.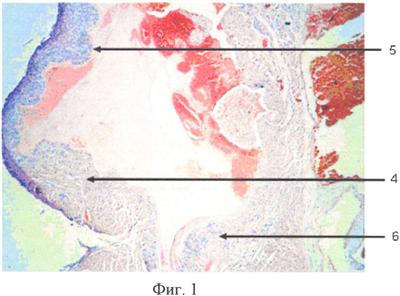
(56) (продолжение):
CLASS=”b560m”биопротезов в хирургии аортального клапана. Гидродинамическая оценка и первый опыт клинического применения. Груд. и сердечно-сосудистая хирургия. 2002, №4. с.13-17. FREEDMAN L.R. “[Proceedings: Experimental endocarditis. Experimental basis and prophylaxis]” Schweiz Med Wochenschr. 1975 Nov 1; 105(44):1417-20.
Предлагаемое изобретение относится к области медицины, а именно к патофизиологии и экспериментальной хирургии.
Известны различные способы моделирования инфекционного эндокардита.
Так, известен способ, заключающийся в повышении функциональной нагрузки на сердце крыс путем «подъема» животных в барокамере на высоту с последующим многократным введением в течение 3-х недель стрептококков (Теодори М.И. Затяжной септический эндокардит. – М.: Медицина, 1965, – С.27).
К недостаткам данного способа следует отнести низкую воспроизводимость модели инфекционного эндокардита, которая составляет 59%, а также и длительное время, необходимое для получения модели.
Известный способ осуществляют следующим образом. Экспериментальному животному – крысе через правую сонную артерию в левые отделы сердца вводят полиэтиленовый катетер, который оставляют там на протяжении всего эксперимента. Через 24-72 часа проводят внутривенное введение суточной культуры бактерий staphylococcus aureus или streptococcus mitis, или streptococcus faecalis в количестве 107 колоний образующих единиц (КОЕ).
К недостаткам данного способа следует отнести высокую послеоперационную летальность, которая на 2-е сутки достигает 40%, а на 10-е сутки – 56%.
Задачей заявляемого изобретения является разработка способа моделирования инфекционного эндокардита у мелких лабораторных животных.
Техническим результатом предлагаемого способа является повышение воспроизводимости модели инфекционного эндокардита, а также обеспечение возможности его длительного изучения и коррекции за счет снижения послеоперационной летальности экспериментальных животных.
Технический результат достигается тем, что способ получения модели инфекционного эндокардита у мелких лабораторных животных проводят путем повреждения эндокарда и введения суточной культуры бактерий.
Отличие предлагаемого способа заключается в том, что за 72 часа до введения бактерий и повреждения эндокарда внутривенно вводят раствор гидрокортизона ацетата в дозе 0,125 мг на 100 г веса животного.
Отличие также заключается и в том, что через 72 часа после введения гидрокортизона ацетата проводят катетеризацию яремной вены и через катетер внутрисердечно вводят смесь культур E.coli 107 и Ps. Aeruginosa 107, взятых в соотношении 1:1, по 0,5 мл каждой.
К отличительным приемам заявляемого способа также относится и то, что повреждение эндокарда правых отделов сердца и трикуспидального клапана крыс проводят полиэтиленовой струной, веденной через катетер. При этом после размещения дистального конца струны в правом желудочке катетер извлекают, а проксимальный конец струны фиксируют к окружающим мягким тканям.
Эти отличия позволяют сделать вывод о соответствии заявляемого технического решения критерию изобретения «новизна».
Сравнение заявляемого технического решения не только с прототипом, но и другими техническими решениями в экспериментальной кардиологии не позволило выявить в них признаки, отличающие заявленное решение от прототипа.
Авторами заявляемого способа экспериментальным путем установлено, что предварительное внутривенное введение раствора гидрокортизона ацетата в дозе 0,125 мг на 100 г веса экспериментального животного позволило усилить действие вводимого бактериального агента и повысить вероятность повреждения эндокарда. В экспериментах без введения раствора гидрокортизона ацетата, при прочих равных условиях, модель инфекционного эндокардита не была получена.
Проведение катетеризации яремной вены обеспечивает возможность внутрисердечного введения смеси бактериальных культур, также и полиэтиленовой струны позволило снизить интраоперационную летальность экспериментальных животных.
Внутрисердечное введение смеси культур грамотрицательных бактерий культур E.coli 107 и Ps. Aeruginosa 107, взятых в соотношении 1:1 (при этом общий объем смеси составляет 1,0 мл), позволило достичь 89%-й воспроизводимости модели инфекционного эндокардита у мелких лабораторных животных.
Изложенное позволяет сделать вывод о соответствии технического решения критерию «изобретательский уровень».
Способ, составляющий заявляемое изобретение, предназначен для использования в экспериментальной медицине. Возможность его осуществления подтверждена описанными в заявке приемами и средствами. Заявляемый способ обеспечивает достижение усматриваемого заявителем технического результата, а именно повышение воспроизводимости модели инфекционного эндокардита, а также обеспечение возможности его длительного изучения и коррекции, за счет снижения послеоперационной летальности экспериментальных животных.
Увеличение выживаемости экспериментальных животных в послеоперационном периоде дает возможность провести более точный анализ характеристик заболевания, что имеет определяющее значение при изучении процессов повреждения и репарации, испытании лекарственных препаратов. Снижение летальности позволяет экономить животных и время экспериментаторов. Вышеизложенное дает основание считать, что заявляемое решение соответствует критерию изобретения «промышленная применимость».
Заявляемый способ осуществляют следующим образом. На первом этапе экспериментальному животному – крысе в условиях внутрибрюшинного наркоза в бедренную вену вводят раствор гидрокортизона ацетата в дозе 0,125 мг/100 г веса животного.
Через 72 часа после введения раствора гидрокортизона ацетата под наркозом в правую яремную вену устанавливают катетер, через который вводят по 0,5 мл смеси грамотрицательных бактерий E.coli 107 и Ps. 107 Aeruginosa 107 и полиэтиленовую струну. Дистальный конец введенной струны размещают в правом желудочке сердца, после чего катетер извлекают, а проксимальный конец струны фиксируют к окружающим тканям.
Сущность предложенного способа моделирования инфекционного эндокардита поясняется чертежами, на которых представлены фотографии гистологических препаратов срезов сердец, окрашенных гематоксилин-эозином.
На фиг.1 представлен гистологический срез правого предсердия, на фиг.2 – гистологический срез на уровне трикуспидального клапана, где 1 – створка клапана, 2 – эндотелий, 3 – тромботические наложения, 4 – стенка правого предсердия, 5 – эндокард с продуктивным воспалением и тромботическими массами, 6 – створка клапана с продуктивным воспалением и тромботическими массами.
Предлагаемый способ поясняется примером конкретного выполнения.
Экспериментальные исследования выполнены на 20 крысах обоего пола линии «Wistar» массой 200-300 г. Всем животным в условиях внутрибрюшинного наркоза (кетамин 0,2 мл, сибазон 0,1 мл) в асептических условиях выполняли доступ к бедренной вене. Внутривенно вводили раствор гидрокортизона ацетата в дозе 0,125 мг на 100 г веса животного. Через 72 часа в асептических условиях под внутрибрюшинным наркозом осуществляли доступ к правой яремной вене. После чего проводили пункцию вены периферическим катетером, через который вводили смесь бактерий E.coli и Ps. Aeruginosa в дозе 107 КОЕ в объеме по 0,5 мл каждой культуры. Затем через катетер в правые отделы сердца экспериментального животного вводили полиэтиленовую струну диаметром 0,6 мм, длиной 2-4 см, после чего катетер удаляли. Дистальный конец струны размещали в правом желудочке, о чем свидетельствовали выраженные нарушения ритма сердца и передаточные колебания струны. Вену со струной перевязывали. Дополнительно проксимальный конец струны фиксировали к окружающим тканям лигатурами, после чего выполняли ушивание раны. В ходе операции, при размещении струны в правом желудочке сердца, погибло 2 крысы, т.е. интраоперационная летальность составила 10%. Выживаемость животных в послеоперационном периоде равнялась 100%, т.е. до окончания эксперимента дожили все 18 крыс. Выведение крыс из эксперимента осуществляли на 10-е сутки. По данным морфологического исследования воспроизводимость модели инфекционного эндокардита составила 89% (17 животных). Критериями, по которым оценивалось наличие инфекционного эндокардита у мелких лабораторных животных, являлись состояния верхней полой вены, правого предсердия, правого желудочка, трикуспидального клапана, так верхняя полая вена – значительное утолщение интимы, за счет развития сосудов, пролиферации фибробластов, диффузно расположенных лимфоцитов, редких сегментоядерных лейкоцитов. На поверхности со стороны внутреннего слоя расположены тромботические массы из фибрина с включенными в толщу редкими лимфоцитами, сегментоядерными лейкоцитами, эритроцитами. Эндотелизации нет. По ходу кровотока в стенке верхней полой вены толщина ткани внутреннего слоя с продуктивной реакцией уменьшается. Структура поверхностных отделов представлена тромботическими массами без эндотелизации. Правое предсердие: утолщение эндокарда в виде подушек и уплощенных структур. В их толще расположены капилляры, фибробласты, лимфоциты. На поверхности эндокарда определены участки с эндотелизацией и участки с тромботическими массами. Продуктивный процесс в эндокарде распространен на прилежащий миокард. Утолщения створок трикуспидального клапана. Лимфоциты в толще створок в небольшом количестве (фиг.1 и 2).
Всего моделирование инфекционного эндокардита проведено на 74-х лабораторных животных, которые были разделены на 3 группы.
Животным 1-й группы выполняли повреждение эндокарда правых отделов струной, а внутривенное введение смеси культур 0,5 мл E.coli 107 КОЕ и 0,5 мл Ps. Aeruginosa 107 КОЕ (соотношение 1:1) проводили на 3-и сутки.
Животным 2-й группы перед введением струны проводили внутривенное введение смеси культур E.coli 105 КОЕ 0,5 мл и Ps. Aeruginosa 105 КОЕ 0,5 мл. На 3-и сутки проводили введение струны в правые отделы сердца и повторное введение смеси культур 0,5 E.coli 109 КОЕ и 0,5 мл Ps. Aeruginosa 109 КОЕ (соотношение 1:1).
Животным 3-й группы выполняли внутривенное введение раствора гидрокортизона ацетата в дозе 0,125 мг на 100 г веса крысы, затем повреждали струной эндокард правых отделов и осуществляли введение смеси культуры бактерий 0,5 E.coli 107 КОЕ и 0,5 мл Ps. Aeruginosa 107 КОЕ, в соотношении 1:1. В этой группе для получения оптимальных результатов изменяли порядок введения струны, бактерий, гидрокортизона а также временные интервалы. Были выделены 3 подгруппы:
3а подгруппа – внутривенное введение раствора гидрокортизона, введение струны и указанной смеси культур бактерий через 72 часа.
3б подгруппа – одновременное ведение раствора гидрокортизона и струны, а введение инфекционного агента через 48 часов.
3в подгруппа – одновременное введение раствора гидрокортизона и струны, а введение инфекции – смеси культур бактерий – через 24 часа.
Полученные результаты по интра- и послеоперационной летальности для наглядности сведены в таблице.
| Группа |
Общее количество крыс |
Интраоперационная летальность |
Послеоперационная летальность |
Воспроизводимость эндокардита |
| Абс. |
% |
Абс. |
% |
Абс. |
% |
| 1 |
26 |
5 |
19 |
11 |
42 |
1 |
10 |
| 2 |
9 |
2 |
22 |
1 |
11 |
1 |
16 |
| 3а |
20 |
2 |
10 |
– |
– |
17 |
89 |
| 3б |
5 |
– |
– |
– |
– |
1 |
20 |
| 3в |
14 |
2 |
14 |
– |
– |
2 |
14 |
Как видно из таблицы, наиболее оптимальные результаты были получены в группе 3а: интраоперационная летальность 10%, послеоперационная летальность 0%, воспроизводимость 89%. Данные этой группы легли в основу заявляемого способа.
Таким образом, заявляемый способ обеспечивает возможность получения модели инфекционного эндокардита с воспроизводимостью 89%, с низкой интраоперационной летальностью – 10% и высокой выживаемостью экспериментальных животных в длительные послеоперационные сроки – 100%. Все это и обеспечивает возможность длительного изучения данного патологического процесса.
Снижение летальности животных во время проведения эксперимента обеспечивает экономию животных и сокращает время и трудозатраты экспериментаторов.
Предложенный способ может быть использован для патофизиологических и терапевтических изучений данной патологии в эксперименте.
Формула изобретения
Способ моделирования инфекционного эндокардита у мелких лабораторных животных, включающий повреждение эндокарда и введение суточной культуры бактерий, отличающийся тем, что предварительно внутривенно вводят раствор гидрокортизона ацетата в дозе 0,125 мг на 100 г веса животного и через 72 ч проводят катетеризацию яремной вены и внутрисердечно вводят 1,0 мл смеси культур E.coli 107 и Ps. Aeruginosa 107, взятых в соотношении 1:1, и полиэтиленовую струну, дистальный конец которой размещают в правом желудочке, после чего катетер извлекают, а проксимальный конец струны фиксируют.
РИСУНКИ
|