Патент на изобретение №2162087
|
||||||||||||||||||||||||||
(54) 3-АЛКОКСИКАРБОНИЛ-ТИАДИАЗИНОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ
(57) Реферат: Описываются новые тиадиазиноны общей формулы I, в которой R1 обозначает A; R2 и R3 обозначают Н, A; R4 обозначает бензоил, замещенный C1-С6-алкоксигруппой; R5 обозначает NA2 или насыщенный пяти- или шестичленный гетероциклический остаток по меньшей мере с одним N-атомом, который может быть заменен A; Q обозначает разветвленный или неразветвленный алкилен с 1-10 С-атомами или отсутствует; n обозначает 1,2, или 3; А обозначает алкил с 1-6-С-атомами, а также их физиологически приемлемые соли. Соединения могут найти применение при лечении сердечной недостаточности. Описываются также способ получения соединений и фармацевтическая композиция на их основе. 3 с. и 1 з.п.ф-лы, 1 табл. 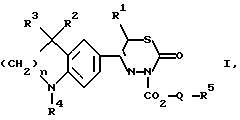
Изобретение относится к новым 3-алкоксикарбонил-тиадиазинонам формулы (I) 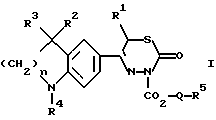 где R1, R2 и R3 каждый, независимо друг от друга, обозначают H или A; R4 обозначает ацил с 1-15 C-атомами; R5 обозначает NH2, NHA, NA2 или насыщенный трех- – восьмичленный гетероциклический остаток по меньшей мере с одним N-атомом, который может быть замещен с помощью A и где дополнительно другая CH2-группа в кольце может быть заменена на NH-группу, NA-группу, атом кислорода или серы; Q отсутствует или обозначает разветвленный или неразветвленный алкилен с 1-10 C-атомами; “n” обозначает 1, 2 или 3; и A обозначает алкил с 1-6 C-атомами; а также к их физиологически приемлемым солям. Производные тиадиазинона, основная структура которых соответствует формуле (I), которые, однако, в остальном имеют другой образец замещения, известны из патента ФРГ 3719031-A1. В основу изобретения положена задача нахождения новых соединений с ценными свойствами, в особенности таких, которые можно применять для приготовления лекарственных средств. Найдено, что соединения формулы (I) при хорошей совместимости обладают ценными фармакологическими свойствами. В особенности они обладают сильным антиаритмическим действием, а также положительно инотропным эффектом; далее, вещества действуют сосудорасширяюще и поэтому способствуют кровотоку. Сосудорасширяющее воздействие и действие на сердце можно обнаруживать, например, на находящихся под наркозом или бодрствующих собаках, кошках, обезьянах или поросятах; положительно инотропное действие также можно устанавливать на изолированных препаратах сердца (например, предсердие, сосочковая мышца или перфундированное все целиком сердце) крыс, морских свинок, кошек или собак, например, по методам, которые описываются в Arzneimittelforschung, том 31 (1) Nla (1981, с. 141-170, или Schliep и др., 9-th International Congress of Pharmacol., London., Abstracts of papers 9P (1984). Далее, появляются антитромботические, подавляющие агрегацию тромбоцитов и влияющие на форму эритроцитов свойства. Влияние на функцию тромбоцитов в смысле подавления агрегации можно доказать на крысе ex vivo в тесте по Born (Nature, 194, 927-929, 1962). Антитромботическое действие проявляется в удлинении времени кровотечения согласно Stella (Thrombos, Res. 7, 709-716, 1975), в уменьшении веса тромба в случае индуцированного холодом тромбоза яремной вены у крысы согласно Meng (Ther. Ber. 47, 69-79, 1975) и в повышении необходимого для полного тромбоза лазерного импульса на Mensenterial-Venale крысы, соответственно изменению метода по Kovacs (Microvasc. Res., 6., 194-201, 1973). Благоприятное воздействие на деформируемость эритроцитов обнаруживается в нуклеопоровом фильтре согласно Schmid-Schonbein (Pfluger’s Archiv., 338, 93-114, 1973). Также можно установить благоприятные воздействия на время фибринолиз/лизис эуглобулина согласно v. Kaulla (Progr. Chem. Fibrinol Thrombol. 1, 131-149, 1975; изд. J.F. Davidson, Raven Press, N.Y.). Далее, найдено, что введение основно замещенных алкоксикарбонильных остатков в тиадиазиновое кольцо приводит к хорошо растворимым в воде соединениям, которые обладают хорошей биодоступностью. Поэтому соединения можно применять в качестве биологически активных веществ лекарственных средств в медицине и ветеринарии. Далее, они могут служить в качестве промежуточных продуктов для получения других биологически активных веществ лекарственных средств. Соответственно этому, предметом изобретения являются соединения формулы (I), их соли присоединения кислот, а также способ их получения, отличающийся тем, что соединение формулы (II): 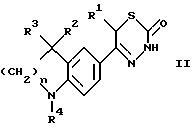 где R1, R2, R3, R4 и “n” имеют указанные значения, вводят во взаимодействие с соединением формулы (III) X-CO2-Q-R5 где Q и R5 имеют указанные значения, а X обозначает Cl, Br, OH или реакционноспособную, этерифицированную до сложноэфирной OH-группу, или соединение формулы (IV) 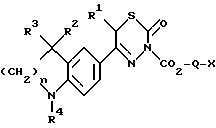 где R1, R2, R3, R4, “n”, Q и X имеют указанные значения, вводят во взаимодействие с соединением формулы (V) R5-H, (V) где R5 имеет указанное значение; или соединение, которое соответствует формуле (I), однако вместо R4 содержит атом водорода, обычным образом ацbлируют; или в соединении формулы (I) один остаток R4 превращают в другой остаток R4; или соединение формулы (I), где остаток R5 содержит первичную или вторичную аминогруппу, обычным образом алкилируют; и/или основание формулы (I) путем обработки с помощью кислоты превращают в одну из его солей. Выше- и нижеуказанные, остатки R1, R2, R3, R4, R5, Q и X, а также параметр “n” имеют указанные в случае формул (I), (II), (III), (IV) и (V) значения, если не указано ничего другого. В формулах остаток A предпочтительно неразветвлен, содержит предпочтительно 1, 2, 3 или 4 C-атома и предпочтительно обозначает метил, далее предпочтительно этил или пропил, далее предпочтительно изопропил, бутил, изобутил, втор.-бутил, трет.-бутил, однако также н-пентил, изопентил, н-гексил или изогексил. Q обозначает предпочтительно этилен, пропилен, бутилен, пентилен, гексилен, далее, например, также 1-метилэтилен. Q-R5 обозначает предпочтительно также N-метилпиперидил. Остатки R1, R2 и R3 предпочтительно обозначают, смотря по обстоятельствам, H или метил. “n” предпочтительно обозначает 2. R4 обозначает кислотный остаток карбоновой или сульфоновой кислоты, предпочтительно алканоил с 1-10, в особенности 1, 2, 3, 4 или 5 C-атомами, в частности предпочтительно ацетил, далее предпочтительно формил, пропионил, бутирил, изобутирил, валерил, изовалерил, пивалоил (триметилацетил), далее предпочтительно в случае необходимости замещенный ароил с 7-15 C-атомами, причем в качестве заместителей принимают во внимание в особенности 1-3, предпочтительно одну из следующих групп: алкил, алкоксил, алкилтиогруппу, алкилсульфинил или алкилсульфонил, смотря по обстоятельствам, с 1-3, предпочтительно 1 или 2 C-атомами, метилендиоксигруппу, далее, OH, F, Cl, Br, I, NO2, NH2, алкиламиногруппу или диалкиламиногруппу с 1-3, предпочтительно 1 или 2 C-атомами в каждой алкильной группе. Отдельными предпочтительными ароильными остатками являются бензоил; о-, м- или п-толуил, о-, м- или п-метоксибензоил; 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-диметокснбензоил, 2,3,4-, 2,3,5-, 2,3,6-, 2,4,5-, 2,4,6- или 3,4,5-триметоксибензоил; о-, м-, или п-метилтиобензоил; о-, м-, или п-метилсульфинилбензоил; о-, м-, или п-метилсульфонилбензоил; 2,3- или 3,4-метилендиоксибензоил, 1- или 2-нафтоил. Ацил, далее, может обозначать гетероарилкарбонил с 2-10 C-атомами, как 2- или 3-фуроил, 2 или 3-теноил, пиколиноил, никотиноил, изоникотиноил, кроме того, арилалканоил, как фенилацетил, о-, м-, или п-метоксифенилацетил, 2- или 3-фенилпропионил; 2-, 3- или 4-фенилбутирил; циклоалкилкарбонил; как циклогексилкарбонил; алкилсульфонил, как метил-, этил-, пропил- или бутилсульфонил; арилсульфонил, как бензолсульфонил, о-, м- или п-толуолсульфоннл, о-, м- или п-метокси-бензолсульфонил, 1- или 2-нафталинсульфонил. Остаток R5 предпочтительно обозначает метиламино-, диметиламнно-, этиламино-, метилэтиламино, диэтиламино- или, однако, пирролидино-, пиперидино- или морфолиногруппу. Предметом изобретения являются в частности те соединения формулы (I), в которых по меньшей мере один из указанных остатков имеет одно из вышеуказанных предпочтительных значений. Некоторые предпочтительные группы соединений могут быть выражены следующими частичными формулами (1a) – (1h), которые соответствуют формуле (I) и где подробнее не обозначенные остатки имеют указанное в случае формулы (I) значение, где, однако: в 1a: R1 обозначает метил и “n” обозначает 2; в 1b: R1 обозначает H и “n” обозначает 2; в 1c: R1 обозначает метил, R2 и R3 обозначают H и “n” = 2; в 1d: R1 и R2 обозначают метил; R3 обозначает H и “n” = 2; в 1e: R1, R2 и R3 обозначают метил и “n” = 2; в 1f: R1, R2 и R3 обозначают метил; R4 обозначает ацил с 1-10 C-атомами и “n” обозначает 2; в 1g: R1 и R2 каждый, независимо друг от друга, обозначают H или метил; R3 обозначает H; R4 обозначает ацил с 1-10 C-атомами, Q обозначает разветвленный или неразветвленный алкилен с 1-6 C-атомами; 5 обозначает NH2, NHCH3, NHC2H5, N(CH3)2 или N(C2H5)2; и “n” = 2; в 1h: R1, R2 и R3 обозначает метил; R4 обозначает ацил с 1-10 C-атомами и Q-R5 обозначает пирролидиноэтил, пирролидинопропил, пиперидиноэтил, пиперидинопропил, морфолиноэтил, морфолинопропил, N-метилпирролидинил, N-этилпирролидинил, N-метилпиперидинил, N-этилпиперидинил или морфолинил. Соединения формулы (I), впрочем, получают само по себе известными способами, которые описаны в литературе (например, в стандартных работах, как Губен-Вейл, Методы органической химии, изд. Georg-Thieme, Штутгарт), а именно при реакционных условиях, которые известны и пригодны для указанных взаимодействий. При этом можно применять также само по себе известные, здесь подробнее не упомянутые варианты. Исходные вещества для заявляемого способа в желательном случае могут образовываться in situ, таким образом, что их не выделяют из реакционной смеси, а тотчас вводят во взаимодействие далее до получения соединений формулы (I). Исходные вещества формул (II) и (III) частично известны. Если они неизвестны, то их можно получать само по себе известными способами. Получение соединений формулы (II) известно из патента ФРГ 3719031. В частности, взаимодействие соединений формулы (II) с соединениями формулы (III) осуществляют в присутствии или в отсутствие инертного растворителя, при температурах примерно от -20oC до примерно +150oC, предпочтительно при 20-100oC. В качестве растворителя пригодны, например, углеводороды, как бензол, толуол, ксилолы или мезитилен; галогенированные углеводороды, как дихлорметан, трихлорэтилен или хлорбензол; спирты, как метанол, этанол или изопропанол, гликоли или простые гликолевые эфиры, как этиленгликоль, диэтиленгликоль, 2-метоксиэтанол, нитрилы, как ацетонитрил, простые эфиры, как тетрагидрофуран или диоксан, амиды, как диметилформамид (ДМФ); сульфоксиды, как диметилсульфоксид. Также пригодны смеси этих растворителей. В соединениях формулы (III) X предпочтительно обозначает хлор или бром. Если X обозначает реакционноспособную, этерифицированную до сложноэфирной OH-группу, то она предпочтительно обозначает алкилсульфонилоксигруппу с 1-6 C атомами, например, метансульфонилоксигруппу, или арилсульфонилокси-группу с 6-10 C-атомами, например, бензол-, п-толуол- или 1- или 2-нафталинсульфонилоксигруппу. Далее, соединение формулы (I) также можно получать тем, что соединение формулы (IV) вводят во взаимодействие с соединением формулы (V). Соединения формулы (IV) можно получать тем, что соединение формулы (II) вводят во взаимодействие с соединением формулы Y-CO2-Q-OH, где Y обозначает Cl, Br или реакционноспособную, этерифицированную до сложноэфирной OH-группу, в условиях, которые указаны выше для реакции между соединениями формул (II) и (III), и в случае необходимости затем функционализируют концевую OH-группу. Соединения формулы (V) известны или их можно получать само по себе известными способами. Точно также один остаток R4 можно превращать в другой остаток R4. Например, при применении само по себе известных реакций можно этерифицировать до простой эфирной OH-группу или, однако, расщеплять простой арильный эфир. Далее, заместители остатка R4, как, например, S-A- или SO-A-группы, можно окислять, поскольку реакция протекает селективно на остатке R4. Соединение, которое соответствует формуле (I), однако вместо R4 содержит атом водорода, можно ацилировать с помощью ацилгалогенида формулы R4-Cl или R4-Br или ангидрида формулы (R4)2O, в инертном растворителе, целесообразно в присутствии основания, например гидроксида щелочного или щелочноземельного металла, а также карбоната, алкоголята или гидрида щелочного или щелочноземельного металла, как гидроксид, карбонат, метилат, этилат или гидрид натрия или калия; далее, вторичных или третичный аминов, например, триэтиламина или пиридина. Полученное основание формулы (I) с помощью кислоты можно переводить в соответствующую соль присоединения кислоты. Для этого взаимодействия пригодны кислоты, которые дают физиологически приемлемые соли. Так, можно применять неорганические кислоты, например серную кислоту; галогенводородные кислоты, как соляная кислота или бромоводородная кислота; фосфорные кислоты, как ортофосфорная кислота; азотную кислоту, сульфаминовую кислоту; далее, органические кислоты, в особенности алифатические, алициклические, аралифатические, ароматические или гетероциклические одно- или многоосновные карбоновые, сульфоновые или серные кислоты, как муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, бензойная кислота, салициловая кислота, 2- или 3-фенил-пропионовая кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метан- и этансульфокислота, этандисульфокислота, 2-гидрокси-этансульфокислота, бензосульфокислота, п-толуол-сульфокислота, нафталин-моно- и ди-сульфокислоты, лаурил-серная кислота. Соли с физиологически неприемлемыми кислотами, например пикраты, можно применять для очистки соединений формулы (I). Соединения формулы (I) могут содержать один или несколько асимметрических центров. В этом случае они обычно находятся в рацемической форме. Полученные рацематы можно разделять, механически или химически, на их энантиомеры согласно само по себе известным методам. Предпочтительно из рацемической смеси путем введения во взаимодействие с оптически активным разделяющим агентом получают диастереомеры. В качестве разделяющего агента для основных соединений формулы (I) пригодны, например, оптически активные кислоты, как D- и L-формы винной кислоты, диацетилвинной кислот, дибензоилвинной кислоты, миндальной кислоты, яблочной кислоты, молочной кислоты или различных оптически активных камфорсульфокислот, как  – камфорсульфокислота или, однако, оптически активная камфановая кислота, соответственно другие оптически активные терпеновые кислоты.
Естественно, также можно получать оптически активные соединения формулы (I) по вышеописанным способам тем, что применяют исходные вещества, которые уже оптически активны.
Формула (I) охватывает все стереоизомеры и их смеси, например рацематы.
Предметом изобретения, далее, является применение соединений формулы (I) и их физиологически приемлемых солей для приготовления фармацевтических композиций, в особенности нехимическим путем. При этом их вместе по меньшей мере с одним твердым, жидким и/или полужидким носителем или вспомогательным веществом и в случае необходимости в комбинации с одним или несколькими другими биологически активными веществами можно доводить до пригодной дозировочной формы.
Предметом изобретения, далее, являются средства, в особенности фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I) и/или одну из его физиологически приемлемых солей.
Эти композиции можно применять в качестве лекарственных средств в медицине или ветеринарии. В качестве носителей принимают во внимание органические или неорганические вещества, которые пригодны для кишечного (например), орального, парентерального или топического применения и не реагируют с новыми соединениями, например, как вода, растительные масла, бензиловые спирты, полиэтиленгликоли, глицеринтриацетат, желатина, углеводы, как лактоза или крахмалы, стеарат магния, тальк, вазелин. Для орального применения служат в особенности таблетки, драже, капсулы, сиропы, соки или капли; для ректального применения служат свечи; для парентерального применения служат растворы, предпочтительно масляные или водные растворы; далее, суспензии, эмульсии или имплантаты; для топического применения служат мази, кремы, пластыри (Sticks) или порошки (пудры). Новые соединения можно также лиофилизировать и полученные лиофилизаты применять, например, для приготовления препаратов для инъекций.
Указанные композиции могут быть стерилизованы и/или могут содержать вспомогательные вещества, как смазки, консерванты, стабилизаторы и/или смачиватели, эмульгаторы, соли для влияния на осмотическое давление, буферные вещества, красители, вкусовые вещества и/или ароматические вещества. Если желательно, они могут также содержать одно или несколько других биологически активных веществ, например, один или несколько витаминов.
Соединения формулы (I) можно применять при борьбе с заболеваниями, в особенности с аритмиями и сердечными недостаточностями, а также при терапии человеческого или животного организма.
При этом предлагаемые согласно изобретению вещества как правило вводят по аналогии с известными, положительно инотропно действующими веществами, как Амринон, предпочтительно в дозах примерно 1-100 мг, в особенности 2-20 мг, на дозировочную единицу.
Суточная доза составляет предпочтительно примерно 0,2-20 мг/кг веса тела. Специальная доза для каждого определенного пациента зависит, однако, от самых различных факторов, например от эффективности используемого особого соединения, от возраста, веса тела, общего состояния здоровья, пола, от стоимости, момента и пути введения, от скорости выделения, комбинации лекарственных веществ и тяжести соответствующего заболевания, которое имеет значение для терапии. Предпочтительно оральное применение. По сравнению с до сих пор применяемыми для лечения сердечной недостаточности Digitalis-гликозидами, соединения формулы (I) отличаются улучшенным терапевтическим диапазоном и периферической разгрузкой.
В нижеследующих примерах выражение “обычная обработка” обозначает: добавляют, если необходимо, воду или разбавленный раствор гидроксила натрия, экстрагируют органическим растворителем, как этилацетат, хлороформ или дихлорметан, разделяют, органическую фазу сушат над сульфатом натрия, отфильтровывают, выпаривают и очищают путем хроматографии и/или кристаллизации, Rf-значения определяют на силикагеле.
Выше- и нижеуказанные, все температуры даны в градусах Цельсия.
Пример 1 – камфорсульфокислота или, однако, оптически активная камфановая кислота, соответственно другие оптически активные терпеновые кислоты.
Естественно, также можно получать оптически активные соединения формулы (I) по вышеописанным способам тем, что применяют исходные вещества, которые уже оптически активны.
Формула (I) охватывает все стереоизомеры и их смеси, например рацематы.
Предметом изобретения, далее, является применение соединений формулы (I) и их физиологически приемлемых солей для приготовления фармацевтических композиций, в особенности нехимическим путем. При этом их вместе по меньшей мере с одним твердым, жидким и/или полужидким носителем или вспомогательным веществом и в случае необходимости в комбинации с одним или несколькими другими биологически активными веществами можно доводить до пригодной дозировочной формы.
Предметом изобретения, далее, являются средства, в особенности фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I) и/или одну из его физиологически приемлемых солей.
Эти композиции можно применять в качестве лекарственных средств в медицине или ветеринарии. В качестве носителей принимают во внимание органические или неорганические вещества, которые пригодны для кишечного (например), орального, парентерального или топического применения и не реагируют с новыми соединениями, например, как вода, растительные масла, бензиловые спирты, полиэтиленгликоли, глицеринтриацетат, желатина, углеводы, как лактоза или крахмалы, стеарат магния, тальк, вазелин. Для орального применения служат в особенности таблетки, драже, капсулы, сиропы, соки или капли; для ректального применения служат свечи; для парентерального применения служат растворы, предпочтительно масляные или водные растворы; далее, суспензии, эмульсии или имплантаты; для топического применения служат мази, кремы, пластыри (Sticks) или порошки (пудры). Новые соединения можно также лиофилизировать и полученные лиофилизаты применять, например, для приготовления препаратов для инъекций.
Указанные композиции могут быть стерилизованы и/или могут содержать вспомогательные вещества, как смазки, консерванты, стабилизаторы и/или смачиватели, эмульгаторы, соли для влияния на осмотическое давление, буферные вещества, красители, вкусовые вещества и/или ароматические вещества. Если желательно, они могут также содержать одно или несколько других биологически активных веществ, например, один или несколько витаминов.
Соединения формулы (I) можно применять при борьбе с заболеваниями, в особенности с аритмиями и сердечными недостаточностями, а также при терапии человеческого или животного организма.
При этом предлагаемые согласно изобретению вещества как правило вводят по аналогии с известными, положительно инотропно действующими веществами, как Амринон, предпочтительно в дозах примерно 1-100 мг, в особенности 2-20 мг, на дозировочную единицу.
Суточная доза составляет предпочтительно примерно 0,2-20 мг/кг веса тела. Специальная доза для каждого определенного пациента зависит, однако, от самых различных факторов, например от эффективности используемого особого соединения, от возраста, веса тела, общего состояния здоровья, пола, от стоимости, момента и пути введения, от скорости выделения, комбинации лекарственных веществ и тяжести соответствующего заболевания, которое имеет значение для терапии. Предпочтительно оральное применение. По сравнению с до сих пор применяемыми для лечения сердечной недостаточности Digitalis-гликозидами, соединения формулы (I) отличаются улучшенным терапевтическим диапазоном и периферической разгрузкой.
В нижеследующих примерах выражение “обычная обработка” обозначает: добавляют, если необходимо, воду или разбавленный раствор гидроксила натрия, экстрагируют органическим растворителем, как этилацетат, хлороформ или дихлорметан, разделяют, органическую фазу сушат над сульфатом натрия, отфильтровывают, выпаривают и очищают путем хроматографии и/или кристаллизации, Rf-значения определяют на силикагеле.
Выше- и нижеуказанные, все температуры даны в градусах Цельсия.
Пример 1К раствору 10 г 3,6-дигидро-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-6-хинолил/-6-метил-2H-1,3,4-тиадиазин-2-она (“A”) и 9,8 мл триэтиламина в 100 мл дихлорметана при перемешивании прикалывают 6 г 2-N,N-диэтиламиноэтилового сложного эфира хлормуравьиной кислоты, растворенные в 50 мл дихлорметана и дополнительно перемешивают в течение часа при 20oC. Растворитель удаляют, обрабатывают как обычно и получают 3-/2-(N,N-диэтиламино)-этоксикарбонил/-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; гидрохлорид. Аналогичным образом, путем взаимодействия “A” с 3-N, N-диэтиламино-пропиловым эфиром хлормуравьиной кислоты получают 3-/3-(N, N-диэтиламино)-пропоксикарбонил/-5-/1,2,3,4- тетрагидро-1-(3,4-диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро- 2H-1,3,4-тиадиазин-2-он; гидрохлорид; с 6-N, N-диметиламино-гексиловым эфиром хлормуравьиной кислоты получают 3-/6-(N, N-диметиламино)-гексилоксикарбонил/-5-/1,2,3,4- тетрагидро-1-(3,4-диметоксибеизоил)-6-хинолил/-6-метил-3,6-дигидро- 2H-1,3,4-тиадиазин-2-он, гидрохлорид; с 2-N,N-диметиламино-1-метил-этиловым эфиром хлормуравьиной кислоты получают 3-/1-метил-2-(N, N-диметиламино)-этоксикарбонил/- 5-/1,2,3,4-тетрагидро-1-(3,4-диметоксибензоил)-6-хинолил/-6-метил- 3,6-дигидро-2H-1,3,4-тиадиазин-2-он; гидрохлорид; с 1-метил-4-пиперидиловым эфиром хлормуравьиной кислоты получают 3-(1-метил-4-пиперидилоксикарбонил)-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; полуфумарат; с 2-морфолино-этиловым эфиром хлормуравьиной кислоты получают 3-(2-морфолино-этоксикарбонил)-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; с 3-морфолино-пропиловым эфиром хлормуравьиной кислоты получают 3-(3-морфлино-пропоксикарбонил)-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензолил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; с 2-тиоморфолино-этиловым эфиром хлормуравьиной кислоты получают 3-(2-тиоморфолино-этоксикарбонил)-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; с 3-тимоморфолино-пропиловым эфиром хлормуравьиной кислоты получают 3-(3-тиоморфолино-пропоксикарбонил)-5-/1,2,3,4-тетрагидро- 1-(3,4-диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4- тиадиазин-2-он; с 2-пиперазино-этиловым эфиром хлормуравьиной кислоты получают 3-(2-пиперазино-этоксикарбонил)-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; с 3-пиперазино-пропиловым эфиром хлормуравьиной кислоты получают 3-(3-пиперазино-пропоксикарбонил)-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; с 2-пирролидино-этиловым эфиром хлормуравьиной кислоты получают 3-(2-пирролидино-этоксикарбонил)-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; с 3-пирролидино-пропиловым эфиром хлормуравьиной кислоты получают 3-(3-пирролидино-пропоксикарбонил)-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; Аналогичным образом, путем взаимодействия (+)-3,6-дигидро-5-/1,2,3,4-тетрагидро-1-(3,4-диметоксибензоил)-6- хинолил/-6-метил-2H-1,3,4-тиадиазин-2-она с 2-N, N-диэтиламино-этиловым эфиром хлормуравьиной кислоты получают (+)-3-/2-(N, N-диэтиламино)-этоксикарбонил/-5-/1,2,3,4- тетрагидро-1-(3,4-диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро- 2H-1,3,4-тиадиазин-2-он; гидрохлорид; т.пл. 135oC; с 3-N, N-диэтиламино-пропиловым эфиром хлормуравьиной кислоты получают (+)-3-/3-(N, N-диэтиламино)-пропоксикарбонил/-5-/1,2,3,4- тетрагидро-1-(3,4-диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро- 2H-1,3,4-тиадиазин-2-он; гидрохлорид, т.пл. 130oC; с 6-N, N-диэтиламино-гексиловым эфиром хлормуравьиной кислоты получают (+)-3-/6-(N, N-диметиламино)-гексилоксикарбонил/-5-/1,2,3,4- тетрагидро-1-(3,4-диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро- 2H-1,3,4-тиадиазин-2-он; гидрохлорид; т.пл. 133oC; с 6-N, N-диэтиламино-1-метил-этиловым эфиром хлормуравьиной кислоты получают (+)-3-/1-метил-2-(N,N-диметиламино)-этоксикарбонил/- 5-/1,2,3,4-тетрагидро-1-(3,4-диметоксибензоил)-6-хинолил/-6-метил-3,6- дигидро-2H-1,3,4-тиадиазин-2-он; гидрохлорид; т.пл. 168oC; с 1-метил-4-пиперидиловым эфиром хлормуравьиной кислоты получают (+)-3-/1-метил-4-пиперидилоксикарбонил/-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; гидрохлорид; т.пл. 150oC. Аналогичным образом, путем взаимодействия в 2-N,N-диэтиламиноэтилового эфира хлормуравьиной кислоты с 5-/1,2,3,4-тетрагидро-1-(3-этокси-4-метоксибензоил)-6- хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-оном получают 3-/2-(N, N-диэтиламино)-этоксикарбонил/-5-/1,2,3,4-тетрагидро-1-(3- этокси-4-метоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4- тиадиазин-2-он; с 5-/1,2,3,4-тетрагидро-1-(3-метокси-4-этоксибензоил)-6- хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-оном получают 3-/2-(N,N-диэтиламино)-этоксиарбонил/-5-/1,2,3,4-тетрагидро-1-(3- метокси-4-этоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4- тиадиазин-2-он; с 5-/1,2,3,4-тетрагидро-1-(3-метокси-4-гидроксибензоил)-6- хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-оном получают 3-/2-(N, N-диэтиламино)-этоксикарбонил/-5-/1,2,3,4-тетрагидро-1-(3- метокси-4-гидроксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4- тиадиазин-2-он. Пример 2 К раствору 10 г 3,6-дигидро-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-4,4-диметил-6-хинолил/-6-метил-2H-1,3,4-тиадиазин-2-она (“B”) и 9,8 мл пиридина в 100 мл дихлорметана при перемешивании прикапывают 6 г 2-N,N-диэтиламино-этилового эфира хлормуравьиной кислоты, растворенные в 50 мл дихлорметана, и дополнительно перемешивают в течение часа при 20oC. Растворитель удаляют, обрабатывают как обычно и получают 3-/2-(N,N-диэтиламино)-этоксикарбонил/-5-/1,2,3,4-тетрагидро- 1-(3,4-диметоксибензоил)-4,4-диметил-6-хинолил/-6-метил-3,6-дигидро-2H- 1,3,4-тиадиазин-2-он; Rf (ТГФ) = 0,65. Аналогичным образом, путем взаимодействия “B” с 3-N, N-диэтиламино-пропиловым эфиром хлормуравьиной кислоты получают 3-/3-(N, N-диэтиламино)-пропоксикарбонил/-5-/1,2,3,4- тетрагидро-1-(3,4-диметоксибензоил)-4,4-диметил-6-хинолил/-6- метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; Rf (ТГФ) = 0,64; с 6-N, N-диметиламино-гексиловым эфиром хлормуравьиной кислоты получают 3-/6-(N, N-диметиламино)-гексилоксикарбонил/-5-/1,2,3,4- тетрагидро-1-(3,4-диметоксибензоил)-4,4-диметил-6-хинолил/-6-метил- 3,6-дигидро-2H-1,3,4-тиадиазин-2-он; Rf (ТГФ) = 0,2; с 2-N, N-диметиламино-1-метил-этиловым эфиром хлормуравьиной кислоты получают 3-/1-метил-2-(N,N-диметиламино)-этоксикарбонил/-5-/1,2,3,4- тетрагидро-1-(3,4-диметоксибензоил)-4,4-диметил-6-хинолил/-6-метил- 3,6-дигидро-2H-1,3,4-тиадиазин-2-он; Rf (ТГФ) = 0,25; с 1-метил-4-пиперидиловым эфиром хлормуравьиной кислоты получают 3-(1-метил-4-пиперидилоксикарбонил)-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-4,4-диметил-6-хинолил/-6-метил-3,6-дигидро-2H- 1,3,4-тиадиазин-2-он; полуфумарат; Rf (ТГФ) = 0,65. Аналогичным образом, путем взаимодействия 2-N,N-диэтиламиноэтилового эфира хлормуравьиной кислоты с 5-/1,2,3,4-тетрагидро-1-(3-этокси-4-метоксибензоил)-6-хинолил/- 4,4-диметил-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-оном получают 3-/2-(N,N-диэтиламино)-этоксикарбонил/-5-/1,2,3,4-тетрагидро-1-(3- этокси-4-метоксибензоил)-4,4-диметил-6-хинолил/-6-метил-3,6- дигидро-2H-1,3,4-тиадиазин-2-он; с 5-/1,2,3,4-тетрагидро-1-(3-метокси-4-этоксибензоил)-6-хинолил/- 4,4-диметил-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-оном получают 3-/2-(N,N-диэтиламино)-этоксикарбонил/-5-/1,2,3,4-тетрагидро-1-(3- метокси-4-этоксибензоил)-4,4-диметил-6-хинолил/-6-метил-3,6-дигидро- 2H-1,3,4-тиадиазин-2-он; с 5-/1,2,3,4-тетрагидро-1-(3-метокси-4-гидроксибензоил)-4,4- диметил-6-хинолил/-6-метил-3,6-дигидро)-2H-1,3,4-тиадиазин-2-оном получают 3-/2-(N, N-диэтиламино)-этоксикарбонил/-5-/1,2,3,4-тетрагидро- 1-(3-метокси-4-гидроксибензоил)-4,4-диметил-6-хинолил/-6-метил-3,6- дигидро-2H-1,3,4-тиадиазин-2-он; Пример 3 К раствору 10 г 3-/2-хлорэтоксикарбонил/-5-/1,2,3,4-тетрагидро- 1-(3,4-диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4- тиадиазин-2-она и 9 мл пиридина в 100 мл дихлорметана при перемешивании прикапывают 2,5 г диэтиламина, растворенные в 30 мл дихлорметана, и дополнительно перемешивают в течение часа при 20oC. Растворитель удаляют, обрабатывают как обычно и получают 3-/2-(N, N-диэтиламино)-этоксикарбонил/-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; гидрохлорид. Пример 4 Аналогично примеру 1, путем взаимодействия 3-N,N-диэтиламинопропилового эфира хлормуравьиной кислоты с 5-/1,2,3,4-театрагидро-1-(3-этокси-4-метокси-бензоил)-6- хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-оном получают 3-/3-(N, N-диэтиламино)-пропоксикарбонил/-5-/1,2,3,4-тетрагидро-1-(3- этокси-4-метоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4- тиадиазин-2-он; с 5-/1,2,3,4-тетрагидро-1-(3-метокси-4-этоксибензоил)-6- хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-оном получают 3-/3-(N,N-диэтиламино)-пропоксикарбонил/-5-/1,2,3,4-тетрагидро-1-(3- метокси-4-этоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4- тиадиазин-2-он; с 5-/1,2,3,4-тетрагидро-1-(3-метокси-4-гидроксибензоил)-6- хииолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-оном получают 3-/3-(N, N-диэтиламино)-пропоксикарбонил/-5-/1,2,3,4-тетрагидро-1-(3- метокси-4-гидроксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H- 1,3,4-тиадиазин-2-он. Пример 5 Аналогично примеру 2, путем взаимодействия 3-N,N-диэтиламинопропилового эфира хлормуравьиной кислоты с 5-/1,2,3,4-тетрагидро-1-(3-метокси-4-метоксибензоил)-4,4- диметил-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-оном получают 3-/3-(N,N-диэтиламино)-пропоксикарбонил/-5-/1,2,3,4- тетрагидро-1-(3-этокси-4-метоксибензоил)-4,4-диметил-6-хинолил/-6- метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; с 5-/1,2,3,4-тетрагидро-1-(3-метокси-4-этоксибензоил)-4,4- диметил-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-оном получают 3-/3-(N, N-диэтиламино)-пропоксикарбонил/-5-/1,2,3,4- тетрагидро-1-(3-метокси-4-этоксибензоил)-4,4-диметил-6-хинолил/-6- метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; с 5-/1,2,3,4-тетрагидро-1-(3-метокси-4-гидроксибензоил)-4,4- диметил-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-оном получают 3-/3-(N, N-диэтиламино)-пропоксикарбонил/-5-/1,2,3,4- тетрагидро-1-(3-метокси-4-гидроксибензоил)-4,4-диметил-6-хинолил/-6- метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он. Пример 6 Раствор 12 г 3-/2-(N,N-диэтиламино)-этоксикарбонил/-5-(1,2,3,4- тетрагидро-6-хинолил)-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-она (получен аналогично примеру 1 путем взаимодействия 5-(1,2,3,4-тетрагидро-6-хинолил)-6-метил-3,6-дигидро-2H-1,3,4- тиадиазин-2-она с 2-N, N-диэтиламиноэтиловым эфиром хлормуравьиной кислоты) в 100 мл дихлорметана смешивают с 5 мл триэтиламина, затем при перемешивании прикапывают 4 мл ацетилхлорида. Перемешивают еще час при 20oC, разлагают водой, обрабатывают как обычно и получают 3-/2-(N, N-диэтиламино)-этокси-карбонил/-5-(1-ацетил-1,2,3,4- тетрагидро-6-хинолил)-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он. Аналогичным образом получают нижеследующие 3-/2-(N,N-диэтиламино-этоксикарбонил/-[R]-6-метил-3,6-дигидро-2H- 1,3,4-тиадиазин-2-оны, где -[R]- обозначает: 5-(1-формил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-пропионил-1,2,3,4-тетрагмдро-6-хинолил)-; 5-(1-бутирил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-изобутирил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-валерил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-изовалерил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-пивалоил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-бензоил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-п-метоксибензоил-1,2,3,4-тетрагидро-6-хинолил)-; 5-/1-(3,4-метилендиоксибензоил)-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-п-метилтиобензоил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-п-метилсульфинилбензоил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-п-метилсульфонилбензоил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-пиколиноил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-никотиноил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-изоникотиноил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-метансульфонил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-бензолсульфонил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-п-толуолсульфонил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-формил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-ацетил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-пропионил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-бутирил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-изобутирил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-валерил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-изовалерил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-пивалоил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-бензоил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-п-метоксибензоил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-/1-(3,4-метилендиоксибензоил)-4,4-диметил-1,2,3,4-тетрагидро-6- хинолил/-; 5-(1-п-метилтиобензоил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-п-метилсульфинилбензоил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-п-метилсульфонилбензоил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-пиколиноил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-никотиноил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-изоникотиноил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-метансульфонил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-бензолсульфонил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; 5-(1-п-толуолсульфонил-4,4-диметил-1,2,3,4-тетрагидро-6-хинолил)-; Пример 7 Аналогично примеру 1, путем взаимодействия 3,6-дигидро-5-/1,2,3,4-тетрагидро-1-(3-метокси-4-этоксибензоил)-6- хинолил/-6-метил-2H-1,3,4-тиадиазин-2-она с 3-морфолино-пропиловым эфиром хлормуравьиной кислоты получают 3-(3-морфолино-пропоксикарбонил)-5-/1,2,3,4-тетрагидро-1-(3- метокси-4-этоксибензоил)-6-хинолил/-6-метил-2H-1,3,4-тиадиазин-2-он; 3,6-дигидро-5-/1,2,3,4-тетрагидро-1-(3-метокси-4-этоксибензоил)-6- хинолил/-6-метил-2H-1,3,4-тиадиазин-2-она с 3-пиперидино-пропиловым эфиром хлормуравьиной кислоты получают 3-(3-пиперидино-пропокси-карбонил)-5-/1,2,3,4-тетрагидро-1-(3- метокси-4-этоксибензоил)-6-хинолил/-6-метил-2H-1,3,4-тиадиазин-2-он. Пример 8 К раствору 10 г 3-(3-пиперазино-пропоксикарбонил)-5-/1,2,3,4- теграгидро-1-(3,4-диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро- 2H-1,3,4-тиадиазин-2-она и 1,8 г триэтиламина в 100 мл толуола при перемешивании прикалывают 1,3 г этилхлорида, растворенные в 10 мл толуола, и перемешивают при нагревании в течение часа. Растворитель удаляют, обрабатывают как обычно и получают 3-/3-(1-этил-4-пиперазинил)-пропоксикарбонил/- 5-/1,2,3,4-тетрагидро-1-(3,4-диметоксибензоил)-6-хинолил/-6- метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он. Пример 9 Аналогично примеру 1, путем взаимодействия 3,6-дигидро-5-/1,2,3,4-тетрагидро-1-(3-метокси-4-этоксибензоил)- 4,4-диметил-6-хинолил/-6-метил-2H-1,3,4-тиадиазин-2-она с 3-морфолинопропиловым эфиром хлормуравьиной кислоты получают 3-(3-морфолино-пропоксикарбонил)-5-/1,2,3,4-тетрагидро-1-(3-метокси-4- этоксибензоил)-4,4-диметил-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4- тиадиазин-2-он; 3,6-дигидро-5-/1,2,3,4-тетрагидро-1-(3-метокси-4-этоксибензоил)- 4,4-диметил-6-хинолил/-6-метил-2H-1,3,4-тиадиазин-2-она с 3-пиперидино-пропиловым эфиром хлормуравьиной кислоты получают 3-(3-пиперидино-пропоксикарбонил)-5-/1,2,3,4-тетрагидро-1-(3-метокси-4- этоксибензоил)-4,4-диметил-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4- тиадиазин-2-он; 3,6-дигидро-5-/1,2,3,4-теграгидро-1-(3,4-диметоксибензоил)-6- хинолил/-6-метил-2H-1,3,4-тиадиазон-2-она с Cl-C (=O)-O-C10H20-N-(CH3)2 получают 3-/10-(N, N-диметиламино)-децилоксикарбонил/-5-/1,2,3,4-тетрагидро- 1-(3,4-диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4- тиадиазин-2-он, т.пл. = 87oC; 3,6-дигидро-5-/1,2,3,4-тетрагидро-1-(3,4-диметоксибензоил)-6- хинолил/-6-метил-2H-1,3,4-тиадиазин-2-она с 6-пирролидино-гексиловым эфиром хлормуравьиной кислоты получают 3-(6-пирролидино-гексилоксикарбонил)-5-/1,2,3,4-тетрагидро-1-(3,4- диметоксибензоил)-6-хинолил/-6-метил-3,6-дигидро-2H-1,3,4-тиадиазин-2-он; т.пл. = 107oC. Нижеследующие примеры относятся к фармацевтическим композициям, которые содержат биологически активные вещества формулы (I) или их соли. Пример А: Таблетки и драже Обычным образом прессуют таблетки следующего состава, которые в случае необходимости покрывают оболочкой для драже на основе сахарозы: биологически активное вещество формулы (I) – 100 мг микрокристаллическая целлюлоза – 278,8 мг лактоза – 110 мг кукурузный крахмал – 11 мг стеарат магния – 5 мг высокодисперсный диоксид кремния – 0,2 мг Пример Б: Твердые желатиновые капсулы Обычные, состоящие из двух частей (разъемные) твердые желатиновые капсулы заполняют с помощью композиции следующего состава: биологически активное вещество формулы (I) – 100 мг лактоза – 150 мг целлюлоза – 50 мг стеарат магния – 6 мг Пример В: Мягкие желатиновые капсулы Обычные мягкие желатиновые капсулы заполняют смесью из 50 мг биологически активного вещества и 250 мг оливкового масла. Пример Г: Ампулы Раствор 200 мг биологически активного вещества в 2 кг пропан-1,2-диола доливают водой до 10 мл и заполняют им ампулы так, что каждая ампула содержит 20 мг биологически активного вещества. Пример Д: Водная суспензия для орального введения Готовят обычным образом водную суспензию биологически активного вещества. Разовая (единичная) доза (5 мл) содержит 100 мг биологически активного вещества, 100 мг натрийкарбоксиметилцеллюлозы, 5 мг бензоата натрия и 100 мг сорбита. Пример Е: Свечи Расплавляют смесь 20 г биологически активного вещества со 100 г соевого лецитина и 1400 г масла какао, разливают в формы и оставляют охлаждаться. Каждая свеча содержит 20 мг биологически активного вещества. Фармакологические данные Определяли in vivo положительную инотропную активность некоторых характерных соединений общей формулы (I) в соответствии с методом, описанным F. Mahler Am. J. Cardiol. 1975, 35, 626-634 Winter, Cardiovasc. Research, 1978, 12, 81-90. Полученные данные по увеличению пика скорости увеличения левого вертикального давления (dP/dt) приведены в нижеследующей таблице. 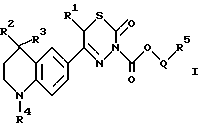 R4 = 3,4-диметоксибензоилс Формула изобретения
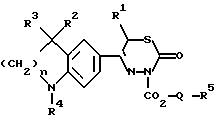 где R1 обозначает А; R2 и R3 обозначают H, A; R4 обозначает бензоил, замещенный C1 – C6-алкоксигруппой; R5 обозначает NA2 или насыщенный пяти- или шестичленный гетероциклический остаток по меньшей мере с одним N-атомом, который может быть замещен А; Q отсутствует или обозначает разветвленный или неразветвленный алкилен с 1 – 10 С-атомами; n обозначает 1, 2 или 3; А обозначает алкил с 1 – 6 С-атомами, а также их физиологически приемлемые соли. 2. 3-Алкоксикарбонил-тиадиазиноны по п.1, представляющие собой (а) 3-[2-(N, N-диэтиламино)-этоксикарбонил] -5-[1,2,3,4-тетрагидро-1-(3,4-диметокси-бензоил)-6-хинолил] -6-метил-2Н-3,6-дигидро-1,3,4-тиадиазин-2-он; (б) 3-[3-(N, N-диэтиламино)-пропоксикарбонил]-5-[1,2,3,4-тетрагидро-1-(3,4-диметокси-бензоил)-6-хинолил] -6-метил-2Н-3,6-дигидро-1,3,4-тиадиазин-2-он; (в) 3-[6-(N,N-диметиламино)-гексилоксикарбонил]-5-[1,2,3,4-тетрагидро-1-(3,4-диметокси-бензоил)-6-хинолил] -6-метил-2Н-3,6-дигидро-1,3,4-тиадиазин-2-он; (г) 3-[1-метил-2-(N, N-диметиламино)-этоксикарбонил] -5-[1,2,3,4-тетрагидро-1-(3,4-диметокси-бензоил)-6-хинолил] -6-метил-2Н-3,6-дигидро-1,3,4-тиадиазин-2-он; (д) 3-[1-метил-4-пиперидилоксикарбонил)-5-[1,2,3,4-тетрагидро-1-(3,4-диметокси-бензоил)-6-хинолил]-6-метил-2Н-3,6-дигидро-1,3,4-тиадиазин-2-он; (е) 3-[2-(N, N-диэтиламино)-этоксикарбонил] -5-[1,2,3,4-тетрагидро-1-(3,4-диметокси-бензоил)-4,4-диметил-6-хинолил] -6-метил-2Н-3,6-дигидро-1,3,4-тиадиазин-2-он; (ж) 3-[6-(N,N-диметиламино)-гексилоксикарбонил]-5-[1,2,3,4-тетрагидро-1-(3,4-диметокси-бензоил)-4,4-диметил-6-хинолил] -6-метил-2Н-3,6-дигидро-1,3,4-тиадиазин-2-он; (з) 3-[1-метил-4-пиперидилоксикарбонил] -5-[1,2,3,4-тетрагидро-1-(3,4-диметокси-бензоил)-4,4-диметил-6-хинолил] -6-метил-2Н-3,6-дигидро-1,3,4-тиадиазин-2-он; (и) 3-[1-метил-2-(N, N-диметиламино)-этоксикарбонил] -5-[1,2,3,4-тетрагидро-1-(3,4-диметокси-бензоил)-4,4-диметил-6-хинолил] -6-метил-2Н-3,6-дигидро-1,3,4-тиадиазин-2-он. 3. Способ получения соединений формулы I по п.1 или их солей, заключающийся в том, что соединение формулы II 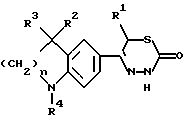 (II) (II)где R1, R2, R3, R4 и n имеют указанные в п.1 значения, вводят во взаимодействие с соединением формулы III X-CO2-Q-R5, где R5 и Q имеют указанные в п.1 значения; X обозначает Cl, Br, OH или реакционноспособную, этерифицированную до сложноэфирной OH-группу, с последующими в случае необходимости преобразованиями: соединение, которое соответствует формуле (I) и вместо R5 содержит первичную или вторичную амино-группу, обычным образом алкилируют; соединение, которое соответствует формуле I и вместо R4 содержит атом водорода, обычным образом ацилируют; в соединении формулы I один остаток R4 превращают в другой остаток R4; и/или основание формулы I путем обработки кислотой превращают в одну из его солей. 4. Фармацевтическая композиция с положительным инотропным действием, отличающаяся тем, что в качестве активного вещества она содержит по меньшей мере одно соединение формулы I по п.1 и/или одну из его физиологически приемлемых солей в эффективном количестве. РИСУНКИ
MM4A – Досрочное прекращение действия патента СССР или патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 11.01.2007
Извещение опубликовано: 20.07.2010 БИ: 20/2010
|
||||||||||||||||||||||||||
