Патент на изобретение №2162084
|
||||||||||||||||||||||||||
(54) СУЛЬФОНАМИДЫ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ
(57) Реферат: Описываются новые соединения – сульфонамиды общей формулы I, где R1 выбран из моноциклического пяти-шестичленного S, N и/или О-содержащего гетероциклического остатка, такого как пиридил, пиримидинил, изоксазолил, тиенил, тиазолил, которые могут быть незамещены или замещены низшим алкилом, галогеном или низшим алканоилом; R2 обозначает водород, низший алкил, низший алкокси, низший алкилтио, низший алкокси-низший алкил, низший алкилсульфонил-низший алкокси, фенил, низший алкилфенил, низший алкоксифенил, низший алкилендиоксифенил, фенил-низший алкил, низший алкилфенил-низший алкил, низший алкоксифенил-низший алкил, низший алкилендиоксифенил-низший алкил, моноциклический шестичленный N и/или О-содержащий гетероциклический остаток, такой как пиримидинил, пиридил, морфолино; R3 обозначает низший алкил, низший алкокси, формил, галоген-низший алкил, гидрокси-низший алкил, амино-низший алкил или остаток -СН2О-А-низший алкил, -(СН2)m-O-(CRaRb)nOH, -(CH2)m-O-(CRaRb)nOR9, -(СН2)m-O-(СН2)nNH2 или -(СН2)m-O-(CRaRb)n-B-R9; R4 – R8 обозначают водород, низший алкокси или галоген; R9 обозначает пиридил, пиримидинил; Ra и Rb обозначают водород или низший алкил; А представляет собой кеталированную 1,2-дигидроксиэтиленовую группу; В представляет собой -ОС(O)O-, -OC(O)NH-, -NHC(O)NH- или -NHC(O)O-; n обозначает 2, 3 или 4 и m обозначает 0 или 1. Соединения формулы I представляют собой ингибиторы рецепторов эндотелина, поэтому они могут найти применение в качестве биологически активных веществ при изготовлении лекарственных средств для лечения заболеваний, ассоциируемых с активностью эндотелия, в частности заболеваний системы кровообращения, например гипертонии, ишемии, спазмов сосудов и стенокардии. 3 с. и 21 з.п. ф-лы. 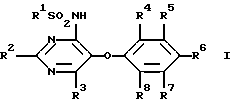
Изобретение относится к новым сульфонамидам, обладающим свойствами ингибитора связывания эндотелина, и фармацевтическому препарату на их основе. Изобретение относится в частности к новым соединениям формулы 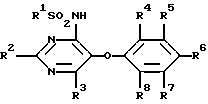 где R1 обозначает гетероциклил, выбранный из моноциклического пяти-, шестичленного S-, N- и/или O-содержащего гетероциклического остатка, такого как пиридил, пиримидинил, изоксазолил, тиенил, тиазолил, которые могут быть незамещены или замещены низшим алкилом, галогеном или низшим алканоилом; R2 обозначает водород, низший алкил, низший алкокси, низший алкилтио, низший алкокси-низший алкил, низший алкилсульфонил-низший алкокси, фенил, низший алкилфенил, низший алкоксифенил, низший алкилендиокси-фенил, фенил-низший алкил, низший алкилфенил-низший алкил, низший алкоксифенил-низший алкил, низший алкилендиоксифенил-низший алкил, гетероциклил – моноциклический шестичленный N- и/или O-содержащий гетероциклический остаток, такой как пиримидинил, пиридил, морфолино; R3 обозначает низший алкил, низший алкокси, формил, галоген-низший алкил, гидрокси-низший алкил, амино-низший алкил или остаток -CH2O-A-низший алкил, -(CH2)m-O-(CRaRb)nOH, -(CH2)m-O-(CRaRb)nOR9, -(CH2)m-O-(CH2)nNH2 или -(CH2)m-O-(CRaRb)n-B-R9; R4-R8 обозначают водород, низший алкокси или галоген; R9 обозначает пиридил, пиримидинил; Ra и Rb обозначают водород или низший алкил; A представляет собой кеталированную 1,2-дигидроксиэтиленовую группу; B представляет собой -OC(O)O-, – OC(O)NH-, -NHC(O)NH- или -NHC(O)O-; n обозначает 2, 3 или 4 и m обозначает 0 или 1. Ближайшим аналогом является заявка EP-A-0526708, где описаны соединения из ряда сульфонамидов, обладающие свойствами подавлять рецепторы эндотелина. Поразительным оказалось, что сульфонамиды настоящего изобретения показали неожиданно высокую степень антагонизма в опытах in vitro. Предлагаемые соединения нетоксичны или слаботоксичны. Используемое здесь определение “низший” обозначает группы с числом C-атомов 1-7, предпочтительно 1-4 C-атомов. Алкильные группы, алкокси- и алкилтиогруппы, равно как и алкильные группы, являющиеся фрагментами алканоильных групп, могут быть линейными или разветвленными. Примерами таких алкильных групп являются метил, этил, пропил, изопропил, бутил, втор- и трет-бутил. Под галогеном имеются в виду фтор, хлор, бром и йод, причем предпочтителен из них хлор. Низший алкилендиоксифенильный остаток представляет собой, например, этилендиоксифенильный остаток. Кетализованная 1,2-дигидроксиэтиленовая группа представляет собой, например, 2,2-диметил-1,3-диоксолан-4,5-дииловую группу. Примерами указанных замещенных гетероциклильных остатков являются прежде всего замещенные, например, низшим алкилом, низшим алканоилом, галогеном. Возможны также гетероциклильные остатки одно- либо двузамещенные другим гетероциклическим остатком или незамещенные моно- либо бициклические 5- и 6-членные гетероциклические остатки, содержащие в качестве гетероатома кислород, азот или серу, как 2- и 3-фурил, пиримидинил, 2-, 3- и 4-пиридил, 1,2- и 1,4-диазинил, морфолино, 2- и 3-тиенил, изоксазолил, оксазолил, тиазолил, имидазолил, пирролил, бензофуранил, бензотиенил, индолил, пуринил, хинолил, изохинолил и хиназолил. Примерами гетероциклильных остатков R1 могут служить в первую очередь замещенный и незамещенный пиридил, пиримидинил, тиенил и изоксазолил. Примерами гетероциклильных остатков R2 являются прежде всего пиримидинил и морфолино. В качестве примеров гетероциклильных остатков R9 можно также назвать кроме пиридила – пиримидинил и фурил. R9 также может быть фенилом, возможно замещенным низшим алкилом, низшим алкокси и/или галогеном, или низшим алкилом. К соединениям формулы I могут быть отнесены те из них, в которых R1 представляет собой моноциклический S-, N- и/или O-гетероциклический остаток, прежде всего незамещенный или замещенный низшим алкилом, галогеном, аминогруппой, моно- либо ди-низший алкил-аминогруппой или низшим алканоилом пиридил, пиримидинил, изоксазолил, фурил или тиенил, и соединения формулы I, где R2 представляет собой водород, пиримидинил, пиридил, морфолино, тиоморфолино, пиперидино, пирролидино, бензодиоксолил, низший алкоксифенил или низший алкилтио, а также такие соединения, в которых R3 представляет собой остаток -O-(CRaRb)nOH, -O-(CRaRb)nNH2 или остаток -O(CH2)2-B-R9, и R9 обозначает моноциклический N- и/или O-гетероциклический остаток, прежде всего пиридил, пиразинил или фурил. Особый интерес представляют соединения формулы I, в которых R1 представляет собой замещенный низшим алкилом пиридиловый остаток, R2 представляет собой морфолино, R3 представляет собой остаток – O(CH2)2OC(O)NHR9, R4 представляет собой низший алкокси и R5-R8 являются водородом. Предпочтительными остатками R9 являются гетероциклильные остатки, прежде всего пиридиловые остатки, как 2-пиридил. Соединения вышеприведенной формулы I обладают свойствами ингибиторов рецепторов эндотелина. Поэтому они могут применяться для лечения заболеваний, ассоциируемых с активностью эндотелина, прежде всего заболеваний системы кровообращения, таких как гипертония, ишемия, спазмы сосудов и стенокардия. Соединения формулы I могут быть получены следующим путем: а) соединение формулы 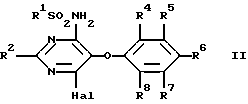 где R1, R2 и R4-R8 имеют значение, указанное выше, a Hal обозначает галоген, подвергают взаимодействию с соединением формулы HO(CRaRb)nXH где n, Ra и Rb имеют значение, указанное выше, а X обозначает O либо NH, или б) соединение формулы 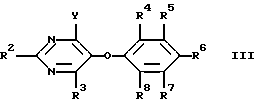 где R2-R8 имеют значение, указанное выше, подвергают взаимодействию с соединением формулы R1SO2Z где R1 имеет значение, указанное выше, a Y и Z представляют собой соответственно галоген и аминогруппу, либо Y представляет собой аминогруппу, а Z галоген, или в) соединение формулы 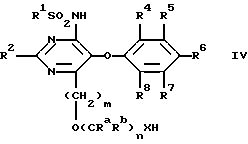 где R1, R2, R4-R8, Ra, Rb, X, m и n имеют значение, указанное выше, подвергают взаимодействию в1) с изоцианатом формулы R9NCO либо карбамоилхлоридом формулы R9NCOCl, где R9 имеет значение, указанное выше, или в2) с фосгеном, а затем со спиртом формулы R9OH; либо с эфиром хлормуравьиной кислоты формулы R9OC(O)Cl; или г) соединение формулы I, в которой R3 представляет собой галоген-низший алкил, подвергают взаимодействию с соединением формулы HOCH2-A-низший алкил, где A представляет собой кеталированную 1,2-дигидроксиэтиленовую группу. При необходимости содержащиеся в полученном соединении формулы I заместители модифицируют и/или полученное соединение формулы I переводят в соль. При осуществлении взаимодействия соединения формулы II с соединением формулы HO(CRaRb)nXH последнее целесообразно применять в виде алкоголята щелочного металла. В качестве растворителя при этом предпочтительно используют соответствующий гликоль либо соответствующий аминоспирт, например этиленгликоль, или соответственно аминоэтанол, если n=2. В качестве алкоголята щелочного металла предпочтение отдают алкоголяту натрия. Реакцию целесообразно осуществлять при нагревании, например, до температуры 40-120oC. В одном из предпочтительных вариантов выполнения изобретения соединение HO(CRaRb)nXH в виде натриевой соли представляет собой мононатриевую соль этилен-, пропилен- либо бутиленгликоля, соответственно аминоэтанола, аминопропанола либо аминобутанола. Взаимодействие соединения формулы III с соединением формулы R1SO2Z может осуществляться по известной методике, используемой для получения сульфонамидов, например в инертном органическом растворителе, таком как диметилсульфоксид, предпочтительно при нагревании и в атмосфере защитного газа, например аргона. Реакцию согласно варианту в1) способа можно осуществлять по известной методике, применяемой обычно для получения карбаматов и мочевин из спиртов, соответственно аминов. Так, соединение формулы IV с помощью изоцианата формулы R9NCO можно трансформировать в соответствующем безводном органическом растворителе, например, в углеводороде, таком как толуол, предпочтительно при нагревании, в соединение формулы I, в которой B представляет собой -OC(O)NH-. Изоцианат можно получать при этом in situ, например, из азида формулы R9CON3 путем термического разложения. Аналогичным образом при использовании соединений формулы IV, в которых B представляет собой NH, могут быть получены соединения формулы I с B, обозначающим -NHC(О)NH-. Согласно варианту в2) способа соединение формулы IV, в которой B является кислородом, с помощью фосгена, а затем с помощью спирта формулы R9OH может быть трансформировано в соединение формулы I, в которой A представляет собой остаток -OC(O)O-. Вместо фосгена может использоваться фосгеновая соль, такая как дифосген (Cl-COOCCl3) либо трифосген (CO(OCCl3)2). Аналогичным путем исходя из соединений формулы IV с B, представляющим собой NH, получают соединения формулы I с B, обозначающим -NHC(O)O-. Фосген при этом целесообразно применять в виде раствора в инертном безводном органическом растворителе, например в углеводороде, таком как толуол. Взаимодействие с фосгеном можно проводить при комнатной температуре. Полученный в качестве промежуточного продукта хлорид кислоты подвергают непосредственно взаимодействию со спиртом R9OH, предпочтительно при нагревании. Реакция согласно варианту г) способа может осуществляться в тех же условиях, которые описаны в варианте а) способа, получая таким путем соединения формулы I, в которых R3 представляет собой остаток -CH2O-A-низший алкил. Заместители, содержащиеся в полученном таким путем соединении формулы I, могут быть модифицированы. Так, метиловую группу R3 путем окисления можно трансформировать в формиловую группу. Окисление может проводиться по известной методике, например, с помощью двуокиси селена. В полученном таким путем соединении формиловая группа может быть восстановлена до гидроксиметиловой группы. Это восстановление может осуществляться по известной методике, например, с помощью восстановителя, как NaBH4. Гидроксиметиловая группа может быть переведена взаимодействием с галогенирующим средством, как POCl3/PCl5, в галогенметиловую группу. Далее, N-гетероциклические остатки, как пиридил, могут окисляться до N-оксидов. Все названные реакции могут осуществляться с помощью известных методов. Соединения формулы I по известной методике могут быть переведены в соли, например в соли щелочных металлов, такие как соли натрия и калия, или в соли щелочно-земельных металлов, такие как соли кальция и магния. Применяемые в качестве исходных соединения, если они неизвестны или если их получение описано ниже, могут быть получены аналогично известным методам, соответственно аналогично методам, описанным ниже. Ингибирующее действие соединений формулы I на рецепторы эндотелина может быть проиллюстрировано на серии опытов, описанных ниже. I. Ингибирование связывания эндотелина рекомбинантным ETA-рецептором кДНК, которая кодирует человеческий ETA-рецептор плаценты человека, клонируют (M.Adachi, Y.-Y.Yang, Y.Furuichi и C.Miyamoto, BBRC 180, 1265-1272) и экспрессируют в системе бакуловирус-клетки насекомых. Инфицированные бакуловирусом клетки насекомых из ферментера объемом 23 л через 60 ч после инфицирования центрифугируют (3000 g, 15 мин, 4oC), затем ресуспендируют в Трис-буфере (5 мМ, pH 7,4, 1 мМ MgCl2) и повторно центрифугируют. После повторного ресуспендирования и центрифугирования клетки суспендируют в 800 мл того же самого буфера и замораживают при температуре -120oC. Разрушение клеток происходит при оттаивании суспензии в этой гипотонической буферной смеси. После повторного цикла замораживание/оттаивание суспензию гомогенизируют и центрифугируют (25000 х g, 15 мин, 4oC). После суспендирования в Трис-буфере (75 мМ, pH 7,4, 25 мМ MgCl2, 250 мМ сахарозы) 1 мл аликвотной пробы (содержание протеина приблизительно 3,5 мг/мл) выдерживают при температуре -85oC. Для проведения теста на связывание замороженные препараты мембраны оттаивают и после 10-минутного центрифугирования при 25000 х g и температуре 20oC ресуспендируют в испытуемом буфере (50 мМ Трис-буфера, pH 7,4, содержит 25 мМ MnCl2, 1 мМ ЭДТК и 0,5% альбумина бычьей сыворотки). 100 мкл этой мембранной суспензии, содержащей 70 мкг протеина, инкубируют в присутствии 50 мкл 125I-эндотелина (удельная активность 2200 Ки/ммоль) в испытуемом буфере (25000 импульсов в минуту, конечная концентрация 20 нМ) и в 100 мкл испытуемого буфера, содержащего различные концентрации испытуемого соединения. Инкубирование проводят в течение 2 ч при температуре 20oC или в течение 24 ч при температуре 4oC. Разделение свободного и связанных с мембраной радиолигандов осуществляют путем фильтрования через фильтр из стекловолокна. В таблице 1 выявленное в этой серии опытов ингибирующее действие соединений формулы I представлено как IC50 т.е. как концентрация (нМ), необходимая для ингибирования 50% удельного связывания 125I-эндотелина. Таблица 1 Соединение из примера – IC50 [нМ] 34 – 0,3 51 – 0,4 II. Ингибирование индуцированных эндотелином сокращений на выделенных кольцах аорты крысы Из грудной аорты взрослых крыс Wistar-Kyoto вырезали кольца шириной 5 мм. Легким растиранием внутренней поверхности удаляли эндотелии. Каждое кольцо погружали при температуре 37oC в изолированную ванну с 10 мл раствора Кребса-Гензелейта при одновременной обработке газом: 95% O2 и 5% CO2. Затем определяли изометрическое напряжение колец. Кольца растягивали под предварительным напряжением 3 г. Через 10 мин после инкубирования испытуемым соединением или связующим добавляли кумулятивные дозы эндотелина-1. Активность испытуемого соединения определяли на основании наблюдаемого сдвига вправо кривой доза-эффект эндотелина-1 в присутствии различных концентраций антагониста. Этот сдвиг вправо (или также “dose ratio”, DR) соответствует коэффициенту, выведенному из значений EC50 эндотелина-1 в присутствии и при отсутствии антагониста, причем показатель EC50 обозначает концентрацию эндотелина, требующуюся для половины максимального сокращения. Исходя из “dose ratio” DR (соотношение доз) с помощью соответствующей компьютерной программы для каждой кривой доза – эффект было выведено приведенное ниже уравнение, на основании которого рассчитывали соответствующее значение pA2, являющееся показателем активности испытуемого соединения. pA2=log(DR-l)-log(концентрация антагониста) EC50 эндотелина при отсутствии испытуемых соединений составляет 0,3 нМ. Значения pA2, полученные описанным путем с помощью соединений формулы I, представлены в таблице 2. Таблица 2 Соединение из примера – Соотношение доз (Сдвиг вправо) 34 – 9,7 51 – 9,2 Соединения формулы I в силу их способности ингибировать связывание эндотелина могут применяться в качестве средств для лечения заболеваний, связанных с процессами, которые повышают сужение сосудов. Примерами таких заболеваний являются высокое кровяное давление, коронарная болезнь, сердечная недостаточность, ренальная и миокардиальная ишемия, почечная недостаточность, диализ, церебральная ишемия, инфаркт головного мозга, мигрени, субарахноидальное кровоизлияние, синдром Рейно и пульмонарная гипертония. Соединения формулы I могут находить применение также при атеросклерозе, предупреждении рестеноза после баллонной дилатации, воспалениях, язвенных болезнях желудка и двенадцатиперстной кишки, язвах голени, грамотрицательном сепсисе, шоке, гломерулонефрите, почечных коликах, глаукоме, астме, при терапии и профилактике диабетических осложнений и осложнений, сопутствующих приему циклоспорина, а также при заболеваниях, ассоциируемых с активностью эндотелина. Соединения формулы I могут назначаться для орального, ректального, парентерального введения, например внутривенного, внутримышечного, подкожного, интратекального либо внутрикожного; или их можно вводить в сублингвальных или офтальмологических препаративных формах или же в виде аэрозолей. Примерами форм применения могут служить капсулы, таблетки, вводимые оральным путем суспензии либо растворы, суппозитории, растворы для инъекций, глазные капли, мази или аэрозольные растворы. Предпочтительными формами введения являются внутривенное, внутримышечное или оральное. Дозировка действенных количеств, в которых вводятся соединения формулы I, зависит от вида и особенностей биологически активного вещества, возраста и потребностей пациента, а также от формы введения. Как правило, суточную дозу назначают из расчета 0,1-100 мг/кг веса тела. Препараты, содержащие соединения формулы I, могут содержать инертные или также активные в фармакодинамическом отношении добавки. Так, например, таблетки или грануляты могут содержать целый ряд связующих веществ, наполнителей, носителей или разбавителей. Жидкие препараты могут быть представлены, например, в виде стерильного, смешиваемого с водой раствора. Капсулы наряду с биологически активным веществом могут включать в себя дополнительно наполнители или загустители. Кроме того, в них могут добавляться вещества, улучшающие вкус, вещества, используемые обычно в качестве консервантов, стабилизаторов, влагосберегающих средств и эмульгаторов, далее, соли для изменения осмотического давления, буферы и другие добавки. Упомянутые выше наполнители и разбавители могут представлять собой органические и неорганические вещества, например воду, желатин, молочный сахар, крахмал, стеарат магния, тальк, гуммиарабик, полиалкиленгликоли и т.п. Главное условие применения всех вспомогательных веществ при изготовлении препаратов – они должны быть нетоксичными. Ниже изобретение поясняется на следующих примерах. Пример 1 1,29 г Na растворяли при 50oC в 50 мл этиленгликоля. Затем при той же температуре порциями добавляли 3,0 г 6-хлор-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламида 5-трет- бутилтиофен-2-сульфокислоты и нагревали в течение 4,5 ч при 100oC. Прозрачный раствор сливали в ледяной/разбавленный раствор HCl, после чего трижды экстрагировали соответственно порциями по 0,2 л эфира уксусной кислоты. Органическую фазу трижды промывали водой, сушили над сульфатом натрия и в завершение упаривали в ротационном испарителе. Таким путем получали 6-(2-гидроксиэтокси)-5-(2- метоксифенокси)-2,2′-бипиримидин-4-иламид 5-трет- бутилтиофен-2-сульфокислоты в виде светло-желтого пенистого вещества. МС: 493 (M-SO2). Получение исходного соединения: а) 2,0 г хлорида 5-трет-бутилтиофен-2-сульфокислоты растворяли при комнатной температуре в 30 мл этанола, смешивали с 50 мл 25%-ного раствора аммиака и нагревали в течение 4,5 ч с обратным холодильником. Затем концентрировали с помощью ротационного испарителя, смешивали остаток с водой, экстрагировали эфиром уксусной кислоты (150 мл), сушили над сульфатом магния и повторно концентрировали с помощью ротационного испарителя. В результате получали 5-трет-бутилтиофен-2-сульфонамид в виде белых кристаллов. МС: 219 (М). С помощью трет-бутилата калия в метаноле из них получали калиевую соль. б) 3,49 г 4,6-дихлор-5-(2-метоксифенокси)-2,2′-бипиримидина растворяли в 125 мл диметилсульфоксида, добавляли при комнатной температуре 3,855 г (5-трет-бутилтиофен-2-сульфонамид)-K, после чего раствор перемешивали в течение 20 ч при комнатной температуре. Затем смешивали еще с 1,285 г (5-трет-бутилтиофен-2-сульфонамид)-K и реакция протекала еще в течение 2 ч при комнатной температуре. Далее, при энергичном перемешивании в реакционную смесь добавляли сначала 200 мл воды, а затем 200 мл простого эфира, в результате чего образовывался тонкокристаллический осадок белого цвета, который отсасывали. Кристаллы суспендировали в разбавленной водной соляной кислоте и в течение 0,5 ч перемешивали при комнатной температуре, после чего отфильтровывали на нутче и сушили под высоким вакуумом. Таким путем получали 6-хлор-5-(2-метоксифенокси)-2,2′-бипиримидин-4- иламид 5-трет-бутилтиофен-2-сульфокислоты в виде кристаллического твердого вещества белого цвета. МС: 523,4 (М+Н). Пример 2 Раствор из 3,23 г 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′- бипиримидин-2-иламида 5-трет-бутилтиофен-2-сульфокислоты, 1,71 г азида 2-пиридилкарбоновой кислоты и 70 мг p-диметиламинопиридина в толуоле (50 мл) нагревали в течение 2 ч при температуре 80oC. Затем толуол удаляли с помощью ротационного испарителя и остаток распределяли между метиленхлоридом (0,5 л) и 1 н. раствором HCl (0,35 л). Органическую фазу сушили над сульфатом магния и в завершение удаляли растворитель с помощью ротационного испарителя. Сырой продукт хроматографировали на кизельгеле в системе растворителей метиленхлорид/MeOH (5: 1). Таким путем получали 2-[6-(5-трет-бутилтиофен-2-илсульфониламино)-5-(2- метоксифенокси)-2,2′-бипиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты в виде светло-желтого твердого вещества, которое перекристаллизовывали из метиленхлорида/MeOH. МС: 678,3 (М+Н). Пример 3 26 мг натрия растворяли в 2 мл этаноламина при 50oC, смешивали при той же температуре порциями со 150 мг соединения из примера 1, раздел б) и нагревали раствор в течение 4 ч при 100oC. Затем сливали на лед/воду, устанавливали с помощью 3 н. HCl на pH 6, после чего выпадал осадок в виде кристаллического твердого вещества светло-желтого цвета, которое отфильтровывали на нутче, промывали водой и сушили под высоким вакуумом. В результате получали 6-(2-аминоэтокси)-5-(2- метоксифенокси)-2,2′- бипиримидин-4-иламид 5-трет-бутилтиофен-2-сульфокислоты в виде желтых кристаллов. МС: 557,4 (М+Н). Пример 4 100 мг 6-(2-аминоэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4- иламида 5-трет-бутилтиофен-2-сульфокислоты растворяли в 10 мл толуола, смешивали с 53 мг азида 2-пиридилкарбоновой кислоты и нагревали раствор в течение 4 ч при температуре 120oC. Затем толуол удаляли с помощью ротационного испарителя и остаток распределяли между эфиром уксусной кислоты и водой. Органическую фазу сушили над сульфатом магния и в завершение концентрировали с помощью ротационного испарителя. Остаток хроматографировали на кизельгеле в системе растворителей метиленхлорид/метанол (30: 1). Таким путем получали 5-(2-метоксифенокси)-6-[2-(3-пиридин-2- илуреидо)-этокси] -2,2′-бипиримидин-4-иламид 5-трет- бутилотиофен-2-сульфокислоты в виде кристаллического твердого вещества. МС: 677,4 (М+Н). Пример 5 В раствор из 162,5 мг 4-амино-6-метокси-5-(2-метоксифенокси)-2,2′-бипиримидина в 10 мл тетрагидрофурана добавляли при комнатной температуре 92 мг NaH (65%-ный), перемешивали раствор в течение 1,5 ч при комнатной температуре, после чего при той же температуре добавляли 162,5 мг 5-трет-бутилтиофен-2-сульфонилхлорида. Затем продолжали перемешивание еще в течение 2 ч при комнатной температуре, сливали на лед/воду, экстрагировали эфиром уксусной кислоты, водную фазу подкисляли и экстрагировали с помощью метиленхлорида. Соединенные органические фазы сушили над сульфатом магния и концентрировали в ротационном испарителе. Остаток хроматографировали на кизельгеле в системе растворителей метиленхлорид/метанол (20:1). В результате получали 5-трет-бутил-N-[6-метокси-5-(2-метоксифенокси)-2,2′- бипиримидин-4-ил]-тиофен-2-сульфонамид в виде желтого порошка. МС: 463 (M-SO2). Получение исходных соединений: а) 2,09 г 4,6-дихлор-5-(2-метоксифенокси)-2,2′-бипиримидина (европейская заявка EP-A 0526708) суспендировали в 75 мл этанола и конденсировали при температуре -75oC с добавлением 150 мл аммиака, который вводили через трубку. В течение ночи реакционной смеси давали остыть до комнатной температуры, после чего концентрировали в водоструйном вакууме и остаток распределяли между небольшим количеством воды и метиленхлорида (500 мл). Органическую фазу сушили над сульфатом натрия и концентрировали с помощью ротационного испарителя. Остаток смешивали с простым эфиром, образовавшееся твердое вещество отделяли и сушили под высоким вакуумом. В результате получали 4-амино-6-хлор-5-(2- метоксифенокси)-2,2′-бипиримидин в виде тонкокристаллического порошка почти белого цвета. МС: 329 (М). б) В раствор из 2,0 г 4-амино-6-хлор-5-(2-метоксифенокси)-2,2′-бипиримидина в 200 мл метанола при комнатной температуре добавляли 6,55 г метилата натрия, после чего раствор нагревали в течение 32 ч с обратным холодильником. Затем метанол удаляли с помощью ротационного испарителя, остаток растворяли в метиленхлориде и промывали 1 н. соляной кислотой. Органическую фазу сушили над сульфатом магния, после чего растворитель удаляли в водоструйном вакууме. Сырой продукт хроматографировали на кизельгеле в системе растворителей метиленхлорид/метанол (10:1). Таким путем получали 4-амино-6- метокси-5-(2-метоксифенокси)-2,2′-бипиримидин в виде порошка лимонно-желтого цвета. МС: 325 (М). Пример 6 Аналогично примеру 1 из гликолята натрия и 6-хлор-5-(2-метоксифенокси)-2,2′- бипиримидин-4-иламида 5-пентилтиофен-2-сульфокислоты получали 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид 5-пентилтиофен-2-сульфокислоты в виде твердого вещества белого цвета. МС: 570,3 (М+Н). Получение исходных соединений: а) Из 2-пентил-5-(трет-бутилсульфонамидо)тиофена (европейская заявка EP-A 0512675) с использованием этанола/концентрированной HCl и получали с помощью трет-бутилата калия в метаноле калиевую соль амида 5-н-пентилтиофен-2-сульфокислоты. б) Аналогично примеру 1, раздел б), взаимодействием калиевой соли амида 5-н-пентилтиофен-2-сульфокислоты и 4,6-дихлор-5-(2- метоксифенокси)-2,2′-бипиримидина получали 6-хлор-5-(2- метоксифенокси)-2,2′-бипиримидин-4-иламид 5-пентилтиофен-2-сульфокислоты в виде твердого вещества белого цвета. МС: 545 (М). Пример 7 Аналогично примеру 2 из азида 2-пиридилкарбоновой кислоты и 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин- 4-иламида 5-пентилтиофен-2-сульфокислоты получали 2-[5-(2- метоксифенокси)-6-(5-пентилтиофен-2-илсульфониламино)-2,2′- бипиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты в виде твердого вещества белого цвета. МС: 692,4 (М+Н). Пример 8 Аналогично примеру 1 из гликолята натрия и 6-хлор-5-(2- метоксифенокси)-2,2′-бипиримидин-4-иламида 5-(2,2-диметилпропионил)- тиофен-2-сульфокислоты получали 6-(2- гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид 5-(2,2-диметилпропионил)-тиофен-2-сульфокислоты в виде розового порошка. МС: 586,3 (М+Н). Получение исходного соединения: а) Аналогично примеру 1, раздел б), взаимодействием калиевой соли 5-(2,2-диметилпропионил)тиофен-2-сульфонамида (получение: Journ. Org. Chem., том 56, стр. 4260) и 4,6-дихлор-5-(2-метоксифенокси)- 2,2′-бипиримидина получали 6-хлор-5-(2-метоксифенокси)-2,2′- бипиримидин-4-иламид 5-(2,2-диметилпропионил)-тиофен-2- сульфокислоты в виде кристаллического твердого вещества. МС: 560,1 (М+Н). С помощью трет-бутилата калия в метаноле из этого соединения получали калиевую соль. Пример 9 Аналогично примеру 2 из азида 2-пиридилкарбоновой кислоты и 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламида 5-(2,2-диметилпропионил)-тиофен-2-сульфокислоты получали в качестве целевого продукта 2-[6-[5-(2,2-диметилпропионил)-тиофен-2- илсульфониламино] -5- (2-метоксифенокси)-2,2′-бипиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты в виде порошка бежевого цвета. МС: 704,3 (М+Н). Пример 10 1,75 г Na растворяли при температуре 50oC в 70 мл этиленгликоля. Затем при той же температуре порциями добавляли 4,9 г 6-хлор-5-(2-метоксифенокси) -2,2′-бипиримидин-4-иламида 5-изопропилпиридин-2-сульфокислоты и нагревали в течение 4 ч до 100oC. Прозрачный раствор сливали на 200 мл воды, с помощью 3 н. HCl устанавливали на pH 1, выпавшие желтые кристаллы отфильтровывали на нутче, промывали последовательно водой и простым эфиром, после чего сушили под высоким вакуумом. Таким путем получали 6-(2-гидроксиэтокси)-5- (2-метоксифенокси)-2,2′-бипиримидин-4-иламид 5-изопропилпиридин- 2-сульфокислоты в виде кристаллического твердого вещества желтого цвета. МС: 537,3 (М-Н). Получение исходных соединений: а) 4,0 г 5-изопропилпиридин-2-сульфонамида растворяли в 40 мл MeOH, добавляли при комнатной температуре 2,308 г трет-бутилата калия и перемешивали раствор в течение 20 мин. Затем полностью концентрировали с помощью ротационного испарителя и полученную таким путем калиевую соль сушили под высоким вакуумом. б) 3,49 г 4,6-дихлор-5-(2-метоксифенокси)-2,2′-бипиримидина растворяли в 125 мл диметилсульфоксида, добавляли при комнатной температуре 4,7 г калиевую соль 5-изопропилпиридин-2-сульфонамида, после чего перемешивали раствор в течение 20 ч при комнатной температуре. Затем при энергичном перемешивании сливали на 350 мл воды и 90 мл простого эфира, раствор устанавливали при одновременной добавке 3 н. HCl на pH 1. Образовавшийся кристаллический осадок белого цвета отсасывали и последовательно промывали водой и простым эфиром. Кристаллы суспендировали в разбавленной водной соляной кислоте (100 мл воды и 50 мл 1 н. HCl), перемешивали в течение 5 мин, отфильтровывали на нутче и повторно промывали водой, после чего сушили под высоким вакуумом. Таким путем получали 6-хлор-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид 5- изопропилпиридин-2-сульфокислоты в виде кристаллического твердого вещества белого цвета. МС: 511,3 (М-Н). Пример 11 2,0 г 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4- иламида 5-изопропилпиридин-2-сульфокислоты растворяли в 80 мл толуола, смешивали с 1,1 г азида 2-пиридилкарбоновой кислоты, после чего нагревали раствор в течение 4 ч при температуре 90oC. Затем концентрировали с помощью ротационного испарителя и распределяли остаток между 1 н. HCl и эфиром уксусной кислоты. Органическую фазу сушили над сульфатом магния, растворитель удаляли в водоструйном вакууме и остаток хроматографировали на кизельгеле в системе растворителей метиленхлорид/метанол (30: 1). Таким путем получали 2-[6-(5-изопропилпиридин-2-илсульфониламино)-5- (2-метоксифенокси)-2,2′-бипиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты в виде желтых кристаллов. МС: 657,3 (М+Н). Для получения дигидрохлорида соединение растворяли в метиленхлориде и смешивали с соответствующим количеством 4,4 н. HCl в этаноле при комнатной температуре. Раствор концентрировали с помощью ротационного испарителя, выпавшее кристаллическое твердое вещество выделяли и сушили в течение 4 ч при температуре 60oC под высоким вакуумом. Пример 12 Аналогично примеру 4 из 6-(2-аминоэтокси)-5-(2- метоксифенокси)-2,2′-бипиримидин-4-иламида 5-изопропилпиридин-2- сульфокислоты и азида 2-пиридилкарбоновой кислоты получали в качестве целевого продукта 5-(2-метоксифенокси)-6-[2-(3-пиридин-2- илуреидо)-этокси]-2,2′-бипиримидин-4-иламид 5-изопропилпиридин-2- сульфокислоты в виде желтых кристаллов. МС: 656,3 (М-Н). Исходное соединение получали аналогично примеру 3 из этаноламина и соединения из примера 10, раздел б), в виде желтого пенистого вещества. МС: 538,3 (М+Н). Пример 13 Аналогично примеру 10 из 6-хлор-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламида пиридин-2- сульфокислоты и этиленгликоля получали 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′- бипиримидин-4-иламид пиридин-2-сульфокислоты в виде белых кристаллов. МС: 615,4 (М-Н). Получение исходных соединений: а) 1,7 г хлорида 2-пиридилсульфокислоты (Journ. Org. Chem., том 54, стр. 389) растворяли в 30 мл этанола, при охлаждении льдом добавляли 30 мл 25%-ного раствора аммиака, после чего нагревали в течение 4 ч с обратным холодильником. Реакционный раствор концентрировали с помощью ротационного испарителя, остаток распределяли между эфиром уксусной кислоты и водой, органическую фазу сушили над сульфатом магния и затем концентрировали с помощью ротационного испарителя, в результате чего амид 2-пиридилсульфокислоты выпадал в виде кристаллического твердого вещества бежевого цвета. МС: 469,2 (М-Н). Из этого амида с помощью трет-бутилата калия в метаноле получали калиевую соль. б) Аналогично примеру 10, раздел б), взаимодействием калиевой соли 2-пиридилсульфонамида с 4,6-дихлор-5-(2-метоксифенокси)-2,2′- бипиримидином получали 6-хлор-5-(2-метоксифенокси)-2,2′- бипиримидин-4-иламид пиридин-2-сульфокислоты в виде белых кристаллов. МС: 495,3 (М-Н). Пример 14 Аналогично примеру 11 из 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)- 2,2′-бипиримидин-4-иламида пиридин-2-сульфокислоты и азида 2-пиридилкарбоновой кислоты получали 2-[5-(2-метоксифенокси)-6-пиридин-2- илсульфониламино)-2,2′-бипиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты в виде белых кристаллов. МС: 615,4 (М-Н). Пример 15 Аналогично примеру 10 из 6-хлор-5-(2- метоксифенокси)-2,2′-бипиримидин-4-иламида пиридин-3-сульфокислоты и этиленгликоля получали 6-(2-гидроксиэтокси)-5- (2-метоксифенокси)-2,2′-бипиримидин-4-иламид пиридин-3-сульфокислоты в виде белых кристаллов. МС: 496 (М). Получение исходных соединений: а) Аналогично примеру 13, раздел а), из хлорида 3-пиридилсульфокислоты (Journ. Org. Chem. , том 54, стр. 389) и аммиака получали амид 2-пиридилсульфокислоты в виде кристаллического твердого вещества белого цвета, из которого затем с помощью трет-бутилата калия в метаноле получали калиевую соль. б) Аналогично примеру 10, раздел б), взаимодействием калиевой соли 3-пиридилсульфонамида с 4,6-дихлор- 5-(2-метоксифенокси)-2,2′-бипиримидином получали в качестве целевого продукта 6-хлор-5-(2-метоксифенокси)-2,2′-бипиримидин-4- иламид пиридин-3-сульфокислоты в виде белых кристаллов. МС: 470 (М). Пример 16 Аналогично примеру 11 из 6-(2-гидроксиэтокси)-5-(2- метоксифенокси)-2,2′-бипиримидин-4-иламида пиридин-3-сульфокислоты и азида 2-пиридилкарбоновой кислоты получали 2-[5- (2-метоксифенокси)-6-пиридин-3-илсульфониламино) -2,2′- бипиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты в виде белых кристаллов. МС: 615,4 (М-Н). Пример 17 213 мг 6-[2-(трет-бутилдиметилсиланокси) -этокси]-5-(2-хлор-5- метоксифенокси)-пиримидин-4-иламина растворяли в 15 мл тетрагидрофурана, смешивали при комнатной температуре с 92 мг NaH (65%-ный), перемешивали в течение 2 ч при комнатной температуре и затем добавляли порциями 155 мг 5-трет-бутилтиофен-2-сульфонилхлорида. Раствор продолжали перемешивать еще в течение 2 ч при комнатной температуре, сливали на ледяную воду и дважды экстрагировали в общей сложности 200 мл уксусного эфира. После обычной переработки органической фазы защищенный силиловой группой сырой продукт хроматографировали на кизельгеле в системе растворителей метиленхлорид/уксусный эфир (8:1). Полученное пенистое вещество коричневатого цвета (219 мг) растворяли в 15 мл ацетонитрила, смешивали при комнатной температуре с 1,5 мл 40%-ного раствора HF и перемешивали в течение 2 ч. Затем реакционную смесь распределяли между эфиром уксусной кислоты и полунасыщенным раствором NaCl и органическую фазу обрабатывали по обычной методике. Сырой продукт хроматографировали на кизельгеле в системе растворителей метиленхлорид/уксусный эфир (4:1) и перекристаллизовывали из простого эфира/гексана. В результате получали 5-(2-хлор-5-метоксифенокси)-6-(2-гидроксиэтокси)- пиримидин-4-иламид 5-трет-бутилтиофен-2-сульфокислоты в виде белых кристаллов. МС: 449 (M-SO2). Получение исходного соединения: а) 3-метоксифенол согласно рекомендации M.Julia и I. de Rosnay, Chemie Therapeutique 5 (1965 г.), стр. 334, трансформировали с помощью сульфурилхлорида в 2-хлор-5- метоксифенол. б) 18,2 г 2-хлор-5-метоксифенола растворяли в 150 мл сухого метанола. Затем добавляли последовательно 9,3 г MeONa и 25 г диметилового эфира хлормалоновой кислоты. Реакционную смесь перемешивали в течение 2 ч при температуре 50oC. После отгонки растворителя остаток распределяли в делительной воронке между толуолом и водой и промывали до нейтрального состояния. После кристаллизации в этаноле получали (2-хлор-5- метокси)феноксидиметилмалонат в виде белых кристаллов с Тпл 68-69oC. в) 1,43 г Na растворяли в 70 мл MeOH. Затем добавляли 5,8 г (2-хлор-5-метокси)феноксидиметилмалоната и 2,29 г формамидинацетата; реакционную смесь перемешивали в течение 1,5 ч при нагреве с обратным холодильником. Затем растворитель отгоняли, остаток растворяли в H2O, водную фазу экстрагировали с помощью уксусного эфира, органическую фазу отделяли, а водную фазу подкисляли уксусной кислотой до pH 4, в результате чего 5-(2-хлор-5- метокси)фенокси-4,6(1Н,5Н)-пиримидиндион выпадал в виде белого порошка. МС: m/e = 268 (М). г) Смесь из 3,75 г 5-(2-хлор-5-метокси)фенокси-4,6(1Н,5Н)- пиримидиндиона, 5,4 г N-этилдиизопропиламина, 12,5 мл POCl3 в 20 мл диоксана перемешивали в течение 18 ч при нагреве с обратным холодильником. После отгонки летучих компонентов остаток распределяли между уксусным эфиром и H2O и промывали до нейтрального состояния. После отгонки растворителя соединение очищали на кизельгеле с помощью CH2Cl2 в качестве элюента. После кристаллизации из EtOH получали 4,6-дихлор-5-(2-хлор-5-метоксифенокси)-пиримидин в виде белых кристаллов с Тпл 88-89oC. д) В раствор из 9,9 г 4,6-дихлор-5-(2- хлор-5-метоксифенокси)-пиримидина из раздела г) в 400 мл этанола при температуре -78oC добавляли приблизительно 500 мл NH3. Затем реакционную смесь перемешивали в течение 15 ч при -78oC и в течение 50 ч при комнатной температуре, после чего ее упаривали. Остаток распределяли между этилацетатом и водой и органическую фазу подвергали обычной обработке. Таким путем получали 8,53 г 6-хлор-5-(2-хлор-5-метоксифенокси)-пиримидин-4- иламина в виде желтых кристаллов. МС: 285 (М). e) 8,53 г полученного описанным выше путем соединения добавляли в раствор из 0,82 г натрия в 100 мл этиленгликоля при температуре 50oC. Раствор нагревали в течение 20 ч до 100oC, после чего распределяли между полунасыщенным раствором NH4Cl и CH2Cl2 и обрабатывали по обычной методике. В результате получали 8,3 г 2- [6-амино-5-(2-хлор-5-метоксифенокси)-4-пиримидин-4-илокси] -1- этанола в виде белого твердого вещества, которое без последующей очистки силилировали. С этой целью указанный выше материал (8,3 г) растворяли в 300 мл метиленхлорида, смешивали последовательно с 8,15 г диметиламинопиридина и при комнатной температуре с 10,05 г трет-бутилдиметилхлорсилана. Реакционный раствор перемешивали в течение 5 ч при комнатной температуре, а затем фильтровали, раствор концентрировали, остаток после упаривания распределяли между полунасыщенным раствором NH4Cl и этилацетатом и органическую фазу подвергали обычной обработке. Путем последующей кристаллизации из метиленхлорида/гексана получали 7 г 6-[2- (трет-бутилдиметилсиланилокси)-этокси]-5-(2-хлор-5- метоксифенокси)-пиримидин-4-иламина. МС: 410 (М-CH3). Пример 18 Аналогично примеру 2 из 5-(2-хлор-5-метоксифенокси)-6-(2- гидроксиэтокси)-пиримидин-4-иламида 5-трет-бутилтиофен-2- сульфокислоты и азида 2-пиридилкарбоновой кислоты получали 2-[6- (5-трет-бутилтиофен-2-илсульфониламино)-5-(2-хлор-5- метоксифенокси)-пиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты в виде белых кристаллов. МС: 634,3 (М+Н). Пример 19 Аналогично примеру 2 из соединения из примера 17 и азида 4-пиридилкарбоновой кислоты получали 2-[6-(5-трет-бутилтиофен-2- илсульфониламино)- 5-(2-хлор-5-метоксифенокси)-пиримидин-4-илокси] -этиловый эфир пиридин-4-илкарбаминовой кислоты в виде белых кристаллов. МС: 634,3 (М+Н). Пример 20 Аналогично примеру 17, причем 6-[2-(трет- бутилдиметилсиланокси)-этокси] -5-(2-метоксифенокси)-пиримидин-4- иламин использовали в качестве компонента реакции, получали 6-(2- гидроксиэтокси)-5-(2-метоксифенокси)-пиримидин-4-иламид 5-трет- бутилтиофен-2-сульфокислоты в виде твердого вещества белого цвета. МС: 479 (М). Пример 21 В раствор гликолята натрия, состоящего из 1,5 мл этиленгликоля и 46 мг Na добавляли 180 мг соединения из предыдущей стадии. Для достижения полной растворимости добавляли 1 мл ДМСО. Реакция протекала далее в течение 3 ч при температуре 90oC. После охлаждения до комнатной температуры реакционную смесь подкисляли водной лимонной кислотой до pH 4, после чего полученное соединение экстрагировали уксусным эфиром. После отгонки уксусного эфира кристаллизовали из этанола N-[5-(2-хлор-5-метоксифенокси) -6-(2-гидроксиэтокси)-пиримидин-4-ил] -5-изопропилпиридин-2-сульфонамид. В результате получали 175 мг белых кристаллов, разлагавшихся при 180oC. Получение исходного соединения: 306 мг 4,6-дихлор-5-(2-хлор-5-метоксифенокси)-пиримидина, 320 мг 5-изопропил-2-пиридин-сульфонамида и 180 мг трет-бутилата калия растворяли в 2 мл ДМСО и затем осуществляли реакцию в течение 3 ч при температуре 90oC. После охлаждения до комнатной температуры реакционную смесь подкисляли водной лимонной кислотой; соединение экстрагировали уксусным эфиром и после отгонки растворителя кристаллизовали из этанола. Таким путем получали 250 мг N-[6-хлор- 5-(2-хлор-5-метоксифенокси)-пиримидин-4-ил] -5-изопропилпиридин- сульфонамида в виде белых кристаллов с пл 174-175oC. Пример 22 100 мг N-[5-(2-хлор-5-метоксифенокси)-6-(2-гидроксиэтокси)- пиримидин-4-ил] -5-изопропилпиридин-2-сульфонамида и 38,5 мг азида 2-пиридилкарбоновой кислоты растворяли в 1 мл сухого диоксана. Раствор перемешивали в течение 2 ч при температуре 95oC, и при этом высвобождался N2. После отгонки растворителя соединение кристаллизовали из этанола. В результате получали 115 мг 2-[5-(2- хлор-5-метоксифенокси)-6-(5-изопропилпиридин-2-илсульфониламино) – пиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты в виде белых кристаллов с пл 190-191oC. Пример 23 Аналогично примеру 21 получали 5-изопропил-N-[6-(2- гидроксиэтокси)-5-(2-метоксифенокси)-2-(3-метоксифенил)- пиримидин-4-ил] -пиридин-2-сульфонамид. Тпл 139-140oC (из этанола). Получение исходного соединения: Аналогично примеру 21, раздел два, получали 400 мг N-[6-хлор-5-(2-метоксифенокси)-2-(3- метоксифенил)-пиримидин-4-ил] -5-изопропилпиридин-2-сульфонамид из 330 мг 4,6-дихлор-2-(3-метоксифенил)-5-(2-метоксифенокси)- пиримидина и 420 мг калиевой соли 5-изопропилпиридин-2-сульфонамида. Пример 24 Аналогично примеру 22 из 115 мг 5-изопропил-N-[6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2-(3- метоксифенил)-пиримидин-4-ил] -пиридин-2-сульфонамида и 38,5 мг азида 2-пиридилкарбоновой кислоты получали 120 мг 2-[6-(5- изопропилпиридин-2-илсульфониламино)-5-(2-метоксифенокси)-2-(3- метоксифенил)-пиримидин-4-илокси]-этилового эфира пиридин-2-илкарбаминовой кислоты. Тпл 158-160oC (из этанола). Пример 25 а) Аналогично примеру 21 получали N-[6-хлор-5-(2-метоксифенокси)-2- метилсульфанилпиримидин-4-ил] -5-изопропилпиридин-2-сульфонамид из 4,6-дихлор-2-метилсульфанил-5-(2-метоксифенокси)-пиримидина и калиевой соли 5-изопропилпиридин-2-сульфонамида. Тпл 192oC (из этанола). б) Указанное выше соединение с помощью гликолята натрия трансформировали в 5-изопропил-N-[6-(2-гидроксиэтокси)-5-(2- метоксифенокси)-2- метилсульфанилпиримидин-4-ил]-пиридин-2-сульфонамид. Тпл 76-78oC (из EtOH). Пример 26 Аналогично примеру 22 получали 106 мг 2-[6-(5-изопропилпиридин-2-илсульфониламино)-5-(2- метоксифенокси)-2-метилсульфанилпиримидин-4-илокси]-этилового эфира пиридин-2-илкарбаминовой кислоты из 100 мг 5-изопропил-N- [6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2-метилсульфанилпиримидин-4-ил] – пиридин-2-сульфонамида и азида 2-пиридилкарбоновой кислоты. Тпл 213-214oC (из этанола). Пример 27 а) Из 4,6-дихлор-2-(1,3-бензодиоксол-5-ил)-5-(2-метоксифенокси)- пиримидина и 5-изопропилпиридин-2-сульфонамида калия получали N-[6-хлор-2-(1,3-бензодиоксол-5-ил)-5-(2-метоксифенокси)- пиримидин-4-ил] -5-изопропилпиридин-2-сульфонамид. б) Это соединение с помощью гликолята натрия переводили в N-[2-(1,3- бензодиоксол-5-ил)-6-(2-гидроксиэтокси)-5 (2-метоксифенокси)- пиримидин-4-ил]-5-изопропилпиридин-2-сульфонамид. Тпл 184oC (из EtOH). Пример 28 Аналогично примеру 22 получали 110 мг 2-[2- (1,3-бензодиоксол-5-ил)-6-(5-изопропилпиридин-2-илсульфониламино) -5-(2-метоксифенокси)-пиримидин-4-илокси] -этилового эфира из 116 мг N-[2-(1,3-бензодиоксол-5-ил)-6-(2-гидроксиэтокси)-5-(2- метоксифенокси)-пиримидин-4-ил] -5-изопропилпиридин-2-сульфонамида и азида 2-пиридилкарбоновой кислоты. Тпл 184oC (из этанола). Пример 29 а) Из 4,6-дихлор-2-морфолин-4-илпиримидина и 5-изопропилпиридин-2-сульфонамида калия получали N-[6-хлор-5-(2- хлор-5-метоксифенокси)-2-морфолин-4-илпиримидин-4-ил]-5- изопропилпиридин-2-сульфонамид. б) Взаимодействием этого соединения с гликолятом натрия получали N-[5-(2-хлор-5- метоксифенокси)-6-(2-гидроксиэтокси)-2-морфолин-4-илпиримидин-4- ил]-5-изопропилпиридин-2-сульфонамид. Тпл 189-190oC (из EtOH). Пример 30 Аналогично примеру 22 116 мг N-[5-(2-хлор-5- метоксифенокси)-6-(2-гидроксиэтокси) -2-морфолин-4-илпиримидин-4- ил]-5-изопропилпиридин-2-сульфонамида подвергали взаимодействию с азидом 2-пиридилкарбоновой кислоты, получая в результате 2-[5-(2- хлор-5-метоксифенокси) -6-(5-изопропилпиридин-2- илсульфониламино)-2-морфолин-4 -илпиримидин-4-илокси] – этиловый эфир пиридин-2-илкарбаминовой кислоты. Затем получали из этанола 106 мг белых кристаллов, которые разлагались при температуре 240oC. Пример 31 Аналогично примеру 21 из [6-хлор-5- (2-метоксифенокси)-2,2′-бипиримидин-4-ил] -амида 5-метилпиридин-2- сульфокислоты и гликолята натрия получали 6-(2-гидроксиэтокси)-5- (2-метоксифенокси)-2,2′-бипиримидин-4-иламид 5-метилпиридин-2-сульфокислоты. Тпл 190oC (из этанола). Получение исходного соединения: а) 2-амино-5-метилпиридин диазотировали и трансформировали в 2-бром-5-метилпиридин по методу F.H.Case (JACS 68 (1946 г.), стр. 2574). б) 4,8 г этого соединения подвергали взаимодействию в 40 мл пропиленгликоля с 7,4 г гидросульфида натрия при 150oC. После охлаждения до комнатной температуры в реакционную смесь добавляли по каплям 5 мл уксусной кислоты, после чего образовавшийся 2-меркапто-5-метилпиридин выпадал в осадок в виде желтого порошка. в) В двухфазовую смесь из 40 мл CH2Cl2, 20 мл 37%-ной водной HCl и 3 г 2-меркапто-5-метилпиридина после ее охлаждения до -10oC по каплям добавляли в течение 30 мин 50 мл 1,2 молярного раствора гипохлорита натрия. Затем органическую фазу трижды экстрагировали с помощью H2O путем встряхивания. После отгонки растворителя получали 5-метилпиридин-сульфохлорид в виде желтоватой жидкости. г) Взаимодействием этого сульфохлорида с 25%-ным раствором NH4OH получали 5-метилпиридин-2-сульфонамид. д) 0,7 г 4,6-дихлор-5-(2-метоксифенокси)-2,2′-бипиримидина, 520 мг 5-метилпиридин-2-сульфонамида и 320 мг трет-бутилата калия растворяли в 2 мл ДМСО и перемешивали в течение 3 ч при температуре 80oC. После обычного разделения реакционной смеси получали 410 мг [6-хлор-5-(2-метоксифенокси) -2,2′-бипиримидин-4- ил]-амида 5-метилпиридин-2 -сульфокислоты. Пример 32 Аналогично примеру 22 из 105 мг 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)- 2,2′-бипиримидин-4-иламида 5-метилпиридин-2-сульфокислоты и 30 мг азида 2-пиридилкарбоновой кислоты получали 100 мг 2-[5-(2- метоксифенокси)-6-(5-метилпиридин -2-илсульфониламино)-2,2′- бипиримидин-4-илокси]-этилового эфира пиридин-2-илкарбаминовой кислоты в виде кристаллов бежевого цвета. Тпл: разложение при 198oC. Пример 33 а) Аналогично примеру 22 из 712 мг 4,6-дихлор-5- (2-метоксифенокси)-2-морфолин-4-илпиримидина и 5-метилпиридин-2- сульфонамида калия получали 580 мг 6-хлор-5-(2-метоксифенокси)-2- морфолин-4-илпиримидин-4-иламида 5-метилпиридин-2-сульфокислоты. б) Взаимодействием этого соединения с гликолятом натрия получали 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2-морфолин-4- илпиримидин-4-иламид 5-метилпиридин-2-сульфокислоты. Тпл 195-196oC. (из этанола). Пример 34 Аналогично примеру 22 получали 117 мг 2-[5-(2-метоксифенокси) -6-(5-метилпиридин-2 -илсульфониламино)-2- морфолин -4-илпиримидин-4-илокси] -этилового эфира пиридин-2-илкарбаминовой кислоты из 105 мг 6-(2-гидрокси-этокси)-5-(2- метоксифенокси)-2-морфолин -4-илпиримидин-4-иламида 5-метилпиридин- 2-сульфокислоты и азида 2-пиридилкарбоновой кислоты. Тпл: разложение при 175oC. Пример 35 105 мг 6-(2-гидроксиэтокси)-5-(2- метоксифенокси)-2-морфолин-4-илпиримидин-4-иламида 5-метилпиридин- 2-сульфокислоты в 2 мл дихлорметана смешивали с 3 мл 1,9 молярного раствора фосгена в толуоле. Через 1 ч при комнатной температуре заканчивалось полностью образование хлорформиата, после чего избыточное количество реагента отгоняли, остаток растворяли в смеси из хлороформа и пиридина; затем добавляли 0,5 г 3-(гидроксиметил)-фурана и дальнейшая реакция протекала при температуре 60oC в течение 3 ч. После обычного разделения смеси полученное соединение очищали на кизельгеле (система элюентов дихлорметан/простой диэтиловый эфир 4:1 в объеме). В результате получали 65 мг фуран-3-илметиловый эфир-{2-[5-(2- метоксифенокси)-6-(5-метилпиридин-2-сульфониламино)-2-морфолин- 4-илпиримидин-4-илокси] -этиловый эфир} карбоновой кислоты. МС: 640,5 [(М-Н)–]. Пример 36 9,2 г 4-[4-хлор-5-(2-хлор-5- метоксифенокси)-6-метилпиримидин-2-ил]-морфолина и 17,8 г 5-изопропилпиридин-2-сульфонамид-калия в 130 мл сухого диметилсульфоксида нагревали в атмосфере аргона в течение 16 ч до температуры 120oC. Затем диметилсульфоксид отгоняли, остаток распределяли между этилацетатом и 1 н. соляной кислотой и органическую фазу промывали до нейтрального состояния. Далее органическую фазу сушили, растворитель выпаривали и остаток перекристаллизовывали из этанола. Таким путем получали 10,3 г 5-(2-хлор-5-метоксифенокси)-6-метил-2-морфолин-4-илпиримидин-4- иламида 5-изопропилпиридин-2-сульфокислоты. МС: М = 534. Пример 37 1 г полученного в примере 36 соединения и 2,1 г двуокиси селена в 40 мл диоксана перемешивали в автоклаве при температуре 170oC в течение 7 ч. Затем реакционную смесь фильтровали и фильтрат концентрировали. Остаток распределяли между уксусным эфиром и водой. Органическую фазу сушили, растворитель выпаривали и остаток очищали на кизельгеле с помощью уксусного эфира/гексана. Таким путем получали 0,53 г 5-(2-хлор-5- метоксифенокси)-6-формил-2- морфолин-4-илпиримидин -4-иламида 5-изопропилпиридин-2- сульфокислоты. Тпл 194oC. Пример 38 0,1 г полученного в примере 37 соединения в 3 мл этанола смешивали с 0,014 г борогидрида натрия. Реакционную смесь перемешивали при температуре 80oC в течение 1 ч, после чего этанол отгоняли и остаток распределяли между хлороформом и 1 н. HCl. Органическую фазу промывали водой и сушили, растворитель выпаривали и остаток хроматографировали на кизельгеле с помощью хлороформа/метанола. После перекристаллизации из дихлорметана/этанола получали 0,072 г 5-(2-хлор-5- метоксифенокси)-6-гидроксиметил-2 -морфолин-4-илпиримидин-4- иламида 5-изопропилпиридин-2-сульфокислоты. Тпл 105oC. Пример 39 0,2 г полученного в примере 38 соединения в 3,5 мл POCl3 перемешивали с 0,083 г PCl5 в течение 2 ч при температуре 20oC, после чего POCl3 отгоняли и остаток распределяли между уксусным эфиром и водным бикарбонатом натрия. Органическую фазу промывали водой, сушили, а растворитель выпаривали. Остаток хроматографировали на кизельгеле с помощью хлороформа/метанола и затем перекристаллизовывали из дихлорметана/этанола. В результате получали 0,150 г 5-(2-хлор-5-метоксифенокси)-6- хлорметил-2-морфолин-4-илпиримидин-4-иламида 5-изопропилпиридин-2- сульфокислоты. Тпл 205oC. Пример 40 В раствор гликолята натрия, состоящего из 0,35 г этиленгликоля и 0,021 г натрия, добавляли 0,130 г соединения, полученного в примере 39. Реакционную смесь перемешивали в атмосфере аргона в течение 2 ч при температуре 80oC, после чего этиленгликоль отгоняли и остаток распределяли между этилацетатом и 1 н. соляной кислотой. Органическую фазу промывали водой, сушили над сульфатом натрия и растворитель удаляли отгонкой. Остаток перекристаллизовывали из простого эфира/петролейного эфира. Таким путем получали 0,104 г 5-(2- хлор-5-метоксифенокси) -6-(2-гидроксиэтоксиметил)-2-морфолин-4- илпиримидин-4-иламида. Тпл 166oC. Пример 41 Аналогично примеру 2 из полученного в примере 40 соединения получали 2-[5-(2-хлор-5- метоксифенокси)-6-(5-изопропилпиридин-2-сульфониламино)-2- морфолин-4-илпиримидин-4-илметокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты. МС: (М-Н)– = 713. Пример 42 Аналогично примеру 2 из полученного в примере 38 соединения получали 5-(2- хлор-5-метоксифенокси)-6-(5-изопропилпиридин-2-илсульфониламино)-2- морфолин-4-илпиримидин-4-илметиловый эфир пиридин 2-илкарбаминовой кислоты. МС: (М-Н)– = 669. Пример 43 Аналогично примеру 40 из полученного в примере 39 соединения и (RS)-2,2-диметил-1,3-диоксолан-4-метанол-Na получали (RS)-5-(2-хлор-5- метоксифенокси)-6-(2,2-диметил-1,3-диоксолан-3-илметоксиметил)-2- морфолин-4-илпиримидин-4-иламид 5-изопропилпиридин-2-сульфокислоты. МС: (М-Н)– = 663. Пример 44 Раствор из 0,05 г полученного в примере 43 соединения в 2 мл диоксана смешивали с 2 мл 1 н. HCl и нагревали в течение 15 мин до температуры 80oC. После упаривания остаток хроматографировали на кизельгеле с помощью хлороформа/метанола и таким путем получали (RS)-5-(2-хлор-5-метоксифенокси)-6-(2,3-дигидроксипропоксиметил)-2- морфолин-4-илпиримидин-4-иламид 5-изопропилпиридин-2-сульфокислоты. Тпл 116oC, МС: (М-Н)– = 623. Пример 45 345 мг натрия растворяли при температуре 80oC в 50 мл абс. этиленгликоля. После непродолжительного охлаждения в раствор добавляли 1,56 г 6-хлор-5-(2-метоксифенокси)-2-морфолин-4-илпиримидин-4-иламида 5- изопропилпиридин-2-сульфокислоты. Образовавшийся раствор перемешивали в течение 24 ч при температуре 140oC, растворитель удаляли под высоким вакуумом и остаток растворяли в 40 мл воды. Через 4 ч при температуре 5oC отфильтровывали на нутче, кристаллы суспендировали в 40 мл воды, “расслаивали” с помощью уксусного эфира и при перемешивании вводили по каплям 1 н. водную HCl, пока значение pH не снижалось до 3,5. Водную фазу трижды экстрагировали уксусным эфиром, а органические фазы промывали дважды водой и один раз насыщенным раствором NaCl. Соединенные органические фазы сушили и концентрировали, пока не начиналась кристаллизация (приблизительно 5 мл). Затем фильтровали на нутче, промывали простым эфиром и сушили. В результате получали 1,144 г (70%) белых кристаллов 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2- морфолин-4-илпиримидин-4-иламида 5-изопропилпиридин-2-сульфокислоты. Тпл 157-160oC, МС: (М-Н)– = 544,4. Получение исходного соединения: Раствор из 1,18 г 4,6-дихлор-5-(2- метоксифенокси)-2-морфолин-4-илпиримидина и 2,12 г (8,88 ммолей) 5-изопропилпиридин-2-сульфонамид-калиевой соли в 25 мл сухого ДМСО нагревали в течение 3 ч до температуры 80oC, пока дихлорид полностью не прореагировал. Затем ДМСО удаляли под высоким вакуумом, остаток растворяли в 60 мл воды и водный раствор трижды промывали диэтиловым эфиром. Далее раствор подкисляли 1 н. HCl до pH 3,5 и продукт трижды экстрагировали с помощью уксусного эфира. Органические фазы последовательно промывали дважды водой и один раз насыщенным раствором поваренной соли, после чего соединяли, сушили над сульфатом натрия и упаривали. Кристаллический остаток с целью полного удаления следа 5-изопропилпиридин-2-сульфонамида дважды дигерировали с помощью абсолютного диэтилового эфира. Оставшиеся кристаллы отфильтровывали и сушили. В результате получали 1,66 г (96%) 6-хлор-5-(2-метоксифенокси)-2-морфолин-4-илпиримидин-4-иламида 5-изопропилпиридин-2-сульфокислоты в виде белых кристаллов с Тпл 168-176oC. МС: (М-Н)– = 518,3. Пример 46 Аналогично примеру 45 через 10 ч осуществления реакции при температуре 120oC с добавками ДМСО в качестве агента растворения (этиленгликоль/ДМСО 5: 2) получали 6-(2-гидроксиэтокси)-5-(2- метоксифенокси)-2-морфолин-4-илпиримидин-4-иламид 5-трет- бутилтиофен-2-сульфокислоты в виде твердого пенистого вещества белого цвета с выходом 54%. МС: 565,5 (М+Н)+. Пример 47 Аналогично примеру 45 через 3 ч проведения реакции при температуре 140oC получали 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2- морфолин-4-илпиримидин-4-иламид 2,5-дихлортиофен-3-сульфокислоты в виде белых кристаллов с выходом 43%. Тпл 180-183oC, МС: 575,3 (М-Н)–. Пример 48 Аналогично примеру 45 через 3,5 ч осуществления реакции при температуре 140oC получали 6-(2-гидроксиэтокси)- 5-(2-метоксифенокси)-2-морфолин-4-илпиримидин-4-иламид 3,5- диметилизоксазол-4-сульфокислоты в виде белых кристаллов с пл 144-147oC. МС: 520,4 (М-Н)–. Пример 49 110 мг натрия растворяли при температуре 50oC в 2,5 мл этиленгликоля. После охлаждения до комнатной температуры в раствор добавляли 260 мг 6-хлор-5-(2- метоксифенокси)-2,2′-бипиримидин-4-иламида 2,5-дихлортиофен-3-сульфокислоты. После нагрева в течение 2 ч до 50oC гликоль удаляли под высоким вакуумом и твердый остаток растворяли в 20 мл воды. Добавкой 0,3 мл уксусной кислоты продукт осаждали. После фильтрования, промывки водой и сушки под высоким вакуумом при температуре 50oC получали 182 мг (67%) светло-бежевых кристаллов 6-(2-гидроксиэтокси)-5-(2- метоксифенокси)-2,2′-бипиримидин-4-иламида 2,5-дихлортиофен-3- сульфокислоты. Тпл 157-160oC, МС: М+(569), 470 (M+-(SO2+Cl)). Получение исходного соединения: Раствор из 0,349 г 4,6-дихлор-5-(2-метоксифенокси)-2,2′-бипиримидина и 0,405 г 2,5-дихлортиофен-3-сульфонамид-калиевой соли в 5 мл сухого ДМСО выдерживали в течение 16 ч при комнатной температуре. Затем добавляли 0,112 г трет-бутилата калия, после чего реакция продолжалась в течение 5 ч. Далее реакционную смесь сливали на 40 мл ледяной воды и для удаления избыточного реагента экстрагировали с помощью 40 мл диэтилового эфира. Из водной фазы с применением высаливания насыщенным раствором поваренной соли (20 мл) получали 6-хлор-5-(2- метоксифенокси)-2,2′-бипиримидин-4-иламид-натриевую соль 2,5-дихлортиофен-3-сульфокислоты путем фильтрования и промывки простым эфиром (0,54 г порошка бежевого цвета). Для получения свободного сульфонамида натриевую соль суспендировали в воде и суспензию подкисляли уксусной кислотой, после чего экстрагировали уксусным эфиром, в который добавляли небольшое количество CH2Cl2. Органическую фазу дважды промывали насыщенным раствором поваренной соли, сушили над MgSO4 и упаривали при пониженном давлении. Остаток непродолжительное время промывали диэтиловым эфиром и гексаном и затем сушили. В результате получали 0,30 г (54%) бежевого порошка с Тпл 140oC (разложение). МС: 444 (М-(SO2+Cl)). Аналогичным путем, применяя 3,5-диметилизоксазол-4-сульфонамид-калий, получали 6-хлор-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид 3,5-диметилизоксазол-4-сульфокислоты с выходом 71% в виде бежевого, слегка окрашенного в красноватый цвет порошка с Тпл 184-187oC. МС: М+=488,393 (М-(SO2+OCH3)). Пример 50 Аналогично примеру 49 получали 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид 3,5-диметилизоксазол-4- сульфокислоты в виде бежевого порошка с Тпл 200-204oC. МС: 514 (М+), 450 (М+-SO2), 419 (450-CH3O). Пример 51 Раствор из 888 мг пиридин-2-карбонилазида в 15 мл абс.диоксана выдерживали в течение 15 мин при температуре 80oC. После непродолжительного охлаждения добавляли 1,09 г соединения, полученного в примере 45, и выдерживали раствор в течение 4 ч при температуре 90oC. Затем упаривали до сухого состояния, остаток растворяли в уксусном эфире, дважды промывали водой и один раз насыщенным раствором поваренной соли, органические фазы соединяли, сушили и концентрировали, в результате чего продукт выпадал в виде кристаллов. Для полной очистки проводили хроматографию на кизельгеле с помощью EtOAc/CH2Cl2 (1:1) и таким путем получали 931 мг (70%) белых кристаллов 2-[6-(5-изопропилпиридин-2- илсульфониламино)-5-(2-метоксифенокси)-2-морфолин-4-илпиримидин-4-илокси] – этилового эфира пиридин-2-илкарбаминовой кислоты с Тпл 200-202oC. МС: 664,4 (М-Н)–, ИК (KBr) 1730 см-1 (карбамат). Пример 52 Аналогично примеру 51 из полученного в примере 49 соединения с выходом 61% получали 2-[6-(2,5-дихлортиофен-3 илсульфониламино)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-илокси] – этиловый эфир пиридин-2-илкарбаминовой кислоты в виде белых кристаллов с Тпл 194-197oC. МС: 690,1 (М+Н)+, ИК (KBr) 1732 см-1 (карбамат). Пример 53 Аналогично примеру 51 из полученного в примере 50 соединения с выходом 68% получали 2-[5-(2-метоксифенокси)-6-(3,5-диметилизоксазол-4-илсульфониламино)-2,2′- бипиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты в виде светло-желтых кристаллов с Тпл 217-218oC. МС: 635,3 (М+Н)+, ИК (KBr) 1736 см-1 (карбамат). Пример 54 Аналогично примеру 51 из полученного в примере 46 соединения с выходом 90% получали 2-[6-(5-трет-бутилтиофен-2-илсульфониламино)-5-(2- метоксифенокси)-2-морфолин-4-илпиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты в виде пенистого вещества белого цвета. МС: 683,5 (М-Н)–. Пример 55 Аналогично примеру 51 из полученного в примере 47 соединения с выходом 55% получали 2-[6-(2,5-дихлортиофен-3-илсульфониламино)-5-(2-метоксифенокси)-2- морфолин-4-илпиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты в виде белых кристаллов с пл 194-196oC. МС: 695,3 (М-Н)–. Пример 56 Аналогично примеру 51 из полученного в примере 48 соединения с выходом 70% получали 2-[6-(3,5- диметилизоксазол-4-илсульфониламино)-5-(2-метоксифенокси)-2- морфолин-4-илпиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты в виде белых кристаллов с пл 106-109oC. МС: 640,4 (М-Н)–. Пример 57 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2-морфолин-4-илпиримидин- 4-иламид 5-изопропилпиридин-2-сульфокислоты (54,5 мг) растворяли в N,N-диметилацетамиде (5 мл), добавляли при комнатной температуре 14,4 мг 60%-ной суспензии NaH, перемешивали в течение 20 мин при комнатной температуре и смешивали с 2-хлорпиримидином (11,7 мг). Затем реакционную смесь продолжали перемешивать в течение 18 ч при комнатной температуре, сливали на ледяную воду, добавляли насыщенный раствор NH4Cl и экстрагировали уксусным эфиром. Органическую фазу промывали водой, сушили над сульфатом магния, после чего концентрировали с помощью ротационного испарителя. Остаток хроматографировали на кизельгеле в системе растворителей метиленхлорид/метанол (100:1). Таким путем получали {5-(2- метоксифенокси)-2-морфолин-4-ил-6-[2-(пиримидин-2-илокси)- этокси] -пиримидин-4-ил} -амид 5-изопропилпиридин-2-сульфокислоты в виде белых кристаллов. МС: 624 (М+Н). Пример 58 а) Аналогично примеру 45 взаимодействием [6-хлор-2-(3-метоксибензил)-5-(2- метоксифенокси)-пиримидин-4-ил] -амида 5-изопропилпиридин-2- сульфокислоты с Na в этиленгликоле получали [6-(2- гидроксиэтокси)-2-(3-метоксибензил)-5-(2-метоксифенокси)- пиримидин-4-ил] -амид 5-изопропилпиридин-2-сульфокислоты в виде белого пенистого вещества. МС: 579,3 (М-Н). Получение исходных соединений: б) 10,8 г 3-метоксифенилацетонитрила растворяли в этаноле (100 мл) и насыщали раствор хлористым водородом при комнатной температуре. Затем перемешивали в течение 12 ч при комнатной температуре, охлаждали раствор до 0oC и отсасывали выпавшие кристаллы. Сырой продукт перекристаллизовывали из ацетона/диэтилового эфира. В результате получали гидрохлорид этилового эфира 2-(3-метоксифенил)-иминоуксусной кислоты в виде твердого кристаллического вещества белого цвета. МС: 193 (М). в) Гидрохлорид этилового эфира 2-(3-метоксифенил)-иминоуксусной кислоты (12 г) растворяли в этаноле (100 мл) и при -75oC смешивали с 14 мл жидкого аммиака. Затем смеси давали нагреться в течение 5 ч до комнатной температуры, после чего концентрировали с помощью ротационного испарителя. Остаток суспендировали в ацетоне, получая взвесь, выпавшие кристаллы отсасывали и сушили под высоким вакуумом. В результате получали гидрохлорид 2-(3-метоксифенил)-ацетамидина в виде твердого кристаллического вещества белого цвета. МС: 164 (М). г) 2,3 г Na растворяли в метаноле (40 мл), добавляли при комнатной температуре последовательно гидрохлорид 2-(3-метоксифенил)-ацетамидина (10 г) и диметиловый эфир (2-метоксифенокси)малоновой кислоты (12,67 г) и перемешивали в течение 5 ч при комнатной температуре. Затем концентрировали с помощью ротационного испарителя и сырой продукт помещали в воду. Водную фазу промывали уксусным эфиром, затем устанавливали на pH 1 и выпавшие кристаллы отфильтровывали на нутче, после чего сушили их под высоким вакуумом. В результате получали 2-(3-метоксибензил)-5-(2-метоксифенокси)-пиримидин-4,6-диол в виде кристаллов бежевого цвета. МС: 354 (М). д) 2-(3-метоксибензил)-5-(2-метоксифенокси)-пиримидин-4,6-диол (14 г) растворяли в ацетонитриле (150 мл), смешивали при комнатной температуре с коллидином (5,24 мл), фосфороксихлоридом (21,7 мл) и перемешивали в течение 9 ч при комнатной температуре. Затем смесь сливали на ледяную воду и экстрагировали уксусным эфиром. Органическую фазу промывали полунасыщенным раствором KHCO3, сушили над сульфатом магния и концентрировали. Остаток растворяли в гексане/диэтиловом эфире, фильтровали и фильтрат концентрировали с помощью ротационного испарителя. В результате получали 4,6-дихлор-2-(3-метоксибензил)-5-(2-метоксифенокси)- пиримидин в виде светло-коричневых кристаллов. МС: 390 (М). е) Аналогично примеру 45 взаимодействием 4,6-дихлор-2-(3- метоксибензил)-5-(2-метоксифенокси)-пиримидина с 5-изопропилпиридин-2-сульфонамид-калиевой солью получали [6-хлор-2- (3-метоксибензил)-5-(2-метоксифенокси)-пиримидин-4-ил] -амид 5-изопропилпиридин-2-сульфокислоты в виде пенистого вещества желтого цвета. МС: 553,1 (М-Н). Пример 59 а) Аналогично примеру 45 взаимодействием [6-хлор-2-(3-метоксибензил)-5-феноксипиримидин-4-ил] – амида 5-изопропилпиридин-2-сульфокислоты с Na в этиленгликоле получали [6-(2-гидроксиэтокси)-2-(3-метоксибензил)- 5-феноксипиримидин-4-ил] -амид 5-изопропилпиридин-2-сульфокислоты в виде светло-желтых кристаллов. МС: 549,2 (М-Н). Получение исходных соединений: б) Аналогично примеру 58 г) путем конденсации гидрохлорида 2-(3-метоксифенил)-ацетамидина с диметиловым эфиром феноксималоновой кислоты получали 2-(3-метоксибензил)-5-феноксипиримидин- 4,6-диол в виде пенистого вещества желтого цвета. МС: 324 (М). в) Аналогично примеру 58 д) хлорированием 2-(3-метоксибензил)-5-феноксипиримидин-4,6-диола оксихлоридом фосфора получали 4,6-дихлор-2-(3-метоксибензил)-5-феноксипиримидин в виде желтых кристаллов. МС: 360 (М). г) Аналогично примеру 45 взаимодействием 4,6-дихлор-2-(3-метоксибензил)-5- феноксипиримидина с 5-изопропилпиридин-2-сульфонамид-калиевой солью получали [6-хлор-2-(3-метоксибензил)-5-феноксипиримидин-4- ил] – амид 5-изопропилпиридин-2-сульфокислоты в виде пенистого вещества желтого цвета. МС: 523 (М-Н). д) [6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2-(2-метоксифенил)- пиримидин-4-ил]амид 5-метилтиазол-2-сульфоновой кислоты  Масспектр (ISP): m/e 545,1 (М+1). е)[6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2-пиридин-4-ил- пиримидин-4-ил]амид 5-изопропилпиридин-2 сульфоновой кислоты. По аналогии с примером 45 из (6-хлор-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амида 5-изопропилпиридин-2-сульфоновой кислоты и натрия в этиленгликоле получен [6-(2-гидроксиэтокси)-5-(2-метоксифенокси)- 2-пиридин-4-илпиримидин-4-ил] амид 5-изопропилпиридин-2-сульфоновой кислоты в виде белых кристаллов. Т.пл. 163-164oC. Получение исходного вещества: Исходный продукт был получен из 4,6-дихлор-5-(2-метоксифенокси)-2-пиридин-4-ил)пиримидина и калиевой соли 5-изопропилпиридил-2-пиридин-4-ил)пиримидина и калиевой соли 5-изопропилпиридил-2-сульфонамида аналогично описанной методике. Пример 60 [6-(2-гидроксиэтокси)-2-(3-метоксибензил-5-феноксипиримидин-4-ил] -амид 5-изопропилпиридин-2-сульфокислоты (55 мг) растворяли в сухом метиленхлориде (3 мл) и смешивали при температуре 0oC с трибромидом бора (50 мг) в метиленхлориде (2 мл). Затем перемешивали в течение 2 ч при 0oC и в течение последующих 4 ч при комнатной температуре, после чего концентрировали с помощью ротационного испарителя и хроматографировали остаток на кизельгеле в системе растворителей метиленхлорид/уксусный эфир. Таким путем получали [2-(3-гидроксибензил)-6-(2-гидроксиэтокси)-5- феноксипиримидин-4-ил]-амид 5-изопропилпиридин-2-сульфокислоты в виде белых кристаллов. МС: 525,1 (М-Н). Пример А Таблетки, содержащие следующие ингредиенты, могут изготавливаться по обычной методике. Ингредиенты – на 1 таблетку Соединение формулы I – 10,0-100,0 мг Лактоза – 125,0 мг Кукурузный крахмал – 75,0 мг Тальк – 4,0 мг Стеарат магния – 1,0 мг Пример Б Капсулы, содержащие следующие ингредиенты, могут изготавливаться по обычной методике. Ингредиенты – на 1 капсулу Соединение формулы I – 25,0 мг Лактоза – 150,0 мг Кукурузный крахмал – 20,0 мг Тальк – 5,0 мг Пример В Растворы для инъекций могут иметь следующий состав: Соединение формулы I – 3,0 мг Желатин – 150,0 мг Фенол – 4,7 мг Вода для инъекционных растворов – до 1,0 мл Пример Г В 3,5 мл миглиоля 812 и 0,08 г бензилового спирта суспендируют 500 мг соединения формулы I. Затем этой суспензией наполняют баллончик, снабженный дозирующим клапаном. Через этот клапан в баллончик подают под давлением 5,0 г фреона 12. В результате встряхиваний фреон растворяется в смеси миглиоля и бензилового спирта. Этот аэрозольный баллончик содержит примерно 100 разовых доз, которые могут назначаться для поэтапного приема. Формула изобретения
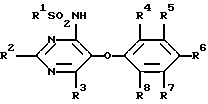 где R1 выбран из моноциклического пяти-шестичленного S, N и/или O-содержащего гетероциклического остатка, такого, как пиридил, пиримидинил, изоксазолил, тиенил, тиазолил, которые могут быть незамещены или замещены низшим алкилом, галогеном или низшим алканоилом; R2 обозначает водород, низший алкил, низший алкокси, низший алкилтио, низший алкокси-низший алкил, низший алкилсульфонил-низший алкокси, фенил, низший алкилфенил, низший алкоксифенил, низший алкилендиоксифенил, фенил-низший алкил, низший алкилфенил-низший алкил, низший алкоксифенил-низший алкил, низший алкилендиоксифенил-низший алкил, моноциклический шестичленный N и/или O-содержащий гетероциклический остаток, такой, как пиримидинил, пиридил, морфолино; R3 обозначает низший алкил, низший алкокси, формил, галоген-низший алкил, гидрокси-низший алкил, амино-низший алкил или остаток -CH2O-A – низший алкил, – (CH2)m – O – (CRaRb)nOH, – (CH2)m – O – (CRaRb)nOR9, – (CH2)m – O – (CH2)nNH2 или -(CH2)m – O – (CRaRb)n – B – R9; R4 – R8 обозначают водород, низший алкокси или галоген; R9 обозначает пиридил, пиримидинил; Ra и Rb обозначают водород или низший алкил; A представляет собой кеталированную 1,2-дигидроксиэтиленовую группу; B представляет собой -OC(O)O-, -OC(O)NH-, NHC(O)NH- или NHC(O)O-; n = 2, 3 или 4; m = 0 или 1. 2. Соединения по п.1, где R2 обозначает водород, низший алкил, низший алкокси, низший алкилтио, низший алкокси-низший алкил, низший алкилсульфонил-низший алкокси, фенил, низший алкоксифенил, низший алкилендиоксифенил или моноциклический шестичленный N и/или O-содержащий гетероциклический остаток, такой, как пиримидинил, пиридил, морфолино; R3 обозначает низший алкил, низший алкокси, формил, галоген-низший алкил, гидроси-низший алкил, амино-низший алкил или остаток – CH2O-A – низший алкил, – (CH2)m – O – (CRaRb)n – OH, – (CH2)m – O – (CH2)n NH2 или -((CH2)m – O – (CRaRb)n – B – R9; R1, R4 – R9, Ra, Rb, A, B, n и m имеют значение, указанное в п.1. 3. Соединения по п.1 или 2, где R1 обозначает незамещенный либо замещенный низшим алкилом, галогеном или низшим алканоилом пиридил, пиримидинил. 4. Соединения по одному из пп.1 – 3, где R2 обозначает водород, пиримидинил, пиридил, морфолино. 5. Соединения по одному из пп.1 – 4, где R3 представляет собой остаток -O – (CRaRb)n – OH, – O – (CH2)nNH2 или остаток – O – (CH2)2 – B – R9, а R9 обозначает пиридил. 6. Соединения по п.6, где R9 представляет собой 2-пиридил. 7. Соединения по п.6, где R3 представляет собой остаток -O(CH2)2 – B – R9, а B обозначает -(O)C(O)NH-. 8. Соединение по п.7, представляющее собой 2-[6-(5-изопропилпиридин-2-илсульфониламино)-5-(2-метоксифенокси)-2-морфолин-4-илпиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты. 9. Соединения по п.7, представляющие собой 2-[6-(5-трет. -бутилтиофен-2-илсульфониламино)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-илокси]-этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[5-(2-метоксифенокси)-6-(5-пентилтиофен-2-илсульфониламино)-2,2′-бипиримидин-4-илокси]-этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[6-[5-(2,2-диметилпропионил)-тиофен-2-илсульфониламино)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-илокси]-этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[6-(5-изопропилпиридин-2-илсульфониламино)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-илокси]-этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[5-(2-метоксифенокси)-6-пиридин-2-илсульфониламино)-2,2′-бипиримидин-4-илокси]-этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[5-(2-метоксифенокси)-6-пиридин-3-илсульфониламино)-2,2′-бипиримидин-4-илокси]-этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[6-(5-трет. -бутилтиофен-2-илсульфониламино)-5-(2-хлор-5-метоксифенокси)-пиримидин-4-илокси]-этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[6-(5-изопропилпиридин-2-илсульфониламино)-5-(2-метоксифенокси)-2-(3-метоксифенил)-пиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[6-(5-изопропилпиридин-2-илсульфониламино)-5-(2-метоксифенокси)-2-метилсульфанилпиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[2-(1,3-бензодиоксол-5-ил)-6-(5-изопропилпиридин-2-илсульфониламино)-5-(2-метоксифенокси)-пиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[5-(2-хлор-5-метоксифенокси)-6-(5-изопропилпиридин-2-илсульфониламино)-2-морфолин-4-илпиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[5-(2-метоксифенокси)-6-(5-метилпиридин-2-илсульфониламино)-2,2′-бипиримидин-4-илокси]-этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[5-(2-метоксифенокси)-6-(5-метилпиридин-2-илсульфониламино)-2-морфолин-4-илпиримидин-4-илокси]-этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[5-(2-хлор-5-метоксифенокси)-6-(5-изопропилпиридин-2-сульфониламино)-2-морфолин-4-илпиримидин-4-илметокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты, 5-(2-хлор-5-метоксифенокси)-6-(5-изопропилпиридин-2-илсульфониламино)-2-морфолин-4-илпиримидин-4-илметиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[6-(2,5-дихлортиофен-3-илсульфониламино)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-илокси]-этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[5-(2-метоксифенокси)-6-(3,5-диметилизоксазол-4-илсульфониламино)-2,2′-бипиримидин-4-илокси]-этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[6-(5-трет. -бутилтиофен-2-илсульфониламино)-5-(2-метоксифенокси)-2-морфолин-4-илпиримидин-4-илокси]-этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[6-(2,5-дихлортиофен-3-илсульфониламино)-5-(2-метоксифенокси)-2-морфолин-4-илпиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты, 2-[6-(3,5-диметилизоксазол-4-илсульфониламино)-5-(2-метоксифенокси)-2-морфолин-4-илпиримидин-4-илокси] -этиловый эфир пиридин-2-илкарбаминовой кислоты. 10. Соединения по п.6, где R9 представляет собой 4-пиридил. 11. Соединение по п. 10, представляющее собой 2-[6-(5-трет.-бутилтиофен-2-илсульфониламино)-5-(2-хлор-5-метоксифенокси)-пиримидин-4-илокси]-этиловый эфир пиридин-4-илкарбаминовой кислоты. 12. Соединения по п.5, где R3 представляет собой остаток -O(CH2)2 – B – R9, а B представляет собой -(O)C(O)O-. 13. Соединения по п.12, представляющее собой {5-(2-метоксифенокси)-2-морфолин-4-ил 6-[2-(пиримидин-2-илокси)-этокси]-примидин-4-ил}-амид 5-изопропилпиридин-2-сульфокислоты. 14. Соединения по п.5, где R3 представляет собой остаток -O(CH2)2 – B – R9, а B представляет собой остаток -NHC(O)NH-. 15. Соединения по п.14, представляющие собой 5-(2-метоксифенокси)-6-[2-(3-пиридин-2-илуреидо)-этокси] -2,2′-бипиримидин-4-иламид 5-трет.-бутилтиофен-2-сульфокислоты, 5-(2-метоксифенокси)-6-[2-(3-пиридин-2-илуреидо)-этокси] -2,2′-бипиримидин-4-иламид 5-изопропилпиридин-2-сульфокислоты. 16. Соединения по пп.1 – 4, где R3 представляет собой гидроксиэтоксигруппу. 17. Соединения по п.16, представляющие собой 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид 5-трет.-бутилтиофен-2-сульфокислоты, 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид 5-пентилтиофен-2-сульфоновой кислоты, 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид 5-(2,2-диметилпропионил)-тиофен-2-сульфокислоты, 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид -5-изопропилпиридин-2-сульфокислоты, 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид пиридин-3-сульфокислоты, 5-(2-хлор-5-метоксифенокси)-6-(2-гидроксиэтокси)-пиримидин-4-иламид 5-трет.-бутилтиофен-2-сульфокислоты, 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-пиримидин-4-иламид 5-трет.-бутилтиофен-2-сульфокислоты, N-[5-(2-хлор-5-метоксифенокси)-6-(2-гидроксиэтокси)-пиримидин-4-ил] -5-изопропилпиридин-2-сульфонамид, 5-изопропил-N-[6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2-(3-метоксифенил)-пиримидин-4-ил]-пиридин-2-сульфонамид, 5-изопропил-N-[6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-метилсульфанилпиримидин-4-ил]-пиридин-2-сульфонамид, N-[2-(1,3-бензодиоксол-5-ил)-6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-пиримидин-4-ил]-5-изопропилпиридин-2-сульфонамид, N-[5-(2-хлор-5-метоксифенокси)-6-(2-гидроксиэтокси)-2-морфолин-4-илпиримидин-4-ил]-5-изопропилпиридин-2-сульфонамид, 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид 5-метилпиридин-2-сульфокислоты, 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2-морфолин-4-илпиримидин-4-иламид 5-метилпиридин-2-сульфокислоты, 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2-морфолин-4-илпиримидин-3-иламид 5-изопропилпиридин-2-сульфокислоты, 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2-морфолин-4-илпиримидин-4-иламид 5-трет.-бутилтиофен-2-сульфокислоты, 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2-морфолин-4-илпиримидин-4-иламид 2,5-дихлортиофен-3-сульфокислоты, 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2-морфолин-4-илпиримидин-4-иламид 3,5-диметилизоксазол-4-сульфокислоты, 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид 2,5-дихлортиофен-3-сульфокислоты, 6-(2-гидроксиэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид 3,5-диметилизоксазол-4-сульфокислоты, [6-(2-гидроксиэтокси)-2-(3-метоксибензил)-5-(2-метоксифенокси)-пиримидин-4-ил]-амид 5-изопропилпиридин-2-сульфокислоты, [6-(2-гидроксиэтокси)-2-(3-метоксибензил)-5-феноксипиримидин-4-ил] -амид 5-изопропилпиридин-2-сульфокислоты, [2-(3-гидроксибензил)-6-(2-гидроксиэтокси)-5-феноксипиримидин-4-ил]-амид 5-изопропилпиридин-2-сульфокислоты. 18. Соединения по пп.1 – 4, где R3 представляет собой аминоэтоксигруппу. 19. Соединение по п.18, представляющее собой 6-(2-аминоэтокси)-5-(2-метоксифенокси)-2,2′-бипиримидин-4-иламид 5-трет. -бутилтиофен-2-сульфокислоты. 20. Соединения по пп.1 – 4, где R3 обозначает низший алкил, низший алкокси, формил, галоген-низший алкил, гидрокси-низший алкил или -CH2O-A-низший алкил. 21. Соединения по п.20, представляющие собой 5-(2-хлор-5-метоксифенокси)-6-метил-2-морфолин-4-илпиримидин-4-иламид 5-изопропилпиридин-2-сульфокислоты, 5-(2-хлор-5-метоксифенокси)-6-формил-2-морфолин-4-илпиримидин-4-иламид, 5-(2-хлор-5-метоксифенокси)-6-гидроксиметил-2-морфолин-4-илпиримидин-4-иламид 5-изопропилпиридин-2-сульфокислоты, 5-(2-хлор-5-метоксифенокси)-6-хлорметил-2-морфолин-4-илпиримидин-4-иламид 5-изопропилпиридин-2-сульфокислоты, 5-(2-хлор-5-метоксифенокси)-6-(2-гидроксиэтоксиметил)-2-морфолин-4-илпиримидин-4-иламид. 22. Соединения формулы II 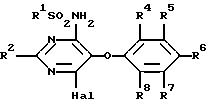 где R1, R2 и R4 – R8 имеют значение, указанное в п.1, а Hal обозначает галоген. 23. Сульфонамиды по пп.1 – 21 в качестве ингибиторов связывания эндотелина. 24. Фармацевтический препарат, обладающий свойствами ингибитора связывания эндотелина, включающий активное вещество и обычные наполнители и вспомогательные вещества, отличающийся тем, что в качестве активного вещества содержит одно из соединений по пп.1 – 21 формулы изобретения. Приоритет по пунктам: 25.11.94 – по пп.1 – 24 для соединений формулы 1, 11 и фармацевтической композиции на основе соединений формулы I, где R1, R4 – R9, Ra, Rb, A, B, m, n имеют значения, соответствующие значениям, указанным в п.1 формулы изобретения, кроме R2 фенил-низший алкил, низший алкилфенил-низший алкил, низший алкоксифенил-низший алкил, низший алкилендиоксифенил-низший алкил и R3 – (CH2)m – O – (CRaRb)n – R9; 09.10.95 – по пп.1 – 24 для соединений формулы I, II и фармацевтической композиции на основе соединений формулы I, где R1, R4 – R9, Ra, Rb, A, B, m, n имеют значения, соответствующие значениям, указанным в п.1 формулы изобретения, R2 означает фенил-низший алкил, низший алкилфенил-низший алкил, низший алкоксифенил-низший алкил, низший алкилендиоксифенил-низший алкил и R3 означает – (CH2)m – O – (CRaRb)n – R9. PC4A – Регистрация договора об уступке патента Российской Федерации на изобретение
Прежний патентообладатель:
(73) Патентообладатель:
Дата и номер государственной регистрации перехода исключительного права: 20.08.2008 № РД0039850
Извещение опубликовано: 27.09.2008 БИ: 27/2008
|
||||||||||||||||||||||||||
