Патент на изобретение №2162083
|
||||||||||||||||||||||||||
(54) ОПТИЧЕСКИ АКТИВНОЕ ПРОИЗВОДНОЕ БЕНЗОТИЕПИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ, АКТИВАТОРЫ ОСТЕОГЕНЕЗА, СПОСОБ АКТИВАЦИИ ОСТЕОГЕНЕЗА, СПОСОБЫ ЛЕЧЕНИЯ
(57) Реферат: Изобретение относится к оптически активному производному бензотиепина формулы I, где R представляет низшую алкильную группу; R1 и R2 независимо представляют низшую алкильную группу или вместе представляют низший алкилен, которое обладает отличным остеогенезактивирующим действием, полезно в качестве профилактического или терапевтического средства против заболеваний костей. Описывается способ его получения, активаторы остеогенеза, способ активации остеогенеза, способы лечения. При этом значительно угнетается рассасывание кости и растет активирование ее образования. 9 с. и 6 з.п. ф-лы, 1 тaбл. 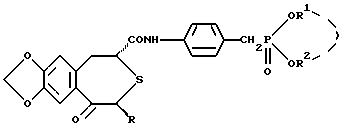
Настоящее изобретение относится к оптически активному производному бензотиепина, обладающему остеогенезактивирующей активностью, угнетающей рассасывание (резорбцию) кости активностью и другими активностями, и к содержащему его в качестве активного компонента средству для предупреждения или лечения заболевания костей. Заболевание кости – это патологическое состояние, или болезнь, с каким-либо симптомом или риском, вызванным уменьшением массы кости выше определенной величины. Основными симптомами остеопороза (заболевание костей) являются искривление позвоночника (спинальный кифоз) и переломы поясничных костей, тел позвонков, шейки бедренных костей, нижнего конца лучевой кости, ребер, верхнего конца плечевой кости и прочее. В здоровой костной ткани разрушение кости происходит непрерывно при надлежащем равновесии между образованием и рассасыванием кости, причем ключевую роль в образовании и рассасывании кости играют соответственно остеобласты и остеокласты. Нарушение равновесия между ними приводит к уменьшению массы кости. Для предупреждения и лечения остеопороза обычно использовали главным образом средства, угнетающие рассасывание кости, такие как эстрогены, кальчитонин и бисфосфонаты. Однако эти средства угнетения рассасывания кости в некоторых случаях, обусловленных ограничениями для субъекта и неопределенностью действия, не способны обеспечить удовлетворительный эффект. С другой стороны, создатели настоящего изобретения уже открыли серосодержащее гетероциклическое соединение, обладающее превосходной угнетающей рассасывание кости активностью, которое представлено следующей ниже общей формулой (A) или (B), или его соль (нерассмотренные японские патентные публикации N 232880/1991 и N 364179/1992). 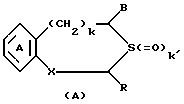 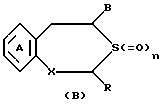 где кольцо A является бензольным кольцом, которое может быть замещено; R представляет атом водорода или углеводородную группу, которая может быть замещена; B представляет карбоксильную группу, которая может быть этерифицирована или амидирована; X представляет -CH(OH)- или -CO-; k представляет 0 или 1, k’ и n каждый представляет 0, 1 или 2. В качестве примера такого соединения было описано соединение, представленное формулой (C): 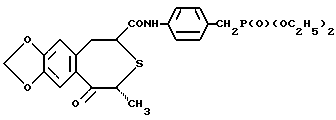 Существует потребность в разработке профилактического или лечебного средства, обладающего улучшенными свойствами (стабильность, всасываемость, биодоступность и т.д.), для клинически пригодных фармацевтических препаратов (в частности, препаратов для перорального введения). Создатели настоящего изобретения провели интенсивные исследования для разработки клинически более пригодного лекарственного средства, оказывающего непосредственное действие на кость, для угнетения рассасывания кости и активирования ее образования, синтезировали сначала оптически активное производное бензотиепина, представленное формулой (I): 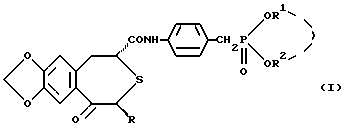 где R представляет низшую алкильную группу; R1 и R2 независимо представляют низшую алкильную группу или могут быть связаны друг с другом с образованием кольца; и обнаружили, что это соединение неожиданно оказалось очень полезным клинически среди соединений, представленных приведенной выше формулой (A) или (B), и, в частности, обладает превосходной остеогенез-активирующей активностью, всасываемостью при приеме внутрь и т.д. Например, оптически активное производное бензотиепина формулы (I) лучше, чем соединение формулы (C) по всасываемости при пероральном введении. На основе этой находки создатели настоящего изобретения провели дополнительные исследования и в результате получили настоящее изобретение. Таким образом, в соответствии с настоящим изобретением предлагаются: (1) оптически активное соединение формулы (I): 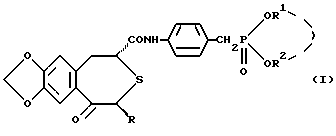 где R представляет низшую алкильную группу; R1 и R2 независимо представляют низшую алкильную группу или вместе представляют низший алкилен, (2) соединение по пункту (1), у которого R, R1 и R2 независимо представляют C1-4 алкильную группу, (3) соединение по пункту (1), представляющее собой (2R,4S)-(-)-N-[4-(диэтоксифосфорилметил)фенил] -1,2,4,5-тетрагидро-4- метил-7,8-метилендиокси-5-оксо-3-бензотиепин-2-карбоксамид, (4) способ получения оптически активного соединения формулы (I): 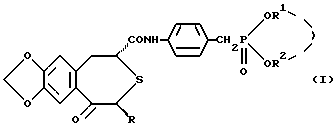 где R представляет низшую алкильную группу; R1 и R2 независимо представляют низшую алкильную группу или вместе представляют низший алкилен, химическим взаимодействием оптически активного соединения формулы (II): 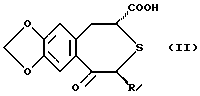 где R – такой, как указан выше, или его реакционноспособного производного или соли по карбоксильной группе с соединением формулы (III): 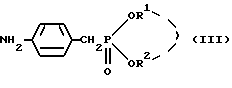 где R1 и R2 – такие, как указаны выше, или его реакционноспособным производным или солью по аминогруппе, (5) оптически активное соединение формулы (II): 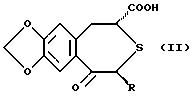 где R представляет низшую алкильную группу, или его реакционноспособное производное или соль по карбоксильной группе, (6) активатор остеогенеза, содержащий оптически активное соединение формулы (I) по пункту (1), (7) активатор остеогенеза по пункту (6), способный всасываться при пероральном введении, (8) профилактическое или терапевтическое средство против заболеваний костей, содержащее оптически активное соединение формулы (I) по пункту (1), (9) активатор для лечения перелома кости, содержащий оптически активное соединение формулы (I) по пункту (1), (10) способ активации остеогенеза у млекопитающего животного, который включает введение млекопитающему животному при необходимости эффективного количества оптически активного соединения формулы (I) по пункту (1), (11) способ предупреждения или лечения заболеваний кости у млекопитающего животного, который включает введение млекопитающему животному при необходимости эффективного количества оптически активного соединения формулы (I) по пункту (1), (12) способ активации лечения перелома кости у млекопитающего животного, который включает введение млекопитающему животному при необходимости эффективного количества оптически активного соединения формулы (I) по пункту (1), (13) применение оптически активного соединения формулы (I) по пункту (1) для изготовления активатора остеогенеза, (14) применение оптически активного соединения формулы (I) по пункту (1) для изготовления профилактического или терапевтического средства против заболеваний костей, и (15) применение оптически активного соединения формулы (I) по пункту (1) для изготовления активатора для лечения перелома кости. Примером низшей алкильной группы, представленной символами R, R1 или R2, в приведенных выше формулах являются алкильные группы с неразветвленной или разветвленной цепью, имеющие от 1 до 6 углеродных атомов, такие как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил и гексил. R1 и R2 могут представлять вместе низший алкилен, и в этом случае 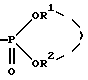 может представлять 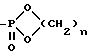 (n представляет целое число от 2 до 4). Предпочтительно каждый из радикалов R, R1 и R2 представляет алкильную группу, имеющую 1-4 атома углерода, такую как метил или этил. Соединение (I) в соответствии с настоящим изобретением, являющееся оптически активным соединением конфигурации (2R, 4S), предпочтительно, по существу, не содержит соединений конфигурации (2S,4R) и имеет оптическую чистоту около 100%. Из соединений формулы (I) предпочтительными являются (2R,4S)-(-)-N-[4-(диэтоксифосфорилметил)фенил] -1,2,4,5-тетрагидро-4- метил-7,8-метилендиокси-5-оксо-3-бензотиепин-2-карбоксамид и т.д. Соединение (I) получают взаимодействием оптически активного соединения, представленного формулой (II), или его реакционноспособного производного или соли по карбоксильной группе с соединением, представленным формулой (III), или его реакционноспособным производным или солью по аминогруппе. Предпочтительные производные соединения (III), реакционноспособные по его аминогруппе, включают таутомерные изомеры иминовой или енаминовой формы типа оснований Шиффа, полученные в результате взаимодействия соединения (III) и карбонильного соединения, такого как альдегид (напр., ацетальдегид) или кетон (напр. , ацетон); силильные производные, полученные в результате реакции между соединением (III) и силильным соединением, таким как бис(триметилсилил) ацетамид, моно-(триметилсилил)ацетамид или бис(триметилсилил)мочевина; и производные, полученные взаимодействием соединения (III) и трихлорида фосфора или фосгена. Предпочтительные производные соединения (II), реакционноспособные по его карбоксильной группе, включают галогенангидриды, ангидриды кислоты, активированные амиды и активированные сложные эфиры, все полученные традиционными способами. В частности такие предпочтительные реакционноспособные производные включают хлорангидриды; азиды кислоты; смешанные ангидриды кислоты, такие как смешанные ангидриды с замещенной фосфорной кислотой, такой как диалкилфосфорная, фенилфосфорная, дифенилфосфорная, дибензилфосфорная или галогенированная фосфорная кислота, или с диалкилфосфористой, сернистой, тиосерной или серной кислотой, или с сульфокислотой, такой как метансульфокислота, или с алифатической карбоновой кислотой, такой как уксусная, пропионовая, масляная, изомасляная, триметилуксусная, пентановая, изопентановая или трихлоруксусная кислота, или с ароматической карбоновой кислотой, такой как бензойная кислота; симметричные ангидриды кислоты; активированные амиды с имидазолом, 4-замещенным имидазолом, диметилпиразолом, триазолом или тетразолом; активированные сложные эфиры, такие как цианметиловый, метоксиметиловый, диметилиминометиловый, виниловый, пропаргиловый, пара-нитрофениловый, трихлорфениловый, пентахлорфениловый, метилсульфонилфениловый, фенилазофениловый, фенилтио-, пара-нитрофениловый, пара-крезилтио-, карбоксиметилтио-, пираниловый, пиридиловый, пиперидиловый и 8-хинолилтио-эфиры; и сложные эфиры с N-гидроксисоединениями, такими как N,N-диметилгидроксиламин, 1-гидрокси-2(1H)-пиридон, N-гидроксисукцинимид, N-гидроксифталимид, 1-гидрокси-1H-бензотриазол и N-гидрокси-5-норборнан-2,3-дикарбоксимид. Эти реакционноспособные производные могут быть произвольно выбраны в соответствии с видом использованного соединения (II). Предпочтительные соли реакционноспособных производных соединения (II) или (III) включают соли оснований, например соли щелочных металлов, такие как натриевая и калиевая соли, соли щелочноземельных металлов, такие как кальциевая и магниевая соли, аммониевая соль, и соли органических оснований, такие как триметиламиновая, триэтиламиновая, пиридиновая, пиколиновая, дициклогексиаминовая и N,N-дибензилэтилендиаминовая соли. Эту реакцию обычно осуществляют в обыкновенном растворителе, например воде, спирте, таком как метанол или этанол, ацетоне, диоксане, ацетонитриле, хлороформе, метиленхлориде, этиленхлориде, тетрагидрофуране, этилацетате, N, N-диметилформамиде или пиридине, но можно проводить в любом другом органическом растворителе, если он не мешает реакции. Указанные традиционные растворители могут быть использованы в смеси с водой. Когда соединение (II) или (III) используют в форме свободной кислоты или ее соли, эту реакцию предпочтительно осуществляют в присутствии традиционного конденсирующего агента, например N, N’-дициклогексил-карбодиимида; N-циклогексил-N’-морфолиноэтилкарбодиимида; N-циклогесил-N’-(4-диэтилкарбодиимида; N,N’-диизопропил-карбодиимида; N-этил-N’-(3-диметиламинопропил)карбодиимида; N, N’-карбонилбис(2-метилимидазола); пентаметиленккетен-N-цикоргексилимина; дифенилкетен-N-циклогексилимина; этоксиацетилена; 1-алкокси-1-хлорэтилена; триалкилфосфита; этилполифосфата; изопропилполифосфата; оксихлорида фосфора; дифенилфосфорилазида; тионилхлорида; оксалилхлорида; низшего алкилгалогенформиата, такого как этилхлорформиат или изопропилхлорформиат; трифенилфосфина; 2-этил-7-гидроксибензизоксазолиевой соли; внутримолекулярной соли 2-этил-5-(мета-сульфофенил)изоксазолийгидроксида; N-гидроксибензотриазола; 1-(пара-хлорбензолсульфонилокси)-6-хлор-1H-бензотриазола или так называемого реактива Вилсмейера, получаемого взаимодействием N,N’-диметилформамида с тионилхлоридом, фосгеном, трихлорметилхлорформиатом, оксихлоридом фосфора или т.п. Является предпочтительным также использовать конденсирующий агент, такой как N,N’-дициклогексилкарбодиимид, в присутствии N-гидроксибензотриазола или N-гидрокси-5-норборнан-эндо-2,3-дикарбоксиимида. Эта реакция может быть осуществлена также в присутствии неорганического или органического основания, такого как три(низший)алкиламиногидрокарбонат щелочного металла, пиридин, N-(низший)алкилморфолин или N,N-ди(низший)алкилбензиламин. Температуру реакции не ограничивают, но обычно реакцию проводят в условиях от охлаждения до нагрева (-10 – 120oC). Время реакции составляет обычно примерно 0,5-100 часов, а предпочтительно примерно 1-50 часов. Полученное описанным образом соединение (I) может быть выделено и очищено известными способами разделения и очистки, такими как концентрирование, концентрирование под пониженным давлением, экстракция растворителями, кристаллизация, перекристаллизация, перерастворение и хроматография. Исходное соединение (II) может, например, быть получено путем оптического разделения рацемата соединения (II), описанного в нерассмотренной японской патентной публикации N 364179/1992. В частности, оптически активное соединение получают путем приготовления соли рацемата соединения (II) и оптически активного основания (напр., оптически активного  -метилбензиламина, бруцина, хинина, цинхонина), повторения дробной кристаллизации на основе различия в растворимости между полученными диастереомерами, чтобы получить умеренно растворимую соль в чистом виде, и затем выполнения операции обработки кислотой. В соответствии с другим способом оптически активное соединение может быть получено путем этерификации рацемата соединения (II) оптически активным спиртом (напр., оптически активный метиллактат, метилманделат), получения одного из полученных диастереомеров сложного эфира в чистом виде на основе различия в физических свойствах между диастереомерами и затем выполнения гидролиза.
Соединение (I) – целевое соединение по настоящему изобретению – может быть приготовлено в виде твердых лекарственных форм, таких как таблетки, капсулы, гранулы и порошки, жидких лекарственных форм, таких как сиропы и препараты для инъекций, в состав которых входят фармацевтически приемлемые носители и которые могут быть изготовлены традиционными способами и могут быть введены перорально или неперорально. Содержание соединения (I) относительной всей массы лекарственной формы составляет обычно примерно 0,01-95% (по массе), а предпочтительно примерно 0,1-20% (по массе). Соединение (I) предпочтительно используют в виде препарата для перорального введения.
Фармацевтически приемлемыми носителями являются различные органические или неорганические вещества-носители, широко используемые в качестве фармацевтических материалов, включающих эксципиенты, смазывающие, связывающие и разрыхляющие вещества для твердых лекарственных форм и растворители, вещества, способствующие растворению, суспендирующие, изотонирующие, буферные и успокаивающие вещества для жидких лекарственных форм. При необходимости могут быть использованы и другие фармацевтические добавки, такие как консерванты, антиоксиданты и красящие и подслащивающие вещества. Предпочтительные эксципиенты включают лактозу, сахарозу, D-маннит, крахмал, кристаллическую целлюлозу и легкий кремниевый ангидрид. Предпочтительные смазывающие вещества включают стеарат магния, стеарат кальция, тальк и коллоидальный диоксид кремния. Предпочтительные связывающие вещества включают кристаллическую целлюлозу, сахарозу, D-маннит, декстрин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и поливинилпирролидон. Предпочтительные разрыхляющие вещества включают крахмал, карбоксиметилцеллюлозу, кальций-карбоксиметилцеллюлозу, натрий-кросскарбоксиметилцеллюлозу и натрий-карбоксиметилкрахмал. Предпочтительные растворители включают воду для инъекции, спирт, пропиленгликоль, макроголь, сезамовое масло и кукурузное масло. Предпочтительные вещества, способствующие растворению, включают полиэтиленгликоль, пропиленгликоль, D-маннит, бензилбензоат, этанол, трис-аминометан, холестерин, триэтаноламин, карбонат натрия и цитрат натрия. Предпочтительные суспендирующие вещества включают поверхностно-активные вещества, такие как стеарилтриэтаноламин, лаурилсульфат натрия, лауриламинопропионовая кислота, лецитин, бензалконийхлорид, бензэтонийхлорид и моностеариновый глицерин; и гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон, натрий-карбоксиметилцеллюлоза, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза и гидроксипропилцеллюлоза. Предпочтительные изотонирующие вещества включают хлорид натрия, глицерин и D-маннит. Предпочтительные буферы включают буферные растворы фосфатов, ацетатов, карбонатов и цитратов. Предпочтительные успокаивающие вещества включают бензиловый спирт. Предпочтительные консерванты включают эфиры пара-оксибензойной кислоты, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидрацетовую кислоту и сорбиновую кислоту. Предпочтительные антиоксиданты включают сульфиты и аскорбиновую кислоту.
Поскольку соединение, представленное общей формулой (I), обладает высокими угнетающей рассасывание кости и остеогенезактивирующей активностями и отличными свойствами, касающимися клинического применения, такими как стабильность, всасываемость и биологическая доступность, то оно пригодно для применения в качестве активатора остеогенеза и может быть использовано для предупреждения или лечения различных заболеваний (повреждений) кости, таких как остеопороз и перелом, у млекопитающих животных (например, людей, крыс, мышей, кошек, собак, кроликов, коров, свиней). Соединение (I) в соответствии с настоящим изобретением безопасно в применении, потому что низкотоксично. Например, при пероральном введении соединения (I) крысам при дозе 500 мг/кг/день в течение 2 недель не было никаких анормальных явлений. Соединение (I) особенно превосходит соответствующее рацемическое соединение по всасываемости при пероральном введении и потому пригодно для изготовления лекарственных форм для перорального введения.
Более конкретно, оптически активное производное бензотиепина по настоящему изобретению, представленное общей формулой (I), обладает индицирующей щелочную фосфатазу активностью и потому проявляет сильное остеогенезеактивирующее действие и полезно как лекарственное средство для предотвращения или лечения связанных с нарушением обмена веществ заболеваний кости, включая остеопороз. Активатор остеогенеза, содержащий предлагаемое соединение (I) с такой активностью, может быть применен для лечения переломов, дефектов и заболеваний кости, таких как остеоартрит в области ортопедии и периодонтальные заболевания. Как установлено, такой активатор эффективен также в области стоматологии при лечении дефектов периодонта (околозубной ткани), вызванных периодонтитом, фиксации корней искусственных зубов, формировании альвеолярного отростка челюсти и лечении расщелины неба и т.д.
При использовании в качестве средства для профилактики и терапии, например, остеопороза соединение, представленное общей формулой (I), вводят в качестве активного компонента (I) при суточной дозе от 5 до 1000 мг, предпочтительно от 30 до 600 мг, в зависимости от состояния и массы больного и от способа введения, на каждого взрослого человека (весящего 50 кг) 1-3 порциями в сутки в случае перорального введения.
Соединение (I) по настоящему изобретению может быть применено в сочетании с другими средствами угнетения рассасывания кости и активаторами остеогенеза, такими как Витамин Ds (напр., 1 -метилбензиламина, бруцина, хинина, цинхонина), повторения дробной кристаллизации на основе различия в растворимости между полученными диастереомерами, чтобы получить умеренно растворимую соль в чистом виде, и затем выполнения операции обработки кислотой. В соответствии с другим способом оптически активное соединение может быть получено путем этерификации рацемата соединения (II) оптически активным спиртом (напр., оптически активный метиллактат, метилманделат), получения одного из полученных диастереомеров сложного эфира в чистом виде на основе различия в физических свойствах между диастереомерами и затем выполнения гидролиза.
Соединение (I) – целевое соединение по настоящему изобретению – может быть приготовлено в виде твердых лекарственных форм, таких как таблетки, капсулы, гранулы и порошки, жидких лекарственных форм, таких как сиропы и препараты для инъекций, в состав которых входят фармацевтически приемлемые носители и которые могут быть изготовлены традиционными способами и могут быть введены перорально или неперорально. Содержание соединения (I) относительной всей массы лекарственной формы составляет обычно примерно 0,01-95% (по массе), а предпочтительно примерно 0,1-20% (по массе). Соединение (I) предпочтительно используют в виде препарата для перорального введения.
Фармацевтически приемлемыми носителями являются различные органические или неорганические вещества-носители, широко используемые в качестве фармацевтических материалов, включающих эксципиенты, смазывающие, связывающие и разрыхляющие вещества для твердых лекарственных форм и растворители, вещества, способствующие растворению, суспендирующие, изотонирующие, буферные и успокаивающие вещества для жидких лекарственных форм. При необходимости могут быть использованы и другие фармацевтические добавки, такие как консерванты, антиоксиданты и красящие и подслащивающие вещества. Предпочтительные эксципиенты включают лактозу, сахарозу, D-маннит, крахмал, кристаллическую целлюлозу и легкий кремниевый ангидрид. Предпочтительные смазывающие вещества включают стеарат магния, стеарат кальция, тальк и коллоидальный диоксид кремния. Предпочтительные связывающие вещества включают кристаллическую целлюлозу, сахарозу, D-маннит, декстрин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу и поливинилпирролидон. Предпочтительные разрыхляющие вещества включают крахмал, карбоксиметилцеллюлозу, кальций-карбоксиметилцеллюлозу, натрий-кросскарбоксиметилцеллюлозу и натрий-карбоксиметилкрахмал. Предпочтительные растворители включают воду для инъекции, спирт, пропиленгликоль, макроголь, сезамовое масло и кукурузное масло. Предпочтительные вещества, способствующие растворению, включают полиэтиленгликоль, пропиленгликоль, D-маннит, бензилбензоат, этанол, трис-аминометан, холестерин, триэтаноламин, карбонат натрия и цитрат натрия. Предпочтительные суспендирующие вещества включают поверхностно-активные вещества, такие как стеарилтриэтаноламин, лаурилсульфат натрия, лауриламинопропионовая кислота, лецитин, бензалконийхлорид, бензэтонийхлорид и моностеариновый глицерин; и гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон, натрий-карбоксиметилцеллюлоза, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза и гидроксипропилцеллюлоза. Предпочтительные изотонирующие вещества включают хлорид натрия, глицерин и D-маннит. Предпочтительные буферы включают буферные растворы фосфатов, ацетатов, карбонатов и цитратов. Предпочтительные успокаивающие вещества включают бензиловый спирт. Предпочтительные консерванты включают эфиры пара-оксибензойной кислоты, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидрацетовую кислоту и сорбиновую кислоту. Предпочтительные антиоксиданты включают сульфиты и аскорбиновую кислоту.
Поскольку соединение, представленное общей формулой (I), обладает высокими угнетающей рассасывание кости и остеогенезактивирующей активностями и отличными свойствами, касающимися клинического применения, такими как стабильность, всасываемость и биологическая доступность, то оно пригодно для применения в качестве активатора остеогенеза и может быть использовано для предупреждения или лечения различных заболеваний (повреждений) кости, таких как остеопороз и перелом, у млекопитающих животных (например, людей, крыс, мышей, кошек, собак, кроликов, коров, свиней). Соединение (I) в соответствии с настоящим изобретением безопасно в применении, потому что низкотоксично. Например, при пероральном введении соединения (I) крысам при дозе 500 мг/кг/день в течение 2 недель не было никаких анормальных явлений. Соединение (I) особенно превосходит соответствующее рацемическое соединение по всасываемости при пероральном введении и потому пригодно для изготовления лекарственных форм для перорального введения.
Более конкретно, оптически активное производное бензотиепина по настоящему изобретению, представленное общей формулой (I), обладает индицирующей щелочную фосфатазу активностью и потому проявляет сильное остеогенезеактивирующее действие и полезно как лекарственное средство для предотвращения или лечения связанных с нарушением обмена веществ заболеваний кости, включая остеопороз. Активатор остеогенеза, содержащий предлагаемое соединение (I) с такой активностью, может быть применен для лечения переломов, дефектов и заболеваний кости, таких как остеоартрит в области ортопедии и периодонтальные заболевания. Как установлено, такой активатор эффективен также в области стоматологии при лечении дефектов периодонта (околозубной ткани), вызванных периодонтитом, фиксации корней искусственных зубов, формировании альвеолярного отростка челюсти и лечении расщелины неба и т.д.
При использовании в качестве средства для профилактики и терапии, например, остеопороза соединение, представленное общей формулой (I), вводят в качестве активного компонента (I) при суточной дозе от 5 до 1000 мг, предпочтительно от 30 до 600 мг, в зависимости от состояния и массы больного и от способа введения, на каждого взрослого человека (весящего 50 кг) 1-3 порциями в сутки в случае перорального введения.
Соединение (I) по настоящему изобретению может быть применено в сочетании с другими средствами угнетения рассасывания кости и активаторами остеогенеза, такими как Витамин Ds (напр., 1  -гидроксивитамин D3, 1 -гидроксивитамин D3, 1  , 25-дигидроксивитамин D3, флокальцитриол, Секальциферол и т.д.), Кальцитонины (напр. , Кальцитонин угревый, Кальцитонин лососевый, Кальцитонин свиной, Авикатонин и т. д. ), производные бисфосфиновой кислоты (напр., Этидронат, Цимадронат, Алендронат, Тилудронат, Ризедронат, Клодронат, YH-529 и т.д.), соединения, относящиеся к половым гормонам (напр., Тиболон, Эстрадиол, Озатерон, Ралоксифен, Дролоксифен, Ормелоксифен, Тамоксифен, Мифепристон и т.д.). Иприфлавон, Витамин K3 (напр. , Менатетренон), фторид натрия и производные РТН (напр., РТН(1-34), РТН(1-84), РТН(1-36) и т.д.).
Далее настоящее изобретение описано более подробно на примере испытания и ссылочных и рабочих примерах, которые ни в коей мере не ограничивают изобретение.
Пример 1 испытания , 25-дигидроксивитамин D3, флокальцитриол, Секальциферол и т.д.), Кальцитонины (напр. , Кальцитонин угревый, Кальцитонин лососевый, Кальцитонин свиной, Авикатонин и т. д. ), производные бисфосфиновой кислоты (напр., Этидронат, Цимадронат, Алендронат, Тилудронат, Ризедронат, Клодронат, YH-529 и т.д.), соединения, относящиеся к половым гормонам (напр., Тиболон, Эстрадиол, Озатерон, Ралоксифен, Дролоксифен, Ормелоксифен, Тамоксифен, Мифепристон и т.д.). Иприфлавон, Витамин K3 (напр. , Менатетренон), фторид натрия и производные РТН (напр., РТН(1-34), РТН(1-84), РТН(1-36) и т.д.).
Далее настоящее изобретение описано более подробно на примере испытания и ссылочных и рабочих примерах, которые ни в коей мере не ограничивают изобретение.
Пример 1 испытанияОстеогенезактивирующее действие Использовав стромальные клетки, полученные из мозга бедренной кости обычной крысы, определяли в качестве показателя остеогенеза активность щелочной фосфатазы. В частности, стромальные клетки, полученные из костного мозга бедренной кости мужской особи крысы Sprague-Dawley 7-недельного возраста по методу Maniatopoulos et al. [Cell Tissue Research, т. 254, стр. 317 (1988)] , культивировали в  -MEM (минимальная необходимая среда) растворе, содержавшем как дексаметазон (10-7 М), так и -MEM (минимальная необходимая среда) растворе, содержавшем как дексаметазон (10-7 М), так и  -глицерофосфорную кислоту (10-2 М), для получения минерализованной костнообразной ткани. Спустя неделю к сливающимся клеткам добавляли испытываемое соединение (10-6 М или 10-5 М) с последующим культивированием в указанной жидкой питательной среде еще в течение 10-14 дней. После промывки фосфатным буферным раствором клетки гомогенезировали посредством 0,2%-ного Нонидета Р-40 и центрифугировали при 3000 об/мин в течение 10 минут. Полученный супернатант исследовали на щелочнофосфатазную активность по методу Lowry et al. [Journal of Biological Chemistry, т. 207, стр. 19 (1954)]. Полученные значения даны как средние значения -глицерофосфорную кислоту (10-2 М), для получения минерализованной костнообразной ткани. Спустя неделю к сливающимся клеткам добавляли испытываемое соединение (10-6 М или 10-5 М) с последующим культивированием в указанной жидкой питательной среде еще в течение 10-14 дней. После промывки фосфатным буферным раствором клетки гомогенезировали посредством 0,2%-ного Нонидета Р-40 и центрифугировали при 3000 об/мин в течение 10 минут. Полученный супернатант исследовали на щелочнофосфатазную активность по методу Lowry et al. [Journal of Biological Chemistry, т. 207, стр. 19 (1954)]. Полученные значения даны как средние значения  SE (средняя квадратичная ошибка) в таблице. Данные были подвергнуты статистическому анализу по t-критерию Стьюдента.
Из таблицы видно, что оптически активное производное бензотиепина по настоящему изобретению, представленное общей формулой (I), обладает высокой щелочнофосфатазной активностью и потому проявляет отличное остеогенезактивирующее действие и полезно в качестве лекарственного средства для предупреждения и лечения заболеваний кости, связанных с обменом веществ, включая остеопороз.
Ссылочный пример 1 SE (средняя квадратичная ошибка) в таблице. Данные были подвергнуты статистическому анализу по t-критерию Стьюдента.
Из таблицы видно, что оптически активное производное бензотиепина по настоящему изобретению, представленное общей формулой (I), обладает высокой щелочнофосфатазной активностью и потому проявляет отличное остеогенезактивирующее действие и полезно в качестве лекарственного средства для предупреждения и лечения заболеваний кости, связанных с обменом веществ, включая остеопороз.
Ссылочный пример 1Смесь (R)-  -метоксикарбонилбензилового эфира (2R,4S)-(-)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (4,18 г), уксусной кислоты (45 мл) и концентрированной хлористоводородной кислоты (30 мл) перемешивали в течение 30 минут при нагреве с обратным холодильником. Реакционную смесь вливали в воду (800 мл), полученные кристаллы отфильтровывали и растворяли в этилацетате (150 мл). Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель, отфильтровывали полученные кристаллы, промывали их гексаном и затем перекристаллизовывали из смеси этилацетат-гексан, получив в результате (2R,4S)-(-)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5- оксо-3-бензилтиепин-2-карбоновую кислоту (1,62 г, 59%). Бесцветные игольчатые кристаллы. Температура плавления 194-195oC. Удельное вращение [ -метоксикарбонилбензилового эфира (2R,4S)-(-)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (4,18 г), уксусной кислоты (45 мл) и концентрированной хлористоводородной кислоты (30 мл) перемешивали в течение 30 минут при нагреве с обратным холодильником. Реакционную смесь вливали в воду (800 мл), полученные кристаллы отфильтровывали и растворяли в этилацетате (150 мл). Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель, отфильтровывали полученные кристаллы, промывали их гексаном и затем перекристаллизовывали из смеси этилацетат-гексан, получив в результате (2R,4S)-(-)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5- оксо-3-бензилтиепин-2-карбоновую кислоту (1,62 г, 59%). Бесцветные игольчатые кристаллы. Температура плавления 194-195oC. Удельное вращение [ ]D (23oC): -210,8o (c = 0,50, CH3OH).
Ссылочный пример 2 ]D (23oC): -210,8o (c = 0,50, CH3OH).
Ссылочный пример 2Раствор 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида (12,59 г) в дихлорметане (200 мл) добавляли к раствору (  )-транс-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (15,34 г) и метил(R)-(-)-манделата (18,19 г) в N,N-диметилформамиде (ДМФ) (200 мл), после чего к полученной смеси добавляли 4-диметиламинопиридин (ДМАП) (3,34 г) при 0oC. Эту смесь перемешивали при 0oC в течение 1 часа и при комнатной температуре в течение 15 часов, после чего ее вливали в воду и экстрагировали этилацетатом. Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель, отфильтровывали полученные кристаллы, промывали их смесью диэтиловый эфир-гексан и затем дважды перекристаллизовывали из смеси этилацетат-гексан, получив в результате (R)- )-транс-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (15,34 г) и метил(R)-(-)-манделата (18,19 г) в N,N-диметилформамиде (ДМФ) (200 мл), после чего к полученной смеси добавляли 4-диметиламинопиридин (ДМАП) (3,34 г) при 0oC. Эту смесь перемешивали при 0oC в течение 1 часа и при комнатной температуре в течение 15 часов, после чего ее вливали в воду и экстрагировали этилацетатом. Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель, отфильтровывали полученные кристаллы, промывали их смесью диэтиловый эфир-гексан и затем дважды перекристаллизовывали из смеси этилацетат-гексан, получив в результате (R)-  -метоксикарбонилбензиловый эфир (2R, 4S)-(-)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (4,09 г, 17%). Бесцветные игольчатые кристаллы. Температура плавления 140-141oC. Удельное вращение [ -метоксикарбонилбензиловый эфир (2R, 4S)-(-)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (4,09 г, 17%). Бесцветные игольчатые кристаллы. Температура плавления 140-141oC. Удельное вращение [ ]D (23oC): -244,2o (c = 0,50, CHCl3).
Пример 1 ]D (23oC): -244,2o (c = 0,50, CHCl3).
Пример 1(2R, 4S)-(-)-N-[4-(Диэтоксифосфорилметил)фенил] -1,2,4,5- тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3-бензотиепин-2-карбоксамид 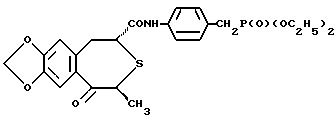 Раствор 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида (0,39 г) в дихлорметане (7 мл) добавляли к раствору (2R,4S)-(-)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (0,47 г) и диэтил-4-аминобензилфосфоната (0,41 г) в N,N-диметилформамиде (ДМФ) (7 мл) при 0oC, после чего к полученной смеси добавляли 1-гидрооксибензотриазол (ГОБт) (0,28 г). Эту смесь перемешивали при 0oC в течение 1 часа и при комнатной температуре (25oC) в течение 15 часов, после чего вливали в воду и экстрагировали этилацетатом. Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель и отфильтровывали полученные кристаллы с последующей их перекристаллизацией из смеси этилацетат-гексан и затем из смеси метано-гексан, и в результате получили (2R,4S)-(-)-N-[4-(диэтоксифосфорилметил)-фенил] -1,2,4,5-тетрагидро-4- метил-7,8-метилендиокси-5-оксо-3-бензотиепин-2-карбоксамид (0,37 г, 44%). Бесцветные призматические кристаллы. Температура плавления 181-182oC. Удельное вращение [  ]D (23oC): -187,4o (c = 0,50, CHCl3).
Пример 2 ]D (23oC): -187,4o (c = 0,50, CHCl3).
Пример 2(2R, 4S)-(-)-N-[4-(диметоксифосфорилметил)-фенил] -1,2,4,5- тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3-бензотиепин-2-карбоксамид 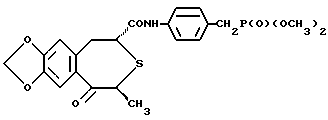 К раствору (2R,4S)-(-)-1,2,4,5-тетрагидро-4-метил-7,8- метилендиокси-5-оксо-3-бензотиепин-2-карбоновой кислоты (0,84 г) и диметил-4-аминобензилфосфата (0,85 г) в N,N-диметилформамиде (ДМФ) (10 мл) при 0oC добавляли 1-гидроксибензотриазол (ГОБт) (0,51 г) и 1-этил-3-(3-диметиламинопропил)карбодимиимидгидрохлорид (0,69 г). Эту смесь перемешивали при 0oC в течение 1 часа и при комнатной температуре в течение 15 часов, после чего вливали в воду и экстрагировали смесью этилцетат-тетрагидрофуран (3:1). Слой этилацетата промывали последовательно 1н. HCl, водой, насыщенным раствором гидрокарбоната натрия, водой и солевым раствором и осушали (MgSO4), после чего отгоняли растворитель. Оставшееся твердое вещество отфильтровывали с последующей перекристаллизацией из смеси этанол-гексан, и в результате получили (2R,4S)-(-)-N-[4-(диметоксифосфорилметил)-фенил]-1,2,4,5-тетрагидро-4- метил-7,8-метилендиокси-5-оксо-3-бензотиепин-2-карбоксамид (0,92 г, 64%). Бесцветные игольчатые кристаллы. Температура плавления 198-199oC. Удельное вращение [  ]D (23oC): -198,8o (c = 0,50, CHCl3).
Пример 3 ]D (23oC): -198,8o (c = 0,50, CHCl3).
Пример 3(2R, 4S)-(-)-N-[4-(Тетраметилендиоксифосфорилметил)-фенил]-1,2,4,5- тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3-бензотиепин-2-карбоксамид 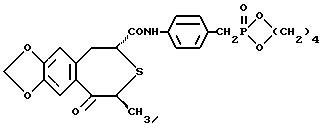 Таким же образом, как в примере 2, получили (2R,4S)-(-)-N-[4-(Тетраметилендиоксифосфорилметил)-фенил] -1,2,4,5- тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3-бензотиепин-2-карбоксамид. Бесцветные призматические кристаллы. Температура плавления 139-140oC. Удельное вращение [  ]D (23oC): 176,2o (c = 0,50, CHCl3).
Примеры изготовления лекарственных форм ]D (23oC): 176,2o (c = 0,50, CHCl3).
Примеры изготовления лекарственных формАктиватор остеогенеза, содержащий в качестве активного компонента оптически активное соединение формулы (I), может быть получен, например, в виде следующих лекарственных форм: 1. Капсулы (1) (2R, 4S)-(-)-N-[4-(Диэтоксифосфорилметил)фенил] -1,2,4,5- тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3-бензотиепин-2-карбоксамид – 10 мг (2) Лактоза – 90 мг (3) Микрокристаллическая целлюлоза – 70 мг (4) Стеарат магния – 10 мг Итого: 180 мг, на капсулу Компоненты (1), (2) и (3) и половину компонента (4) смешивают и гранулируют. К полученным гранулам добавляют оставшуюся часть компонента (4), и всю смесь заключают в желатиновую капсулу. 2. Таблетки (1) (2R, 4S)-(-)-N-[4-(Диэтоксифосфорилметил)фенил] -1,2,4,5- тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3-бензотиепин-2-карбоксамид – 10 мг (2) Лактоза – 35 мг (3) Кукурузный крахмал – 150 мг (4) Микрокристаллическая целлюлоза – 30 мг (5) Стеарат магния – 5 мг Итого: 230 мг на таблетку Компоненты (1), (2) и (3), две трети компонента (4) и половину компонента (5) смешивают и гранулируют. К полученным гранулам добавляют оставшиеся части компонентов (4) и (5), и всю смесь таблетируют путем прессования на таблеточной машине. 3. Лекарственная форма для инъекции (1) (2R, 4S)-(-)-N-[4-(Диэтоксифосфорилметил)фенил] -1,2,4,5- тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3-бензотиепин-2-карбоксамид – 10 мг (2) Инозит – 100 мг (3) Бензиловый спирт – 20 мг Итого: 130 мг на ампулу Компоненты (1), (2) и (3) растворяют в дистиллированной воде для инъекции до получения конечного количества 2 мл и раствор заключают в ампулу. Всю процедуру выполняют стерильно. Ссылочный пример 3 К суспензии (  )-3,4-дигидро-6,7-диметил-4-оксо-1H-2- бензотиопиран-1-карбоновой кислоты (27,5 г) в хлороформе (200 мл) добавляли (S)-(-)- )-3,4-дигидро-6,7-диметил-4-оксо-1H-2- бензотиопиран-1-карбоновой кислоты (27,5 г) в хлороформе (200 мл) добавляли (S)-(-)-  -метилбензиламин (14,1 г). После перемешивания при комнатной температуре в течение 30 минут реакционную смесь концентрировали под пониженным давлением. Полученный остаток растворяли в этилацетате (200 мл) и оставляли при комнатной температуре на 2 часа. Полученные кристаллы отфильтровывали, после чего перекристаллизовывали из смеси хлороформ-этилацетат и затем из смеси хлороформ-гексан, получив в результате (S)-(-)-метилбензиламиновую соль (-)-3,4-дигидро-6,7-диметил-4-оксо-1H-2-бензотиопиран-1-карбоновой кислоты (15,5 г, 37%). Бесцветные призматические кристаллы. Температура плавления 162-163oC. Удельное вращение [ -метилбензиламин (14,1 г). После перемешивания при комнатной температуре в течение 30 минут реакционную смесь концентрировали под пониженным давлением. Полученный остаток растворяли в этилацетате (200 мл) и оставляли при комнатной температуре на 2 часа. Полученные кристаллы отфильтровывали, после чего перекристаллизовывали из смеси хлороформ-этилацетат и затем из смеси хлороформ-гексан, получив в результате (S)-(-)-метилбензиламиновую соль (-)-3,4-дигидро-6,7-диметил-4-оксо-1H-2-бензотиопиран-1-карбоновой кислоты (15,5 г, 37%). Бесцветные призматические кристаллы. Температура плавления 162-163oC. Удельное вращение [ ]D (23oC): -43o (c = 0,50, CHCl3).
Ссылочный пример 4 ]D (23oC): -43o (c = 0,50, CHCl3).
Ссылочный пример 4К суспензии (  )-3,4-дигидро-6,7-диметил-4-оксо-1H-2- бензотиопиран-1-карбоновой кислоты (35,0 г) в хлороформе (300 мл) добавляли (R)-(+)- )-3,4-дигидро-6,7-диметил-4-оксо-1H-2- бензотиопиран-1-карбоновой кислоты (35,0 г) в хлороформе (300 мл) добавляли (R)-(+)-  -метилбензиламин (17,9 г). После перемешивания при комнатной температуре в течение 30 минут реакционную смесь концентрировали под пониженным давлением. Полученный остаток растворяли в этилацетате (200 мл) и оставляли при комнатной температуре на 2 часа. Полученные кристаллы отфильтровывали, после чего перекристаллизовывали из смеси хлороформ-этилацетат и затем из смеси хлороформ-гексан, получив в результате (R)-(+)- -метилбензиламин (17,9 г). После перемешивания при комнатной температуре в течение 30 минут реакционную смесь концентрировали под пониженным давлением. Полученный остаток растворяли в этилацетате (200 мл) и оставляли при комнатной температуре на 2 часа. Полученные кристаллы отфильтровывали, после чего перекристаллизовывали из смеси хлороформ-этилацетат и затем из смеси хлороформ-гексан, получив в результате (R)-(+)-  -метилбензиламиновую соль (+)-3,4-дигидро-6,7-диметил-4-оксо-1H-2- бензотиопиран-1-карбоновой кислоты (17,9 г, 34%). Бесцветные призматические кристаллы. Температура плавления 162-163oC. Удельное вращение [ -метилбензиламиновую соль (+)-3,4-дигидро-6,7-диметил-4-оксо-1H-2- бензотиопиран-1-карбоновой кислоты (17,9 г, 34%). Бесцветные призматические кристаллы. Температура плавления 162-163oC. Удельное вращение [ ]D (23oC): -42,2o (c = 0,51, CHCl3).
Ссылочный пример 5 ]D (23oC): -42,2o (c = 0,51, CHCl3).
Ссылочный пример 5К суспензии (S)-(-)-  -метилбензиламиновой соли (-)-3,4-дигидро-6,7-диметил-4-оксо-1H-2-бензотиопиран-1-карбоновой кислоты (14,5 г) в этилацетате (100 мл) добавляли 2 н. HCl (100 мл). После перемешивания смеси при комнатной температуре в течение 30 минут собирали слой этилацетата. Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель с последующей их перекристаллизацией из смеси этилацетат-гексан и в результате получили (-)-3,4-дигидро-6,7-диметил-4-оксо-1H-2-бензотиопиран-1-карбоновую кислоту (9,1 г 95%). Бесцветные призматические кристаллы. Температура плавления 177-178oC. Удельное вращение [ -метилбензиламиновой соли (-)-3,4-дигидро-6,7-диметил-4-оксо-1H-2-бензотиопиран-1-карбоновой кислоты (14,5 г) в этилацетате (100 мл) добавляли 2 н. HCl (100 мл). После перемешивания смеси при комнатной температуре в течение 30 минут собирали слой этилацетата. Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель с последующей их перекристаллизацией из смеси этилацетат-гексан и в результате получили (-)-3,4-дигидро-6,7-диметил-4-оксо-1H-2-бензотиопиран-1-карбоновую кислоту (9,1 г 95%). Бесцветные призматические кристаллы. Температура плавления 177-178oC. Удельное вращение [ ]D (23oC): -135,0o (c = 0,50, CHCl3).
Ссылочный пример 6 ]D (23oC): -135,0o (c = 0,50, CHCl3).
Ссылочный пример 6К суспензии (R)-(+)-  -метилбензиламиновой соли (+)-3,4-дигидро-6,7-диметил-4-оксо-1H-2-бензотиопиран-1-карбоновой кислоты (8,0 г) в этилацетате (100 мл) добавляли 2 н. HCl (50 мл). После перемешивания смеси при комнатной температуре в течение 30 минут собирали слой этилацетата. Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель с последующей перекристаллизацией из смеси этилацетат-гексан, и в результате получили (+)-3,4-дигидро-6,7-диметил-4-оксо-1H-2-бензотиопиран-1-карбоновую кислоту (4,55 г 86%). Бесцветные призматические кристаллы. Температура плавления 177-178oC. Удельное вращение [ -метилбензиламиновой соли (+)-3,4-дигидро-6,7-диметил-4-оксо-1H-2-бензотиопиран-1-карбоновой кислоты (8,0 г) в этилацетате (100 мл) добавляли 2 н. HCl (50 мл). После перемешивания смеси при комнатной температуре в течение 30 минут собирали слой этилацетата. Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель с последующей перекристаллизацией из смеси этилацетат-гексан, и в результате получили (+)-3,4-дигидро-6,7-диметил-4-оксо-1H-2-бензотиопиран-1-карбоновую кислоту (4,55 г 86%). Бесцветные призматические кристаллы. Температура плавления 177-178oC. Удельное вращение [ ]D (23oC): -135,0o (c = 0,50, CHCl3).
Ссылочный пример 7 ]D (23oC): -135,0o (c = 0,50, CHCl3).
Ссылочный пример 7Раствор 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида (4,89 г) в дихлорметане (80 мл) добавляли к раствору (  )-1,2,4,5-тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоновой кислоты (6,0 г) и метил-(R)-(+)-лактата (4,43 г) в N,N-диметилформамиде (ДМФ) (80 мл) при 0oC с последующим добавлением 4-диметиламинопиридина (ДМАП) (1,3 г). Эту смесь перемешивали при 0oC в течение 1 часа и при комнатной температуре в течение 15 часов и концентрировали при пониженном давлении. К остатку добавляли этилацетат (500 мл) и воду (500 мл), после чего собирали органический слой. Органический слой промывали водой и осушали (MgSO4), после чего отгоняли растворитель, и оставшееся твердое вещество отфильтровывали и промывали диэтиловым эфиром, после чего дважды перекристаллизовывали из смеси этилацетат, получив в результате (R)-1-метоксикарбонилэтиловый эфир (2R)-(-)-1,2,4,5-тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоновой кислоты (2,2 г, 28%). Бесцветные игольчатые кристаллы. Температура плавления 161-162oC. Удельное вращение [ )-1,2,4,5-тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоновой кислоты (6,0 г) и метил-(R)-(+)-лактата (4,43 г) в N,N-диметилформамиде (ДМФ) (80 мл) при 0oC с последующим добавлением 4-диметиламинопиридина (ДМАП) (1,3 г). Эту смесь перемешивали при 0oC в течение 1 часа и при комнатной температуре в течение 15 часов и концентрировали при пониженном давлении. К остатку добавляли этилацетат (500 мл) и воду (500 мл), после чего собирали органический слой. Органический слой промывали водой и осушали (MgSO4), после чего отгоняли растворитель, и оставшееся твердое вещество отфильтровывали и промывали диэтиловым эфиром, после чего дважды перекристаллизовывали из смеси этилацетат, получив в результате (R)-1-метоксикарбонилэтиловый эфир (2R)-(-)-1,2,4,5-тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоновой кислоты (2,2 г, 28%). Бесцветные игольчатые кристаллы. Температура плавления 161-162oC. Удельное вращение [ ]D (16oC): -194,1o (c = 0,50, CHCl3). Фильтрат вышеуказанного твердого вещества концентрировали и полученные кристаллы улавливали путем фильтрования со смесью диэтиловый эфир-гексан, после чего дважды перекристаллизовывали из смеси этилацетат-гексан, получив в результате (R)-1-метоксикарбонилэтиловый эфир (2S)-(+)-1,2,4,5-тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоновой кислоты (1,6 г, 20%). Бесцветные пластинки. Температура плавления 121-122oC. Удельное вращение [ ]D (16oC): -194,1o (c = 0,50, CHCl3). Фильтрат вышеуказанного твердого вещества концентрировали и полученные кристаллы улавливали путем фильтрования со смесью диэтиловый эфир-гексан, после чего дважды перекристаллизовывали из смеси этилацетат-гексан, получив в результате (R)-1-метоксикарбонилэтиловый эфир (2S)-(+)-1,2,4,5-тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоновой кислоты (1,6 г, 20%). Бесцветные пластинки. Температура плавления 121-122oC. Удельное вращение [ ]D (16oC): -234,3o (c = 0,50, CHCl3).
Ссылочный пример 8 ]D (16oC): -234,3o (c = 0,50, CHCl3).
Ссылочный пример 8Смесь (R)-1-метоксикарбонилэтилового эфира (2R)-(-)-1,2,4,5-тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоновой кислоты (0,5 г), уксусной кислоты (2,5 мл) и концентрированной хлористоводородной кислоты (2,5 мл) перемешивали 30 минут при нагреве с обратным холодильником. Реакционную смесь вливали в воду (50 мл) и полученные кристаллы отфильтровывали и промывали последовательно водой, этанолом и диэтиловым эфиром, получив в результате (2R)-(-)-1,2,4,5-тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоновую кислоту (0,2 г, 53%). Бесцветный порошок. Температура плавления 223-224oC. Удельное вращение [  ]D (23oC): -190,0o (c = 0,50, ДМСО).
Ссылочный пример 9 ]D (23oC): -190,0o (c = 0,50, ДМСО).
Ссылочный пример 9Смесь (R)-1-метоксикарбонилэтилового эфира (2S)-(+)-1,2,4,5-тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоновой кислоты (0,7 г), уксусной кислоты (3,5 мл) и концентрированной хлористоводородной кислоты (3,5 мл) перемешивали 30 минут при нагреве с обратным холодильником. Реакционную смесь вливали в воду (70 мл), и полученные кристаллы отфильтровывали и промывали последовательно водой, этанолом и диэтиловым эфиром, получив в результате (2S)-(+)-1,2,4,5-тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоновую кислоту (0,3 г, 56%). Бесцветный порошок. Температура плавления 223-224oC. Удельное вращение [  ]D (22oС): +196,7o (c = 0,50, ДМСО).
Ссылочный пример 10 ]D (22oС): +196,7o (c = 0,50, ДМСО).
Ссылочный пример 10Раствор 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида (12,5 г) в дихлорметане (200 мл) добавляли к раствору (  )-транс-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (15,34 г) и метил-(S)-(+)-манделата (18,19 г) в N,N-диметилформамиде (ДМФ) (200 мл) при 0oC с последующим добавлением 4-диметиламинопиридина (ДМАП) (3,34 г). Эту смесь перемешивали при 0oC в течение 1 часа и при комнатной температуре в течение 15 часов, после чего вливали в воду и экстрагировали этилацетатом. Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель, и оставшиеся кристаллы отфильтровывали и промывали смесью диэтиловый эфир-гексан, а затем дважды перекристаллизовывали из смеси этилацетат, получив в результате (S)- )-транс-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (15,34 г) и метил-(S)-(+)-манделата (18,19 г) в N,N-диметилформамиде (ДМФ) (200 мл) при 0oC с последующим добавлением 4-диметиламинопиридина (ДМАП) (3,34 г). Эту смесь перемешивали при 0oC в течение 1 часа и при комнатной температуре в течение 15 часов, после чего вливали в воду и экстрагировали этилацетатом. Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель, и оставшиеся кристаллы отфильтровывали и промывали смесью диэтиловый эфир-гексан, а затем дважды перекристаллизовывали из смеси этилацетат, получив в результате (S)-  -метоксикарбонилэтиловый эфир (2S, 4R)-(+)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (4,57 г, 19%). Бесцветные игольчатые кристаллы. Температура плавления 141-142oC. Удельное вращение [ -метоксикарбонилэтиловый эфир (2S, 4R)-(+)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (4,57 г, 19%). Бесцветные игольчатые кристаллы. Температура плавления 141-142oC. Удельное вращение [ ]D (23oC): +239,7o (c = 0,50, CHCl3).
Ссылочный пример 11 ]D (23oC): +239,7o (c = 0,50, CHCl3).
Ссылочный пример 11Смесь (S)-  -метоксикарбонилэтилового эфира (2S,4R)-(+)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (4,37 г), уксусной кислоты (45 мл) и концентрированной хлористоводородной кислоты (30 мл) перемешивали 30 минут при нагреве с обратным холодильником. Реакционную смесь вливали в воду (800 мл), и полученные кристаллы отфильтровывали и растворяли в этилацетате (150 мл). Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель и оставшиеся кристаллы отфильтровывали и промывали гексаном, а затем перекристаллизовывали из смеси этилацетат-гексан, получив в результате (2S,4R)-(+)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиоксин-5- оксо-3-бензотиепин-2-карбоновую кислоту (1,38 г, 48%). Бесцветные игольчатые кристаллы. Температура плавления 192-193oC. Удельное вращение [ -метоксикарбонилэтилового эфира (2S,4R)-(+)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (4,37 г), уксусной кислоты (45 мл) и концентрированной хлористоводородной кислоты (30 мл) перемешивали 30 минут при нагреве с обратным холодильником. Реакционную смесь вливали в воду (800 мл), и полученные кристаллы отфильтровывали и растворяли в этилацетате (150 мл). Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель и оставшиеся кристаллы отфильтровывали и промывали гексаном, а затем перекристаллизовывали из смеси этилацетат-гексан, получив в результате (2S,4R)-(+)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиоксин-5- оксо-3-бензотиепин-2-карбоновую кислоту (1,38 г, 48%). Бесцветные игольчатые кристаллы. Температура плавления 192-193oC. Удельное вращение [ ]D (23oC): +212,9o (c = 0,50, CH3OH).
Ссылочный пример 12 ]D (23oC): +212,9o (c = 0,50, CH3OH).
Ссылочный пример 12После растворения (-)-3,4-дигидро-6,7-диметил-4-оксо-1H-2- бензотиопиран-1-карбоновой кислоты (8,6 г) в тетрагидрофуране (100 мл) к полученному раствору добавляли оксалилхлорид (5,0 г) с последующим добавлением N,N-диметилформамида (1 капля). После перемешивания при комнатной температуре в течение 3 часов, реакционную смесь концентрировали под пониженным давлением. Остаток растворяли в дихлорметане (30 мл) и полученный раствор добавляли по каплям к смеси диэтил-4-амино-бензилфосфоната (8,8 г), гидрокарбоната натрия (10,0 г) и дихлорметана (100 мл) при охлаждении льдом. После перемешивания в течение 30 минут при охлаждении льдом реакционную смесь промывали водой и осушали (MgSO4), а затем отгоняли растворитель с последующей перекристаллизацией из смеси хлороформгексан, и в результате получили (-)-N-[4-(диэтоксифосфорилметил)фенил]-3,4-дигидро-6,7-диметил-4-оксо- 1H-2-бензотиопиран-1-карбоксамид (15,4 г, 92%). Бесцветные игольчатые кристаллы. Температура плавления 175-176oC. Удельное вращение [  ]D (23oC): -152,0o (c = 1,0, CH3OH).
Ссылочный пример 13 ]D (23oC): -152,0o (c = 1,0, CH3OH).
Ссылочный пример 13После растворения (+)-3,4-дигидро-6,7-диметил-4-оксо-1H-2- бензотиопиран-1-карбоновой кислоты (8,4 г) в тетрагидрофуране (100 мл) к полученному раствору добавляли оксалилхлорид (5,0 г) с последующим добавлением N,N-диметилформамида (1 капля). После перемешивания при комнатной температуре в течение 3 часов реакционную смесь концентрировали под пониженным давлением. Остаток растворяли в дихлорметане (30 мл), и полученный раствор добавляли по каплям к смеси диэтил-4-амино-бензилфосфоната (8,6 г), гидрокарбоната натрия (8,0 г) и дихлорметана (100 мл) при охлаждении льдом. После перемешивания в течение 30 минут при охлаждении льдом реакционную смесь промывали водой и осушили (MgSO4), а затем отгоняли растворитель с последующей перекристаллизацией из смеси хлороформ-гексан и в результате получили (+)-N-[4-(диэтоксифосфорилметил)фенил] -3,4-дигидро-6,7-диметил-4- оксо-1H-2-бензотиопиран-1-карбоксамид (15,8 г, 96%). Бесцветные игольчатые кристаллы. Температура плавления 175-176oC. Удельное вращение [  ]D (23oC): +155,0o (c = 1,0, CH3OH).
Ссылочный пример 14 ]D (23oC): +155,0o (c = 1,0, CH3OH).
Ссылочный пример 14Раствор 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида (0,149 г) в дихлорметане (3 мл) добавляли к раствору (R)-(-)-1,2,4,5-тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоновой кислоты (0,183 г) и диэтил-4-аминобензилфосфоната (0,158 г) в N,N-диметилформамиде (ДМФ) (3 мл) при 0oC с последующим добавлением 1-гидроксибензотриазола (ГОБт) (0,109 г). Эту смесь перемешивали при 0oC в течение 1 часа и при комнатной температуре в течение 15 часов, после чего вливали в воду и экстрагировали этилацетатом. Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель, остаток обрабатывали смесью этанол-диизопропиловый эфир, и отфильтровывали твердое вещество. Фильтрат концентрировали и остаточное масло подвергали колоночной хроматографии на силикагеле. Из фракции, элюированной смесью этилацетат-хлороформ-метанол (15: 15:1, о/о), получили (2R)-(-)-N-[4-диэтоксифосфорилметил)фенил] -1,2,4,5- тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоксамид (0,136 г, 41%). Бесцветное аморфное твердое вещество. Температура плавления 96-98oC. Удельное вращение [  ]D (23oC): -155,0o (c = 0,50, CHCl3).
Ссылочный пример 15 ]D (23oC): -155,0o (c = 0,50, CHCl3).
Ссылочный пример 15Раствор 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида (0,228 г) в дихлорметане (5 мл) добавляли к раствору (S)-(+)-1,2,4,5-тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоновой кислоты (0,28 г) и диэтил-4-аминобензилфосфоната (0,241 г) в N,N-диметилформамиде (ДМФ) (5 мл) при 0oC с последующим добавлением 1-гидроксибензотриазола (ГОБт) (0,167 г). Эту смесь перемешивали при 0oC в течение 1 часа и при комнатной температуре в течение 15 часов, после чего вливали в воду и экстрагировали этилацетатом. Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель, остаток обрабатывали смесью этанол-диизопропиловый эфир и отфильтровывали твердое вещество. Фильтрат концентрировали, и остаточное масло подвергали колоночной хроматографии на силикагеле. Из фракции, элюированной смесью этилацетат-хлороформ-метанол (15: 15:1, о/о), получили (2S)-(+)-N-[4-диэтоксифосфорилметил)фенил] -1,2,4,5- тетрагидро-7,8-диметокси-5-оксо-3-бензотиепин-2-карбоксамид (0,202 г, 40%). Бесцветное аморфное твердое вещество, температура плавления 97-99oC. Удельное вращение [  ]D (23oC): +155,3o (c = 0,50, CHCl3).
Ссылочный пример 16 ]D (23oC): +155,3o (c = 0,50, CHCl3).
Ссылочный пример 16Раствор 1-этил-3-(3-диметиламинопропил)карбодиимидгидрохлорида (0,69 г) в дихлорметане (12 мл) добавляли к раствору (2S,4R)-(+)-1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3- бензотиепин-2-карбоновой кислоты (0,84 г) и диэтил-4-аминобензилфосфоната (0,73 г) в N,N-диметилформамиде (ДМФ) (12 мл) при 0oC с последующим добавлением 1-гидроксибензотриазола (ГОБт) (0,51 г). Эту смесь перемешивали при 0oC в течение 1 часа и при комнатной температуре в течение 15 часов, после чего вливали в воду и экстрагировали этилацетатом. Слой этилацетата промывали водой и осушали (MgSO4), после чего отгоняли растворитель, остаточные кристаллы отфильтровывали с последующей перекристаллизацией из смеси этилацетат-гексан и затем из смеси метанол-гексан, и в результате получили (2S,4R)-(+)-N-[4-диэтоксифосфорилметил)фенил] -1,2,4,5-тетрагидро-7,8- метилендиокси-5-оксо-3-бензотиепин-2-карбоксамид (0,62 г, 41%). Бесцветные призматические кристаллы. Температура плавления 183-184oC. Удельное вращение [  ]D (23oC): +190,5o (c = 0,50, CHCl3).
Промышленная применимость ]D (23oC): +190,5o (c = 0,50, CHCl3).
Промышленная применимостьСоединение (1) по настоящему изобретению обладает отличным остеогенезактивирующим действием и полезно как профилактическое и терапевтическое средство против заболеваний кости (заболевания кости, связанные с нарушением обмена веществ, включая остеопороз, переломы костей, дефекты костей и заболевания кости, такие как остеоартрит в области ортопедии), а также эффективно в области стоматологии для лечения дефектов периодонта (околозубной ткани), фиксации искусственных корней, формирования альвеолярного отростка челюсти и лечения расщелины неба и т.д. Формула изобретения
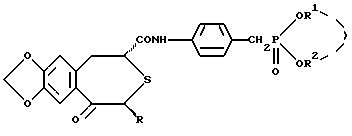 где R представляет низшую алкильную группу; R1 и R2 независимо представляют низшую алкильную группу или вместе представляют низший алкилен. 2. Соединение по п.1, где R, R1 и R2 независимо представляют C1-4-алкильную группу. 3. Соединение по п.1, представляющее собой (2R,4S)-(-)-N-[4-диэтоксифосфорилметил)-фенил] -1,2,4,5-тетрагидро-4-метил-7,8-метилендиокси-5-оксо-3-бензотиепин-2-карбоксамид. 4. Способ получения оптически активного соединения формулы 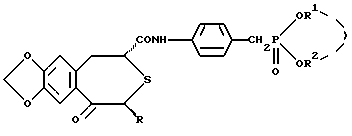 где R представляет низшую алкильную группу; R1 и R2 независимо представляют низшую алкильную группу или вместе представляют низший алкилен, отличающийся тем, что осуществляют взаимодействие оптически активного соединения формулы II 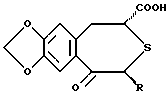 где R – такой, как указан выше, или его реакционноспособного производного, или соли по карбоксильной группе с соединением формулы III 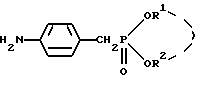 где R1 и R2 – такие, как указаны выше, или его реакционноспособным производным, или солью по аминогруппе. 5. Оптически активное соединение формулы II 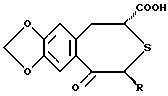 где R представляет низшую алкильную группу, или его реакционноспособное производное, или соль по карбоксильной группе. 6. Активатор остеогенеза, отличающийся тем, что содержит оптически активное соединение формулы I по п.1. 7. Активатор остеогенеза по п.6, отличающийся тем, что способен всасываться при пероральном введении. 8. Средство для предупреждения или лечения заболеваний костей, связанных с нарушением обмена веществ, отличающееся тем, что содержит оптически активное соединение формулы I по п.1. 9. Активатор для лечения перелома костей, отличающийся тем, что содержит оптически активное соединение формулы I по п.1. 10. Способ активации остеогенеза у млекопитающего, отличающийся тем, что млекопитающему вводят эффективное количество оптически активного соединения формулы I по п.1. 11. Способ предупреждения или лечения заболеваний костей, связанных с нарушением обмена веществ у млекопитающего, отличающийся тем, что млекопитающему вводят эффективное количество оптически активного соединения формулы I по п.1. 12. Способ активации лечения перелома костей у млекопитающего, отличающийся тем, что млекопитающему вводят эффективное количество оптически активного соединения формулы I по п.1. 13. Оптически активное соединение формулы I по п.1, обладающее остеогенезактивирующей активностью. 14. Оптически активное соединение формулы I по п.1, обладающее угнетающей рассасывание кости активностью. 15. Оптически активное соединение формулы I по п.1, обладающее активностью, стимулирующей лечение перелома кости. РИСУНКИ
MM4A Досрочное прекращение действия патента Российской Федерации на изобретение из-за неуплаты в установленный срок пошлины за поддержание патента в силе
Дата прекращения действия патента: 28.12.2002
Извещение опубликовано: 20.11.2004 БИ: 32/2004
|
||||||||||||||||||||||||||
